Производные акриловой кислоты и их стереоизомеры, обладающие фунгицидной активностьюПатент на изобретение №: 2037487 Автор: Джон Мартин Клау[GB], Кристофер Ричард Эйлз Годфри[GB], Стефен Пол Хиней[GB], Кеннет Андертон[GB] Патентообладатель: Империал Кемикал Индастриз ПЛС (GB) Дата публикации: 19 Июня, 1995 Адрес для переписки: подача заявки16.09.1991 публикация патента19.06.1995 Изображения   Использование: в качестве вещества, обладающего фунгицидной активностью, в сельском хозяйстве. Сущность изобретения: продукт ф-лы  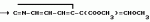 и его стереоизомеры, где Z - фенил, необязательно замещенный галоидом, C1-C4 -алкокси, нитро, циано, амино, пиримидин -2-ил, необязательно замещенный галоидом, пиримидин-4-ил, необязательно замещенный галоидом или C1-C4 -алкилсульфонилом, пиридин-2-ил, необязательно замещенный нитро, циано, нитротиазол-2-ил, OCH2 , CH2O , O, SO2O , CH(OH). Реагент 1: 2-(3-феноксифенокси)-3-цианопиридин. Реагент 2: сплав скелетного никелевого катализатора по Ренею. Реагент 3: метилсульфинилметил сульфид. Реагент 4: метилформат. 4 табл.
, , и его стереоизомеры, где Z - фенил, необязательно замещенный галоидом, C1-C4 -алкокси, нитро, циано, амино, пиримидин -2-ил, необязательно замещенный галоидом, пиримидин-4-ил, необязательно замещенный галоидом или C1-C4 -алкилсульфонилом, пиридин-2-ил, необязательно замещенный нитро, циано, нитротиазол-2-ил, OCH2 , CH2O , O, SO2O , CH(OH). Реагент 1: 2-(3-феноксифенокси)-3-цианопиридин. Реагент 2: сплав скелетного никелевого катализатора по Ренею. Реагент 3: метилсульфинилметил сульфид. Реагент 4: метилформат. 4 табл.
, , ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУИзобретение относится к новым производным акриловой кислоты, обладающим фунгицидной активностью, которые могут найти применение в сельском хозяйстве. Известны соединения общей формулы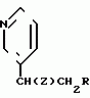 где R замещенный фенил, тиенил, бензил, Z-CR1OH или COOR2 R1 и R2 алкил, обладающий фунгицидной активностью. Целью изобретения является изыскание новых соединений, обладающий фунгицидной активностью. Указанная цель достигается за счет соединений общей формулы где R замещенный фенил, тиенил, бензил, Z-CR1OH или COOR2 R1 и R2 алкил, обладающий фунгицидной активностью. Целью изобретения является изыскание новых соединений, обладающий фунгицидной активностью. Указанная цель достигается за счет соединений общей формулы 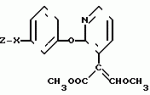 и их стереоизомеров, где Z представляет собой фенил, незамещенный или замещенный галоидом С1-С4-алкокси, нитро, циано, амино; 2-пиримидинил, необязательно замещенный галоидом, 4-пиримидинил, необязательно замещенный галоидом или С1-С4-алкилсульфонилом, пиридин-2-ил, необязательно замещенный нитро-, цианогруппой, или 2-тиазолил, замещенный нитрогруппой, Х представляет собой ОСН2, СН2О, О, SO2O- или СН(ОН), обладающих фунгицидной активностью. Соединения по изобретению, содержащие, по меньшей мере, одну углерод-углерод двойную связь, иногда получают в виде смесей геометрических изомеров. Однако такие смеси возможно разделить на отдельные изомеры. Данное изобретение охватывает такие изомеры и их смеси во всех соотношениях, включая состояние по существу из (Z) изомера и те, которые состоят преимущественно из (Е) изомера. Индивидуальные изомеры, которые получаются из несимметрично замещенной двойной связи пропеноатной группы, идентифицируются посредством общеупотребительных терминов Е и Z. Изобретение поясняется соединениями, перечисленными в табл.1 и 2, в которых метил-3-метоксипропеонат имеет (ЕН) конфигурацию. В табл. 3 показаны избранные показатели для протонов в спектре ядерного магнитного резонанса (Я.М.Р.) для некоторых соединений, описанных в табл.1 и 2. Химические сдвиги измерены в частях 1 миллион от тетраметилсилана. Во всех случаях применяли дейтерохлороформ в качестве растворителя. Колонка, озаглавленная "частота", относится к эксплуатационной частоте ЯМР-спектрометра. Применение следующие сокращения: br широкий s синглет d дублет t триплет q квартет m мультиплет Следующие примеры поясняют изобретение. Повсюду в примерах термин "простой эфир" относится к диэтиловому эфиру. Для высушивания растворов используют сульфат магния и растворы концентрируют при пониженном давлении. Реакции, включающие концентрируют при пониженном давлении. Реакции, включающие образование промежуточных соединений, чувствительных к действию воздуха или влаги, проводят в атмосфере азота, а растворители высушивают до употребления, если необходимо. При отсутствии других указаний хроматографию проводят на колоне силикагелем в качестве стационарной фазы. Где показано, данные инфракрасного анализа и ЯМР являются избранными; не пытались привести перечень каждой абсорбции во всех случаях. 1H ЯМР-спектры регистрировали с применением растворов дейтерированного хлороформа при отсутствии других указаний. Повсюду применены следующие сокращения: ТГФ тетрагидрофуран s синглет ДМФ N,N-диметилфор- мамид d дублет ЯМР ядерный магнит- ный t триплет резонанс m мультиплет ИК-инфракрасный br широкий т.пл, точка плавления П р и м е р 1. Этот пример поясняет получение (Е)-метил 2-[2-(3-феноксифенокси)пирид-3-ил]-4-метоксипропионата (соединение 12 в табл.1). Смесь карбоната калия (5,53 г 0,04 моль) и 3-феноксифенола (15 г, 0.08 моль) в ДМФ (60 мл) нагревают при 80оС при перемешивании 30 мин 2-хлор-3-цианопиридин (11,08 г, 0,08 моль) и медь в виде бронзы (0,8 г) добавляют и полученную смесь нагревают с обратным холодильником 90 мин. Газохроматографийный (GC) анализ показал образование единичного продукта (96%). Реакционную смесь охлаждают, фильтруют, затем выливают в воду (300 мл) и оставляют стоять в течение уикэнда. Выпавшее желтовато-коричневое масло экстрагируют дихлорметаном и высушивают. Затем дихлорметановый раствор фильтруют и выпаривают, что дает неочищенный 2-(2-феноксифенокси)-3-цианопиридин 36,2 г, загрязненного ДМФ, который используют для следующей ступени без дополнительной очистки. Неочищенный 2-(3-феноксифенокси= -2-цианопиридин (15 г) перемешивают с оплавом скелетного никелевого катализатора по Ренею (125 г, 50:50) при кипячении с обратным холодильником с 75%-ной муравьиной кислотой (200 мл) 2 ч. Реакционную смесь разбавляют водой, затем экстрагируют неоднократно эфиром. Объединенные эфирные экстракты высушивают, фильтруют и выпаривают, что дает оранжевое масло. Фильтрование через данный фильтр из силикагеля, средство для отмывки с адсорбента гексанэфир (1:1), приводит к 2-(3-феноксифенокси)-3-формилпиридину 3.03 г. Инфракрасный анализ: макс. 1685 см-1. К перемешиваемому раствору альдегида (3,03 г, 0,01 моль) и метил метил-сульфинилметил сульфида (1,29 г, 0,01 моль) в сухом ТГФ (8 мл) при комнатной температуре добавляют каплями раствор Тритона Б (2,5 мл, 40% в метаноле). Полученный раствор нагревают с обратным холодильником 1 ч, охлаждают, затем разбавляют водой. Экстрагирование дихлорметаном с последующим высушиванием и выпариванием дает желтое масло, которое растворяют в метанольном растворе хлористого водорода (100 мл) и оставляют стоять на ночь. Метанол выпаривают и остаток обрабатывают насыщенным раствором бикарбоната натрия, затем экстрагируют дихлорметаном. Объединенные органические экстракты высушивают, фильтруют и выпаривают. Остаток хроматографируют на силикагеле (средство для отмывки с адсорбента гексанэфир 1:1), что дает метил 2-(3-феноксифенокси)пирид-3-ил-ацетат (1,35 иг) в виде светло-желтого масла: 1Н ЯМР дельта 3,68 (3Н, синглет); 6,74-6,88 (3Н, мультиплет); 6,96-7,12 (4Н, мультиплет); 7,24-7,40 )3Н, мультиплет), 7,56-7,60 (1Н, мультиплет); 8,06-8,12 (1Н, мультиплет); Инфракрасный анализ: макс. 1735 см-1. Раствор метил 2-(3-феноксифенокси)пирид-3-ил-ацетата (0,64 г, 0,0019 моль) и метилформат (2,34 мл, 0,038 моль) в ДМФ (2 мл) добавляют каплями за 15 мин к перемешиваемой суспензии промытого петролейным эфиром гидрида натрия (0,18 г, 0,0038 моль/50%-ной суспензии в масле) в ДМФ (10 мл). Во время добавления температуру выдерживают на уровне ниже 10оС. Реакционная смесь с интенсивным выделением пузырьков газа приобретает желтую окраску. Температуре раствора дают повыситься до комнатной. Температуры и перемешивание продолжают 2 ч. Реакционную смесь выливают в воду (100 мл), нейтрализуют разбавленным раствором хлористоводородной кислоты, затем экстрагируют эфиром (4 х 25 мл). Объединенные эфирные слои промывают водой и рассолом, затем высушивают и выпаривают. Полученное желтое масло (0,69 г) растворяют в ДМФ (10 мл), затем перемешивают с карбонатом калия (0,53 г) 15 мин. Диметилсульфат (0,17 мл) затем добавляют единичной порцией и перемешивание продолжают еще 4 ч. После этого реакционную смесь разбавляют водой (100 мл) и экстрагируют эфиром (4 х 25). Объединенные экстракты промывают водой и рассолом, высушивают, фильтруют и выпаривают, что приводит к оранжевому маслу. Хроматографирование на силикагеле (средства для отмывки адсорбента 40:50 петролейный эфир эфир 1:1) дает указанное в заголовке соединение в виде кристаллического твердого вещества (0,32 г, 45%). Точка плавления, 79-81оС; 1Н ЯМР дельта 3,64 (3Н, синглет); 3,84 (3Н, синглет); 6,72-6,84 (3Н, мультиплет); 7,00-7,12 (4Н, мультиплет); 7,24-7,34 (3Н, мультиплет); 7,52-7,60 (2Н, мультиплет); 7,56 (1Н, синглет), 8,08-8,14 (1Н, мультиплет). Инфракрасный анализ: макс. 1710, 1640 см-1. П р и м е р 2. Этот пример поясняет получение (Е)-метил-2-[2-(3-бензолоксифенокси)пиридин-2-ил]-3-метокси- пропеноата (соединение 2, табл.1). 3-Метоксифенол (124 г) и безводный карбонат калия (69 г) нагревают совместно при перемешивании в сухом ДМФ (500 мл) при 80о в атмосфере азота. Спустя 45 мин сероватый раствор охлаждают и добавляют 2-хлорникотинитрил (138,5 г) и медь в виде бронзы (10 г), промытую 100 мл ДМФ. Полученную коричневую реакционную смесь нагревают до 125-130оС. Через 2ч 30 мин реакционную смесь охлаждают и фильтруют для удаления избытка медной бронзы и нерастворенного твердого материала. Полученный раствор добавляют к воде (3 л) и оставляют стоять на ночь. Полученный осадок отфильтровывают, промывают водой, затем растворяют в эфире. Эфирный раствор высушивают, фильтруют и выпаривают, что дает 2-(3-метоксифенокси)-3-цианопиридин в виде не вполне белого твердого вещества (203,5 г, 90%). Точка плавления: 66-68оС. Инфракрасный анализ: макс 2232 см-1. К перемешиваемому раствору 2-(3-метоксифенокси)-3-цианопиридина (5 г) в сухом ТГФ (25 мл) при минус 70оС в атмосфере азота добавляют каплями диизобутилалюминий гидрид (27,6 мл, 1,0 моль) при минус 70оС дополнительно 30 мин, затем дают подогреться до комнатной температуры. Через 9 ч хроматографический газовый анализ показал 30%-ную реакцию. Реакционную смесь охлаждают до минус 70оС и обрабатывают как указано во второй загрузке диизобутилалюминийгидридом (27,6 мл). Через 1 ч по данным газового хроматографического анализа при комнатной температуре отсутствие исходного материала. Разбавленную хлористоводородную кислоту (50%) добавляют чрезвычайно осторожно по причине экзотермической реакции. Полученный раствор перемешивают еще 30 мин, затем разделяют на слои посредством эфира. Водный слой дополнительно экстрагируют (х 2) эфиром. Объединенные эфирные слои высушивают, фильтруют и выпаривают, что приводит к желтому маслу. Хроматография на силикагеле (средство для отмывки из адсорбента дихлорметан) показала наличие 2-(3-метоксифенокси)-3-пиридинкарбоксальдегида (1,7 г, 33%) в виде белых кристаллов. Точка плавления: 76-78оС. Инфракрасный анализ: макс. 1694 см-1. 1Н ЯМР дельта, 3,63 (3Н, синглет); 6,75-6,84 (3А); 7,11-7,15 (1Н); 7,33-7,38 (1Н); 8,24-8,26 (1Н) 8,35-8,38 (1Н), части на 1 млн. При проведении отдельного крупномасштабного эксперимента 2-(3-метоксифенокси)-3-цианопиридин (45 г) превращают (за 3 загрузки) до 2-(3-метоксифенокси)-3-пиридинкарбоксальдегида (34 г, 75%). К перемешиваемому раствору 2-(3-метоксифенокси)-3-пиридин карбоксальдегида (8,07 г) и метил метилсульфинилметил- сульфида (6,78 мл) в сухом ТГФ(20 мл) при комнатной температуре, в атмосфере азота добавляют каплями Тритон Б (14 мл, 40%-ный раствор в метаноле). После нагревания с обратным холодильником 90 мин газохроматографический анализ показал отсутствие исходного материала. Реакционную смесь охлаждают до комнатной температуры и добавляют дихлорметан (450 мл). После этого полученный раствор высушивают, экстрагируют водой (3 х 10 мл). Далее органический слой высушивают, фильтруют и выпаривают, что дает оранжевое масло (22,88 г), которое используют в последующей ступени без дополнительной очистки. Оранжевое масло растворяют в метанольном растворе хлористого водорода из 300 мл метанола и 35 мл ацетил хлорида, перемешивают 4 ч, оставляют стоять при комнатной температуре. Через 2 дня растворитель удаляют и остаток нейтрализуют насыщенным раствором бикарбоната натрия. Продукт экстрагируют этилацетатом. Полученный раствор высушивают, фильтруют и выпаривают, что дает неочищенный метил 2-(3-метоксифенокси)-3-пиридинил ацетат (13,88 г 90%-ной частоты по данным газовой хроматографии). Инфракрасный анализ: макс 1740 см-1. 1Н ЯМР (дейтерированный хлороформ). Среди прочих дельта (9,71 (3Н, синглет); 3,76 (2Н); 3,95 (3Н). В отдельном эксперименте 2-(3-метоксифенокси)-3-пиридинкарбоксальдегид (93,03 г) превращают до метил 2-(3-метоксифенокси)-2-пиридинилацетата (28% общий выход 71%). Метил 2-(3-метоксифенокси)-3-пиридинилацетат (27,2 г) нагревают при 115оС в 47%-ной бромистоводородной кислоте (249 г), содержащей гексадецилтрибутилфосфоний бромид (5,6 г). Через 3 ч раствор охлаждают и добавляют карбонат калия до рН раствора около 6. Реакционную смесь экстрагируют (х 5) этилацетатом. Органические экстракты высушивают, фильтруют и выпаривают, что дает бледно-оранжевое твердое вещество. Затем твердое вещество обрабатывают метанольным раствором хлористого водорода, оставляя на всю ночь (из метанола (500 мл) и ацетил хлорида (50 мл)). Метанол удаляют и остаток растворяют в воде. рН раствора добавляют приблизительно до рН 6 посредством бикарбоната натрия и раствор экстрагируют этилацетатом (х 3). Объединенные органические экстракты высушивают, фильтруют и выпаривают. Остаток, полученный в виде твердого оранжевого вещества, перерастворяют в дихлорметане и фильтруют через домный фильтр из силикагеля (средство для отмывки из адсорбента эфир дихлорметан). Выпаривание дает метил 2-(3-оксифенокси)-3-пиридинилацетат в виде бледно-желтого твердого вещества (13,28 г, 51%), который используют дополнительной очистки. Метил 2-(3-оксифенокси)-3-пиридинил ацетат (0,8 г) и безводный карбонат калия (0,21 г) перемешивают совместно в ДМФ в атмосфере азота при 70оС. Через 20 мин бензил бромид (1,06 г) добавляют вместе с медью в виде бронзы (катализатор) и реакционную смесь нагревают до 1000оС 3 ч. Анализ показал, что реакция прошла на 50% Добавляют второй эквивалент карбоната калия и бензил бромида и нагревание продолжают при 100оС 2 ч. Реакционную смесь охлаждают до комнатной температуры, фильтруют, разбавляют водой и экстрагируют эфиром (х3). Эфирные экстракты объединяют, высушивают, фильтруют и выпаривают, что дает коричневое масло. Хроматографирование на силикагеле (элюент петролейный эфир эфир 50:50) дает метил 2-(3-бензилоксифенокси)-3-пиридинацетат в виде светло-желтого твердого вещества (0,5 г 46%). Инфракрасный анализ: макс. 1735 см-1. 1Н ЯМР (дейтерированный хлороформ), среди прочих дельта 3,70 (3Н, синглет); 3,76 (2Н, синглет); 5,04 (2Н, синглет). При отдельном эксперименте получено дополнительно 0,3 г продукта. 2 пробы объединяют для следующей ступени. Раствор, содержащий метил формат (2,85 мл) и метил 2-(3-бензилоксифенокси)-2-пиридинилацетата (0,8 г) в ДМФ, добавляют по каплям к перемешиваемой суспензии гидрида натрия (0,22 г 50%-ная дисперсия в масле, предварительно промытая петролейным эфиром) в ДМФ (10 мл) (выделение пузырьков газа). Температуру поддерживают на уровне ниже 10оС за все время добавления, затем составляют до достижения комнатной температуры. После дополнительного 4 ч перемешивания реакционную смесь оставляют стоять на уикэнд. Реакционную смесь выливают в воду, заранее подксиленную разбавленной хлористоводородной кислотой, затем экстрагируют эфиром (х3). Объединенные эфирные экстракты высушивают, фильтруют и выпаривают, что дает желтое масло (0,86 г). Масло растворяют в ДМФ (10 мл) и обрабатывают карбонатом калия (0,64 г) и диметилсульфатом (0,21 мл) при комнатной температуре. После 4 ч перемешивания хроматографический газовый анализ показал полное окончание реакции. Добавляют воду (100 мл) и полученный раствор экстрагируют эфиром (3 х 25 мл). Объединенные эфирные экстракты промывают водой, затем рассолом и высушивают. Фильтрование и выпаривание дают оранжево-коричневое масло. Хроматографирование на силикагеле (элюент петролейные эфир-эфир 50:50) приводит к указанному в заголовке соединению в виде твердого белого вещества (0,2 г, 22%). Т.пл. 119-122оС. Масс-спектр т/е 391 (М+). Инфракрасный анализ: макс. 1705, 1640 см-1. 1Н ЯМР (дейтерированный хлороформ) дельта 3,68 (3Н; синглет); 3,84 (синглет); 5,03 (2Н, синглет); 6,66-6,80 (3Н, мультиплет); 6,96-7,04 (1Н, мультиплет); 7,20-7,42 (6Н, мультиплет); 7,58 (1Н, синглет); 7,60-7,62 (1Н, мультиплет); 8,08-8,12 (1Н, мультиплет). П р и м е р 3. Этот пример поясняет получение (Е)-метил-2-[2-(3-нитробензолсульфонилокси)фенокси]пиридин-3- ил-3-метоксипропионата (соединение 9, табл.1). Раствор, содержащий метил 2-(3-оксифенокси)-3-пиридинацетат (1 г, получен как описано в примере 2) и метилформат (4,68 мл) в ДМФ (5 мл) добавляют каплями к перемешиваемой суспензии гидрида натрия (0,56 г 50%-ная дисперсия в масле, предварительно промыт петролейным эфиром) в ДМФ (10 мл). По окончании реакции реакционную смесь обрабатывают как указано ранее, что дает неочищенный метил 2-[2-(3-оксифенокси)пиридин-3-ил]-3-окси- пропеонат. Продукт обрабатывают карбонатом калия (0,31 г) и диметил сульфатом (0,27 г) в ДМФ (10 мл) при условиях, описанных в примере 2, что дает после стандартной обработки масло. Хроматографирование на силикагеле (элюент петролейный эфир эфир 50: 50 дает (Е)-метил-2-[2-(3-оксифенокси)пиридин-3-ил]-3- метоксипропенона в виде белого твердого вещества (0,635 г, 31%). Точка плавления 163-165оС, масс-спектр m/e 301 (М+). Инфракрасный спектр: макс 1665, 1633 см-1. 1Н ЯМР (дейтерированный хлороформ) дельта и 3,68 (3Н, синглет); 3,86 (3Н, синглет); 6,48 (1Н); 6,54-6,6 (3Н); 7.00-7,06 (1Н); 7,12-7,20 (1Н); 7,58 (1Н, синглет); 7,60-7,64 (1Н); 8,08-8,12 (1Н), части на 1 миллион. (Е)-метил-2-[2-(3-оксифеноксипиридин-3-ил)-3-метоксипропеноат] (0,1, получен, как описано выше) перемешивают с 3-нитробензолсульфонилхлоридом (0,074 мл) и три этиламином (0,74 мл) в сухом дихлорметане (2 мл) при комнатной температуре. Через 1 ч реакционную смесь переносят непосредственно в колонку с силикагелем. Элюирование петролейным эфиром эфиром (50:50) дает указанное в заголовке соединение в виде белого губчатого твердого вещества (0,101 г, 63%). Точка плавления: 49-51оС. Масс-спектр m/e 486 (М+). Инфракрасный спектр: 1710, 1638 см-1. 1H ЯМР (дейтерированный хлороформ) дельта 3,66 (3Н, синглет); 3,85 (3Н, синглет); 6,77-6,83 (2Н); 7,00-7,09 (2Н); 7,29-7,31 (Э1Н); 7,57 (1Н, синглет); 7,60-7,62 (1Н); 7,71-7,78 (1Н); 8,03-8,08 (1Н); части на 1 миллион. П р и м е р 4. Этот пример поясняет получение (Е)-метил-2-[2-(3- (4-нитрофенокси)фенокси)пиридин-3-ил]-3-метоксипропенота (соединение 6, табл.1). (Е)-Метил-2-[2-(3-оксифенокси)пиридин-3-ил] -3-метоксипропионат (0,3 г, получен, как описано в примере 1), и карбонат калия (0,069 г) нагревают совместно с ДМФ (5 мл) при 70оС. Спустя 20 мин 4-фторнитробензол (0,141 л ) и медь в виде бронзы (катализатор) добавляют и полученную смесь нагревают при 130оС 2 ч. Газовая хроматография свидетельствует об отсутствии исходного материала. Реакционную смесь фильтруют, затем выливают в воду (70 мл). Полученную смесь экстрагируют эфиром (х3) объединенные эфирные экстракты высушивают, фильтруют и выпаривают, что дает оранжевое масло. Хроматография на силикагеле приводит к указанному в заголовке соединению в виде белого кристаллического твердого вещества (0,266 г, 64%). Точка плавления: 102-103оС; масс-спектр m/e 422 (М+). Инфракрасный анализ: макс 1700, 1625 см-1. 1Н ЯМР (дейтерированный хлороформ) дельта 3,64 (3Н, синглет); 3,85 (3Н, синглет); 6,80-6,88 (2Н); 6,94-7,10 (4Н); 7,36-7,42 (1Н); 7,59 (1Н, синглет); 7,60-7,64 (1Н); 8,10-8,12 (1Н); 8,15-8,22 (2Н). П р и м е р 5. Этот пример поясняет получение (Е)-метил-2-[2-(3- (пиримидин-2-ил-окси)фенокси)пиридин-2-ил] -3-метоксипропионат (соединен 14, табл.2). (Е)-Метил-2-[2-(3-оксифенокси)пиридин-3-ил]-3-метоксипропионат (0,67 л), полученный как описано в примере 3, нагревают при 80оС с карбонатом калия (0,154 г) в ДМФ (10 мл) в атмосфере азота. Спустя 20 мин добавляют 2-хлорпиримидин ), 253 г) и медь в виде бронзы (катализатор). Полученную смесь нагревают при 130оС при перемешивании 2 ч 30 мин. Газовая хроматография свидетельствует об окончании реакции. Реакционную смесь охлаждают, фильтруют и затем выливают в воду. Далее водную фазу экстрагируют эфиром (х3), объединенные эфирные слои высушивают, фильтруют и выпаривают, что дает желтоватое твердое вещество. Хроматография на силикагеле (элюент-этилацетат, 2:1), дает указанное в заголовке соединение в виде белого твердого вещества (0,308, 37% ). Точка плавления: 151-153оС; масс-спектр m/e 379 (М+). Инфракрасный анализ: макс 1695, 1635 см-1. 1Н ЯМР (дейтрированный хлороформ) дельта 3,68 (3Н, синглет); 3,85 (3Н, синглет); 6,94-7,06 (5Н); 7,38-7,43 (1Н); 7,57 (1Н, синглет); 7,62-7,66 (1Н); 8,11-8,15 (1Н); 8,53-8,57 (2Н); части на 1 миллион. П р и м е р 6. Этот пример поясняет получение (Е)-метил-2-[2-(3-феноксиметилфенокси)пиридин-ил[-3-метоксипропеноат (соединение 1, табл.1). Смесь 2-хлор-3-пиридинкарбоксальдегида (10,0 г); 3-оксибензилового спирта (8,76); безводного карбоната калия (4,76 г); безводного карбоната калия (4,88 г) в ДМФ (70 мл) нагревают с обратным холодильником. Через 3 ч газовый хроматографический анализ показал, что весь альдегид израсходовался. Реакционную смесь охлаждают, фильтруют, затем выливают в воду. Полученную смесь экстрагируют эфиром (х3) и объединенные эфирные слои промывают однократно разбавленным раствором гидроокиси натрия. Затем эфирный раствор высушивают, фильтруют и выпаривают, что дает палево-оранжевое масло, кристаллизующееся при стоянии (9,1 г). К раствору этого продукта (6,24 г) метилсульфинилметилсульфида (3,38 г) в ТГФ при комнатной температуре в атмосфере азота добавляют каплями Тритон Б (8 мл, 40%-ный раствор в метаноле). После 4 ч нагревают с обратным холодильником реакционную смесь охлаждают до комнатной температуры и добавляют дихлорметан (300 мл). Полученный раствор экстрагируют водой (х3). Дихлорметановый слой высушивают, фильтруют и выпаривают, что дает темно-оранжевое масло (8,5 г), которое используют непосредственно для следующей ступени. Темно-оранжевое масло (8,5 г) неочищенный продукт растворяют в метанольном растворе хлористого водорода (из метанола (150 мл) и ацетил хлорида (15 мл), перемешивают 3 ч, затем оставляют стоять на уикэнд. Метанол удаляют выпариванием и добавляют насыщенный водный раствор бикарбоната натрия. Смесь экстрагируют этилацетатом (х3). Объединенные органические слои высушивают, фильтруют и выпаривают, что дает желтое масло. Масло фильтруют через донный слой силикагеля (элюент дихлорметан, затем эфир). Выпаривание растворителя дает метил-2-(3-эксиметилфенокси)-3-пиридинилацетат в виде палево-оранжевого масла (4,04 г, 88%-ной степени чистоты по данным газовой хроматографии. Инфракрасный анализ: макс. 3400, 1737 см-1. Продукт применяют для следующей ступени без дополнительной очистки. Раствор метил-2-(3-оксифенокси)-3-пиридинацетата (0,63 г) и триэтиламина (0,45 мл) в дихлорметане (2 мл) добавляют каплями за 20 мин к перемешиваемому раствору хлористого метила (0,026 мл) в дихлорметане (6 мл) примерно 5оС. Смесь перемешивают при 5оС мин, подогревают до комнатной температуры, затем оставляют стоять на уикэнд. Газовый хроматографический анализ аликвотной пробы показывает на завершение реакции. Реакционную смесь перемешивают с рассолом 30 мин. Далее органический слой высушивают, фильтруют и выпаривают, что дает метил-2-(3-хлорметилфенокси)-3-пиридинилацетат в виде палево-желтого масла (0,55 г), которое применяют непосредственно. Инфракрасный анализ: макс. 1738 см-1. Макс-спектр m/e 291 9М+). 1Н ЯМР (дейтрированный хлороформ); среди прочих дельта 3,69 (3Н, синглет); 3,77 (2Н, синглет); 4,60 (2Н, синглет). Фенол (0,16 г) и карбонат калия (0,12 г) перемешивают вместе с ДМФ (6 мл) в атмосфере азота при комнатной температуре. Через 20 мин добавляют раствор метил-2-(3-хлорметилфенокси)-3-пиридинилацетат (0,5 г) в ДМФ и продолжают перемешивание. Добавляют медь в виде бронзы (катализатор) и реакционную смесь нагревают при 100оС в течение 5 ч. Газохроматогpафический анализ показал завершение реакции. Реакционную смесь охлаждают, фильтруют, затем выливают в воду (50 мл). Водную смесь экстрагируют эфиром (х3). Объединенные экстракты промывают раствором гидроокиси натрия. После этого эфирный раствор высушивают, фильтруют и выпаривают, что дает метил-2-(3-феноксиметилфенокси(-3-пиридинацетет в виде желтого масла (0,35 г, 59%). Масс-спектр m/e 439 (М+). 1Н ЯМР (дейтрированный хлороформ) среди прочих, дельта 3,69 (3Н, синглет); 3,76 (2Н, синглет); 5,07 (2Н, синглет) части на 1 миллион. Указанное соединение содержит следы ДМФ. При отдельном опыте хлорметильное соединение (2,73 г), полученное как указано выше, дает дополнительно 2,00 г метил-2-(3-феноксиметилфенокси)-3-пиридинилацетат. Раствор метил-2-(3-феноксиметилфенокси)-3-пиридинилацетата (3,35 г) и метилформата (6,2 мл) в ДМФ добавляют к суспензии гидрида натрия (0,64 г, 60%-ная дисперсия в масле, предварительно промытый петролейным эфиром) в ДМФ (25 мл) при тех же условиях, что описаны в заключительной стадии примера 1. Стандартная обработка приводит к неочищенному метил-[2-(3-феноксиметилфенокси)пиридин-3-ил] -3-оксипропан, который обрабатывают непосредственно карбонатом калия (1,85 г) и диметилсульфатом (0,63 мл) в ДМФ (17 мл). Стандартная обработка и хроматография на силикагеле (элюент петролейный эфир-эфир (50:50) проводят к указанному в заголовке соединению в виде белой смолы (0,53 г, 1638 см-1; 1ЯМР таковы, как в табл.3). П р и м е р 7. Этот пример поясняет получение (Е)-метил-2-[2-(3-метоксифенокси)пиридин-3-ил]-3-метокси- пропеоната (соединение 4, табл.1). К охлаждаемой льдом перемешиваемой суспензии промытого петролейным эфиром гидрида натрия (1,04 г, 50%-ная дисперсия в масле, 22 ммоль) в ДМФ (16 мл) добавляют раствор метил-2-хлорпирид-3-илацетет (2 г, 11 ммоль) и метилформата (12,75 г; 0,22 моль) в ДМФ (8 мл). Реакционную смесь оставляют подогреться до комнатной температуры и перемешивание продолжают до тех пор, пока анализ по способу тонкослойной хроматографии не покажет отсутствие остаточного исходного материала (около 3 ч.). Реакционную смесь выливают в воду, затем подкисляют разбавленной хлористоводородной кислотой. Раствор повторно экстрагируют эфиром и объединенные эфирные экстракты высушивают, фильтруют и выпаривают. Остаток снова растворяют в ДМФ, после чего обрабатывают диметилсульфатом (1,32 г, 10 ммоль), а безводным карбонатом калия (1,52 г, 11 ммоль) при комнатной температуре. Реакционную смесь перемешивают 2 ч, разбавляют водой, после чего повторно экстрагируют эфиром. Объединенные эфирные экстракты высушивают, фильтруют и выпаривают, что дает желтое масло. Хроматография на силикагеле (элюент петролейный эфир-эфир 50:50) дает (Е)-метил-2-(2-хлор-пирид-3-ил)-3-метоксипропеноат в виде белого похожего на воск вещества (0,9 г; 36%). Точка плавления: 39-40оС. Инфракрасный анализ: макс. 1711, 1638 см-1. 1Н ЯМР дельта: 3,74 (3Н, синглет); 3,89 (3Н, синглет); 7,21-7,26 (1Н); 7,55-7,57 (1Н); 7,60 (1Н, синглет); 8,32-8,36 (1Н). (Е)-Метил-2-(2-хлорпиридин-3-ил)-2-метоксипропеноат (0,227 г), 3-(2-метоксифенокси) фенол (0,255 г), безводный карбонат калия (0,069 г), медь в виде бронзы (катализатор) и медь (I) хлорид (катализатор) нагревают совместно приблизительно при 170оС 3 ч в атмосфере азота. Реакционную смесь охлаждают, затем разбавляют небольшим количеством дихлорметана. Полученную смесь помещают непосредственно в колонку с силикагелем и хроматографируют (элюент петролейный эфир-эфир 1:1), что дает указанное в заголовке соединение в виде палево-коричневого масла (0,023 г, 6%). Масс-спектр m/e 407 (М+). 1Н ЯМР (дейтерированный хлороформ) даны в табл.3. П р и м е р 8. Этот пример иллюстрирует получение (Е)-метил-2-[2-[3-(пиридин-2-ил)оксиметилфенокси]пиридин-3-ил] 3-метоксипропеноата (соединение 20, табл.2). Смесь, содержащую 2 г полученного по методике примера 6 метил-2-(3-хлорметилфенокси)-3-пиридинилацетата, 0,64 г 2-оксипиридина и 1,88 г карбоната серебра в 30 мл гексана, кипятят с обратным холодильником 6 ч. Реакционную смесь распределяют между водой с гексаном и водный слой трижды экстрагируют эфиром. Объединенные органические экстракты сушат, фильтруют и выпаривают, получая коричневое масло. Хроматография на силикагале (элюент петролейный эфир-эфир, 1:1) дает метил-2-[3-пиридин-2-ил)оксиметилфенокси] -3-пиридинилацетат (0,56 г, 24%) в виде прозрачного масла: 1Н-ЯМР (CDCl3) дельта: 3,70 (3Н, С); 3,75 (2Н, с), 5,38 (2Н, с), 6,77-7,42 (7Н, м), 7,57-7,64 (2Н, м), 8,03-8,18 (2Н, м). Раствор метил-2-[3-(пиридин-2-ил)оксиметилфенокси] -3-пиридиналацетата (0,56 г) и 1,48 г метилформата в 5 мл ДМФ прибавляют к суспензии гидрида натрия (0,15 г, 50%-ная дисперсия в масле, предварительная промывка петролейным эфиром) в ДМФ в тех же условиях, что описаны в конечной стадии примера 1. Стандартная обработка дает сырой метиил-2-[2-[3-(пиридин2-ил)оксиметилфенокси] пиридин-3-ил]-3- оксипропеноат, который непосредственно обрабатывают 0,44 г карбоната калия и 0,2 г диметилсульфата в 5 мл ДМФ 4 ч. Стандартная обработка и хроматография на силикагеле (элюент эфир-петролейный эфир, 6:4) дает целевое соединение в виде белого масла (0,05 г); ИК-спектр: 1711, 1637 см-1; 1Н ЯМР-спектр (CDCl3) дельта: 3,68 (3Н, с), 3,85 (3Н, с), 5,38 (2Н, с); 6,75-6,87 (1Н, м), 6,98-7,06 (1Н, м), 7,17-7,25 (4Н, м), 7,37-7,40 (1Н, м), 7,58 (1Н, с), 7,55-7,64 (2Н, м), 8.09-8,17 (2Н, м). П р и м е р 9. Этот пример иллюстрирует получение (Е)-метил-2- [2-[3,6-хлолрпиримидин-4-ил-оксифенокси] пиридин-3-ил] -3- метоксипропеноата (соединение 16, табл.2). Смесь, содержащую 0,512 г (Е)-метил-2-(2-(3-оксифенокси) миридин-3-ил)-3-метоксипропеноата, полученного по методике примера 3, и 0,0117 г безводного карбоната калия в 5 мл ДМФ нагревают при 80-90оС в течение 1 ч в атмосфере азота. Оранжевую реакционную смесь охлаждают, разбавляют 5 мл ДМФ и затем по каплям прибавляют в течение 15 мин при перемешивании к раствору 4,6-дихлорпиримидина при комнатной температуре. Реакционную смесь перемешивают всю ночь, а затем выливают в воду и экстрагируют три раза эфиром. Объединенные эфирные экстракты промывают разбавленным раствором гидроксида натрия (х3) и водой (х3), а затем сушат, фильтруют и выпаривают, получают 0,39 г желтой смолы. Хроматография на силикагеле (элюент эфир) дает целевое соединение в виде 0,29 г желтой смолы, которую тщательно растирают с эфиром и петролейным эфиром, получают 0,208 г твердого продукта, т.пл. 82-84оС, масс-спектр m/e 413 (М+); 1Н-ЯМР (CDCl3) дельта: 3,70 (3Н, с(. 3,85 (3Н, с), 6,91-6,97 (3Н, м), 7,03-7,09 (2Н, м), 7,40-7,47 (1Н, т), 7,59 (1Н, с), 7,61-7,65 (1Н, м), 8,12-8,15 (1Н, м), 8,60 (1Н, с). П р и м е р 10. Этот пример иллюстрирует получение (Е)-метил-2-[2-[3-(3-цианопиридин% 2-илокси)фенокси] пиридин-3- ил] -3-метоксипропеоната (соединение 21, табл.2). Смесь, содержащую 0,301 г (Е)-метил-2-]2-(3-оксифенокси) пиридин-3-ил] -3-метоксипропеноата, полученного по методике применения 3, к 0,069 г карбоната калия в 5 мл ДМФ, нагревают в атмосфере азота при 80-90оС в течение 45 мин. Прибавляют 0,139 г 2-хлoр-пиридин-3-карбонитрила и каталитическое количество медной бронзы и нагревают смесь до 115оС. Через 75 мин реакционную смесь охлаждают, оставляют на ночь, а затем выливают в воду. Смесь 3 раза экстрагируют эфиром, объединенные экстракты промывают 2 раза разбавленным раствором гидроксида натрия и 3 раза водой. Органический слой сушат, фильтруют и выпаривают, получают 0,26 г смолы, которую тщательно растирают с эфиром, получают целевое соединение в виде беловатого твердого продукта (0,170 г), т.пл. 109-112оС; ИК-спектр 1714, 1632, 2232 см-1, масс-спектр m/e 403 (М+); 1Н-ЯМР (CDCl3) дельта: 3,70 (3Н, с), 3,85 (3Н, с), 6,95-7,11 (5Н, м), 7,38-7,44 (1Н, т), 7,59 (1Н, с), 7,0-7,64 (1Н, м), 7,98-8,01 (1Н, м), 8,12-8,15 (1Н, м), 8,30-8,33 (1Н, м). П р и м е р 11. Этот пример иллюстрирует получение (Е)-метил-2-[2-[3-(5-нитротиазол-2-илокси)фенокси]пиридин-3- ил]-3-метоксипропеноата (соединение 22, табл.2). Смесь, содержащую 0,301 г (Е)-метил-2-(2-3-оксифенокси)пиридин-3-ил-3-метоксипропеноата, полученного по методике примера 3, и 0,138 г карбоната калия в 5 мл ДМФ, нагревают в атмосфере азота 1 ч при 90оС. Реакционную смесь охлаждают до комнатной температуры и прибавляют в одну порцию 0,209 г 2-бром-5-нитротиазола. Реакционную смесь перемешивают при комнатной температуре 135 мин, выливают в воду и затем 3 раза экстрагируют эфиром. Объединенные эфирные экстракты 3 раза промывают разбавленным раствором гидроксида натрия и 3 раза водой, сушат, фильтруют и выпаривают, получают 0,33 г оранжевой смолы. Хроматография на силикагеле (элюент эфиp-гексан, 1:1), дает 0,25 г целевого соединения; ИК-спектр 1710, 1638 см-1 масс-спектр m/e 429 (М+); 1Н-ЯМР (CDCl3) дельта: 3,70 (3Н, с), 3,85 (3Н, с), 7,05-7,14 (4Н, м), 7,43-7,49 (1Н, т), 7,60 (1Н, с), 7,63-7,66 (1Н, д), 8,10-8,15 (2Н, м). Примеры композиций, пригодных для сельскохозяйственных и садоводческих нужд, которые могут быть составлены из соединений по изобретению. П р и м е р 12. Эмульгирующийся концентрат изготовляют посредством смешения и перемешивания ингредиентов до полного их растворения, Соединение 12 табл.1 10 Бензиловый спирт 30 Кальций додецилбензосуль- фонат 5 Нонилфенолэроксилат (13 моль оксиэтилена) 10 Алкил бензолы 45 П р и м е р 13. Активный ингредиент растворяют в метилендихлориде и полученной жидкостью опрыскивают гранулы из глин "Аттапульгит". Для получения гранулированной композиции затем растворителю дают испариться, Соединение 12 табл.1 5 Гранулы Аттапульгита 95 П р и м е р 14. Композицию, пригодную для применения при протравливании семян, получают измельчением и смешением 3 ингредиентов, Соединение 12 табл. 1 50 Минеральное масло 2 Каолин 48 П р и м е р 15. Пригодный для опыления порошок получают измельчением и смешением активных ингредиентов с тальком, Соединение 12 табл.1 5 Тальк 95 П р и м е р 16. Суспензию концентрата получают перемалыванием в шаровой мельнице ингредиентов для получения водной суспензии измельченной смеси с водой, Соединение 12 табл.1 40 Натрий лигносульфонат 10 Бентонитовая глина 1 Вода 49 Эту рецептуру можно использовать для опрыскивания при разбавлении водой или при непосредственном нанесении на семена. П р и м е р 17. Рецептуру смачивающегося порошка получают совместным смешением и перемалыванием ингредиентов, пока все они не будут тщательно перемешаны, Соединени12 табл.1 25 Натрий лаурил сульфат 2 Натрий лигносульфонатт 5 Силикагель 25 Каолин 43 П р и м е р 18. Соединения испытывают против целого ряда грибковых заболеваний листвы растений. Применяют следующие технические приемы. Растения выращивают на компосте (1 или 2) по Джону Иннесу для применения в горшках, в мини-горшках диаметром 4 см. Испытуемое соединение вводят в состав рецептур или перемалыванием в шаровой мельнице совместно с водным Дисперсилом Т или в виде раствора в ацетоне, или в смеси ацетона с этанолом. Полученный раствор разбавляют до требуемой концентрации непосредственно перед употреблением. При заболеваниях листвы рецептуры (100 ч на миллион активного ингредиента) наносят на листву опрыскиванием, также наносят на корни растений в почве. Опрыскиваемые растворы наносят с целью максимального их удержания на обрабатываемой поверхности. Корни орошают до достижения окончательной концентрации приблизительно 40 ч на миллион активного ингредиент/сухая почва. При нанесении на хлебные, зерновые злаки добавляют "Tween 20" до достижения окончательной концентрации 0065% При проведении большинства испытаний соединение наносят на почву (корни) и листву (путем опрыскивания) за 1 или 2 дня до того, как растения инокулируют возбудителем заболевания. Исключением служит испытание с Erysiphe graminis, при котором инокулируют за 24 ч до обработки. Патогенные для листвы возбудители наносят в виде суспензий спор опрыскиванием листьев испытуемых растений. После такого опрыскивания помещают в соответствующие условия окружающей среды для развития инфекции. Инкубирование проводят до тех пор, пока заболевание не станет готовым для оценки. Период от инокулирования до оценки варьируется от 4 до 40 дней, в зависимости от заболеваний и условий окружающей среды. Борьбу с заболеванием регистрируют соответственно следующим оценочным показателям: 4 отсутствие заболевания; 3 от следов до 5% заболевания на необработанных растениях, 2 6-25% заболевания на необработанных растениях, 1 26-59% заболевания на необработанных растениях, 0 60-100% заболевания на необработанных растениях. Результаты показаны в табл.4. Все соединения относятся к категории низкотоксичных. и их стереоизомеров, где Z представляет собой фенил, незамещенный или замещенный галоидом С1-С4-алкокси, нитро, циано, амино; 2-пиримидинил, необязательно замещенный галоидом, 4-пиримидинил, необязательно замещенный галоидом или С1-С4-алкилсульфонилом, пиридин-2-ил, необязательно замещенный нитро-, цианогруппой, или 2-тиазолил, замещенный нитрогруппой, Х представляет собой ОСН2, СН2О, О, SO2O- или СН(ОН), обладающих фунгицидной активностью. Соединения по изобретению, содержащие, по меньшей мере, одну углерод-углерод двойную связь, иногда получают в виде смесей геометрических изомеров. Однако такие смеси возможно разделить на отдельные изомеры. Данное изобретение охватывает такие изомеры и их смеси во всех соотношениях, включая состояние по существу из (Z) изомера и те, которые состоят преимущественно из (Е) изомера. Индивидуальные изомеры, которые получаются из несимметрично замещенной двойной связи пропеноатной группы, идентифицируются посредством общеупотребительных терминов Е и Z. Изобретение поясняется соединениями, перечисленными в табл.1 и 2, в которых метил-3-метоксипропеонат имеет (ЕН) конфигурацию. В табл. 3 показаны избранные показатели для протонов в спектре ядерного магнитного резонанса (Я.М.Р.) для некоторых соединений, описанных в табл.1 и 2. Химические сдвиги измерены в частях 1 миллион от тетраметилсилана. Во всех случаях применяли дейтерохлороформ в качестве растворителя. Колонка, озаглавленная "частота", относится к эксплуатационной частоте ЯМР-спектрометра. Применение следующие сокращения: br широкий s синглет d дублет t триплет q квартет m мультиплет Следующие примеры поясняют изобретение. Повсюду в примерах термин "простой эфир" относится к диэтиловому эфиру. Для высушивания растворов используют сульфат магния и растворы концентрируют при пониженном давлении. Реакции, включающие концентрируют при пониженном давлении. Реакции, включающие образование промежуточных соединений, чувствительных к действию воздуха или влаги, проводят в атмосфере азота, а растворители высушивают до употребления, если необходимо. При отсутствии других указаний хроматографию проводят на колоне силикагелем в качестве стационарной фазы. Где показано, данные инфракрасного анализа и ЯМР являются избранными; не пытались привести перечень каждой абсорбции во всех случаях. 1H ЯМР-спектры регистрировали с применением растворов дейтерированного хлороформа при отсутствии других указаний. Повсюду применены следующие сокращения: ТГФ тетрагидрофуран s синглет ДМФ N,N-диметилфор- мамид d дублет ЯМР ядерный магнит- ный t триплет резонанс m мультиплет ИК-инфракрасный br широкий т.пл, точка плавления П р и м е р 1. Этот пример поясняет получение (Е)-метил 2-[2-(3-феноксифенокси)пирид-3-ил]-4-метоксипропионата (соединение 12 в табл.1). Смесь карбоната калия (5,53 г 0,04 моль) и 3-феноксифенола (15 г, 0.08 моль) в ДМФ (60 мл) нагревают при 80оС при перемешивании 30 мин 2-хлор-3-цианопиридин (11,08 г, 0,08 моль) и медь в виде бронзы (0,8 г) добавляют и полученную смесь нагревают с обратным холодильником 90 мин. Газохроматографийный (GC) анализ показал образование единичного продукта (96%). Реакционную смесь охлаждают, фильтруют, затем выливают в воду (300 мл) и оставляют стоять в течение уикэнда. Выпавшее желтовато-коричневое масло экстрагируют дихлорметаном и высушивают. Затем дихлорметановый раствор фильтруют и выпаривают, что дает неочищенный 2-(2-феноксифенокси)-3-цианопиридин 36,2 г, загрязненного ДМФ, который используют для следующей ступени без дополнительной очистки. Неочищенный 2-(3-феноксифенокси= -2-цианопиридин (15 г) перемешивают с оплавом скелетного никелевого катализатора по Ренею (125 г, 50:50) при кипячении с обратным холодильником с 75%-ной муравьиной кислотой (200 мл) 2 ч. Реакционную смесь разбавляют водой, затем экстрагируют неоднократно эфиром. Объединенные эфирные экстракты высушивают, фильтруют и выпаривают, что дает оранжевое масло. Фильтрование через данный фильтр из силикагеля, средство для отмывки с адсорбента гексанэфир (1:1), приводит к 2-(3-феноксифенокси)-3-формилпиридину 3.03 г. Инфракрасный анализ: макс. 1685 см-1. К перемешиваемому раствору альдегида (3,03 г, 0,01 моль) и метил метил-сульфинилметил сульфида (1,29 г, 0,01 моль) в сухом ТГФ (8 мл) при комнатной температуре добавляют каплями раствор Тритона Б (2,5 мл, 40% в метаноле). Полученный раствор нагревают с обратным холодильником 1 ч, охлаждают, затем разбавляют водой. Экстрагирование дихлорметаном с последующим высушиванием и выпариванием дает желтое масло, которое растворяют в метанольном растворе хлористого водорода (100 мл) и оставляют стоять на ночь. Метанол выпаривают и остаток обрабатывают насыщенным раствором бикарбоната натрия, затем экстрагируют дихлорметаном. Объединенные органические экстракты высушивают, фильтруют и выпаривают. Остаток хроматографируют на силикагеле (средство для отмывки с адсорбента гексанэфир 1:1), что дает метил 2-(3-феноксифенокси)пирид-3-ил-ацетат (1,35 иг) в виде светло-желтого масла: 1Н ЯМР дельта 3,68 (3Н, синглет); 6,74-6,88 (3Н, мультиплет); 6,96-7,12 (4Н, мультиплет); 7,24-7,40 )3Н, мультиплет), 7,56-7,60 (1Н, мультиплет); 8,06-8,12 (1Н, мультиплет); Инфракрасный анализ: макс. 1735 см-1. Раствор метил 2-(3-феноксифенокси)пирид-3-ил-ацетата (0,64 г, 0,0019 моль) и метилформат (2,34 мл, 0,038 моль) в ДМФ (2 мл) добавляют каплями за 15 мин к перемешиваемой суспензии промытого петролейным эфиром гидрида натрия (0,18 г, 0,0038 моль/50%-ной суспензии в масле) в ДМФ (10 мл). Во время добавления температуру выдерживают на уровне ниже 10оС. Реакционная смесь с интенсивным выделением пузырьков газа приобретает желтую окраску. Температуре раствора дают повыситься до комнатной. Температуры и перемешивание продолжают 2 ч. Реакционную смесь выливают в воду (100 мл), нейтрализуют разбавленным раствором хлористоводородной кислоты, затем экстрагируют эфиром (4 х 25 мл). Объединенные эфирные слои промывают водой и рассолом, затем высушивают и выпаривают. Полученное желтое масло (0,69 г) растворяют в ДМФ (10 мл), затем перемешивают с карбонатом калия (0,53 г) 15 мин. Диметилсульфат (0,17 мл) затем добавляют единичной порцией и перемешивание продолжают еще 4 ч. После этого реакционную смесь разбавляют водой (100 мл) и экстрагируют эфиром (4 х 25). Объединенные экстракты промывают водой и рассолом, высушивают, фильтруют и выпаривают, что приводит к оранжевому маслу. Хроматографирование на силикагеле (средства для отмывки адсорбента 40:50 петролейный эфир эфир 1:1) дает указанное в заголовке соединение в виде кристаллического твердого вещества (0,32 г, 45%). Точка плавления, 79-81оС; 1Н ЯМР дельта 3,64 (3Н, синглет); 3,84 (3Н, синглет); 6,72-6,84 (3Н, мультиплет); 7,00-7,12 (4Н, мультиплет); 7,24-7,34 (3Н, мультиплет); 7,52-7,60 (2Н, мультиплет); 7,56 (1Н, синглет), 8,08-8,14 (1Н, мультиплет). Инфракрасный анализ: макс. 1710, 1640 см-1. П р и м е р 2. Этот пример поясняет получение (Е)-метил-2-[2-(3-бензолоксифенокси)пиридин-2-ил]-3-метокси- пропеноата (соединение 2, табл.1). 3-Метоксифенол (124 г) и безводный карбонат калия (69 г) нагревают совместно при перемешивании в сухом ДМФ (500 мл) при 80о в атмосфере азота. Спустя 45 мин сероватый раствор охлаждают и добавляют 2-хлорникотинитрил (138,5 г) и медь в виде бронзы (10 г), промытую 100 мл ДМФ. Полученную коричневую реакционную смесь нагревают до 125-130оС. Через 2ч 30 мин реакционную смесь охлаждают и фильтруют для удаления избытка медной бронзы и нерастворенного твердого материала. Полученный раствор добавляют к воде (3 л) и оставляют стоять на ночь. Полученный осадок отфильтровывают, промывают водой, затем растворяют в эфире. Эфирный раствор высушивают, фильтруют и выпаривают, что дает 2-(3-метоксифенокси)-3-цианопиридин в виде не вполне белого твердого вещества (203,5 г, 90%). Точка плавления: 66-68оС. Инфракрасный анализ: макс 2232 см-1. К перемешиваемому раствору 2-(3-метоксифенокси)-3-цианопиридина (5 г) в сухом ТГФ (25 мл) при минус 70оС в атмосфере азота добавляют каплями диизобутилалюминий гидрид (27,6 мл, 1,0 моль) при минус 70оС дополнительно 30 мин, затем дают подогреться до комнатной температуры. Через 9 ч хроматографический газовый анализ показал 30%-ную реакцию. Реакционную смесь охлаждают до минус 70оС и обрабатывают как указано во второй загрузке диизобутилалюминийгидридом (27,6 мл). Через 1 ч по данным газового хроматографического анализа при комнатной температуре отсутствие исходного материала. Разбавленную хлористоводородную кислоту (50%) добавляют чрезвычайно осторожно по причине экзотермической реакции. Полученный раствор перемешивают еще 30 мин, затем разделяют на слои посредством эфира. Водный слой дополнительно экстрагируют (х 2) эфиром. Объединенные эфирные слои высушивают, фильтруют и выпаривают, что приводит к желтому маслу. Хроматография на силикагеле (средство для отмывки из адсорбента дихлорметан) показала наличие 2-(3-метоксифенокси)-3-пиридинкарбоксальдегида (1,7 г, 33%) в виде белых кристаллов. Точка плавления: 76-78оС. Инфракрасный анализ: макс. 1694 см-1. 1Н ЯМР дельта, 3,63 (3Н, синглет); 6,75-6,84 (3А); 7,11-7,15 (1Н); 7,33-7,38 (1Н); 8,24-8,26 (1Н) 8,35-8,38 (1Н), части на 1 млн. При проведении отдельного крупномасштабного эксперимента 2-(3-метоксифенокси)-3-цианопиридин (45 г) превращают (за 3 загрузки) до 2-(3-метоксифенокси)-3-пиридинкарбоксальдегида (34 г, 75%). К перемешиваемому раствору 2-(3-метоксифенокси)-3-пиридин карбоксальдегида (8,07 г) и метил метилсульфинилметил- сульфида (6,78 мл) в сухом ТГФ(20 мл) при комнатной температуре, в атмосфере азота добавляют каплями Тритон Б (14 мл, 40%-ный раствор в метаноле). После нагревания с обратным холодильником 90 мин газохроматографический анализ показал отсутствие исходного материала. Реакционную смесь охлаждают до комнатной температуры и добавляют дихлорметан (450 мл). После этого полученный раствор высушивают, экстрагируют водой (3 х 10 мл). Далее органический слой высушивают, фильтруют и выпаривают, что дает оранжевое масло (22,88 г), которое используют в последующей ступени без дополнительной очистки. Оранжевое масло растворяют в метанольном растворе хлористого водорода из 300 мл метанола и 35 мл ацетил хлорида, перемешивают 4 ч, оставляют стоять при комнатной температуре. Через 2 дня растворитель удаляют и остаток нейтрализуют насыщенным раствором бикарбоната натрия. Продукт экстрагируют этилацетатом. Полученный раствор высушивают, фильтруют и выпаривают, что дает неочищенный метил 2-(3-метоксифенокси)-3-пиридинил ацетат (13,88 г 90%-ной частоты по данным газовой хроматографии). Инфракрасный анализ: макс 1740 см-1. 1Н ЯМР (дейтерированный хлороформ). Среди прочих дельта (9,71 (3Н, синглет); 3,76 (2Н); 3,95 (3Н). В отдельном эксперименте 2-(3-метоксифенокси)-3-пиридинкарбоксальдегид (93,03 г) превращают до метил 2-(3-метоксифенокси)-2-пиридинилацетата (28% общий выход 71%). Метил 2-(3-метоксифенокси)-3-пиридинилацетат (27,2 г) нагревают при 115оС в 47%-ной бромистоводородной кислоте (249 г), содержащей гексадецилтрибутилфосфоний бромид (5,6 г). Через 3 ч раствор охлаждают и добавляют карбонат калия до рН раствора около 6. Реакционную смесь экстрагируют (х 5) этилацетатом. Органические экстракты высушивают, фильтруют и выпаривают, что дает бледно-оранжевое твердое вещество. Затем твердое вещество обрабатывают метанольным раствором хлористого водорода, оставляя на всю ночь (из метанола (500 мл) и ацетил хлорида (50 мл)). Метанол удаляют и остаток растворяют в воде. рН раствора добавляют приблизительно до рН 6 посредством бикарбоната натрия и раствор экстрагируют этилацетатом (х 3). Объединенные органические экстракты высушивают, фильтруют и выпаривают. Остаток, полученный в виде твердого оранжевого вещества, перерастворяют в дихлорметане и фильтруют через домный фильтр из силикагеля (средство для отмывки из адсорбента эфир дихлорметан). Выпаривание дает метил 2-(3-оксифенокси)-3-пиридинилацетат в виде бледно-желтого твердого вещества (13,28 г, 51%), который используют дополнительной очистки. Метил 2-(3-оксифенокси)-3-пиридинил ацетат (0,8 г) и безводный карбонат калия (0,21 г) перемешивают совместно в ДМФ в атмосфере азота при 70оС. Через 20 мин бензил бромид (1,06 г) добавляют вместе с медью в виде бронзы (катализатор) и реакционную смесь нагревают до 1000оС 3 ч. Анализ показал, что реакция прошла на 50% Добавляют второй эквивалент карбоната калия и бензил бромида и нагревание продолжают при 100оС 2 ч. Реакционную смесь охлаждают до комнатной температуры, фильтруют, разбавляют водой и экстрагируют эфиром (х3). Эфирные экстракты объединяют, высушивают, фильтруют и выпаривают, что дает коричневое масло. Хроматографирование на силикагеле (элюент петролейный эфир эфир 50:50) дает метил 2-(3-бензилоксифенокси)-3-пиридинацетат в виде светло-желтого твердого вещества (0,5 г 46%). Инфракрасный анализ: макс. 1735 см-1. 1Н ЯМР (дейтерированный хлороформ), среди прочих дельта 3,70 (3Н, синглет); 3,76 (2Н, синглет); 5,04 (2Н, синглет). При отдельном эксперименте получено дополнительно 0,3 г продукта. 2 пробы объединяют для следующей ступени. Раствор, содержащий метил формат (2,85 мл) и метил 2-(3-бензилоксифенокси)-2-пиридинилацетата (0,8 г) в ДМФ, добавляют по каплям к перемешиваемой суспензии гидрида натрия (0,22 г 50%-ная дисперсия в масле, предварительно промытая петролейным эфиром) в ДМФ (10 мл) (выделение пузырьков газа). Температуру поддерживают на уровне ниже 10оС за все время добавления, затем составляют до достижения комнатной температуры. После дополнительного 4 ч перемешивания реакционную смесь оставляют стоять на уикэнд. Реакционную смесь выливают в воду, заранее подксиленную разбавленной хлористоводородной кислотой, затем экстрагируют эфиром (х3). Объединенные эфирные экстракты высушивают, фильтруют и выпаривают, что дает желтое масло (0,86 г). Масло растворяют в ДМФ (10 мл) и обрабатывают карбонатом калия (0,64 г) и диметилсульфатом (0,21 мл) при комнатной температуре. После 4 ч перемешивания хроматографический газовый анализ показал полное окончание реакции. Добавляют воду (100 мл) и полученный раствор экстрагируют эфиром (3 х 25 мл). Объединенные эфирные экстракты промывают водой, затем рассолом и высушивают. Фильтрование и выпаривание дают оранжево-коричневое масло. Хроматографирование на силикагеле (элюент петролейные эфир-эфир 50:50) приводит к указанному в заголовке соединению в виде твердого белого вещества (0,2 г, 22%). Т.пл. 119-122оС. Масс-спектр т/е 391 (М+). Инфракрасный анализ: макс. 1705, 1640 см-1. 1Н ЯМР (дейтерированный хлороформ) дельта 3,68 (3Н; синглет); 3,84 (синглет); 5,03 (2Н, синглет); 6,66-6,80 (3Н, мультиплет); 6,96-7,04 (1Н, мультиплет); 7,20-7,42 (6Н, мультиплет); 7,58 (1Н, синглет); 7,60-7,62 (1Н, мультиплет); 8,08-8,12 (1Н, мультиплет). П р и м е р 3. Этот пример поясняет получение (Е)-метил-2-[2-(3-нитробензолсульфонилокси)фенокси]пиридин-3- ил-3-метоксипропионата (соединение 9, табл.1). Раствор, содержащий метил 2-(3-оксифенокси)-3-пиридинацетат (1 г, получен как описано в примере 2) и метилформат (4,68 мл) в ДМФ (5 мл) добавляют каплями к перемешиваемой суспензии гидрида натрия (0,56 г 50%-ная дисперсия в масле, предварительно промыт петролейным эфиром) в ДМФ (10 мл). По окончании реакции реакционную смесь обрабатывают как указано ранее, что дает неочищенный метил 2-[2-(3-оксифенокси)пиридин-3-ил]-3-окси- пропеонат. Продукт обрабатывают карбонатом калия (0,31 г) и диметил сульфатом (0,27 г) в ДМФ (10 мл) при условиях, описанных в примере 2, что дает после стандартной обработки масло. Хроматографирование на силикагеле (элюент петролейный эфир эфир 50: 50 дает (Е)-метил-2-[2-(3-оксифенокси)пиридин-3-ил]-3- метоксипропенона в виде белого твердого вещества (0,635 г, 31%). Точка плавления 163-165оС, масс-спектр m/e 301 (М+). Инфракрасный спектр: макс 1665, 1633 см-1. 1Н ЯМР (дейтерированный хлороформ) дельта и 3,68 (3Н, синглет); 3,86 (3Н, синглет); 6,48 (1Н); 6,54-6,6 (3Н); 7.00-7,06 (1Н); 7,12-7,20 (1Н); 7,58 (1Н, синглет); 7,60-7,64 (1Н); 8,08-8,12 (1Н), части на 1 миллион. (Е)-метил-2-[2-(3-оксифеноксипиридин-3-ил)-3-метоксипропеноат] (0,1, получен, как описано выше) перемешивают с 3-нитробензолсульфонилхлоридом (0,074 мл) и три этиламином (0,74 мл) в сухом дихлорметане (2 мл) при комнатной температуре. Через 1 ч реакционную смесь переносят непосредственно в колонку с силикагелем. Элюирование петролейным эфиром эфиром (50:50) дает указанное в заголовке соединение в виде белого губчатого твердого вещества (0,101 г, 63%). Точка плавления: 49-51оС. Масс-спектр m/e 486 (М+). Инфракрасный спектр: 1710, 1638 см-1. 1H ЯМР (дейтерированный хлороформ) дельта 3,66 (3Н, синглет); 3,85 (3Н, синглет); 6,77-6,83 (2Н); 7,00-7,09 (2Н); 7,29-7,31 (Э1Н); 7,57 (1Н, синглет); 7,60-7,62 (1Н); 7,71-7,78 (1Н); 8,03-8,08 (1Н); части на 1 миллион. П р и м е р 4. Этот пример поясняет получение (Е)-метил-2-[2-(3- (4-нитрофенокси)фенокси)пиридин-3-ил]-3-метоксипропенота (соединение 6, табл.1). (Е)-Метил-2-[2-(3-оксифенокси)пиридин-3-ил] -3-метоксипропионат (0,3 г, получен, как описано в примере 1), и карбонат калия (0,069 г) нагревают совместно с ДМФ (5 мл) при 70оС. Спустя 20 мин 4-фторнитробензол (0,141 л ) и медь в виде бронзы (катализатор) добавляют и полученную смесь нагревают при 130оС 2 ч. Газовая хроматография свидетельствует об отсутствии исходного материала. Реакционную смесь фильтруют, затем выливают в воду (70 мл). Полученную смесь экстрагируют эфиром (х3) объединенные эфирные экстракты высушивают, фильтруют и выпаривают, что дает оранжевое масло. Хроматография на силикагеле приводит к указанному в заголовке соединению в виде белого кристаллического твердого вещества (0,266 г, 64%). Точка плавления: 102-103оС; масс-спектр m/e 422 (М+). Инфракрасный анализ: макс 1700, 1625 см-1. 1Н ЯМР (дейтерированный хлороформ) дельта 3,64 (3Н, синглет); 3,85 (3Н, синглет); 6,80-6,88 (2Н); 6,94-7,10 (4Н); 7,36-7,42 (1Н); 7,59 (1Н, синглет); 7,60-7,64 (1Н); 8,10-8,12 (1Н); 8,15-8,22 (2Н). П р и м е р 5. Этот пример поясняет получение (Е)-метил-2-[2-(3- (пиримидин-2-ил-окси)фенокси)пиридин-2-ил] -3-метоксипропионат (соединен 14, табл.2). (Е)-Метил-2-[2-(3-оксифенокси)пиридин-3-ил]-3-метоксипропионат (0,67 л), полученный как описано в примере 3, нагревают при 80оС с карбонатом калия (0,154 г) в ДМФ (10 мл) в атмосфере азота. Спустя 20 мин добавляют 2-хлорпиримидин ), 253 г) и медь в виде бронзы (катализатор). Полученную смесь нагревают при 130оС при перемешивании 2 ч 30 мин. Газовая хроматография свидетельствует об окончании реакции. Реакционную смесь охлаждают, фильтруют и затем выливают в воду. Далее водную фазу экстрагируют эфиром (х3), объединенные эфирные слои высушивают, фильтруют и выпаривают, что дает желтоватое твердое вещество. Хроматография на силикагеле (элюент-этилацетат, 2:1), дает указанное в заголовке соединение в виде белого твердого вещества (0,308, 37% ). Точка плавления: 151-153оС; масс-спектр m/e 379 (М+). Инфракрасный анализ: макс 1695, 1635 см-1. 1Н ЯМР (дейтрированный хлороформ) дельта 3,68 (3Н, синглет); 3,85 (3Н, синглет); 6,94-7,06 (5Н); 7,38-7,43 (1Н); 7,57 (1Н, синглет); 7,62-7,66 (1Н); 8,11-8,15 (1Н); 8,53-8,57 (2Н); части на 1 миллион. П р и м е р 6. Этот пример поясняет получение (Е)-метил-2-[2-(3-феноксиметилфенокси)пиридин-ил[-3-метоксипропеноат (соединение 1, табл.1). Смесь 2-хлор-3-пиридинкарбоксальдегида (10,0 г); 3-оксибензилового спирта (8,76); безводного карбоната калия (4,76 г); безводного карбоната калия (4,88 г) в ДМФ (70 мл) нагревают с обратным холодильником. Через 3 ч газовый хроматографический анализ показал, что весь альдегид израсходовался. Реакционную смесь охлаждают, фильтруют, затем выливают в воду. Полученную смесь экстрагируют эфиром (х3) и объединенные эфирные слои промывают однократно разбавленным раствором гидроокиси натрия. Затем эфирный раствор высушивают, фильтруют и выпаривают, что дает палево-оранжевое масло, кристаллизующееся при стоянии (9,1 г). К раствору этого продукта (6,24 г) метилсульфинилметилсульфида (3,38 г) в ТГФ при комнатной температуре в атмосфере азота добавляют каплями Тритон Б (8 мл, 40%-ный раствор в метаноле). После 4 ч нагревают с обратным холодильником реакционную смесь охлаждают до комнатной температуры и добавляют дихлорметан (300 мл). Полученный раствор экстрагируют водой (х3). Дихлорметановый слой высушивают, фильтруют и выпаривают, что дает темно-оранжевое масло (8,5 г), которое используют непосредственно для следующей ступени. Темно-оранжевое масло (8,5 г) неочищенный продукт растворяют в метанольном растворе хлористого водорода (из метанола (150 мл) и ацетил хлорида (15 мл), перемешивают 3 ч, затем оставляют стоять на уикэнд. Метанол удаляют выпариванием и добавляют насыщенный водный раствор бикарбоната натрия. Смесь экстрагируют этилацетатом (х3). Объединенные органические слои высушивают, фильтруют и выпаривают, что дает желтое масло. Масло фильтруют через донный слой силикагеля (элюент дихлорметан, затем эфир). Выпаривание растворителя дает метил-2-(3-эксиметилфенокси)-3-пиридинилацетат в виде палево-оранжевого масла (4,04 г, 88%-ной степени чистоты по данным газовой хроматографии. Инфракрасный анализ: макс. 3400, 1737 см-1. Продукт применяют для следующей ступени без дополнительной очистки. Раствор метил-2-(3-оксифенокси)-3-пиридинацетата (0,63 г) и триэтиламина (0,45 мл) в дихлорметане (2 мл) добавляют каплями за 20 мин к перемешиваемому раствору хлористого метила (0,026 мл) в дихлорметане (6 мл) примерно 5оС. Смесь перемешивают при 5оС мин, подогревают до комнатной температуры, затем оставляют стоять на уикэнд. Газовый хроматографический анализ аликвотной пробы показывает на завершение реакции. Реакционную смесь перемешивают с рассолом 30 мин. Далее органический слой высушивают, фильтруют и выпаривают, что дает метил-2-(3-хлорметилфенокси)-3-пиридинилацетат в виде палево-желтого масла (0,55 г), которое применяют непосредственно. Инфракрасный анализ: макс. 1738 см-1. Макс-спектр m/e 291 9М+). 1Н ЯМР (дейтрированный хлороформ); среди прочих дельта 3,69 (3Н, синглет); 3,77 (2Н, синглет); 4,60 (2Н, синглет). Фенол (0,16 г) и карбонат калия (0,12 г) перемешивают вместе с ДМФ (6 мл) в атмосфере азота при комнатной температуре. Через 20 мин добавляют раствор метил-2-(3-хлорметилфенокси)-3-пиридинилацетат (0,5 г) в ДМФ и продолжают перемешивание. Добавляют медь в виде бронзы (катализатор) и реакционную смесь нагревают при 100оС в течение 5 ч. Газохроматогpафический анализ показал завершение реакции. Реакционную смесь охлаждают, фильтруют, затем выливают в воду (50 мл). Водную смесь экстрагируют эфиром (х3). Объединенные экстракты промывают раствором гидроокиси натрия. После этого эфирный раствор высушивают, фильтруют и выпаривают, что дает метил-2-(3-феноксиметилфенокси(-3-пиридинацетет в виде желтого масла (0,35 г, 59%). Масс-спектр m/e 439 (М+). 1Н ЯМР (дейтрированный хлороформ) среди прочих, дельта 3,69 (3Н, синглет); 3,76 (2Н, синглет); 5,07 (2Н, синглет) части на 1 миллион. Указанное соединение содержит следы ДМФ. При отдельном опыте хлорметильное соединение (2,73 г), полученное как указано выше, дает дополнительно 2,00 г метил-2-(3-феноксиметилфенокси)-3-пиридинилацетат. Раствор метил-2-(3-феноксиметилфенокси)-3-пиридинилацетата (3,35 г) и метилформата (6,2 мл) в ДМФ добавляют к суспензии гидрида натрия (0,64 г, 60%-ная дисперсия в масле, предварительно промытый петролейным эфиром) в ДМФ (25 мл) при тех же условиях, что описаны в заключительной стадии примера 1. Стандартная обработка приводит к неочищенному метил-[2-(3-феноксиметилфенокси)пиридин-3-ил] -3-оксипропан, который обрабатывают непосредственно карбонатом калия (1,85 г) и диметилсульфатом (0,63 мл) в ДМФ (17 мл). Стандартная обработка и хроматография на силикагеле (элюент петролейный эфир-эфир (50:50) проводят к указанному в заголовке соединению в виде белой смолы (0,53 г, 1638 см-1; 1ЯМР таковы, как в табл.3). П р и м е р 7. Этот пример поясняет получение (Е)-метил-2-[2-(3-метоксифенокси)пиридин-3-ил]-3-метокси- пропеоната (соединение 4, табл.1). К охлаждаемой льдом перемешиваемой суспензии промытого петролейным эфиром гидрида натрия (1,04 г, 50%-ная дисперсия в масле, 22 ммоль) в ДМФ (16 мл) добавляют раствор метил-2-хлорпирид-3-илацетет (2 г, 11 ммоль) и метилформата (12,75 г; 0,22 моль) в ДМФ (8 мл). Реакционную смесь оставляют подогреться до комнатной температуры и перемешивание продолжают до тех пор, пока анализ по способу тонкослойной хроматографии не покажет отсутствие остаточного исходного материала (около 3 ч.). Реакционную смесь выливают в воду, затем подкисляют разбавленной хлористоводородной кислотой. Раствор повторно экстрагируют эфиром и объединенные эфирные экстракты высушивают, фильтруют и выпаривают. Остаток снова растворяют в ДМФ, после чего обрабатывают диметилсульфатом (1,32 г, 10 ммоль), а безводным карбонатом калия (1,52 г, 11 ммоль) при комнатной температуре. Реакционную смесь перемешивают 2 ч, разбавляют водой, после чего повторно экстрагируют эфиром. Объединенные эфирные экстракты высушивают, фильтруют и выпаривают, что дает желтое масло. Хроматография на силикагеле (элюент петролейный эфир-эфир 50:50) дает (Е)-метил-2-(2-хлор-пирид-3-ил)-3-метоксипропеноат в виде белого похожего на воск вещества (0,9 г; 36%). Точка плавления: 39-40оС. Инфракрасный анализ: макс. 1711, 1638 см-1. 1Н ЯМР дельта: 3,74 (3Н, синглет); 3,89 (3Н, синглет); 7,21-7,26 (1Н); 7,55-7,57 (1Н); 7,60 (1Н, синглет); 8,32-8,36 (1Н). (Е)-Метил-2-(2-хлорпиридин-3-ил)-2-метоксипропеноат (0,227 г), 3-(2-метоксифенокси) фенол (0,255 г), безводный карбонат калия (0,069 г), медь в виде бронзы (катализатор) и медь (I) хлорид (катализатор) нагревают совместно приблизительно при 170оС 3 ч в атмосфере азота. Реакционную смесь охлаждают, затем разбавляют небольшим количеством дихлорметана. Полученную смесь помещают непосредственно в колонку с силикагелем и хроматографируют (элюент петролейный эфир-эфир 1:1), что дает указанное в заголовке соединение в виде палево-коричневого масла (0,023 г, 6%). Масс-спектр m/e 407 (М+). 1Н ЯМР (дейтерированный хлороформ) даны в табл.3. П р и м е р 8. Этот пример иллюстрирует получение (Е)-метил-2-[2-[3-(пиридин-2-ил)оксиметилфенокси]пиридин-3-ил] 3-метоксипропеноата (соединение 20, табл.2). Смесь, содержащую 2 г полученного по методике примера 6 метил-2-(3-хлорметилфенокси)-3-пиридинилацетата, 0,64 г 2-оксипиридина и 1,88 г карбоната серебра в 30 мл гексана, кипятят с обратным холодильником 6 ч. Реакционную смесь распределяют между водой с гексаном и водный слой трижды экстрагируют эфиром. Объединенные органические экстракты сушат, фильтруют и выпаривают, получая коричневое масло. Хроматография на силикагале (элюент петролейный эфир-эфир, 1:1) дает метил-2-[3-пиридин-2-ил)оксиметилфенокси] -3-пиридинилацетат (0,56 г, 24%) в виде прозрачного масла: 1Н-ЯМР (CDCl3) дельта: 3,70 (3Н, С); 3,75 (2Н, с), 5,38 (2Н, с), 6,77-7,42 (7Н, м), 7,57-7,64 (2Н, м), 8,03-8,18 (2Н, м). Раствор метил-2-[3-(пиридин-2-ил)оксиметилфенокси] -3-пиридиналацетата (0,56 г) и 1,48 г метилформата в 5 мл ДМФ прибавляют к суспензии гидрида натрия (0,15 г, 50%-ная дисперсия в масле, предварительная промывка петролейным эфиром) в ДМФ в тех же условиях, что описаны в конечной стадии примера 1. Стандартная обработка дает сырой метиил-2-[2-[3-(пиридин2-ил)оксиметилфенокси] пиридин-3-ил]-3- оксипропеноат, который непосредственно обрабатывают 0,44 г карбоната калия и 0,2 г диметилсульфата в 5 мл ДМФ 4 ч. Стандартная обработка и хроматография на силикагеле (элюент эфир-петролейный эфир, 6:4) дает целевое соединение в виде белого масла (0,05 г); ИК-спектр: 1711, 1637 см-1; 1Н ЯМР-спектр (CDCl3) дельта: 3,68 (3Н, с), 3,85 (3Н, с), 5,38 (2Н, с); 6,75-6,87 (1Н, м), 6,98-7,06 (1Н, м), 7,17-7,25 (4Н, м), 7,37-7,40 (1Н, м), 7,58 (1Н, с), 7,55-7,64 (2Н, м), 8.09-8,17 (2Н, м). П р и м е р 9. Этот пример иллюстрирует получение (Е)-метил-2- [2-[3,6-хлолрпиримидин-4-ил-оксифенокси] пиридин-3-ил] -3- метоксипропеноата (соединение 16, табл.2). Смесь, содержащую 0,512 г (Е)-метил-2-(2-(3-оксифенокси) миридин-3-ил)-3-метоксипропеноата, полученного по методике примера 3, и 0,0117 г безводного карбоната калия в 5 мл ДМФ нагревают при 80-90оС в течение 1 ч в атмосфере азота. Оранжевую реакционную смесь охлаждают, разбавляют 5 мл ДМФ и затем по каплям прибавляют в течение 15 мин при перемешивании к раствору 4,6-дихлорпиримидина при комнатной температуре. Реакционную смесь перемешивают всю ночь, а затем выливают в воду и экстрагируют три раза эфиром. Объединенные эфирные экстракты промывают разбавленным раствором гидроксида натрия (х3) и водой (х3), а затем сушат, фильтруют и выпаривают, получают 0,39 г желтой смолы. Хроматография на силикагеле (элюент эфир) дает целевое соединение в виде 0,29 г желтой смолы, которую тщательно растирают с эфиром и петролейным эфиром, получают 0,208 г твердого продукта, т.пл. 82-84оС, масс-спектр m/e 413 (М+); 1Н-ЯМР (CDCl3) дельта: 3,70 (3Н, с(. 3,85 (3Н, с), 6,91-6,97 (3Н, м), 7,03-7,09 (2Н, м), 7,40-7,47 (1Н, т), 7,59 (1Н, с), 7,61-7,65 (1Н, м), 8,12-8,15 (1Н, м), 8,60 (1Н, с). П р и м е р 10. Этот пример иллюстрирует получение (Е)-метил-2-[2-[3-(3-цианопиридин% 2-илокси)фенокси] пиридин-3- ил] -3-метоксипропеоната (соединение 21, табл.2). Смесь, содержащую 0,301 г (Е)-метил-2-]2-(3-оксифенокси) пиридин-3-ил] -3-метоксипропеноата, полученного по методике применения 3, к 0,069 г карбоната калия в 5 мл ДМФ, нагревают в атмосфере азота при 80-90оС в течение 45 мин. Прибавляют 0,139 г 2-хлoр-пиридин-3-карбонитрила и каталитическое количество медной бронзы и нагревают смесь до 115оС. Через 75 мин реакционную смесь охлаждают, оставляют на ночь, а затем выливают в воду. Смесь 3 раза экстрагируют эфиром, объединенные экстракты промывают 2 раза разбавленным раствором гидроксида натрия и 3 раза водой. Органический слой сушат, фильтруют и выпаривают, получают 0,26 г смолы, которую тщательно растирают с эфиром, получают целевое соединение в виде беловатого твердого продукта (0,170 г), т.пл. 109-112оС; ИК-спектр 1714, 1632, 2232 см-1, масс-спектр m/e 403 (М+); 1Н-ЯМР (CDCl3) дельта: 3,70 (3Н, с), 3,85 (3Н, с), 6,95-7,11 (5Н, м), 7,38-7,44 (1Н, т), 7,59 (1Н, с), 7,0-7,64 (1Н, м), 7,98-8,01 (1Н, м), 8,12-8,15 (1Н, м), 8,30-8,33 (1Н, м). П р и м е р 11. Этот пример иллюстрирует получение (Е)-метил-2-[2-[3-(5-нитротиазол-2-илокси)фенокси]пиридин-3- ил]-3-метоксипропеноата (соединение 22, табл.2). Смесь, содержащую 0,301 г (Е)-метил-2-(2-3-оксифенокси)пиридин-3-ил-3-метоксипропеноата, полученного по методике примера 3, и 0,138 г карбоната калия в 5 мл ДМФ, нагревают в атмосфере азота 1 ч при 90оС. Реакционную смесь охлаждают до комнатной температуры и прибавляют в одну порцию 0,209 г 2-бром-5-нитротиазола. Реакционную смесь перемешивают при комнатной температуре 135 мин, выливают в воду и затем 3 раза экстрагируют эфиром. Объединенные эфирные экстракты 3 раза промывают разбавленным раствором гидроксида натрия и 3 раза водой, сушат, фильтруют и выпаривают, получают 0,33 г оранжевой смолы. Хроматография на силикагеле (элюент эфиp-гексан, 1:1), дает 0,25 г целевого соединения; ИК-спектр 1710, 1638 см-1 масс-спектр m/e 429 (М+); 1Н-ЯМР (CDCl3) дельта: 3,70 (3Н, с), 3,85 (3Н, с), 7,05-7,14 (4Н, м), 7,43-7,49 (1Н, т), 7,60 (1Н, с), 7,63-7,66 (1Н, д), 8,10-8,15 (2Н, м). Примеры композиций, пригодных для сельскохозяйственных и садоводческих нужд, которые могут быть составлены из соединений по изобретению. П р и м е р 12. Эмульгирующийся концентрат изготовляют посредством смешения и перемешивания ингредиентов до полного их растворения, Соединение 12 табл.1 10 Бензиловый спирт 30 Кальций додецилбензосуль- фонат 5 Нонилфенолэроксилат (13 моль оксиэтилена) 10 Алкил бензолы 45 П р и м е р 13. Активный ингредиент растворяют в метилендихлориде и полученной жидкостью опрыскивают гранулы из глин "Аттапульгит". Для получения гранулированной композиции затем растворителю дают испариться, Соединение 12 табл.1 5 Гранулы Аттапульгита 95 П р и м е р 14. Композицию, пригодную для применения при протравливании семян, получают измельчением и смешением 3 ингредиентов, Соединение 12 табл. 1 50 Минеральное масло 2 Каолин 48 П р и м е р 15. Пригодный для опыления порошок получают измельчением и смешением активных ингредиентов с тальком, Соединение 12 табл.1 5 Тальк 95 П р и м е р 16. Суспензию концентрата получают перемалыванием в шаровой мельнице ингредиентов для получения водной суспензии измельченной смеси с водой, Соединение 12 табл.1 40 Натрий лигносульфонат 10 Бентонитовая глина 1 Вода 49 Эту рецептуру можно использовать для опрыскивания при разбавлении водой или при непосредственном нанесении на семена. П р и м е р 17. Рецептуру смачивающегося порошка получают совместным смешением и перемалыванием ингредиентов, пока все они не будут тщательно перемешаны, Соединени12 табл.1 25 Натрий лаурил сульфат 2 Натрий лигносульфонатт 5 Силикагель 25 Каолин 43 П р и м е р 18. Соединения испытывают против целого ряда грибковых заболеваний листвы растений. Применяют следующие технические приемы. Растения выращивают на компосте (1 или 2) по Джону Иннесу для применения в горшках, в мини-горшках диаметром 4 см. Испытуемое соединение вводят в состав рецептур или перемалыванием в шаровой мельнице совместно с водным Дисперсилом Т или в виде раствора в ацетоне, или в смеси ацетона с этанолом. Полученный раствор разбавляют до требуемой концентрации непосредственно перед употреблением. При заболеваниях листвы рецептуры (100 ч на миллион активного ингредиента) наносят на листву опрыскиванием, также наносят на корни растений в почве. Опрыскиваемые растворы наносят с целью максимального их удержания на обрабатываемой поверхности. Корни орошают до достижения окончательной концентрации приблизительно 40 ч на миллион активного ингредиент/сухая почва. При нанесении на хлебные, зерновые злаки добавляют "Tween 20" до достижения окончательной концентрации 0065% При проведении большинства испытаний соединение наносят на почву (корни) и листву (путем опрыскивания) за 1 или 2 дня до того, как растения инокулируют возбудителем заболевания. Исключением служит испытание с Erysiphe graminis, при котором инокулируют за 24 ч до обработки. Патогенные для листвы возбудители наносят в виде суспензий спор опрыскиванием листьев испытуемых растений. После такого опрыскивания помещают в соответствующие условия окружающей среды для развития инфекции. Инкубирование проводят до тех пор, пока заболевание не станет готовым для оценки. Период от инокулирования до оценки варьируется от 4 до 40 дней, в зависимости от заболеваний и условий окружающей среды. Борьбу с заболеванием регистрируют соответственно следующим оценочным показателям: 4 отсутствие заболевания; 3 от следов до 5% заболевания на необработанных растениях, 2 6-25% заболевания на необработанных растениях, 1 26-59% заболевания на необработанных растениях, 0 60-100% заболевания на необработанных растениях. Результаты показаны в табл.4. Все соединения относятся к категории низкотоксичных.
ФОРМУЛА ИЗОБРЕТЕНИЯПроизводные акриловой кислоты общей формулы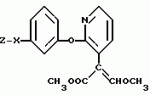 и их стереоизомеры, где Z фенил, необязательно замещенный галоидом, нитро, циано, амино или C1 C4-алкокси, 2-пиридил, необязательно замещенный циано или нитро, 2-пиримидинил, необязательно замещенный галоидом, 4-пиримидинил, необязательно замещенный галоидом или C1 C4-алкилсульфонилом, или 2-тиазолил, замещенный нитрогруппой; X O, OCH2, CH2O, SO2O или CH(OH), обладающие фунгицидной активностью. и их стереоизомеры, где Z фенил, необязательно замещенный галоидом, нитро, циано, амино или C1 C4-алкокси, 2-пиридил, необязательно замещенный циано или нитро, 2-пиримидинил, необязательно замещенный галоидом, 4-пиримидинил, необязательно замещенный галоидом или C1 C4-алкилсульфонилом, или 2-тиазолил, замещенный нитрогруппой; X O, OCH2, CH2O, SO2O или CH(OH), обладающие фунгицидной активностью.Популярные патенты: 2066320 Производные тиазола, способ их получения и способ борьбы с грибками ... Конкретно, был испытан 2-бром-5-нитротиазол с использованием методики примера 36 /d/ и /e/ данной заявки. Как видно из нижеприведенных данных, известное соединение неактивно в отношении Leptosphaedria nodorum /Ln/ и Erysiphe graminis /Eg/, тогда как все испытанные в данной заявке соединения проявляют по меньшей мере 50% активность в отношении хотя бы одного из этих заболеваний. Результаты испытаний 2-бром-5-нитротиазола ТТТ12 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производные тиазола общей формулы где R 4-хлорфенил, 4-фторфенил или 2,4-дихлорфенил; А группа формулы -С О, -С NOR1 или R1 C1-C7-алкил, циклопропилметил, пропен-2-ил, пропин-2-ил, бензил, 4-хлорбензил, 4-бромбензил или ... 2446659 Способ и устройство для органического возделывания зерновых культур ... ... 2502259 Способ получения водорастворимого бактерицидного препарата ... нитрата серебра (состав 10), а также с наночастицами серебра (состав 9), стабилизированными желатином.Состав 4, содержащий меньше лизоцима, чем составы 1-2-3, обладает меньшей антимикробной активностью. Увеличение содержания лизоцима (состав 5) приводит к нестабильности получаемого препарата в растворе NaCl. Снижение количества нитрата серебра (состав 6) приводит к снижению антимикробной активности препарата, увеличение же его содержания (состав 7) ведет к возникновению нестабильности в растворе NaCl. Уменьшение количества желатина ниже 0.071 мас.% (состав 8) приводит к снижению стабильности препарата в среде NaCl. Кроме того, были проведены дополнительные ... 2462016 Устройство для протравливания семян ... - с водосистемой опрыскивателя посредством трубопроводов, подключенных к распределительному вентилю. Шнековый транспортер включает кожух и шнек. Бункерно-загрузочное устройство состоит из кожуха с установленным дозирующим устройством, которое выполнено в виде рифленых или гладких валиков. В емкости бункера установлен распылитель жидкости, соединенный с арматурой опрыскивателя, и через систему распределения снабжается водой из емкостей.Агрегат работает следующим образом. В бункер насыпают семена. Дозирующее устройство, приводящееся от привода шнека, равномерно, в установленном режиме подает их на кожух шнекового транспортера, при этом семена в бункере смачиваются водой или ... 2295848 Способ дезинсекции и дезинфекции материалов зернового происхождения и устройство для его осуществления ... РФ №2112345), согласно которому зерновой поток пропускают через плазму, занимающую весь рабочий объем. При этом достижение приемлемой производительности процесса ограничено малой глубиной проникновения СВЧ поля в плазму атмосферного давления, вследствие чего в приосевой зоне зерно оказывается необработанным. Известно также устройство, позволяющее получить плазменное образование большого диаметра (патент РФ №1602376), содержащее разрядную камеру, в которую через боковые стенки вводится СВЧ энергия и в которой с помощью вихревого газового потока создается рециркуляционная зона, диаметр которой определяется расположением отверстий для выхода газа, выполненных в днище камеры, а ... |
Еще из этого раздела: 2494588 Лемех плуга 2388213 Способ измерения урожайности травяного покрова 2402211 Способ получения трансгенных кроликов, продуцирующих белки в молочную железу 2056737 Способ диагностики морозоустойчивости плодовых культур 2235450 Малогабаритная машина для обескрыливания, очистки и сортирования лесных семян 2234219 Композиция для отпугивания паразитов 2485755 Способ выращивания посадочного материала 2188534 Способ уборки льна-долгунца 2492623 Портативный электроинструмент с управлением спусковым механизмом 2472951 Машина (варианты) |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||