Способ получения трансгенных кроликов, продуцирующих белки в молочную железуПатент на изобретение №: 2402211 Автор: Прокофьев Михаил Иванович (RU), Городецкий Станислав Иванович (RU), Сураева Наталья Михайловна (RU), Мартиросян Валентина Владимировна (RU), Барышников Анатолий Юрьевич (RU), Самойлов Артем Владимирович (RU) Патентообладатель: Общество с ограниченной ответственностью "Биолайн Фармторг" (RU) Дата публикации: 10 Января, 2009 Начало действия патента: 29 Июня, 2007 Адрес для переписки: 117420, Москва, ул. Наметкина, 14б, оф.608, ООО "Биолайн Фармторг" Изобретение относится к области биотехнологии и животноводства. Способ предусматривает смешивание экзогенной ДНК, ячеловеческих моноклональных антител и сперматозоидов кролика с последующим искусственным осеменением самок кроликов. Получаемые в потомстве самки способны стабильно продуцировать в молоко целевой рекомбинантный антиген. Изобретение может быть использовано в животноводстве, ветеринарии и медицине. 3 табл. Описание изобретения Данное изобретение относится к биотехнологии. Микроиньекция является наиболее предпочтительным методом для введения чужеродного гена мышам, разработанным Гордоном и его коллегами в 1980 году (Gordon J.W. et al., Proc. Nat. Acad. Science USA, 1980, 77, 7380-7384). Попытки использовать эту технику для получения трансгенных сельскохозяйственных животных, таких как свиньи, кролики, козы, овцы и крупный рогатый скот, были осуществлены с очень ограниченным успехом. У мышей 3% трансфецированных микроинъкцированных зигот развиваются до рождения трансгенного потомства и только 0,2-0,02% от числа пересаженных зигот у крупного рогатого скота рождаются трансгенными животными (Krimpendorf P. et. al. Generation of transgenic dairy cattle using in vitro embryo production, 1991, 9, 844-847. Wall R.J. Seidel G.E. Transgenic farm animals: A critical analysis. Theriogenology, 1992, 38, 337-357). Имеется много причин в снижении эффективности метода получения трансгенных сельскохозяйственных животных по сравнению с мышами: низкий уровень интеграции трансгена, низкая выживаемость эмбрионов и требование высокой квалификации специалиста. Другие доступные методы переноса гена для создания трансгенных сельскохозяйственных животных включают пересадку ядра и опосредованный ретровирусом перенос гена. К сожалению, все эти методы имеют ограничения в применении. Современные методы для пересадки ядра имеют низкую эффективность (обычно между 0 и 3%) судя по опубликованным данным Вильмута (Wilmut J., Nat. Med., 2002, 8, 215-216), требуют высокой технической квалификации, а также больших трудовых затрат. Проблемами связывания гена ретровирусными векторами являются ограниченный размер трансгена (не более 8 kb) и инактивация, низкие титры экспрессии гена и потенциальная опасность перестройки ретровирусов в онкогенные (Wall R.J., Seidal G.E., Theriogenology, 1992, 38, 337-357, Chan A.W., Cloning, 1999, 1, 25-46). Возможность переноса гена со спермой была впервые высказана Брекеттом с коллегами (Bracken B.G. et al., Proc. Nat. Acad. Sce. USA, 1971, 68, 353-357). В 1998 году Лавитрано с коллегами сообщили об использовании сперматозоидов для переноса экзогенной ДНК в геном мышей при оплодотворении in vitro (Lavitrano M. et al., Cell, 1989, 57, 717-723). Это сообщение вызвало большой интерес у научной общественности и ожидалась революция в технологии переноса гена. Однако в те годы многочисленные усилия ученых из других лабораторий повторить эти эксперименты не увенчались успехом (Brinster R.L. et al., Cell, 1989, 59, 239-241; Squires E.J., Jn: Transgenic Animals in Agriculture (Edited by Murray J. et. al. CABI Publishing, 1999, 87-95). В последнее десятилетие появились многочисленные сообщения, показывающие успешный перенос со спермой чужеродного ДНК у животных с использованием липосом или электропорации. Данная информация представлена в ряде обзоров (Smith K.R., Anim. Biotechnology, 1998, 7, 147-155; Gandolfi F., Theriogenology, 2000, 53, 127-137). Однако пока недостаточно данных, убедительных и воспроизводимых по интеграции чужеродной ДНК, экспрессии генов и передачи их в последующих поколениях указанными методами. Перенос гена, посредством связывания со специфическими рецепторами, на поверхности сперматозоида был продемонстрирован Wu G.X, Wu C.H. (Wu G.X, Wu C.H., J. Biol. Chem., 1987, 262, 4429-4432). Рецепторы связываются с молекулами белков, а положительный заряд белка обеспечивает связывание с ДНК с отрицательным зарядом. Эта стратегия была успешно применена для многих рецепторов клеток in vitro и in vivo, используя антибиотики, галактозу и карбогидраты (Wels W., Adv. Drug. Delev. Rev., 2000, 70, 593-605). Установлено, что чужеродная ДНК связывается с протеином на поверхности сперматозоида. После связывания в течение нескольких минут происходит интернализация ДНК. Комплекс ДНК с протеинами покидает поверхность головки сперматозоида и попадает в ядро, где ДНК отделяется от протеинов и встраивается в хромосому (Zani M. et. al., Exp. Cell Res., 1995, 217, 57-64; Gandolfi F. Transgenis Res., 1998, 7, 147-155). ДНК, соединенная с антителами или фрагментами антител, открывает возможность использования антител, для облегчения интернализации комплексов ген-антитело-сператозоид через опосредованные антитела. Если антитела, реагирующие на сперматозоид, легко будут идентифицированы, то это может служить полезным связующим звеном между ДНК и сперматозоидами. С учетом такой возможности К.Чанг с коллегами (К.Chang et al., BMC Biotechnology, 2002, 2, 5-18) создали специфические моноклональные антитела путем получения гибридомы после многократной иммунизации 6-недельных мышей сперматозоидами из эпидидимуса 12-недельных мышей. Антитела не снижали эффективности оплодотворения ооцитов in vitro и были способны связываться с поверхностью сперматозоидов мышей. Чтобы продемонстрировать способность моноклональных антител связываться со сперматозоидами разных видов животных проводился цитометрический анализ, который подтвердил возможность такого взаимодействия. Известно (Thurstton L.M., et al., J. Reprod. Fertil., 1999, 117, 271-280), что сперма содержит гетерогенную популяцию, что позволяет различным типам белков экспрессировать на поверхности сперматозоида. К. Chang et al. (2002) отметили, что их моноклональные антитела, по-видимому, связываются только с одной из популяций сперматозоидов у коз и овец. К.Chang et al. (2002) показали, что в присутствии моноклональных антител сперматозоиды всех исследованных видов животных связывались больше на 25-56% с меченной ДНК по сравнению с контролем без антител (р<0,001) или с антителами, не обладающими способностью к связыванию (р<0,0001). Это увеличение в специфическом связывании может быть решающим для успешного получения трансгенных животных этим методом. Авторами были получены трансгенные свиньи путем хирургического осеменения через яйцевод, в результате введения трансфецированной спермы в присутствии моноклональных антител. Было осеменено таким образом 30 свинок и 28% из них стали беременными. Получено 32 потомка от 8 свинок. В сперматозоидах 2-х из 11-ти 8-месячных хрячков (18%) была обнаружена интеграция гена. При получении F1 поколении интеграция гена наблюдалась у 37,5% свиней. Чтобы показать, что метод переноса гена со спермой может также использоваться на мышах, было проведено оплодотворение in vitro. Сперматозоиды эпидидимуса были смешаны с мышиными моноклональными антителами. Затем линеазированная ДНК была добавлена и проведено оплодотворение ооцитов in vitro. Методом ПЦР анализа у 33% 10-дневных эмбрионов была обнаружена интеграция гена. Было получено 47 мышей в F0, но сигнал гибридизации методом блотанализа не был обнаружен в образцах ткани, взятых из хвоста. Однако 33% трансгенных мышей получены в F1 поколении. На основе этих экспериментов авторы считают, что метод переноса гена со спермой в присутствии мышиных моноклональных антител может быть применен на различных линиях мышей. После первого сообщения К.Chang et al. (2002) не представили публикаций, подтверждающих первые результаты. Из материалов авторов остается неизвестным можно ли применять этот метод при обычном искусственном осеменении, сопровождается ли интеграция гена его экспрессией вообще и на молочную железу, в частности, можно ли достичь интеграции гена у других видов животных этим методом и использовать его при общепринятом методе искусственного осеменения. За последние 5 лет не появилось ни одной публикации других авторов, подтверждающих эффективность этого метода. По имеющимся у нас сведениям пока ни кому в мире не удалось воспроизвести этот метод. Мы обратились к авторам с просьбой передать или продать нам эти моноклональные антитела, но они отказались. Поэтому авторы заявки на патент провели работу по выявлению других моноклональных антител, способных связываться с рецепторами сперматозоида в банке моноклональных антител человека. Нами были отобраны моноклональные антитела человека против рецептора трансферрина (Барышников А.Ю., Тоневицкий А.Г. Моноклональные антитела в лаборатории и клинике. М., 1997)), которые обладают следующими особенностями по сравнению с прототипом (К.Chang et al., 2002). Во-первых, эти антитела, как было известно, связываются со сперматозоидами человека. Во-вторых, нами экспериментально показано их способность связываться с ДНК (плазмидой гена человеческого гранулоцитарного колониестимулирующего фактора ч-ГКСФ) и ДНК (плазмидой гена человеческого гранулоцитарного макрофагового колониестимулирующего фактора ч-ГМКСФ). В-третьих, методом проточной цитометрии были выявлены человеческие моноклональные антитела (мат), специфически связывающиеся со сперматозоидами. Наиболее высокий процент связывания со сперматозоидами показали мат CD71 и CD25, матCD95, CD59, CD11b и CD4, также специфически связывались, но лишь с небольшой популяцией сперматозоидов (табл.1). Таблица 1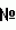 Вид мат Специфичность в % 1 CD41.4 2 CD11b1.7 3 CD2575.8 4 CD7193.0 5 CD955.7 6 CD592.3 7 контроль0.1 Вид мат Специфичность в % 1 CD41.4 2 CD11b1.7 3 CD2575.8 4 CD7193.0 5 CD955.7 6 CD592.3 7 контроль0.1 В-четвертых, при инкубации этих антител с ДНК и с спермой кроликов обычным методом искусственного осеменения нами достигнут высокий уровень интеграции гена, примерно одинаковый с тем, который был получен К.Chang et. al. (2002) при использовании мышиных антител. Это также свидетельствует об участии человеческих моноклональных антител в создании комплекса ген-антитело-сперматозоид. Нами было проведено 10 экспериментов с ДНК (плазмидой гена человеческого гранулоцитарного колониестимулирующего фактора, ч-ГКСФ). Осеменено 18 самок, из них окропились 7 (39%). У двух самок крольчата пали. Всего получено 30 живых потомков. У 13 крольчат обнаружена интеграция гена фрагмент Самки половозрелого возраста окролилась. В молоке 4-х самок был обнаружен целевой белок - гранулоцитарный колониестимулирующий фактор человека (табл.2). Таблица 2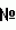 опыта Число потомков Число трансгенных потомков (%) Трансгенные потомки опыта Число потомков Число трансгенных потомков (%) Трансгенные потомки 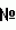 , полч-ГКСФ, мг/литр молока 15 4 (80%) 31 самка 2,0-4,0 33 самец , полч-ГКСФ, мг/литр молока 15 4 (80%) 31 самка 2,0-4,0 33 самец 34 самка2,5-3,0 35 самец 34 самка2,5-3,0 35 самец  24 2 (50%) 13 самец 24 2 (50%) 13 самец  14 самка0,3-1,5 38 3 (37,5%) 36 самка 14 самка0,3-1,5 38 3 (37,5%) 36 самка  12 самец 12 самец 39 самец 39 самец 46 3 (50%) 25 самка 46 3 (50%) 25 самка  26 самец 26 самец 28 самка0,3 28 самка0,3 Также было проведено 4 эксперимента с ДНК (плазмидой гена человеческого гранулоцитарного макрофагового колониестимулирующего фактора, ч-ГМКСФ). Осеменено 9 самок, из них окропились 3 (33%). У одной самки крольчата пали. Всего получено 10 живых потомков. У 4 крольчат обнаружена интеграция гена фрагмент Самки половозрелого возраста окролилась. В молоке 2-х самок был обнаружен целевой белок - гранулоцитарный макрофаговый колониестимулирующий фактор человека (табл.3). Таблица 3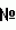 опыта Число потомков Число трансгенных потомков (%) Трансгенные потомки опыта Число потомков Число трансгенных потомков (%) Трансгенные потомки  , полч-ГМКСФ, мг/литр молока 16 2 (33%) 45 самка 0,1-0,4 47 самец , полч-ГМКСФ, мг/литр молока 16 2 (33%) 45 самка 0,1-0,4 47 самец 24 2 (50%) 50 самец 24 2 (50%) 50 самец  51 самка0,2-0,6 51 самка0,2-0,6 Таким образом, отличительными особенностями изобретения являются: 1. Выявление человеческих моноклональных антител в отличие от мышиных в прототипе (К.Chang et al., 2002) для повышения эффективности переноса гена со сперматозоидами. 2. Получение трансгенных кроликов с использованием человеческих антител с высоким уровнем интеграции гена (43,3% против 18% в прототипе К.Chang et. al., 2002, с использованием мышиных моноклональных антител). 3. Разработан метод получения трансгенных кроликов с использованием человеческих моноклональных антител при обычном способе искусственного осеменения в отличие от хирургического осеменения или оплодотворения in vitro в прототипе. 4. Установлена передача гена трансгенными кроликами, полученными с использованием человеческих моноклональных антител в следующем поколении. 5. Продемонстрирована экспрессия гена в молоке трансгенных кроликов, полученных с использованием человеческих моноклональных антител. Получение трансгенных кроликов иллюстрируются следующими примерами: Пример 1. Изучение способности человеческих моноклональных антител связываться с ДНК. Для изучения способности моноклональных антител связываться с ДНК добавляли возрастающее количество человеческих моноклональных антител (0,3-10 мкг) к ДНК (0,3 мкг) и культивировали при комнатной температуре 40 минут. Затем проводили электорофорез в 1% агаровом геле. В качестве контроля использовали ДНК в модифицированной среде Тироиде без БСА и ДНК. На этом основании устанавливали минимальное количество антител, которые нейтрализовали отрицательный заряд ДНК. В результате, начиная с 0,3 мкг антител, полоса ДНК в агарозном геле переставала двигаться в электрическом поле за счет нейтрализации заряда на ДНК вследствие образования комплексов антител с ДНК. Пример 2. Подготовка спермы, трансфецированной ДНК в присутствии человеческих моноклональных антител, и осеменение кроликов. Эякулят кролика разбавляли в разбавители PL Состав разбавителя: лактоза - 1,085 г, трис - 1,370 г, лимонная кислота - 0,725 г и вода до 50 мл. В разбавитель добавляли 0,4 мг/мл БСА (Р1) или 1,5 мг/мл БСА (Р2). Разбавленный эякулят в соотношении 1:1 центрифугировали 3 мин при 3000 об/мин. Сливали надосадочную жидкость, осадок ресуспендировали в 500 мкл разбавителя Р2. Оценивали количество сперматозоидов подсчетом в камере Горяева. Доводили количество сперматозоидов в 1 мл разбавителя до необходимой концентрации. Для осеменения одной самки применяли дозу - 25 миллионов сперматозоидов на одну крольчиху. Затем сперму отмывали и добавляли 1 мл разбавителя с 1,5 мг/мл BSA и 10 мкг человеческих моноклональных антител. Инкубировали 40 минут при комнатной температуре, отмывали, вновь разбавляли сперму разбавителем с 1,5 мг/мл BSA, добавляли 3 мкг ДНК и инкубировали 40 минут при комнатной температуре, после чего самок осеменяли. При этом крольчихи были предварительно обработаны 50 ЕД хореоническим гонадотропином (ХГ) и перед осеменением спарены с вазаэктомированным самцом. После осеменения каждая крольчиха находилась в отдельной клетке на весь период беременности. На 14-16 день после осеменения устанавливали наличие плодов у реципиентов методом пальпации. Через 5-7 дней после окрола крольчат метили и одновременно брали образцы ткани уха для анализа ДНК на интеграцию гена методом ПЦР анализа. Пример 3. Получение трансгенных кроликов с использованием человеческих моноклональных антител. Осеменено 18 крольчих спермой с геном ч-ГКСФ. Окролились 7 самок, что составляет 38,8%. Получено 30 живых крольчат, из них 13 трансгенных крольчат, что составляет 43,3%. Это очень высокий показатель по сравнению с традиционным методом введения гена путем микроиньекции в пронуклеус зиготы, где этот показатель около 7-10% у мышей и не более 3%у сельскохозяйственных животных от числа родившихся потомков. В результате спаривания трансгенных самок Осеменено 9 самок спермой с геном ч-ГМКСФ, из них окролились 3 (33%). Всего получено 10 живых потомков. У 4 крольчат обнаружена интеграция гена фрагмент Список литературы 1. Chang Keejong et al. BMC Biotechnology. Effective generation of transgenic pigs and mice by linker based sperm-mediated gene transfer., BMC Biotechnology, 202, 2, 5-18. 2. Gandolfi F. Spermatozoa, DNA binding and transgenic animals. Transgenic Res., 1998, 7, 147-155. 3. Gandolfi F. Sperm-mediated transgenesis. Theriogenology, 2000, 53, 127-137. 4. Gordon J.W. et al. Genetic transformation of mouse embryos by microinjecton of purified DNA. Proc. Natl. Academ. Sci. USA, 1980, 77, 7380-7384. 5. Krimpendorf P. et. al. Generation of transgenic dairy cattle using in vitro embyo production. Biotechnology, 1991, 9, 844-847. 6. Smith K.R. Sperm cell mediated transgenesis: a review. Anim. Biotechnol., 1999, 10, 1-13. 7. Trurston L.M. et al. Sourcell of variation in the morphological characteristics of sperm subpopulations assessed objectively by a novel automated sperm morphology analysis system. J. Reprod. Fertil. 1999. 8. Zani M. et. al. The Mechanism of binding of exogenous DNA to sperm-factors controlling the DNA uptake. Exp. Cell Res., 217, 57-64. 9. Wall R.J. Seidel G.E. Transgenic farm animals: A critical analysis, Theriogenology, 1992, 38, 337-357. Формула изобретенияСпособ получения трансгенных кроликов, молочная железа лактирующих самок которых продуцирует в молоко рекомбинантный белок, предусматривающий опосредованный перенос экзогенной ДНК с помощью моноклональных антител, ассоциированных на сперматозоидах, отличающийся тем, что используют моноклональные антитела человека, связывающиеся с переносимой ДНК и со сперматозоидами кроликов, а перенос ДНК осуществляют с помощью искусственного осеменения самок кроликов. MM4A Досрочное прекращение действия патента из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 30.06.2011 Дата публикации: 27.04.2012 Популярные патенты: 2282965 Разбрасыватель минеральных удобрений ... ось формирователя потока пересекает вершину двугранного клина под прямым углом, при этом сзади плит на кронштейне закреплена панель, на которой выполнено два паза в форме дуг окружности с центром на оси цапф, а в пазах установлены выполненные на плитах пальцы с резьбой, на которую навернуты гайки, опирающиеся на панель, а последняя опирается на заплечики, образованные на пальцах, при этом на панели вдоль пазов нанесены угловые деления, ответные положениям граней двугранного клина, а на пальцы надеты зафиксированные от поворота указательные стрелки, ответные угловым делениям панели.2. Разбрасыватель по п.1, отличающийся тем, что он снабжен сменными насадками для формирователя ... 2130247 Замкнутый пневмосепаратор ... сообщен с отводом пневмосепарирующего канала, при этом его входной и выходной участки сообщены между собой окном, расположенным в смежной стенке пневмосепарирующего и рециркуляционного каналов. Выходной участок канала частичного отвода запыленного воздуха образован наружной поверхностью кожуха выхлопного диффузора и обращенной к нему стенкой пневмосепарирующего канала. В осадочной камере дополнительно установлен инерционный жалюзийно-противоточный воздухоочиститель. Это позволяет снизить удельный расход энергии и металла без ухудшения эффективности сепарации зернового материала. 2 з.п. ф-лы, 1 ил. Изобретение относится к устройствам для очистки зерна и продуктов его переработки, ... 2051575 Способ отделения дождевых червей от среды обитания и устройство для его осуществления ... черви не могут дышать в воде, они вынуждены выползать выше уровня воды или покидать свою среду обитания. При покидании среды обитания они проползают через отверстия 38 в решете 30 и располагаются в нем. После наполнения площади сетки 37 решето 30 снимают, стряхивают червей в емкость и снова устанавливают решето в исходное положение. После наполнения решета червями снова снимают и стряхивают решето в емкость. Затем червей собирают, упаковывают в емкости и отправляют их на переработку на мясную муку или для кормления животных. Физическое воздействие можно осуществлять другим вариантом. Второй вариант такой же, как первый, отличается от него тем, что физическое воздействие осуществляют ... 2159030 Способ широкорядного посева пропашных культур ... Шаг t криволинейно вогнутых поверхностей равен шагу широкорядного посева кукурузы на зерно, например 70 см; глубина рыхления 0 - 35 см, т.е. специальный рабочий орган рыхлителя прорезает плужную подошву. После этого тем же комбинированным агрегатом проводят дополнительную прикатку почвы до посева семян (фиг. 4) с образованием и уплотнением дна и стенок щелевидных лож 5 с шагом t, равным ширине междурядий. Далее этим агрегатом проводят доуглубление щелевидных семенных лож 6 с дальнейшим уплотнением их дна и стенок (фиг. 5). Окончательная глубина ложа 6 составляет 6 - 8 см, что соответствует оптимальной глубине укладки (заделки) семян кукурузы в почву. Все тот же агрегат проводит ... 2287923 Роторный энергосберегающий мостовой агрегат для сельскохозяйственных работ ... также наиболее близкий к заявляемому роторный мостовой агрегат, включающий раму, смонтированную на ней бесконечную направляющую, в которой установлен тяговый транспортер с подвешенными на катках каретками со сменными рабочими органами пахотно-посевного механизма, колеса, смонтированные на раме посредством поворотных продольно и поперечно раме стоек, и силовой двигатель с приводами, установленный на раме - см. патент РФ №2102845, 6 А 01 В 49/00, приор. 16.02.93, опубл. 27.01.98.Недостатком известного агрегата является конструктивное устройство колесной базы с неизменной шириной продольной колеи, что при воздействии на машину в рабочем процессе разворачивающего момента сил ухудшает ... |
Еще из этого раздела: 2450501 Способ повышения плодородия почвы на склонах 2188534 Способ уборки льна-долгунца 2399203 Способ оценки физиологического состояния организма цыплят 2113779 Агромост 2152151 Гербицидная водорастворимая гранулированная композиция 2422377 Биоцидный концентрат 2281645 Устройство для размещения цветов и растений с подсветкой (варианты) 2210910 Способ обработки растений и используемая в нём композиция для защиты растений 2154939 Способ выращивания кроликов и устройство для его осуществления 2106082 Устройство для укладки подстилочного навоза в бурт |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
 -казеина-hGCSF. Выход трансгенных особей от общего числа потомства - 43%.
-казеина-hGCSF. Выход трансгенных особей от общего числа потомства - 43%.