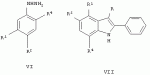
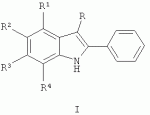
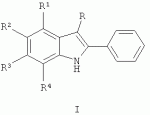
Замещенные 2-фенилиндолы, способ их получения и фунгицидные композиции на их основеПатент на изобретение №: 2440339 Автор: Шевелев Святослав Аркадьевич (RU), Дутов Михаил Дмитриевич (RU), Попков Сергей Владимирович (RU), Еланский Сергей Николаевич (RU), Кокуркина Галина Вячеславовна (RU), Побединская Марина Александровна (RU) Патентообладатель: Учреждение Российской академии наук Институт органической химии им. Н.Д. Зелинского РАН (ИОХ РАН) (RU) Дата публикации: 20 Января, 2012 Начало действия патента: 27 Июля, 2010 Адрес для переписки: 119991, Москва, Ленинский пр-кт, 47, ИОХ РАН, патентный отдел, Г.Н. Капустиной Изобретение относится к новым замещенным 2-фенилиндолам общей формулы I:
где при R, R2 и R4 =Н и R1=OH, R3=CN, CF3, COOEt или SO2NH2; при R=Me и R1 и R3=H, R2=NO2 R4=OH; при R=Me и R1 и R3=H, R2=OH и R4=NO2; при R=Me и R 2 и R3=H, R1=NO2 и R 4=ОН; при R=Me и R2 и R3=Н, R 1=ОН и R4=NO2, которые проявляют фунгицидную активность, что позволяет использовать их при получении фунгицидной композиции. Описан способ получения соединений при R=Me, R1 и R3=H, R2=NO2 R4=OH, при R=Me, R1 и R3 =H, R2=OH, R4=NO2, при R=Me, R2 и R3=H, R1=NO2 , R4=ОН, при R=Me, R2 и R3=H, R1-OH, R4=NO2. 3 н. и 1 з.п. ф-лы, 2 табл. Изобретение относится к химии гетероциклических соединений, а именно к неизвестным ранее замещенным 2-фенилиндолам общей формулы I:
где R - атом водорода или метил, R1 , R2 и R4 - атом водорода, гидроксил или нитрогруппа, R3 - атом водорода, СF3, SO 2NH2, CN, COOEt, обладающим фунгицидной активностью, а также к способу их получения, применению этих соединений в качестве фунгицидных средств и фунгицидным композициям на их основе. Соединения общей формулы I могут найти применение в качестве сельскохозяйственных, промышленных, медицинских или ветеринарных фунгицидов в композициях с другими активными и вспомогательными соединениями для борьбы с грибными болезнями растительных организмов, животных или человека. В литературе описаны соединения, содержащие индольный цикл и обладающие фунгицидной активностью. Наиболее близким к заявляемым замещенным 2-фенилиндолам по структуре и свойствам являются замещенные 4-гидрокси-6-нитро-2-арилиндолы общей формулы Iа:
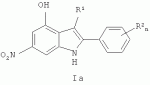
где R1 означает атом водорода или алкил, R2 означает атом водорода и/или алкоксил, и/или галоген, n равно 0-5, и их соли (патент RU Известный способ не пригоден для получения целого ряда предлагаемых соединений общей формулы I. Задачей настоящего изобретения является расширение ассортимента соединений, обладающих фунгицидной активностью, их сырьевой базы, а также разработка способа их получения. Поставленная задача достигается новыми замещенными 2-фенилиндолами общей формулы I, где при R, R2 и R4=Н и R1 =ОН, R3=CN, СF3, COOEt или SO2 NH2, при R=Me и R1 и R3=Н, R 2=NO2 и R4=ОН, при R=Me и R1 и R3=H, R2=ОН и R4=NO 2, при R=Me и R2 и R3=Н, R1 =NO2 и R4=ОН, при R=Me и R2 и R3=Н, R1=ОН и R4=NО2 , обладающими фунгицидной активностью, способами их получения и фунгицидными композициями на их основе. Способ получения соединений общей формулы I, где R, R2 и R4=Н и R1=ОН, R3=CN, СF 3, COOEt или SO2NH2, заключается в том, что замещенные 3,5-динитросоединения общей формулы II, где R3 имеет вышеуказанные значения, подвергают взаимодействию с соответствующими оксимами карбонильных соединений (Nu- ) при нагревании с последующей обработкой образующихся нитрооксимов общей формулы III, где R и R3 имеют вышеуказанные значения, гидразингидратом и полученные при этом аминооксимы общей формулы IV, где R и R3 имеют вышеуказанные значения, подвергают циклизации под действием смеси алифатичского спирта и кислоты при кипячении по следующей схеме: Взаимодействие оксимов карбонильных соединений с коммерчески доступными 3,5-динитросоединениями общей формулы II является новым и в литературе не описано. Соединения общей формулы I, где при R=Me и R1 и R 3=Н, R2=NO2 и R4=ОН, при R=Me и R1 и R3=Н, R2=ОН и R 4=NO2, при R=Me и R2 и R3 =Н, R1=NO2 и R4=OH, при R=Me и R2 и R3=H, R1=ОН и R4 =NO2, не могут быть получены вышеописанным способом. Для их получения предложен новый способ, который заключается в том, что замещенные фенилгидразины общей формулы VI, где R1 и R2=Н, МеО или NO2 , R4=NO2 или МеО, подвергают взаимодействию с пропиофеноном в смеси кипящих муравьиной и трифторуксусной кислот с последующей обработкой полученных при этом 2-фенилзамещенных индолов общей формулы VII, где R=Me, R1 и R2 =Н, МеО или NO2, R4=NO2 или МеО, тетрабутиламмонийбромидом при нагревании по следующей схеме: Исходными веществами для этого способа являются коммерчески доступные замещенные анилины V. Общеизвестно, что перегруппировка Фишера для гидразонов, содержащих нитрогруппу в фенилгидразиновом кольце, идет с большим трудом, сильно зависит от строения исходного карбонильного соединения и часто не приводит к желаемым результатам. В частности для фенонов и метоксинитрогидразинов этот процесс не исследован. Нам удалось осуществить превращение метоксинитрогидразинов VI в 2-фенилзамещенные индолы VII без предварительного получения промежуточных гидразонов в одну стадию. Это достигается путем кипячения исходного гидразина и карбонильного соединения (пропиофенона) в смеси кипящих муравьиной и трифторуксусной кислот. Известные способы преобразования метоксигруппы в гидроксигруппу в случае индолов VII не дают положительных результатов. Нами найдено, что это возможно при проведении реакции при нагревании в расплаве тетрабутиламмонийбромида. Найденные способы превращения VI в VII и VII в I новые и являются одним из предметов данного изобретения. Техническим результатом изобретения являются новые вещества - замещенные 2-фенилиндолы общей формулы I, проявляющие высокую фунгицидную активность. По результатам фунгицидных испытаний in vitro наиболее активным является 7-гидрокси-3-метил-4-нитро-2-фенилиндол (8б), превосходящий эталонный триадимефон (3,3-диметил-1-(1,2,4-триазол-1-ил)-1-(4-хлорфенокси)-2-бутанон) по отношению практически ко всем из испытанных видов грибов-патогенов. Это вещество было дополнительно исследовано на более широком круге грибков, в том числе на грибах - вредителях картофеля. Успешное применение пестицидов для борьбы с различными вредными организмами в большой степени зависит от препаративной формы препарата и условий, при которых действующее вещество контактирует с вредителями и возбудителями заболеваний растений. В зависимости от физико-химических свойств препарата, его назначения и способа применения выбирается наиболее эффективная и экономичная препаративная форма (композиция), это могут быть, например, дусты, гранулы, микрокапсулированные препараты, смачивающиеся порошки, концентраты эмульсий, мази, вододиспергируемые гранулы, суспензионные концентраты. Препаративные формы помимо действующего вещества, могут включать в свой состав наполнители, растворители, поверхностно-активные вещества, смягчители воды, синергетические добавки и др. Например, известный препарат триадимефон применяют в виде 10%-ного концентрата эмульсии для защиты зерновых, овощных и плодовых культур от грибных болезней растений [Пестициды и регуляторы роста растений: Справ. изд. / Н.Н.Мельников, К.В.Новожилов, С.Р.Белан. - М.: Химия, 1995, с.24, с.287]. В связи с этим техническим результатом изобретения также является разработка фунгицидных композиций, состоящих из замещенных 2-фенилиндолов общей формулы I в концентрации 0,1-99% и вспомогательных веществ - остальное. Эти композиции успешно могут быть применены для борьбы с вредоносными грибковыми болезнями сельскохозяйственных культур, животных или человека. Изобретение может быть проиллюстрировано следующими примерами. Пример 1. 4-Гидрокси-6-циано-2-фенилиндол (1в). а) O-(3-Нитро-5-цианофенил)-1-фенилэтаноноксим (1а). К смеси 13,5 г (0,1 моль) оксима ацетофенона и 13,8 г (0,1 моль) К2СО3 в 120 мл 1-метил-2-пирролидона добавляют 19,3 г (0,1 моль) 3,5-динитробензонитрила. Реакционную массу нагревают до 50°С и перемешивают при этой температуре до полной конверсии динитросоединения (3-8 ч). Реакционную массу выливают в 600 мл воды. Выпавший осадок отфильтровывают, промывают водой и сушат. Осадок перекристаллизовывают из ЕtOН и получают 20,22 г (72%) O-(3-нитро-5-цианофенил)-1-фенилэтаноноксима (1а), т.пл. 138-139°С. Спектр 1Н ЯМР, Найдено, %: С 64.42, Н 3.56; N 14.52. Вычислено для С15 Н11N3О3, %: С 64.05; Н 3.94; N 14.94. б) O-(3-Амино-5-цианофенил)-1-фенилэтаноноксим (1б). Смесь 28,1 г (0,1 моль) O-(3-нитро-5-цианофенил)ацетофеноноксима, 0,216 г (0,0008 моль) гексагидрата хлорида железа (III), 12 г активированного угля, 40 мл (0,8 моль) гидразингидрата и 700 мл метанола кипятят с обратным холодильником 3 часа. Реакционную массу фильтруют горячей, фильтрат охлаждают. Выпавший осадок отфильтровывают и получают 18,83 г (75%) O-(3-амино-5-цианофенил)-1-фенилэтаноноксима (1б), т.пл. 106-107°С. Спектр 1 Н ЯМР, Найдено, %: С 71.42, Н 5.57; N 16.43. Вычислено для С15Н13N3О, %: С 71.70, Н 5.21, N16.72. в) 4-Гидрокси-6-циано-2-фенилиндол (1в). 2,51 г (0.01 моль) O-(3-амино-5-цианофенил)-1-фенилэтаноноксима (1б) помещают в смесь 10 мл этилового спирта и 10 мл концентрированной соляной кислоты. Реакционную массу кипятят 2 ч с обратным холодильником. Охлаждают до комнатной температуры, выпавший осадок отфильтровывают. С помощью колоночной хроматографии выделяют 4-гидрокси-6-циано-2-фенилиндол (1в). Выход 1,497 г, 64%, т.пл. 222-223°С. Спектр 1Н ЯМР, Найдено, %: С 76.73, Н 4.16; N 12.16. Вычислено для С15Н10N 2О, %: С 76.91, Н 4.30, N 11.96. Пример 2. 4-Гидрокси-6-трифторметил-2-фенилиндол (2в). а) O-(3-Нитро-5-трифторметилфенил)-1-фенилэтаноноксим (2а). Из 1,3-динитро-5-(трифторметил)бензола аналогично примеру 1а) получают 25,92 г (80%) O-(3-нитро-5-трифторметилфенил)-1-фенилэтаноноксима (2а), т.пл.107-108°С. Спектр 1 Н ЯМР, Найдено, %: С 55.26, Н 3.23; N 8.41. Вычислено для С15 Н11F3N2O3, %: С 55.56; Н 3.42; N 8.64. б) O-(3-Амино-5-трифторметилфенил)-1-фенилэтаноноксим (2б). Аналогично примеру 1б с той разницей, что кипятят с обратным холодильником 2 часа. Выход 26,46 г (90%) O-(3-амино-5-трифторметилфенил)-1-фенилэтаноноксима (2б), т.пл. 52-53°С. Спектр 1Н ЯМР, Найдено, %: С 61.63, Н 4.27; N 9.68. Вычислено для C15H13F3N2O, %: С 61.22, Н 4.45, N9.52. в) 4-Гидрокси-6-трифторметил-2-фенилиндол (2в). Аналогично примеру 1в. Выход 2в 2.16 г (78%), т.пл. 153-154°С. Спектр 1Н ЯМР, Найдено, %: С 64.63, Н 3.84; N 5.16. Вычислено для C15H 10F3NO, %: С 64.98, Н 3.64, N 5.05. Пример 3. Этил-4-гидрокси-2-фенилиндол-6-карбоксилат (3в). а) 3-Нитро-5-({[1-фенилэтилиден]амино}окси)бензамид (3а). Из 3,5-динитробензамида аналогично примеру 1а с той разницей, что реакционную массу выдерживают при 60°С получают 20,61 г (69%) 3-нитро-5-({[1-фенилэтилиден]амино}окси)бензамида (3а), т.пл.176-177°С. Спектр 1 Н ЯМР, Найдено, %: С 60.56, Н 4.13; N 14.38. Вычислено для C15 H13N3O4, %: С 60.20; Н 4.38; N 14.04. б) 3-Амино-5-({[1-фенилэтилиден]амино}окси)бензамид (3б). Аналогично примеру 1б. Выход 3б 18.56 г (69%), т.пл. 148-149°С. Спектр 1Н ЯМР, Найдено, %: С 66.53; Н 5.80; N 15.44. Вычислено для C15H15N3 O2, %: С 66.90; Н 5.61; N15.60. в) Этил-4-гидрокси-2-фенилиндол-6-карбоксилат (3в). Аналогично примеру 1 в. Выход 3в 2,41 г (86%), т.пл. 189-190°С. Спектр 1Н ЯМР, Найдено %: С 72.71; Н 5.49; N 4.87. Вычислено для С17Н15NО3, %: С 72.58; Н 5.37; N 4.98. Пример 4. 4-Гидрокси-2-фенилиндол-6-сульфонамид (4в). а) 3-Нитро-5-({[1-фенилэтилиден]амино}окси)сульфонамид (4а). Из 3,5-динитробензсульфонамида аналогично примеру 1а получают 24,72 г (74%) 3-нитро-5-({[1-фенилэтилиден]амино}окси)сульфонамида (4а), т.пл.185-186°С. Спектр 1 Н ЯМР, Найдено, %: С 50.56, Н 4.13; N 12.68. Вычислено для C14 H13N3O5S, %: С 50.14; Н 3.91; N 12.53; б) 3-Амино-5-({[1-фенилэтилиден]амино}окси)сульфонамид (4б). Аналогично примеру 1 б с той разницей, что кипятят с обратным холодильником в течение 3 часов. Выход 25,93 г (85%) 3-амино-5-({[1-фенилэтилиден]амино}окси)сульфонамида (4б), т.пл. 143-144°С. Спектр 1 Н ЯМР, Найдено, %: С 55.29; Н 4.79; N 13.92;. Вычислено для C14H15N3 O3S, %: С 55.07; Н 4.95; N 13.76. в) 4-Гидрокси-2-фенилиндол-6-сульфонамид (4в). Аналогично примеру 1 в. Выход 4в 2,33 г (81%), т.пл. 123-124°С. Спектр 1Н ЯМР, Найдено, %: С 58.18; Н 4.39; N 9.57. Вычислено для C14H12 N2О3S, %: С 58.32; Н 4.20; N 9.72. Пример 5. 7-Гидрокси-3-метил-5-нитро-2-фенилиндол (5б). а) 3-Метил-7-метокси-5-нитро-2-фенилиндол (5а). К раствору 1,83 г (0,01 моль) (2-метокси-4-нитрофенил)гидразина в муравьиной кислоте (15 мл) добавляют 1,34 г (0,01 моль) пропиофенона и 0,5 г (0,004 моль) трифторуксусной кислоты и кипятят в течение 2 часов. Реакционную массу охлаждают, выпавший осадок отфильтровывают, сушат и чистят методом колоночной хроматографии. Получают 2,06 г (73%) 3-метил-7-метокси-5-нитро-2-фенилиндола, т.пл. 175-176°C. Спектр 1Н ЯМР, Найдено, %: С 68.41; Н 5.14; N 9.67. Вычислено для C16H14N2O3, %: С 68.07; Н 5.00; N 9.92. б) 7-Гидрокси-3-метил-5-нитро-2-фенилиндол (5б). Смесь 2,82 г (0,01 моль) 3-метил-7-метокси-5-нитро-2-фенилиндола и 10 г тетрабутиламмонийбромида нагревают до температуры 150°C и перемешивают в течение 90 минут. Реакционную массу выливают в 5% HCl и экстрагируют хлороформом. Экстракт сушат над Na 2SО4, отгоняют растворитель. Сухой остаток чистят методом колоночной хроматографии. Получают 1,71 г (64%) 7-гидрокси-3-метил-5-нитро-2-фенилиндола, т.пл. 196-197°C. Спектр 1Н ЯМР (ДМСО-d6, Найдено, %: С 67.31; Н 4.26; N 10.32. Вычислено для C15H12N20 3, %: С 67.16; Н 4.51; N 10.44. Пример 6.5-Гидрокси-3-метил-7-нитро-2-фенилиндол (6б). а) 3-Метил-5-метокси-7-нитро-2-фенилиндол (6а). Из (4-метокси-2-нитрофенил)гидразина аналогично примеру 5 получают 2.22 г (83%) 3-метил-5-метокси-7-нитро-2-фенилиндола (6а), т.пл. 127-128°C. Спектр 1 Н ЯМР (ДМСО-(d6, Найдено, %: С 68.38; Н 4.89; N 9.69. Вычислено для C16 H14N2O3, %: С 68.07; Н 5.00; N 9.92. б) 5-Гидрокси-3-метил-7-нитро-2-фенилиндол (6б). Аналогично примеру 5 б. Выход 2.30 г (81%), т.пл. 172-173°C. Спектр 1Н ЯМР (ДМСО-(d6 , Найдено, %: С 67.42; Н 4.12; N 10.53. Вычислено для C15 H12N2O3, %: С 67.16; Н 4.51; N 10.44. Пример 7. 7-Гидрокси-3-метил-4-нитро-2-фенилиндол (7б). а) 3-Мтил-7-метокси-4-нитро-2-фенилиндол (7а). Из (2-Метокси-5-нитрофенил)гидразина аналогично примеру 5а получают 2.06 г (73%) 3-метил-7-метокси-4-нитро-2-фенилиндола (7а), т.пл. 130-131°С. Спектр 1 Н ЯМР (ДМСО-d6, Найдено %: С 68.18; Н 5.21; N 9.61. Вычислено для С16Н14N 2О3, %: С 68.07; Н 5.00; N 9.92. б) 7-Гидрокси-3-метил-4-нитро-2-фенилиндол (7б). Аналогично примеру 5б. Выход 1,9 г (61%), т.пл. 219-220°С. Спектр 1Н ЯМР (ДМСО-d6, Найдено, %: С 67.21; Н 4.30; N 10.57. Вычислено для С15 Н12N2О3, %: С 67.16; Н 4.51; N 10.44. Пример 8. 4-Гидрокси-3-метил-7-нитро-2-фенилиндол (8б). а) 3-Метил-4-метокси-7-нитро-2-фенилиндол (8а). Из (5-метокси-2-нитрофенил)гидразина аналогично примеру 5 а) получают 2.20 г (78%) 3-метил-4-метокси-7-нитро-2-фенилиндол (8а), т.пл. 139-140°С. Спектр 1 Н ЯМР (ДМСО-d6, Найдено, %: С 68.23; Н 5.11; N 9.81. Вычислено для С16Н 14N2О3, %: С 68.07; Н 5.00; N 9.92. б) 4-Гидрокси-3-метил-7-нитро-2-фенилиндол (8б). Аналогично примеру 5 б. Выход 2,30 г (86%), т.пл. 201-202°С. Спектр 1Н ЯМР (ДМСО-d 6, Найдено, %: С 67.03; Н 4.68; N 10.37. Вычислено для С15 Н12N2О3, %: С 67.16; H4.51; N 10.44. Пример 9. Получение фунгицидной композиции (концентрата эмульсии). К раствору действующего вещества - 90 г 7-гидрокси-3-метил-4-нитро-2-фенилиндола (7б) в 290 г циклогексанона добавляют при перемешивании 15 г кальциевой соли алкилбензолсульфокислоты (АБСК), 75 г оксиэтилированного октилфенола (ОП-7), 110 г смеси ксилололов и 420 г нефтяного сольвента, получают 1000 г композиции концентрата эмульсии следующего состава (мас.%): 7-гидрокси-3-метил-4-нитро-2-фенилиндола - 9% циклогексанона - 29% кальциевой соли алкилбензолсульфокислоты (АБСК) - 1,5% оксиэтилированного октилфенола (ОП-7) - 7,5% смеси ксилололов - 11% нефтяного сольвента - 42% Пример 10. Испытания на фунгицидную активность соединений проводили в экспериментах in vitro [Методические рекомендации по определению фунгицидной активности новых соединений. Черкассы: ВНИИХСЗР, ОНИИТЭХИМ, 1983, 2 с.]. Действие препаратов на радиальный рост мицелия определяли растворением композиции соединения в ацетоне и внесением аликвоты в картофеле - сахарозный агар при 50°C до концентрации 30 мг/л по действующему веществу. Конечная концентрация ацетона в контрольных растворах и в растворах с действующими веществами составила 1%. В чашки Петри, содержащие 15 мл агаровой среды, наносили иглой культуры грибов на агаровую поверхность. Образцы выдерживали в инкубаторе при 25°C и измеряли радиальный рост через 3 суток. Процент ингибирования рассчитывали по Эбботу по отношению к необработанному контролю. В качестве эталона использовали коммерческий фунгицид триадимефон в той же концентрации. Результаты испытаний представлены в таблице 1. Таблица 1 Результаты испытаний 4-гидрокси-6-нитроиндолов на фунгицидную активность в концентрации 30 мг/л Соединение Подавление радиального роста мицелия грибов, в % к контролю V.i. R.s.F.о. F.m.H.s. S.s.1в 54 10071 6375 572в 81 10084 70100 973в 51 10056 6188 354в 5 1012 713 155б 48 8963 7195 946б 41 9134 5483 517б 65 10091 8887 548б 70 10073 8483 51Эталон 53 5472 9045 59 Эталон - триадимефон (3,3-диметил-1-(1,2,4-триазол-1-ил)-1-(4-хлорфенокси)-2-бутанон). Обозначения фитопатогенных грибов: V.i. - Venturia inaequalis, R.s. - Rhizoctonia solani, F.o. - Fusarium oxysporum, F.m. - Fusarium moniliforme, H.s. - Helminthosporum sativum, S.s. - Sclerotinia sclerotiorum.Пример 11. Испытания на фунгицидную активность на грибах - вредителях картофеля проводили в экспериментах in vitro аналогичным образом. Действие препаратов определяли по скорости радиального роста мицелия на агаризованной питательной среде на основе пивного сусла с растворенным испытуемым соединением по отношению к скорости роста на среде без него. Растворенное в ацетоне испытуемое соединение вносили в подогретую до 50°C стерильную агаризованную среду с конечной концентрацией соединения в среде 1, 10 и 100 мг/л по действующему веществу. В чашки Петри на поверхность агаризованной среды помещали агаровый блок с мицелием тестируемого гриба размером 5×5 мм слоем мицелия вниз. Образцы выдерживали при 23-25°C и измеряли радиальный рост через 3 суток, вычитая диаметр помещенного агарового блока. Процент ингибирования рассчитывали по Эбботу по отношению к необработанному контролю. При тестировании роста Phytophthora infestans использовали овсяную агаризованную среду, те же концентрации фунгицидов, инкубировали при 18°C, измерения проводили через 7 суток. При тестировании Phizopus sp. измерения проводили через 2 суток. Результаты испытаний представлены в таблице 2. Таблица 2 Результаты испытаний 8б на фунгицидную активность в концентрациях 1,10 и 100 мг/л Соединение Концентрация, мг/л Подавление радиального роста мицелия грибов, в % к контролю A.s. А.i.F.s. Р.i. *R.z. Р.с. P.o. 8б1 90 920 1415 610 14 011 4244 249 100 5131 36100 8343 62 Обозначения грибов: A.s. - Alternaria solani Sorauer, А.i. -Alternaria infectoria E.G.Simmons, F.s. - Fusarium solani (Mart.) Sacc, P.i. - Phytophthora infestans (Mont.) de Bary, Rz. - Rhizopus sp., P.c. - Penicillium cyclopium Westling, P.o. - Pleurotus ostreatus (Jacq.) P.Kumm.Формула изобретения1. Замещенные 2-фенилиндолы общей формулы I 2. Соединение по п.1, обладающее фунгицидной активностью. 3. Способ получения соединений по п.1 или 2 общей формулы I, где при R=Me и R1 и R3=H, R2 =NO2 и R4=OH, при R=Me и R1 и R3=H, R2=OH и R4=NO2 , при R=Me и R2 и R3=H, R1=NO 2 и R4=ОН, при R=Me и R2 и R 3=H, R1=OH и R4=NO2, заключающийся в том, что замещенные фенилгидразины общей формулы VI, где R 1 и R2=Н, МеО или NO2, R4 =NO2 или МеО, подвергают взаимодействию с пропиофеноном в смеси кипящих муравьиной и трифторуксусной кислот с последующей обработкой полученных при этом 2-фенилзамещенных индолов общей формулы VII, где R=Me, R1 и R2=Н, МеО или NO2, R4=NO2 или МеО, тетрабутиламмоний бромидом при нагревании 4. Фунгицидная композиция, содержащая соединения по п.1 или 2 в концентрации 0,1-99% и вспомогательные вещества - остальное. Популярные патенты: 2060618 Пневматический высевающий аппарат ... три вкладыша: верхний (самый большой) с углом перекрытия камеры разряжения в 140о, который предназначен для семян сферической формы, например, гороха; средний с углом перекрытия камеры разряжения в 120о для кормовых бобов; нижний (самый короткий) с углом перекрытия камеры разряжения в 90о для люпина и нута. Вкладыши 29, 30, 31 повторяют конфигурацию выреза 25. Диапазон их длин выбран из условия герметизации выреза 25 и равен 0,37-0,58 длины последнего, начиная от свободного торца дугообразной пластины 28, при одном из ее крайних положений, например, когда пластина 28 убрана из просвета выреза. Вкладыши 29 представляют собой также дугообразные пластины из капрона толщиной 3 мм. ... 2282965 Разбрасыватель минеральных удобрений ... по п.1, отличающийся тем, что он снабжен сменными насадками для формирователя потока, различающимися формой и размерами проходного сечения. MM4A - Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 16.09.2006 Извещение опубликовано: 20.05.2008 БИ: ... 2105446 Плоскорежущая лапа ... позволил установить, что заявителем не обнаружен аналог, характеризующийся признаками, идентичными всем существенным признакам заявленного изобретения. Следовательно, заявленное изобретение соответствует требованию "новизна" по действующему законодательству. Для проверки соответствия заявленного изобретения требования "изобретательского уровня", заявитель провел дополнительный поиск известных решений с целью выявления признаков, совпадающих с отличительными от прототипа признаками заявленного изобретения, результаты которого показывают, что заявленное изобретение не следует для специалиста явным образом из известного уровня техники, поскольку из уровня техники, определенного ... 2157068 Способ управления роением в пчеловодческом хозяйстве ... пчелосемьи отбирают по одной рамке хорошего запечатанного расплода с маткой и домашней пчелой и переносят в один из подготовленных ульев. В эти новые ульи вносят также еще по две рамки хорошего запечатанного расплода с домашней пчелой от оставшихся пчелосемей, а также по две рамки медово-перговые и одну рамку хорошей суши. Рамки, не содержащие матки, предпочтительно брать по одной из улья. Медово-перговые рамки подогревают до 35 - 40oC. Вновь созданные семьи утепляют и оставляют для дальнейшего развития. Одновременно пчелосемьям, у которых взяли только расплод с домашними пчелами, в течение 7 -10 дней дают максимально наполнить улья расплодом, затем матки из этих ульев изымают ... 2056755 Способ регулирования роста овощных культур ... радикал бензил, который за 2-7 дн не может быть метаболизирован тканями растений в связи с отсутствием у них специализированных ферментных систем утилизации этого синтетического аналога цитокининов и, таким образом, вместе с пищей будет попадать в организм человека. Целью изобретения является повышение эффективности снижения содержания нитратов в овощах при отсутствии токсичности для организма человека. Цель достигается тем, что в способе предусматривается внекорневая обработка растений за 2-7 сут до уборки водным раствором цитокининового препарата, представляющего собой спиртовую вытяжку, полученную обработкой отходов производства пива, содержащих сухую массу корешков ... |
Еще из этого раздела: 2235464 Гербицидно-действующее средство 2459398 Способ рекультивации почв, загрязненных минерализованными водами 2414114 Зерноуборочный комбайн 2192734 Устройство для производства прессованных кип из корней лекарственных растений 2201069 Травяное покрытие на основе гибкого полотна 2485083 Способ получения замещенных пиримидин-5-илкарбоновых кислот 2451442 Способ обогащения селеном овощей и злаков 2265444 Способ консервирования пантов 2475025 Средство для обработки семян зерновых и зернобобовых культур, пораженных фузариозом 2449809 Дезинфицирующее средство |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
 2333907, с приоритетом от 27.03.2007 г., опубл. 20.09.2008 г., бюл.
2333907, с приоритетом от 27.03.2007 г., опубл. 20.09.2008 г., бюл. 


 м.д. (DMSO-d6): 7,48-7,54 (m,3H); 7,87-7,90 (m,2H); 8,26 (s,1H); 8,32-8,33 (m,1H); 8,41 (s,1H).
м.д. (DMSO-d6): 7,48-7,54 (m,3H); 7,87-7,90 (m,2H); 8,26 (s,1H); 8,32-8,33 (m,1H); 8,41 (s,1H).