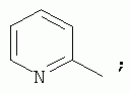
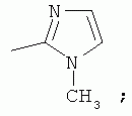
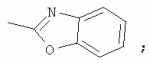
Способ получения замещенных пиримидин-5-илкарбоновых кислотПатент на изобретение №: 2485083 Автор: Шихалиев Хидмет Сафарович (RU), Потапов Андрей Юрьевич (RU), Столповская Надежда Владимировна (RU), Калаев Владислав Николаевич (RU), Баранова Татьяна Валентиновна (RU) Патентообладатель: Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования "Воронежский государственный университет" (ФГБОУ ВПО "ВГУ") (RU) Дата публикации: 20 Июня, 2013 Начало действия патента: 29 Марта, 2012 Адрес для переписки: 394006, г.Воронеж, Университетская пл., 1, ФГБОУ ВПО "ВГУ", ЦКТ Изобретение относится к способу получения замещенных пиримидин-5-илкарбоновых кислот формулы I и может быть использовано в области органической химии. Способ осуществляют путем взаимодействия N-замещенных гуанидинов и гетариламидинов с этоксиметиленпроизводными 1,3-кетоэфиров согласно схеме, приведенной ниже (где заместители являются такими, как определено в формуле изобретения). Технический результат - усовершенствованный способ получения замещенных пиримидин-5-илкарбоновых кислот формулы I. 2 табл., 14 пр. ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУИзобретение относится к области органической химии, к новому способу получения замещенных пиримидин-5-илкарбоновых кислот формулы I, которые могут быть использованы в качестве стимуляторов роста растений. В настоящее время известен способ получения эфиров некоторых пиримидин-5-илкарбоновых кислот взаимодействием этоксиметиленпроизводных 1,3-кетоэфиров с производными гуанидина [Morfolinopyrimidine / Kristen H, Raddats M // Z. Chem. - 1981. - Vol.21, № 3 - P.101, патент JP 61-243067]. Однако в данных работах изучены эфиры только некоторых (морфолин- и N-бензилпиперазин-) замещенных во втором положении пиримидинкарбоновых кислот. Наиболее близким является способ получения 2-арил-6-бензил-пиримидин-5-илкарбоновых кислот, описанный авторами патента KR 20070116876 (A). Синтез целевых продуктов осуществляется в 3 стадии: взаимодействием соответствующих 1,3-кетоэфиров с диметилацеталем диметилформамида получают диметиламинометиленпроизводные, циклизация последних с гидрохлоридами ариламидинов приводит к образованию эфиров 2-арил-6-бензилпиримидин-5-илкарбоновых кислот, гидролизом последних в водном растворе гидроксида натрия получают соответствующие кислоты. Предложенный способ получения 2-арил-6-бензил-пиримидин-5-илкарбоновых кислот имеет ряд недостатков: проведение синтеза в три стадии с использованием дорогостоящего и токсичного диметилацеталя N,N-диметилформамида; Задачей настоящего изобретения является разработка способа получения замещенных пиримидин-5-илкарбоновых кислот, позволяющего существенно расширить вариативный ряд заместителей во 2, 4 и 6-м положениях пиримидинового цикла, которые могут быть использованы в качестве стимуляторов роста растений. Техническим результатом является получение новых замещенных пиримидин-5-илкарбоновых кислот формулы I, замещенных во 2, 4 и 6-м положениях пиримидинового цикла, уменьшение расхода дорогостоящих исходных компонентов, повышение стимулирующего эффекта на высоту растения. Технический результат достигается проведением реакции различных 1,3-кетоэфиров с ортоэфиром муравьиной (уксусной) кислоты, приводящей к соответствующим этоксиметиленпроизводным, циклизация последних с N-замещенными гуанидинами и гетариламидинами протекает с образованием эфиров пиримидин-5-илкарбоновых кислот, щелочной гидролиз которых приводит к целевым пиримидин-5-илкарбоновым кислотам формулы I; получением ранее неизученных 2-арил(гетарил)аминопиримидин-5-илкарбоновых кислот; использованием пиримидин-5-илкарбоновых кислот формулы I в качестве стимулятора роста R1+R2=пиперидин, пирролидин, морфолин, N-Alk(Ar)пиперазин R1=Alk, Ar; R2=Alk, Ar R1=H, R2=H, Alk, Ar, Het: R=H; 6-Me; 6-Et; 6-MeO; 6-EtO; 7-Me; 7-MeO; 8-Me; 8-Et; 8-MeO; 8-EtO; 6,7-диМе; 6,8-диМе; 6,8-диМеО; 6-Cl R3=Alk, Ar, CH2Cl; CH2 SAr, CH2SHet:
R4=H, Me Пиримидин-5-илкарбоновые кислоты формулы I образуются в результате щелочного гидролиза соответствующих эфиров, полученных взаимодействием с N-замещенных гуанидинов и гетариламидинов с этоксиметиленпроизводными 1,3-кетоэфиров. В таблице 1 приведены результаты испытания на всхожесть при обработке семян бархатцев отклоненных (Tagetes patula L.) 0,05% раствором 2-бензиламино-4-метилпиримидин-5-илкарбоновой кислоты; в таблице 2 приведены результаты испытания на всхожесть при обработке семян бархатцев отклоненных (Tagetes patula L.) 0,01-0,05% раствором 4-метил-2-(2-фенилэтиламино)пиримидин-5-илкарбоновой кислоты. Ниже представлены примеры осуществления предлагаемого изобретения. ПРИМЕР 1. 4-метил-(2-пиперидин-1-ил)-пиримидин-5-илкарбоновая кислота Смесь 0.11 моль ацетоуксусного эфира 0.12 моль триэтилортоформиата кипятили два часа с одновременной отгонкой выделяющегося в результате реакции этилового спирта (насадка Вигре 20 см). После охлаждения смеси добавляли 0,1 моль пиперидин-1-илкарбоксамидина, 5 мл этилового спирта и кипятили в течение 1 часа. Выпавший после охлаждения осадок этилового эфира 4-метил-(2-пиперидин-1-ил)-пиримидин-5-илкарбоновой кислоты отфильтровывали, промывали этанолом и перекристаллизовывали из этанола. Выход 72%, т.пл. 50-52°С. Найдено (%): С, 62,74; H, 7,71; N, 18,59. C13H19 N3O2. Вычислено (%): C, 62,63; H, 7,68; N, 18,65. Спектр ЯМР1Н 1.35 (3H, т, CH2 CH3, J=8.0); 1.56-1.68 (6Н, м, пиперид.); 3.28 (3H, с, CH3); 4.41 (2H, кв, СН2СН 3, J=12.5); 8.65 (1Н, с, СН-пиримид.). Масс-спектр, m/z 249 [М]+. 0.06 моль этилового эфира 4-метил-(2-пиперидин-1-ил)-пиримидин-5-илкарбоновой кислоты смачивали этиловым спиртом, добавляли 0.15 моль раствора гидроксида натрия (7%) и кипятили 1 час. После охлаждения к смеси добавляли 0.15 моль раствора соляной кислоты (5%). Выпавший осадок 4-метил-(2-пиперидин-1-ил)-пиримидин-5-илкарбоновой кислоты отфильтровывали, промывали водой. Выход 92%, т.пл. >200°С возгоняется. Найдено (%):C, 59,51; H, 6,80; N, 19,03. C11 H15N3O2. Вычислено (%):C, 59,71; Н, 6,83; N, 18,99. Спектр ЯМР1Н 1.57-1.68 (6Н, м, пиперид.); 3.29 (3Н, с, CH3); 8.66 (1H, с, CH-пиримид.); 13.12 (1H, уш.с, COOH). Масс-спектр, m/z 220 [M-1]+ . ПРИМЕР 2. 4-метил-2-(4-метилфениламино)-пиримидин-5-илкарбоновая кислота Смесь 0.11 моль ацетоуксусного эфира 0.12 моль триэтилортоформиата кипятили два часа с одновременной отгонкой выделяющегося в результате реакции этилового спирта (насадка Вигре 20 см). После охлаждения добавляли 0,1 моль 4-метилфенилгуанидина, 5 мл этилового спирта и кипятили в течение 1 часа. Выпавший при охлаждении осадок этилового эфира 4-метил-2-(4-метилфениламино)-пиримидин-5-илкарбоновой кислоты отфильтровывали, промывали этанолом и перекристаллизовывали из этилового спирта. Выход 81%, т.пл. 114-116°С. Найдено (%):C, 62,58; H, 6,30; N, 15,53. C15H 17N3O2. Вычислено (%):С, 66,40; H, 6,32; N, 15,49. Спектр ЯМР1Н 1.38 (3H, т, CH2 CH3, J=8.0); 2,06 (3H, с, CH3); 3.29 (3H, с, CH3); 4.43 (2H, кв, CH2 CH3, J=12.5); 7.24 (2Н, д, 2CH-арил., J=7.8); 7.38 (2H, д, 2CH-арил., J=7.8); 8.67 (1H, с, CH-пиримид.); 9.93 (1H, с, NH). Масс-спектр, m/z 271 [M]+. 0.06 моль этилового эфира 4-метил-2-(4-метилфениламино)-пиримидин-5-илкарбоновой кислоты смачивали этиловым спиртом, добавляли 0.15 моль раствора гидроксида натрия (7%) и кипятили 1 час. После охлаждения к смеси добавляли 0.15 моль раствора соляной кислоты (5%). Выпавший осадок 4-метил-2-(4-метилфениламино)-пиримидин-5-илкарбоновой кислоты отфильтровывали, промывали водой. Выход 96%, т.пл. >200°С возгоняется. Найдено (%):C, 59,51; H, 6,80; N, 19,03. C13H13N3O2 . Вычислено (%):C, 59,71; H, 6,83; N, 18,99. Спектр ЯМР1 Н 2,06 (3H, с, CH3); 3.29 (3H, с, CH3); 7.25 (2H, д, 2CH-арил, J=7.8); 7.38 (2H, д, 2CH-арил., J=7.8); 8.67 (1H, с, CH-пиримид.); 10.01 (1H, с, NH); 13.15 (1H, уш.с, COOH). Масс-спектр, m/z 242 [M-1]+. ПРИМЕР 3. 2-бензиламино-4-метилпиримидин-5-илкарбоновая кислота Смесь 0.11 моль ацетоуксусного эфира 0.12 моль триэтилортоформиата кипятили два часа с одновременной отгонкой выделяющегося в результате реакции этилового спирта (насадка Вигре 20 см). После охлаждения добавляли 0,1 моль бензилгуанидина, 5 мл этилового спирта и кипятили в течение 1 часа. Выпавший при охлаждении осадок этилового эфира 2-бензиламино-4-метилпиримидин-5-илкарбоновой кислоты отфильтровывали, промывали этанолом и перекристаллизовывали из этанола. Выход 79%, т.пл. 105-107°С. Найдено (%):C, 62,21; H, 6,34; N, 15,49. C15H17 N3O2. Вычислено (%):C, 66,40; H, 6,32; N, 15,49. Спектр ЯМР1Н 1.34 (3H, т, CH2 CH3, J=8.0); 3.25 (3Н, с, CH3); 4.39 (2Н, кв, CH2CH3, J=12.5); 4,62 (2H, с, CH2); 7.35 (3Н, м, 3CH-арил.); 8.14 (2H, м, 2CH-арил.); 8.61 (1Н, с, CH-пиримид.); 9.54 (1H, с, NH). Масс-спектр, m/z 271 [М]+. 0.06 моль этилового эфира 2-бензиламино-4-метил-пиримидин-5-илкарбоновой кислоты смачивали этиловым спиртом, добавляли 0.15 моль раствора гидроксида натрия (7%) и кипятили 1 час. После охлаждения к смеси добавляли 0.15 моль раствора соляной кислоты (5%). Выпавший осадок 2-бензиламино-4-метилпиримидин-5-илкарбоновой кислоты отфильтровывали, промывали водой. Выход 96%, т.пл. >222°С возгоняется. Найдено (%):C, 59,51; H, 6,80; N, 19,03. C13 H13N3O2. Вычислено (%):C, 59,71; H, 6,83; N, 18,99. Спектр ЯМР1 3.24 (3H, с, CH 3); 4,62 (2H, с, CH3); 7.35 (3H, м, 3CH-арил.); 8.14 (2H, м, 2CH-арил.); 8.60 (1H, с, CH-пиримид.); 9.53 (1H, с, NH); 13,10 (1H, уш.с, COOH). Масс-спектр, m/z 242 [М-1] +. ПРИМЕР 4. 4-метил-2-(2-фенилэтиламино)-пиримидин-5-илкарбоновая кислота Смесь 0.11 моль ацетоуксусного эфира 0.12 моль триэтилортоформиата кипятили два часа с одновременной отгонкой выделяющегося в результате реакции этилового спирта (насадка Вигре 20 см). После охлаждения добавляли 0,1 моль 2-фенилэтилгуанидина, 5 мл этилового спирта и кипятили в течение 1 часа. Выпавший при охлаждении осадок этилового эфира 4-метил-2-(2-фенилэтиламино)-пиримидин-5-илкарбоновой кислоты отфильтровывали, промывали этанолом и перекристаллизовывали из этанола. Выход 71%, т.пл. 98-100°С. Найдено (%):C, 67,13; H, 6,69; N, 14,79. C16H19 N3O2. Вычислено (%):С, 67,35; Н, 6,71; N, 14,73. Спектр ЯМР1Н 1.34 (3Н, т, СН2 СН3, J=8.0); 2.82 (2H, т, CH2, J=12.0); 3.25 (3H, с, CH3); 4.11 (2H, т, CH2, J=12.0); 4.39 (2H, кв, CH2CH3, J=12.5); 7.31 (3H, м, 3CH-арил.); 8.13 (2H, м, 2CH-арил.); 8.61 (1H, с, CH-пиримид.); 9.53 (1H, с, NH). Масс-спектр, m/z 285 [M]+. 0.06 моль этилового эфира 4-метил-2-(2-фенилэтиламино)-пиримидин-5-илкарбоновой кислоты смачивали этиловым спиртом, добавляли 0.15 моль раствора гидроксида натрия (7%) и кипятили 1 час. После охлаждения к смеси добавляли 0.15 моль раствора соляной кислоты (5%). Выпавший осадок 4-метил-2-(2-фенилэтиламино)-пиримидин-5-илкарбоновой кислоты отфильтровывали, промывали водой. Выход 95%, т.пл. >232°С возгоняется. Найдено (%):C, 65,19; H, 5,85; N, 16,23. C14H15N3O2 . Вычислено (%):C, 65,36; H, 5,88; N, 16,33. Спектр ЯМР1 2.82 (2H, т, CH2, J=12.0); 3.24 (3Н, с, CH3 ); 4.11 (2H, т, CH2, J=12.0); 7.34 (3H, м, 3CH-арил.); 8.15 (2H, м, 2CH-арил.); 8.61 (1H, с, CH-пиримид.); 9.52 (1H, с, NH); 13,09 (1H, уш.с, COOH). Масс-спектр, m/z 256 [M-1] +. ПРИМЕР 5. 4,6-диметил-2-фениламинопиримидин-5-илкарбоновая кислота Смесь 0.11 моль ацетоуксусного эфира 0.12 моль триэтилортоацетата кипятили два часа с одновременной отгонкой выделяющегося в результате реакции этилового спирта (насадка Вигре 20 см). После охлаждения смеси добавляли 0,1 моль фенилгуанидина, 5 мл этилового спирта и кипятили в течение 1 часа. Выпавший при охлаждении осадок этилового эфира 4,6-диметил-2-фениламинопиримидин-5-илкарбоновой кислоты отфильтровывали, промывали этанолом и перекристаллизовывали из этилового спирта. Выход 65%, т.пл. 92-94°С. Найдено (%):C, 62,20; H, 6,31; N, 15,55. C15H 17N3O2. Вычислено (%):C, 66,40; H, 6,32; N, 15,49. Спектр ЯМР1Н 1.35 (3H, т, CH2 CH3, J=8.0); 2,61 (3H, с, CH3); 3.24 (3H, с, CH3); 4.40 (2H, кв, CH2 CH3, J=12.5); 7.41 (3Н, м, 3CH-арил.); 8.19 (2H, м, 2CH-арил.); 9.95 (1H, с, NH). Масс-спектр, m/z 271 [M]+ . 0.06 моль этилового эфира 4,6-диметил-2-фениламинопиримидин-5-илкарбоновой кислоты смачивали этиловым спиртом, добавляли 0.15 моль раствора гидроксида натрия (7%) и кипятили 1 час. После охлаждения к смеси добавляли 0.15 моль раствора соляной кислоты (5%). Выпавший осадок 4,6-диметил-2-фениламинопиримидин-5-илкарбоновой кислоты отфильтровывали, промывали водой. Выход 92%, т.пл. >218°С возгоняется. Найдено (%):C, 59,48; H, 6,82; N, 18,95. C13 H13N3O2. Вычислено (%):C, 59,71; H, 6,83; N, 18,99. Спектр ЯМР1Н 2,60 (3H, с, CH 3); 3.23 (3H, с, CH3); 7.41 (3Н, м, 3CH-арил.); 8.19 (2H, м, 2CH-арил.); 10.00 (1H, с, NH); 13.14 (1H, уш.с, COOH). Масс-спектр, m/z 242 [М-1]+. ПРИМЕР 6. 4,6-диметил-2-(4-метилхиназол-2-иламино)-пиримидин-5-илкарбоновая кислота Смесь 0.11 моль ацетоуксусного эфира 0.12 моль триэтилортоацетата кипятили два часа с одновременной отгонкой выделяющегося в результате реакции этилового спирта (насадка Вигре 20 см). После охлаждения добавляли 0,1 моль 4-метилхиназол-2-илгуанидина, 5 мл диметилформамида и кипятили в течение 1 часа. Выпавший при охлаждении осадок этилового эфира 4,6-диметил-2-(4-метилхиназол-2-иламино)-пиримидин-5-илкарбоновой кислоты отфильтровывали, промывали спиртом, растворяли в хлороформе, фильтровали через 2-х см слой силикагеля. Эвакуировали хлороформ и перекристаллизовывали из смеси этанол-диметилформамид. Выход 49%, т.пл. 213-215°С. Найдено (%):C, 64,22; H, 5,70; N, 20,72. C18H19N5O2 . Вычислено (%):C, 64,08; H, 5,68; N, 20,76. Спектр ЯМР1 Н 1.43 (3H, т, CH2CH3, J=8.0); 2,69 (3H, с, CH3); 2,76 (3H, с, CH3); 3.49 (3H, с, CH3); 4.48 (2H, кв, CH2CH 3, J=12.5); 7.14-7.61 (4H, м, 4CH-бенз.); 10.19 (1H, с, NH). Масс-спектр, m/z 337 [M]+. 0.06 моль этилового эфира 4,6-диметил-2-(4-метилхиназол-2-иламино)-пиримидин-5-илкарбоновой кислоты смачивали этиловым спиртом, добавляли 0.15 моль раствора гидроксида натрия (7%) и кипятили 1 час. После охлаждения к смеси добавляли 0.15 моль раствора соляной кислоты (5%). Выпавший осадок 4,6-диметил-2-(4-метилхиназол-2-иламино)-пиримидин-5-илкарбоновой кислоты отфильтровывали, промывали водой. Выход 92%, т.пл. >300°С. Найдено (%):C, 59,87; H, 4,85; N, 22,58. C16H15N5O2 . Вычислено (%):C, 62,13; H, 4,89; N, 22,64. Спектр ЯМР1 Н 2,67 (3H, с, CH3); 2,76 (3H, с, CH3); 3.49 (3Н, с, CH3); 7.14-7.61 (4Н, м, 4CH-бенз.); 10.19 (1H, с, NH); 13.18 (1H, уш.с, COOH). Масс-спектр, m/z 308 [М-1] +. ПРИМЕР 7. 4-фенил-(2-пиперидин-1-ил)-пиримидин-5-илкарбоновая кислота Смесь 0.11 моль бензоилуксусного эфира 0.12 моль триэтилортоформиата кипятили два часа с одновременной отгонкой выделяющегося в результате реакции этилового спирта (насадка Вигре 20 см). После охлаждения добавляли 0,1 моль пиперидин-1-илкарбоксамидина, 5 мл этилового спирта и кипятили в течение 1 часа. Выпавший после охлаждения осадок этилового эфира 4-фенил-(2-пиперидин-1-ил)-пиримидин-5-илкарбоновой кислоты отфильтровывали, промывали этанолом и перекристаллизовывали из этилового спирта. Выход 77%, т.пл. 108-110°С. Найдено (%):C, 69,74; H, 6,81; N, 13,42. C18H 21N3O2. Вычислено (%):C, 69,43; H, 6,80; N, 13,49. Спектр ЯМР1Н 1.39 (3H, т, CH2 CH3, J=8.0); 1.58-1.69 (6H, м, пиперид.); 4.43 (2Н, кв, CH2CH3, J=12.5); 7.40 (3H, м, 3CH-арил.); 8.16 (2H, м, 2CH-арил.); 8.70 (1H, с, CH-пиримид.). Масс-спектр, m/z 311 [M]+. 0.06 моль этилового эфира 4-фенил-(2-пиперидин-1-ил)-пиримидин-5-илкарбоновой кислоты смачивали этиловым спиртом, добавляли 0.15 моль раствора гидроксида натрия (7%) и кипятили 1 час. После охлаждения к смеси добавляли 0.15 моль раствора соляной кислоты (5%). Выпавший осадок 4-фенил-(2-пиперидин-1-ил)-пиримидин-5-илкарбоновой кислоты отфильтровывали, промывали водой. Выход 96%, т.пл. >238°С возгоняется. Найдено (%):C, 67,75; H, 6,03; N, 14,86. C16 H17N3O2. Вычислено (%):C, 67,83; H, 6,05; N, 14,83. Спектр ЯМР1Н 1.58-1.69 (6H, м, пиперид.); 7.40 (3H, м, 3CH-арил.); 8.16 (2H, м, 2CH-арил.); 8.70 (1H, с, CH-пиримид.); 13.04 (1H, уш.с, COOH). Масс-спектр, m/z 282[М-1]+. ПРИМЕР 8. 4-фенил-6-метил-2-(бензоксазол-2-иламино)-пиримидин-5-илкарбоновая кислота Смесь 0.11 моль бензоилуксусного эфира 0.12 моль триэтилортоацетата кипятили два часа с одновременной отгонкой выделяющегося в результате реакции этилового спирта (насадка Вигре 20 см). После охлаждения добавляли 0,1 моль бензоксазол-2-илгуанидина, 5 мл диоксана и кипятили в течение 1 часа. Выпавший после охлаждения осадок этилового эфира 4-фенил-6-метил-2-(бензоксазол-2-иламино)-пиримидин-5-илкарбоновой кислоты отфильтровывали, промывали диоксаном и перекристаллизовывали из диоксана. Выход 64%, т.пл. 255-257°С. Найдено (%):C, 63,54; H, 4,89; N, 14,85. C21H 18N4O3. Вычислено (%):C, 67,37; H, 4,85; N, 14,96. Спектр ЯМР1Н 1.41 (3H, т, CH2 CH3, J=8.0); 2,60 (3H, с, CH3); 4.47 (2H, кв, CH2CH3, J=12.5); 6.99-7,58 (9H, м, 9CH-аром.); 9,85 (1H, с, NH). Масс-спектр, m/z 374 [М] +. 0.06 моль этилового эфира 4-фенил-6-метил-2-(бензоксазол-2-иламино)-пиримидин-5-илкарбоновой кислоты смачивали этиловым спиртом, добавляли 0.15 моль раствора гидроксида натрия (7%) и кипятили 1 час. После охлаждения к смеси добавляли 0.15 моль раствора соляной кислоты (5%). Выпавший осадок 4-фенил-6-метил-2-(бензоксазол-2-ил)-пиримидин-5-илкарбоновой кислоты отфильтровывали, промывали водой. Выход 96%, т.пл. >300°С с разложением. Найдено (%):C, 65,73; H, 4,03; N, 16,80. C19H14N4O 3. Вычислено (%):C, 65,89; H, 4,07; N, 16,18. Спектр ЯМР 1Н 2,60 (3H, с, CH3); 6.96-7,54 (9H, м, 9CH-аром.); 9,85 (1H, с, NH); 13.04 (1H, уш.с, COOH). Масс-спектр, m/z 345 [М-1]+. ПРИМЕР 9. 4-(5-метил[1,3,4]тиадиазол-2-илтиометил)-2-(бензтиазол-2-иламино)-пиримидин-5-илкарбоновая кислота Смесь 0.11 моль 4-(5-метил[1,3,4]тиадиазол-2-илтио)ацетоуксусного эфира 0.12 моль триэтилортоформиата кипятили два часа с одновременной отгонкой выделяющегося в результате реакции этилового спирта (насадка Вигре 20 см). После охлаждения добавляли 0,1 моль бензтиазол-2-илгуанидина, 5 мл диоксана и кипятили в течение 1 часа. Выпавший после охлаждения осадок этилового эфира 4-(5-метил [1,3,4]тиадиазол-2-илтиометил)-2-(бензтиазол-2-иламино)-пиримидин-5-илкарбоновой кислоты отфильтровывали, промывали диоксаном и перекристаллизовывали из диоксана. Выход 81%, т.пл. 240-242°С. Найдено (%):C, 48,81; H, 3,60; N, 18,87. C18H 16N6O2S3. Вычислено (%):C, 48,63; H, 3,63; N, 18,90. Спектр ЯМР1Н 1.44 (3H, т, CH2CH3, J=8.0); 4.46 (2H, кв, CH2CH3, J=12.5); 4.99 (2H, с, SCH 2); 7.02 (1H, т, 1CH-бенз, J=7.8); 7.19 (1H, т, 1CH-бенз, J=7.8); 7.58 (2H, м, 2CH-бенз.); 8.73 (1H, с, CH-пиримид.); 10.15 (1H, с, NH). Масс-спектр, m/z 444 [M]+. 0.06 моль этилового эфира 4-(5-метил[1,3,4]тиадиазол-2-илтиометил)-2-(бензтиазол-2-иламино)-пиримидин-5-илкарбоновой кислоты смачивали этиловым спиртом, добавляли 0.15 моль раствора гидроксида натрия (7%) и кипятили 1 час. После охлаждения к смеси добавляли 0.15 моль раствора соляной кислоты (5%). Выпавший осадок 4-(5-метил [1,3,4]тиадиазол-2-илтиометил)-2-(бензтиазол-2-иламино)-пиримидин-5-илкарбоновой кислоты отфильтровывали, промывали водой. Выход 96%, т.пл. >300°С с разложением. Найдено (%):C, 46,23; H, 2,91; N, 20,14. C16H12N6O 2S3. Вычислено (%):C, 46,14; H, 2,90; N, 20,18. Спектр ЯМР1Н 4.99 (2H, с, SCH2); 7.02 (1H, т, 1CH-бенз, J=7.8); 7.19 (1H, т, 1CH-бенз., J=7.8); 7.58 (2H, м, 2CH-бенз.); 8.71 (1H, с, CH-пиримид.) 10,15 (1H, с, NH); 13.04 (1H, уш.с, COOH). Масс-спектр, m/z 415 [M-1]+. ПРИМЕР 10. 4-хлорметил-2-(бензтиазол-2-иламино)-пиримидин-5-илкарбоновая кислота Смесь 0.11 моль 4-хлорацетоуксусного эфира 0.12 моль триэтилортоформиата кипятили два часа с одновременной отгонкой выделяющегося в результате реакции этилового спирта (насадка Вигре 20 см). После охлаждения добавляли 0,1 моль бензтиазол-2-илгуанидина, 5 мл диоксана и кипятили в течение 1 часа. Выпавший после охлаждения осадок этилового эфира 4-хлорметил-2-(бензтиазол-2-иламино)-пиримидин-5-илкарбоновой кислоты отфильтровывали, промывали диоксаном и перекристаллизовывали из диоксана. Выход 43%, т.пл. 286-288°С. Найдено (%):C, 51,89; H, 3,74; N, 16,01. C15H 13ClN4O2S. Вычислено (%):C, 51,65; H, 3,76; N, 16,06. Спектр ЯМР1Н 1.48 (3H, т, СН 2СН3, J=8.0); 4.35 (2H, кв, CH 2CH3, J=12.5); 5.00 (2H, с, CH2 ); 7.11 (1H, т, 1CH-бенз, J=7.8); 7.23 (1H, т, 1CH-бенз, J=7.8); 7.59 (2H, м, 2CH-бенз.); 8.71 (1H, с, CH-пиримид.); 9.54 (1H, с, NH). Масс-спектр, m/z 348 [M]+. 0.06 моль этилового эфира 4-хлорметил-2-(бензтиазол-2-иламино)-пиримидин-5-илкарбоновой кислоты смачивали этиловым спиртом, добавляли 0.15 моль раствора гидроксида натрия (7%) и кипятили 1 час. После охлаждения к смеси добавляли 0.15 моль раствора соляной кислоты (5%). Выпавший осадок 4-хлорметил-2-(бензтиазол-2-ил)-пиримидин-5-илкарбоновой кислоты отфильтровывали, промывали водой и перекристаллизовывали из диметилформамида. Выход 62%, т.пл. >300°С с разложением. Найдено (%):C, 48,53; H, 2,84; N, 17,52. C13H9ClN 4O2S. Вычислено (%):C, 48,68; H, 2,83; N, 17,47. Спектр ЯМР1Н 5.00 (2H, с, CH2); 7.11 (1H, т, 1CH-бенз., J=7.8); 7.23 (1H, т, 1CH-бенз., J=7.8); 7.59 (2H, м, 2CH-бенз.); 8.69 (1H, с, CH-пиримид.); 10,11 (1H, с, NH); 13.07 (1H, уш.с, COOH). Масс-спектр, m/z 319 [M-1]+ . ПРИМЕР 11. 4-фенил-6-метил-2-(бензтиазол-2-иламино)-пиримидин-5-илкарбоновая кислота Смесь 0.11 моль бензоилуксусного эфира 0.12 моль триэтилортоацетата, 0,1 моль бензтиазол-2-илгуанидина и 5 мл диоксана кипятили в течение 1 часа. Выпавший после охлаждения осадок этилового эфира 4-фенил-6-метил-2-(бензтиазол-2-иламино)-пиримидин-5 -илкарбоновой кислоты отфильтровывали, промывали диоксаном и перекристаллизовывали из диоксана. Выход 69%, т.пл. 254-256°С. Найдено (%):C, 64,83; H, 4,69; N, 14,42. C21H18N4O2S. Вычислено (%):C, 64,60; H, 4,65; N, 14,35. Спектр ЯМР1Н 1.40 (3H, т, CH2CH3, J=8.0); 2,59 (3H, с, CH3); 4.45 (2H, кв, CH2CH 3, J=12.5); 6.97-7,56 (9H, м, 9CH-аром.); 9,84 (1H, с, NH). Масс-спектр, m/z 390 [M]+. 0.06 моль этилового эфира 4-фенил-6-метил-2-(бензтиазол-2-иламино)-пиримидин-5-илкарбоновой кислоты смачивали этиловым спиртом, добавляли 0.15 моль раствора гидроксида натрия (7%) и кипятили 1 час. После охлаждения к смеси добавляли 0.15 моль раствора соляной кислоты (5%). Выпавший осадок 4-фенил-6-метил-2-(бензтиазол-2-ил)-пиримидин-5-илкарбоновой кислоты отфильтровывали, промывали водой. Выход 98%, т.пл. >300°С с разложением. Найдено (%):C, 65,73; H, 4,03; N, 16,80. C19H14N4O 2S. Вычислено (%):C, 65,89; H, 4,07; N, 16,18. Спектр ЯМР 1Н 2,59 (3H, с, CH3); 6.97-7,56 (9H, м, 9CH-аром.); 9,84 (1H, с, NH); 13.01 (1H, уш.с, COOH). Масс-спектр, m/z 360 [M-1]+. ПРИМЕР 12. 4-фенилтиометил-2-(бензтиазол-2-иламино)-пиримидин-5-илкарбоновая кислота Смесь 0.11 моль 4-фенилтиоацетоуксусного эфира 0.12 моль триэтилортоформиата, 0,1 моль бензтиазол-2-илгуанидина и 5 мл диоксана кипятили в течение 1 часа. Выпавший после охлаждения осадок этилового эфира 4-фенилтиометил-2-(бензтиазол-2-иламино)-пиримидин-5-илкарбоновой кислоты отфильтровывали, промывали диоксаном и перекристаллизовывали из диоксана. Выход 86%, т.пл. 200-202°С. Найдено (%):C, 59,47; H, 4,32; N, 13,27. C21H 18N4O2S2. Вычислено (%):C, 59,70; H, 4,29; N, 13,26. Спектр ЯМР1Н 1.41 (3H, т, CH2CH3, J=8.0); 4.40 (2H, кв, CH2CH3, J=12.5); 4.97 (2H, с, SCH 2); 6.91-7,52 (9H, м, 9CH-аром.); 8.68 (1H, с, CH-пиримид.); 10.14 (1H, с, NH). Масс-спектр, m/z 422 [М]+. 0.06 моль этилового эфира 4-фенилтиометил-2-(бензтиазол-2-ил)-пиримидин-5-илкарбоновой кислоты смачивали этиловым спиртом, добавляли 0.15 моль раствора гидроксида натрия (7%) и кипятили 1 час. После охлаждения к смеси добавляли 0.15 моль раствора соляной кислоты (5%). Выпавший осадок 4-фенилтиометил-2-(бензтиазол-2-иламино)-пиримидин-5-илкарбоновой кислоты отфильтровывали, промывали водой. Выход 88%, т.пл. >300°С с разложением. Найдено (%):C, 58,03; H, 3,61; N, 14,16. C19H14N4O 2S2. Вычислено (%):C, 57,85; H, 3,58; N, 14,20. Спектр ЯМР1Н 4.97 (2H, с, SCH2); 6.88-7,48 (9H, м, 9CH-аром.); 8.67 (1H, с, CH-пиримид.); 10.12 (1H, с, NH); 13.01 (1H, уш.с, COOH). Масс-спектр, m/z 393 [M-1]+ . Было изучено также стимулирующее действие растворов пиримидин-5-илкарбоновых кислот на рост однолетнего растения - бархатцы отклоненные (Tagetes patula L.), которое широко используется для озеленения городских территорий. ПРИМЕР 13. Установлено, что при обработке семян бархатцев отклоненных {Tagetes patula L.) 0,05% раствором 2-бензиламино-4-метилпиримидин-5-илкарбоновой кислоты средняя высота растений, по сравнению с контрольной, увеличилась на 7,9 см. Обработка данным раствором положительно сказывается и на всхожести семян (Таблица 1). ПРИМЕР 14. Установлено, что при обработке семян бархатцев отклоненных {Tagetes patula L.) 0,01-0,05% раствором 4-метил-2-(2-фенилэтиламино)пиримидин-5-илкарбоновой кислоты средняя высота растений, по сравнению с контрольной, увеличилась на 7,7-9,2 см, при этом чем выше концентрация, тем выше положительный эффект. Всхожесть семян также зависит от концентрации, в данном случае оптимальный результат достигается при использовании 0,01% раствора (Таблица 2). ФОРМУЛА ИЗОБРЕТЕНИЯСпособ получения замещенных пиримидин-5-илкарбоновых кислот формулы I взаимодействием N-замещенных гуанидинов и гетариламидинов с этоксиметиленпроизводными 1,3-кетоэфиров, отличающийся тем, что при получении эфиров пиримидин-5-илкарбоновых кислот используются этоксиметиленпроизводные 1,3-кетоэфиров и различные N-замещенные гуанидины и гетариламидины: Популярные патенты: 2196418 Устройство для укладки, сушки и хранения прессованного сена и соломы в рулонах ... 16 переместится до надлежащей точки, нажимаем на кнопку пульта управления 28, размыкаем электрическую цепь, питающую электрический двигатель 17. При этом перемещение тельфера 16 прекращается. Затем нажимаем на кнопку пульта управления 28. Замыкается электрическая цепь, питающая электрический двигатель 20. Электрический двигатель 20 вращает лебедку 18, захват 21, перемещается вниз над рулоном 26. Устанавливаем шипы 25 в надлежащем положении и нажимаем на определенную кнопку в пульте управления 28. Замыкается электрическая цепь, питающая электрический двигатель 24. Электрический двигатель 24 вращает винт 22 в гайке 23, жестко закрепленной к захвату 21. При этом крылья захвата 21 с ... 2115638 Способ переработки органических отходов животного происхождения в кормовой белок и биогумус ... сущности к изобретению является способ утилизации (переработки) органических отходов, в том числе и животного происхождения, в биогумус. Известный способ включает приготовление субстрата путем смешивания компонентов, одним из которых являются отходы животного происхождения - навоз и птичий помет, внесение в него червей и/или их коконов, укладку субстрата в емкость и компостирование при влажности 65 - 80% с последующим отделением червей от полученного биогумуса. Плотность заселения компостной массы червями составляет 15-25 тыс. особей на 1 м2 (патент РФ 2057743, кл. C 05 F 3/06, опубл. 10.04.96). Недостатками известного способа являются сезонность переработки, низкая плотность ... 2157064 Способ промышленного производства миниклубней картофеля в искусственном климате культивационного сооружения (фитотроне) ... атмосферы в корневой зоне фитотрона в процессе роста картофеля снижают со значения 100 - 95% в начальный период роста растений до 80 - 65% в период клубнеобразования картофеля при активной аэрации всего объема корневой зоны. 6. Способ по любому из пп.1 - 5, отличающийся тем, что в процессе вегетации растений картофеля изменяют спектральный состав искусственного освещения в стеблевой зоне фитотрона, а именно: на этапе роста растений используют лампы со спектром 550 - 650 нм, а на этапе клубнеобразования картофеля - лампы со спектром 365 - 700 нм, при этом интенсивность света в процессе вегетации растений картофеля составляет 80 - 100 ... 2040900 Фунгицидное средство ... вещество (1:11 1:20) 10% Гликолевый простой эфир октилфенол полиэтилена (4-5 молей окиси этилена) 3% Додецилбензолсульфонат кальция 3% Полигликолевый эфир касторового масла (35 молей окиси этилена) 4% Циклогексан 30% Смесь ксилолов 50% Из этого концентрата можно приготовить разбавлением водой эмульсии любой желаемой концентрации. Распыляемое средство а в Активное вещество (1:11 2:3 и 1:1) 5% 8% Тальк 95% Каолин 92% Получают готовое для употребления распыляемое средство, у которого активное вещество смешано с носителем и перемолото в подходящей мельнице. Гранулят, полученный экструдированием. Активное вещество (1:11 20:1) 10% Лигнинсульфонат натрия 2% Карбоксиметилцеллюлоза 1% ... 2232490 Машина для обработки почвы ... около мостиков 44 и упоров 45, огибания рейки 46 по направляющей 47 /фиг.3а,б,в,г,д,е,ж,з/ для изменения направления /реверса/ хода. Длину хода рейки можно регулировать установкой секции 47.Предохранительная муфта 48 /фиг.5а/ тягой 49 с пружиной составляют датчик нагрузки и через регулятор 50 может поднять рабочие органы 51 /опустить колеса 52/, стабилизировать нагрузку. Аналогично объемная муфта 53 /фиг.5б/ может регулировать высоту лопаты 54 и стабилизировать нагрузку двигателя, выглубляя при перегрузке, предохранить от поломки, подавая выходной сигнал обратным знаком на вход управления, автоматически управлять машиной по принципу силового регулятора без отбора энергии.Фиксаторы ... |
Еще из этого раздела: 2010519 Способ биологической борьбы с вредителями растений 2473366 Вещество, обладающее антимикробным действием 2024226 Производные s- -тиоакриламидов и композиция для предотвращения или ингибирования роста бактерий 2455825 Пестицидная аэрозольная композиция 2387128 Система сбора отходов для отделения жидких отходов от твердых отходов 2048767 Способ отбора самок норок для воспроизводства 2146444 Способ выявления и отбора стрессоустойчивых животных 2248352 Замещенные бензоилциклогександионы, гербицидное средство на их основе, исходное соединение 2216923 Способ выращивания льна-долгунца 2228022 Способ ведения виноградных кустов |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||

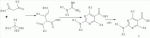

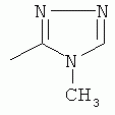 ;
; 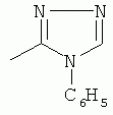 ;
; 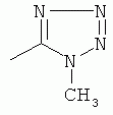 ;
; 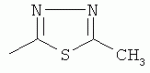 ;
; 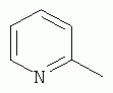 ;
;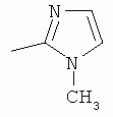 ;
; 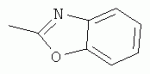 ;
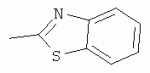
; 

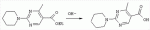
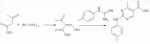





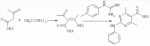

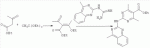
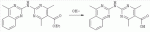


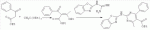


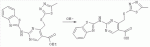

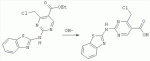






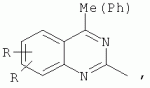
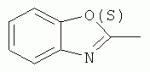 R=H; 6-Me; 6-Et; 6-MeO; 6-EtO; 7-Me; 7-MeO; 8-Me; 8-Et; 8-MeO; 8-EtO; 6,7-диМе; 6,8-диМе; 6,8-диМеО; 6-C1 R3=Alk, Ar, CH2Cl; CH2SAr, CH2 SHet:
R=H; 6-Me; 6-Et; 6-MeO; 6-EtO; 7-Me; 7-MeO; 8-Me; 8-Et; 8-MeO; 8-EtO; 6,7-диМе; 6,8-диМе; 6,8-диМеО; 6-C1 R3=Alk, Ar, CH2Cl; CH2SAr, CH2 SHet: