Способ селекции гаплоидов и двойных гаплоидов растенийПатент на изобретение №: 2158502 Автор: Нильс Олоф БОЗЕМАРК (SE), Бенедикт Раймон Виктор Лена ТИМЕРМАН (BE) Патентообладатель: НОВАРТИС АГ (CH) Дата публикации: 10 Ноября, 2000 Начало действия патента: 4 Июля, 1994 Адрес для переписки: 101000, Москва, Малый Златоустинский пер., д.10, кв.15, "ЕВРОМАРКПАТ", Веселицкой И.А. Изображения  Способ может быть использован для выращивания растений, являющихся гаплоидами и двойными гаплоидами. Применение в качестве маркера в селекции доминантного селектируемого, доминантного скринируемого или доминантного условно летального трансгена индукции неопределенного гаметофита позволяет создать надежную маркерную систему, лишенную недостатков традиционных систем. 15 з.п. ф-лы, 2 ил. , ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУПредметом настоящего изобретения является выращивание растений. В частности, предметом изобретения является получение гаплоидов и двойных гаплоидов (в виде растений или семян), предпочтительно индуцированных геном индукции гаплоидов, и их селекция и/или скрининг. Когда у материнского родителя присутствует мутантный ген "неопределенного гаметофита" (ig), это приводит к получению потомства с высокой долей дефектных семян и сильно увеличенной частотой гаплоидов как по материнской, так и по отцовской линии. Соотношение материнского и отцовского типов составляет 1:2. Было показано, что при скрещивании растений кукурузы с igig женскими типами при четырехкратном стандартном инбридинге частота андрогенеза составляет от 0,5 до 2% с одним андрогенетическим растением на 10 диплоидов. Однако влияние отцовского донора намного сильнее, чем представлялось до сих пор. Так, было показано, что средняя величина частоты андрогенеза из-за ig составляла менее 0,03%, для некоторых генотипов достигая 1,5%. Недавно удалось подтвердить, что наличие гена ig в генотипе раннеспелой кукурузы, например инбредной линии Co220, приводит к образованию гаплоидов, сохраняя такой же или более высокий уровень индукции гаплоидов. Однако использование этого способа для крупномасштабного получения гаплоидов в практической селекции растений требует наличия эффективной системы маркирования, которая позволяет различать гаплоиды и спонтанно удвоенные гаплоиды отцовского происхождения с одной стороны, и полученные половым путем диплоиды и материнские гаплоиды и двойные гаплоиды, с другой стороны. Наиболее удобной маркерной системой, используемой до настоящего времени, по крайней мере для кукурузы, является Маркерная линия с Пурпурным Эмбрионом (ПЭМ) с генотипом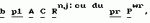 созданная изначально для выявления материнских гаплоидов, но используемая также и для выявления ig-индуцируемых гаплоидов. Основным геном в этой системе является созданная изначально для выявления материнских гаплоидов, но используемая также и для выявления ig-индуцируемых гаплоидов. Основным геном в этой системе является 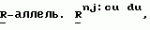 которая в сочетании с доминантными генами которая в сочетании с доминантными генами  обуславливающими пигментацию, вызывает красную или пурпурную пигментацию алейрона, главным образом, верхней части зерна, и глубокую пурпурную пигментацию зародыша. Любая линия кукурузы с бесцветными зернами может являться родительским донором гаплоидов, при условии, что она не является гомозиготой RR, и потеря окраски происходит не из-за доминантного ингибитора пигментации. Для выявления материнских гаплоидов линию ПЕМ используют в качестве опылителя, а для выявления ig-индуцированных андрогенетических гаплоидов линию ПЕМ-ig используют в качестве зернового родителя в скрещиваниях с донорной линией или селекционной линией. В обеих системах искомые гаплоиды имеют белый зародыш и окрашенный алейрон. Несмотря на то, что ПЭМ система обеспечивает эффективную селекцию материнских гаплоидов в сухих зернах, высока доля дефективных и мелких зерен в igig женских наборах зерновой селекции андрогенетических гаплоидов. В данном изобретении предлагают маркерную систему, лишенную вышеуказанных недостатков, для использования в селекции гаплоидов. Согласно данному изобретению в качестве маркера в селекции гаплоидов либо двойных гаплоидов предложено использование по меньшей мере одного из следующих генов: доминантный селектируемый маркерный ген, доминантный скринируемый маркерный ген или доминантный условно летальный ген. Под "доминантным условно летальным геном" понимают любой ген, продукт которого способен вызывать конверсию нелетального или неингибирующего фактора в летальный либо ингибирующий фактор. В предпочтительном случае таким фактором является химическое соединение, например нафтилацетамид, хлорат либо индол-3-ацетамид, а летальный ген при этом может кодировать нитратредуктазу (NR) либо индолацетамидгидролазу (laaH). Под "доминантным селектируемым маркерным геном" понимают любой ген, продукт которого способен вызывать конверсию токсичного, ингибирующего либо еще какого-нибудь фактора, нарушающего метаболизм, в менее токсичную, менее ингибирующую или менее разрушительную для метаболизма форму. Желательно, чтобы указанный генный продукт был способен делать фактор в значительной степени нетоксичным или неингибирующим, не опасным для метаболизма. Очень удачно, если фактор является гербицидом или антибиотиком. В этих случаях селектируемый маркерный ген может кодировать фермент, инактивирующий гербицид, который способен, например, придавать устойчивость либо выносливость к гербициду ткани, его содержащей. Таким образом селектируемый маркерный ген может кодировать фосфинотрицинацетилтрансферазу (PAT), глифосатоксидоредуктазу (GOX), либо EPSPS, то есть придавать выносливость либо устойчивость, например, к глуфосинату или глифосату (глуфосинат производится фирмой Hoechst AG под торговым наименованием "BASTA"). Под "доминантным скринируемым маркерным геном" понимают любой ген, продукт которого способен придавать содержащей его ткани фенотипически проявляющуюся характеристику. Желательно, чтобы указанный продукт был способен действовать на субстрат, который вследствие такого воздействия превращался бы в хромофор, флюорофор либо другое легко идентифицируемое соединение, прямым или косвенным образом. Очень удачно, если селектируемый маркерный ген кодирует бета-глюкуронидазу, которая способна расщеплять нетоксичные глюкуронид-флюоресцеиновые красители, освобождая таким образом эти красители, которые могут быть обнаружены и определены количественно, если это необходимо или желательно. Такие доминантные гены могут быть использованы в селекции индуцированных гаплоидов, такими генами могут быть, например, гены индукции гаплоидов, придающие "неопределенный гаметофит" (ig). Желательно, чтобы растение являлось кукурузой, однако могут быть использованы и другие растения, особенно культурные, содержащие гены индукции гаплоидов. Изобретение включает в себя способ селекции гаплоидов и двойных гаплоидов растений, в котором линию, несущую ген индукции гаплоидов, и гомозиготную по маркерному трансгену используют для скрещивания с линией-производителем. При этом маркерным геном может служить доминантный условно летальный трансген, продукт которого способен обеспечивать конверсию нелетальных или неингибирующих факторов в летальные или ингибирующие факторы или доминантный селектируемый маркерный трансген, продукт которого способен обеспечить конверсию токсичного, ингибирующего или иным образом нарушающего метаболизм фактора в менее токсичный, ингибирующий в меньшей степени или нарушающий в меньшей степени фактор, или доминантный скринируемый маркерный трансген, продукт которого способен давать ткань, обладающую определенными фенотипическими характеристиками. При селекции гаплоидных и двойных гаплоидных андрогенетических растений линию, гомозиготную по маркерному трансгену и несущую признак индукции гаплоидов, используют в качестве женского родителя при скрещивании с линией-производителем. Этот способ включает следующие стадии: а) трансформации растения, гетерозиготного по гену индукции гаплоидов, маркерным геном; б) самоопыления растений, отобранных на стадии а); в) удаления мужских стерильных растений из популяции растений, полученных на стадии б); г) самоопыления растений, оставшихся после стадии в); д) выбраковывания растений, полученных на стадии г), которые являются гомозиготными по доминантному гену индукции гаплоидов; е) отбора потомства, оставшегося после стадии д), содержащего маркерный ген; ж) самоопыления растений, выбранных на стадии е); з) отбора потомства, полученного на стадии ж), которое является гомозиготным по доминантному маркерному гену; и) скрещивания растений, полученных на стадии з), и отбора растений, которые являются гомозиготными по маркерному гену и гомозиготными по рецессивному гену индукции гаплоидов; к) опыления растений, полученных на стадии и), диплоидными растениями; и л) обнаружения или отбора гаплоидов и двойных гаплоидов андрогенетических растений, полученных на этапе к). При селекции гаплоидных и двойных гаплоидных гиногенетических растений линию, гомозиготную по маркерному трансгену и несущую признак индукции гаплоидов, используют в качестве линии-опылителя при скрещивании с линией-производителем. Этот способ включает следующие стадии: а) скрещивания отобранного, полученного в результате инбридинга генотипа, способного индуцировать гиногенетические гаплоиды (линия-индуктор), в качестве женского родителя, с генотипом, гомозиготным по маркерному трансгену в качестве опыляющего растения, или же трансформации указанного отобранного генотипа маркерным геном и отбора стабильных трансформантов; б) обратного скрещивания растений, полученных на стадии а), с линией-индуктором; в) удаления растений, утративших маркерный ген, из потомства, полученного на стадии б); г) самоопыления некоторого числа растений, оставшихся после стадии в); д) удаления растений, утративших маркерный ген, из потомства, полученного на стадии г); е) скрещивания некоторого числа растений, которые не являются индукторами или маркерными растениями, в качестве материнских родителей, с соответствующим количеством растений, оставшихся после стадии д), в качестве опыляющих растений, и получение самоопыленных семян всех опыляющих родителей; ж) использования самоопыленных растений, полученных на этапе е) для скрининга опыляющих родителей на гомозиготность по маркерному гену, а также как на способность к индукции гиногенетических гаплоидов; з) использования оставшихся самоопыленных семян, полученных от опыляющих родителей на стадии е), у которых гомозиготность по маркерному гену сочетается с удовлетворительной способностью к индукции гиногенетических гаплоидов, в качестве линии-опылителя, в скрещивании с линией- производителем; и) обнаружения или отбора гиногенетических гаплоидов и двойных гаплоидов из растений, полученных на стадии з). В предпочтительном варианте осуществления изобретения линия-опылитель имеет генотип, способный к индукции гиногенетических гаплоидов с частотой более чем 0,1%, в более предпочтительном частота составляет около 0,5%. В качестве растения можно использовать кукурузу. Ген индукции гаплоидов может быть геном "неопределенного гаметофита" (ig). Предпочтительно в качестве маркерного гена следует применять условно летальный ген, который обеспечивает чувствительность к химическому соединению или селектируемый маркерный ген, который обеспечивает устойчивость либо выносливость к гербициду или антибиотику, или скринируемый ген, кодирующий белок, способный расщеплять хромогенный или флуорогенный субстрат. Далее изобретение сопровождает ряд примеров, которые описывают получение и селекцию гаплоидных растений кукурузы, а фиг. 1 и 2 иллюстрируют генотипы, полученные вследствие применения схем скрещивания, описанных в примерах 1 и 2 соответственно. Пример 1. Использование гена IaaH в селекции андрогенетических гаплоидов и двойных гаплоидов кукурузы Наиболее удобным условно летальным геном для использования в селекции гаплоидов кукурузы является ген, кодирующий индолацетамид гидролазу (IaaH). Ген IaaH является доминантным бактериальным геном, определяющим заключительную стадию в биосинтезе бактериального ауксина, и отвечающим за превращение индолацетамида (ИАМ) в индолилуксусную кислоту (ИУК). Растения табака, несущие ген IaaH, являются фенотипически нормальными. Однако, если такие растения обрабатывают нафтилацетамидом (НАМ), это вещество превращается продуктом гена IaaH в нафтилуксусную кислоту (НУК), что приводит к резкой задержке роста таких обработанных растений. Для того, чтобы ген IaaH мог быть использован в качестве маркера в ig-индуцированном получении андрогенетических гаплоидов, линия, несущая ig-ген, должна быть гомозиготной по IaaH. Возможная индуцирующая гаплоидность линия кукурузы, гомозиготная по IaaH, может быть получена следующим образом. 1. Вводят ig-ген в раннеспелый, не требовательный к уходу генотип с высоким уровнем индукции гаплоидов. 2. Трансформируют Igig генотипы геном IaaH хорошо известными специалистам способами и отбирают хорошо развивающиеся трансформанты. 3. Самоопыляют трансформированное растение для получения расщепляющегося S1 потомства (см. фиг. 1). 4. Удаляют во время цветения стерильные мужские растения (гомозиготные по igig-гену) из полученной популяции. 5. Самоопыляют оставшиеся растения. 6. Отбраковывают во время сбора урожая растения, имеющие початки только с нормальными семенами. Это растения, гаплоидные по IgIg. 7. Высевают по 20 семян каждого из оставленных потомков и опрыскивают проростки НАМ, что позволяет идентифицировать потомков, не имеющих IaaH гена (на них НАМ не действует). Эти растения выбраковывают. Оставшееся потомство (IgigIaaHIaaH и IgigIaaH генотипы, встречающиеся в соотношении 1:2) идентифицируют, и семена высевают вновь. 8. Выращивают растения, полученные на стадии 7. 9. После сбора урожая с растений, полученных на стадии 8, высевают по 20-30 семян с каждого растения и опрыскивают НАМ. Потомство, которое отличается НАМ-индуцированным замедлением роста, является гетерозиготным по IaaH, его выбраковывают. Потомки, характеризующиеся единообразным замедлением роста, происходят от искомого генотипа IgigIaaHIaaH (в рамке на фиг.1), их вновь высевают, используя оставшиеся семена. 10. Отобранные и вновь посеянные потомки делятся в соотношении 1:2:1 на IgIg, Igig и igig. igig растения характеризуются мужской стерильностью и их используют для репродукции индуцирующей гаплоиды линии. С этой целью проводят скрещивания между группой растений со стерильной пыльцой igig и сестринскими растениями с фертильной пыльцой. Скрещивания могут быть двух типов: обуславливающими пигментацию, вызывает красную или пурпурную пигментацию алейрона, главным образом, верхней части зерна, и глубокую пурпурную пигментацию зародыша. Любая линия кукурузы с бесцветными зернами может являться родительским донором гаплоидов, при условии, что она не является гомозиготой RR, и потеря окраски происходит не из-за доминантного ингибитора пигментации. Для выявления материнских гаплоидов линию ПЕМ используют в качестве опылителя, а для выявления ig-индуцированных андрогенетических гаплоидов линию ПЕМ-ig используют в качестве зернового родителя в скрещиваниях с донорной линией или селекционной линией. В обеих системах искомые гаплоиды имеют белый зародыш и окрашенный алейрон. Несмотря на то, что ПЭМ система обеспечивает эффективную селекцию материнских гаплоидов в сухих зернах, высока доля дефективных и мелких зерен в igig женских наборах зерновой селекции андрогенетических гаплоидов. В данном изобретении предлагают маркерную систему, лишенную вышеуказанных недостатков, для использования в селекции гаплоидов. Согласно данному изобретению в качестве маркера в селекции гаплоидов либо двойных гаплоидов предложено использование по меньшей мере одного из следующих генов: доминантный селектируемый маркерный ген, доминантный скринируемый маркерный ген или доминантный условно летальный ген. Под "доминантным условно летальным геном" понимают любой ген, продукт которого способен вызывать конверсию нелетального или неингибирующего фактора в летальный либо ингибирующий фактор. В предпочтительном случае таким фактором является химическое соединение, например нафтилацетамид, хлорат либо индол-3-ацетамид, а летальный ген при этом может кодировать нитратредуктазу (NR) либо индолацетамидгидролазу (laaH). Под "доминантным селектируемым маркерным геном" понимают любой ген, продукт которого способен вызывать конверсию токсичного, ингибирующего либо еще какого-нибудь фактора, нарушающего метаболизм, в менее токсичную, менее ингибирующую или менее разрушительную для метаболизма форму. Желательно, чтобы указанный генный продукт был способен делать фактор в значительной степени нетоксичным или неингибирующим, не опасным для метаболизма. Очень удачно, если фактор является гербицидом или антибиотиком. В этих случаях селектируемый маркерный ген может кодировать фермент, инактивирующий гербицид, который способен, например, придавать устойчивость либо выносливость к гербициду ткани, его содержащей. Таким образом селектируемый маркерный ген может кодировать фосфинотрицинацетилтрансферазу (PAT), глифосатоксидоредуктазу (GOX), либо EPSPS, то есть придавать выносливость либо устойчивость, например, к глуфосинату или глифосату (глуфосинат производится фирмой Hoechst AG под торговым наименованием "BASTA"). Под "доминантным скринируемым маркерным геном" понимают любой ген, продукт которого способен придавать содержащей его ткани фенотипически проявляющуюся характеристику. Желательно, чтобы указанный продукт был способен действовать на субстрат, который вследствие такого воздействия превращался бы в хромофор, флюорофор либо другое легко идентифицируемое соединение, прямым или косвенным образом. Очень удачно, если селектируемый маркерный ген кодирует бета-глюкуронидазу, которая способна расщеплять нетоксичные глюкуронид-флюоресцеиновые красители, освобождая таким образом эти красители, которые могут быть обнаружены и определены количественно, если это необходимо или желательно. Такие доминантные гены могут быть использованы в селекции индуцированных гаплоидов, такими генами могут быть, например, гены индукции гаплоидов, придающие "неопределенный гаметофит" (ig). Желательно, чтобы растение являлось кукурузой, однако могут быть использованы и другие растения, особенно культурные, содержащие гены индукции гаплоидов. Изобретение включает в себя способ селекции гаплоидов и двойных гаплоидов растений, в котором линию, несущую ген индукции гаплоидов, и гомозиготную по маркерному трансгену используют для скрещивания с линией-производителем. При этом маркерным геном может служить доминантный условно летальный трансген, продукт которого способен обеспечивать конверсию нелетальных или неингибирующих факторов в летальные или ингибирующие факторы или доминантный селектируемый маркерный трансген, продукт которого способен обеспечить конверсию токсичного, ингибирующего или иным образом нарушающего метаболизм фактора в менее токсичный, ингибирующий в меньшей степени или нарушающий в меньшей степени фактор, или доминантный скринируемый маркерный трансген, продукт которого способен давать ткань, обладающую определенными фенотипическими характеристиками. При селекции гаплоидных и двойных гаплоидных андрогенетических растений линию, гомозиготную по маркерному трансгену и несущую признак индукции гаплоидов, используют в качестве женского родителя при скрещивании с линией-производителем. Этот способ включает следующие стадии: а) трансформации растения, гетерозиготного по гену индукции гаплоидов, маркерным геном; б) самоопыления растений, отобранных на стадии а); в) удаления мужских стерильных растений из популяции растений, полученных на стадии б); г) самоопыления растений, оставшихся после стадии в); д) выбраковывания растений, полученных на стадии г), которые являются гомозиготными по доминантному гену индукции гаплоидов; е) отбора потомства, оставшегося после стадии д), содержащего маркерный ген; ж) самоопыления растений, выбранных на стадии е); з) отбора потомства, полученного на стадии ж), которое является гомозиготным по доминантному маркерному гену; и) скрещивания растений, полученных на стадии з), и отбора растений, которые являются гомозиготными по маркерному гену и гомозиготными по рецессивному гену индукции гаплоидов; к) опыления растений, полученных на стадии и), диплоидными растениями; и л) обнаружения или отбора гаплоидов и двойных гаплоидов андрогенетических растений, полученных на этапе к). При селекции гаплоидных и двойных гаплоидных гиногенетических растений линию, гомозиготную по маркерному трансгену и несущую признак индукции гаплоидов, используют в качестве линии-опылителя при скрещивании с линией-производителем. Этот способ включает следующие стадии: а) скрещивания отобранного, полученного в результате инбридинга генотипа, способного индуцировать гиногенетические гаплоиды (линия-индуктор), в качестве женского родителя, с генотипом, гомозиготным по маркерному трансгену в качестве опыляющего растения, или же трансформации указанного отобранного генотипа маркерным геном и отбора стабильных трансформантов; б) обратного скрещивания растений, полученных на стадии а), с линией-индуктором; в) удаления растений, утративших маркерный ген, из потомства, полученного на стадии б); г) самоопыления некоторого числа растений, оставшихся после стадии в); д) удаления растений, утративших маркерный ген, из потомства, полученного на стадии г); е) скрещивания некоторого числа растений, которые не являются индукторами или маркерными растениями, в качестве материнских родителей, с соответствующим количеством растений, оставшихся после стадии д), в качестве опыляющих растений, и получение самоопыленных семян всех опыляющих родителей; ж) использования самоопыленных растений, полученных на этапе е) для скрининга опыляющих родителей на гомозиготность по маркерному гену, а также как на способность к индукции гиногенетических гаплоидов; з) использования оставшихся самоопыленных семян, полученных от опыляющих родителей на стадии е), у которых гомозиготность по маркерному гену сочетается с удовлетворительной способностью к индукции гиногенетических гаплоидов, в качестве линии-опылителя, в скрещивании с линией- производителем; и) обнаружения или отбора гиногенетических гаплоидов и двойных гаплоидов из растений, полученных на стадии з). В предпочтительном варианте осуществления изобретения линия-опылитель имеет генотип, способный к индукции гиногенетических гаплоидов с частотой более чем 0,1%, в более предпочтительном частота составляет около 0,5%. В качестве растения можно использовать кукурузу. Ген индукции гаплоидов может быть геном "неопределенного гаметофита" (ig). Предпочтительно в качестве маркерного гена следует применять условно летальный ген, который обеспечивает чувствительность к химическому соединению или селектируемый маркерный ген, который обеспечивает устойчивость либо выносливость к гербициду или антибиотику, или скринируемый ген, кодирующий белок, способный расщеплять хромогенный или флуорогенный субстрат. Далее изобретение сопровождает ряд примеров, которые описывают получение и селекцию гаплоидных растений кукурузы, а фиг. 1 и 2 иллюстрируют генотипы, полученные вследствие применения схем скрещивания, описанных в примерах 1 и 2 соответственно. Пример 1. Использование гена IaaH в селекции андрогенетических гаплоидов и двойных гаплоидов кукурузы Наиболее удобным условно летальным геном для использования в селекции гаплоидов кукурузы является ген, кодирующий индолацетамид гидролазу (IaaH). Ген IaaH является доминантным бактериальным геном, определяющим заключительную стадию в биосинтезе бактериального ауксина, и отвечающим за превращение индолацетамида (ИАМ) в индолилуксусную кислоту (ИУК). Растения табака, несущие ген IaaH, являются фенотипически нормальными. Однако, если такие растения обрабатывают нафтилацетамидом (НАМ), это вещество превращается продуктом гена IaaH в нафтилуксусную кислоту (НУК), что приводит к резкой задержке роста таких обработанных растений. Для того, чтобы ген IaaH мог быть использован в качестве маркера в ig-индуцированном получении андрогенетических гаплоидов, линия, несущая ig-ген, должна быть гомозиготной по IaaH. Возможная индуцирующая гаплоидность линия кукурузы, гомозиготная по IaaH, может быть получена следующим образом. 1. Вводят ig-ген в раннеспелый, не требовательный к уходу генотип с высоким уровнем индукции гаплоидов. 2. Трансформируют Igig генотипы геном IaaH хорошо известными специалистам способами и отбирают хорошо развивающиеся трансформанты. 3. Самоопыляют трансформированное растение для получения расщепляющегося S1 потомства (см. фиг. 1). 4. Удаляют во время цветения стерильные мужские растения (гомозиготные по igig-гену) из полученной популяции. 5. Самоопыляют оставшиеся растения. 6. Отбраковывают во время сбора урожая растения, имеющие початки только с нормальными семенами. Это растения, гаплоидные по IgIg. 7. Высевают по 20 семян каждого из оставленных потомков и опрыскивают проростки НАМ, что позволяет идентифицировать потомков, не имеющих IaaH гена (на них НАМ не действует). Эти растения выбраковывают. Оставшееся потомство (IgigIaaHIaaH и IgigIaaH генотипы, встречающиеся в соотношении 1:2) идентифицируют, и семена высевают вновь. 8. Выращивают растения, полученные на стадии 7. 9. После сбора урожая с растений, полученных на стадии 8, высевают по 20-30 семян с каждого растения и опрыскивают НАМ. Потомство, которое отличается НАМ-индуцированным замедлением роста, является гетерозиготным по IaaH, его выбраковывают. Потомки, характеризующиеся единообразным замедлением роста, происходят от искомого генотипа IgigIaaHIaaH (в рамке на фиг.1), их вновь высевают, используя оставшиеся семена. 10. Отобранные и вновь посеянные потомки делятся в соотношении 1:2:1 на IgIg, Igig и igig. igig растения характеризуются мужской стерильностью и их используют для репродукции индуцирующей гаплоиды линии. С этой целью проводят скрещивания между группой растений со стерильной пыльцой igig и сестринскими растениями с фертильной пыльцой. Скрещивания могут быть двух типов: 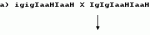 100% IgigIaaHIaaH, все растения имеют фертильную пыльцу и их выбраковывают 100% IgigIaaHIaaH, все растения имеют фертильную пыльцу и их выбраковывают  11. Посредством повторных скрещиваний по типу (б) между неограниченным количеством растений с генотипом igigIaaHIaaH может быть обеспечен высокий уровень получения андрогенетических гаплоидов. 12. Когда igigIaaHIaaH растения опыляют нормальной диплоидной популяцией или линией кукурузы, все диплоидные половые потомки имеют генотип IgigIaaH, а все материнские гаплоиды либо двойные гаплоиды имеют генотипы IgIaaH и igigIaaHIaaH соответственно. Все такие растения чувствительны к обработкам НАМ и поэтому могут быть исключены. Только потомки, не чувствительные к обработке НАМ, являются искомыми андрогенетическими гаплоидами и спонтанными двойными гаплоидами, имеющими генотипы Ig и Igig соответственно. Пример 2. Использование констуитивно экспрессируемого гена нитратредуктазы (Nia) в селекции андрогенетических гаплоидов и двойных гаплоидов кукурузы Нитратредуктаза (NR), которая катализирует первую стадию пути ассимиляции азота путем превращения нитрата в нитрит, обладает хлоратной токсичностью. Nia ген кодирует апофермент NR, и растения табака, трансгенные по констуитивно экспрессируемому Nia гену, являются фенотипически нормальными. Однако эти растения погибают при выращивании их на среде, содержащей в качестве единственного источника азота аммоний, и при обработке хлоратом. В данном примере повторяют схему примера 1, за исключением того, что Igig генотипы на стадии 2 трансформируют не геном IaaH, а геном Nia, а селекцию на стадиях 7, 9 и 12 проводят путем обработки хлоратом растений, растущих на среде, содержащей в качестве единственного источника азота аммоний. Пример 3. Использование доминантного условно летального гена в качестве маркера в селекции гиногенетических гаплоидов и двойных гаплоидов кукурузы В примерах 1 и 2 описывают способы получения андрогенетических ig-индуцированных гаплоидов, в которых ig-линию, трансформированную геном IaaH или Nia, используют в качестве материнских растений в скрещиваниях с селекционной линией. В данном случае повторяют примеры 1 и 2, за исключением того, что геном IaaH или Nia трансформируют линию-опылитель, индуцирующую гаплоиды, и используют ее в качестве опылителя в скрещиваниях с селекционной линией. Пример 4. Использование гена PAT в селекции андрогенетических гаплоидов и двойных гаплоидов кукурузы Удобным геном для использования в качестве маркера в селекции гаплоидов кукурузы является ген, кодирующий фосфинотрицинацетилтрансферазу (Pat). Ген Pat является доминантным бактериальным геном, отвечающим за разложение фосфинотрицина. Растения кукурузы, несущие ген Pat, фенотипически нормальны и при обработке глуфосинатом сохраняют свою жизнеспособность в отличие от обработанных растений, не имеющих данного гена. Для того, чтобы ген Pat мог быть использован в качестве маркера при получении ig-индуцированных андрогенетических гаплоидов, линия, несущая ген ig, должна быть гомозиготной по PAT. Удовлетворяющая этому требованию, индуцирующая гаплоиды линия кукурузы, гомозиготная по гену Pat, может быть получена по следующей схеме. 1. Вводят ген ig в раннеспелый, не требовательный к уходу генотип с высоким уровнем индукции гаплоидов. 2. Способами, хорошо известными специалистам, трансформируют Igig генотипы геном Pat и отбирают жизнеспособные трансформанты. 3. Самоопыляют трансформированное растение для получения расщепляющегося потомства S1 (см. фиг.2). Проверяют устойчивость потомства S1 к глуфосинату способом "кисть или краска", хорошо известным специалистам. Выбраковывают чувствительные растения (сегреганты, нестабильные трансформанты или слабые экспрессоры гена Pat). 4. Во время цветения выбраковывают мужские стерильные растения (гомозиготные по igig гену) из всей популяции. 5. Самоопыляют все оставшиеся растения. 6. В ходе сбора урожая выбраковывают растения, имеющие початки только с нормальными семенами. Они являются гомозиготами по IgIg. 7. Высевают все семена с каждого потомка, сохранившегося по п. 6, когда посеянные растения достигают стадии от 4 до 6 настоящих листьев, опрыскивают их раствором глуфосината в концентрации примерно 1,5 грамма на литр. Спустя некоторое время все растения, лишенные Pat гена, погибают в силу их чувствительности к этому гербициду. Оставшиеся гибриды (имеющие генотипы IgigPatPat и IgigPat-, встречающиеся в соотношении 1:2, сохраняют. 8. Выращивают растения, полученные на стадии 7. 9. После сбора урожая с растений, полученных на стадии 8, высевают по 20-30 семян с растения и проводят опрыскивание их глуфосинатом. Потомство, различающееся по чувствительности к гербициду, является гетерозиготным по гену Pat, и его выбраковывают. Потомство, проявляющее стабильную устойчивость к гербициду, происходит от искомого генотипа IgigPatPat (в рамке на фиг.2) и его сохраняют. 10. Потомство, полученное по п. 9, делится в соотношении 1:2:1 по генам IgIg, Igig и igig. Растения, имеющие генотип igig, проявляют мужскую стерильность и их используют для репродукции индуцирующей гаплоиды линии. С этой целью проводят скрещивания между группой igig растений со стерильной пыльцой и сестринскими растениями с фертильной пыльцой. Скрещивания могут быть двух типов: 11. Посредством повторных скрещиваний по типу (б) между неограниченным количеством растений с генотипом igigIaaHIaaH может быть обеспечен высокий уровень получения андрогенетических гаплоидов. 12. Когда igigIaaHIaaH растения опыляют нормальной диплоидной популяцией или линией кукурузы, все диплоидные половые потомки имеют генотип IgigIaaH, а все материнские гаплоиды либо двойные гаплоиды имеют генотипы IgIaaH и igigIaaHIaaH соответственно. Все такие растения чувствительны к обработкам НАМ и поэтому могут быть исключены. Только потомки, не чувствительные к обработке НАМ, являются искомыми андрогенетическими гаплоидами и спонтанными двойными гаплоидами, имеющими генотипы Ig и Igig соответственно. Пример 2. Использование констуитивно экспрессируемого гена нитратредуктазы (Nia) в селекции андрогенетических гаплоидов и двойных гаплоидов кукурузы Нитратредуктаза (NR), которая катализирует первую стадию пути ассимиляции азота путем превращения нитрата в нитрит, обладает хлоратной токсичностью. Nia ген кодирует апофермент NR, и растения табака, трансгенные по констуитивно экспрессируемому Nia гену, являются фенотипически нормальными. Однако эти растения погибают при выращивании их на среде, содержащей в качестве единственного источника азота аммоний, и при обработке хлоратом. В данном примере повторяют схему примера 1, за исключением того, что Igig генотипы на стадии 2 трансформируют не геном IaaH, а геном Nia, а селекцию на стадиях 7, 9 и 12 проводят путем обработки хлоратом растений, растущих на среде, содержащей в качестве единственного источника азота аммоний. Пример 3. Использование доминантного условно летального гена в качестве маркера в селекции гиногенетических гаплоидов и двойных гаплоидов кукурузы В примерах 1 и 2 описывают способы получения андрогенетических ig-индуцированных гаплоидов, в которых ig-линию, трансформированную геном IaaH или Nia, используют в качестве материнских растений в скрещиваниях с селекционной линией. В данном случае повторяют примеры 1 и 2, за исключением того, что геном IaaH или Nia трансформируют линию-опылитель, индуцирующую гаплоиды, и используют ее в качестве опылителя в скрещиваниях с селекционной линией. Пример 4. Использование гена PAT в селекции андрогенетических гаплоидов и двойных гаплоидов кукурузы Удобным геном для использования в качестве маркера в селекции гаплоидов кукурузы является ген, кодирующий фосфинотрицинацетилтрансферазу (Pat). Ген Pat является доминантным бактериальным геном, отвечающим за разложение фосфинотрицина. Растения кукурузы, несущие ген Pat, фенотипически нормальны и при обработке глуфосинатом сохраняют свою жизнеспособность в отличие от обработанных растений, не имеющих данного гена. Для того, чтобы ген Pat мог быть использован в качестве маркера при получении ig-индуцированных андрогенетических гаплоидов, линия, несущая ген ig, должна быть гомозиготной по PAT. Удовлетворяющая этому требованию, индуцирующая гаплоиды линия кукурузы, гомозиготная по гену Pat, может быть получена по следующей схеме. 1. Вводят ген ig в раннеспелый, не требовательный к уходу генотип с высоким уровнем индукции гаплоидов. 2. Способами, хорошо известными специалистам, трансформируют Igig генотипы геном Pat и отбирают жизнеспособные трансформанты. 3. Самоопыляют трансформированное растение для получения расщепляющегося потомства S1 (см. фиг.2). Проверяют устойчивость потомства S1 к глуфосинату способом "кисть или краска", хорошо известным специалистам. Выбраковывают чувствительные растения (сегреганты, нестабильные трансформанты или слабые экспрессоры гена Pat). 4. Во время цветения выбраковывают мужские стерильные растения (гомозиготные по igig гену) из всей популяции. 5. Самоопыляют все оставшиеся растения. 6. В ходе сбора урожая выбраковывают растения, имеющие початки только с нормальными семенами. Они являются гомозиготами по IgIg. 7. Высевают все семена с каждого потомка, сохранившегося по п. 6, когда посеянные растения достигают стадии от 4 до 6 настоящих листьев, опрыскивают их раствором глуфосината в концентрации примерно 1,5 грамма на литр. Спустя некоторое время все растения, лишенные Pat гена, погибают в силу их чувствительности к этому гербициду. Оставшиеся гибриды (имеющие генотипы IgigPatPat и IgigPat-, встречающиеся в соотношении 1:2, сохраняют. 8. Выращивают растения, полученные на стадии 7. 9. После сбора урожая с растений, полученных на стадии 8, высевают по 20-30 семян с растения и проводят опрыскивание их глуфосинатом. Потомство, различающееся по чувствительности к гербициду, является гетерозиготным по гену Pat, и его выбраковывают. Потомство, проявляющее стабильную устойчивость к гербициду, происходит от искомого генотипа IgigPatPat (в рамке на фиг.2) и его сохраняют. 10. Потомство, полученное по п. 9, делится в соотношении 1:2:1 по генам IgIg, Igig и igig. Растения, имеющие генотип igig, проявляют мужскую стерильность и их используют для репродукции индуцирующей гаплоиды линии. С этой целью проводят скрещивания между группой igig растений со стерильной пыльцой и сестринскими растениями с фертильной пыльцой. Скрещивания могут быть двух типов: 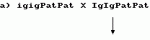 100% IgigPatPat, все растения с фертильной пыльцой, их выбраковывают. 100% IgigPatPat, все растения с фертильной пыльцой, их выбраковывают.  11. Посредством повторных скрещиваний по типу (б) получают неограниченное количество растений с генотипом igigPatPat, необходимых для высокоэффективного производства андрогенетических гаплоидов. 12. При опылении растений igigPatPat нормальной диплоидной популяцией или линией кукурузы все диплоидные, полученные половым путем потомки имеют генотип IgigPat, а все материнские гаплоиды либо двойные гаплоиды имеют фенотипы igPat и igigPatPat соответственно. Такие растения устойчивы к обработке глуфосинатом и могут таким образом быть идентифицированы и выбракованы. Только те гибриды, которые проявляют чувствительность к обработке гербицидом, являются искомыми андрогенетическими гаплоидами и спонтанными двойными гаплоидами, имеющими генотипы Ig и IgIg соответственно. Для того, чтобы выявить гербицид-чувствительные гаплоидные растения, а также двойные гаплоиды, гербицидом следует обрабатывать каждое отдельное растение, нанося его предпочтительно на кончики листьев, путем либо опрыскивания, либо намазывания в концентрации примерно 1,5 грамма глуфосината на литр. Чувствительные растения легко идентифицировать спустя несколько дней после обработки по некрозам и последующему усыханию верхушек листьев. Растения, повреждения которых локализованы только на верхушках листьев, развиваются дальше и являются фертильными, если происходит удвоение хромосом. Пример 5. Использование констуитивно экспрессируемого гена Бета-глюкуронидазы в скрининге андрогенетических гаплоидов и двойных гаплоидов кукурузы Повторяют пример 4, за исключением того, что Pat ген заменен геном, кодирующим бета-глюкоронидазу (GUS), которая способна расщеплять глюкуронид, в состав которого входит регулятор роста растений или другой компонент, который при отщеплении от глюкуронида становится хромогенным, флуорогенным, либо еще как-либо легко обнаруживаемым для специалиста соединением. 1. Ген GUS лучше всего экспрессировать с помощью эмбрион-специфического промотора, так как следует избегать экспрессии гена GUS в эндосперме. Это существенно в силу того, что андрогенетический гаплоид или двойной гаплоид может с определенной частотой развиваться в ассоциации с эндоспермом, который происходит от одного из женских биполярных ядер в овуле. Экспрессия GUS эндоспермом может, таким образом, маскировать неэкспрессирующий андрогенетический гаплоидный или двойной гаплоидный эмбрион и продуцировать ложный позитивный уровень GUS. 2. Igig генотипы на стадии 2 примера 4 трансформируют геном бета-глюкуронидазы вместо гена Pat, проводят скрининг на семенах по п.п. 7, 9 и 12 посредством нанесения небольшого надреза в перикарпе семени, чтобы дать возможность глюкуронидному субстрату диффундировать в эмбрион. В случае, когда глюкуронид содержит компонент, способный к флуоресценции, он отщепляется бета-глюкуронидазой от глюкуронида диплоидных эмбрионов и может быть идентифицирован по его флуоресценции из-за экспрессии интродуцированного GUS гена. Напротив, андрогенетические гаплоидные эмбрионы не имеют GUS и не будут флуоресцировать. В любом случае различия между разными типами клеток легко установить с помощью известных методов, включая авторадиографию и спектроскопию. Пример 6. Использование доминантного селектируемого или скринируемого гена в качестве маркера в селекции гиногенетических гаплоидов и двойных гаплоидов кукурузы В примерах 4 и 5 описывают способы получения андрогенетических ig-индуцируемых гаплоидов, в которых ig-линию, трансформированную Pat или GUS геном, используют в качестве материнских растений в скрещиваниях с селекционной линией. В данном случае повторяют примеры 4 и 5, за исключением того, что индуцирующую гаплоиды линию-опылитель трансформируют Pat или GUS геном и используют в качестве опылителя в скрещиваниях с селекционной линией. Следует отметить, что изобретение не ограничено селекцией гаплоидов кукурузы (андрогенетических или гиногенетических), как описано выше, оно также может быть использовано в селекции гаплоидов у других растений, особенно культурных растений, содержащих гены индукции гаплоидов. Кроме того, любой удобный доминантный селектируемый или скринируемый ген может заменить гены Pat или GUS соответственно, и подобным же образом гены IaaH и Nia могут быть заменены любым удобным доминантным условно летальным геном. Следует также отметить, что доминантные гены могут быть использованы в селекции гаплоидов на специфических стадиях развития. В этом отношении особенно существенно то, что указанные гены находятся под контролем промотора, функционирующего в эмбрионе, что обеспечивает возможность проводить селекцию гаплоидов на уровне зерен, а не целых растений (как описано ранее). 11. Посредством повторных скрещиваний по типу (б) получают неограниченное количество растений с генотипом igigPatPat, необходимых для высокоэффективного производства андрогенетических гаплоидов. 12. При опылении растений igigPatPat нормальной диплоидной популяцией или линией кукурузы все диплоидные, полученные половым путем потомки имеют генотип IgigPat, а все материнские гаплоиды либо двойные гаплоиды имеют фенотипы igPat и igigPatPat соответственно. Такие растения устойчивы к обработке глуфосинатом и могут таким образом быть идентифицированы и выбракованы. Только те гибриды, которые проявляют чувствительность к обработке гербицидом, являются искомыми андрогенетическими гаплоидами и спонтанными двойными гаплоидами, имеющими генотипы Ig и IgIg соответственно. Для того, чтобы выявить гербицид-чувствительные гаплоидные растения, а также двойные гаплоиды, гербицидом следует обрабатывать каждое отдельное растение, нанося его предпочтительно на кончики листьев, путем либо опрыскивания, либо намазывания в концентрации примерно 1,5 грамма глуфосината на литр. Чувствительные растения легко идентифицировать спустя несколько дней после обработки по некрозам и последующему усыханию верхушек листьев. Растения, повреждения которых локализованы только на верхушках листьев, развиваются дальше и являются фертильными, если происходит удвоение хромосом. Пример 5. Использование констуитивно экспрессируемого гена Бета-глюкуронидазы в скрининге андрогенетических гаплоидов и двойных гаплоидов кукурузы Повторяют пример 4, за исключением того, что Pat ген заменен геном, кодирующим бета-глюкоронидазу (GUS), которая способна расщеплять глюкуронид, в состав которого входит регулятор роста растений или другой компонент, который при отщеплении от глюкуронида становится хромогенным, флуорогенным, либо еще как-либо легко обнаруживаемым для специалиста соединением. 1. Ген GUS лучше всего экспрессировать с помощью эмбрион-специфического промотора, так как следует избегать экспрессии гена GUS в эндосперме. Это существенно в силу того, что андрогенетический гаплоид или двойной гаплоид может с определенной частотой развиваться в ассоциации с эндоспермом, который происходит от одного из женских биполярных ядер в овуле. Экспрессия GUS эндоспермом может, таким образом, маскировать неэкспрессирующий андрогенетический гаплоидный или двойной гаплоидный эмбрион и продуцировать ложный позитивный уровень GUS. 2. Igig генотипы на стадии 2 примера 4 трансформируют геном бета-глюкуронидазы вместо гена Pat, проводят скрининг на семенах по п.п. 7, 9 и 12 посредством нанесения небольшого надреза в перикарпе семени, чтобы дать возможность глюкуронидному субстрату диффундировать в эмбрион. В случае, когда глюкуронид содержит компонент, способный к флуоресценции, он отщепляется бета-глюкуронидазой от глюкуронида диплоидных эмбрионов и может быть идентифицирован по его флуоресценции из-за экспрессии интродуцированного GUS гена. Напротив, андрогенетические гаплоидные эмбрионы не имеют GUS и не будут флуоресцировать. В любом случае различия между разными типами клеток легко установить с помощью известных методов, включая авторадиографию и спектроскопию. Пример 6. Использование доминантного селектируемого или скринируемого гена в качестве маркера в селекции гиногенетических гаплоидов и двойных гаплоидов кукурузы В примерах 4 и 5 описывают способы получения андрогенетических ig-индуцируемых гаплоидов, в которых ig-линию, трансформированную Pat или GUS геном, используют в качестве материнских растений в скрещиваниях с селекционной линией. В данном случае повторяют примеры 4 и 5, за исключением того, что индуцирующую гаплоиды линию-опылитель трансформируют Pat или GUS геном и используют в качестве опылителя в скрещиваниях с селекционной линией. Следует отметить, что изобретение не ограничено селекцией гаплоидов кукурузы (андрогенетических или гиногенетических), как описано выше, оно также может быть использовано в селекции гаплоидов у других растений, особенно культурных растений, содержащих гены индукции гаплоидов. Кроме того, любой удобный доминантный селектируемый или скринируемый ген может заменить гены Pat или GUS соответственно, и подобным же образом гены IaaH и Nia могут быть заменены любым удобным доминантным условно летальным геном. Следует также отметить, что доминантные гены могут быть использованы в селекции гаплоидов на специфических стадиях развития. В этом отношении особенно существенно то, что указанные гены находятся под контролем промотора, функционирующего в эмбрионе, что обеспечивает возможность проводить селекцию гаплоидов на уровне зерен, а не целых растений (как описано ранее).
ФОРМУЛА ИЗОБРЕТЕНИЯ1. Способ селекции гаплоидов и двойных гаплоидов растений, отличающийся тем, что линию, несущую ген индукции гаплоидов и гомозиготную по маркерному трансгену, используют для скрещивания с линией-производителем. 2. Способ по п.1, отличающийся тем, что маркерный ген является доминантным условно летальным трансгеном, продукт которого способен обеспечивать конверсию нелетальных или неингибирующих факторов в летальные или ингибирующие факторы. 3. Способ по п.1, отличающийся тем, что маркерный ген является доминантным селектируемым маркерным трансгеном, продукт которого способен обеспечить конверсию токсичного, ингибирующего или иным образом нарушающего метаболизм фактора в менее токсичный, ингибирующий в меньшей степени или нарушающий в меньшей степени фактор, или доминантным скринируемым маркерным трансгеном, продукт которого способен давать ткань, обладающую определенными фенотипическими характеристиками. 4. Способ по п.1, отличающийся тем, что при селекции гаплоидных и двойных гаплоидных андрогенетических растений линию, гомозиготную по маркерному трансгену и несущую признак индукции гаплоидов, используют в качестве женского родителя при скрещивании с линией-производителем. 5. Способ по п.4, отличающийся тем, что включает следующие стадии: а) трансформации растения, гетерозиготного по гену индукции гаплоидов, маркерным геном; б) самоопыления растений, отобранных на стадии а); в) удаления мужских стерильных растений из популяции растений, полученных на стадии б); г) самоопыления растений, оставшихся после стадии в); д) выбраковывания растений, полученных на стадии г); которые являются гомозиготными по доминантному гену индукции гаплоидов; е) отбора потомства, оставшегося после стадии д), содержащего маркерный ген; ж) самоопыления растений, выбранных на стадии е); з) отбора потомства, полученного на стадии ж), которое является гомозиготным по доминантному маркерному гену; и) скрещивания растений, полученных на стадии з), и отбора растений, которые являются гомозиготными по маркерному гену и гомозиготным по рецессивному гену индукции гаплоидов; к) опыления растения, полученных на стадии и), диплоидными растениями; и л) обнаружения или отбора гаплоидов и двойных гаплоидов андрогенетических растений, полученных на этапе к). 6. Способ по п. 1, отличающийся тем, что при селекции гаплоидных и двойных гаплоидных гиногенетических растений линию, гомозиготную по маркерному трансгену и несущую призрак индукции гаплоидов, используют в качестве линии-опылителя при скрещивании с линией-производителем. 7. Способ по п.4, отличающийся тем, что включает следующие стадии: а) скрещивания отобранного, полученного в результате инбридинга генотипа, способного индуцировать гиногенетические гаплоиды (линия-индуктор), в качестве женского родителя, с генотипом, гомозиготным по маркерному трансгену в качестве опыляющего растения, или же трансформации указанного отобранного генотипа маркерным геном и отбора стабильных трансформантов; б) обратного скрещивания растений, полученных на стадии а), с линией-индуктором; в) удаления растений, утративших маркерный ген, из потомства, полученного на стадии б); г) самоопыления некоторого числа растений, оставшихся после стадии в); д) удаления растений, утративших маркерный ген, из потомства, полученного на стадии г); е) скрещивания некоторого числа растений, которые не являются индукторами или маркерными растениями, в качестве материнских родителей, с соответствующим количеством растений, оставшихся после стадии д), в качестве опыляющих растений, и получение самоопыленных семян всех опыляющих родителей; ж) использование самоопыленных растений, полученных на этапе е), для скрининга опыляющих родителей на гомозиготность по маркерному гену, а также на способность к индукции гиногенетических гаплоидов; з) использования оставшихся самоопыленных семян, полученных от опыляющих родителей на стадии е), у которых гомозиготность по маркерному гену сочетается с удовлетворительной способностью к индукции гиногенетических гаплоидов, в качестве линии-опылителя, в скрещивании с линией-производителем; и) обнаружения или отбора гиногенетических гаплоидов и двойных гаплоидов из растений, полученных на стадии з). 8. Способ по п.7, отличающийся тем, что линия-опылитель имеет генотип, способный к индукции гиногенетических гаплоидов с частотой более чем 0,1%. 9. Способ по п.8, отличающийся тем, что частота составляет около 0,5%. 10. Способ по пп.1 - 7, отличающийся тем, что в качестве растения используют кукурузу. 11. Способ по п.10, отличающийся тем, что ген индукции гаплоидов является геном "неопределенного гаметофита" (ig). 12. Способ по любому из пп.1 - 11, отличающийся тем, что маркерный ген является условно летальным геном, который обеспечивает чувствительность к химическому соединению. 13. Способ по любому из пп.1 - 11, отличающийся тем, что маркерный ген является селектируемым маркерным геном, который обеспечивает устойчивость либо выносливость к гербициду или антибиотику, или скринируемым геном, кодирующим белок, способный расщеплять хромогенный или флуорогенный субстрат. 14. Способ по п.13, отличающийся тем, что гербицид выбран из группы, состоящей из глуфозината и глифозата. 15. Способ по п.12, отличающийся тем, что химическое соединение выбрано из группы, состоящей их хлората, нафтилацетамида и индол-3-ацетамида. 16. Способ по п.12, отличающийся тем, что летальный ген кодирует индолацетамидгидролазу (IaaH) либо нитратредуктазу (NR), селектируемый ген кодирует фосфинотрицинацетилтрансферазу (PAT), глифозатоксидоредуктазу (GOX) либо EPSPS, а скринируемый ген кодирует бета-глюкуронидазу. Приоритет по пунктам: 06.07.1993 - по пп.1, 2, 4 - 12 и 15 - 16; 04.07.1994 - по пп.3 и 13 и 14.Популярные патенты: 2492623 Портативный электроинструмент с управлением спусковым механизмом ... другое бывает частым в зависимости от различий в величине срезаемых частей на одном растении и легко можно себе представить неудобство и потерю времени из-за такого устройства.Задачей изобретения является устранение вышеуказанных неудобств и недостатков портативных электроинструментов, в особенности, электрических секаторов. В соответствии с изобретением эта задача решается благодаря портативному электроинструменту, предназначенному для выполнения основной функции и отличающемуся тем, что он содержит спаренный спусковой механизм, образованный, с одной стороны, основным спусковым механизмом для управления приводом, осуществляющим движения, по меньшей мере, подвижного активного ... 2177223 Блесна ... на оси симметрии или вне ее. Крючок 2 может быть выполнен (фиг. 6) с одним или двумя, или тремя и более жалами. Блестящий элемент 3 при двойном крючке, тройном и другой формы может быть установлен на цевье и поддеве одного крючка и/или на всех сразу. Крючок 2 может быть снабжен незацепляющим устройством 11, а также по меньшей мере одним дополнительным крючком 12, связанным с головкой 6 (фиг. 2). Блестящий элемент 3 может изгибаться в различных направлениях, а также может быть снабжен цветным оперением в отдельных частях элемента 3 в соответствии с расположением плавников рыбки, имитируемым блесной. Соединение блестящего элемента 3 с цевьем 4 и поддевом 5 крючка 2 может быть ... 2092036 Способ микроразмножения стевии stevia rebaudiana l. ... в условиях относительной влажности 70% фотопериоде 16 ч, освещении люминесцентными лампами ЛБ-80 при температуре 25 26oC. Через 2 недели из эксплантированной почки вырастает побег с каллусной тканью на базальной части (фиг. 1). Затем через 1 неделю увеличивается каллусная ткань и зарождается большое количество почек и регенерантов (фиг. 2). Через 1 неделю происходит сильный рост регенерантов с корнеобразованием у части из них (приблизительно 20%), пригодных для посадки прямо в грунт (фиг. 3). Оставшиеся регенеранты черенкуют и пересаживают в среду МС (фиг. 4) с содержанием фитогормонов, мг/л: ИУК 2, ГК 1. Через 2 недели побеги укореняются и готовы к высадке в грунт (фиг. ... 2161391 Комбинированная почвообрабатывающая посевная машина ... Оборудование прицепной части машины дисковыми сошниками, семенным ящиком, высевающими аппаратами, семяпроводом и приводом позволяет производить высев семян на уплотненное ложе, сформированное витками спирального катка выше на 2-3 см заделки глубины туков, минеральных удобрений лапами-сошниками, что в дальнейшем при развитии корневой системы возделываемой культуры обеспечивает более полное использование питательных веществ, растворенных в почвенной влаге, и в конечном результате увеличивается урожайность с.-х. культур. Шарнирное присоединение прицепной части с сеялочными рабочими органами, а именно дисковых сошников, семенного ящика, аппаратов с семяпроводами и приводом, к ... 2395497 Способ стимулирования роста подсолнечника регулятором роста ... г (5,0 ммоль) триэтиламина в 20 мл безводного бензола при комнатной температуре прибавляют по каплям при перемешивании раствор 0,88 г (5,05 ммоль) 2-хлорбензоилхлорида в 50 мл безводного бензола в течение 30 мин. Перемешивание продолжают еще 2-2,5 ч, затем осадок отфильтровывают, промывают 5 мл бензола, сушат, затем обильно промывают водой. После перекристаллизации из этанола получают 0,91 (54%) целевого соединения 3 в виде белых кристаллов с т.пл. 198-199°С. Найдено, %: С 53,44; Н 3,61; N 12,57; C15 H13Cl2N3O2; Вычислено, %: С 53,27; Н 3,87; N 12,42.ЯМР 1Н, , м.д. (группа): 2,35 (3Н, с, 4-СН3), 2,45 (3Н, с, 6-СН3), 7,08 (2Н, уш. с, NH2), 7,27 (1Н, с, 5-Н Ру), 7,48 8,00 ... |
Еще из этого раздела: 2452155 Лапа культиватора 2267261 Молочно-доильный комплекс 2432394 Ингибирование образования биогенного сульфида посредством комбинации биоцида и метаболического ингибитора 2305931 Способ регенерации растений клевера лугового при генетической трансформации 2389173 Способ выращивания земляники садовой 2054862 Гидравлический режущий аппарат 2460269 Малогабаритный картофелеуборочный комбайн 2195102 Устройство для отделения грунта и земли от корней и корневищ солодки в качестве лакричного сырья 2182889 Дезинфицирующее средство 2228588 Копатель корнеклубнеплодов |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||