Способ регенерации растений клевера лугового при генетической трансформацииПатент на изобретение №: 2305931 Автор: Солодкая Любовь Андреевна (RU), Агафодорова Мария Николаевна (RU), Куренина Людмила Владимировна (RU), Лапотышкина Людмила Ивановна (RU) Патентообладатель: ГНУ "Всероссийский научно-исследовательский институт кормов им. В.Р. Вильямса" (RU) Дата публикации: 20 Декабря, 2006 Начало действия патента: 9 Июня, 2005 Адрес для переписки: 141055, Московская обл., г. Лобня, п/о Луговая, Научный городок, ВНИИ кормов им. В.Р. Вильямса Изображения Изобретение относится к области сельского хозяйства и может быть использовано в селекции растений для направленного создания исходного материала клевера лугового. Проводят культивирование трансформированной морфогенной культуры клевера на питательной среде Гамборга В5 с добавлением канамицина и цефотаксима, причем морфогенную культуру получают без образования дедифференцированной ткани путем культивирования гипокотиля на питательной среде Гамборга В5 с 4,0 мг/л 6-бензиламинопурина, 1,0 мг/л кинетина и 0,05 мг/л Изобретение относится к области сельского хозяйства и может быть использовано в селекции растений для направленного создания исходного селекционного материала клевера лугового с заданными признаками методами генетической трансформации, в исследованиях по физиологии, фитопатологии и генетике растений. В литературе имеются сведения о регенерации растений клевера лугового в культуре тканей in vitro. Регенерацию растений осуществляли из каллусной ткани, образующейся на поверхностях разрезов листовых эксплантов (1). К недостаткам данного способа можно отнести следующее. В этих экспериментах для получения морфогенных культур использовали каллусную ткань, индуцированную из листовых эксплантов на питательной среде Гамборга В5 с высоким содержанием фитогормонов (6 мг/л 2,4-дихлорфеноксиуксусной кислоты (2.4-Д) и 8 мг/л кинетина). Растения-регенеранты клевера лугового, полученные из морфогенных культур одной и той же клеточной линии (клеточные культуры, полученные из каллусной ткани одного экспланта) вышеназванным способом, различались между собой по ряду морфологических и физиолого-биохимических признаков. При этом морфогенные культуры к 5-8 пассажу теряли свою регенерационную способность. Известен способ регенерации растений клевера лугового в процессе генетической трансформации с использованием разобщенных доминирующих центров (2). В соответствии с этим способом регенерацию растений осуществляют посредством получения дедифференцированной ткани (каллуса) на поверхностях разрезанных на две части (в середине гипокотиля) 7-10-дневных асептических проростков. Для индукции каллусогенеза в среду Гамборга B5 добавляют 2 мг/л 2.4-Д и 0,2 мг/л кинетина. Индукцию морфогенеза из каллусов осуществляют, заменяя вышеназванные гормоны бензила минопурином (БАП) в концентрации 0,2 мг/л. Недостатком данного способа является то, что полученная таким образом морфогенная ткань и растения-регенеранты клевера лугового отличались высокой гетерогенностью и, как следствие, большой сомаклональной изменчивостью по ряду морфологических и физиологических признаков как в положительную, так и отрицательную сторону по сравнению с исходным генотипом. Кроме того, в связи с тем, что для получения каллусов используют как гипокотильную, так и эпикотильную части проростков, исходный генотип не сохраняется и становится невозможным контролировать сомаклональную изменчивость и в дальнейшем проводить полноценный сравнительный морфологический и цитологический анализ полученных в процессе генетической трансформации растений. В связи с этим данный способ регенерации растений оказался не пригоден для направленного создания методом генетической трансформации форм клевера лугового с одним из признаков (устойчивость к болезням, вредителям и т.д.) и сохраняющих при этом все ценные селекционные признаки исходного материала. Цель изобретения - разработка способа прямой регенерации растений клевера лугового, сохраняющих высокий морфогенетический потенциал и ценные селекционные признаки исходных генотипов при длительном культивировании на канамицинсодержащих питательных средах в процессе генетической трансформации. В предлагаемом способе поставленная цель достигается тем, что культивирование трансформированной морфогенной культуры клевера на питательной среде Гамборга В5 осуществляется с добавлением канамицина и цефотаксима, причем морфогенную культуру получают без образования дедифференцированной ткани путем культивирования гипокотиля на питательной среде Гамборга B5 с 4,0 мг/л 6-бензиламинопурина, 1,0 мг/л кинетина и 0,05 мг/л Способ осуществляется следующим образом: из сортообразцов клевера лугового проводили отбор генотипов с высокой регенерационной способностью. Для этого из семян клевера с ценными селекционными признаками получали 6-7-дневные асептические проростки. Эпикотили отделяли и культивировали in vitro для сохранения исходного растения на среде Гамборга B5 без гормонов или для микроразмножения на среде того же состава с 2 мг/л 6-бензиламинопурина (БАП). Гипокотили помещали на питательную среду Гамборга B 5 с 4,0 мг/л БАП, 1 мг/л кинетина и 0,05 мг/л Пример 1. Оценка регенерационной способности различных линий клевера лугового после длительного культивирования на среде с канамицином (24 пассаж). Для генетической трансформации использовали только генотипы клевера лугового с высокой регенерационной способностью. Для чего морфогенные культуры с небольшими побегами, разрезанные на части величиной 3-5 мм, помещали срезом вверх на среду Гамборга В5 с 2,0 мг/л БАП, инокулировали штаммами агробактерий, несущих различные конструкции с маркерным (канамицинустойчивость) и целевым генами. Через 5 суток морфогенные культуры переносили на свежую питательную среду того же состава с добавлением 50 мг/л канамицина (для отбора клеточных культур клевера с встроенными генами канамицинустойчивости) и 500 мг/л цефотаксима для подавления роста бактерии. Субкультивирование на средах с цефотаксимом проводили через каждые 3-4 недели до полной элиминации агробактерий. Канамицин добавляли в среды в продолжение всего процесса трансформации и поддержания in vitro коллекции трансформированных морфогенных культур клевера лугового. На чертеже представлены результаты изучения регенерационной способности пяти генотипов клевера лугового сорта Ранний-2 (15П, Р8, К7 11-1, К7 11-2, РП-150) с ценными селекционными признаками (кислотоустойчивость, раннеспелость, высокая семенная продуктивность и т.д.), инокулированных шестью штаммами Agrobacterium tumefaciens и A.rhizogenes с конструкциями A4/pK22rs, A4/pK22ac, LBA 4404/pK22rs, LBA 4404/рК22ас, LGV 3850/pK22rs, LGV 3850/рК22ас. Через 24 пассажа на питательной среде Гамборга B5 без цефотаксима с 50 мг/л канамицина морфогенные культуры клевера лугового сохраняли способность к активной пролиферации, массовому образованию зеленых побегов и корней. В течение одного пассажа (1 месяц) из морфогенной ткани с одной чашки Петри получали в среднем более 100 зеленых побегов, и общее число их составляло 1000 и более штук и ограничивалось только потребностями практической селекции и площадью в фитотроне. Пример 2. Сравнительное изучение цитогенетических (табл.1) характеристик исходных растений и растений-регенерантов клевера лугового, полученных из каллусных культур и методом прямой регенерации из гипокотилей. Из таблицы 1 видно, что количество хромосомных и хроматидных перестроек в клетках растений-регенерантов клевера лугового сорта Ранний-2 клеточной линии РП 150, полученных методом прямой регенерации из гипокотилей, по всем показателям достоверно не отличались от контроля (исходные растения с ценными селекционными признаками), тогда как в варианте РП 116 число хроматидных перестроек с фрагментами и мостами в процентах возросло с 3,4±0,81 до 6,0±0,93 и 0,2±0,19 до 0,76±0,34 соответственно, а общий процент аберраций составил 8,15±1,07 против 3,8±0,85 в контроле. Кроме того, о значительных нарушениях в хромосомном аппарате клеток в процессе регенерации из каллусной культуры свидетельствовало появление хромосомных мостов (0,3±0,21), существенное снижение митотического индекса (Mi) до 4,6±0,66 и достоверное уменьшение числа диплоидных клеток (2n=14) с 98,0±0,99 до 91,0±2,02. Пример 3. Сравнительная оценка морфологических признаков растений исходных генотипов и растений-регенерантов, полученных методом прямой регенерации. Как следует из представленных результатов (табл.2), морфологические и биологические характеристики регенерантов полностью соответствуют исходным генотипам. По всем показателям представленных в таблице 2 признаков растения, полученные методом прямой регенерации, не отличаются от исходного генотипа и, при этом, разброс их характеристик укладывается в 5% ошибку опыта и соответствует величине вариации данных признаков у растений исходного сорта Ранний-2. Это свидетельствует об отсутствии сомаклональной вариабельности у растений-регенерантов РП 150 и их полной идентичности исходному генотипу. Таким образом, предлагаемый способ регенерации позволяет в процессе генетической трансформации на основе одного и того же генотипа, используя конструкции, несущие различные целевые гены, направленно создавать целый ряд генетических аналогов, полностью сохраняя при этом без изменения все ценные признаки исходного образца клевера лугового; получать и поддерживать in vitro морфогенные культуры, способные к длительной пролиферации на селективных средах и массовой регенерации канами-цинустойчивых растений клевера лугового; контролировать сомаклональную изменчивость и проводить сравнительный генетический анализ полученных в процессе генетической трансформации селекционных номеров. Источники информации 1. А.В.Мезенцев. Способ размножения клевера красного in vitro. / Авторское свидетельство СССР №781035, 1978. 2. В.В.Мазин, С.И.Ивашута, М.Н.Агафодорова, Л.А.Солодкая. Система разобщенных доминирующих центров для генетической трансформации люцерны и клевера // Физиология растений. - 1994. - Т.41. - №6, с.762-766. Таблица 1 Цитогенетическая характеристика растений исходного генотипа и растений-регенерантов клевера лугового, полученных из каллусных культур и методом прямой регенерации ВариантПроанализировано анафаз Число клеток, норма (2п=14) M dif±md MiХроматидные перестройки Хромосомные перестройки АберрацииФрагменты Мосты ФрагментыМосты Число% Число%Число %Число% Число%Контроль 50098,0±0,99 -7,9±0,85 173,4±0,811 0,2±0,191 0,2±0,1900 193,8±0,85 РП150500 96,0±1,381,2±1,28 7,5±0,83214,2±0,89 20,4±0,28 20,4±0,280 025 5,0±0,97РП116 65091,0±2,02 4,71±1,014,6±0,66 396,0±0,935 0,76±0,347 1,07±0,4020,3±0,21 538,15±1,07 РП150 - растения-регенеранты, полученные методом прямой регенерации (сорт Ранний 2) РП116 - растения-регенеранты, полученные из каллусной ткани (сорт Ранний2) Таблица 2. Сравнительная оценка исходных генотипов и растений-регенерантов, полученных методом прямой регенерации ПризнакИсходный сорт Ранний 2 Исходный генотип РП 150Растения-регенеранты РП 150Фертильность пыльцы, % 90-9797,3 96,3-97,4Количество цветков, шт. / головку70-160150 149-152Количество соцветий, шт. / растение60-130 110108-120 Масса 1000 семян, г1,6-2,2 1,81,7-1,9 Облиственность, %55,6 55,855,4-56,8 Длина стебля, см60-70 65,264,9-66,0 Число стеблей на 1 растение, шт.11-22 1413,0-15,0 Толщина стебля, мм3-4 43,9-4,0 Количество междоузлий на главном стебле, шт. 8-108 8,9-9,0Масса вегетативной части растений, г80-250 196189-207Формула изобретения1. Способ регенерации растений клевера лугового при генетической трансформации, включающий культивирование трансформированной морфогенной культуры клевера на питательной среде Гамборга В 5 с добавлением канамицина и цефотаксима, причем морфогенную культуру получают без образования дедифференцированной ткани путем культивирования гипокотиля на питательной среде Гамборга В5 с 4,0 мг/л 6-бензиламинопурина, 1,0 мг/л кинетина и 0,05 мг/л 2. Способ по п.1, отличающийся тем, что морфогенные культуры в процессе генетической трансформации сохраняют способность к регенерации растений и ризогенезу до 24-го пассажа и более на питательной среде Гамборга B 5 с 50 мг/л канамицина. 3. Способ по п.1, характеризующийся тем, что полученные из гипокотильных эксплантов морфогенные культуры по генетическим и морфологическим признакам не отличаются от исходных генотипов. MM4A Досрочное прекращение действия патента из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 10.06.2010 Дата публикации: 10.05.2011 NF4A Восстановление действия патента Дата, с которой действие патента восстановлено: 10.07.2011 Дата публикации: 10.07.2011 MM4A Досрочное прекращение действия патента из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 10.06.2012 Дата публикации: 10.04.2013 Популярные патенты: 2455825 Пестицидная аэрозольная композиция ... 0,01Цифенотрин 0,05 75Пример биологического испытания 4 0,01Циперметрин 0,1 80Пример биологического испытания 5 0,01Дельтаметрин 0,05 85Сравнительный пример биологического испытания 1 0,01- -15 Сравнительный пример биологического испытания 2 -Перметрин 0,15 0Сравнительный пример биологического испытания 3 -Фенотрин 0,10 Сравнительный пример биологического испытания 4 -Цифенотрин 0,05 0Сравнительный пример биологического испытания 5 -Циперметрин 0,1 35Сравнительный пример биологического испытания 6 -Дельтаметрин 0,05 40Сравнительные примеры биологических испытаний 7-12Испытания проводят в соответствии с методикой примера 1, но с тем отличием, что аэрозоль ... 2456799 Ловушка для поимки животных, обитающих в земле ... концов трубы 20. Ширина первых прорезей 21 выполнена больше, чем толщина задвижек 22, описанных далее. Четвертое отверстие 15 расположено между первыми прорезями 21 на воображаемой линии трубы 20, проходящей через центры первых прорезей 21 параллельно оси трубы 20. Ось четвертого отверстия 15 перпендикулярна оси трубы 20. Четвертое отверстие 15 выполнено сквозным. Размеры четвертого отверстия 15 выполнены больше, чем размеры поперечного сечения стержня 14, описанного далее. Третьи отверстия 19 расположены на одной прямой, перпендикулярной оси четвертого отверстия 15. Третьи отверстия 19 выполнены сквозными. Размеры третьих отверстий 19 выполнены больше, чем размеры поперечного ... 2016512 Средство для борьбы против стресса у рыб и способ борьбы со стрессом у рыб ... сравнении с группами контроля независимо от времени "АМИМОМИ". Если сравнивают две группы в одинаковых условиях, то оказывается, что процент заражения слабее, выздоровление появляется раньше, и не наблюдается никакой смерти в группе, обработанной ТБА. В группе ТБА (10 рыб) в "2 мин АМИМОМИ" только одна рыба не поправилась. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение триеновых стероидов формулы где R - алкил с 1-4 атомами углерода, X - ацилпроизводное карбоновой кислоты с 1 - 18 атомами углерода (ацетат тренболон), в качестве средства для борьбы против стресса у рыб. 2. Способ борьбы со стрессом у рыб путем введения антистрессового препарата в среду обитания, отличающийся тем, что в ... 2171570 Устройство для группового учета надоев молока при доении ... на опорных пружинах, которые вставлены в направляющие втулки. Положение мерного резервуара контролируется датчиком. При доении молоко попадает в приемную камеру, затем межстенную камеру и переливается в мерный резервуар. При заполнении мерного резервуара возрастает действующая на опорные пружины сила, при достижении заданной величины которой срабатывает датчик контроля положения мерного резервуара. Происходит опорожнение мерного резервуара. Устройство обеспечивает повышение точности дозирования порций молока. 2 ил. , ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУ Изобретение относится к сельскому хозяйству, в частности к устройствам для группового учета надоев молока. ... 2270554 Сепарирующее устройство зерноуборочного комбайна (варианты) ... обращенные к оси ротора стороны по меньшей мере двух рамных элементов выполнены также ступенчатыми в соответствии со ступенчатой конфигурацией стоек.9. Устройство для сепарирования зерна из убранной массы, содержащее ротор и частично окружающий его с зазором сепарирующий короб, который снабжен по меньшей мере двумя дугообразными рамными элементами, соединенными между собой с помощью проходящих параллельно оси ротора профилей, которые снабжены образующими решето листами с отверстиями, проходящими поперечно оси ротора на расстоянии друг от друга, отличающееся тем, что сепарирующий короб состоит по меньшей мере из двух рамных элементов, которые выполнены ступенчатыми, при этом на ... |
Еще из этого раздела: 2305931 Способ регенерации растений клевера лугового при генетической трансформации 2050341 Устройство для переработки органического субстрата в биогумус 2437262 Культиватор-плоскорез 2206985 Упряжь для собак 2281645 Устройство для размещения цветов и растений с подсветкой (варианты) 2444885 Посевной агрегат 2229127 Способ испытания растущих деревьев после рубок прореживания и проходных 2164741 Устройство для заготовки древесины 2403703 Способ интенсификации роста растений 2239993 Устройство для комбинированного охлаждения сельскохозяйственной продукции естественным и искусственным холодом |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
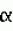 -нафтилуксусной кислоты с дальнейшей пересадкой эксплантов на свежую среду того же состава с 2,0 мг/л 6-бензиламинопурина, а эпикотильную часть проростков сохраняют путем культивирования на среде Гамборга В5 без гормонов или путем микроразмножения на среде того же состава с добавлением 2 мг/л 6-бензиламинопурина. Изобретение позволяет провести прямую регенерацию клевера лугового с сохранением морфогенетического потенциала и ценных селекционных признаков исходных генотипов 2 з.п. ф-лы, 1ил., 2 табл.
-нафтилуксусной кислоты с дальнейшей пересадкой эксплантов на свежую среду того же состава с 2,0 мг/л 6-бензиламинопурина, а эпикотильную часть проростков сохраняют путем культивирования на среде Гамборга В5 без гормонов или путем микроразмножения на среде того же состава с добавлением 2 мг/л 6-бензиламинопурина. Изобретение позволяет провести прямую регенерацию клевера лугового с сохранением морфогенетического потенциала и ценных селекционных признаков исходных генотипов 2 з.п. ф-лы, 1ил., 2 табл.