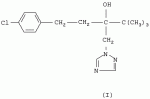
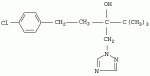
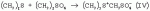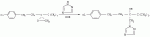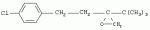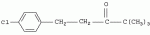Способ получения 1-(4-хлорфенил)-3-(1,2,4-триазол-1-ил-метил)-4,4-диметилпентан-3-олаПатент на изобретение №: 2256655 Автор: Усков А.М. (RU), Нестерова Л.М. (RU), Харитонов А.В. (RU), Белов М.Ю. (RU), Неборако Д.Н. (RU), Хараузов Е.С. (RU), Алдошин С.М. (RU), Дорохов В.Г. (RU), Савченко В.И. (RU) Патентообладатель: Закрытое акционерное общество Фирма "Август" (RU) Дата публикации: 20 Июля, 2005 Начало действия патента: 27 Января, 2004 Адрес для переписки: 129515, Москва, ул. Цандера, 6, ЗАО "Август" научный отдел, П.Е. Ивлеву Описывается улучшенный способ получения 1-(4-хлорфенил)-4,4-диметил-3-(1,2,4-триазол-1 -ил-метил)пентан-3-ола, заключающийся во взаимодействии 1,2,4-триазола с 2-(4-хлорфенил-этил)-2-трет-бутилоксираном в присутствии гидроокиси калия в среде н-бутанола. Отличие состоит в том, что процесс проводят непосредственно в реакционной смеси, содержащей 2-(4-хлорфенил-этил)-2-трет-бутилоксиран, полученный в результате взаимодействия 4,4-диметил-1-(4-хлорфенил)пентан-3-она с триметилсульфоний метилсульфатом в среде н-бутанола при 50-55°С, без предварительного выделения оксирана и его очистки. Способ позволяет сократить количество операций, времени проведения процесса с сохранением высокого выхода продукта. 3 з.п. ф-лы. Настоящее изобретение относится к новому способу получения 1-(4--хлорфенил)-3-(1,2,4-триазол-1-ил-метил)-4,4-диметилпентан-3-ола (общепринятое наименование - "тебуконазол") действующего вещества фунгицидных препаратов FolicurВ®* и RaxilВ®* (EP 0040345, USPat. №4723984, DE-OS 3018865, DE-OS 3018866, DE-OS 3333411). Известно, что 1-(4-хлорфенил)-3-(1,2,4-триазол-1-ил-метил)-4,4-диметил-пентан-3-ол (I) может быть получен при взаимодействии 1,2,4-триазола с 1-(4-хлорфенил-этил)-2-трет-бутилоксираном (II) в присутствии щелочи. Известно также, что оксиран (II) получают при взаимодействии 4,4-диметил-1-(4-хлорфенил)пентан-3-она (III) с триметилсульфоний метилсульфатом (IV) в присутствии щелочи. Для получения триметилсульфоний метилсульфата (IV) используют реакцию диметилсульфида с диметилсульфатом. Процесс получения тебуконазола (I) с использованием в качестве исходного продукта кетона (III) проводят в две стадии по следующей схеме: 1. Стадия получения 2-(4-хлорфенил-этил)-2-трет-бутилоксирана (II) Вторую стадию осуществляют после выделения из реакционной смеси оксирана (II). 2. Стадия получения 1-(4-хлорфенил)-3-(1,2,4-триазол-1-ил-метил)-4,4-диметил-пентан-3-ола (тебуконазола) (I) Из источников, относящихся к способу получения оксирана (II), известно, что 2-(4-хлорфенил-этил)-2-трет-бутилоксиран (II) можно получить при проведении реакции диметилсульфида и диметилсульфата в органическом растворителе с последующим добавлением к образовавшемуся триметилсульфоний метилсульфату (IV) 1-(4-хлорфенил)-4,4-диметилпентанона (III) и щелочного агента, например КОН или КОС(СН3 )3. В качестве растворителей используют ацетонитрил, толуол, трет-бутиловый спирт, а также диметилсульфид, причем последний вводят в реакцию в количестве, многократно превышающем необходимое для образования триметилсульфоний метилсульфата (DE-OS 3315619, DE-OS 3315681, USPat. №4898954). Недостатком вышеуказанных способов является использование постороннего органического растворителя, необходимость его регенерации и утилизации. В случае с диметилсульфидом имеют место сложности, связанные с его резким неприятным запахом и повышенной пожароопасностью, а также с увеличением объемов аппаратов. При проведении процесса в трет-бутиловом спирте используют на 1 моль исходного кетона 2 моля трет-бутилата калия (USPat. №4898954), для приготовления которого необходим металлический калий, то есть производство становиться особо пожароопасным. В Европейском патенте №0219799 и DE-OS 3537817 описан способ получения 2-(4-хлорфенил-этил)-2-третбутилоксирана (II) в среде диметилсульфида с добавлением диметилсульфоксида, что ведет к существенному удорожанию процесса и делает его малопригодным для промышленных масштабов. В заявке DE-OS 3733755 описан способ получения 2-(4-хлорфенил-этил)-2-трет-бутилоксирана (II) в среде диметилсульфида с добавлением воды в количестве 1 моль на 1 моль исходного кетона. Процесс проводят при температуре не выше 38°С, поэтому протекает он медленно (~14 часов.) Из источников, относящихся к стадии получения тебуконазола (I) известно, что 1-(4-хлорфенил)-3-(1,2,4-триазол-1-ил-метил)-4,4-диметилпентан-3-ол может быть получен при взаимодействии 2-(4-хлорфенил-этил)-2-трет-бутилоксирана с 1,2,4-триазолом в растворе этанола или н-пропанола в присутствии КОН или NaOH, а также в диметилсульфоксиде в присутствии Nа 2СО3 (ЕР 0040435, DE-OS 3315681 и ЕР 0219799). Недостатком этих способов является невысокий выход продукта и образование значительного количества примесей. Известен также способ получения 1-(4-хлорфенил)-3-(1,2,4-триазол-1-ил-метил)-4,4-диметилпентан-3-ола (I) из соответствующих оксирана (II) и триазола в растворе N-метилпирролидона в присутствии NaOH (DE-OS 3342692). Несмотря на высокий выход продукта применение способа в промышленном масштабе нецелесообразно из-за высокой стоимости использования N-метилпирролидона. Наиболее близким к заявляемому является способ получения 1-(4-хлорфенил)-3-(1,2,4-триазол-1-ил-метил)-4,4-диметилпентан-3-ола (I) при взаимодействии 2-(4-хлорфенил-этил)-2-трет-бутилоксирана (II) с 1,2,4-триазолом в присутствии КОН и н-бутанола при температуре от 80°С до 145°С. При этом на 1 моль 2-(4-хлорфенил-этил)-2-трет-бутилоксирана (II) в реакцию вводят от 1,0 до 1,1 молей 1,2,4-триазола, от 0,1 до 0,25 молей КОН и от 0,8 до 2,5 молей н-бутанола. Судя по приведенным в описании примерам, процесс завершается в течение 6-7 часов без учета времени, необходимого для выделения и очистки целевого продукта, выход которого составляет от 79,6% до 83,4%, считая на оксиран (II) (DE-OS 3733754). Во всех известных способах получения 1-(4-хлорфенил)-3-(1,2,4-триазол-1-ил-метил)-4,4-диметилпентан-3-ола (I) используют выделенный из реакционной смеси и очищенный (-97% содержания основного вещества) 2-(4-хлорфенил-этил)-2-трет-бутилоксиран (II). При разработке технологических процессов такой степени сложности, как процесс получения 1-(4-хлорфенил)-3-(1,2,4-триазол-1-ил-метил)-4,4-диметил-пентан-3-ола ("тебуконазола") одной из важных задач является достижение максимальной простоты и компактности процесса, т.е. сокращения количества операций, необходимой аппаратуры, времени проведения процесса при сохранении качества и выхода конечного продукта. Эту задачу удалось решить путем совмещения стадий получения 2-(4-хлорфенил-этил)-2-трет-бутилоксирана (II) и 1-(4-хлорфенил)-3-(1,2,4-триазол-1-ил-метил)-4,4-диметилпентан-3-ола (I) в одном производственном цикле. Такое совмещение оказалось возможным в результате проведения процесса получения 2-(4-хлорфенил-этил)-2-трет-бутилоксирана (II) в среде н-бутилового спирта, т.е. того же растворителя, который используют в известном способе получения 1-(4-хлорфенил)-3-(1,2,4-триазол-1-ил-метил)-4,4-диметил-пентан-3-ола (DE-OS 3733754) и в разработанном ранее заявителем способе получения 1-(4-хлорфенил)-4,4-диметилпентан-3-она (III) (исходного продукта для оксирана (II) (заявка №2002126238/04 (027830) от 02.10.2002 г.)). Оказалось, что в среде бутилового спирта реакция протекает полностью в присутствии порошкообразного КОН, который добавляют в количестве не более 3 молей на 1 моль кетона. После перемешивания реакционной смеси в течение 3,5-4 часов при 50-55°С осуществляется превращение 1-(4-хлорфенил)-4,4-диметилпентан-3-она в 2-(4-хлорфенил-этил)-2-трет-бутилоксиран со степенью конверсии не ниже 97% (по данным ГЖХ). Образовавшийся оксиран находится в растворе н-бутанола с примесью диметилсульфида. Кроме того, в реакционной смеси присутствует подвижный осадок, состоящий из смеси различных солей калия и избыточной щелочи, которая необходима для дальнейшего превращения оксирана в целевой продукт (I). К этой реакционной смеси добавляют 1,2,4-триазол в количестве, не превышающем 1,1 моля на 1 моль введенного в реакцию 1-(4-хлорфенил)-4,4-диметилпентан-3-она (III). Во время проведения реакции происходит также отгонка избытка диметилсульфида, воды и других возможных легколетучих примесей. Твердые компоненты осадка, содержащиеся в реакционной смеси, как оказалось, не препятствуют нормальному течению процесса, в результате которого получают 1-(4-хлорфенил)-3-(1,2,4-триазол-1-ил-метил)-4,4-диметилпентан-3-ол ("тебуконазол") (I) 98-99% чистоты по ВЭЖХ с выходом 80-82%, считая на 1-(4-хлорфенил)-4,4-диметилпентан-3-он (III). Эти данные вполне сопоставимы или даже превосходят результаты по прототипу (DE-OS 3733754), в котором используют предварительно выделенный и очищенный оксиран (II) и где выход рассчитан на оксиран (II), а не на предшествующий ему кетон (III). Кроме того, на стадии выделения и очистки целевого продукта (I) оказалось возможным и достаточным использовать в отличие от прототипа кристаллизацию из петролейного эфира без охлаждения смеси ниже комнатной температуры. Таким образом, очевидные преимущества заявляемого способа состоят в совмещении в одном процессе двух стадий - получения 2-(4-хлорфенил-этил)-2-трет-бутилоксирана (II) и 1-(4-хлорфенил)-3-(1,2,4-триазол-1-ил-метил)-4,4-диметил-пентан-3-ола (I) в результате использования на стадии получения оксирана в качестве растворителя н-бутанола и небольшого избытка КОН, который работает на стадии получения "тебуконазола". При этом уменьшается количество операций, в том числе устраняются операции по выделению и очистке оксирана (II), а также операция по регенерации "постороннего" растворителя, поскольку на всем протяжении процесса используется один растворитель - н-бутанол. Одновременно сокращается также время проведения процесса, упрощается его аппаратурное оформление при сохранении выхода конечного продукта (I) и его качества. Как показали опыты, наилучшие результаты могут быть достигнуты, если на 1 моль 1-(4-хлорфенил)-4,4-диметилпентан-3-она (III) используют 1,5-1,6 моль триметилсульфоний метилсульфата (из эквимольных количеств диметилсульфида и диметилсульфата с небольшим избытком диметилсульфида (~0,015 М)); 2,5-3 моля КОН; 2,2-2,5 моля н-бутанола и 1,0-1,1 моля 1,2,4-триазола. Далее следуют примеры, иллюстрирующие, но не ограничивающие изобретение. Способ получения 1-(4-хлорфенил)-4,4-диметил-3-(1,2,4-триазол-1-ил-метил)пентан-4-ола Пример №1 К раствору 1,13 кг (18,2 М) диметилсульфида, 2,70 кг (11,8 М) 98% 1-(4-хлорфенил)-4,4-диметилпентан-3-она в 2,5 л (26,4 М) н-бутанола при перемешивании в течение 30 мин прибавляют 2,26 кг (17,9 М) диметилсульфата. Затем реакционную смесь перемешивают в течение 1 часа при 50°С, после чего охлаждают до 30°С. Далее при перемешивании к реакционной смеси в течение 20 минут прибавляют 2,28 кг (34,5 М) 85% порошкообразного КОН. Затем реакционную смесь перемешивают 3,5-4,0 часа при 50-55°С. По истечении этого времени осуществляется превращение 1-(4-хлорфенил)-4,4-диметилпентан-3-она в 2-(4-хлорфенил-этил)-2-трет-бутилоксиран со степенью конверсии 98,8% (по данным ГЖХ). Далее к полученной смеси, содержащей бутанольный раствор 2-(4-хлорфенил-этил)-2-трет-бутилоксирана, прибавляют 0,84 кг (12,2 М) 1,2,4-триазола. Реакционную смесь нагревают до 130-140°С при этой температуре 3 часа. При этом отгоняются легколетучие компоненты. Далее смесь охлаждают до 60°С и фильтруют, после чего органический раствор промывают 800 мл воды. Органический слой отделяют и из полученного раствора при 40-90°С и остаточном давлении 20-50 мм рт.ст. удаляют н-бутанол. К оставшейся массе при перемешивании при 60°С добавляют 1,4 кг петролейного эфира и выдерживают смесь при 20°С в течение 6 часов. Выпавший осадок отфильтровывают, промывают 0,9 кг петролейного эфира и сушат 1 час при 60°С. Получают 3,15 кг 1-(4-хлорфенил)-3-(1,2,4-триазол-1-ил-метил)-4,4-диметил-пентан-3-ола (99,2% чистоты по ВЭЖХ). Выход - 82% от теоретического, считая на 1-(4-хлорфенил)-4,4-диметилпентан-3-он. Пример №2 К раствору 3,28 кг (26,0 М) диметилсульфата, 3,89 кг (17,0 М) 98% 1-(4-хлорфенил)-4,4-диметилпентан-3-она в 3,7 л (39,1 М) н-бутанола в течение 30 минут прибавляют 1,63 кг (26,3 М) диметилсульфида. Затем реакционную смесь перемешивают 1 час при 50°С, после чего охлаждают до 30°С. Далее при перемешивании к реакционной смеси в течение 30 мин прибавляют 2,81 кг (42,5 М) 85% порошкообразного КОН. Затем реакционную смесь перемешивают 4 часа при 50-55°С. По истечении этого времени осуществляется превращение 1-(4-хлорфенил)-4,4-диметилпентан-3-она в 2-(4-хлорфенил-этил)-2-трет-бутилоксиран со степенью конверсии 97,6% (по данным ГЖХ). Далее к полученной смеси, содержащей бутанольный раствор 2-(4-хлорфенил-этил)-2-трет-бутилоксирана, прибавляют 1,29 кг (18,7 М) 1,2,4-триазола. Реакционную смесь нагревают до 130-140°С и перемешивают при этой температуре 3,5 часа. При этом отгоняются легколетучие компоненты. Далее смесь охлаждают до 70°С и фильтруют, после чего органический раствор промывают 1,2 л воды. Органический слой отделяют и из полученного раствора при пониженном давлении отгоняют н-бутанол. Оставшуюся маслообразную жидкость при перемешивании прибавляют к нагретому до 50°С петролейному эфиру в количестве 2,0 кг, и выдерживают смесь при 20°С в течение 6 часов. Выпавший осадок отфильтровывают, промывают 1,3 кг петролейного эфира и сушат 1 час при 60°С. Получают 4,48 кг 1-(4-хлорфенил)-4,4-диметил-3-(1,2,4-триазол-1-ил-метил)пентан-4-ола (98,0% чистоты по ВЭЖХ). Выход - 80%, считая на 1-(4-хлорфенил)-4,4-диметилпентан-3-он. Пример №3 К раствору 176 кг (768 М) диметилсульфида в 104 л (1100 М) н-бутанола при перемешивании в течение 1 часа прибавляют 96 кг (760 М) диметилсульфата. Затем реакционную смесь перемешивают в течение 1,5 часа при 50°С, после чего охлаждают до 35°С. Далее при перемешивании к реакционной смеси прибавляют 114 кг (500 М) 98%-го 1-(4-хлорфенил)-4,4-диметилпентан-3-она и порциями 96 кг (1450 М) 85%-го порошкообразного КОН. Затем реакционную смесь перемешивают 4 часа при 50-55°С. По истечении этого времени осуществляется превращение 1-(4-хлорфенил)-4,4-диметилпентан-3-она в 2-(4-хлорфенил-этил)-2-трет-бутилоксиран со степенью конверсии 98,2% (по данным ГЖХ). Далее к полученной смеси, содержащей бутанольный раствор 2-(4-хлорфенил-этил)-2-трет-бутилоксирана, прибавляют 36 кг (525 М) 1,2,4-триазола. Реакционную смесь нагревают до 130-140°С при одновременной отгонке легколетучих компонентов, причем время перемешивания при 135-140°С составляет 4 часа. Далее смесь охлаждают до 80°С и промывают 30 л воды. Органический слой отделяют и из полученного раствора при пониженном давлении отгоняют н-бутанол. Оставшуюся маслообразную жидкость при перемешивании прибавляют к нагретому до 60°С петролейному эфиру в количестве 50 кг, и выдерживают смесь при 20 С в течение 8 часов. Выпавший осадок отфильтровывают, промывают 23 кг петролейного эфира и сушат 3 часа при 60°С. Получают 133 кг 1-(4-хлорфенил)-4,4-диметил-3-(1,2,4-триазол-1-ил-метил)пентан-4-ола (99,1% чистоты по ВЭЖХ). Выход - 82%, считая на 1-(4-хлорфенил)-4,4-диметилпентан-3-он. Формула изобретения1. Способ получения 1-(4-хлорфенил)-4,4-диметил-3-(1,2,4-триазол-1-ил-метил)пентан-3-ола (I), заключающийся во взаимодействии 1,2,4-триазола с 2-(4-хлорфенил-этил)-2-трет-бутилоксираном (II) в присутствии гидроокиси калия в среде н-бутанола при температуре 130-140°С, отличающийся тем, что 1,2,4-триазол вводят непосредственно в реакционную смесь, полученную в результате взаимодействия 4,4-диметил-1-(4-хлорфенил)пентан-3-она (III) с триметилсульфонийметилсульфатом (СH3) 3S+CH3SO4 - в среде н-бутанола при температуре 50-55°С в присутствии гидроокиси калия. 2. Способ получения 1-(4-хлорфенил)-4,4-диметил-3-(1,2,4-триазол-1-ил-метил)пентан-4-ола (I) по п.1, отличающийся тем, что КОН применяют в количестве 2,5 - 3,0 молей на 1 моль 4,4-диметил-1-(4-хлорфенил)пентан-3-она (III). 3. Способ получения по п.1, отличающийся тем, что н-бутанол применяют в количестве 2,2 - 2,5 молей, а 1,2,4-триазол в количестве 1,0 - 1,1 молей на 1 моль исходного кетона (III). 4. Способ по п.1, отличающийся тем, что конечный продукт кристаллизуют из петролейного эфира. TE4A Изменение адреса для переписки Адрес для переписки: 129515, Москва, ул. Цандера, дом 6, ЗАО Фирма "Август", Дирекция НИОКР Дата публикации: 27.01.2012 Популярные патенты: 2432394 Ингибирование образования биогенного сульфида посредством комбинации биоцида и метаболического ингибитора ... биоцидов. Комбинации биоцидов в виде соединений четвертичных аминов и глутарового альдегида имеются в продаже для использования на нефтепромыслах и в других ситуациях. Кокодиамины состоят из аминовой и диаминовой групп биоцида. Кокодиаминовый биоцид, использованный в настоящем исследовании, представлял собой Т-397, предоставленный Brenntag Canada. Бронопол (2-бром-2-нитропропан-1,3-диол) представляет собой галогенизированный биоцид. Сульфат тетракис(гидроксиметил)фосфония (THPS) представляет собой соль четвертичного фосфония. Биоциды из нескольких групп, обычно используемые в нефтепромысловых ситуациях, были преднамеренно выбраны для обеспечения возможности общей оценки эффективности ... 2195644 Монитор для определения качества зерна ... сигналов интенсивности для получения цифровых детектированных значений интенсивности. 20. Способ по п. 14, отличающийся тем, что дополнительно включает шаг вычисления, по меньшей мере, одного составляющего компонента исследуемого участка сельскохозяйственного продукта по значениям детектированной интенсивности. 21. Способ по п. 20, отличающийся тем, что дополнительно включает следующие шаги: селективное выполнение шага сбора диффузно отраженного излучения с установкой шторки коллектора в закрывающее 104 или открывающее 106 положение; селективное выполнение шага разделения по длинам волн с установкой шторки оптического блока в закрывающее 101 или открывающее 103 положение, ... 2132610 Устройство обогрева сельскохозяйственных животных и птицы ... температуры и радиационно-конвективного теплообмена от ИК-излучателя животного или птицы в различные периоды их развития, система регулируемого ИК-обогрева животного или птицы в различные периоды их развития в случае изменения температуры воздуха в помещении, биокалориметр и блок управления уровня радиационно-конвективного теплообмена в различные периоды роста и развития животного или птицы. Блок термостатирования и моделирования температуры живого объекта содержит нагреватель, соединенный с исполнительным механизмом и выходом блока сравнения, один из входов которого через задатчик конвективного потока соединен с датчиком температуры, а другой вход с блока сравнения соединен ... 2199860 Способ увеличения устойчивости подсолнечника к действию гербицида ... - длина проростков в контроле и опытных вариантах соответственно. Б) В условиях полевого опыта по достижению вегетирующими растениями подсолнечника фазы 10-16 листьев (площадь 3 м2, трехкратная повторность) делянки с растениями подвергают обработке опрыскиванием водной дисперсией БЭ 2,4-Д в количестве 20 г/га при норме расхода раствора 500 л/га. Через 5 сут делянки подвергают опрыскиванию водным раствором ТХЭТ концентрации 0,1 мас. %, при норме расхода раствора 500 л/га. По достижению полной спелости корзинок их срезают, обмолачивают и по количеству намолоченных семян методом взвешивания определяют урожайность (см. табл.2). Уменьшение урожайности семян подсолнечника в опытных ... 2426299 Способ повышения урожая картофеля в несколько раз ... АСУ РГС с необходимыми устройствами, измерителями и исполнительными механизмами в камере 1 (элеваторе),27 - усилитель и реле для включения клапанов 5 и 11 при достижении СО2 0,3% от объема РГС,28 - схемы сравнения в АСУ РГС: Рат-Рргс; O2opt-O 2; СO2кам CO2 0,3%,30 - нагреватель РГС в рециркуляторе,31 - опорное напряжение, пропорциональное CO2 0,3%,32 - опорное напряжение, пропорциональное значению O2opt,33 - опорное значение t°C,34 - опорное значение напряжения, пропорциональное ,35 - реле для включения клапанов 5 и 11, 36 - ресивер для N2,37 - дюар для жидкого кислорода O2,38 - компрессор для продувки камеры 1 воздухом,39 - клапан с редуктором и нагревателем O2, ... |
Еще из этого раздела: 2267261 Молочно-доильный комплекс 2305931 Способ регенерации растений клевера лугового при генетической трансформации 2108700 Способ оценки горных сенокосов и пастбищ 2278503 Способ управления формированием качества виноградного вина 2199195 Мостовая сельскохозяйственная платформа "сотка" 2083070 Способ предпосевной обработки семян и устройство для его осуществления 2492640 Способ выращивания рыбы в мелководных заморных озерах с применением глубокого водоема-спутника 2075933 Композиция для иммунизации растений от различных фитопатогенов 2076603 Способ повышения урожайности сельскохозяйственных культур 2423042 Электронно-оптический способ регулирования технологии производства агропродукции |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||