Добавка к пищевым продуктам, биоцидный препарат, 2-(1-окси- 4-гидроксифенилен)-бензохинон (варианты) и способ его полученияПатент на изобретение №: 2230467 Автор: Алкацева Н.И. (RU), Башкин В.М. (RU) Патентообладатель: ООО "ЭКОТЕК БИОФАРМ" (RU) Дата публикации: 20 Июня, 2004 Начало действия патента: 23 Мая, 2003 Адрес для переписки: 193318, Санкт-Петербург, ул. Подвойского, 14, корп. 1, кв.741, пат.пов. В.А.Кузнецову Изображения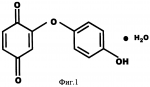  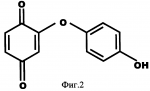 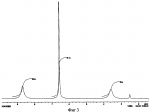 Изобретение относится к пищевой промышленности, в частности к добавкам к пищевым продуктам, обладающим биоцидными свойствами. Продукт представляет собой 2-(1-окси-4-гидроксифенилен)бензохинон или 2-(1-окси-4-гидроксифенилен)-бензохинон кристаллогидрат. Способ получения включает смешивание гидрохинона, гидроперита и воды, добавление 0,001-0,04% от массы смеси солей двухвалентного железа, нейтрализацию смеси после прохождения реакции и выделение полученного продукта. 2-(1-окси-4-гидроксифенилен)бензохинон используют в составе добавки к пищевым продуктам или в составе биоцидного препарата. Изобретение позволяет получить вещество, являющееся эффективной пищевой добавкой и сочетающее биоцидные и антиоксидантные свойства. 5 с. и 2 з.п. ф-лы, 5 ил., 11 табл. Заявляемая группа изобретений относится к области биотехнологии, а именно к веществам, перспективным для использования в качестве добавок к пищевым продуктам, в частности обладающим биоцидными свойствами и перспективным для борьбы с бактериальными и грибковыми поражениями косметических средств и иных товаров. Изобретения предназначены для использования в пищевой и молочной промышленности, медицине, ветеринарии, косметике, текстильной и строительной индустрии, а также смежных отраслях производства.В настоящее время известно большое количество веществ и их композиций, перспективных для использования в качестве добавок к пищевым продуктам.Под добавками к пищевым продуктам или пищевыми добавками понимают, как правило, группу веществ природного или искусственного происхождения, намеренно вводимых в продукт и используемых для усовершенствования технологии, получения продуктов специализированного назначения (детских, диетических и т.п.), сохранения или придания пищевым продуктам необходимых свойств, повышения стабильности или улучшения органолептических свойств. К пищевым добавкам не относятся соединения, повышающие пищевую ценность продуктов, и посторонние загрязняющие вещества (контаминанты).Пищевые добавки, как правило, подразделяют на добавки, улучшающие органолептические свойства и внешний вид продуктов (улучшители консистенции, красители, ароматизаторы, вкусовые вещества), предотвращающие микробную или окислительную порчу продуктов (консерванты) - антимикробные средства и антиокислители; пищевые добавки, необходимые в технологическом процессе приготовления пищи (желе- и пенообразователи, фиксаторы миоглобина и т.д.) и улучшители качества пищевых продуктов (Сарафанова С.А. Пищевые добавки: энциклопедия. - СПб: ГИОРД, 2003, 688 с.; Булдаков А.С. Пищевые добавки. Справочник., СПб., “Ut”, 1996, с.13-14).К добавкам, предотвращающим микробную или окислительную порчу продуктов (консерванты), в частности, относятся (Сарафанова С.А. Пищевые добавки: энциклопедия. - СПб: ГИОРД, 2003, с.45-48, 385-388, 489-491):антимикробные средства - поваренная соль, уксус, сахар, этиловый спирт, двуокись углерода, используемые в концентрации от процентов до нескольких десятков процентов;вещества, условно отнесенные к консервантам, - сорбиновая и бензойные кислоты, низин, диоксид серы, сульфиты щелочных металлов - используемые в концентрации менее 0.5% и практически не влияющие на органолептические свойства;антиокислители - аскорбиновая кислота и ее соли, токоферолы, алкилгаллаты, трет-бутилгидрохинон, сульфиты щелочных металлов, сантохин.В качестве добавок, сочетающих наличие антимикробных и антиоксидантных свойств, известны, в частности, нитриты натрия или калия. Препараты применяют в дозах 50-125 мг/кг мясопродуктов в качестве добавок к другим консервантам.В связи с их токсичностью и мутагенностью они имеют ограниченное применение (только в мясопродуктах) и требуют при работе с ними соблюдения специальной техники безопасности.Наиболее близкой по эффективности к заявляемой пищевой добавке является сорбиновая кислота, наиболее широко применяемая в качестве консерванта в жиромолочной, фруктово-овощной, хлебобулочной и иной продукции. Добавку вводят в продукт в концентрации от 200 до 2000 мг/кг (Сарафанова С.А., Пищевые добавки: энциклопедия. - СПб: ГИОРД, 2003, с.489-491).Недостатком сорбиновой кислоты является отсутствие антиоксидантных свойств, а также неэффективность при использовании в продуктах с нейтральной или щелочной рН (используется при рН не более 6.5).Кроме того, сорбиновая кислота обладает высокой себестоимостью и относительно низким биоцидным действием, что исключает возможность ее использования для дезинфекции помещений.В настоящее время для борьбы с микроорганизмами используют такие препараты, как метафлор, формальдегид, алкамон, хлористые углеводороды, глутаровый альдегид и т.п. (Англ. пат. № 1476730, 1977, кл. В 27 К 3/50, пат. ФРГ № 2820409, 1981, кл. В 27 К 3/50). Обработку ведут введением биоцидных добавок в продукцию или путем обработки поверхностей изделия их растворами или аэрозолями. Однако указанные препараты не обладают пролонгированным действием, опасны для человека и окружающей среды, малоэффективны в низких концентрациях.Одной из наиболее перспективных групп биоцидов являются различные производные гуанидина (Англ. пат. № 821113, 1959, кл.15 (2) G; авт. св. СССР 1184296, 1983, кл. D 06 М 14/04; пат. СССР № 1687261, 1991, кл. А 61 L 2/16) - сочетающие хорошие биоцидные свойства с относительной малотоксичностью.Среди указанных производных наиболее известен для борьбы с бактериальными загрязнениями полигексаметиленгуанидин гидрохлорид, получивший наименование метацид (авт. св. СССР № 247463, 1968, кл. А 61 L 2/16; авт. св. СССР № 1698061, 1991, кл. В 27 К 3/34), который может рассматриваться как наиболее близкий к заявляемому препарату биоцидного действия.Однако метацид эффективен только при относительно высоких концентраций препарата, как правило от 0.1 до 7% (авт. св. СССР № 247463, 1968, кл. A 61 L 2/16). Кроме того, отмечается его высокая коррозионная активность и токсичность для человека и животных, что практически исключает возможность его использования в пищевых продуктах. Кроме того, как показали проведенные эксперименты, биоцидное действие препаратов этой группы отмечается только при прямом контакте с микроорганизмами.Среди препаратов, близких по структуре к заявляемым веществам, известны производные бензохинонов, например фенилмеркантобензохинон и 2-фенил-5-сульфотио-пара-бензохинон (Helvetica Chimica Acta, v.XXX, Fsaciculus 11, 1947, p.578-584 // Beil Bd. 08/03/70 р.2635-2637). Все выявленные соединения имели связи между ядрами С-С или -S-S-. Активность указанных веществ авторами не изучалась.Наиболее близкими по структуре к заявляемому соединению являются полиариленовые эфиры С6Н5O(С6Н4O)6C6H5 (пат. США № 3257357, 1966, НКл. 260-47), получаемые окислением фенолов и используемые в качестве компонентов сополимеров с полипропиленами или в качестве добавок, повышающих термоустойчивость смол (пат. США № 3257357, 1966, НКл. 260-47; пат. США № 3306874, 1967, НКл. 260-47; пат. США № 4645787, 1987, НКл. 260-47). Общим признаком, роднящим их с заявляемым веществом, является наличие эфирной связи между ароматическими ядрами.Отличием данных аналогов от заявляемых веществ является отсутствие хиноидной группы, полимерная природа соединения, принципиально иные физико-химические свойства.Задачей, решаемой авторами настоящей группы изобретений, является создание нового вещества, являющегося эффективной пищевой добавкой и сочетающего биоцидные и антиоксидантные свойства, а также разработка способа его получения.Указанная задача решалась созданием 2-(1-окси-4-гидроксифенилен) бензохинона (фиг.1) в виде индивидуального соединения или в виде кристаллогидрата (фиг.2), сочетающего биоцидные и антиоксидантные свойства, и перспективного для использования в виде добавки к пищевым продуктам или в качестве биоцидного средства, а также способа их получения.Выделенный в ходе синтеза 2-(1-окси-4-гидроксифенилен) бензохинон, кристаллогидрат имел брутто-формулу C12H10O5.Молекулярная масса, определенная по криоскопическому методу (В.А. Попков, Г.М. Дугачева. Криоскопический метод определения чистоты лекарственных веществ. М.: Медицина, 1999, с.9-28) составил 234 к.е. (анализ 240  8).Массовая доля углерода -59.5% (расчет 61.5%); массовая доля водорода -4.8% (расчет -4.3%).Вещество после кристаллизации и сушки образует игольчатые кристаллы серого цвета, хорошо растворимые в воде и практически нерастворимые в органических растворителях: бензоле, дихлорметилене, хлороформе, этилацетате, ацетоне, органических спиртах (метиловом, этиловом, изопропиловом). Слабо растворимо в кислотах. рН 5% водного раствора 6.8, плотность 0.9 г/см3. Температура плавления - 170 8).Массовая доля углерода -59.5% (расчет 61.5%); массовая доля водорода -4.8% (расчет -4.3%).Вещество после кристаллизации и сушки образует игольчатые кристаллы серого цвета, хорошо растворимые в воде и практически нерастворимые в органических растворителях: бензоле, дихлорметилене, хлороформе, этилацетате, ацетоне, органических спиртах (метиловом, этиловом, изопропиловом). Слабо растворимо в кислотах. рН 5% водного раствора 6.8, плотность 0.9 г/см3. Температура плавления - 170 С.Доказательство структуры ОГБХ осуществлялось с использованием методов инфракрасной (ИК) и ультрафиолетовой спектроскопии, протонного магнитного (ПМР) резонанса и рядом других методов.Было показано, что УФ-спектр (фиг.5) субстанции имеет максимум поглощения при 285 нм, в ИК-спектре (фиг.4) имеются характерные для субстанции полосы поглощения при 817, 831, 1520, 1447, 3600-3000 см-1, ПМР-спектр (рис.3) имеет характерные для субстанции сигналы протонов в области 2.6-8.8 м.д.Для оценки структуры препарата методом ПМР образцы препарата растворяли в диметилсульфоксиде (“Изотоп”, 98% 2H) до конечной концентрации 10 вес.%. Спектры ПМР измеряли на частоте 300 МГц. Отнесение линии в спектрах производили по сигналу резонанса d6 ( С.Доказательство структуры ОГБХ осуществлялось с использованием методов инфракрасной (ИК) и ультрафиолетовой спектроскопии, протонного магнитного (ПМР) резонанса и рядом других методов.Было показано, что УФ-спектр (фиг.5) субстанции имеет максимум поглощения при 285 нм, в ИК-спектре (фиг.4) имеются характерные для субстанции полосы поглощения при 817, 831, 1520, 1447, 3600-3000 см-1, ПМР-спектр (рис.3) имеет характерные для субстанции сигналы протонов в области 2.6-8.8 м.д.Для оценки структуры препарата методом ПМР образцы препарата растворяли в диметилсульфоксиде (“Изотоп”, 98% 2H) до конечной концентрации 10 вес.%. Спектры ПМР измеряли на частоте 300 МГц. Отнесение линии в спектрах производили по сигналу резонанса d6 (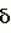 =2.50 м.д.; 3.7 м.д. - сигнал протонов примеси воды). Спектры ПМР снимали при комнатной температуре (20 =2.50 м.д.; 3.7 м.д. - сигнал протонов примеси воды). Спектры ПМР снимали при комнатной температуре (20 2) 2) С. Спектр ПМР приведен на фиг. 3.Анализ спектра показал, что в области резонанса ароматических протонов обнаружен мультиплет с положением С. Спектр ПМР приведен на фиг. 3.Анализ спектра показал, что в области резонанса ароматических протонов обнаружен мультиплет с положением 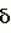 =6.6 м.д., принадлежащий протонам гидроксилов и синглет с положением =6.6 м.д., принадлежащий протонам гидроксилов и синглет с положением 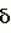 =8,76 м.д., принадлежащий протонам ароматического кольца, что подтверждает наличие гидрохинонной структуры в соединении.Анализ ОГБХ методами ИК-спектроскопии выявил характеристические линии, соответствующие наличию гидроксильных групп, замещению ароматического кольца в пара-положении, наличия связей -С-O- и -С=С-, С=O, что подтверждает предполагаемую вторичную структуру (табл. 1). =8,76 м.д., принадлежащий протонам ароматического кольца, что подтверждает наличие гидрохинонной структуры в соединении.Анализ ОГБХ методами ИК-спектроскопии выявил характеристические линии, соответствующие наличию гидроксильных групп, замещению ароматического кольца в пара-положении, наличия связей -С-O- и -С=С-, С=O, что подтверждает предполагаемую вторичную структуру (табл. 1).  Исследование УФ-спектра выявило наличие характеристической полосы поглощения с максимумом 285 нм, характерной для гидрохиноидной структуры.Способ получения 2-(1-окси-4-гидроксифенилен)бензохинонов (далее - ОГФБ) заключается во взаимодействии гидрохинона (ГХ) с гидроперитом (ГП)-комплексом эквимолекулярных количеств мочевины и перекиси водорода (ПВ) в присутствии солей двухвалентного железа (СЖ) по реакции2(НО-С6Н4-ОН)+2O=C(NH2)2В·H2O2=НО-С6Н4-O-С6Н3O2 (фиг.1)+4NH3+2CO2+2Н2OПолученную смесь нейтрализуют и выделяют целевой продукт традиционными методами, например сочетанием фильтрования с упариванием фильтрата. Очистка полученного продукта осуществляется, как правило, его промывкой 96% этанолом и перекристаллизацией ОГФБ из водного раствора и сушкой полученного продукта. Получаемые кристаллы представляют собой ОГФБ-кристаллогидрат, который может при необходимости подвергаться дальнейшему обезвоживанию до ОГФБ.ГП может вводиться в исходную смесь изначально в виде комплекса или получаться в ходе реакции в качестве промежуточного соединения из смеси мочевины и перекиси водорода, вводимых в ходе реакции.Оптимальным является использование ингредиентов при весовом соотношении 60-70% ГП и 40-30% ГХ. Соли железа вводят в количестве 0.001-0.04%. При изменении соотношения ингредиентов часть из них остается непрореагировавшими, что ухудшает экономические показатели процесса. В условиях реакции происходит полный гидролиз мочевины, входящей в гидроперит, с образованием NH3 и СO2, что подтверждается отсутствием в ИК-спектре полученной субстанции характерных амидных полос 1690-1630 см-1 и 1620-1590 см-1.Промышленное использование изобретений иллюстрируется следующими примерами.Пример 1. Получение ОГФБ.К 500 г гидроперита (CO(NH2)2В·H2O2), помещенного в фарфоровую ступку, добавляли 300 г гидрохинона (ГХ) и 60 мг железного купороса (ЖК) и тщательно перемешивали при комнатной температуре. Затем к смеси добавляли 0.1 мл воды. При этом происходит экзотермическая реакция, в результате которой образуется черное твердое вещество со слабым запахом аммиака.К полученному твердому веществу добавляют 200 мл 5% водного раствора щелочи (NaOH) и фильтровали полученную смесь. Полученный фильтрат упаривали до сухого остатка, проводили двухкратную промывку сухого остатка 96% этанолом и перекристаллизовали из водного раствора. После перекристаллизации выход субстанции - 280 г. рН 5% раствора 6.8. Температура плавления - 170 Исследование УФ-спектра выявило наличие характеристической полосы поглощения с максимумом 285 нм, характерной для гидрохиноидной структуры.Способ получения 2-(1-окси-4-гидроксифенилен)бензохинонов (далее - ОГФБ) заключается во взаимодействии гидрохинона (ГХ) с гидроперитом (ГП)-комплексом эквимолекулярных количеств мочевины и перекиси водорода (ПВ) в присутствии солей двухвалентного железа (СЖ) по реакции2(НО-С6Н4-ОН)+2O=C(NH2)2В·H2O2=НО-С6Н4-O-С6Н3O2 (фиг.1)+4NH3+2CO2+2Н2OПолученную смесь нейтрализуют и выделяют целевой продукт традиционными методами, например сочетанием фильтрования с упариванием фильтрата. Очистка полученного продукта осуществляется, как правило, его промывкой 96% этанолом и перекристаллизацией ОГФБ из водного раствора и сушкой полученного продукта. Получаемые кристаллы представляют собой ОГФБ-кристаллогидрат, который может при необходимости подвергаться дальнейшему обезвоживанию до ОГФБ.ГП может вводиться в исходную смесь изначально в виде комплекса или получаться в ходе реакции в качестве промежуточного соединения из смеси мочевины и перекиси водорода, вводимых в ходе реакции.Оптимальным является использование ингредиентов при весовом соотношении 60-70% ГП и 40-30% ГХ. Соли железа вводят в количестве 0.001-0.04%. При изменении соотношения ингредиентов часть из них остается непрореагировавшими, что ухудшает экономические показатели процесса. В условиях реакции происходит полный гидролиз мочевины, входящей в гидроперит, с образованием NH3 и СO2, что подтверждается отсутствием в ИК-спектре полученной субстанции характерных амидных полос 1690-1630 см-1 и 1620-1590 см-1.Промышленное использование изобретений иллюстрируется следующими примерами.Пример 1. Получение ОГФБ.К 500 г гидроперита (CO(NH2)2В·H2O2), помещенного в фарфоровую ступку, добавляли 300 г гидрохинона (ГХ) и 60 мг железного купороса (ЖК) и тщательно перемешивали при комнатной температуре. Затем к смеси добавляли 0.1 мл воды. При этом происходит экзотермическая реакция, в результате которой образуется черное твердое вещество со слабым запахом аммиака.К полученному твердому веществу добавляют 200 мл 5% водного раствора щелочи (NaOH) и фильтровали полученную смесь. Полученный фильтрат упаривали до сухого остатка, проводили двухкратную промывку сухого остатка 96% этанолом и перекристаллизовали из водного раствора. После перекристаллизации выход субстанции - 280 г. рН 5% раствора 6.8. Температура плавления - 170 С. Молекулярная масса - УФ-спектр субстанции имеет максимум поглощения при 285 нм, в ИК-спектре имеются характерные для субстанции полосы поглощения при 817, 831, 1520, 1447, 3600-3000 см-1, ПМР-спектр имеет характерные сигналы протонов в области 2.6-8.8 м.д.Оценка безвредности и эффективности вещества проводилась в Институте токсикологии (г. С.Петербург).Определение показателей острой токсичности включало эксперименты на грызунах (мышах, крысах). Животные распределялись по группам случайным образом методом рандомизации. В качестве критериев приемлемости рандомизации считали отсутствие внешних признаков заболеваний и гомогенность групп по весу тела ( С. Молекулярная масса - УФ-спектр субстанции имеет максимум поглощения при 285 нм, в ИК-спектре имеются характерные для субстанции полосы поглощения при 817, 831, 1520, 1447, 3600-3000 см-1, ПМР-спектр имеет характерные сигналы протонов в области 2.6-8.8 м.д.Оценка безвредности и эффективности вещества проводилась в Институте токсикологии (г. С.Петербург).Определение показателей острой токсичности включало эксперименты на грызунах (мышах, крысах). Животные распределялись по группам случайным образом методом рандомизации. В качестве критериев приемлемости рандомизации считали отсутствие внешних признаков заболеваний и гомогенность групп по весу тела ( 20%).Субстанцию растирали в порошок, из которого готовили водные растворы (взвеси) для внутрижелудочного (в/ж) введения. Введение осуществляли перорально через металлический атравматический зонд в возрастающих дозах по Литчфилду-Уилкоксону.Для исследования каждой дозы препарата использовались группы по 6 животных одного пола. Кроме того, имелись аналогичные по численности группы контрольных животных каждого пола, которым по тому же пути вводили эквивалентные объемы растворителя - дистиллированной воды. Период наблюдения составлял 14 суток.Были получены следующие результаты для крыс ЛД50=1900 20%).Субстанцию растирали в порошок, из которого готовили водные растворы (взвеси) для внутрижелудочного (в/ж) введения. Введение осуществляли перорально через металлический атравматический зонд в возрастающих дозах по Литчфилду-Уилкоксону.Для исследования каждой дозы препарата использовались группы по 6 животных одного пола. Кроме того, имелись аналогичные по численности группы контрольных животных каждого пола, которым по тому же пути вводили эквивалентные объемы растворителя - дистиллированной воды. Период наблюдения составлял 14 суток.Были получены следующие результаты для крыс ЛД50=1900 25 мг/кг; ЛД16=530 25 мг/кг; ЛД16=530 20 мг/кг; ЛД84=3400 20 мг/кг; ЛД84=3400 150 мг/кг.Введение субстанции в токсических дозах через 20-30 мин сопровождалось развитием заторможенности, гиподинамии, атаксии, тремором, взъерошенностью шерсти, гиперсаливацией. В течение часа развивались приступы клонико-тонических судорог с нарушением акта дыхания. Гибель животных наблюдалась в течение 3-5 часов при явлениях одышки и паралича. Выжившие животные были заторможены, гиподинамичны, имели неопрятный вид.При вскрытии через день после острого введения выявлено: листки плевры и органы грудной клетки не изменены. Легкие бледно-розовые, воздушные, без уплотнений на ощупь. Размеры сердца в пределах нормы. В полостях сердца содержится небольшое количество жидкой крови. Мышца сердца плотная, коричневой окраски. Желудок заполнен небольшим количеством плотной пищи. Слизистая оболочка блестящая, складчатая, слегка розоватой окраски.Слизистая тонкого кишечника блестящая, гладкая, розоватой окраски. Размеры и форма печени не отличаются от контроля. Поверхность печени гладкая. Капсула тонкая, прозрачная. Рисунок печени на разрезе не изменен. Ткань печени умеренно полнокровна. Почки обычной величины и формы, коричневатого цвета, плотные, с отчетливыми корковым и мозговым веществом на разрезе. Щитовидная железа, надпочечники и поджелудочная железа по внешнему виду не отличаются от контроля. При осмотре гистологических препаратов желудка и паренхиматозных органов отличий в структуре между опытными и контрольными группами не обнаружено. Сосуды легких были умеренно полнокровны. Эпителий альвеол и внутрилегочных бронхов изменений не представлял. Альвеолы были заполнены воздухом. Отека либо воспаления легочной ткани не наблюдалось. Миобифриллы левого желудочка сердца и межжелудочковой перегородки имели отчетливую поперечную исчерченность, ядра кардиомиоцитов были светлыми. Сосуды миокарда умеренно полнокровные. Дольчатое строение печени сохранялось. Границы гепатоцитов были четкими, цитоплазма гепатоцитов - слабобазофильной, зернистой; ядра с достаточным содержанием хроматина и тонкой ядерной мембраной.Эпителий извитых канальцев почек изменений не представлял. Цитоплазма его была зернистой, оксифильной, ядра светлыми. Сосуды клубочков умеренно полнокровные.Строение слизистой оболочки фундальной части желудка не отличалось от контроля. Ядра эпителия слизистой и желез были светлыми. В базальных отделах желез сохранилась зернистость в цитоплазме. Эпителий ворсинок и крипт слизистой тонкой кишки был сохранен, в криптах присутствовали митозы.При окраске замороженных срезов печени суданом IV признаков жировой дистрофии не наблюдалось. В головном мозге наблюдались субдуральные и периваскулярные кровоизлияния.Результаты измерения массы тела животных, переживших интоксикацию в дозах, вызывающих летальные эффекты, показывают некоторое снижение средней массы тела у всех животных, получавших субстанцию на второй день после введения. В последующие дни динамика массы тела опытных животных во всех группах не отличалась от контроля.Анализ величин массовых коэффициентов внутренних органов не выявил каких-либо достоверных отличий как между группами животных, получавших субстанцию, и контрольной группой.Результаты токсикометрии, данные наблюдений за экспериментальными животными на протяжении 14 дней после острого введения, а также данные некропсии позволяют отнести заявляемый препарат к IV классу малотоксичных лекарственных веществ (Н. Hodge et al. Clinical Toxicology of Commercial Products. Acute Poisoning. Ed. IV, Baltimore, 1975, 427 p.; К.К. Сидоров, 1973).При хроническом ежедневном (на протяжении 30 дней) в/ж введении субстанций крысам в дозе 100 мг/кг (доза, превышающая максимальную терапевтическую для человека в 2 раза) (“Энциклопедия лекарств”, изд. 7. Под ред. Ю.Ф. Крылова, М., 2000, с. 678) летальных эффектов не наблюдалось. Ни по одному из использованных показателей не было выявлено статистически значимых различий с контролем (вода) (р>0,05 при 95% уровне вероятности) или патологических отклонений за пределы варьирования физиологической нормы (табл. 2, 3). 150 мг/кг.Введение субстанции в токсических дозах через 20-30 мин сопровождалось развитием заторможенности, гиподинамии, атаксии, тремором, взъерошенностью шерсти, гиперсаливацией. В течение часа развивались приступы клонико-тонических судорог с нарушением акта дыхания. Гибель животных наблюдалась в течение 3-5 часов при явлениях одышки и паралича. Выжившие животные были заторможены, гиподинамичны, имели неопрятный вид.При вскрытии через день после острого введения выявлено: листки плевры и органы грудной клетки не изменены. Легкие бледно-розовые, воздушные, без уплотнений на ощупь. Размеры сердца в пределах нормы. В полостях сердца содержится небольшое количество жидкой крови. Мышца сердца плотная, коричневой окраски. Желудок заполнен небольшим количеством плотной пищи. Слизистая оболочка блестящая, складчатая, слегка розоватой окраски.Слизистая тонкого кишечника блестящая, гладкая, розоватой окраски. Размеры и форма печени не отличаются от контроля. Поверхность печени гладкая. Капсула тонкая, прозрачная. Рисунок печени на разрезе не изменен. Ткань печени умеренно полнокровна. Почки обычной величины и формы, коричневатого цвета, плотные, с отчетливыми корковым и мозговым веществом на разрезе. Щитовидная железа, надпочечники и поджелудочная железа по внешнему виду не отличаются от контроля. При осмотре гистологических препаратов желудка и паренхиматозных органов отличий в структуре между опытными и контрольными группами не обнаружено. Сосуды легких были умеренно полнокровны. Эпителий альвеол и внутрилегочных бронхов изменений не представлял. Альвеолы были заполнены воздухом. Отека либо воспаления легочной ткани не наблюдалось. Миобифриллы левого желудочка сердца и межжелудочковой перегородки имели отчетливую поперечную исчерченность, ядра кардиомиоцитов были светлыми. Сосуды миокарда умеренно полнокровные. Дольчатое строение печени сохранялось. Границы гепатоцитов были четкими, цитоплазма гепатоцитов - слабобазофильной, зернистой; ядра с достаточным содержанием хроматина и тонкой ядерной мембраной.Эпителий извитых канальцев почек изменений не представлял. Цитоплазма его была зернистой, оксифильной, ядра светлыми. Сосуды клубочков умеренно полнокровные.Строение слизистой оболочки фундальной части желудка не отличалось от контроля. Ядра эпителия слизистой и желез были светлыми. В базальных отделах желез сохранилась зернистость в цитоплазме. Эпителий ворсинок и крипт слизистой тонкой кишки был сохранен, в криптах присутствовали митозы.При окраске замороженных срезов печени суданом IV признаков жировой дистрофии не наблюдалось. В головном мозге наблюдались субдуральные и периваскулярные кровоизлияния.Результаты измерения массы тела животных, переживших интоксикацию в дозах, вызывающих летальные эффекты, показывают некоторое снижение средней массы тела у всех животных, получавших субстанцию на второй день после введения. В последующие дни динамика массы тела опытных животных во всех группах не отличалась от контроля.Анализ величин массовых коэффициентов внутренних органов не выявил каких-либо достоверных отличий как между группами животных, получавших субстанцию, и контрольной группой.Результаты токсикометрии, данные наблюдений за экспериментальными животными на протяжении 14 дней после острого введения, а также данные некропсии позволяют отнести заявляемый препарат к IV классу малотоксичных лекарственных веществ (Н. Hodge et al. Clinical Toxicology of Commercial Products. Acute Poisoning. Ed. IV, Baltimore, 1975, 427 p.; К.К. Сидоров, 1973).При хроническом ежедневном (на протяжении 30 дней) в/ж введении субстанций крысам в дозе 100 мг/кг (доза, превышающая максимальную терапевтическую для человека в 2 раза) (“Энциклопедия лекарств”, изд. 7. Под ред. Ю.Ф. Крылова, М., 2000, с. 678) летальных эффектов не наблюдалось. Ни по одному из использованных показателей не было выявлено статистически значимых различий с контролем (вода) (р>0,05 при 95% уровне вероятности) или патологических отклонений за пределы варьирования физиологической нормы (табл. 2, 3).  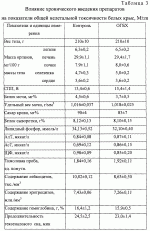 При вскрытии крыс, забитых на следующий день после последнего введения субстанций, размеры, форма и окраска внутренних органов макроскопических изменений по сравнению с контролем не имели. Слизистая оболочка желудка и тонкого кишечника были блестящими, бледно-розовыми, без признаков раздражения или воспаления. При гистологическом исследовании препаратов легких, миокарда, печени, почек и слизистой желудка подопытных животных дистрофических, воспалительных или некробиотических изменений указанных выше органов не наблюдалось.Эпителий альвеол и внутрилегочных бронхов изменений не представлял, альвеолы были воздушными. Ателектазов либо отека легочной ткани не наблюдалось. Поперечная исчерченность миофибрилл миокарда была отчетливой. Строение печени нарушений не представляло. Границы гепатоцитов были отчетливые, цитоплазма зернистая, слабобазофильная, ядра светлые с тонкой мембраной и отчетливыми ядрышками. Нефроэпителий с оксифильной зернистой цитоплазмой и светлыми четкими ядрами. Эпителий слизистой желудка сохранен, главные и обкладочные клетки желез желудка не изменены.Хроническое поступление субстанции ОГБХ в организм мышей и крыс через желудок не вызывает дистрофических или деструктивных изменений паренхиматозных органов и не сопровождается раздражением слизистых оболочек желудочно-кишечного тракта. Таким образом, по интегральному показателю хронической летальности и показателям общей нелетальной токсичности субстанция не обладает способностью к кумуляции и нетоксична.При эпикутанном контакте ОГБХ не обладает сенсибилизирующим действием, т.е. не провоцирует развитие аллергии, не обладает токсическим влиянием на репродуктивную функцию и не оказывает мутагенного эффекта. Препарат не обладает местно-раздражающим действием.Пример.2. Оценка антиоксидантной активности субстанцийДля анализа общей антиоксидантной активности субстанций использовали спектрофотометрический метод с дианидизиновым реактивом и рибофлавином по оптической плотности при длине волны 460 нм на спектрофотометре СФ-56. Показатель антиоксидантной активности при этом составил 45 При вскрытии крыс, забитых на следующий день после последнего введения субстанций, размеры, форма и окраска внутренних органов макроскопических изменений по сравнению с контролем не имели. Слизистая оболочка желудка и тонкого кишечника были блестящими, бледно-розовыми, без признаков раздражения или воспаления. При гистологическом исследовании препаратов легких, миокарда, печени, почек и слизистой желудка подопытных животных дистрофических, воспалительных или некробиотических изменений указанных выше органов не наблюдалось.Эпителий альвеол и внутрилегочных бронхов изменений не представлял, альвеолы были воздушными. Ателектазов либо отека легочной ткани не наблюдалось. Поперечная исчерченность миофибрилл миокарда была отчетливой. Строение печени нарушений не представляло. Границы гепатоцитов были отчетливые, цитоплазма зернистая, слабобазофильная, ядра светлые с тонкой мембраной и отчетливыми ядрышками. Нефроэпителий с оксифильной зернистой цитоплазмой и светлыми четкими ядрами. Эпителий слизистой желудка сохранен, главные и обкладочные клетки желез желудка не изменены.Хроническое поступление субстанции ОГБХ в организм мышей и крыс через желудок не вызывает дистрофических или деструктивных изменений паренхиматозных органов и не сопровождается раздражением слизистых оболочек желудочно-кишечного тракта. Таким образом, по интегральному показателю хронической летальности и показателям общей нелетальной токсичности субстанция не обладает способностью к кумуляции и нетоксична.При эпикутанном контакте ОГБХ не обладает сенсибилизирующим действием, т.е. не провоцирует развитие аллергии, не обладает токсическим влиянием на репродуктивную функцию и не оказывает мутагенного эффекта. Препарат не обладает местно-раздражающим действием.Пример.2. Оценка антиоксидантной активности субстанцийДля анализа общей антиоксидантной активности субстанций использовали спектрофотометрический метод с дианидизиновым реактивом и рибофлавином по оптической плотности при длине волны 460 нм на спектрофотометре СФ-56. Показатель антиоксидантной активности при этом составил 45 5 ед. опт. плотности/ мг белка.Пример 3. В условиях примера 1 проводился синтез ОГФБ при изменениях соотношения ингредиентов. Полученные результаты приведены в табл.4. 5 ед. опт. плотности/ мг белка.Пример 3. В условиях примера 1 проводился синтез ОГФБ при изменениях соотношения ингредиентов. Полученные результаты приведены в табл.4.  Пример 4. Испытания влияния препарата, полученного по примеру 1, на пищевые продукты проводилось на кафедре органической, физической и биологической химии Санкт-Петербургского государственного университета низкотемпературных и пищевых технологий. Было изучено влияние различных доз препарата на развитие молочнокислых бактерий в процессе сквашивания молока, их метаболическую активность в процессе хранения при разных температурах, на развитие посторонней микрофлоры в готовых кисломолочных напитках, а также влияние консервантов - ОГБХ и сорбиновой кислоты - на изменение качества сливочного крема в процессе хранения. В качестве объектов исследования были использованы:- ряженка "Нежность", производимая Пискаревским МЗ;- кефир "Доктор", производимый ОАО "Петмол";- йогурт, приготовленный в лаборатории микробиологии СПбГУНиПТ на пастеризованном молоке (пастеризация при 80В°С в течение 5 мин);- простокваша обыкновенная, приготовленная на пастеризованном молоке (режим тот же).Препарат вносили в концентрации 0,05 и 0,01% в готовые кисломолочные продукты - ряженку и кефир, а при приготовлении йогурта и простокваши - перед внесением закваски. В качестве альтернативного консерванта была использована сорбиновая кислота в концентрации 0,01%.В продуктах определяли титруемую кислотность по ГОСТ 3624-92, микробиологические показатели: количество мезофильных аэробных и факультативно-анаэробных микроорганизмов (КМАФАнМ), титр бактерий группы кишечных палочек (БГКП), количество дрожжей и мицелиальных грибов по ГОСТ 9225-87, микроскопическую картину и органолептическую оценку.При исследовании микрофлоры йогурта, приготовленного с добавлением в молоко перед заквашиванием 0,05% ОГБХ, в микроскопическом препарате обнаружены инволюционные формы клеток: у болгарской палочки - грибовидные выросты; у термофильного стрептококка - увеличенные раздутые особи. В связи с этим в дальнейшем доза вносимого препарата была уменьшена до 0,01%.Готовые кисломолочные продукты - ряженку и кефир после внесения консервантов хранили в домашнем холодильнике при температуре 6...8 Пример 4. Испытания влияния препарата, полученного по примеру 1, на пищевые продукты проводилось на кафедре органической, физической и биологической химии Санкт-Петербургского государственного университета низкотемпературных и пищевых технологий. Было изучено влияние различных доз препарата на развитие молочнокислых бактерий в процессе сквашивания молока, их метаболическую активность в процессе хранения при разных температурах, на развитие посторонней микрофлоры в готовых кисломолочных напитках, а также влияние консервантов - ОГБХ и сорбиновой кислоты - на изменение качества сливочного крема в процессе хранения. В качестве объектов исследования были использованы:- ряженка "Нежность", производимая Пискаревским МЗ;- кефир "Доктор", производимый ОАО "Петмол";- йогурт, приготовленный в лаборатории микробиологии СПбГУНиПТ на пастеризованном молоке (пастеризация при 80В°С в течение 5 мин);- простокваша обыкновенная, приготовленная на пастеризованном молоке (режим тот же).Препарат вносили в концентрации 0,05 и 0,01% в готовые кисломолочные продукты - ряженку и кефир, а при приготовлении йогурта и простокваши - перед внесением закваски. В качестве альтернативного консерванта была использована сорбиновая кислота в концентрации 0,01%.В продуктах определяли титруемую кислотность по ГОСТ 3624-92, микробиологические показатели: количество мезофильных аэробных и факультативно-анаэробных микроорганизмов (КМАФАнМ), титр бактерий группы кишечных палочек (БГКП), количество дрожжей и мицелиальных грибов по ГОСТ 9225-87, микроскопическую картину и органолептическую оценку.При исследовании микрофлоры йогурта, приготовленного с добавлением в молоко перед заквашиванием 0,05% ОГБХ, в микроскопическом препарате обнаружены инволюционные формы клеток: у болгарской палочки - грибовидные выросты; у термофильного стрептококка - увеличенные раздутые особи. В связи с этим в дальнейшем доза вносимого препарата была уменьшена до 0,01%.Готовые кисломолочные продукты - ряженку и кефир после внесения консервантов хранили в домашнем холодильнике при температуре 6...8 С и при температуре 37 С и при температуре 37 С. Образцы кефира и ряженки после 2 суток хранения при температуре 37 С. Образцы кефира и ряженки после 2 суток хранения при температуре 37 С потеряли свой товарный вид: появился отстой сыворотки, сгусток стал рваным, на поверхности контрольного образца образовалась пленка, в микроскопическом препарате которой были обнаружены несовершенные дрожжи.В табл. 5 представлены данные по изменению посторонней микрофлоры в кисломолочных продуктах после 12 суток хранения при 6...8 С потеряли свой товарный вид: появился отстой сыворотки, сгусток стал рваным, на поверхности контрольного образца образовалась пленка, в микроскопическом препарате которой были обнаружены несовершенные дрожжи.В табл. 5 представлены данные по изменению посторонней микрофлоры в кисломолочных продуктах после 12 суток хранения при 6...8 С. С. 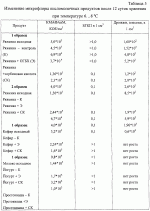 Из табл.5 следует, что ОГБХ, внесенный в кисломолочный продукт как после его изготовления (ряженка, кефир), так и перед сквашиванием молока (йогурт, простокваша), в процессе хранения продуктов при температуре 6...8 Из табл.5 следует, что ОГБХ, внесенный в кисломолочный продукт как после его изготовления (ряженка, кефир), так и перед сквашиванием молока (йогурт, простокваша), в процессе хранения продуктов при температуре 6...8 С подавляет развитие посторонних микроорганизмов: количество мезофильных аэробных и факультативно-анаэробных микроорганизмов (КМАФАнМ) меньше в среднем на один-два порядка, а количество дрожжей - на один порядок по сравнению с количеством таковых в контрольном образце. На бактерии группы кишечных палочек (БГКП) его введение в данных концентрациях не влияет. Что касается сорбиновой кислоты, то она не оказывает существенного влияния на КМАФАнМ и аналогично с ОГБХ подавляет рост дрожжей.Результаты органолептической оценки образцов кефира и ряженки после 12 суток холодильного хранения представлены в табл.6. С подавляет развитие посторонних микроорганизмов: количество мезофильных аэробных и факультативно-анаэробных микроорганизмов (КМАФАнМ) меньше в среднем на один-два порядка, а количество дрожжей - на один порядок по сравнению с количеством таковых в контрольном образце. На бактерии группы кишечных палочек (БГКП) его введение в данных концентрациях не влияет. Что касается сорбиновой кислоты, то она не оказывает существенного влияния на КМАФАнМ и аналогично с ОГБХ подавляет рост дрожжей.Результаты органолептической оценки образцов кефира и ряженки после 12 суток холодильного хранения представлены в табл.6.  Влияние различных доз ОГБХ на микрофлору йогурта и ее метаболическую активность изучалось следующим образом. В стерилизованное молоко вносили 5% закваски для йогурта, приготовленной на основе лифилизированных йогуртных культур фирмы "Висби". Затем в колбы с заквашенным молоком вносили 2, 1, 0,5 и 0, 25% ОГБХ и выдерживали их при температуре 42 Влияние различных доз ОГБХ на микрофлору йогурта и ее метаболическую активность изучалось следующим образом. В стерилизованное молоко вносили 5% закваски для йогурта, приготовленной на основе лифилизированных йогуртных культур фирмы "Висби". Затем в колбы с заквашенным молоком вносили 2, 1, 0,5 и 0, 25% ОГБХ и выдерживали их при температуре 42 С в течение 9 ч. В ходе ферментации определяли титруемую кислотность, время сквашивания молока и микроскопическую картину.В контрольной пробе нарастание кислотности происходило равномерно в течение всего процесса ферментации.В пробе, содержащей 0,25% препарата, кислотность в первые часы нарастала быстрее, чем в контроле, кроме того, сгусток в этой пробе образовался на 30 мин раньше, чем в контрольной пробе. После образования сгустка скорость увеличения кислотности в этой пробе стала меньше по сравнению с контролем. В пробе, содержащей 0,5% препарата, сгусток образовался через 6,5 ч, кривая нарастания кислотности находится на более низком уровне по сравнению с контрольной пробой и пробой, содержащей 0,25% ОГБХ.В пробах, содержащих 1 и 2% препарата, кислотность сначала медленно повышалась до 48 и 36 С в течение 9 ч. В ходе ферментации определяли титруемую кислотность, время сквашивания молока и микроскопическую картину.В контрольной пробе нарастание кислотности происходило равномерно в течение всего процесса ферментации.В пробе, содержащей 0,25% препарата, кислотность в первые часы нарастала быстрее, чем в контроле, кроме того, сгусток в этой пробе образовался на 30 мин раньше, чем в контрольной пробе. После образования сгустка скорость увеличения кислотности в этой пробе стала меньше по сравнению с контролем. В пробе, содержащей 0,5% препарата, сгусток образовался через 6,5 ч, кривая нарастания кислотности находится на более низком уровне по сравнению с контрольной пробой и пробой, содержащей 0,25% ОГБХ.В пробах, содержащих 1 и 2% препарата, кислотность сначала медленно повышалась до 48 и 36 С соответственно, после чего ее нарастание прекратилось. Сгусток в этих пробах не образовался. Таким образом, препарат в дозе 0, 25% повышает метаболическую активность йогуртных культур, дальнейшее увеличение концентрации эпофена привело к подавлению кислотообразующей активности молочнокислых бактерий. Исследование влияния ОГБХ на жизнедеятельность молочнокислых бактерий осуществляли следующим образом. Для исследования были выбраны йогуртные культуры - болгарская палочка Lactobacillus bulgaricus 22K (из коллекции ВНИИМСа) и Streptococcus thermophilus СЛ 26 (из коллекции ВНИИЖа). Культуры вносили в стерилизованное молоко в количестве 5% и инкубировали при 42 С соответственно, после чего ее нарастание прекратилось. Сгусток в этих пробах не образовался. Таким образом, препарат в дозе 0, 25% повышает метаболическую активность йогуртных культур, дальнейшее увеличение концентрации эпофена привело к подавлению кислотообразующей активности молочнокислых бактерий. Исследование влияния ОГБХ на жизнедеятельность молочнокислых бактерий осуществляли следующим образом. Для исследования были выбраны йогуртные культуры - болгарская палочка Lactobacillus bulgaricus 22K (из коллекции ВНИИМСа) и Streptococcus thermophilus СЛ 26 (из коллекции ВНИИЖа). Культуры вносили в стерилизованное молоко в количестве 5% и инкубировали при 42 С. Препарат вносили в количестве 0,01% перед внесением инокулята. Через каждые 3 ч отбирали пробы и определяли титруемую кислотность и число клеток молочнокислых бактерий. В колбах с термофильным стрептококком, как в контрольной, так и с добавлением ОГБХ, сгусток образовался через 3,5 ч, а в колбах с болгарской палочкой - через 4 ч.В табл.7 представлены данные по нарастанию числа клеток и титруемой кислотности молока. Из таблицы следует, что ОГБХ в концентрации 0,01% не оказывает влияния на рост болгарской палочки и термофильного стрептококка, а также на их ферментативную активность. Как в контрольном образце, так и в образце с препаратом число клеток и титруемая кислотность увеличивались идентично. С. Препарат вносили в количестве 0,01% перед внесением инокулята. Через каждые 3 ч отбирали пробы и определяли титруемую кислотность и число клеток молочнокислых бактерий. В колбах с термофильным стрептококком, как в контрольной, так и с добавлением ОГБХ, сгусток образовался через 3,5 ч, а в колбах с болгарской палочкой - через 4 ч.В табл.7 представлены данные по нарастанию числа клеток и титруемой кислотности молока. Из таблицы следует, что ОГБХ в концентрации 0,01% не оказывает влияния на рост болгарской палочки и термофильного стрептококка, а также на их ферментативную активность. Как в контрольном образце, так и в образце с препаратом число клеток и титруемая кислотность увеличивались идентично. 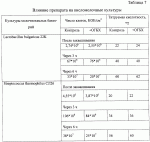 Исследование влияния консервантов на качество сливочного крема осуществляли следующим образом. Сливочный крем был приготовлен на основе масла "Валио" с массовой долей молочного жира 82% и масла "Фермерского" с массовой долей жира 71%, в том числе молочного жира 41%. В готовом креме содержание молочного жира с маслом "Валио" составило 50%, а с маслом фермерским - 25%.В образцы полученного крема вносили 0,02% ОГБХ и 0,02% сорбиновой кислоты. В исходных образцах и в образцах крема после 30 суток холодильного хранения определяли перекисное число (по количеству йода, выделяющегося из пробы с йодидом калия перекисными соединениями) и кислотное число титрованием 0,1 н. раствором КОН. Результаты исследований представлены в табл.8. Как следует из табл.8, после 30 суток хранения крема при температуре 6 Исследование влияния консервантов на качество сливочного крема осуществляли следующим образом. Сливочный крем был приготовлен на основе масла "Валио" с массовой долей молочного жира 82% и масла "Фермерского" с массовой долей жира 71%, в том числе молочного жира 41%. В готовом креме содержание молочного жира с маслом "Валио" составило 50%, а с маслом фермерским - 25%.В образцы полученного крема вносили 0,02% ОГБХ и 0,02% сорбиновой кислоты. В исходных образцах и в образцах крема после 30 суток холодильного хранения определяли перекисное число (по количеству йода, выделяющегося из пробы с йодидом калия перекисными соединениями) и кислотное число титрованием 0,1 н. раствором КОН. Результаты исследований представлены в табл.8. Как следует из табл.8, после 30 суток хранения крема при температуре 6 С перекисное число значительно возросло лишь в образце крема, приготовленного из масла "Валио" с добавлением сорбиновой кислоты. В остальных образцах этот показатель мало отличался от контрольного.Что касается кислотного числа, то наибольшее его значение имел контрольный образец крема из масла "Фермерское". Такие различия, по-видимому, связаны с тем, что массовая доля молочного жира в масле "Валио" почти в два раза выше, чем в "Фермерском". С перекисное число значительно возросло лишь в образце крема, приготовленного из масла "Валио" с добавлением сорбиновой кислоты. В остальных образцах этот показатель мало отличался от контрольного.Что касается кислотного числа, то наибольшее его значение имел контрольный образец крема из масла "Фермерское". Такие различия, по-видимому, связаны с тем, что массовая доля молочного жира в масле "Валио" почти в два раза выше, чем в "Фермерском". 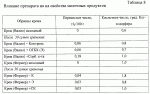 В табл.9 приведены результаты органолептической оценки крема, хранившегося в течение 30 суток при температуре 6 В табл.9 приведены результаты органолептической оценки крема, хранившегося в течение 30 суток при температуре 6 С и в течение 7 суток при комнатной температуре (18...20 С и в течение 7 суток при комнатной температуре (18...20 С). С). 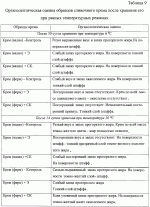 Ощутимые органолептические изменения контрольных образцов крема, хранившегося при температуре 6 Ощутимые органолептические изменения контрольных образцов крема, хранившегося при температуре 6 С, появились через 10 суток хранения, тогда как образцы с консервантами оставались без изменений вкуса, запаха и цвета.Через 30 суток холодильного хранения наибольшая окислительная порча жира была отмечена в контрольных образцах, а наименьшая - в образце с ОГБХ. При этом образцы крема, приготовленные из фермерского масла, были в меньшей степени подвержены окислительной порче, чем образцы крема из масла "Валио", что можно объяснить меньшей массовой долей молочного жира в фермерском масле.Хранение образцов крема при комнатной температуре привело к более быстрой их порче, и через 14 суток жир в контрольных образцах крема был полностью окислен. Органолептические показатели образцов крема с консервантами были намного лучше.Пример 5. В реактор емкостью 0.063 м3 поместили 20 кг гидрохинона, добавили 12 литров 3%-ной перекиси водорода и при перемешивании довели рабочую смесь до температуры 70 С, появились через 10 суток хранения, тогда как образцы с консервантами оставались без изменений вкуса, запаха и цвета.Через 30 суток холодильного хранения наибольшая окислительная порча жира была отмечена в контрольных образцах, а наименьшая - в образце с ОГБХ. При этом образцы крема, приготовленные из фермерского масла, были в меньшей степени подвержены окислительной порче, чем образцы крема из масла "Валио", что можно объяснить меньшей массовой долей молочного жира в фермерском масле.Хранение образцов крема при комнатной температуре привело к более быстрой их порче, и через 14 суток жир в контрольных образцах крема был полностью окислен. Органолептические показатели образцов крема с консервантами были намного лучше.Пример 5. В реактор емкостью 0.063 м3 поместили 20 кг гидрохинона, добавили 12 литров 3%-ной перекиси водорода и при перемешивании довели рабочую смесь до температуры 70 С (до полного растворения гидрохинона), а затем добавили 0.5 кг мочевины и перемешивали в течение получаса, после чего в рабочую смесь добавили 200 см3 5% раствора железного купороса и 15 литров 10% перекиси водорода. По окончании реакции в рабочую смесь добавляли 2 л 25% щелочи (NaOH). Затем рабочую смесь выпаривали, сушили и перекристаллизовывали из водного раствора. Выход субстанции - 17 кг. рН 5% раствора 6.8. Температура плавления - 170 С (до полного растворения гидрохинона), а затем добавили 0.5 кг мочевины и перемешивали в течение получаса, после чего в рабочую смесь добавили 200 см3 5% раствора железного купороса и 15 литров 10% перекиси водорода. По окончании реакции в рабочую смесь добавляли 2 л 25% щелочи (NaOH). Затем рабочую смесь выпаривали, сушили и перекристаллизовывали из водного раствора. Выход субстанции - 17 кг. рН 5% раствора 6.8. Температура плавления - 170 С.УФ-спектр субстанции имеет максимум поглощения при 285 нм, в ИК-спектре имеются характерные для субстанции полосы поглощения при 817, 831, 1520, 1447, 3600-ЗООС см-1, ПМР-спектр имеет характерные сигналы протонов в области 2.6-8.8 м.д. В ИК-спектре полученной субстанции не обнаружено характерных амидных полос 1690-1630 см-1 и 1620-1590 см-1. В ходе проведенного исследования изучалось воздействие полученного препарата на культуры микроорганизмов.Тест-культуры подбирали по принципу их разной чувствительности к неблагоприятным воздействиям внешней среды, в т.ч. к химическим препаратам, обусловленной:- типом строения клеточной стенки (грациликутный, фармикутный, дрожжевой);- наличием на клеточной стенке дополнительных поверхностных слоев (капсул и др.);- происхождением штамма (музейный или клинический изолят);- индивидуальными особенностями микроорганизма;- плотностью популяции микроорганизмов, испытывающей “давление” неблагоприятного фактора.В качестве дополнительного показателя учитывали принадлежность тест-культуры к нормальной (НМ) или условно-патогенной (УПМ) микрофлоры, Перечень и характеристики тест-культур приведены в табл. 10. С.УФ-спектр субстанции имеет максимум поглощения при 285 нм, в ИК-спектре имеются характерные для субстанции полосы поглощения при 817, 831, 1520, 1447, 3600-ЗООС см-1, ПМР-спектр имеет характерные сигналы протонов в области 2.6-8.8 м.д. В ИК-спектре полученной субстанции не обнаружено характерных амидных полос 1690-1630 см-1 и 1620-1590 см-1. В ходе проведенного исследования изучалось воздействие полученного препарата на культуры микроорганизмов.Тест-культуры подбирали по принципу их разной чувствительности к неблагоприятным воздействиям внешней среды, в т.ч. к химическим препаратам, обусловленной:- типом строения клеточной стенки (грациликутный, фармикутный, дрожжевой);- наличием на клеточной стенке дополнительных поверхностных слоев (капсул и др.);- происхождением штамма (музейный или клинический изолят);- индивидуальными особенностями микроорганизма;- плотностью популяции микроорганизмов, испытывающей “давление” неблагоприятного фактора.В качестве дополнительного показателя учитывали принадлежность тест-культуры к нормальной (НМ) или условно-патогенной (УПМ) микрофлоры, Перечень и характеристики тест-культур приведены в табл. 10. 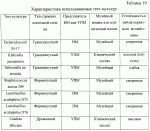 Тест-культуры выращивали в соответствующих питательных средах (Lactobacillus acidophilus в МРС-1; Escherichia coli M-17, Klebsiella pneumonia, Salmonella enteritidis, Staphylococcus aureus 209 - в питательном бульоне; Candida albicans - в мальтозном бульоне) в течение 24 часов при 37 Тест-культуры выращивали в соответствующих питательных средах (Lactobacillus acidophilus в МРС-1; Escherichia coli M-17, Klebsiella pneumonia, Salmonella enteritidis, Staphylococcus aureus 209 - в питательном бульоне; Candida albicans - в мальтозном бульоне) в течение 24 часов при 37 С. Из жидких культур готовили стандартные суспензии плотностью 103-10 КОЕ/мл и наносили по 100 С. Из жидких культур готовили стандартные суспензии плотностью 103-10 КОЕ/мл и наносили по 100 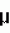 l на поверхность аналогичных агаровых сред, содержащих 0.025-0.5% исследуемых препаратов. Посевы инкубировали при 37 l на поверхность аналогичных агаровых сред, содержащих 0.025-0.5% исследуемых препаратов. Посевы инкубировали при 37 С в течение 5 суток, просматривая ежедневно, после чего производили подсчет колоний. Результаты выражали в lgKOE/мл (см. табл.11).Примечание. В случаях отсутствия роста колоний считали, что 100 мкл пробы содержит менее 1 колонии, т.е. менее 10 колоний в 1 мл. Соответственно lgKOE/мл=1 правильно представлять как lgKOE/мл<1. С в течение 5 суток, просматривая ежедневно, после чего производили подсчет колоний. Результаты выражали в lgKOE/мл (см. табл.11).Примечание. В случаях отсутствия роста колоний считали, что 100 мкл пробы содержит менее 1 колонии, т.е. менее 10 колоний в 1 мл. Соответственно lgKOE/мл=1 правильно представлять как lgKOE/мл<1.
Формула изобретения 1. Добавка к пищевым продуктам, отличающаяся тем, что в ее состав входит 2-(1-окси-4-гидроксифенилен)бензохинон и/или 2-(1-окси-4-гидроксифенилен)-бензохинон кристаллогидрат.2. 2-(1-окси-4-гидроксифенилен)бензохинон общей формулы 3. 2-(1-окси-4-гидроксифенилен)бензохинон кристаллогидрат общей формулы 3. 2-(1-окси-4-гидроксифенилен)бензохинон кристаллогидрат общей формулы 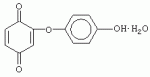 4. Биоцидный препарат, заключающийся в том, что он содержит вещество по п.2.5. Способ получения 2-(1-окси-4-гидроксифенилен)бензохинона, заключающийся в том, что гидрохинон смешивают с гидроперитом в присутствии воды, добавляют 0,001-0,04% от массы смеси солей двухвалентного железа, нейтрализуют полученную смесь и выделяют полученный продукт.6. Способ по п.5, отличающийся тем, что гидрохинон смешивают с гидроперитом в весовом соотношении (30-40):(70-60).7. Способ по п.5, отличающийся тем, что гидроперит получают в ходе реакции в качестве промежуточного продукта взаимодействием мочевины и перекиси водорода. 4. Биоцидный препарат, заключающийся в том, что он содержит вещество по п.2.5. Способ получения 2-(1-окси-4-гидроксифенилен)бензохинона, заключающийся в том, что гидрохинон смешивают с гидроперитом в присутствии воды, добавляют 0,001-0,04% от массы смеси солей двухвалентного железа, нейтрализуют полученную смесь и выделяют полученный продукт.6. Способ по п.5, отличающийся тем, что гидрохинон смешивают с гидроперитом в весовом соотношении (30-40):(70-60).7. Способ по п.5, отличающийся тем, что гидроперит получают в ходе реакции в качестве промежуточного продукта взаимодействием мочевины и перекиси водорода.
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 24.05.2005 Извещение опубликовано: 10.06.2006 БИ: 16/2006 Популярные патенты: 2452155 Лапа культиватора ... лезвиями [2]. Недостатком известной конструкции лапы является ее низкая стойкость, т.к. у неё не регламентировано соотношение размеров наплавленного слоя и толщины металла лапы. Технический результат изобретения - повышение срока службы лапы культиватора при равномерном износе режущей части. Технический результат достигается тем, что в лапе культиватора, содержащей держатель, два крыла с наплавленными износостойким слоем лезвиями и носовую часть, наплавленный износостойкий слой выполнен на наружной поверхности каждого лезвия вдоль режущей кромки под углом 1-30° относительно края режущей кромки к носовой части, а носовая часть с наружной стороны имеет наплавленный слой. ... 2051575 Способ отделения дождевых червей от среды обитания и устройство для его осуществления ... зацепы 13, контактирующие с микропереключателями 14 и 15, соединенными с электрическим двигателем 12 при помощи электрической цепи. Рама 9 выполнена с возможностью перемещения в горизонтальной плоскости. На раме 9 жестко закреплено четыре вертикальных трубы 16. В нижнем основании трубы 16 жестко закреплена гайка 17 с винтовым нарезом, в них установлены винты 18. На винтах 18 жестко закреплены звездочки 19. На звездочках 19 натянута бесконечная цепь 20. Ведущая звездочка 19 соединена с электрическим двигателем 21. В нижнем основании винтов 18 шарнирно закреплен каркас 22 подъемного устройства, содержащий соленоидный захват 23 и соленоидный зацеп 24, контактирующий с ... 2188534 Способ уборки льна-долгунца ... по степени вылежки, так как вылежка верхних слоев стеблей в ленте и ее нижних, контактирующих с льнищем слоев стеблей происходит с разной интенсивностью. Кроме того, верхние и нижние слои стеблей в ленте как льносоломы, так и тресты имеют разный цвет, что недопустимо. В результате этих недостатков при переработке на льнозаводе такой ленты стеблей (такого льносырья) выход и качество вырабатываемого волокна снижаются. Для устранения этих недостатков при указанном способе уборки льна требуется проведение обязательной дополнительной технологической операции - оборачивания ленты, что связано с существенными дополнительными затратами для получения качественного льносырья. Известный ... 2233582 Устройство для охлаждения молока ... очередь, позволяет использовать такие устройства в сочетании с водой низкого качества.Помимо этого использование зазорозадающих прокладок, выполненных из того же материала, что и теплообменные пластины, для формирования размеров, а также герметизации каналов молочного и водяного контуров, исполняющих одновременно с этим роль припоя при сварке теплообменных пластин в среде инертных газов, способствует унификации конструкции теплообменника, так как в данном случае практически полностью снимаются принципиальные ограничения на поперечные размеры каналов теплообменника. Формула изобретения Устройство для охлаждения молока, содержащее проточный теплообменник, вход молочного контура ... 2127256 Замещенные простые оксимовые эфиры и фунгицидное, инсектицидное, арахноицидное средство ... A (см. схему в конце текста). Соединения формулы II, где L обозначает алкоксильную группу C1-C4, известны из EP N 386561 или могут быть получены аналогично описанному там способу. Из них легко могут быть получены соответствующие карбоновые кислоты N (L= OH) обычным способом (см., например, Houben Weyl, Bd E 5, S. 223-254; Org. Reactions 24, (1976), S. 187-224). Затем они могут быть переведены в активированные производные кислот, как, например, имидазолиды кислоты II, где L = имидазол-1-ил или галогениды кислоты II, где L = Cl, Br (Houben Weyl, Bd VIII, S. 463). Полученные соединения формулы II реагируют с первичным или вторичным амином HNR5R6 с получением соответствующего амида ... |
Еще из этого раздела: 2232490 Машина для обработки почвы 2066320 Производные тиазола, способ их получения и способ борьбы с грибками 2120752 Способ консервирования ксеногенных клеток печени 2264065 Способ возделывания сельскохозяйственных культур на корм 2402211 Способ получения трансгенных кроликов, продуцирующих белки в молочную железу 2160520 Способ создания лакричных плантаций, предпочтительно солодки голой, на бросовых землях 2243658 Способ повышения урожайности картофеля и томатов 2455815 Самоходный универсальный комбайн для уборки картофеля и топинамбура 2200947 Способ количественной оценки лесопригодности почвогрунтов 2195644 Монитор для определения качества зерна |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||