Способ получения генетически модифицированных растений картофеля сорта луговской с помощью agrobacterium tumefaciensПатент на изобретение №: 2231550 Автор: Стародубцева А.М. (RU), Белоусова М.Б. (RU), Шульга О.А. (RU), Конов А.Л. (RU), Скрябин К.Г. (RU) Патентообладатель: Центр "Биоинженерия" РАН (RU), Стародубцева Анастасия Михайловна (RU), Белоусова Мария Борисовна (RU), Шульга Ольга Альбертовна (RU), Конов Алексей Львович (RU), Скрябин Константин Георгиевич (RU) Дата публикации: 27 Ноября, 2003 Начало действия патента: 24 Апреля, 2002 Адрес для переписки: 121165, Москва, Г-165, а/я 15, ООО "ППФ-ЮСТИС", пат.пов. А.Е.Груниной Изображения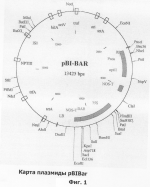 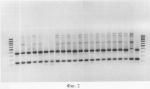 Изобретение относится к селекции растений. Экспланты растений картофеля сорта Луговской сокультивируют с трансформированным штаммом A. timefaciens, а затем помещают на питательную среду для инициации каллусообразования с последующей регенерацией из них фертильных трансгенных растений. Сокультивацию осуществляют контактированием эксплантов с фильтром, смоченным бактериальной суспензией, в течение 48  4 часа. Для инициации каллусообразования используют питательную среду, содержащую зеатин в количестве 0,2-1,0 мг/л, БАП - 0,2-1,0 мг/л и НУК - 0,01-0,05 мг/л. На восьмой день экспланты помещают на среду для регенерации, содержащую зеатин в количестве 0,2-1,0 мг/л, БАП - 0,2-1,0 мг/л и ГК3 - 0,01-0,05 мг/л. В результате увеличивается выход трансформированных растений. 4 з.п. ф-лы, 2 ил., 4 табл.
Изобретение относится к селекции и биотехнологии растений, в частности генной инженерии. Изобретение может быть использовано для получения генетически модифицированных растений картофеля сорта Луговской, экспрессирующего различные гетерологичные гены.Способ получения трансгенных растений картофеля сорта Луговской заключается в генетической трансформации сегментов стебля (эксплантов) in vitro культивируемых растений картофеля методом сокультивирования с Agrobacterium tumefaciens, несущей рекомбинантные плазмиды с селективными, маркерными и полезными генами, и в последующей регенерации до фертильных трансгенных растений, имеющих внесенные гены и сохраняющих все признаки исходного сорта.Картофель (Solanum tuberosum var. tuberosum) выращивается в России повсеместно, практически во всех климатических зонах. Относительно высокая продуктивность при известной простоте возделывания позволяет картофелю стабильно занимать второе место после злаковых культур в отечественном сельскохозяйственном производстве. Сегодня более 90% товарного картофеля производится в личных подсобных хозяйствах (ЛПХ), а для наименее обеспеченных слоев населения картофель находится на первом месте в рационе питания.Таким образом, проблема получения стабильного урожая картофеля является одной из важнейших. В России решение этой проблемы осложняется рядом неблагоприятных факторов, среди которых основное место занимают потери урожая от болезней, вредителей и сорной растительности.Первые работы по трансформации картофеля были начаты в восьмидесятых годах XX века [Ooms G, Hooykaas PJJ, van Veen RJM, van Bellen P, Regensburg-Tuink TJG, Schilperoort RA. Plasmid 1985 7:15-29], и в 1986 году впервые была показана возможность получения картофеля с использованием Agrobacterium tumefaciens [An G., Watson B.D., Chiang C.C. Plant Physiology, 1986, v.81, p.301-305], сотрудниками Центра "Биоинженерия" РАН в 1990-1992 г. [Глагоцкая Т.Ц., Шульга О.А., Сидоров В.А., Захарьев В.М., Скрябин К.Г., Глеба Ю.Ю. ДАН СССР 314, №5, с. 1240-1242, 1990, Feher A., Skryabin K.G., Balazs E., Preiszner J., Shulga O.A., Zakharyev V.M., Dudits D. Plant Cell Reports, 1992, v.11, p.48-52].За первыми попытками последовало более 200 работ, многие из которых посвящены модификации и оптимизации процедуры трансформации [Tavazza R., Tavazza М., Ordas R.J., Ancora G., Benvenuto E. Plant Science, 1988, v.59, p.175-181; Snyder G.W. & Belknap W.R. Plant Cell Reports, 1993, v.12, p.324-327]. Миновав первый этап разработки и освоения методов трансформации, к настоящему моменту во многих странах перешли к этапу внедрения полученных результатов в производство, что, в свою очередь, обусловило переход от работы с модельными, легко трансформируемыми генотипами к коммерческим генотипам (сортам). Однако подавляющее большинство коммерческих сортов картофеля, включая и основные российские сорта, не относится к легкотрансформируемым.Несмотря на усилия по созданию единой эффективной методики трансформации, такая система трансформации для различных генотипов (сортов) до сих пор не создана. При необходимости получения модифицированных растений труднотрансформируемых коммерческих сортов приходится проводить оптимизацию протокола для каждого генотипа [Wordragen M.F. & Dons H.J.M. Plant Molecular biology reporter, 1992, v.10(1), p.12-36].Наиболее близким к предложенному является способ получения генетически модифицированных растений картофеля [Гулина И.В. Создание трансгенных растений картофеля, экспрессирующих модифицированный ген 4 часа. Для инициации каллусообразования используют питательную среду, содержащую зеатин в количестве 0,2-1,0 мг/л, БАП - 0,2-1,0 мг/л и НУК - 0,01-0,05 мг/л. На восьмой день экспланты помещают на среду для регенерации, содержащую зеатин в количестве 0,2-1,0 мг/л, БАП - 0,2-1,0 мг/л и ГК3 - 0,01-0,05 мг/л. В результате увеличивается выход трансформированных растений. 4 з.п. ф-лы, 2 ил., 4 табл.
Изобретение относится к селекции и биотехнологии растений, в частности генной инженерии. Изобретение может быть использовано для получения генетически модифицированных растений картофеля сорта Луговской, экспрессирующего различные гетерологичные гены.Способ получения трансгенных растений картофеля сорта Луговской заключается в генетической трансформации сегментов стебля (эксплантов) in vitro культивируемых растений картофеля методом сокультивирования с Agrobacterium tumefaciens, несущей рекомбинантные плазмиды с селективными, маркерными и полезными генами, и в последующей регенерации до фертильных трансгенных растений, имеющих внесенные гены и сохраняющих все признаки исходного сорта.Картофель (Solanum tuberosum var. tuberosum) выращивается в России повсеместно, практически во всех климатических зонах. Относительно высокая продуктивность при известной простоте возделывания позволяет картофелю стабильно занимать второе место после злаковых культур в отечественном сельскохозяйственном производстве. Сегодня более 90% товарного картофеля производится в личных подсобных хозяйствах (ЛПХ), а для наименее обеспеченных слоев населения картофель находится на первом месте в рационе питания.Таким образом, проблема получения стабильного урожая картофеля является одной из важнейших. В России решение этой проблемы осложняется рядом неблагоприятных факторов, среди которых основное место занимают потери урожая от болезней, вредителей и сорной растительности.Первые работы по трансформации картофеля были начаты в восьмидесятых годах XX века [Ooms G, Hooykaas PJJ, van Veen RJM, van Bellen P, Regensburg-Tuink TJG, Schilperoort RA. Plasmid 1985 7:15-29], и в 1986 году впервые была показана возможность получения картофеля с использованием Agrobacterium tumefaciens [An G., Watson B.D., Chiang C.C. Plant Physiology, 1986, v.81, p.301-305], сотрудниками Центра "Биоинженерия" РАН в 1990-1992 г. [Глагоцкая Т.Ц., Шульга О.А., Сидоров В.А., Захарьев В.М., Скрябин К.Г., Глеба Ю.Ю. ДАН СССР 314, №5, с. 1240-1242, 1990, Feher A., Skryabin K.G., Balazs E., Preiszner J., Shulga O.A., Zakharyev V.M., Dudits D. Plant Cell Reports, 1992, v.11, p.48-52].За первыми попытками последовало более 200 работ, многие из которых посвящены модификации и оптимизации процедуры трансформации [Tavazza R., Tavazza М., Ordas R.J., Ancora G., Benvenuto E. Plant Science, 1988, v.59, p.175-181; Snyder G.W. & Belknap W.R. Plant Cell Reports, 1993, v.12, p.324-327]. Миновав первый этап разработки и освоения методов трансформации, к настоящему моменту во многих странах перешли к этапу внедрения полученных результатов в производство, что, в свою очередь, обусловило переход от работы с модельными, легко трансформируемыми генотипами к коммерческим генотипам (сортам). Однако подавляющее большинство коммерческих сортов картофеля, включая и основные российские сорта, не относится к легкотрансформируемым.Несмотря на усилия по созданию единой эффективной методики трансформации, такая система трансформации для различных генотипов (сортов) до сих пор не создана. При необходимости получения модифицированных растений труднотрансформируемых коммерческих сортов приходится проводить оптимизацию протокола для каждого генотипа [Wordragen M.F. & Dons H.J.M. Plant Molecular biology reporter, 1992, v.10(1), p.12-36].Наиболее близким к предложенному является способ получения генетически модифицированных растений картофеля [Гулина И.В. Создание трансгенных растений картофеля, экспрессирующих модифицированный ген  -эндотоксина из В. thuringiensisvar tenebrionis. Диссертация, М., 1994, с.9, б-ка Института молекулярной биологии им. В.А.Энгельгардта].Этот способ получения генетически модифицированных растений картофеля осуществляется следующим образом (модификация известного метода Horsch R.B., Rogers S.G., Fraley R.T. Transgenic plants. Cold Spring Harb Symp Quant Biol. 1985; 50:433-7).Стеблевые сегменты картофеля получали из растений, выращенных асептически в течение четырех недель на среде S1, и переносили их в жидкую среду MS. Ночную культуру штамма Agrobacterium tumefaciens добавляли к стеблевым сегментам, находящимся в чашке Петри в 10 мл жидкой среды MS, таким образом, чтобы соотношение культуры штамма Agrobacterium и среды инкубирования составляло 1:20. Сокультивирование штамма Agrobacterium и стеблевых сегментов растений картофеля проводили в течение 16-18 часов при 28 -эндотоксина из В. thuringiensisvar tenebrionis. Диссертация, М., 1994, с.9, б-ка Института молекулярной биологии им. В.А.Энгельгардта].Этот способ получения генетически модифицированных растений картофеля осуществляется следующим образом (модификация известного метода Horsch R.B., Rogers S.G., Fraley R.T. Transgenic plants. Cold Spring Harb Symp Quant Biol. 1985; 50:433-7).Стеблевые сегменты картофеля получали из растений, выращенных асептически в течение четырех недель на среде S1, и переносили их в жидкую среду MS. Ночную культуру штамма Agrobacterium tumefaciens добавляли к стеблевым сегментам, находящимся в чашке Петри в 10 мл жидкой среды MS, таким образом, чтобы соотношение культуры штамма Agrobacterium и среды инкубирования составляло 1:20. Сокультивирование штамма Agrobacterium и стеблевых сегментов растений картофеля проводили в течение 16-18 часов при 28 С в темноте. По окончании инкубации сегменты переносили на среду MS, содержащую агар в концентрации 0,7%. Через трое суток сегменты переносили на среду MSV с фитогармонами состава: 0,2 мг/л НУК, 1 мг/л зеатина, 0,02 мг/л ГК3, 1 мг/л БАП, соли MS, 0,7% агар, 100 мкг/мл цефотаксима, 200 мкг/мл карбенициллина, 50 мкг/мл канамицина. Регенеранты переносили на среду S1, содержащую селективный агент и цефортаксим, чтобы предупредить агробактериальное заражение растений.Данная методика не является эффективной для картофеля сорта Невский.В ближайшем аналоге раскрыта методика получения трансгенного картофеля на примере другого сорта. По мнению авторов заявки и большинства специалистов в данной области процессы регенерации и трансформации растений являются генотипзависимыми, то есть эффективность и возможность получения положительного результата во многом определяются самим генотипом (в данном случае - сортом).Из этого следует, что для достижения высокой эффективности необходимо заново подобрать все условия (параметры) регенерации - трансформации для каждого конкретного сорта (генотипа).Авторы использовали известную методику для сорта Луговской и получили низкую эффективность регенерации и трансформации (эти цифры приведены ниже).Задачей изобретения является создание эффективной методики для трансформации растений картофеля сорта Луговской.Технический результат изобретения заключается в повышении эффективности трансформации данного генотипа.Развитие биотехнологии привело к переходу от фундаментальных работ к решению практических задач сельского хозяйства, фармацевтики, медицины. Для решения таких задач возникает проблема не просто получения трансгенного растения, а получения достаточного (по разным оценкам от сотен до нескольких тысяч) количества первичных трансгенных растений - индивидуальных трансформационных событий, среди общего пула которых возможно будет выбрать удовлетворяющие всем требованиям селекционеров-оригинаторов (трансгенное растение не должно отличаться от исходного по сортовым характеристикам), требованиям биобезопасности (стабильности введенной вставки в геноме в поколениях и т.д.), требованиям пищевой безопасности (генетически модифицированное не должно отличаться от исходного растения по пищевым и токсикологическим характеристикам). Таким образом, чем большее количество первичных трансгенных растений будет получено, тем быстрее и эффективнее будет решена конкретная задача.Эффективность трансформации, понимаемая как отношение количества первичных трансгенных растений (для которых подтверждено наличие вставки в геноме) к общему количеству полученных регенерантов, напрямую зависит от эффективности регенерации, которая определяется как отношение количества полученных регенерантов (среди них могут быть как трансгенные, так и “пустые” нетрансгенные растения) к количеству эксплантов (то есть к количеству затраченного исходного материала). Оба показателя обычно представляют в процентах.Технический результат достигается тем, что в способе получения генетически модифицированных растений картофеля, заключающемся в сокультивировании эксплантов со штаммом Agrobacterium tumefaciens, несущим рекомбинантные плазмиды с селективными, маркерными и полезными генами, помещении эксплантов на питательную среду для инициации каллусообразования и последующей регенерации до фертильных трансгенных растений, имеющих внесенные гены и признаки исходного сорта, сокультивацию эксплантов картофеля сорта Невский предпочтительно осуществлять путем нанесения суспензии штамма Agrobacterium на поверхность агаризованной питательной среды, накрывания его бумажным фильтром, раскладывания на фильтре эксплантов и выдержки в течение 48 С в темноте. По окончании инкубации сегменты переносили на среду MS, содержащую агар в концентрации 0,7%. Через трое суток сегменты переносили на среду MSV с фитогармонами состава: 0,2 мг/л НУК, 1 мг/л зеатина, 0,02 мг/л ГК3, 1 мг/л БАП, соли MS, 0,7% агар, 100 мкг/мл цефотаксима, 200 мкг/мл карбенициллина, 50 мкг/мл канамицина. Регенеранты переносили на среду S1, содержащую селективный агент и цефортаксим, чтобы предупредить агробактериальное заражение растений.Данная методика не является эффективной для картофеля сорта Невский.В ближайшем аналоге раскрыта методика получения трансгенного картофеля на примере другого сорта. По мнению авторов заявки и большинства специалистов в данной области процессы регенерации и трансформации растений являются генотипзависимыми, то есть эффективность и возможность получения положительного результата во многом определяются самим генотипом (в данном случае - сортом).Из этого следует, что для достижения высокой эффективности необходимо заново подобрать все условия (параметры) регенерации - трансформации для каждого конкретного сорта (генотипа).Авторы использовали известную методику для сорта Луговской и получили низкую эффективность регенерации и трансформации (эти цифры приведены ниже).Задачей изобретения является создание эффективной методики для трансформации растений картофеля сорта Луговской.Технический результат изобретения заключается в повышении эффективности трансформации данного генотипа.Развитие биотехнологии привело к переходу от фундаментальных работ к решению практических задач сельского хозяйства, фармацевтики, медицины. Для решения таких задач возникает проблема не просто получения трансгенного растения, а получения достаточного (по разным оценкам от сотен до нескольких тысяч) количества первичных трансгенных растений - индивидуальных трансформационных событий, среди общего пула которых возможно будет выбрать удовлетворяющие всем требованиям селекционеров-оригинаторов (трансгенное растение не должно отличаться от исходного по сортовым характеристикам), требованиям биобезопасности (стабильности введенной вставки в геноме в поколениях и т.д.), требованиям пищевой безопасности (генетически модифицированное не должно отличаться от исходного растения по пищевым и токсикологическим характеристикам). Таким образом, чем большее количество первичных трансгенных растений будет получено, тем быстрее и эффективнее будет решена конкретная задача.Эффективность трансформации, понимаемая как отношение количества первичных трансгенных растений (для которых подтверждено наличие вставки в геноме) к общему количеству полученных регенерантов, напрямую зависит от эффективности регенерации, которая определяется как отношение количества полученных регенерантов (среди них могут быть как трансгенные, так и “пустые” нетрансгенные растения) к количеству эксплантов (то есть к количеству затраченного исходного материала). Оба показателя обычно представляют в процентах.Технический результат достигается тем, что в способе получения генетически модифицированных растений картофеля, заключающемся в сокультивировании эксплантов со штаммом Agrobacterium tumefaciens, несущим рекомбинантные плазмиды с селективными, маркерными и полезными генами, помещении эксплантов на питательную среду для инициации каллусообразования и последующей регенерации до фертильных трансгенных растений, имеющих внесенные гены и признаки исходного сорта, сокультивацию эксплантов картофеля сорта Невский предпочтительно осуществлять путем нанесения суспензии штамма Agrobacterium на поверхность агаризованной питательной среды, накрывания его бумажным фильтром, раскладывания на фильтре эксплантов и выдержки в течение 48 4 часов при 18-21 4 часов при 18-21 1 1 C, для инициации каллусообразования используют питательную среду, содержащую зеатин в количестве 0,5-3,5 мг/л и НУК в количестве 0,01-0,05 мг/л, а на среду для регенерации, содержащую зеатин в количестве 0,5-3,5 мг/л и ГК3 в количестве 0,01-0,05 мг/л, экпланты переносят на восьмой день.Для подготовки штамма Agrobacterium tumefaciens его предварительно целесообразно засевать штрихом на питательную среду на 3 C, для инициации каллусообразования используют питательную среду, содержащую зеатин в количестве 0,5-3,5 мг/л и НУК в количестве 0,01-0,05 мг/л, а на среду для регенерации, содержащую зеатин в количестве 0,5-3,5 мг/л и ГК3 в количестве 0,01-0,05 мг/л, экпланты переносят на восьмой день.Для подготовки штамма Agrobacterium tumefaciens его предварительно целесообразно засевать штрихом на питательную среду на 3 0,5 суток в темноте при 24-29 0,5 суток в темноте при 24-29 С, за двое суток до сокультивации засевают полученной смесью колоний первую ночную культуру штамма Agrobacterium в питательной среде, за одни сутки до сокультивации засевают вторую ночную культуру путем внесения в питательную среду первой ночной культуры, в день сокультивации концентрируют ночную культуру, то есть осаждают и разводят осадок в жидкой среде.Кроме того, после сокультивации отмывку эксплантов можно осуществлять путем помещения эксплантов в раствор, содержащий жидкую среду и антибиотик, подавляющий развитие штамма Agrobacterium, на 5-40 минут при комнатной температуре.В другом более предпочтительном варианте после помещения эксплантов в раствор отмывку можно проводить с использованием ротационной качалки.Перечень графических материаловНа фиг.1 приведена карта плазмиды pBIBar.На фиг.2 приведен пример электрофоретического анализа продуктов ПЦР на препаратах ДНК модифицированных линий сорта Луговской (негатив). Дорожки:1, 24 - маркер молекулярной массы GeneRuler Fermentas, 100bp;3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21 - ПЦР на препаратах ДНК растений, в которых обнаружен перенесенный ген thau II;22 - ПЦР на препарате ДНК растений исходного нетрансформированного сорта Чародей;2, 23 - продукт ПЦР на плазмидной ДНК (0,1 нг/реакцию), использованной для трансформации растений.Способ получения генетически модифицированных растений картофеля сорта Луговской осуществляют следующим образом.Данный протокол рассчитан на постановку одного трансформационного эксперимента, исходя из среднего количества исходных материнских растений - 100 С, за двое суток до сокультивации засевают полученной смесью колоний первую ночную культуру штамма Agrobacterium в питательной среде, за одни сутки до сокультивации засевают вторую ночную культуру путем внесения в питательную среду первой ночной культуры, в день сокультивации концентрируют ночную культуру, то есть осаждают и разводят осадок в жидкой среде.Кроме того, после сокультивации отмывку эксплантов можно осуществлять путем помещения эксплантов в раствор, содержащий жидкую среду и антибиотик, подавляющий развитие штамма Agrobacterium, на 5-40 минут при комнатной температуре.В другом более предпочтительном варианте после помещения эксплантов в раствор отмывку можно проводить с использованием ротационной качалки.Перечень графических материаловНа фиг.1 приведена карта плазмиды pBIBar.На фиг.2 приведен пример электрофоретического анализа продуктов ПЦР на препаратах ДНК модифицированных линий сорта Луговской (негатив). Дорожки:1, 24 - маркер молекулярной массы GeneRuler Fermentas, 100bp;3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21 - ПЦР на препаратах ДНК растений, в которых обнаружен перенесенный ген thau II;22 - ПЦР на препарате ДНК растений исходного нетрансформированного сорта Чародей;2, 23 - продукт ПЦР на плазмидной ДНК (0,1 нг/реакцию), использованной для трансформации растений.Способ получения генетически модифицированных растений картофеля сорта Луговской осуществляют следующим образом.Данный протокол рассчитан на постановку одного трансформационного эксперимента, исходя из среднего количества исходных материнских растений - 100 10 шт. Среднее количество эксплантов - 500 10 шт. Среднее количество эксплантов - 500 50 шт.Культура исходных растений: исходные растения, свободные от вирусной и вироидной инфекции, культивировали в асептических условиях в культуре in vitro. Для этого стебли исходных растений нарезали на черенки с одной пазушной почкой и культивировали в вегетационных сосудах на питательной среде, содержащей минеральные соли и витамины (например, среда Msbase, табл.1) при температуре +18-22 50 шт.Культура исходных растений: исходные растения, свободные от вирусной и вироидной инфекции, культивировали в асептических условиях в культуре in vitro. Для этого стебли исходных растений нарезали на черенки с одной пазушной почкой и культивировали в вегетационных сосудах на питательной среде, содержащей минеральные соли и витамины (например, среда Msbase, табл.1) при температуре +18-22 1 1 С в дневное и +15-18 С в дневное и +15-18 1 1 С в ночное время; фотопериодичности 16 часов день/8 часов ночь (освещенность 120 С в ночное время; фотопериодичности 16 часов день/8 часов ночь (освещенность 120  Е) 3-5 недель.Подготовку штамма Agrobacterium проводили следующим образом.Засевали штамм Agrobacterium tumefaciens штрихом на питательную среду (например, среда LB, табл.4), на 3 Е) 3-5 недель.Подготовку штамма Agrobacterium проводили следующим образом.Засевали штамм Agrobacterium tumefaciens штрихом на питательную среду (например, среда LB, табл.4), на 3 0,5 суток в темноте, при +25-28 0,5 суток в темноте, при +25-28 1 1 С. За два дня до планируемой трансформации засевали смесью колоний первую (I) ночную культуру штамма Agrobacterium объемом 1-6 мл С. За два дня до планируемой трансформации засевали смесью колоний первую (I) ночную культуру штамма Agrobacterium объемом 1-6 мл  0,2 в питательной среде (например, среда LB, табл.4) при +25-28 0,2 в питательной среде (например, среда LB, табл.4) при +25-28 1 1 С, 100-140 С, 100-140 10 об/мин.За день до сокультивации засевали вторую (II) ночную культуру объемом 5-10 10 об/мин.За день до сокультивации засевали вторую (II) ночную культуру объемом 5-10 3 мл. Для этого вносили в питательную среду (например, среда LB, табл.4) ночную культуру I в количестве 1/100 от конечного объема. Культивировали при +25-28 3 мл. Для этого вносили в питательную среду (например, среда LB, табл.4) ночную культуру I в количестве 1/100 от конечного объема. Культивировали при +25-28 1 1 С, 100-140 С, 100-140 10 об/мин.Первый день трансформацииКонцентрировали ночную культуру II, осадив при 3,5-5 10 об/мин.Первый день трансформацииКонцентрировали ночную культуру II, осадив при 3,5-5 0,5 тыс. об/мин в течение 3-10 0,5 тыс. об/мин в течение 3-10 1 мин. Разводили полученный осадок в 3-10 1 мин. Разводили полученный осадок в 3-10 1 мл жидкой среды (например, среда СМ, табл. 1).Нарезали стебель на сегменты без пазушных почек длиной 5-10 1 мл жидкой среды (например, среда СМ, табл. 1).Нарезали стебель на сегменты без пазушных почек длиной 5-10 2 мм.1. Сокультивация.В чашки Петри помещали стерильные бумажные фильтры, равномерно смачивали их небольшим количеством разведенной суспензии штамма Agrobacterium (1-3 2 мм.1. Сокультивация.В чашки Петри помещали стерильные бумажные фильтры, равномерно смачивали их небольшим количеством разведенной суспензии штамма Agrobacterium (1-3 0,5 мл), экспланты раскладывали на влажном фильтре для сокультивации на 48 0,5 мл), экспланты раскладывали на влажном фильтре для сокультивации на 48 4 часов при 18-21 4 часов при 18-21 1 1 С.В контрольном варианте использовали вместо суспензии штамма Agrobacterium такое же количество жидкой питательной среды (например, среда CM, табл.1).2. Отмывка эксплантов.Вариант I. Помещали экспланты в раствор (15-50 С.В контрольном варианте использовали вместо суспензии штамма Agrobacterium такое же количество жидкой питательной среды (например, среда CM, табл.1).2. Отмывка эксплантов.Вариант I. Помещали экспланты в раствор (15-50 10 мл), содержащий жидкую среду (например, среда Msbase, табл.1) и раствор антибиотика, подавляющего развитие штамма Agrobacterium, на 10-30В±5 минут при комнатной температуре (18-20 10 мл), содержащий жидкую среду (например, среда Msbase, табл.1) и раствор антибиотика, подавляющего развитие штамма Agrobacterium, на 10-30В±5 минут при комнатной температуре (18-20 1 1 С).Вариант II. Экспланты в растворе жидкой среды и антибиотика, приготовленном как в способе I, отмывали с использованием ротационной качалки (шейкера) при 50-70 С).Вариант II. Экспланты в растворе жидкой среды и антибиотика, приготовленном как в способе I, отмывали с использованием ротационной качалки (шейкера) при 50-70 10 об/мин в течение 15-30 10 об/мин в течение 15-30 10 минут при комнатной температуре (18-20 10 минут при комнатной температуре (18-20 1 1 С).Третий день трансформацииПосле сокультивации (включая этап отмывки, когда она необходима) помещали экспланты на питательную среду (например, среда CIM, табл.1) для инициации каллусообразования.Использовали в питательной среде для инициации каллусообразования: зеатин в концентрации от 0,3 до 0,9 С).Третий день трансформацииПосле сокультивации (включая этап отмывки, когда она необходима) помещали экспланты на питательную среду (например, среда CIM, табл.1) для инициации каллусообразования.Использовали в питательной среде для инициации каллусообразования: зеатин в концентрации от 0,3 до 0,9 0,1 мг/л, БАП в концентрации от 0,3 до 0,9 0,1 мг/л, БАП в концентрации от 0,3 до 0,9 0,1 мг/л и НУК в концентрации от 0,02 до 0,04 0,1 мг/л и НУК в концентрации от 0,02 до 0,04 0,01 мг/л.Восьмой деньПереносили экспланты на чашки со средой для регенерации (например, среда RM, табл.1) с добавлением селективного агента, выбранного в зависимости от используемой генетической конструкции.Для тестирования эффективности процесса регенерации в контрольных вариантах использовали среду для регенерации, без добавления селективного агента (например, среда RM, табл.1).Использовали в питательной среде для регенерации зеатин в концентрации от 0,3 до0,9 0,01 мг/л.Восьмой деньПереносили экспланты на чашки со средой для регенерации (например, среда RM, табл.1) с добавлением селективного агента, выбранного в зависимости от используемой генетической конструкции.Для тестирования эффективности процесса регенерации в контрольных вариантах использовали среду для регенерации, без добавления селективного агента (например, среда RM, табл.1).Использовали в питательной среде для регенерации зеатин в концентрации от 0,3 до0,9 0,1 мг/л, БАП в концентрации от 0,3 до 0,9 0,1 мг/л, БАП в концентрации от 0,3 до 0,9 0,1 мг/л и ГК3 в концентрации от 0,02 до 0,04 0,1 мг/л и ГК3 в концентрации от 0,02 до 0,04 0,01 мг/л.Через каждые 14 днейПереносили экспланты на свежие чашки Петри со средой для регенерации того же состава.При появлении регенерантовСрезали регенеранты и переносили их в пробирки, содержащие среду для укоренения (например, среда RIM, табл. 1).Первичные регенеранты, укоренившиеся на селективной среде, считали прошедшими первичный отбор.Далее прошедшие отбор первичные регенеранты проверяли на наличие перенесенной генетической конструкции при помощи ПЦР-анализа с праймерами, специфичными для кодирующей области трансгенной конструкции. Уровень экспрессии целевого гена проверяли при помощи иммуноферментного анализа [Towbin H., Staehelin Т., Gordon J. Proc. Natl. Acad. Sci. USA 1979, v.76(9):4350-4].Эффективность регенерации по предлагаемому способу для сорта Луговской составляет 84,4% по сравнению с 40,0% для способа по ближайшему аналогу.Эффективность трансформации в целом по предлагаемому способу составляет 23,8% по сравнению с 13,4% для способа по ближайшему аналогу.Экспериментальный пример использования патентуемого способа получения трансгенных растений картофеля сорта ЛуговскойЭксперимент по получению трансгенных растений картофеля сорта Луговской, экспрессирующих ген bar, обеспечивающий устойчивость растений к гербицидам на основе фосфинотрицина.Культура исходных растений: исходные растения, свободные от вирусной и вироидной инфекции, в количестве 97 шт. культивировали в асептических условиях в культуре in vitro. Для этого стебли исходных растений нарезали на черенки с одной пазушной почкой и культивировали в вегетационных сосудах на питательной среде, содержащей минеральные соли и витамины (среда Msbase, табл.1) при температуре +18-21 0,01 мг/л.Через каждые 14 днейПереносили экспланты на свежие чашки Петри со средой для регенерации того же состава.При появлении регенерантовСрезали регенеранты и переносили их в пробирки, содержащие среду для укоренения (например, среда RIM, табл. 1).Первичные регенеранты, укоренившиеся на селективной среде, считали прошедшими первичный отбор.Далее прошедшие отбор первичные регенеранты проверяли на наличие перенесенной генетической конструкции при помощи ПЦР-анализа с праймерами, специфичными для кодирующей области трансгенной конструкции. Уровень экспрессии целевого гена проверяли при помощи иммуноферментного анализа [Towbin H., Staehelin Т., Gordon J. Proc. Natl. Acad. Sci. USA 1979, v.76(9):4350-4].Эффективность регенерации по предлагаемому способу для сорта Луговской составляет 84,4% по сравнению с 40,0% для способа по ближайшему аналогу.Эффективность трансформации в целом по предлагаемому способу составляет 23,8% по сравнению с 13,4% для способа по ближайшему аналогу.Экспериментальный пример использования патентуемого способа получения трансгенных растений картофеля сорта ЛуговскойЭксперимент по получению трансгенных растений картофеля сорта Луговской, экспрессирующих ген bar, обеспечивающий устойчивость растений к гербицидам на основе фосфинотрицина.Культура исходных растений: исходные растения, свободные от вирусной и вироидной инфекции, в количестве 97 шт. культивировали в асептических условиях в культуре in vitro. Для этого стебли исходных растений нарезали на черенки с одной пазушной почкой и культивировали в вегетационных сосудах на питательной среде, содержащей минеральные соли и витамины (среда Msbase, табл.1) при температуре +18-21 1 1 С в дневное и +15-18 С в дневное и +15-18 1 1 С в ночное время; фотопериодичности 16 часов день/8 часов ночь (освещенность 120 С в ночное время; фотопериодичности 16 часов день/8 часов ночь (освещенность 120  Е) 3-5 недель.Для трансформации использовали штамм Agrobacterium tumefaciens LBA 4404, содержащий плазмиду pBIBar (фиг.1), в состав кассеты экспрессии которой входят генетические конструкции: промотор pNOS - ген NPTII - NOS-T терминатор 35S промотор - ген bar - NOS Т' терминатор.Подготовку штамма A. tumefaciens LBA 4404 проводили следующим образом. Засевали штамм A. tumefaciens LBA 4404 штрихом на питательную среду LB (табл.4), содержащую селективные антибиотики рифампицин и канамицин в концентрации 50 мг/л каждого, на 3 Е) 3-5 недель.Для трансформации использовали штамм Agrobacterium tumefaciens LBA 4404, содержащий плазмиду pBIBar (фиг.1), в состав кассеты экспрессии которой входят генетические конструкции: промотор pNOS - ген NPTII - NOS-T терминатор 35S промотор - ген bar - NOS Т' терминатор.Подготовку штамма A. tumefaciens LBA 4404 проводили следующим образом. Засевали штамм A. tumefaciens LBA 4404 штрихом на питательную среду LB (табл.4), содержащую селективные антибиотики рифампицин и канамицин в концентрации 50 мг/л каждого, на 3 0,5 суток в темноте, при +26 0,5 суток в темноте, при +26 1 1 С.За два дня до планируемой трансформации засевали смесью колоний первую (I) ночную культуру штамма A. tumefaciens LBA 4404 объемом 6В±0,2 мл в питательной среде LB (табл.4), содержащей селективные антибиотики рифампицин и канамицин в концентрации 50 мг/л каждого, при +26 С.За два дня до планируемой трансформации засевали смесью колоний первую (I) ночную культуру штамма A. tumefaciens LBA 4404 объемом 6В±0,2 мл в питательной среде LB (табл.4), содержащей селективные антибиотики рифампицин и канамицин в концентрации 50 мг/л каждого, при +26 1 1 С, 100-140 С, 100-140 10 об/мин.За день до сокультивации засевали вторую (II) ночную культуру объемом 6 10 об/мин.За день до сокультивации засевали вторую (II) ночную культуру объемом 6 1 мл. Для этого вносили в питательную среду LB (табл.4), содержащую селективные антибиотики рифампицин и канамицин в концентрации 50 мг/л каждого, ночную культуру I в количестве 1/100 от конечного объема. Культивировали при +26 1 мл. Для этого вносили в питательную среду LB (табл.4), содержащую селективные антибиотики рифампицин и канамицин в концентрации 50 мг/л каждого, ночную культуру I в количестве 1/100 от конечного объема. Культивировали при +26 1 1 С, 100-140 С, 100-140 10 об/мин.Первый день трансформацииСконцентрировали ночную культуру II, осадив при 3,5 10 об/мин.Первый день трансформацииСконцентрировали ночную культуру II, осадив при 3,5 0,5 тыс. об/мин в течение 3 0,5 тыс. об/мин в течение 3 1 мин. Развели полученный осадок в 5 1 мин. Развели полученный осадок в 5 1 мл жидкой среды (среда СМ, табл.1). Нарезали стебель на сегменты без пазушных почек длиной 5-10 1 мл жидкой среды (среда СМ, табл.1). Нарезали стебель на сегменты без пазушных почек длиной 5-10 2 мм. Для проведения этапа сокультивации в чашки Петри помещали стерильные бумажные фильтры, равномерно смачивали их небольшим количеством разведенной суспензии штамма A. tumefaciens LBA 4404 (2 2 мм. Для проведения этапа сокультивации в чашки Петри помещали стерильные бумажные фильтры, равномерно смачивали их небольшим количеством разведенной суспензии штамма A. tumefaciens LBA 4404 (2 0,5 мл), экспланты раскладывали на влажном фильтре для сокультивации на 48 0,5 мл), экспланты раскладывали на влажном фильтре для сокультивации на 48 4 часов при 18-21 4 часов при 18-21 1 1 С.В контрольном варианте вместо суспензии штамма A. tumefaciens LBA 4404 использовали такое же количество жидкой питательной среды (среда СМ, табл.1).После проведения этапа сокультивации экспланты не отмывали, так как это не было необходимо.Третий день трансформацииПосле сокультивации помещали экспланты на питательную среду (среда CIM, табл.1) для инициации каллусообразования.Использовали в питательной среде для инициации каллусообразования: зеатин в концентрации 1,0 С.В контрольном варианте вместо суспензии штамма A. tumefaciens LBA 4404 использовали такое же количество жидкой питательной среды (среда СМ, табл.1).После проведения этапа сокультивации экспланты не отмывали, так как это не было необходимо.Третий день трансформацииПосле сокультивации помещали экспланты на питательную среду (среда CIM, табл.1) для инициации каллусообразования.Использовали в питательной среде для инициации каллусообразования: зеатин в концентрации 1,0 0,01 мг/л, БАП в концентрации от 1,0 0,01 мг/л, БАП в концентрации от 1,0 0,01 мг/л и ПУК в концентрации 0,02 0,01 мг/л и ПУК в концентрации 0,02 0,001 мг/л.Восьмой деньПереносили экспланты на чашки со средой RM для регенерации (среда RM, табл.1) с добавлением селективного агента фосфинотрицина в концентрации 10 мг/л. В качестве селективного агента использовали фосфинотрицин, так как генетическая конструкция содержит ген bar, кодирующий фермент фосфинотрицил ацетил трансферазу (ФАТ), экспрессия которого обеспечивает устойчивость к фосфинотрицину.Для тестирования эффективности процесса регенерации в контрольных вариантах использовали среду для регенерации без добавления селективного агента (среда RM, табл.1).Использовали в питательной среде для регенерации зеатин в концентрации 1,0 0,001 мг/л.Восьмой деньПереносили экспланты на чашки со средой RM для регенерации (среда RM, табл.1) с добавлением селективного агента фосфинотрицина в концентрации 10 мг/л. В качестве селективного агента использовали фосфинотрицин, так как генетическая конструкция содержит ген bar, кодирующий фермент фосфинотрицил ацетил трансферазу (ФАТ), экспрессия которого обеспечивает устойчивость к фосфинотрицину.Для тестирования эффективности процесса регенерации в контрольных вариантах использовали среду для регенерации без добавления селективного агента (среда RM, табл.1).Использовали в питательной среде для регенерации зеатин в концентрации 1,0 0,01 мг/л, БАП в концентрации 1,0 0,01 мг/л, БАП в концентрации 1,0 0,01 мг/л и ГК3 в концентрации от 0,02 0,01 мг/л и ГК3 в концентрации от 0,02 0,001 мг/л.Через каждые 14 днейПереносили экспланты на свежие чашки Петри со средой для регенерации того же состава.При появлении регенерантовСрезали регенеранты и переносили их в пробирки, содержащие среду для укоренения (среда RIM, табл.1).Первичные регенеранты, укоренившиеся на селективной среде, содержащей фосфинотрицин в концентрации 10 мг/л, считали прошедшими первичный отбор.Далее прошедшие отбор первичные регенеранты проверяли на наличие перенесенной генетической конструкции при помощи ПЦР-анализа с праймерами, специфичными для кодирующей области трансгенной конструкции. Для ПЦР-анализа генома растений на наличие гена NPT II использовали праймерную систему:nptF primer: 5' TGCTCCTGCC GAGAAAGTAT CC 3'nptR primer: 5' AGGACATAG CGTTGGCTACC CG 3'Оба праймера находятся на расстоянии 350 нуклеотидов друг от друга.Методика проведения ПЦР-анализаПроведение ПЦР осуществляли на ДНК-амплификаторе Techne Genius. Центрифугирование осуществляли на настольной микроцентрифуге Eppendorf 5415C, с максимальной скорость вращения ротора 14000 об/мин. Термостатирование образцов осуществляли в сухом термостате “Термо 28-23”. Анализ продуктов ПЦР производили путем электрофореза в агарозном геле соответствующей концентрации при напряженности электрического поля 6 В/см с последующим окрашиванием гелей бромистым этидием (концентрация красящего раствора 1 мкг/мл в воде, время окрашивания - 20 минут при комнатной температуре) и фотографированием полученной картины в ультрафиолете (длина волны - 260-280 нм) на фотопленку “Микрат-Изопан” при помощи TTL-фотоаппарата типа “Зенит” (светофильтр КС-8). Ввод полученных данных электрофореза в компьютер осуществляли посредством прямого сканирования негативов на сканере Mustek 9600. Обработку оцифрованной информации проводили при помощи пакета Adobe Photoshop 5.0.Состав реакционной смеси для ПЦР:- Праймеры - по 25 пМ каждого;- 10 0,001 мг/л.Через каждые 14 днейПереносили экспланты на свежие чашки Петри со средой для регенерации того же состава.При появлении регенерантовСрезали регенеранты и переносили их в пробирки, содержащие среду для укоренения (среда RIM, табл.1).Первичные регенеранты, укоренившиеся на селективной среде, содержащей фосфинотрицин в концентрации 10 мг/л, считали прошедшими первичный отбор.Далее прошедшие отбор первичные регенеранты проверяли на наличие перенесенной генетической конструкции при помощи ПЦР-анализа с праймерами, специфичными для кодирующей области трансгенной конструкции. Для ПЦР-анализа генома растений на наличие гена NPT II использовали праймерную систему:nptF primer: 5' TGCTCCTGCC GAGAAAGTAT CC 3'nptR primer: 5' AGGACATAG CGTTGGCTACC CG 3'Оба праймера находятся на расстоянии 350 нуклеотидов друг от друга.Методика проведения ПЦР-анализаПроведение ПЦР осуществляли на ДНК-амплификаторе Techne Genius. Центрифугирование осуществляли на настольной микроцентрифуге Eppendorf 5415C, с максимальной скорость вращения ротора 14000 об/мин. Термостатирование образцов осуществляли в сухом термостате “Термо 28-23”. Анализ продуктов ПЦР производили путем электрофореза в агарозном геле соответствующей концентрации при напряженности электрического поля 6 В/см с последующим окрашиванием гелей бромистым этидием (концентрация красящего раствора 1 мкг/мл в воде, время окрашивания - 20 минут при комнатной температуре) и фотографированием полученной картины в ультрафиолете (длина волны - 260-280 нм) на фотопленку “Микрат-Изопан” при помощи TTL-фотоаппарата типа “Зенит” (светофильтр КС-8). Ввод полученных данных электрофореза в компьютер осуществляли посредством прямого сканирования негативов на сканере Mustek 9600. Обработку оцифрованной информации проводили при помощи пакета Adobe Photoshop 5.0.Состав реакционной смеси для ПЦР:- Праймеры - по 25 пМ каждого;- 10 буфер - 2,5 мкл;- 2 мМ dNTP - 2,5 мкл;- BioTaq полимераза 5Е мкл - 0,5 мкл;- ДНК-матрица - 100 нг;- Н2О - до 25 мкл.Условия проведения ПЦР были выбраны следующие: 43 цикла: 94 буфер - 2,5 мкл;- 2 мМ dNTP - 2,5 мкл;- BioTaq полимераза 5Е мкл - 0,5 мкл;- ДНК-матрица - 100 нг;- Н2О - до 25 мкл.Условия проведения ПЦР были выбраны следующие: 43 цикла: 94 С - 5 сек, 55 С - 5 сек, 55 С - 5 сек, 72 С - 5 сек, 72 С - 20 сек, окончательная полимеризация - 7 минут.Появление продукта ПЦР с указанными праймерами и длиной 558 нуклеотидов при условии отсутствия его в реакциях, поставленных на контрольной ДНК, свидетельствует о присутствии искомого гена в геномной ДНК анализируемой линии.Результаты эксперимента по получению трансгенных растений картофеля сорта Луговской, экспрессирующих ген barВ результате проведения одного трансформационного эксперимента (по описанному выше протоколу) было получено 461 регенерант из 546 эксплантов от 97 исходных растений. Таким образом, эффективность регенерации (процентное отношение количества регенерантов к количеству эксплантов) составила 84,4%.Последующий после получения регенерантов и первичного отбора на селективной среде первичный молекулярный анализ методом ПЦР (фиг.2) подтвердил наличие перенесенного гена npt II в геноме 110 проанализированных растений (линий), следовательно, эффективность трансформации (процентное отношение трансформантов к количеству регенерантов) составила 23,8%.В период с 10 июня по 20 сентября 2000 года на сертифицированном МВК ГИД участке ВНИИ Фитопатологии РАСХН, пос. Б. Вяземы, Московская обл. были проведены ограниченные полевые испытания полученных трансгенных линий картофеля сорта Луговской. Испытания проводили с целью подтвердить проявление внесенного признака в полевых условиях и отобрать жизнеспособные, фенотипически нормальные растения. После обработки в два срока суммарной дозой гербицида фосфинотрицина 6 л/га (3+3) трансгенные растения не проявляли признаков фитотоксического угнетения. Обработанные гербицидом контрольные (нетрансформированные) растения погибли полностью. По результатам морфологического отбора были отобраны 23 линии (и.т.с.) картофеля сорта Луговской, устойчивые к глюфосинату натрия. В конце вегетационного сезона был получен первичный семенной материал. Анализ отобранных линий по урожайности не выявил существенных различий между модифицированными и контрольными линиями, вероятность существенности различий составила 44% для линий сорта Луговской (статистическую обработку полученных данных проводили при помощи пакета программ Statistica 5.5). С - 20 сек, окончательная полимеризация - 7 минут.Появление продукта ПЦР с указанными праймерами и длиной 558 нуклеотидов при условии отсутствия его в реакциях, поставленных на контрольной ДНК, свидетельствует о присутствии искомого гена в геномной ДНК анализируемой линии.Результаты эксперимента по получению трансгенных растений картофеля сорта Луговской, экспрессирующих ген barВ результате проведения одного трансформационного эксперимента (по описанному выше протоколу) было получено 461 регенерант из 546 эксплантов от 97 исходных растений. Таким образом, эффективность регенерации (процентное отношение количества регенерантов к количеству эксплантов) составила 84,4%.Последующий после получения регенерантов и первичного отбора на селективной среде первичный молекулярный анализ методом ПЦР (фиг.2) подтвердил наличие перенесенного гена npt II в геноме 110 проанализированных растений (линий), следовательно, эффективность трансформации (процентное отношение трансформантов к количеству регенерантов) составила 23,8%.В период с 10 июня по 20 сентября 2000 года на сертифицированном МВК ГИД участке ВНИИ Фитопатологии РАСХН, пос. Б. Вяземы, Московская обл. были проведены ограниченные полевые испытания полученных трансгенных линий картофеля сорта Луговской. Испытания проводили с целью подтвердить проявление внесенного признака в полевых условиях и отобрать жизнеспособные, фенотипически нормальные растения. После обработки в два срока суммарной дозой гербицида фосфинотрицина 6 л/га (3+3) трансгенные растения не проявляли признаков фитотоксического угнетения. Обработанные гербицидом контрольные (нетрансформированные) растения погибли полностью. По результатам морфологического отбора были отобраны 23 линии (и.т.с.) картофеля сорта Луговской, устойчивые к глюфосинату натрия. В конце вегетационного сезона был получен первичный семенной материал. Анализ отобранных линий по урожайности не выявил существенных различий между модифицированными и контрольными линиями, вероятность существенности различий составила 44% для линий сорта Луговской (статистическую обработку полученных данных проводили при помощи пакета программ Statistica 5.5). 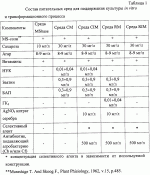 Для приготовления сред, представленных в табл.1, готовили раствор MS-солей в деионизованной воде, доводя рН до значения 5,6-5,8 Для приготовления сред, представленных в табл.1, готовили раствор MS-солей в деионизованной воде, доводя рН до значения 5,6-5,8 0,1 с помощью растворов 1N КОН и 1N HCl. Стерилизацию сред осуществляли в автоклаве при 1 атм, 121 0,1 с помощью растворов 1N КОН и 1N HCl. Стерилизацию сред осуществляли в автоклаве при 1 атм, 121 С в течение 20 минут. После охлаждения среды до +45-50 С в течение 20 минут. После охлаждения среды до +45-50 С добавляли витамины (табл.2), гормоны, антибиотики и селективные агенты (методика приготовления и концентрации исходных растворов см. табл.3) соответственно составу сред и заливали чашки Петри ( С добавляли витамины (табл.2), гормоны, антибиотики и селективные агенты (методика приготовления и концентрации исходных растворов см. табл.3) соответственно составу сред и заливали чашки Петри ( 9 см) по 20 9 см) по 20 5 мл среды в каждую. 5 мл среды в каждую.  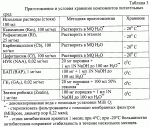  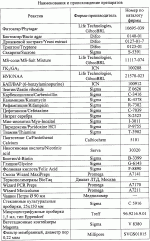 Список сокращений и терминовСb - карбенициллин;Cf - цефотаксим;Km - канамицин;LB - питательная среда Luria-Bertani;Rf - рифампицин;БАП (ВАР) - 6-бензиламинопурин;ГК3 (GA3) - гиббереллиновая кислота;ИМК (IBA) - индолил-3-масляная кислота;НУК (NAA) - нафтилуксусная кислота;ПЦР - полимеразная цепная реакция;среда Msbase - среда базовая, на основе смеси солей;среда СМ - среда для сокультивации - co-cultivation media;среда CIM - среда для инициации каллусообразования - callus induction media;среда RM - среда для регенерации - regeneration media;среда RIM - среда для корнеобразования - root induction media;л - литр;мл - миллилитр;мкл - микролитр;мкг/мл - микрограмм в миллилитре;мг/л - миллиграмм в литре;л/га - литров на гектар;мМ - миллимоль вещества;пМ - пикомоль вещества;нг - нанограмм;В/см - вольт на см;шт. - штук;об/мин - оборотов в минуту;нм - нанометр;мкм - микрометр;см - сантиметр;мм - миллиметр;сек - секунда;мин - минута; Список сокращений и терминовСb - карбенициллин;Cf - цефотаксим;Km - канамицин;LB - питательная среда Luria-Bertani;Rf - рифампицин;БАП (ВАР) - 6-бензиламинопурин;ГК3 (GA3) - гиббереллиновая кислота;ИМК (IBA) - индолил-3-масляная кислота;НУК (NAA) - нафтилуксусная кислота;ПЦР - полимеразная цепная реакция;среда Msbase - среда базовая, на основе смеси солей;среда СМ - среда для сокультивации - co-cultivation media;среда CIM - среда для инициации каллусообразования - callus induction media;среда RM - среда для регенерации - regeneration media;среда RIM - среда для корнеобразования - root induction media;л - литр;мл - миллилитр;мкл - микролитр;мкг/мл - микрограмм в миллилитре;мг/л - миллиграмм в литре;л/га - литров на гектар;мМ - миллимоль вещества;пМ - пикомоль вещества;нг - нанограмм;В/см - вольт на см;шт. - штук;об/мин - оборотов в минуту;нм - нанометр;мкм - микрометр;см - сантиметр;мм - миллиметр;сек - секунда;мин - минута; С - градусы по Цельсию;атм - атмосфера;МВК ГИД - Межведомственная комиссия по генно-инженерной деятельности;РАСХН - Российская академия сельскохозяйственных наук;И.т.с. - индивидуальное трансформационное событие;dNTP - дезоксирибонуклеотиды;MQ - установка Milli Q для деионизирования воды;рН - водородный показатель;N - нормальность;pNOS - промотор;NPT II - ген, кодирующий белок неомицинфосфотрансферазу;NOST - терминатор;35S - промотор;pBIBar - плазмида;Bar - ген белка;LBA 4404 - штамм Agrobacterium tumefaciens. С - градусы по Цельсию;атм - атмосфера;МВК ГИД - Межведомственная комиссия по генно-инженерной деятельности;РАСХН - Российская академия сельскохозяйственных наук;И.т.с. - индивидуальное трансформационное событие;dNTP - дезоксирибонуклеотиды;MQ - установка Milli Q для деионизирования воды;рН - водородный показатель;N - нормальность;pNOS - промотор;NPT II - ген, кодирующий белок неомицинфосфотрансферазу;NOST - терминатор;35S - промотор;pBIBar - плазмида;Bar - ген белка;LBA 4404 - штамм Agrobacterium tumefaciens.
Формула изобретения1. Способ получения генетически модифицированных растений картофеля, заключающийся в сокультивировании эксплантов со штаммом Agrobacterium tumefaciens, несущим рекомбинантные плазмиды с селективными маркерными и полезными генами, помещении эксплантов на питательную среду для инициации каллусообразования и последующей регенерации до фертильных трансгенных растений, имеющих внесенные гены и признаки исходного сорта, отличающийся тем, что для инициации каллусообразования эксплантов картофеля сорта Луговской используют питательную среду, содержащую зеатин в количестве 0,2-1,0 мг/л, БАП в количестве 0,2-1,0 мг/л и НУК в количестве 0,01-0,05 мг/л, а регенерацию начинают на восьмой день с использованием среды, содержащей зеатин в количестве 0,2-1,0 мг/л, БАП в количестве 0,2-1,0 мг/л и ГК3 в количестве 0,01-0,05 мг/л.2. Способ по п.1, отличающийся тем, что сокультивацию осуществляют путем раскладывания эксплантов на влажном бумажном фильтре, смоченном разведенной суспензией штамма Agrobacterium tumefaciens, с последующей выдержкой в течение (48 4) ч при (18-21) 4) ч при (18-21) С С 1 1 С.3. Способ по п.1 или 2, отличающийся тем, что для подготовки штамма Agrobacterium tumefaciens его предварительно засевают штрихом на питательную среду на (3 С.3. Способ по п.1 или 2, отличающийся тем, что для подготовки штамма Agrobacterium tumefaciens его предварительно засевают штрихом на питательную среду на (3 0,5) суток в темноте при 24-29 0,5) суток в темноте при 24-29 С, за двое суток до сокультивации засевают полученной смесью колоний первую ночную культуру штамма Agrobacterium tumefaciens в питательной среде, за одни сутки до сокультивации засевают вторую ночную культуру путем внесения в питательную среду первой ночной культуры, в день сокультивации концентрируют ночную культуру, осаждают и разводят осадок в жидкой среде.4. Способ по любому из пп.1-3, отличающийся тем, что после сокультивации помещают экспланты в раствор, содержащий жидкую среду и антибиотик, подавляющий развитие штамма Agrobacterium tumefaciens, на 5-40 мин при комнатной температуре для отмывки эксплантов.5. Способ по пп.1-3, отличающийся тем, что помещают экспланты в раствор, содержащий жидкую среду и антибиотик, подавляющий развитие штамма Agrobacterium tumefaciens, и отмывают экспланты при комнатной температуре с использованием ротационной качалки в течение 5-40 мин. С, за двое суток до сокультивации засевают полученной смесью колоний первую ночную культуру штамма Agrobacterium tumefaciens в питательной среде, за одни сутки до сокультивации засевают вторую ночную культуру путем внесения в питательную среду первой ночной культуры, в день сокультивации концентрируют ночную культуру, осаждают и разводят осадок в жидкой среде.4. Способ по любому из пп.1-3, отличающийся тем, что после сокультивации помещают экспланты в раствор, содержащий жидкую среду и антибиотик, подавляющий развитие штамма Agrobacterium tumefaciens, на 5-40 мин при комнатной температуре для отмывки эксплантов.5. Способ по пп.1-3, отличающийся тем, что помещают экспланты в раствор, содержащий жидкую среду и антибиотик, подавляющий развитие штамма Agrobacterium tumefaciens, и отмывают экспланты при комнатной температуре с использованием ротационной качалки в течение 5-40 мин.
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 25.04.2005 Извещение опубликовано: 20.07.2006 БИ: 20/2006 NF4A Восстановление действия патента Российской Федерации на изобретение Извещение опубликовано: 27.08.2006 БИ: 24/2006 Популярные патенты: 2201065 Приемная часть осевого сепаратора ... охватывающего кожуха, которые дальше будут описаны более подробно. Центральная труба 8 осевого сепарирующего ротора 6 имеет круглое поперечное сечение и в приемной части 4а снабжена раструбом 9 в форме усеченного конуса, больший диаметр которого в окончании приемной части 4а равен диаметру центральной трубы 8. На боковой поверхности конического раструба 9 приварены две основные спиральные лопасти 10, расположенные со смещением на 180o по окружности, причем высота лопастей уменьшается по мере увеличения радиуса конического раструба 9. Тем самым образовано цилиндрическое начало ротора, диаметр описанной окружности которого не превышает диаметра остальной части сепарирующего ротора 6. ... 2016512 Средство для борьбы против стресса у рыб и способ борьбы со стрессом у рыб ... стали нормальными на 9-й день. В этой последней группе процент заражения был выше, чем процент группы "30 с АМИМОМИ". Группа "2 мин АМИМОМИ" показала практически ту же тенденцию, что и группа "1 мин АМИМОМИ", причем все рыбы излечиваются от Saprolegniase, за исключением рыбы, у которой болезнь еще была подтверждена в последний день. Кроме того, процент заражения был ниже, чем в группе "1 мин АМИМОМИ". При анализе, сравнивающем условия заражения рыб одной и той же группы по времени "АМИМОМИ", получены следующие результаты. В "группе 2 мин АМИМОМИ" процент заражения был намного выше, чем в группе "АМИМОМИ с 5 рыбами". В группе "30 с и 1 мин АМИМОМИ" не было никакой разницы, за ... 2127256 Замещенные простые оксимовые эфиры и фунгицидное, инсектицидное, арахноицидное средство ... Предпочтительными являются соединения формулы I, где R5 - водород и R6 - метил. Радикал -C(R4)=N-O-R1 может находиться на фенильном радикале относительно -O-CH2 во втором, или в третьем, или, предпочтительно, в четвертом положении. Новые соединения общей формулы I могут быть получены относительно двойных связей C=C или C=N в виде изомерных смесей E/Z, которые могут быть разделены на отдельные изомеры обычным способом, например путем кристаллизации или хроматографии. Как отдельные изомерные соединения, так и их смеси охватываются изобретением и являются пригодными в качестве фунгицидов и ядохимикатов. В случае группировки -C(CONR5R6)=X-OCH3 предпочтительными являются те соединения, ... 2056100 Доильный стакан ... с установленным на его боковой поверхности патрубком и расположенной внутри него эластичной сосковой трубкой, отличается тем, что корпус в средней части на диаметрально противоположных сторонах выполнен вогнутым с деформацией сосковой трубки, а патрубок установлен на одной из вогнутых сторон в месте касания корпуса и сосковой трубки. Доильный стакан устанавливается на сосок вымени так, что патрубок, деформирующий сосковую трубку, расположен ниже относительно соска, подсосковое пространство подключается через коллектор и молочный шланг к источнику постоянного вакууметрического давления, а межстенное пространство через коллектор и шланги к источнику переменного давления ... 2494588 Лемех плуга ... покрытия из износостойкого материала. Износостойкое покрытие на пяточной зоне 6 режущей носовой части 3 нанесено по всей ширине пластины режущей новой части на длине не менее 20 мм. Размеры пластины режущей носовой части определяются предельным износом лемеха плуга. На несущей части лемеха в зоне 7 крепления долота выполнены отверстия 8 для крепления долота. Покрытие выполнено из износостойкого материала с твердостью 55-60 HRC. В качестве износостойкого покрытия могут использоваться высокопрочные стали, твердые сплавы и металлокерамики, имеющие в своем составе карбиды металлов, нитриды металлов или другие керамические материалы.Сварка производится с двух сторон без разделки. При ... |
Еще из этого раздела: 2121258 Устройство для вентилирования зерна или другого сыпучего материала (варианты) 2254705 Способ уплотнения и герметизации консервируемых кормов в рулонах 2427999 Способ повышения плодородия мерзлотных засоленных почв в условиях криолитзоны 2484613 Способ создания почвенно-растительного покрова при рекультивации нарушенных земель 2271095 Многофункциональное устройство 2060650 Дозатор концентрированных кормов 2391804 Почвообрабатывающий каток 2256318 Инъектор для капельного орошения 2141196 Способ получения растений с комплексной устойчивостью к фитостеринзависимым вредителям 2197082 Установка для охлаждения молока с использованием естественного холода |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||