Способ микроклонального размножения гладиолусаПатент на изобретение №: 2180165 Автор: Гапоненко А.К. (RU), Абукамель А.А. (RU), Бабаева Сима Ага Гусейн (AZ) Патентообладатель: Абукамель Ахмед Абдельсамад (RU), Гапоненко Александр Константинович (RU) Дата публикации: 10 Марта, 2002 Начало действия патента: 31 Января, 2000 Адрес для переписки: 113216, Москва, ул.Акад. Глушко, 8, кв.75, А.К.Гапоненко Изобретение предназначено для использования в области сельского хозяйства в цветоводстве и селекции, и в биотехнологии. Способ включает замачивание водопроводной водой в течение 24 ч клубнелуковиц диаметром 5-6 мм с последующей поверхностной их стерилизацией 6%-ным раствором гипохлорида натрия в течение 15 мин и промыванием 5-6 раз стерильной дистиллированной водой в течение 1 ч, повторную стерилизацию 90%-ным этанолом в течение 10 мин и трехкратное промывание, затем клубнелуковицы освобождают от туники и стерилизуют последовательно 70%-ным этанолом в течение 5-7 мин и 90%-ным - в течение 1 мин, после трехкратного промывания клубнелуковиц стерильной дистиллированной водой вырезают апикальные почки с прилегающими участками ткани и помещают на агаризованную питательную среду для определения чистоты стерильности эксплантов, которая содержит 1/2 концентраций макро- и микросолей по Murashige and Skoog (MS), полный состав витаминов и органических добавок среды MS, 1,0-2,0% сахарозы, 0,50-0,70  M 1-нафтилуксусной кислоты (НУК), после семи дней культивирования на агаризованнои среде стерильные экспланты переносят в жидкую питательную среду (с объемом среда/число эксплантов - 3: 1), дополненную 10,0-11,0 M 1-нафтилуксусной кислоты (НУК), после семи дней культивирования на агаризованнои среде стерильные экспланты переносят в жидкую питательную среду (с объемом среда/число эксплантов - 3: 1), дополненную 10,0-11,0  M 6-бензиламинопурином (6-БАП), затем проводят культивирование на шейкере при 100 мин-1 с непрерывным освещением при температуре 25 M 6-бензиламинопурином (6-БАП), затем проводят культивирование на шейкере при 100 мин-1 с непрерывным освещением при температуре 25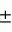 2oС в течение 28-30 дней в жидкой среде, а после пролиферирующие почки разделяют на одиночные и кластеры из 3-4 почек и культивируют при непрерывном освещении и температуре 25 2oС в течение 28-30 дней в жидкой среде, а после пролиферирующие почки разделяют на одиночные и кластеры из 3-4 почек и культивируют при непрерывном освещении и температуре 25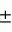 2oС на агаризованной среде, содержащей 1/2 MS, добавки по MS: сахарозу, витамины и инозитол, 0,2-0,3 2oС на агаризованной среде, содержащей 1/2 MS, добавки по MS: сахарозу, витамины и инозитол, 0,2-0,3  M абсцизовую кислоту (АБК), 0,50-0,70 M абсцизовую кислоту (АБК), 0,50-0,70  M НУК, 10,0-11,0 M НУК, 10,0-11,0  M 6-БАП, 10,0-12,5 мг/л п-аминобензойную кислоту (ПАБК) с получением побегов, которые после четырех месяцев с момента субкультивирования на агаризованную среду подвергают укоренению на среде 1/2 MS с низким содержанием азота и добавлением активированного угля при фотопериоде 16 ч день при t=27-28oС, 8 ч ночь при t=19-21oС, после чего указанные побеги высаживают. Способ позволяет повысить коэффициент размножения генетически стабильных и свободных от инфекций растений. 3 з.п. ф-лы.
Изобретение относится к биотехнологии, в частности к культивированию тканей и органов растений, и может быть использовано в цветоводстве для повышения коэффициента размножения, оздоровления посадочного материала, а также в селекционной практике для создания новых и улучшения уже известных сортов растений. Техника микроклонирования сокращает продолжительность развития в несколько раз по сравнению с жизненным циклом гладиолуса в естественных условиях, а коэффициент размножения (КР) повышает на порядки. Однако микроклонирование гладиолуса остается еще сравнительно продолжительной, сложной и дорогостоящей процедурой. Известны способы клонального микроразмножения гладиолуса через каллусную культуру, основанные в подборе типа экспланта и оптимального состава среды, а также методы, связанные с пролиферацией пазушных и адвентивных меристем. В одном из таких способов была показана регенерация из сегментов стебельков соцветий, которая зависела от концентраций 1-нафтилуксусной кислоты (НУК) и кинетина. Регенерация происходила образованием на базальном конце слоя каллуса зачатков корней, на дистальном конце - почек и вторичных побегов (Ziv et al. Organs and plantlets regeneration of Gladiolus through tissue culture./Ann. Bot. - 1970. - V.34. - P. 671-676). Для получения здоровых растений была показана индукция каллуса из изолированных верхушек вторичных побегов на модифицированной среде Murashige and Skoog (MS) (Murashige Т. And Skoog F. Arevised medium for rapid growth and bioassay with tobacco tissue culture./Physiol. Plant. - 1962. - V.15. - P. 472-497) в сочетании с ростовыми веществами. В аналогичном способе морфогенез происходил за счет образования органоидов с сосудистой тканью, побегов и растений с корешками (Simonsen J. and Hildebrandt A.C. In vitro growth and differentiation of Gladiolus plants from callus cultures./Can. J. Bot - 1971. - V.49. - P. 1817-1819). Недостаток вышеуказанных методов заключается в длительности процесса, низкой выживаемости регенерантов, отсутствии сведений о стабильности растений в культуре in vitro. Известен также способ размножения гладиолуса (Dantu Р.К. and Bhojwani S. S. In vitro propagation and corm formation in Gladiolus. /Gartenbauwissenschaft. - 1987. - V.52. - .2. - P. 90-93), в котором был продемонстрирован высокий потенциал размножения у трех коммерческих сортов гладиолуса. Побеговая культура была получена из пазушных почек клубнелуковиц, храненных в холодном помещении. В таких условиях были получены 100% стерильные каллусные культуры. Это дает возможность начать культуральные работы в любое время года. На среде MS с 0,5 мг/л 6-бензиламинопурином (6-БАП) в течение 2-х лет побеги размножались каждые две недели в три раза или каждые четыре недели в 5 раз. Удлинение побегов происходило только в том случае, если содержание 6-БАП в среде было ниже 0,2 мг/л. У побегов вызывали укоренение и корнеобразование. Высокие концентрации сахарозы (6-10%) приводили к сравнительно большим клубням (диаметр 23 мм, сырая масса 6,6 г), которые на 80% всходили in vitro. Недостаток этого способа состоит в невысоком коэффициенте размножения и частоте всхожести клубнелуковиц. Из известных способов наиболее близким к заявленному изобретению по своей сущности является способ клонального микроразмножения гладиолуса, описывающий получение побеговых культур из почек в жидкой питательной среде (Ziv M. Enhanced shoot and cormlet proliferation in liquid cultured gladiolus buds by growth retardants./Plant Cell, Tissue and Organ Culture. - 1989. - V.17. - P. 101-110). Почки культивировались в присутствии ретардантов роста, пролиферировали в массивные агрегаты пазушных и адвентивных почек. Ретарданты роста ингибировали рост апикальных почек. НУК и 6-БАП в культуральной среде увеличивали пролиферацию адвентивных почек. Присутствие в питательной среде сахарозы способствовало развитию маленьких клубнелуковиц. Рост листа новообразованных почек сильно ингибировался. Почки развивались в протокормы и после субкультивирования на агаризованную среду образовывали маленькие клубнелуковицы диаметром 8-10 мм. Клубнелуковицы не были в состоянии покоя и после переноса в горшки в теплицу, развивались в растеньица, таким образом, 5-6 месяцев после изоляции эксплантов. Недостаток этого метода заключается в длительности процесса, кроме того, коэффициент размножения еще не очень достаточен. Задачей изобретения является повышение коэффициента размножения (КР) генетически стабильных и свободных от инфекций растений. Согласно изобретению указанная задача решается способом микроклонального размножения гладиолуса, включающим замачивание водопроводной водой в течение 24 ч клубнелуковиц диаметром 5-6 мм с последующей поверхностной их стерилизацей 6%-ным раствором гипохлорида натрия в течение 15 мин и промыванием 5-6 раз стерильной дистиллированной водой в течение 1 ч, повторную стерилизацию 90%-ным этанолом в течение 10 мин и трехкратное промывание, затем клубнелуковицы освобождают от туники и стерилизуют последовательно 70%-ным этанолом в течение 5-7 мин. и 90%-ным - в течение 1 мин. Затем трехкратно промывают клубнелуковицы стерильной дистиллированной водой, вырезают апикальные почки с прилегающими участками ткани и помещают на агаризованную питательную среду для определения чистоты стерильности эксплантов, которая содержит 1/2 концентраций макро- и микросолей по Murashige and Skoog (MS), полный состав витаминов и органических добавок среды MS, 1,0-2,0% сахарозы, 0,50-0,70 M 6-БАП, 10,0-12,5 мг/л п-аминобензойную кислоту (ПАБК) с получением побегов, которые после четырех месяцев с момента субкультивирования на агаризованную среду подвергают укоренению на среде 1/2 MS с низким содержанием азота и добавлением активированного угля при фотопериоде 16 ч день при t=27-28oС, 8 ч ночь при t=19-21oС, после чего указанные побеги высаживают. Способ позволяет повысить коэффициент размножения генетически стабильных и свободных от инфекций растений. 3 з.п. ф-лы.
Изобретение относится к биотехнологии, в частности к культивированию тканей и органов растений, и может быть использовано в цветоводстве для повышения коэффициента размножения, оздоровления посадочного материала, а также в селекционной практике для создания новых и улучшения уже известных сортов растений. Техника микроклонирования сокращает продолжительность развития в несколько раз по сравнению с жизненным циклом гладиолуса в естественных условиях, а коэффициент размножения (КР) повышает на порядки. Однако микроклонирование гладиолуса остается еще сравнительно продолжительной, сложной и дорогостоящей процедурой. Известны способы клонального микроразмножения гладиолуса через каллусную культуру, основанные в подборе типа экспланта и оптимального состава среды, а также методы, связанные с пролиферацией пазушных и адвентивных меристем. В одном из таких способов была показана регенерация из сегментов стебельков соцветий, которая зависела от концентраций 1-нафтилуксусной кислоты (НУК) и кинетина. Регенерация происходила образованием на базальном конце слоя каллуса зачатков корней, на дистальном конце - почек и вторичных побегов (Ziv et al. Organs and plantlets regeneration of Gladiolus through tissue culture./Ann. Bot. - 1970. - V.34. - P. 671-676). Для получения здоровых растений была показана индукция каллуса из изолированных верхушек вторичных побегов на модифицированной среде Murashige and Skoog (MS) (Murashige Т. And Skoog F. Arevised medium for rapid growth and bioassay with tobacco tissue culture./Physiol. Plant. - 1962. - V.15. - P. 472-497) в сочетании с ростовыми веществами. В аналогичном способе морфогенез происходил за счет образования органоидов с сосудистой тканью, побегов и растений с корешками (Simonsen J. and Hildebrandt A.C. In vitro growth and differentiation of Gladiolus plants from callus cultures./Can. J. Bot - 1971. - V.49. - P. 1817-1819). Недостаток вышеуказанных методов заключается в длительности процесса, низкой выживаемости регенерантов, отсутствии сведений о стабильности растений в культуре in vitro. Известен также способ размножения гладиолуса (Dantu Р.К. and Bhojwani S. S. In vitro propagation and corm formation in Gladiolus. /Gartenbauwissenschaft. - 1987. - V.52. - .2. - P. 90-93), в котором был продемонстрирован высокий потенциал размножения у трех коммерческих сортов гладиолуса. Побеговая культура была получена из пазушных почек клубнелуковиц, храненных в холодном помещении. В таких условиях были получены 100% стерильные каллусные культуры. Это дает возможность начать культуральные работы в любое время года. На среде MS с 0,5 мг/л 6-бензиламинопурином (6-БАП) в течение 2-х лет побеги размножались каждые две недели в три раза или каждые четыре недели в 5 раз. Удлинение побегов происходило только в том случае, если содержание 6-БАП в среде было ниже 0,2 мг/л. У побегов вызывали укоренение и корнеобразование. Высокие концентрации сахарозы (6-10%) приводили к сравнительно большим клубням (диаметр 23 мм, сырая масса 6,6 г), которые на 80% всходили in vitro. Недостаток этого способа состоит в невысоком коэффициенте размножения и частоте всхожести клубнелуковиц. Из известных способов наиболее близким к заявленному изобретению по своей сущности является способ клонального микроразмножения гладиолуса, описывающий получение побеговых культур из почек в жидкой питательной среде (Ziv M. Enhanced shoot and cormlet proliferation in liquid cultured gladiolus buds by growth retardants./Plant Cell, Tissue and Organ Culture. - 1989. - V.17. - P. 101-110). Почки культивировались в присутствии ретардантов роста, пролиферировали в массивные агрегаты пазушных и адвентивных почек. Ретарданты роста ингибировали рост апикальных почек. НУК и 6-БАП в культуральной среде увеличивали пролиферацию адвентивных почек. Присутствие в питательной среде сахарозы способствовало развитию маленьких клубнелуковиц. Рост листа новообразованных почек сильно ингибировался. Почки развивались в протокормы и после субкультивирования на агаризованную среду образовывали маленькие клубнелуковицы диаметром 8-10 мм. Клубнелуковицы не были в состоянии покоя и после переноса в горшки в теплицу, развивались в растеньица, таким образом, 5-6 месяцев после изоляции эксплантов. Недостаток этого метода заключается в длительности процесса, кроме того, коэффициент размножения еще не очень достаточен. Задачей изобретения является повышение коэффициента размножения (КР) генетически стабильных и свободных от инфекций растений. Согласно изобретению указанная задача решается способом микроклонального размножения гладиолуса, включающим замачивание водопроводной водой в течение 24 ч клубнелуковиц диаметром 5-6 мм с последующей поверхностной их стерилизацей 6%-ным раствором гипохлорида натрия в течение 15 мин и промыванием 5-6 раз стерильной дистиллированной водой в течение 1 ч, повторную стерилизацию 90%-ным этанолом в течение 10 мин и трехкратное промывание, затем клубнелуковицы освобождают от туники и стерилизуют последовательно 70%-ным этанолом в течение 5-7 мин. и 90%-ным - в течение 1 мин. Затем трехкратно промывают клубнелуковицы стерильной дистиллированной водой, вырезают апикальные почки с прилегающими участками ткани и помещают на агаризованную питательную среду для определения чистоты стерильности эксплантов, которая содержит 1/2 концентраций макро- и микросолей по Murashige and Skoog (MS), полный состав витаминов и органических добавок среды MS, 1,0-2,0% сахарозы, 0,50-0,70  M 1-нафтилуксусной кислоты (НУК). После семи дней культивирования на агаризованной среде стерильные экспланты переносят в жидкую питательную среду с объемом среды/число эксплантов - 3:1), дополненную 10,0-11,0 M 1-нафтилуксусной кислоты (НУК). После семи дней культивирования на агаризованной среде стерильные экспланты переносят в жидкую питательную среду с объемом среды/число эксплантов - 3:1), дополненную 10,0-11,0  M 6-бензиламинопурином (6-БАП), затем проводят культивирование на шейкере при 100 мин-1 с непрерывным освещением при температуре 25 M 6-бензиламинопурином (6-БАП), затем проводят культивирование на шейкере при 100 мин-1 с непрерывным освещением при температуре 25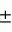 2oС в течение 28-30 дней в жидкой среде, а после пролиферирующие почки разделяют на одиночные и кластеры из 3-4 почек и культивируют при непрерывном освещении и температуре 25 2oС в течение 28-30 дней в жидкой среде, а после пролиферирующие почки разделяют на одиночные и кластеры из 3-4 почек и культивируют при непрерывном освещении и температуре 25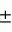 2oС на агаризованной среде, содержащей 1/2 MS, добавки по MS: сахарозу, витамины и инозитол, 0,2-0,3 2oС на агаризованной среде, содержащей 1/2 MS, добавки по MS: сахарозу, витамины и инозитол, 0,2-0,3  M абсцизовую кислоту (АБК), 0,50-0,70 M абсцизовую кислоту (АБК), 0,50-0,70  M НУК, 10,0-11,0 M НУК, 10,0-11,0  M 6-БАП, 10,0-12,5 мг/л п-аминобензойную кислоту (ПАБК) с получением побегов, которые после 4-х месяцев с момента субкультивирования на агаризованную среду подвергают укоренению на среде 1/2 MS с низким содержанием азота и добавлением активированного угля при фотопериоде 16 ч день при t=27-28oС, 8 ч ночь при t=19-21oC. В среде культивирования in vitro увеличивают концентрацию сахарозы до 6-10% для получения более крупных клубнелуковиц диаметром 18-23 мм. После указанных операций полученные побеги высаживают. Укорененные побеги длиной 10-12 см высаживают в смесь торфа и песка (2:1) в выращивают в течение недели при непрерывном тумане для акклиматизации побегов. Возможен вариант высаживания зачатков побегов, полученных при культивировании на последней стадии на агаризованной среде, в пластиковые горшки с песком диаметром 8 см, а через 2 недели после прорастания их пересаживают в более крупные горшки в смесь песка и садовой почки (1:1). Использование предложенного способа приводит к множественному образованию клубнелуковиц из одной апикальной почки путем пролиферации экспланта, образования побегов и боковых почек. Способ предусматривает культивирование экспланта гладиолуса в питательной индуцирующей среде, содержащей гормоны для инициации пролиферации почек и дальнейшее культивирование побегов для их роста, развития и прорастания, позволяющий получить растения регенеранты с клубнелуковицами. Способ осуществляется следующим образом. Используют 5 генотипов гладиолуса: сорта Закат, Колокол, Анфиса, Гранд, Сомбреро. В качестве экспланта для получения культуры используют апикальные почки с прилегающими участками ткани. Способ иллюстрируется следующими примерами: Пример I Клубнелуковицы сорта Закат диаметром 5-6 мм замачивают водопроводной водой в течение 24 ч и затем поверхностно стерилизуют по следующей схеме: 6% раствор гипохлорида натрия - 15 мин (промывают 5-6 раз стерильной дистиллированной водой в течение 1 ч); 90% этанол - 10 мин (трехкратное промывание). Затем клубнелуковицы освобождают от туники и стерилизуют последовательно 70%-ным этанолом в течение 5-7 мин и 90%-ным - 1 мин. После трехкратного промывания клубнелуковиц стерильной дистиллированной водой вырезают апикальные почки с прилегающими участками ткани и помещают на агаризованную питательную среду с целью определения частоты стерильности эксплантов. Питательная среда содержит 1/2 концентраций макро- и микросолей по MS, полный состав витаминов и органических добавок среды MS, 1,0-2,0% сахарозы, 0,50-0,70 M 6-БАП, 10,0-12,5 мг/л п-аминобензойную кислоту (ПАБК) с получением побегов, которые после 4-х месяцев с момента субкультивирования на агаризованную среду подвергают укоренению на среде 1/2 MS с низким содержанием азота и добавлением активированного угля при фотопериоде 16 ч день при t=27-28oС, 8 ч ночь при t=19-21oC. В среде культивирования in vitro увеличивают концентрацию сахарозы до 6-10% для получения более крупных клубнелуковиц диаметром 18-23 мм. После указанных операций полученные побеги высаживают. Укорененные побеги длиной 10-12 см высаживают в смесь торфа и песка (2:1) в выращивают в течение недели при непрерывном тумане для акклиматизации побегов. Возможен вариант высаживания зачатков побегов, полученных при культивировании на последней стадии на агаризованной среде, в пластиковые горшки с песком диаметром 8 см, а через 2 недели после прорастания их пересаживают в более крупные горшки в смесь песка и садовой почки (1:1). Использование предложенного способа приводит к множественному образованию клубнелуковиц из одной апикальной почки путем пролиферации экспланта, образования побегов и боковых почек. Способ предусматривает культивирование экспланта гладиолуса в питательной индуцирующей среде, содержащей гормоны для инициации пролиферации почек и дальнейшее культивирование побегов для их роста, развития и прорастания, позволяющий получить растения регенеранты с клубнелуковицами. Способ осуществляется следующим образом. Используют 5 генотипов гладиолуса: сорта Закат, Колокол, Анфиса, Гранд, Сомбреро. В качестве экспланта для получения культуры используют апикальные почки с прилегающими участками ткани. Способ иллюстрируется следующими примерами: Пример I Клубнелуковицы сорта Закат диаметром 5-6 мм замачивают водопроводной водой в течение 24 ч и затем поверхностно стерилизуют по следующей схеме: 6% раствор гипохлорида натрия - 15 мин (промывают 5-6 раз стерильной дистиллированной водой в течение 1 ч); 90% этанол - 10 мин (трехкратное промывание). Затем клубнелуковицы освобождают от туники и стерилизуют последовательно 70%-ным этанолом в течение 5-7 мин и 90%-ным - 1 мин. После трехкратного промывания клубнелуковиц стерильной дистиллированной водой вырезают апикальные почки с прилегающими участками ткани и помещают на агаризованную питательную среду с целью определения частоты стерильности эксплантов. Питательная среда содержит 1/2 концентраций макро- и микросолей по MS, полный состав витаминов и органических добавок среды MS, 1,0-2,0% сахарозы, 0,50-0,70  M НУК. После 7-и дней культивирования на агаризованной среде стерильные экспланты переносят в жидкую питательную среду (объем среды/число эксплантов 3:1), дополненную 10,0-11,0 M НУК. После 7-и дней культивирования на агаризованной среде стерильные экспланты переносят в жидкую питательную среду (объем среды/число эксплантов 3:1), дополненную 10,0-11,0  M 6-БАП. Культивирование проводят на шейкере при 100 оборот./мин, непрерывном освещении, t=25 M 6-БАП. Культивирование проводят на шейкере при 100 оборот./мин, непрерывном освещении, t=25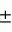 2oС. После 28-30 дней культивирования в жидкой среде пролиферирующие почки разделяют на одиночные и кластеры из 3-4 почек и переносят на агаризованную среду, содержащую 1/2 MS, добавки по MS: сахарозу, витамины и инозитол, 0,2-0,3 2oС. После 28-30 дней культивирования в жидкой среде пролиферирующие почки разделяют на одиночные и кластеры из 3-4 почек и переносят на агаризованную среду, содержащую 1/2 MS, добавки по MS: сахарозу, витамины и инозитол, 0,2-0,3  M АБК, 0,50-0,70 M АБК, 0,50-0,70  M НУК, 10,0-11,0 M НУК, 10,0-11,0  M 6-БАП 10,0-12,5 мг/л п-аминобензойной кислотой (ПАБК) и культивируют при непрерывном освещении и t=25 M 6-БАП 10,0-12,5 мг/л п-аминобензойной кислотой (ПАБК) и культивируют при непрерывном освещении и t=25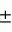 2oС. После 4-х месяцев с момента субкультивирования на агаризованную среду производят укоренение побегов на среде 1/2 MS с низким содержанием азота и добавлением активированного угля при фотопериоде 16 ч день при t=27-28oС, 8 часов ночь при t=19-21oС. Клубнелуковицы получают 3-мя способами. I - Укорененные побеги длиной 10-12 см сажают в смесь торфа и песка (2: 1). В течение недели их выращивают при непрерывном тумане для акклиматизации растений. Через 2 месяца у них развиваются луковицы 9-11 мм. II - Для получения более крупных клубнелуковиц, диаметром 18-23 мм, необходимо в среде культивирования in vitro увеличить концентрацию сахарозы до 6-10%. III - Зачатки побегов оставляют на среде культивирования на 4 месяца. За это время в пробирках образуются клубнелуковицы диаметром 8-10 мм. Клубнелуковицы сажают в пластиковые горшки с песком диаметром 8 см. Через 2 недели после прорастания их пересаживают в более крупные горшки в смесь песка и садовой почки (1:1). Образовавшиеся клубнелуковицы проростают на 85-90%. Пример II Способ осуществляется аналогично примеру I, различие состоит в составе жидкой питательной среды для пролиферации почек. Данную среду, содержащую 1/2 макро- и микросолей MS, полный состав добавок по MS, 10,0-11,0 2oС. После 4-х месяцев с момента субкультивирования на агаризованную среду производят укоренение побегов на среде 1/2 MS с низким содержанием азота и добавлением активированного угля при фотопериоде 16 ч день при t=27-28oС, 8 часов ночь при t=19-21oС. Клубнелуковицы получают 3-мя способами. I - Укорененные побеги длиной 10-12 см сажают в смесь торфа и песка (2: 1). В течение недели их выращивают при непрерывном тумане для акклиматизации растений. Через 2 месяца у них развиваются луковицы 9-11 мм. II - Для получения более крупных клубнелуковиц, диаметром 18-23 мм, необходимо в среде культивирования in vitro увеличить концентрацию сахарозы до 6-10%. III - Зачатки побегов оставляют на среде культивирования на 4 месяца. За это время в пробирках образуются клубнелуковицы диаметром 8-10 мм. Клубнелуковицы сажают в пластиковые горшки с песком диаметром 8 см. Через 2 недели после прорастания их пересаживают в более крупные горшки в смесь песка и садовой почки (1:1). Образовавшиеся клубнелуковицы проростают на 85-90%. Пример II Способ осуществляется аналогично примеру I, различие состоит в составе жидкой питательной среды для пролиферации почек. Данную среду, содержащую 1/2 макро- и микросолей MS, полный состав добавок по MS, 10,0-11,0  M 6-БАП, дополняют 10,0-12,5 мг/л ПАБК. Пример III Способ осуществляется аналогично примеру I, различие состоит в составе агаризованной питательной среды, на которую переносят пролиферирующие почки для дальнейшего развития. Данная среда содержит 1/2 соли MS, полный состав добавок по MS, 0,2-0,3 M 6-БАП, дополняют 10,0-12,5 мг/л ПАБК. Пример III Способ осуществляется аналогично примеру I, различие состоит в составе агаризованной питательной среды, на которую переносят пролиферирующие почки для дальнейшего развития. Данная среда содержит 1/2 соли MS, полный состав добавок по MS, 0,2-0,3  M АБК. Пример IV Способ осуществляется аналогично примеру III, различие состоит в составе жидкой питательной среды. Состав данной питательной среды аналогичен составу в примере II. Пример V Жидкая питательная среда для пролиферации почек содержит 1/2 соли MS, полный состав добавок по MS, 10,0-11,0 M АБК. Пример IV Способ осуществляется аналогично примеру III, различие состоит в составе жидкой питательной среды. Состав данной питательной среды аналогичен составу в примере II. Пример V Жидкая питательная среда для пролиферации почек содержит 1/2 соли MS, полный состав добавок по MS, 10,0-11,0  M 6-БАП, 10,0-12,5 мг/л ПАБК. Агаризованная питательная среда для развития побегов содержит 1/2 соли MS, полный состав добавок по MS. Остальные приемы осуществляют аналогично примеру I. Аналогично проводят испытания с другими генотипами гладиолуса. Использование сред, предлагаемых в данном способе, привело к следующим результатам: 1. Повысилась частота образования боковых почек в 12 раз по сравнению с прототипом. 2. По сравнению с прототипом увеличились следующие параметры: диаметр клубнелуковиц - 5,7 раза; сырая масса клубнелуковиц - 28 раз; КР - 9 раз. Настоящий способ позволит получить клубнелуковицы путем клонального микроразмножения. M 6-БАП, 10,0-12,5 мг/л ПАБК. Агаризованная питательная среда для развития побегов содержит 1/2 соли MS, полный состав добавок по MS. Остальные приемы осуществляют аналогично примеру I. Аналогично проводят испытания с другими генотипами гладиолуса. Использование сред, предлагаемых в данном способе, привело к следующим результатам: 1. Повысилась частота образования боковых почек в 12 раз по сравнению с прототипом. 2. По сравнению с прототипом увеличились следующие параметры: диаметр клубнелуковиц - 5,7 раза; сырая масса клубнелуковиц - 28 раз; КР - 9 раз. Настоящий способ позволит получить клубнелуковицы путем клонального микроразмножения.
Формула изобретения1. Способ микроклонального размножения гладиолуса, включающий замачивание водопроводной водой в течение 24 ч клубнелуковиц диаметром 5-6 мм с последующей поверхностной их стерилизацией 6%-ным раствором гипохлорида натрия в течение 15 мин и промыванием 5-6 раз стерильной дистиллированной водой в течение 1 ч, повторную стерилизацию 90%-ным этанолом в течение 10 мин и трехкратное промывание, затем клубнелуковицы освобождают от туники и стерилизуют последовательно 70%-ным этанолом в течение 5-7 мин и 90%-ным - в течение 1 мин, после трехкратного промывания клубнелуковиц стерильной дистиллированной водой вырезают апикальные почки с прилегающими участками ткани и помещают на агаризованную питательную среду для определения чистоты стерильности эксплантов, которая содержит 1/2 концентраций макро- и микросолей по Murashige and Skoog (MS), полный состав витаминов и органических добавок среды MS, 1,0-2,0% сахарозы, 0,50-0,70 M 1-нафтилуксусной кислоты (НУК), после семи дней культивирования на агаризованной среде стерильные экспланты переносят в жидкую питательную среду (с объемом среда/число эксплантов - 3: 1), дополненную 10,0-11,0 M 1-нафтилуксусной кислоты (НУК), после семи дней культивирования на агаризованной среде стерильные экспланты переносят в жидкую питательную среду (с объемом среда/число эксплантов - 3: 1), дополненную 10,0-11,0 M 6-бензиламинопурином (6-БАП), затем проводят культивирование на шейкере при 100 мин-1 с непрерывным освещением при температуре 25 M 6-бензиламинопурином (6-БАП), затем проводят культивирование на шейкере при 100 мин-1 с непрерывным освещением при температуре 25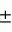 2oС в течение 28-30 дней в жидкой среде, а после пролиферирующие почки разделяют на одиночные и кластеры из 3-4 почек и культивируют при непрерывном освещении и температуре 25 2oС в течение 28-30 дней в жидкой среде, а после пролиферирующие почки разделяют на одиночные и кластеры из 3-4 почек и культивируют при непрерывном освещении и температуре 25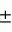 2oС на агаризованной среде, содержащей 1/2 MS, добавки по MS: сахарозу, витамины и инозитол, 0,2-0,3 2oС на агаризованной среде, содержащей 1/2 MS, добавки по MS: сахарозу, витамины и инозитол, 0,2-0,3 M абсцизовую кислоту (АБК), 0,50-0,70 M абсцизовую кислоту (АБК), 0,50-0,70 M НУК, 10,0-11,0 M НУК, 10,0-11,0 M 6-БАП, 10,0-12,5 мг/л п-аминобензойную кислоту (ПАБК) с получением побегов, которые после четырех месяцев с момента субкультивирования на агаризованную среду подвергают укоренению на среде 1/2 MS с низким содержанием азота и добавлением активированного угля при фотопериоде 16 ч день при t= 27-28oС, 8 ч ночь при t= 19-21oС, после чего указанные побеги высаживают. 2. Способ по п. 1, отличающийся тем, что в среде культивирования in vitro увеличивают концентрацию сахарозы до 6-10% для получения более крупных клубнелуковиц диаметром 18-23 мм. 3. Способ по п. 1, отличающийся тем, что укорененные побеги длиной 10-12 см высаживают в смесь торфа и песка (2: 1), выращивают в течение недели при непрерывном тумане для акклиматизации побегов. 4. Способ по п. 1, отличающийся тем, что полученные при культивировании на последней стадии на агаризованной среде зачатки побегов высаживают в пластиковые горшки с песком диаметром 8 см, а через 2 недели после прорастания их пересаживают в более крупные горшки в смесь песка и садовой почвы (1: 1). M 6-БАП, 10,0-12,5 мг/л п-аминобензойную кислоту (ПАБК) с получением побегов, которые после четырех месяцев с момента субкультивирования на агаризованную среду подвергают укоренению на среде 1/2 MS с низким содержанием азота и добавлением активированного угля при фотопериоде 16 ч день при t= 27-28oС, 8 ч ночь при t= 19-21oС, после чего указанные побеги высаживают. 2. Способ по п. 1, отличающийся тем, что в среде культивирования in vitro увеличивают концентрацию сахарозы до 6-10% для получения более крупных клубнелуковиц диаметром 18-23 мм. 3. Способ по п. 1, отличающийся тем, что укорененные побеги длиной 10-12 см высаживают в смесь торфа и песка (2: 1), выращивают в течение недели при непрерывном тумане для акклиматизации побегов. 4. Способ по п. 1, отличающийся тем, что полученные при культивировании на последней стадии на агаризованной среде зачатки побегов высаживают в пластиковые горшки с песком диаметром 8 см, а через 2 недели после прорастания их пересаживают в более крупные горшки в смесь песка и садовой почвы (1: 1).
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 01.02.2002 Номер и год публикации бюллетеня: 10-2003 Извещение опубликовано: 10.04.2003 Популярные патенты: 2048055 Устройство для отрезания и погрузки сенажа и силоса ... 34. Отверстия 32 кронштейнов 31, 34 и ось 29 выполнены с одинаковым диаметром и расположены на одной геометрической оси. Ось 29 проходит в отверстиях 32 кронштейнов 31 и 34 и образует шарнирное соединение, которое с двух сторон закрывается крышками 17. Это соединение позволяет поворачиваться одной части ножа относительно другой. Торцовые поверхности частей 14 и 15 ножа, соприкасающиеся между собой, выполнены концентрично цилиндрическими. Кроме того, с целью беспрепятственного поворота они, а также крышки 17 снабжены фасками 35 (см. фиг.5). Кронштейны 10 имеют по два штыря 11, которые имеют поперечное сечение, равное или меньшее поперечного сечения отверстий 16. Штыри 11 отстоят ... 2265444 Способ консервирования пантов ... при температуре +8-10° в течение трех часов и помещают в воздушный поток, где их вентилируют при комнатной температуре и влажности до готовности. Окончание сушки определяют практически по характерному сухому звуку при соударении двух пантов друг о друга. Панты сортируют и упаковывают по НТД. Контрольные панты на продольном и поперечном распилах имеют по всей длине и толщине ствола и отростка красно-коричневую окраску, округлую без морщин верхушку, ненарушенный кожно-волосяной покров и отвечают всем требованиям, предъявляемым к экспортным пантам.Общая продолжительность предлагаемого способа консервирования пантов составляет от 142 до 190 часов, в том числе 36,5 часов ... 2088063 Широкозахватный сельскохозяйственный агрегат ... которых шарнирно с задними звеньями 7. На соединительном брусе 12 закреплены упоры 17, ограничивающие положение задних звеньев 7. Гидроцилиндры 18 поворота задних звеньев 7 в шарнире 6 корпусами шарнирно соединены с задними звеньями 7, а штоками с вертикальными шарнирами 4 шарнирных звеньев 3. Гидроцилиндры 16 свода-развода задних звеньев с гидрозапорным блоком 19. Широкозахватный сельскохозяйственный агрегат работает образом. При переводе широкозахватного сельскохозяйственного агрегата из транспортного положения в рабочее освобождают фиксаторы 10 самоустанавливающихся колес 9, гидроцилиндры 16 свода-развода задних звеньев 7 с помощью гидрозапорного блока 19 и подключают к общей ... 2411718 Устройство для внутрипочвенного импульсного дискретного полива растений ... зубчатой рейки 13 линейного реверсивного сервопривода выдвижного шприца 10.В момент зацепления с зубом цилиндрической шестерни сервопривода 15 впадина между зубьями зацепления зубчатой рейки линейного реверсивного сервопривода выдвижного шприца 10 эластично деформируется внутрь шприца. Выступ зуба зацепления рейки, который выполнен жестким, занимает позицию впадины между зубьями зацепления цилиндрической шестерни сервопривода 15. Цилиндрическая шестерня сервопривода 15 увлекает зубчатую рейку 13 линейного реверсивного сервопривода выдвижного шприца 10 вместе со шприцем 10 наружу из исходного положения внутри корпуса шприца 11 в рабочее положение. В зоне гидравлического ... 2256318 Инъектор для капельного орошения ... 8 приводит к перекосу поплавка в корпусе 1. Капельница перестает работать. Капельница подает воду только на поверхность орошаемого участка.Известен также капельный водовыпуск, включающий корпус с двумя сообщающимися отверстием камерами, впускным и выпускным отверстиями и поплавковым клапаном, расположенным в верхней камере, в котором с целью повышения надежности работы водовыпуск снабжен вторым поплавковым клапаном, установленным в нижней камере, при этом оба клапана выполнены двустороннего действия; с целью расширения диапазона рабочих давлений при заданном расходе в отверстиях камер смонтированы регулируемые вставки (SU, авторское свидетельство №858670, М.кл.3 А 01 G 25/02. ... |
Еще из этого раздела: 2446659 Способ и устройство для органического возделывания зерновых культур 2394414 Соединительное устройство для сельскохозяйственной машины 2201069 Травяное покрытие на основе гибкого полотна 2057432 Биологический состав кузнецова для подсочки деревьев, в том числе каучуконосов (варианты), и способ его приготовления 2388213 Способ измерения урожайности травяного покрова 2444885 Посевной агрегат 2113779 Агромост 2305931 Способ регенерации растений клевера лугового при генетической трансформации 2216908 Комбайн для уборки урожая с кустарников 2489835 Гнездовой высевающий аппарат для посева проросших семян овощных культур |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||