Раствор для хранения роговицы, включающий гиалуроновую кислоту, способ хранения ткани роговицыПатент на изобретение №: 2184448 Автор: ПОНЦИН Диего (IT) Патентообладатель: ФИДИА С.П.А. (IT) Дата публикации: 20 Сентября, 2000 Начало действия патента: 4 Апреля, 1997 Адрес для переписки: 129010, Москва, ул. Большая Спасская, 25, стр.3, ООО "Юридическая фирма Городисский и Партнеры", Н.Г.Лебедевой Изображения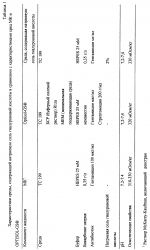  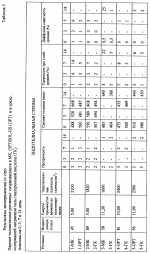 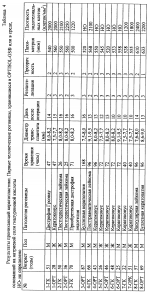 Изобретение относится к области медицины, в частности к офтальмологии. Роговицу глаза хранят в растворе, который включает гиалуроновую кислоту с молекулярной массой от 50000 до 15000 Да и ее фармацевтически приемлемую соль в концентрации от 1 до 20 мг/мл, дополнительно может включать антибиотик из группы гентамицина, пенициллина G и стрептомицина, при этом хранение производят при температуре раствора 2-8oС. Изобретение позволяет производить хранение роговицы глаза эффективно, просто и недорого. 2 с. и 4 з.п. ф-лы, 4 табл. Целью настоящего изобретения является улучшение и упрощение хранения роговиц, предназначенных для проникающей кератопластики, в течение времени между удалением от донора и трансплантацией, за счет использования рецептур жидкостей для хранения, содержащих гиалуpoновую кислоту. Проникающая кератопластика широко используется для восстановления зрения при ряде заболеваний роговицы. В случае выраженной дистрофии роговицы, воспаления или дегенеративного процесса проникающая кератопластика является единственным эффективным лечением для восстановления зрения. Главной проблемой в таком лечении является способ, используемый для консервирования жизнеспособной ткани роговицы после ее удаления у донора. Роговица представляет собой аваскулярную ткань с хорошо выраженной организацией толщиной 1 мм на периферии и 0,5 мм в центре. Часть, подвергаемая действию внешней окружающей среды, покрыта слоистым некератинизованным эпителием, образованным 3-4 слоями уплощенных чешуйчатых клеток, 1-3 слоями мидэпителиальных клеток и единственным слоем цилиндрических базальных клеток, связанных с базальной мембраной и лежащей ниже стромой за счет комплекса адгезии. При хранении роговицы эпителий может быть потерян, но если базальная мембрана не повреждена, то реэпителизация после трансплантации обычно является быстрой. Строма организована в три четких слоя экстрацеллюлярной матрицы. Начиная от эпителия, она включает тонкий слой Боумана, среднюю слоистую строму и базальную мембрану (мембрана Десцемета (Descemet)), генерируемую клетками эндотелия, расположенными на стороне ткани, обращенной к водянистой влаге. Другие части стромы продуцируются и поддерживаются фибробластами стромы, плоскими клетками, обычно называемыми термином кератоциты. Из-за присутствия солей, коллагена и протеогликанов, строма является гипертонической по отношению как к слезам, так и к водянистой влаге. Вода в меньшей степени концентрируется на эпителиальной стороне, вероятно, из-за сухости в эпителиальных слоях. Аналогично глюкоза меньше концентрируется на эпителиальной стороне из-за того, что этот метаболит вытекает из водянистой влаги для использования большей частью эпителием. Строма содержит протеогликаны (дерматан и сульфат кератана) с большей концентрацией первого из них на эпителиальной стороне, а второго на эндотелиальной стороне. Эндотелий роговицы представляет собой единственный слой из кубоидального эндотелия, образующего гексагональную мозаику, лежащую на мембране Десцемета, если смотреть со стороны передней камеры глазного яблока. Гексагональные клетки связаны между собой прочным соединением, которое, однако, не образует полной герметизации вокруг клеток. Скорее они сконцентрированы в клеточной апикальной мембране. Целостность соединения зависит от присутствия Са2+ в окружающей среде. Подобная организация позволяет водянистой влаге и ее растворимым компонентам иметь доступ к параклеточному пространству. При нормальных условиях за отеком роговицы не следует приток жидкости, потому что эквивалентный объем жидкости активно удаляется комплексом откачки эндотелия. Na+-K+ АТФ является существенной частью такой системы откачки, требующей поэтому продуцирования АТФ за счет метаболической активности эндотелиальных клеток. Для полной оценки функции эндотелиальных клеток представляет интерес наблюдение, что эти клетки имеют на стороне, обращенной к водянистой влаге, член семейства иммуноглобулинов, ICAM-1 (молекула межклеточного слипания-1), который служит сорецептором для работоспособности LFA-1 ( 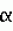 L, L,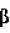 2), расположенного на поверхности лейкоцита. ICAM-1 может также функционировать как рецептор гиалуроновой кислоты (McCourt, P.A.G. et al (1994) J.Biol. Chem., 269, 30081-30084). Это указывает на то, что эндотелиальные клетки взаимодействуют с лейкоцитами, когда те достигают водянистой влаги. Это также может указывать на то, что при нормальных условиях и в отсутствие лейкоцитов гиалуроновая кислота связывается с этим рецептором для предохранения целостности эндотелиального слоя. Отек роговицы: при потере функции откачки эндотелием гипертоничность стромы вызывает отек ткани роговицы. Отек приводит к увеличению толщины роговицы и уменьшает ее прозрачность. Кроме того, наблюдается потеря протеогликанов из стромы в окружающую среду. Потеря эндотелиальной функции является следствием патологии (например, дистрофии, дегенерации, глаукомы). Старение может приводить к эндотелиальной декомпенсации вследствие того, что эндотелиальные клетки ухудшаются с возрастом (примерно 50% с момента рождения до старости). Поскольку эндотелиальные клетки имеют ограниченную регенеративную способность, повреждение целостности эндотелия может быть скомпенсировано только увеличением остаточных клеток, которые становятся тоньше. Повреждение эндотелия является также главным риском при хранении роговицы перед трансплантацией. Это приводит к отеку роговицы с потерей прозрачности и смерти прогрессивной эндотелиальной клетки. Сохранность целостности эндотелиального слоя является действительно главной целью в заявляемых способах для сохранения роговицы перед проникающей кератопластикой. Хранение роговицы: целые глазные яблоки от донора могут храниться во влажной камере при 4oС, но их следует использовать в течение 24 ч. Успешно используется консервирование роговицы в замороженном состоянии (Kaufman Н.Е. and Capella J.A. (1968) J.Cryosurg., 1, 125-129). Перед замораживанием роговицы обрабатывают увеличенными концентрациями ДМСО и сахарозы, чтобы предотвратить образование межклеточного льда. Трудности при обработке и транспортировке замороженных роговиц при постоянной низкой температуре не дают широкого распространения такого способа. Альтернативно роговица может храниться при 37oС в органической культуральной среде (Doughman D.J. et al., (1976) Trans. Am. Acad. Ophtalmol. Otolaringol. , 81, 778-793). Поскольку культуральная среда дополняется сывороткой для оптимального сохранения клеток, этот метод имеет своим недостатком то, что глаз реципиента подвергается действию остаточного количества сыворотки, переносимой на роговице в момент трансплантации. Животная сыворотка может вызывать иммунный ответ, тогда как человеческая сыворотка может передавать вирусные заболевания. В настоящее время большинство общепринятых способов для сохранения роговицы оказываются способами краткосрочного хранения в свободной от сыворотки среде при 4oС. При этой температуре метаболическая активность эндотелиальных клеток является минимальной. Таким образом, теряется функция откачки. Отек роговицы может предотвращаться посредством добавления удерживающих воду соединений в среду для хранения. Среди них одним из наиболее используемых является декстран или сам по себе (McKarey B.E. and Kaufman H.E. (1974) Invest.Ophtalmol.Vis.Sci.l3, 165) или в комплексе с глюкозаминогликан хондроитин сульфатом (Kaufman H. E. et al.,(1991) Arch.Ophthalmol. 109, 864-868). Однако хондроитин сульфат является гетерогенным соединением из-за различного распределения сульфатных молекул в полимере (Scott, 1995). В результате композиции используемые для хранения роговицы могут варьироваться для различных серий. Кроме того, за счет сульфатных молекул хондроитин сульфат несет сильный отрицательный заряд. Недавно было выдвинуто предположение, что такой сильный отрицательный заряд является вредным при хранении роговицы, потому что сильный отрицательный заряд уменьшает адгезионную способность эндотелия роговицы (Chen et al., 1996). Далее сообщалось, что хондроитин сульфат может проникать в роговицу и вызывать ее отек, особенно при нагревании ткани от 4oС до комнатной температуры перед трансплантацией (Kaufman et al., 1991). При попытке снизить отек роговицы, вызываемый хондроитин сульфатом, составлялись композиции для хранения роговицы, содержащие такие удерживающие агенты, как декстран, в комбинации с хондроитин сульфатом (ЕР 0 517 972). Однако декстран может проникать в строму при хранении и может увеличивать давление при отеке при подогревании. Кроме того, в настоящее время также ясно, что декстран может быть токсичным для роговицы, вызывая физиологическое старение и вырождение (Chen et al., 1996). Ogino с сотр. (Mokugan Zen-shi, Воздействие вновь созданных сред для хранения роговицы на эндотелий роговицы - Морфологическое исследование методом сканирующей электронной микроскопии, 1995) описал среды для хранения, содержащие гиалуроновую кислоту (ГК). Но гиалуроновая кислота, использованная Ogino и др., имела молекулярную массу 800 000. ГК с такой высокой молекулярной массой является слишком вязкой, чтобы она была подходящей в качестве компоненты среды для хранения, и ее нужно использовать в комбинации с другими водоудерживающими компонентами для предотвращения отека роговицы без увеличения вязкости раствора. Следовательно, задачей настоящего изобретения является создание жидкости для хранения роговицы, способной обеспечить подходящие условия хранения для жизнеспособной роговицы, при исключении недостатков предшествующих жидкостей. Подробное описание изобретения Настоящее изобретение, следовательно, относится к композиции жидкости для роговицы, включающей гиалуроновую кислоту, и использованию рецептуры, включающей гиалуроновую кислоту, которая является подходящей для хранения жизнеспособной роговицы при низкой температуре, особенно между 2-8oС. Изобретение основано на следующих предположениях, которые согласуются с исследованием организации и функционирования роговицы, обсуждавшимся выше: (i) при хранении роговиц при низких температурах метаболическая активность эндотелиальных клеток гасится. Таким образом, факторы питания и роста (сыворотка или другие) не являются необходимыми. Функция откачки не осуществляется и не нуждается в поддержании; (ii) cбалансированный солевой раствор, дополненный водоудерживающим соединением, должен быть достаточным для поддержания целостности роговицы. Если единственное водоудерживающее соединение является подходящим, то другие соединения, такие как декстран, не являются более необходимыми; (iii) защитная пленка поверх эндотелиальных клеток необходима для предотвращения их повреждения во время хранения. Природный лиганд, способный ассоциироваться с сорецептором ICAM-1, кажется подходящим. Как подчеркивается ниже, гиалуроновая кислота была идентифицирована в качестве подходящего соединения, удовлетворяющего требованиям оптимального хранения роговицы при низких температурах. Гиалуроновая кислота принадлежит к группе глюкозаминогликанов, которая также включает соединения, содержащие сульфатные группы (хондроитины, кератаны и гепараны). Как следствие различного распределения сульфатных остатков эта группа глюкозаминогликанов представляет собой гетерогенную совокупность различных молекул. Напротив, гиалуроновая кислота содержит только дисахаридное звено N-ацетил-глюкозамина и глюкуронат. Таким образом, гиалуроновая кислота представляет собой гомогенное соединение с определенной первичной структурой: прямые цепи, содержащие сотни дисахаридных звеньев и сотни анионов, зафиксированных в каждой цепи (карбоксилатные группы). Недавно для гиалуроновй кислоты была установлена упорядоченная вторичная структура (Scott J.E. (1995) Eur.J.Rheumatol.Inflamm. 15, 3-8). Она поддерживается интенсивными водородными связями между звеньями сахаров и двухмерной спиральной структурой, образующейся при повороте на 180o между дисахаридными звеньями. Вторичная структура дает значительные гидрофобные участки в цепях гиалуроновой кислоты для примерно 8СН звеньев (длина короткой цепи жирной кислоты), которые способны ассоциироваться с мембранными фосфолипидами и другими липидами. Действительно положительный эффект гиалуроновой кислоты при воспалителении суставов может быть результатом ее ассоциации с липидоподобными воспалительными цитокинами, такими как тромбоцит-активирующий фактор. При разбавленных концентрациях гиалуроновой кислоты в водной среде (1 мкг/мл или более) образуется трехмерная структура (Scott J.E. et al., (1991) Biochem. J. 274, 699-705). Она представляет собой сотовидную сетчатую структуру, образованную за счет агрегации цепей гиалуроновой кислоты, устанавливающих динамические контакты между всеми молекулами гиалуроновой кислоты. Сетчатая структура захватывает внутрь воду и растворенные вещества, таким образом ограничивая их взаимодействие с внешней окружающей средой. Клетки с рецепторами для гиалуроновой кислоты могут закреплять большую сетчатую структуру вокруг себя. Это может иметь защитный эффект, предотвращая проникновение в клетки химических соединений. Представляет интерес наблюдение, что такая организация становится менее компактной и может действительно разрываться под действием свободных ОН радикалов, которые вызывают деградацию цепей гиалуроновой кислоты. В заключение свойства гиалуроновой кислоты, относящиеся к настоящему изобретению и служащие в целях поддержания жизнеспособной роговицы, являются следующими: 1. Присутствие фиксированных анионов в цепях гиалуроновой кислоты, действующих как растворимый катионообменник и, следовательно, ограничивающих движение одновалентных и двухвалентных катионов к ткани роговицы. 2. Присутствие гидрофобных частей во вторичной структуре цепей гиалуроновой кислоты, позволяющее соединению контактировать и защищать гидрофобные сайты, возможно оставленные незащищенными от воздействия в клеточной мембране. 3. Образование сети цепей гиалуроновой кислоты, охватывающей воду и растворенные вещества и обеспечивающей максимальный водоудерживающий эффект. 4. Взаимодействие с ICAM-1, сосредоточенным на поверхности эндотелиальных клеток, обеспечивающее образование защитной пленки гиалуроновой кислоты вокруг самих клеток. В принципе эти свойства являются достаточными для обеспечения защиты эндотелиальных клеток при низких температурах и для того, чтобы избежать отека роговицы. Поскольку гиалуроновая кислота высокой молекулярной массы (1 000 000 Да или более) образует вязкие растворы, следует использовать гиалуроновую кислоту более низкой молекулярной массы. В частности, гиалуроновая кислота должна иметь среднюю молекулярную массу менее примерно 600 000, предпочтительно она имеет среднюю молекулярную массу в пределах интервала от 50 000 до 250 000 Да, наиболее предпочтительно в пределах интервала от 50 000 до 150 000 Дальтон. При таком молекулярном размере все еще образуется сетчатая структура гиалуроновой кислоты, хотя ее организация может быть менее компактной. Для медицинских растворов, включаемых в настоящее изобретение, гиалуроновые кислоты могут быть получены из нескольких источников. Например, гиалуроновая кислота может быть очищена из обычных источников, таких как петушиные гребни, с использованием способов, описанных в ЕР 0 138 572. Альтернативно гиалуроновая кислота может быть получена ферментативным способом, как описано в WO 95/04132, или путем энзиматического синтеза с использованием очищенного протеинового фактора, содержащего гиалуронат синтазу, как описано в WO 95/24497. Примеры композиций Свободный от сыворотки медицинский раствор, предлагаемый в настоящем изобретении, должен содержать: 1. Сбалансированный раствор электролита, забуференный до рН 7,2-7,4 с помощью фосфата, бикарбоната и HEPES (гидроксиэтилпиперазинэтансульфоновая кислота). В целях изобретения минимальная незаменимая среда (например ТС 199, такая как доступная от Gibco BRL, Maryland; Signa, Missouri; Flow Laboratories, Maryland) является удовлетворительной. Эта среда широко используется при культивировании тканей и содержит в своем составе незаменимые неорганические соли, аминокислоты, витамины и предшественники АТФ. 2. Антибиотики такие как, но не ограничиваясь ими, гентамицин, стрептомицин, пенициллин G и их комбинации для предотвращения микробного загрязнения. 3. Натриевая соль гиалуроновой кислоты с молекулярной массой 50000-150000 Да, добавленная от 1 до 20 мг/мл, 0,1 до 2% мас./объем, исходя из общего раствора. Вариации могут быть сделаны при выборе солевого буферного раствора и антибиотиков. Эта простая композиция будет достаточной для удовлетворения всех требований оптимального хранения роговицы при низких температурах в течение по крайней мере недели. Биологические оценки 1. Материалы и методы Композиция свободной от сыворотки среды, включающей натриевую соль гиалуроновой кислоты, описана в таблице 1 в сравнении с коммерчески доступными средами для хранения роговицы, содержащими хондроитин сульфат и декстран (Optisol-GS) или один декстран (McKarey-Kaufman). Парные человеческие глаза донора были удалены в течение 9-10 ч после смерти. Роговицы отделялись от глазных яблок с 2 мм ободком склеры и испытывались на жизнеспособность эндотелиальных клеток, плотность эндотелиальных клеток, толщину роговицы и прозрачность. Жизнеспособность эндотелиальных клеток оценивалась путем окрашивания с 0,3% трипаном синим. Смерть клеток обычно распределяется по двум видам: регулярный массив окрашенных клеток, соответствующих слоям, образующимся при механическом давлении на роговицу во время удаления, и диффузная смертность, указывающая на метаболическую дисфункцию эндотелиальных клеток. Анализ завершали в конце каждого эксперимента путем окрашивания ализариновым красным для оценки клеточной морфологии и площади мембраны Десцемета, не покрытой эндотелием. Смерть клеток выражали как процент окрашенных клеток по отношению к общему количеству клеток. Плотность эндотелиальных клеток оценивали, подсчитывая клетки в 5 областях центральной части роговицы с использованием оптического микроскопа с установленной 10 х 10 мм квадратной окулярной шкалой. Когда смертность клеток была менее 2% и число эндотелиальных клеток было >2000 мм2, роговицы рассматривались как подходящие для трансплантации. Толщина роговицы измерялась посредством вертикального микроскопа, установленного с цифровым микрометром для оценки расстояния между эпителием и эндотелием. Для каждой роговицы получали три главных показания. Прозрачность оценивалась с использованием вертикального микроскопа и сортировалась следующим образом: оценка 3 - превосходная; оценка 2 - хорошая с некоторой нерегулярностью в мембране Десцемета; оценка 1 - неудовлетворительная из-за отека стромы или выраженных нерегулярностей в мембране Десцемета. После анализа роговицы погружали в среду для хранения при 4oС до последующих испытаний на сохранность или до использования для проникающей кератопластики. Исследования in vitro: эти эксперименты осуществляли с хорошо сохранившейся донорской роговицей, не подходящей для трансплантации по донорским противопоказаниям или заболеваниям. Парные глаза человека-донора удаляли в течение 10 ч после смерти. Роговицы удаляли с глазных яблок с 2 мм ободком склеры и испытывали на жизнеспособность эндотелиальных клеток, плотность эндотелиальных клеток, толщину роговицы и прозрачность. Жизнеспособность эндотелиальных клеток оценивали путем окрашивания с 0,3% трипаном синим. Смерть клеток обычно распределяется по двум видам: регулярный массив окрашенных клеток, соответствующих слоям, образующимся при механическом давлении на роговицу во время удаления, и диффузная смертность, указывающая на метаболическую дисфункцию эндотелиальных клеток. Анализ завершали в конце каждого эксперимента путем окрашивания ализариновым красным для оценки клеточной морфологии и площади мембраны Десцемета, не покрытой эндотелием. Смерть клеток выражали как процент окрашенных клеток по отношению к общему количеству клеток. Плотность эндотелиальных клеток оценивали, подсчитывая клетки в 5 областях центральной части роговицы с использованием оптического микроскопа с установленной 10 х 10 мм квадратной окулярной шкалой. Смертность клеток выше 10% и прозрачность с оценкой 1 рассматривались как несовместимые с экспериментом. Толщина роговицы измерялась посредством вертикального микроскопа, установленного с цифровым микрометром для оценки расстояния между эпителием и эндотелием. Для каждой роговицы получали три главных показания. Прозрачность оценивалась с использованием вертикального микроскопа и сортировалась следующим образом: оценка 3 - превосходная; оценка 2 - хорошая с некоторой нерегулярностью в мембране Десцемета; оценка 1 - неудовлетворительная из-за отека стромы или выраженных нерегулярностей в мембране Десцемета. После анализа роговицы хранили в 10 мл испытываемой среды (натриевая соль гиалуроновой кислоты, Optisol-GS или McKarey-Kaufman) при 4oC в течение 7-14 дней. Клинические исследования Неконтролируемые открыто меченные исследования осуществляли с использованием роговицы, оцененной, как описано выше и хранившейся в среде, содержащей гиалуроновую кислоту. Роговицы, хранившиеся в среде Optisol-GS, служили контрольными. Донорам было от 46 до 86 лет. Их роговицы, собранные в промежуток времени от 2 до 9 ч после смерти, были в превосходных условиях сохранности согласно оценке прозрачности, толщины, жизнеспособности эндотелиальных клеток (отсутствие клеток положительных по трипану синему) и плотности (2200-3000 клеток/мм2). Время хранения при 4oС составляло 25-96 ч (смотри таблицу 2). Роговицы нагревали до комнатной температуры во время трансплантации. Всего было отобрано 16 реципиентов, нуждающихся в проникающей кератопластике по причине кератоконуса, буллезной кератопатии, дистрофии Гроеноу (Groenow), приобретенной дистрофии эндотелия и лейкомы. Оперативный и послеоперационный уход были одинаковыми во всех случаях. Через две недели для трансплантата записывали степень реэпителиализации, прозрачность роговицы, толщину (измеренную ультразвуковой пахиметрией) и эндотелиальную клеточную плотность (оцененную анализом с фиксированной рамкой отражающих фотографий). Пациенты дополнительно обследовались через два месяца. 2. Результаты Исследования in vitro: пять пар роговиц хранили или в среде McKarey-Kaufman, Optisol-GS или в среде натриевой соли гиалуроновой кислоты. Прозрачность, толщину и смертность эндотелиальных клеток оценивали через 3, 7 или 14 дней, данные представлены в таблице 3. Превосходная сохранность роговицы наблюдалась в Optisol-GS и в среде гиалуроновой кислоты. Даже через 14 дней потеря эндотелиальных клеток не превышала 7%. Окрашивание ализарином красным и трипаном синим через 7 дней подтвердило целостность эндотелия. В соответствии с этим прозрачность роговицы и толщина хорошо сохранялись. Напротив, среда McKarey-Kaufman была менее эффективной. Прозрачность начинала пропадать через 3 дня, тогда как толщина увеличивалась до максимума в 40% через 7 дней. Потери эндотелиальных клеток достигали 22-25% через 14 дней. Эти результаты подтвердили слабую способность декстрана служить консервантом роговицы и указывают на большую эффективность как хондроитина сульфата, так и натриевой соли гиалуроновой кислоты. Натриевая соль гиалуроновой кислоты, однако, была способна достигать удовлетворительной сохранности роговицы в отсутствии декстрана, который требуется в среде Optisol-GS. Как констатировано выше, декстран может проникать в ткань роговицы и может увеличивать давление отека при подогревании. Клинические исследования: группе из восьми пациентов, назначенных на проникающую кератопластику, была пересажена роговица, хранившаяся в среде гиалуроновой кислоты, параллельной группе из восьми пациентов пересадили роговицу, хранившуюся в Optisol-GS. Реэпителиализация роговицы завершалась через 3 дня после хирургического вмешательства. Через две недели прозрачность и толщина роговицы хорошо сохранялись. Анализ плотности эндотелиальных клеток осуществляли для 10 пациентов и он подтвердил эффективность этих двух сред. Все трансплантаты были в хороших условиях через два месяца, когда они продемонстрировали реэпителиализацию и прозрачность с оценкой 3 (таблица 4). Выводы В общем результаты проведенного исследования продемонстрировали, что гиалуроновая кислота представляет собой эффективный агент для консервации роговицы, даже в отсутствие других веществ в среде для хранения. Ее главным преимуществом является эффективность в отсутствии других добавок к среде для хранения. Это делает композицию среды простой и недорогой, исключающей сложные питательные смеси. Кроме того, отсутствие лабильных компонентов, таких как пептиды или протеины (факторы роста), увеличивает стабильность среды при хранении и предотвращает образование продуктов деградации. Дополнительное преимущество среды гиалуроновой кислоты заключается в консервировании тонкой ткани во время хирургического вмешательства. Это позволяет обеспечивать точную оценку состояния ткани и более легкое обращение с ней во время трансплантации. Изобретение описано таким образом, но будет очевидно, что оно может варьироваться различными способами. Такие изменения не следует рассматривать как отход от духа изобретения и выход за объем притязаний, и предполагается, что все такие модификации, которые очевидны для специалиста в данной области, включаются в рамки следующих пунктов формулы изобретения. 2), расположенного на поверхности лейкоцита. ICAM-1 может также функционировать как рецептор гиалуроновой кислоты (McCourt, P.A.G. et al (1994) J.Biol. Chem., 269, 30081-30084). Это указывает на то, что эндотелиальные клетки взаимодействуют с лейкоцитами, когда те достигают водянистой влаги. Это также может указывать на то, что при нормальных условиях и в отсутствие лейкоцитов гиалуроновая кислота связывается с этим рецептором для предохранения целостности эндотелиального слоя. Отек роговицы: при потере функции откачки эндотелием гипертоничность стромы вызывает отек ткани роговицы. Отек приводит к увеличению толщины роговицы и уменьшает ее прозрачность. Кроме того, наблюдается потеря протеогликанов из стромы в окружающую среду. Потеря эндотелиальной функции является следствием патологии (например, дистрофии, дегенерации, глаукомы). Старение может приводить к эндотелиальной декомпенсации вследствие того, что эндотелиальные клетки ухудшаются с возрастом (примерно 50% с момента рождения до старости). Поскольку эндотелиальные клетки имеют ограниченную регенеративную способность, повреждение целостности эндотелия может быть скомпенсировано только увеличением остаточных клеток, которые становятся тоньше. Повреждение эндотелия является также главным риском при хранении роговицы перед трансплантацией. Это приводит к отеку роговицы с потерей прозрачности и смерти прогрессивной эндотелиальной клетки. Сохранность целостности эндотелиального слоя является действительно главной целью в заявляемых способах для сохранения роговицы перед проникающей кератопластикой. Хранение роговицы: целые глазные яблоки от донора могут храниться во влажной камере при 4oС, но их следует использовать в течение 24 ч. Успешно используется консервирование роговицы в замороженном состоянии (Kaufman Н.Е. and Capella J.A. (1968) J.Cryosurg., 1, 125-129). Перед замораживанием роговицы обрабатывают увеличенными концентрациями ДМСО и сахарозы, чтобы предотвратить образование межклеточного льда. Трудности при обработке и транспортировке замороженных роговиц при постоянной низкой температуре не дают широкого распространения такого способа. Альтернативно роговица может храниться при 37oС в органической культуральной среде (Doughman D.J. et al., (1976) Trans. Am. Acad. Ophtalmol. Otolaringol. , 81, 778-793). Поскольку культуральная среда дополняется сывороткой для оптимального сохранения клеток, этот метод имеет своим недостатком то, что глаз реципиента подвергается действию остаточного количества сыворотки, переносимой на роговице в момент трансплантации. Животная сыворотка может вызывать иммунный ответ, тогда как человеческая сыворотка может передавать вирусные заболевания. В настоящее время большинство общепринятых способов для сохранения роговицы оказываются способами краткосрочного хранения в свободной от сыворотки среде при 4oС. При этой температуре метаболическая активность эндотелиальных клеток является минимальной. Таким образом, теряется функция откачки. Отек роговицы может предотвращаться посредством добавления удерживающих воду соединений в среду для хранения. Среди них одним из наиболее используемых является декстран или сам по себе (McKarey B.E. and Kaufman H.E. (1974) Invest.Ophtalmol.Vis.Sci.l3, 165) или в комплексе с глюкозаминогликан хондроитин сульфатом (Kaufman H. E. et al.,(1991) Arch.Ophthalmol. 109, 864-868). Однако хондроитин сульфат является гетерогенным соединением из-за различного распределения сульфатных молекул в полимере (Scott, 1995). В результате композиции используемые для хранения роговицы могут варьироваться для различных серий. Кроме того, за счет сульфатных молекул хондроитин сульфат несет сильный отрицательный заряд. Недавно было выдвинуто предположение, что такой сильный отрицательный заряд является вредным при хранении роговицы, потому что сильный отрицательный заряд уменьшает адгезионную способность эндотелия роговицы (Chen et al., 1996). Далее сообщалось, что хондроитин сульфат может проникать в роговицу и вызывать ее отек, особенно при нагревании ткани от 4oС до комнатной температуры перед трансплантацией (Kaufman et al., 1991). При попытке снизить отек роговицы, вызываемый хондроитин сульфатом, составлялись композиции для хранения роговицы, содержащие такие удерживающие агенты, как декстран, в комбинации с хондроитин сульфатом (ЕР 0 517 972). Однако декстран может проникать в строму при хранении и может увеличивать давление при отеке при подогревании. Кроме того, в настоящее время также ясно, что декстран может быть токсичным для роговицы, вызывая физиологическое старение и вырождение (Chen et al., 1996). Ogino с сотр. (Mokugan Zen-shi, Воздействие вновь созданных сред для хранения роговицы на эндотелий роговицы - Морфологическое исследование методом сканирующей электронной микроскопии, 1995) описал среды для хранения, содержащие гиалуроновую кислоту (ГК). Но гиалуроновая кислота, использованная Ogino и др., имела молекулярную массу 800 000. ГК с такой высокой молекулярной массой является слишком вязкой, чтобы она была подходящей в качестве компоненты среды для хранения, и ее нужно использовать в комбинации с другими водоудерживающими компонентами для предотвращения отека роговицы без увеличения вязкости раствора. Следовательно, задачей настоящего изобретения является создание жидкости для хранения роговицы, способной обеспечить подходящие условия хранения для жизнеспособной роговицы, при исключении недостатков предшествующих жидкостей. Подробное описание изобретения Настоящее изобретение, следовательно, относится к композиции жидкости для роговицы, включающей гиалуроновую кислоту, и использованию рецептуры, включающей гиалуроновую кислоту, которая является подходящей для хранения жизнеспособной роговицы при низкой температуре, особенно между 2-8oС. Изобретение основано на следующих предположениях, которые согласуются с исследованием организации и функционирования роговицы, обсуждавшимся выше: (i) при хранении роговиц при низких температурах метаболическая активность эндотелиальных клеток гасится. Таким образом, факторы питания и роста (сыворотка или другие) не являются необходимыми. Функция откачки не осуществляется и не нуждается в поддержании; (ii) cбалансированный солевой раствор, дополненный водоудерживающим соединением, должен быть достаточным для поддержания целостности роговицы. Если единственное водоудерживающее соединение является подходящим, то другие соединения, такие как декстран, не являются более необходимыми; (iii) защитная пленка поверх эндотелиальных клеток необходима для предотвращения их повреждения во время хранения. Природный лиганд, способный ассоциироваться с сорецептором ICAM-1, кажется подходящим. Как подчеркивается ниже, гиалуроновая кислота была идентифицирована в качестве подходящего соединения, удовлетворяющего требованиям оптимального хранения роговицы при низких температурах. Гиалуроновая кислота принадлежит к группе глюкозаминогликанов, которая также включает соединения, содержащие сульфатные группы (хондроитины, кератаны и гепараны). Как следствие различного распределения сульфатных остатков эта группа глюкозаминогликанов представляет собой гетерогенную совокупность различных молекул. Напротив, гиалуроновая кислота содержит только дисахаридное звено N-ацетил-глюкозамина и глюкуронат. Таким образом, гиалуроновая кислота представляет собой гомогенное соединение с определенной первичной структурой: прямые цепи, содержащие сотни дисахаридных звеньев и сотни анионов, зафиксированных в каждой цепи (карбоксилатные группы). Недавно для гиалуроновй кислоты была установлена упорядоченная вторичная структура (Scott J.E. (1995) Eur.J.Rheumatol.Inflamm. 15, 3-8). Она поддерживается интенсивными водородными связями между звеньями сахаров и двухмерной спиральной структурой, образующейся при повороте на 180o между дисахаридными звеньями. Вторичная структура дает значительные гидрофобные участки в цепях гиалуроновой кислоты для примерно 8СН звеньев (длина короткой цепи жирной кислоты), которые способны ассоциироваться с мембранными фосфолипидами и другими липидами. Действительно положительный эффект гиалуроновой кислоты при воспалителении суставов может быть результатом ее ассоциации с липидоподобными воспалительными цитокинами, такими как тромбоцит-активирующий фактор. При разбавленных концентрациях гиалуроновой кислоты в водной среде (1 мкг/мл или более) образуется трехмерная структура (Scott J.E. et al., (1991) Biochem. J. 274, 699-705). Она представляет собой сотовидную сетчатую структуру, образованную за счет агрегации цепей гиалуроновой кислоты, устанавливающих динамические контакты между всеми молекулами гиалуроновой кислоты. Сетчатая структура захватывает внутрь воду и растворенные вещества, таким образом ограничивая их взаимодействие с внешней окружающей средой. Клетки с рецепторами для гиалуроновой кислоты могут закреплять большую сетчатую структуру вокруг себя. Это может иметь защитный эффект, предотвращая проникновение в клетки химических соединений. Представляет интерес наблюдение, что такая организация становится менее компактной и может действительно разрываться под действием свободных ОН радикалов, которые вызывают деградацию цепей гиалуроновой кислоты. В заключение свойства гиалуроновой кислоты, относящиеся к настоящему изобретению и служащие в целях поддержания жизнеспособной роговицы, являются следующими: 1. Присутствие фиксированных анионов в цепях гиалуроновой кислоты, действующих как растворимый катионообменник и, следовательно, ограничивающих движение одновалентных и двухвалентных катионов к ткани роговицы. 2. Присутствие гидрофобных частей во вторичной структуре цепей гиалуроновой кислоты, позволяющее соединению контактировать и защищать гидрофобные сайты, возможно оставленные незащищенными от воздействия в клеточной мембране. 3. Образование сети цепей гиалуроновой кислоты, охватывающей воду и растворенные вещества и обеспечивающей максимальный водоудерживающий эффект. 4. Взаимодействие с ICAM-1, сосредоточенным на поверхности эндотелиальных клеток, обеспечивающее образование защитной пленки гиалуроновой кислоты вокруг самих клеток. В принципе эти свойства являются достаточными для обеспечения защиты эндотелиальных клеток при низких температурах и для того, чтобы избежать отека роговицы. Поскольку гиалуроновая кислота высокой молекулярной массы (1 000 000 Да или более) образует вязкие растворы, следует использовать гиалуроновую кислоту более низкой молекулярной массы. В частности, гиалуроновая кислота должна иметь среднюю молекулярную массу менее примерно 600 000, предпочтительно она имеет среднюю молекулярную массу в пределах интервала от 50 000 до 250 000 Да, наиболее предпочтительно в пределах интервала от 50 000 до 150 000 Дальтон. При таком молекулярном размере все еще образуется сетчатая структура гиалуроновой кислоты, хотя ее организация может быть менее компактной. Для медицинских растворов, включаемых в настоящее изобретение, гиалуроновые кислоты могут быть получены из нескольких источников. Например, гиалуроновая кислота может быть очищена из обычных источников, таких как петушиные гребни, с использованием способов, описанных в ЕР 0 138 572. Альтернативно гиалуроновая кислота может быть получена ферментативным способом, как описано в WO 95/04132, или путем энзиматического синтеза с использованием очищенного протеинового фактора, содержащего гиалуронат синтазу, как описано в WO 95/24497. Примеры композиций Свободный от сыворотки медицинский раствор, предлагаемый в настоящем изобретении, должен содержать: 1. Сбалансированный раствор электролита, забуференный до рН 7,2-7,4 с помощью фосфата, бикарбоната и HEPES (гидроксиэтилпиперазинэтансульфоновая кислота). В целях изобретения минимальная незаменимая среда (например ТС 199, такая как доступная от Gibco BRL, Maryland; Signa, Missouri; Flow Laboratories, Maryland) является удовлетворительной. Эта среда широко используется при культивировании тканей и содержит в своем составе незаменимые неорганические соли, аминокислоты, витамины и предшественники АТФ. 2. Антибиотики такие как, но не ограничиваясь ими, гентамицин, стрептомицин, пенициллин G и их комбинации для предотвращения микробного загрязнения. 3. Натриевая соль гиалуроновой кислоты с молекулярной массой 50000-150000 Да, добавленная от 1 до 20 мг/мл, 0,1 до 2% мас./объем, исходя из общего раствора. Вариации могут быть сделаны при выборе солевого буферного раствора и антибиотиков. Эта простая композиция будет достаточной для удовлетворения всех требований оптимального хранения роговицы при низких температурах в течение по крайней мере недели. Биологические оценки 1. Материалы и методы Композиция свободной от сыворотки среды, включающей натриевую соль гиалуроновой кислоты, описана в таблице 1 в сравнении с коммерчески доступными средами для хранения роговицы, содержащими хондроитин сульфат и декстран (Optisol-GS) или один декстран (McKarey-Kaufman). Парные человеческие глаза донора были удалены в течение 9-10 ч после смерти. Роговицы отделялись от глазных яблок с 2 мм ободком склеры и испытывались на жизнеспособность эндотелиальных клеток, плотность эндотелиальных клеток, толщину роговицы и прозрачность. Жизнеспособность эндотелиальных клеток оценивалась путем окрашивания с 0,3% трипаном синим. Смерть клеток обычно распределяется по двум видам: регулярный массив окрашенных клеток, соответствующих слоям, образующимся при механическом давлении на роговицу во время удаления, и диффузная смертность, указывающая на метаболическую дисфункцию эндотелиальных клеток. Анализ завершали в конце каждого эксперимента путем окрашивания ализариновым красным для оценки клеточной морфологии и площади мембраны Десцемета, не покрытой эндотелием. Смерть клеток выражали как процент окрашенных клеток по отношению к общему количеству клеток. Плотность эндотелиальных клеток оценивали, подсчитывая клетки в 5 областях центральной части роговицы с использованием оптического микроскопа с установленной 10 х 10 мм квадратной окулярной шкалой. Когда смертность клеток была менее 2% и число эндотелиальных клеток было >2000 мм2, роговицы рассматривались как подходящие для трансплантации. Толщина роговицы измерялась посредством вертикального микроскопа, установленного с цифровым микрометром для оценки расстояния между эпителием и эндотелием. Для каждой роговицы получали три главных показания. Прозрачность оценивалась с использованием вертикального микроскопа и сортировалась следующим образом: оценка 3 - превосходная; оценка 2 - хорошая с некоторой нерегулярностью в мембране Десцемета; оценка 1 - неудовлетворительная из-за отека стромы или выраженных нерегулярностей в мембране Десцемета. После анализа роговицы погружали в среду для хранения при 4oС до последующих испытаний на сохранность или до использования для проникающей кератопластики. Исследования in vitro: эти эксперименты осуществляли с хорошо сохранившейся донорской роговицей, не подходящей для трансплантации по донорским противопоказаниям или заболеваниям. Парные глаза человека-донора удаляли в течение 10 ч после смерти. Роговицы удаляли с глазных яблок с 2 мм ободком склеры и испытывали на жизнеспособность эндотелиальных клеток, плотность эндотелиальных клеток, толщину роговицы и прозрачность. Жизнеспособность эндотелиальных клеток оценивали путем окрашивания с 0,3% трипаном синим. Смерть клеток обычно распределяется по двум видам: регулярный массив окрашенных клеток, соответствующих слоям, образующимся при механическом давлении на роговицу во время удаления, и диффузная смертность, указывающая на метаболическую дисфункцию эндотелиальных клеток. Анализ завершали в конце каждого эксперимента путем окрашивания ализариновым красным для оценки клеточной морфологии и площади мембраны Десцемета, не покрытой эндотелием. Смерть клеток выражали как процент окрашенных клеток по отношению к общему количеству клеток. Плотность эндотелиальных клеток оценивали, подсчитывая клетки в 5 областях центральной части роговицы с использованием оптического микроскопа с установленной 10 х 10 мм квадратной окулярной шкалой. Смертность клеток выше 10% и прозрачность с оценкой 1 рассматривались как несовместимые с экспериментом. Толщина роговицы измерялась посредством вертикального микроскопа, установленного с цифровым микрометром для оценки расстояния между эпителием и эндотелием. Для каждой роговицы получали три главных показания. Прозрачность оценивалась с использованием вертикального микроскопа и сортировалась следующим образом: оценка 3 - превосходная; оценка 2 - хорошая с некоторой нерегулярностью в мембране Десцемета; оценка 1 - неудовлетворительная из-за отека стромы или выраженных нерегулярностей в мембране Десцемета. После анализа роговицы хранили в 10 мл испытываемой среды (натриевая соль гиалуроновой кислоты, Optisol-GS или McKarey-Kaufman) при 4oC в течение 7-14 дней. Клинические исследования Неконтролируемые открыто меченные исследования осуществляли с использованием роговицы, оцененной, как описано выше и хранившейся в среде, содержащей гиалуроновую кислоту. Роговицы, хранившиеся в среде Optisol-GS, служили контрольными. Донорам было от 46 до 86 лет. Их роговицы, собранные в промежуток времени от 2 до 9 ч после смерти, были в превосходных условиях сохранности согласно оценке прозрачности, толщины, жизнеспособности эндотелиальных клеток (отсутствие клеток положительных по трипану синему) и плотности (2200-3000 клеток/мм2). Время хранения при 4oС составляло 25-96 ч (смотри таблицу 2). Роговицы нагревали до комнатной температуры во время трансплантации. Всего было отобрано 16 реципиентов, нуждающихся в проникающей кератопластике по причине кератоконуса, буллезной кератопатии, дистрофии Гроеноу (Groenow), приобретенной дистрофии эндотелия и лейкомы. Оперативный и послеоперационный уход были одинаковыми во всех случаях. Через две недели для трансплантата записывали степень реэпителиализации, прозрачность роговицы, толщину (измеренную ультразвуковой пахиметрией) и эндотелиальную клеточную плотность (оцененную анализом с фиксированной рамкой отражающих фотографий). Пациенты дополнительно обследовались через два месяца. 2. Результаты Исследования in vitro: пять пар роговиц хранили или в среде McKarey-Kaufman, Optisol-GS или в среде натриевой соли гиалуроновой кислоты. Прозрачность, толщину и смертность эндотелиальных клеток оценивали через 3, 7 или 14 дней, данные представлены в таблице 3. Превосходная сохранность роговицы наблюдалась в Optisol-GS и в среде гиалуроновой кислоты. Даже через 14 дней потеря эндотелиальных клеток не превышала 7%. Окрашивание ализарином красным и трипаном синим через 7 дней подтвердило целостность эндотелия. В соответствии с этим прозрачность роговицы и толщина хорошо сохранялись. Напротив, среда McKarey-Kaufman была менее эффективной. Прозрачность начинала пропадать через 3 дня, тогда как толщина увеличивалась до максимума в 40% через 7 дней. Потери эндотелиальных клеток достигали 22-25% через 14 дней. Эти результаты подтвердили слабую способность декстрана служить консервантом роговицы и указывают на большую эффективность как хондроитина сульфата, так и натриевой соли гиалуроновой кислоты. Натриевая соль гиалуроновой кислоты, однако, была способна достигать удовлетворительной сохранности роговицы в отсутствии декстрана, который требуется в среде Optisol-GS. Как констатировано выше, декстран может проникать в ткань роговицы и может увеличивать давление отека при подогревании. Клинические исследования: группе из восьми пациентов, назначенных на проникающую кератопластику, была пересажена роговица, хранившаяся в среде гиалуроновой кислоты, параллельной группе из восьми пациентов пересадили роговицу, хранившуюся в Optisol-GS. Реэпителиализация роговицы завершалась через 3 дня после хирургического вмешательства. Через две недели прозрачность и толщина роговицы хорошо сохранялись. Анализ плотности эндотелиальных клеток осуществляли для 10 пациентов и он подтвердил эффективность этих двух сред. Все трансплантаты были в хороших условиях через два месяца, когда они продемонстрировали реэпителиализацию и прозрачность с оценкой 3 (таблица 4). Выводы В общем результаты проведенного исследования продемонстрировали, что гиалуроновая кислота представляет собой эффективный агент для консервации роговицы, даже в отсутствие других веществ в среде для хранения. Ее главным преимуществом является эффективность в отсутствии других добавок к среде для хранения. Это делает композицию среды простой и недорогой, исключающей сложные питательные смеси. Кроме того, отсутствие лабильных компонентов, таких как пептиды или протеины (факторы роста), увеличивает стабильность среды при хранении и предотвращает образование продуктов деградации. Дополнительное преимущество среды гиалуроновой кислоты заключается в консервировании тонкой ткани во время хирургического вмешательства. Это позволяет обеспечивать точную оценку состояния ткани и более легкое обращение с ней во время трансплантации. Изобретение описано таким образом, но будет очевидно, что оно может варьироваться различными способами. Такие изменения не следует рассматривать как отход от духа изобретения и выход за объем притязаний, и предполагается, что все такие модификации, которые очевидны для специалиста в данной области, включаются в рамки следующих пунктов формулы изобретения.
Формула изобретения1. Раствор для хранения роговицы, который включает гиалуроновую кислоту, имеющую среднюю молекулярную массу от 50000 до 150000 Да или ее фармацевтически приемлемую соль в концентрации от 1 до 20 мг/мл. 2. Раствор для хранения роговицы по п. 1, который дополнительно включает сбалансированный раствор электролита и, по крайней мере, один антибиотик. 3. Раствор по п. 2, в котором рН раствора сбалансированного электролита равен 7,2-7,4. 4. Раствор по п. 3, в котором антибиотик представляет собой, по крайней мере, один член, выбранный из группы, состоящей из гентамицина, пенициллина G и стрептомицина. 5. Способ хранения ткани роговицы, который включает воздействие на ткани роговицы раствором по любому из пп. 1-4. 6. Способ по п. 5, в котором указанный медицинский раствор поддерживают при температуре 2-8oС.MM4A - Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 05.04.2005 Извещение опубликовано: 20.09.2007 БИ: 26/2007 Популярные патенты: 2232490 Машина для обработки почвы ... органы и повышают эксплуатационную надежность. Снижение нагрузки колес в 10-20 раз соответственно повышает надежность и энергомодуля /фиг.13-16/.Улучшают динамику машины и реверсивность, оборотность, многорежимность, саморегулируемость положения и нагрузки, самовыглубляемость при встрече с камнем, преобразуемость массы в технологически полезную силу, повторность работы.В динамике реверсивные рабочие органы 7, 8, 10, 30, 50, 61, 62, 66, 70, 72, 73, 95, 102 с упорами 121, 122, 123, колесами 8, 21, 32, 50, 52, роликами 64, 66, 68, 70, 72 выполняют соответствующие названию функции и реализуют законы /фиг.14-18/ без сложных энергомодулей и склоноходов, снижают скорость в 10 раз.Диски ... 2051971 Способ определения биологической активности -эндотоксинов различных патотипов bacileus thuringiensis ... упрощение и ускорение, повышение экономичности способа, расширение границ его применения. Цель достигается тем, что параспоральные кристаллы B.thuringiensis патотипов А и С, полученные при выращивании культур эндомопатогенных бактерий (например, B.thuringiensis sspp. thuringiensis, kurstaki, dendrolimus, galleriae, alesti, tenebrionis и др.) на средах любого известного состава, отмывают от адсорбированных на их поверхности примесей водой, IM NaCl, смесью ацетон: вода (2:3) и снова дистиллированной водой. Затем кристаллы (можно в смеси со спорами) растворяют в 0,015-0,035 н.NaCl 1 ч при комнатной температуре с перемешиванием (на качалке при 250 об./мин), осаждают -эндотоксинов ... 2459398 Способ рекультивации почв, загрязненных минерализованными водами ... промывки дренажных стоков, что удорожает технологию. Известен способ рекультивации засоленных почв, включающий высев на засоленной почве однолетних растений-галофитов (амарант) с последующей их уборкой (см, например Патент РФ 2109425, C1 A01B 79, опубл. 27.04.1998). Недостатками данного способа являются ограниченность применения способа (содержание солей до 3%), низкая эффективность предлагаемой технологии, а также длительность самого процесса расселения. Наиболее близким к заявляемому по технической сущности является способ рекультивации почв, загрязненных нефтепромысловыми пластовыми водами, задачей которого является рассолонцевание и расселение загрязненных земель (см. ... 2189742 Способ обработки инкубационных яиц ... ... 2105446 Плоскорежущая лапа ... и просеиваемости эрозионно-опасных частиц на дно борозды крошащая часть поверхности лапы по ширине захвата выполнена в виде косинусоиды с положительной выпуклостью кривизны вверх против выступов лезвия и отрицательной против вырезов лезвия, при этом лобовая поверхность лапы против выступов выполнена в виде сопряженных знакопеременных логарифмических кривых, одна из которых расположена в режущей части и имеет выпуклость в сторону нижней части лапы, а лобовая поверхность лапы против вырезов выполнена плоской [1] К причинам, препятствующим достижению требуемого технического результата при использовании известного устройства, относится низкое качество подрезания сорняков, в частности ... |
Еще из этого раздела: 2067798 Агромостовой комплекс 2154296 Зерноуборочная машина, преимущественно зерноуборочный комбайн, с мультипроцессорным управляющим устройством 2487516 Почвообрабатывающая машина 2243658 Способ повышения урожайности картофеля и томатов 2140738 Производные n-арилгидразина, способ их получения, способ подавления насекомых и композиция для подавления насекомых 2415570 Искусственное роение и борьба с естественным роением пчелиных семей 2272840 Способ молекулярного маркирования пола хмеля обыкновенного (humulus lupulus l) 2141182 Культиватор 2159526 Устройство для навешивания сельскохозяйственных орудий на трактор 2267924 Способ стимулирования роста растений |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||