Производные нафтохинона, инсектицидноакарицидная и-или фунгицидная композиция, способ борьбы с грибками, и-или насекомыми, и-или акаридамиПатент на изобретение №: 2174981 Автор: КХАМБАЙ Бхупиндер Полл Сингх (GB), БЭТТИ Дункан (GB), КАМЕРОН Стюарт (GB) Патентообладатель: БРИТИШ ТЕКНОЛОДЖИ ГРУП ЛИМИТЕД (GB) Дата публикации: 20 Декабря, 1999 Начало действия патента: 4 Июля, 1996 Адрес для переписки: 129010, Москва, ул. Большая Спасская 25, стр.3, ООО "Юридическая фирма Городисский и Партнеры", Лебедевой Н.Г. Изображения  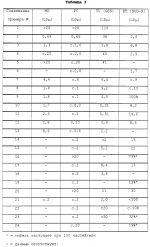  Описываются новые производные нафтохинона общей формулы I или его соли, где m равно 0 или 1, n - 0,R1 и R2 каждый независимо С1-С4 алкокси или вместе они представляют группу = 0, R3 - ОR10, где R10 - водород, С1-С6 алкил, замещенный С1-С4 алкокси, или R3 -COR11, где R11 - С1-С6 алкил, фенил, R4 и R5 каждый независимо атом водорода, С1-С4 алкил или вместе с атомом углерода, к которому они присоединены, представляют собой замещенную С1-С4 алкилом С3-С8 циклоалкильную группу, содержащую в кольце один атом кремния, R6 - (А)m Si(R14)3, где каждый R14 независимо С1-С4 алкил, или две группы R14 вместе с атомом кремния, находящимся между ними, образуют С3-С8 силакарбоциклическое кольцо, А - С1-С20 алкильная или алкенильная группа, R6 может дополнительно представлять атом водорода, алкоксигруппу, которая содержит один атом кремния и до 20 атомов углерода, R7 и R8 вместе представляют группу = 0, когда R6 представляет необязательно замещенную группу, содержащую атом кремния, то атом кремния группы R6 не связан непосредственно с карбоциклом. Описывается инсектицидноакарицидная и/или фунгицидная композиция на основе указанных соединений и способ борьбы с грибками, и/или насекомыми, и/или акаридам в локусе, использующий эти соединения. Технический результат - повышение активности, в особенности в отношении устойчивых штаммов насекомых и/или акарид, а также против чувствительных штаммов. 3 с. и 6 з.п.ф-лы, 7 табл. 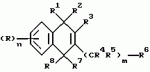 Данное изобретение относится к некоторым производным нафтохинона, способу их получения, композициям, содержащим такие соединения и к применению их в качестве пестицидов, таких как фунгициды и особенно инсектициды и/или акарициды. DE 3801743 A1 в целом раскрывает соединения общей формулы
Данное изобретение относится к некоторым производным нафтохинона, способу их получения, композициям, содержащим такие соединения и к применению их в качестве пестицидов, таких как фунгициды и особенно инсектициды и/или акарициды. DE 3801743 A1 в целом раскрывает соединения общей формулы 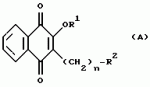 где n является целым числом от 0 до 12, R1 представляет собой необязательно замещенный алкил, аралкил, алкилкарбонил, (гетеро) арилкарбонил, алкоксикарбонил, алкилсульфонил или арилсульфонил, a R 2 представляет собой галоалкил, необязательно замещенный (гетеро)арил или замещенный циклоалкил. Эти соединения обладают акарицидной и фунгицидной активностью. Если R2 представляет собой фенильную или циклогексильную группу, то список предпочтительных заместителей включает в себя три-(C1-2 алкил) силильные группы, из которых наиболее предпочтительна триметилсилильная группа. Однако только одно из многих раскрытых соединений, удовлетворяющих формуле I, которая определена выше, имеет такие заместители, как соединение примера 5, в котором n равно 0, 1 представляет собой атом водорода, a R2 представляет собой 4-(триметилсилил)циклогексильную группу. Более того, хотя полученные результаты показывают, что соединение примера 5 имеет некоторую акарицидную и фунгицидную активность, ясно, что оно является не самым активным фунгицидом из тех, что раскрыты в DE 3801743 A1. Было обнаружено, что некоторые производные нафтохинона, имеющие группы, присоединенные к нафтохиноновому циклу, включающие как минимум один атом кремния, как основную часть группы, а не когда он является частью необязательного заместителя, имеют незаурядную пестицидную, особенно фунгицидную, и/или особенно инсектицидную, и/или акарицидную активность, и что многие из этих соединений активны против устойчивых штаммов насекомых и/или акарид, особенно против устойчивых штаммов тли, клещей и белокрылки, а также против чувствительных штаммов. Настоящее изобретение представляет соединение общей формулы где n является целым числом от 0 до 12, R1 представляет собой необязательно замещенный алкил, аралкил, алкилкарбонил, (гетеро) арилкарбонил, алкоксикарбонил, алкилсульфонил или арилсульфонил, a R 2 представляет собой галоалкил, необязательно замещенный (гетеро)арил или замещенный циклоалкил. Эти соединения обладают акарицидной и фунгицидной активностью. Если R2 представляет собой фенильную или циклогексильную группу, то список предпочтительных заместителей включает в себя три-(C1-2 алкил) силильные группы, из которых наиболее предпочтительна триметилсилильная группа. Однако только одно из многих раскрытых соединений, удовлетворяющих формуле I, которая определена выше, имеет такие заместители, как соединение примера 5, в котором n равно 0, 1 представляет собой атом водорода, a R2 представляет собой 4-(триметилсилил)циклогексильную группу. Более того, хотя полученные результаты показывают, что соединение примера 5 имеет некоторую акарицидную и фунгицидную активность, ясно, что оно является не самым активным фунгицидом из тех, что раскрыты в DE 3801743 A1. Было обнаружено, что некоторые производные нафтохинона, имеющие группы, присоединенные к нафтохиноновому циклу, включающие как минимум один атом кремния, как основную часть группы, а не когда он является частью необязательного заместителя, имеют незаурядную пестицидную, особенно фунгицидную, и/или особенно инсектицидную, и/или акарицидную активность, и что многие из этих соединений активны против устойчивых штаммов насекомых и/или акарид, особенно против устойчивых штаммов тли, клещей и белокрылки, а также против чувствительных штаммов. Настоящее изобретение представляет соединение общей формулы 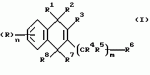 или его соль, где m равно 0 или 1; n представляет собой целое число от 0 до 4; каждый R представляет собой независимо атом галогена или нитро-, циано-, гидроксильную, алкильную, галоалкильную, алкокси-, галоалкокси, амино-, алкиламино, диалкиламино, алкоксикарбонильную, карбоксильную, алканоильную, алкилтио-, алкилсульфинильную, алкилсульфонильную, карбамоильную, алкиламидную, циклоалкильную, арильную или аралкильную группу; R1 и R2 каждый независимо представляет собой необязательно замещенную алкокси-группу, или вместе они представляют собой группы =O, =S или =N-OR9, где R9 представляет собой атом водорода или необязательно замещенную алкильную группу; R3 представляет собой гидроксильную группу, группу -OL, где L - уходящая группа, или группа, которая in vivo трансформируется в группу -OL1, где L1 является уходящей группой; R4 и R5, если присутствует, каждый независимо представляет собой атом водорода или галогена или необязательно замещенную алкильную группу, или вместе с атомом углерода, который их соединяет, представляют собой необязательно замещенную циклоалкильную или циклоалкенильную группу, необязательно содержащую в кольце по меньшей мере один атом кремния; R6 представляет собой необязательно замещенную группу, содержащую как минимум один атом кремния, или, в том случае, если m равно 1, -CR4R5-группа содержит как минимум один атом кремния, R6 может дополнительно представлять собой атом водорода, или необязательно замещенную алкильную, алкенильную, алкинильную, циклоалкильную, циклоалкенильную, арильную, алкокси, алкенилокси, алкинилокси, циклоалкокси, циклоалкенилокси или арилокси группу; и R7 и R8 независимо представляют собой необязательно замещенную алкоксигруппу или вместе представляют собой следующие группы: =O, =S или =N-OR9, где R9 такой, как определен выше. Если любая из вышеуказанных групп R4, R5 и R6 содержит как минимум один атом кремния, каждый атом кремния либо является составной частью группы, что означает, что он является атомом, входящим в состав цикла или цепи, но не в заместитель группы. В частности, атом кремния не является заместителем карбоциклического кольца, но может быть непосредственно связан с таким кольцом только, когда оно является частью цепи, и включает атом кремния в 1' положении карбоциклического кольца. Если соединения формулы I содержат алкильную, алкенильную или алкинильную группу в качестве заместителя, то эти группы могут быть линейными или разветвленными и содержать до 12, предпочтительно до 6, а еще лучше до 4 атомов углерода. Циклоалкильная или циклоалкенильная группа может содержать от 3 до 8, предпочтительно от 4 до 7 атомов углерода. Арильная группа может представлять собой любую ароматическую углеводородную группу, особенно фенильную или нафтильную группу. Аралкильная группа может представлять собой любую алкильную группу, как определено выше, которая замещена арильной группой, определенной выше, предпочтительно бензильной. Если любой из вышеуказанных заместителей, которые, как обозначено, являются необязательно замещенными, замещающие группы, которые необязательно присутствуют и могут представлять собой любую из тех, которые обычно применяются при разработке пестицидных соединений и/или модификации таких соединений для изменения их активности, устойчивости, проницаемости или других свойств. Характерные примеры таких заместителей включают, например, атомы галогенов, нитро, циано, гидроксильные, алкильные, галоалкильные, алкокси, галоалкокси, амино, алкиламино, диалкиламино, алкоксикарбонильные, карбоксильные, алканоильные, алкилтио, алкилсульфинильные, алкилсульфонильные, карбамоильные, алкиламидные, циклоалкильные, фенильную и бензильную группы. Обычно присутствуют от одного до трех заместителей. Если любой из предшествующих заместителей представляет собой или содержит алкил-замещающую группу, оно может быть линейным или разветвленным и может содержать до 12, предпочтительно до 6, а еще лучше до 4 атомов углерода. Если любой из предшествующих заместителей представляет собой или содержит арильную или циклоалкильную группу, то эта группа сама может содержать в качестве заместителей одни или несколько атомов галогенов, нитро-, циано-, алкильные, галоалкильные, алкокси или галоалкокси группы. Предпочтительно арильная группа представляет собой фенил, а циклоалкильная часть содержит от 3 до 8, а лучше от 4 до 7 атомов углерода. Соединения формулы I, в которых R3 представляет собой гидроксильную группу, и атом в или его соль, где m равно 0 или 1; n представляет собой целое число от 0 до 4; каждый R представляет собой независимо атом галогена или нитро-, циано-, гидроксильную, алкильную, галоалкильную, алкокси-, галоалкокси, амино-, алкиламино, диалкиламино, алкоксикарбонильную, карбоксильную, алканоильную, алкилтио-, алкилсульфинильную, алкилсульфонильную, карбамоильную, алкиламидную, циклоалкильную, арильную или аралкильную группу; R1 и R2 каждый независимо представляет собой необязательно замещенную алкокси-группу, или вместе они представляют собой группы =O, =S или =N-OR9, где R9 представляет собой атом водорода или необязательно замещенную алкильную группу; R3 представляет собой гидроксильную группу, группу -OL, где L - уходящая группа, или группа, которая in vivo трансформируется в группу -OL1, где L1 является уходящей группой; R4 и R5, если присутствует, каждый независимо представляет собой атом водорода или галогена или необязательно замещенную алкильную группу, или вместе с атомом углерода, который их соединяет, представляют собой необязательно замещенную циклоалкильную или циклоалкенильную группу, необязательно содержащую в кольце по меньшей мере один атом кремния; R6 представляет собой необязательно замещенную группу, содержащую как минимум один атом кремния, или, в том случае, если m равно 1, -CR4R5-группа содержит как минимум один атом кремния, R6 может дополнительно представлять собой атом водорода, или необязательно замещенную алкильную, алкенильную, алкинильную, циклоалкильную, циклоалкенильную, арильную, алкокси, алкенилокси, алкинилокси, циклоалкокси, циклоалкенилокси или арилокси группу; и R7 и R8 независимо представляют собой необязательно замещенную алкоксигруппу или вместе представляют собой следующие группы: =O, =S или =N-OR9, где R9 такой, как определен выше. Если любая из вышеуказанных групп R4, R5 и R6 содержит как минимум один атом кремния, каждый атом кремния либо является составной частью группы, что означает, что он является атомом, входящим в состав цикла или цепи, но не в заместитель группы. В частности, атом кремния не является заместителем карбоциклического кольца, но может быть непосредственно связан с таким кольцом только, когда оно является частью цепи, и включает атом кремния в 1' положении карбоциклического кольца. Если соединения формулы I содержат алкильную, алкенильную или алкинильную группу в качестве заместителя, то эти группы могут быть линейными или разветвленными и содержать до 12, предпочтительно до 6, а еще лучше до 4 атомов углерода. Циклоалкильная или циклоалкенильная группа может содержать от 3 до 8, предпочтительно от 4 до 7 атомов углерода. Арильная группа может представлять собой любую ароматическую углеводородную группу, особенно фенильную или нафтильную группу. Аралкильная группа может представлять собой любую алкильную группу, как определено выше, которая замещена арильной группой, определенной выше, предпочтительно бензильной. Если любой из вышеуказанных заместителей, которые, как обозначено, являются необязательно замещенными, замещающие группы, которые необязательно присутствуют и могут представлять собой любую из тех, которые обычно применяются при разработке пестицидных соединений и/или модификации таких соединений для изменения их активности, устойчивости, проницаемости или других свойств. Характерные примеры таких заместителей включают, например, атомы галогенов, нитро, циано, гидроксильные, алкильные, галоалкильные, алкокси, галоалкокси, амино, алкиламино, диалкиламино, алкоксикарбонильные, карбоксильные, алканоильные, алкилтио, алкилсульфинильные, алкилсульфонильные, карбамоильные, алкиламидные, циклоалкильные, фенильную и бензильную группы. Обычно присутствуют от одного до трех заместителей. Если любой из предшествующих заместителей представляет собой или содержит алкил-замещающую группу, оно может быть линейным или разветвленным и может содержать до 12, предпочтительно до 6, а еще лучше до 4 атомов углерода. Если любой из предшествующих заместителей представляет собой или содержит арильную или циклоалкильную группу, то эта группа сама может содержать в качестве заместителей одни или несколько атомов галогенов, нитро-, циано-, алкильные, галоалкильные, алкокси или галоалкокси группы. Предпочтительно арильная группа представляет собой фенил, а циклоалкильная часть содержит от 3 до 8, а лучше от 4 до 7 атомов углерода. Соединения формулы I, в которых R3 представляет собой гидроксильную группу, и атом в 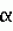 - и - и 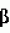 -положении, особенно в -положении, особенно в 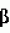 -положении группы R6, является атомом кремния, являются синтетически менее доступными, чем другие соединения формулы I. Следовательно, более предпочтительно, что, если R3 представляет собой гидроксильную группу, то атом в -положении группы R6, является атомом кремния, являются синтетически менее доступными, чем другие соединения формулы I. Следовательно, более предпочтительно, что, если R3 представляет собой гидроксильную группу, то атом в 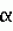 - и/или - и/или  -положении группы R6 не является атомом кремния. Предпочтительным также является, когда R (в случае присутствия) представляет собой атом галогена или нитро-, циано-, гидроксильную, C1-4 алкильную, C1-4 галоалкильную, C1-4 алкокси, C1-4 галоалкокси, C1-4 алкиламино, ди-C1-4 алкиламино-, C1-4 алкоксикарбонильную, C1-4 алкилтио, C1-4 алкилсульфинильную или C1-4 алкилсульфонильную группу. Более предпочтительно, когда R (в случае присутствия) представляет собой атом галогена или C1-4 алкильную, C1-4 галоалкильную, C1-4 алкокси- или C1-4 галоалкоксигруппу. В предпочтительном варианте n равно 0, 1 или 2, особенно предпочтительно, чтобы n было равно 0. Предпочтительно также, чтобы R1 и R2 каждый независимо представляли собой C1-4алкокси-, особенно метоксигруппу, или вместе представляли собой =O или = N-OR9, где R9 представляет атом водорода или C1-4алкильную, особенно метильную, группу. Наиболее предпочтительно, чтобы R1 и R2 вместе представляли собой =O. Если R3 представляет собой группу -OL, где L - уходящая группа, которая in vivo трансформируется в группу -OL1, где L1 является уходящей группой, L и L1 могут быть любой группой, обычно применяемой в качестве уходящей группы. Однако желательно, чтобы значение рКa кислот LOH и L1ОН в воде были ниже 7, лучше ниже 6, а еще лучше ниже 5. Если R3 представляет собой группу, которая in vivo трансформируется в группу-OL1, где L1 является уходящей группой, желательно, чтобы эта трансформация происходила в защищаемых растениях или в паразитах, предпочтительно под действием ферментов в этих организмах. Например, если R3 представляет собой -положении группы R6 не является атомом кремния. Предпочтительным также является, когда R (в случае присутствия) представляет собой атом галогена или нитро-, циано-, гидроксильную, C1-4 алкильную, C1-4 галоалкильную, C1-4 алкокси, C1-4 галоалкокси, C1-4 алкиламино, ди-C1-4 алкиламино-, C1-4 алкоксикарбонильную, C1-4 алкилтио, C1-4 алкилсульфинильную или C1-4 алкилсульфонильную группу. Более предпочтительно, когда R (в случае присутствия) представляет собой атом галогена или C1-4 алкильную, C1-4 галоалкильную, C1-4 алкокси- или C1-4 галоалкоксигруппу. В предпочтительном варианте n равно 0, 1 или 2, особенно предпочтительно, чтобы n было равно 0. Предпочтительно также, чтобы R1 и R2 каждый независимо представляли собой C1-4алкокси-, особенно метоксигруппу, или вместе представляли собой =O или = N-OR9, где R9 представляет атом водорода или C1-4алкильную, особенно метильную, группу. Наиболее предпочтительно, чтобы R1 и R2 вместе представляли собой =O. Если R3 представляет собой группу -OL, где L - уходящая группа, которая in vivo трансформируется в группу -OL1, где L1 является уходящей группой, L и L1 могут быть любой группой, обычно применяемой в качестве уходящей группы. Однако желательно, чтобы значение рКa кислот LOH и L1ОН в воде были ниже 7, лучше ниже 6, а еще лучше ниже 5. Если R3 представляет собой группу, которая in vivo трансформируется в группу-OL1, где L1 является уходящей группой, желательно, чтобы эта трансформация происходила в защищаемых растениях или в паразитах, предпочтительно под действием ферментов в этих организмах. Например, если R3 представляет собой  -кислотную группу, такую как -O-CH2CH2CO-OH, где -CH2CH2CO-OH не является уходящей группой, то она может подвергаться ферментативному окислению in vivo, под действием, например, -кислотную группу, такую как -O-CH2CH2CO-OH, где -CH2CH2CO-OH не является уходящей группой, то она может подвергаться ферментативному окислению in vivo, под действием, например,  -оксидазы, с образованием группы -O-CO-CH2-CO-OH, где -CO-CH2-CO-OH является уходящей группой. Желательно, чтобы R3 представлял собой группу -OR10, где R10 представляет собой атом водорода или группу -CO-R11, -SO-R11, -SO2-R11, -P(X) (OR12)(OR13), -P(X)(R12)(OR13), -P(OR12)(OR13) или -P(R12)(OR13), где R11 представляет собой атом водорода, необязательно замещенную алкильную, арильную или аралкильную группу, или группу -NR12R13; R12 и R13 независимо представляют собой атом водорода или необязательно замещенную алкильную группу, а X представляет собой атом кислорода или серы. Если R10 или R11 представляют собой необязательно замещенную арильную или аралкильную группу, предпочтительно, чтобы арильная группа представляла собой фенил, а необязательные заместители были выбраны из атомов галогенов, нитро- и C1-4 алкильных групп. Особенно предпочтительно замещение в 4 положении фенильного кольца. Предпочтительно R3 представляет собой гидроксильную группу или группу -O-CO-R11, где R11 представляет собой атом водорода, или C1-12 алкильную, C1-12 галоалкильную, C1-12 гидроксиалкильную, C1-12 карбоксиалкильную, фенильную или бензильную группу. Особенно предпочтительно, если R3 представляет собой гидроксильную группу, или группу -O-CO-R11, где R11 представляет собой атом водорода, или C1-6 алкильную, C1-6 галоалкильную, фенильную или бензильную группу. В одном предпочтительном аспекте R4 и R5 каждый независимо представляет собой атом водорода, или C1-4 алкильную, особенно метильную или C1-4 галоалкильную, особенно трифторметильную, группу. В более предпочтительном варианте R4 и R5 оба представляют собой атом водорода. Альтернативно, R4 и R5 вместе с атомом, к которому присоединены, представляют собой C3-8 циклоалкильную группу, необязательно замещенную одним или более заместителями, выбранными из атомов галогена, C1-4 алкильной и C1-4 галоалкильной групп. В более предпочтительном варианте R4 и R5 вместе со смежным атомом представляют собой С3-8 циклоалкильную группу, необязательно замещенную одним или более атомами галогена, лучше хлора или брома. Особенно предпочтительно R4 и R5 вместе со смежным атомом представляют собой незамещенную C5-7 циклоалкильную группу. Если R4 и R5 имеют любое значение из приведенных в двух предыдущих параграфах, то R6 должен представлять собой группу, содержащую как минимум один атом кремния. То есть предпочтительно, если R6 представляет собой необязательно замещенную алкильную, алкенильную, алкинильную, циклоалкильную, циклоалкенильную, арильную, алкокси-, алкенилокси-, алкинилокси-, циклоалкокси-, циклоалкенилокси- или арилоксигруппу, причем каждая группа содержит как минимум один атом кремния и до 20, лучше до 15, и предпочтительно от 2 до 12 атомов углерода. Более предпочтительно, если R6 представляет собой алкильную, галоалкильную, алкоксиалкильную, алкокси-, галоалкокси-, алкоксиалкокси-, алкенильную, галоалкенильную или алкоксиалкенильную группу, причем каждая группа содержит один или два атома кремния и до 20, лучше до 15, и предпочтительно от 2 до 12 атомов углерода. Еще более предпочтительно, если R6 представляет собой алкильную или алкенильную группу, содержащую один атом кремния и до 20, лучше до 15, и предпочтительно от 2 до 12 атомов углерода. Предпочтительные группы R6, имеющие формулу -(A)m-Si(R14)3, где m такой, как определено для формулы (I), каждый R14 представляет собой независимо C1-4 алкил, или вместе с атомом кремния, находящимся между двумя такими группами, образуют кремнеуглеродный цикл, а A представляет собой C1-20 алкильную или алкенильную группу, которая может быть замещена галогеном и которая может быть неразветвленной, разветвленной или может включать углеродный цикл (карбоцикл). В более предпочтительных случаях группы R6 содержат атом кремния, который включен в углеродный цикл и может там занимать любую позицию, включая место присоединения других групп, таких как алкильные или алкенильные цепи с R6. Более предпочтительны группы R6, имеющие формулу -(CH2)p-Si(R14), где p находится в интервале от 1 до 15, предпочтительно от 1 до 10, а особенно от 1 до 6, каждый R14 представляет собой независимо C1-4 алкильную, особенно метильную, группу. Альтернативно две группы R14 вместе с атомом кремния, находящимся между двумя такими группами, могут образовывать 3-8 членный кремнеуглеродный, или силациклоалкильный, цикл. В другом предпочтительном аспекте R4 и R5 вместе с атомом углерода, находящимся между ними, могут представлять собой силациклоалкильную группу, содержащую от 3 до 8, лучше от 5 до 7, атомов в цикле, необязательно замещенную одним или несколькими заместителями, выбранными из атомов галогенов, C1-4 алкильной и C1-4 галоалкильной групп. Более предпочтительно, если R4 и R5 вместе с атомом углерода, находящимся между ними, представляет собой силациклоалкильную группу, содержащую от 3 до 8, лучше от 5 до 7, атомов в цикле, необязательно замещенную одним или несколькими атомами галогенов, особенно хлором или бромом. Особенно предпочтительными являются такие варианты, когда R4 и R5 вместе с атомом углерода, находящимся между ними, представляет собой силациклоалкильную группу, содержащую от 5 до 7 атомов. Желательно, чтобы такая группа содержала один или два атома кремния, а лучше только один. Если R4 и R5 такие, как описано в двух предыдущих параграфах, желательно, чтобы R6 представлял собой атом водорода или необязательно замещенную алкильную, алкенильную, алкинильную, циклоалкильную, циклоалкенильную, арильную, алкокси-, алкенилокси-, алкинилокси-, циклоалкокси-, циклоалкенилокси- или арилоксигруппу, причем каждая такая группа может необязательно содержать как минимум один атом кремния и до 20, особенно до 15, а лучше от 2 до 12 атомов углерода. В более предпочтительном варианте R6 представляет собой атом водорода или алкильную, галоалкильную, алкоксиалкильную, алкокси-, галоалкокси-, алкоксиалкокси-, алкенильную, галоалкенильную или алкоксиалкенильную группу, причем каждая группа может необязательно содержать один или два атома кремния и до 20, особенно до 15, и лучше от 2 до 12 атомов углерода. Еще более предпочтительными вариантами являются такие варианты, где R6 представляет собой алкильную или алкенильную группу, необязательно содержащую один атом кремния и до 20, особенно до 15, и лучше от 2 до 12 атомов углерода. Желательно, чтобы R7 и R8 независимо представляли собой C1-4 алкокси, особенно метоксигруппу, или вместе - группу =O или =N-OR9, где R9 представляет собой атом водорода или C1-4 алкильную, особенно метильную, группу. Наиболее предпочтительно, чтобы R7 и R8 вместе представляли собой группу =O. Особенно предпочтительной замещающей группой соединений формулы (I) является такая, в которой m равно 1; n равно 0; 1 и R2 оба представляют собой метоксигруппу, или вместе - группу =O; R3 представляет собой гидрокси, алкинокси (например, этаноилокси) или арилокси (напр., бензоилокси) группу; R4 и R5 оба представляют собой атом водорода; R6 представляет собой триметилсилилметильную, триметилсилилэтильную, триметилсилилпропильную, триметилсилилбутильную, триметилсилилпентильную, триметилсилилгексильную, триметилсилилгептильную, триметилсилилоктильную, триметилсилилнонильную или триметилсилилдецильную группу; и R7 и R9 вместе представляют собой группу =O. Соединения формулы I могут образовывать соли, если R3 представляет собой гидроксильную группу. Основания, подходящие для образования таких солей, включают неорганические основания, такие как гидроксид натрия, гидроксид калия или карбонат натрия, и органические основания, особенно третичные амины, такие как триэтиламин и пирролидин. Некоторые соединения формулы I могут существовать в виде различных геометрических изомеров и диастереомеров. Данное изобретение включает как индивидуальные изомеры, так и смеси этих изомеров. Настоящее изобретение также предоставляет способ получения соединения формулы I или его соли, описанных выше, который представляет собой взаимодействие соединения общей формулы (II) -оксидазы, с образованием группы -O-CO-CH2-CO-OH, где -CO-CH2-CO-OH является уходящей группой. Желательно, чтобы R3 представлял собой группу -OR10, где R10 представляет собой атом водорода или группу -CO-R11, -SO-R11, -SO2-R11, -P(X) (OR12)(OR13), -P(X)(R12)(OR13), -P(OR12)(OR13) или -P(R12)(OR13), где R11 представляет собой атом водорода, необязательно замещенную алкильную, арильную или аралкильную группу, или группу -NR12R13; R12 и R13 независимо представляют собой атом водорода или необязательно замещенную алкильную группу, а X представляет собой атом кислорода или серы. Если R10 или R11 представляют собой необязательно замещенную арильную или аралкильную группу, предпочтительно, чтобы арильная группа представляла собой фенил, а необязательные заместители были выбраны из атомов галогенов, нитро- и C1-4 алкильных групп. Особенно предпочтительно замещение в 4 положении фенильного кольца. Предпочтительно R3 представляет собой гидроксильную группу или группу -O-CO-R11, где R11 представляет собой атом водорода, или C1-12 алкильную, C1-12 галоалкильную, C1-12 гидроксиалкильную, C1-12 карбоксиалкильную, фенильную или бензильную группу. Особенно предпочтительно, если R3 представляет собой гидроксильную группу, или группу -O-CO-R11, где R11 представляет собой атом водорода, или C1-6 алкильную, C1-6 галоалкильную, фенильную или бензильную группу. В одном предпочтительном аспекте R4 и R5 каждый независимо представляет собой атом водорода, или C1-4 алкильную, особенно метильную или C1-4 галоалкильную, особенно трифторметильную, группу. В более предпочтительном варианте R4 и R5 оба представляют собой атом водорода. Альтернативно, R4 и R5 вместе с атомом, к которому присоединены, представляют собой C3-8 циклоалкильную группу, необязательно замещенную одним или более заместителями, выбранными из атомов галогена, C1-4 алкильной и C1-4 галоалкильной групп. В более предпочтительном варианте R4 и R5 вместе со смежным атомом представляют собой С3-8 циклоалкильную группу, необязательно замещенную одним или более атомами галогена, лучше хлора или брома. Особенно предпочтительно R4 и R5 вместе со смежным атомом представляют собой незамещенную C5-7 циклоалкильную группу. Если R4 и R5 имеют любое значение из приведенных в двух предыдущих параграфах, то R6 должен представлять собой группу, содержащую как минимум один атом кремния. То есть предпочтительно, если R6 представляет собой необязательно замещенную алкильную, алкенильную, алкинильную, циклоалкильную, циклоалкенильную, арильную, алкокси-, алкенилокси-, алкинилокси-, циклоалкокси-, циклоалкенилокси- или арилоксигруппу, причем каждая группа содержит как минимум один атом кремния и до 20, лучше до 15, и предпочтительно от 2 до 12 атомов углерода. Более предпочтительно, если R6 представляет собой алкильную, галоалкильную, алкоксиалкильную, алкокси-, галоалкокси-, алкоксиалкокси-, алкенильную, галоалкенильную или алкоксиалкенильную группу, причем каждая группа содержит один или два атома кремния и до 20, лучше до 15, и предпочтительно от 2 до 12 атомов углерода. Еще более предпочтительно, если R6 представляет собой алкильную или алкенильную группу, содержащую один атом кремния и до 20, лучше до 15, и предпочтительно от 2 до 12 атомов углерода. Предпочтительные группы R6, имеющие формулу -(A)m-Si(R14)3, где m такой, как определено для формулы (I), каждый R14 представляет собой независимо C1-4 алкил, или вместе с атомом кремния, находящимся между двумя такими группами, образуют кремнеуглеродный цикл, а A представляет собой C1-20 алкильную или алкенильную группу, которая может быть замещена галогеном и которая может быть неразветвленной, разветвленной или может включать углеродный цикл (карбоцикл). В более предпочтительных случаях группы R6 содержат атом кремния, который включен в углеродный цикл и может там занимать любую позицию, включая место присоединения других групп, таких как алкильные или алкенильные цепи с R6. Более предпочтительны группы R6, имеющие формулу -(CH2)p-Si(R14), где p находится в интервале от 1 до 15, предпочтительно от 1 до 10, а особенно от 1 до 6, каждый R14 представляет собой независимо C1-4 алкильную, особенно метильную, группу. Альтернативно две группы R14 вместе с атомом кремния, находящимся между двумя такими группами, могут образовывать 3-8 членный кремнеуглеродный, или силациклоалкильный, цикл. В другом предпочтительном аспекте R4 и R5 вместе с атомом углерода, находящимся между ними, могут представлять собой силациклоалкильную группу, содержащую от 3 до 8, лучше от 5 до 7, атомов в цикле, необязательно замещенную одним или несколькими заместителями, выбранными из атомов галогенов, C1-4 алкильной и C1-4 галоалкильной групп. Более предпочтительно, если R4 и R5 вместе с атомом углерода, находящимся между ними, представляет собой силациклоалкильную группу, содержащую от 3 до 8, лучше от 5 до 7, атомов в цикле, необязательно замещенную одним или несколькими атомами галогенов, особенно хлором или бромом. Особенно предпочтительными являются такие варианты, когда R4 и R5 вместе с атомом углерода, находящимся между ними, представляет собой силациклоалкильную группу, содержащую от 5 до 7 атомов. Желательно, чтобы такая группа содержала один или два атома кремния, а лучше только один. Если R4 и R5 такие, как описано в двух предыдущих параграфах, желательно, чтобы R6 представлял собой атом водорода или необязательно замещенную алкильную, алкенильную, алкинильную, циклоалкильную, циклоалкенильную, арильную, алкокси-, алкенилокси-, алкинилокси-, циклоалкокси-, циклоалкенилокси- или арилоксигруппу, причем каждая такая группа может необязательно содержать как минимум один атом кремния и до 20, особенно до 15, а лучше от 2 до 12 атомов углерода. В более предпочтительном варианте R6 представляет собой атом водорода или алкильную, галоалкильную, алкоксиалкильную, алкокси-, галоалкокси-, алкоксиалкокси-, алкенильную, галоалкенильную или алкоксиалкенильную группу, причем каждая группа может необязательно содержать один или два атома кремния и до 20, особенно до 15, и лучше от 2 до 12 атомов углерода. Еще более предпочтительными вариантами являются такие варианты, где R6 представляет собой алкильную или алкенильную группу, необязательно содержащую один атом кремния и до 20, особенно до 15, и лучше от 2 до 12 атомов углерода. Желательно, чтобы R7 и R8 независимо представляли собой C1-4 алкокси, особенно метоксигруппу, или вместе - группу =O или =N-OR9, где R9 представляет собой атом водорода или C1-4 алкильную, особенно метильную, группу. Наиболее предпочтительно, чтобы R7 и R8 вместе представляли собой группу =O. Особенно предпочтительной замещающей группой соединений формулы (I) является такая, в которой m равно 1; n равно 0; 1 и R2 оба представляют собой метоксигруппу, или вместе - группу =O; R3 представляет собой гидрокси, алкинокси (например, этаноилокси) или арилокси (напр., бензоилокси) группу; R4 и R5 оба представляют собой атом водорода; R6 представляет собой триметилсилилметильную, триметилсилилэтильную, триметилсилилпропильную, триметилсилилбутильную, триметилсилилпентильную, триметилсилилгексильную, триметилсилилгептильную, триметилсилилоктильную, триметилсилилнонильную или триметилсилилдецильную группу; и R7 и R9 вместе представляют собой группу =O. Соединения формулы I могут образовывать соли, если R3 представляет собой гидроксильную группу. Основания, подходящие для образования таких солей, включают неорганические основания, такие как гидроксид натрия, гидроксид калия или карбонат натрия, и органические основания, особенно третичные амины, такие как триэтиламин и пирролидин. Некоторые соединения формулы I могут существовать в виде различных геометрических изомеров и диастереомеров. Данное изобретение включает как индивидуальные изомеры, так и смеси этих изомеров. Настоящее изобретение также предоставляет способ получения соединения формулы I или его соли, описанных выше, который представляет собой взаимодействие соединения общей формулы (II) 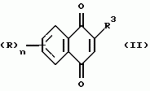 в которой n, R и R3 такие, как определены выше, с карбоновой кислотой HOOC-(CR4R5)m-R6, где R4, R5 и R6 такие, как определены выше, с условием, что если m равно 0, то атом в в которой n, R и R3 такие, как определены выше, с карбоновой кислотой HOOC-(CR4R5)m-R6, где R4, R5 и R6 такие, как определены выше, с условием, что если m равно 0, то атом в 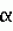 -положении группы R6 не является атомом кремния. Это взаимодействие происходит в присутствии свободнорадикального инициатора, такого как пероксисульфат аммония и нитрат серебра, в подходящем растворителе, таком как водный ацетонитрил, с образованием соединения общей формулы (III) -положении группы R6 не является атомом кремния. Это взаимодействие происходит в присутствии свободнорадикального инициатора, такого как пероксисульфат аммония и нитрат серебра, в подходящем растворителе, таком как водный ацетонитрил, с образованием соединения общей формулы (III) 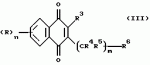 в которой m, n, R3, R4, R5 и R6 такие, как определены выше, с условием, что если m равно 0, то атом в в которой m, n, R3, R4, R5 и R6 такие, как определены выше, с условием, что если m равно 0, то атом в 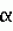 -положении группы R6 не является атомом кремния. Соединения формулы III соответствуют соединениям формулы I, в которых R1 и R2 вместе и R7 и R8 вместе представляют собой группу =O, и могут далее подвергаться реакциям для получения других соединений формулы I с помощью различных способов получения производных или комбинаций этих способов. Например, соединения формулы II, в которых R3 представляет собой -O-CO-C6H5, являются подходящими исходными соединениями и могут вступать в реакцию по описанной выше схеме с образованием соединения формулы III. Соединения формулы I, в которых R3 представляет собой гидроксильную группу, могут быть получены путем взаимодействия соединения формулы III, в котором R3 представляет собой группу -O-CO-C6H5 с соответствующим основанием, например гидроксидом натрия или калия, в подходящем растворителе, таком как тетрагидрофуран. Соединения формулы I, в которых R3 представляет собой группу -OL, где L такая, как определена выше, могут быть получены путем взаимодействия соединения формулы I, в котором R3 представляет собой гидроксильную группу с соединением Y-L, где Y представляет собой атом галогена, в присутствии органического основания, желательно третичного амина, такого как триэтиламин, или неорганического основания, такого как карбонат натрия. Например, соединения формулы I, в которых R3 представляет собой группу -O-CO-R11, где R11 такой, как определен выше, могут быть получены путем ацилирования гидроксильной группы соответствующего соединения формулы I, например, с помощью хлорангидрида R11-CO-Cl в соответствующем растворителе, таком как дихлорметан, в присутствии основания, такого как триэтиламин, или с помощью ангидрида кислоты в присутствии пиридина в качестве основания. Альтернативно, соединения формулы I, в которых R3 представляет собой гидроксильную группу, могут взаимодействовать с соединением HO-L, где L такая, как определена выше, в присутствии дегитратирующего агента, например дициклогексилкарбодиимида. Соединения формулы I, в которых R3 представляет собой группу -OL, где L такой, как определен выше, могут быть получены также путем взаимодействия соединения формулы I в виде соли металла, где R3 представляет собой гидроксильную группу, то есть R3 представляет собой группу -ОМ, где М является ионом металла, с соединением Y-L, как описано выше. Соединения формулы I, в которых R1 и R2 и/или R7 и R8 каждый независимо представляет собой необязательно замещенную алкоксигруппу, могут быть получены путем кетализации одной или обоих карбонильных групп в подходящем соединении формулы III, при использовании, например, подходящего спирта в основных или кислых условиях, таких как гидроксид калия в метаноле. Соединения формулы I, в которых R1 и R2 и/или R7 и R8 вместе представляют собой тиокарбонильную группу =S, могут быть получены путем обработки соответствующего соединения формулы III таким реагентом, как, например, реагент Лавессона (Lawesson's Reagent) (2,4-бис(4-метоксифенил)-1,3- дитио-2,4-дифосфетан-2,4-дисульфид), при необходимости используя защитные группы. Соединения формулы I, в которых R1 и R2 и/или R9 и R8 вместе представляют собой оксим =N-OR9, где R9 такой, как определен выше, могут быть получены путем обработки соответствующего соединения формулы III гидроксиламином или алкоксиламином, имеющим формулу R9O-NH2, где R9 такой, как определен выше, в присутствии основания, например пиридина. В альтернативном варианте получения соединений формулы I, особенно в которых m равно 0 и атом в -положении группы R6 не является атомом кремния. Соединения формулы III соответствуют соединениям формулы I, в которых R1 и R2 вместе и R7 и R8 вместе представляют собой группу =O, и могут далее подвергаться реакциям для получения других соединений формулы I с помощью различных способов получения производных или комбинаций этих способов. Например, соединения формулы II, в которых R3 представляет собой -O-CO-C6H5, являются подходящими исходными соединениями и могут вступать в реакцию по описанной выше схеме с образованием соединения формулы III. Соединения формулы I, в которых R3 представляет собой гидроксильную группу, могут быть получены путем взаимодействия соединения формулы III, в котором R3 представляет собой группу -O-CO-C6H5 с соответствующим основанием, например гидроксидом натрия или калия, в подходящем растворителе, таком как тетрагидрофуран. Соединения формулы I, в которых R3 представляет собой группу -OL, где L такая, как определена выше, могут быть получены путем взаимодействия соединения формулы I, в котором R3 представляет собой гидроксильную группу с соединением Y-L, где Y представляет собой атом галогена, в присутствии органического основания, желательно третичного амина, такого как триэтиламин, или неорганического основания, такого как карбонат натрия. Например, соединения формулы I, в которых R3 представляет собой группу -O-CO-R11, где R11 такой, как определен выше, могут быть получены путем ацилирования гидроксильной группы соответствующего соединения формулы I, например, с помощью хлорангидрида R11-CO-Cl в соответствующем растворителе, таком как дихлорметан, в присутствии основания, такого как триэтиламин, или с помощью ангидрида кислоты в присутствии пиридина в качестве основания. Альтернативно, соединения формулы I, в которых R3 представляет собой гидроксильную группу, могут взаимодействовать с соединением HO-L, где L такая, как определена выше, в присутствии дегитратирующего агента, например дициклогексилкарбодиимида. Соединения формулы I, в которых R3 представляет собой группу -OL, где L такой, как определен выше, могут быть получены также путем взаимодействия соединения формулы I в виде соли металла, где R3 представляет собой гидроксильную группу, то есть R3 представляет собой группу -ОМ, где М является ионом металла, с соединением Y-L, как описано выше. Соединения формулы I, в которых R1 и R2 и/или R7 и R8 каждый независимо представляет собой необязательно замещенную алкоксигруппу, могут быть получены путем кетализации одной или обоих карбонильных групп в подходящем соединении формулы III, при использовании, например, подходящего спирта в основных или кислых условиях, таких как гидроксид калия в метаноле. Соединения формулы I, в которых R1 и R2 и/или R7 и R8 вместе представляют собой тиокарбонильную группу =S, могут быть получены путем обработки соответствующего соединения формулы III таким реагентом, как, например, реагент Лавессона (Lawesson's Reagent) (2,4-бис(4-метоксифенил)-1,3- дитио-2,4-дифосфетан-2,4-дисульфид), при необходимости используя защитные группы. Соединения формулы I, в которых R1 и R2 и/или R9 и R8 вместе представляют собой оксим =N-OR9, где R9 такой, как определен выше, могут быть получены путем обработки соответствующего соединения формулы III гидроксиламином или алкоксиламином, имеющим формулу R9O-NH2, где R9 такой, как определен выше, в присутствии основания, например пиридина. В альтернативном варианте получения соединений формулы I, особенно в которых m равно 0 и атом в 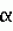 -положении группы R6 является атомом кремния, соединение общей формулы (IV) -положении группы R6 является атомом кремния, соединение общей формулы (IV) 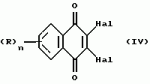 где каждый Hal независимо представляет собой атом галогена, предпочтительно хлора или брома, а n и R такие, как определены выше, взаимодействует с соединением общей формулы Z-R6, где Z представляет собой атом галогена, предпочтительно хлора или брома, a R6 такой, как определен выше, особенно при условии, что атом где каждый Hal независимо представляет собой атом галогена, предпочтительно хлора или брома, а n и R такие, как определены выше, взаимодействует с соединением общей формулы Z-R6, где Z представляет собой атом галогена, предпочтительно хлора или брома, a R6 такой, как определен выше, особенно при условии, что атом  -положении группы R6 является атомом кремния, в присутствии органометаллического реагента, такого как бутилат лития, в таком растворителе, как диэтиловый эфир или тетрагидрофуран, при низкой температуре, желательно от -70oC до - 120oC, с образованием соединения, имеющего общую формулу (V) -положении группы R6 является атомом кремния, в присутствии органометаллического реагента, такого как бутилат лития, в таком растворителе, как диэтиловый эфир или тетрагидрофуран, при низкой температуре, желательно от -70oC до - 120oC, с образованием соединения, имеющего общую формулу (V) 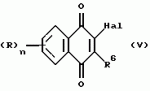 где n, R, R6 и Hal такие, как определены выше, особенно при условии, что атом в где n, R, R6 и Hal такие, как определены выше, особенно при условии, что атом в  -положении группы R6 является атомом кремния. Соединение формулы V может затем взаимодействовать с подходящим основанием, например неорганическим основанием, таким как гидроксид натрия или калия, с образованием соответствующего соединения формулы I, в котором R3 представляет собой гидроксильную группу. Для получения других соединений формулы I могут использоваться комбинации способов получения производных, описанных выше. Соединения формул II и IV являются известными соединениями или могут быть приготовлены из известных соединений с помощью известных способов получения. Как упомянуто выше, было обнаружено, что соединения формулы I обладают пестицидной, например фунгицидной, и/или особенно инсектицидной, и/или акарицидной активностью. Соответственно, данное изобретение далее рассматривает пестицидные композиции, которые включают носитель и, в качестве активного ингредиента, соединение формулы I или его соль. Здесь также рассматривается способ приготовления таких композиций, который включает смешение и ассоциацию соединения формулы I, определенного выше, с как минимум одним носителем. Такие композиции могут содержать одно или смесь нескольких соединений настоящего изобретения. Различные изомеры или смеси изомеров могут иметь разные уровни или спектры активностей, и, следовательно, разные композиции могут включать индивидуальные изомеры или смеси изомеров. Композиции данного изобретения могут содержать от 0,001 до 95 вес.% активного ингредиента формулы I. Предпочтительно композиции данного изобретения в готовом для использования виде содержат от 0,001 до 25 вес.% активного ингредиента. Однако более высокие концентрации, а именно до 95 вес.%, могут иметь место в композициях, если активный ингредиент находится в твердом виде, как концентрат, который необходимо разводить перед использованием. Соединения настоящего изобретения можно смешивать с различными подходящими инертными носителями, такими как растворители, разбавители и/или поверхностно-активные вещества, с образованием в результате порошков, гранул, смачивающихся порошков, антикомариных спиралей, а также в виде других твердых форм или эмульсий, эмульгирующихся концентратов, спреев, аэрозолей и других жидких препаратов. Подходящие растворители и разбавители включают воду, алифатические и ароматические углеводороды, такие как ксилол или другие фракции нефти, и спирты, например этанол. Поверхностно-активные агенты могут быть анионного, катионного или неионного типа. Кроме того, могут быть включены антиоксиданты или другие стабилизаторы, а также отдушки и красители. Тип и пропорции этих инертных носителей такие, как обычно используют в пестицидных композициях. Кроме инертных носителей композиции данного изобретения могут также содержать один или несколько дополнительных активных ингредиентов. Эти дополнительные активные ингредиенты могут представлять собой соединения, отличные от соединений, рассматриваемых в данном изобретении, но обладающие пестицидной активностью и синергетическим эффектом с соединениями данного изобретения. Как указано выше, соединения формулы I могут использоваться для подавления распространения паразитов в домашнем хозяйстве, садоводстве, сельском хозяйстве, медицине и ветеринарии. Таким образом, в другом аспекте настоящее изобретение предлагает применение соединения формулы I или его соли, или композиции, которые определены выше, в качестве пестицида, например фунгицида, и/или особенно инсектицида, и/или акарицида. Настоящее изобретение представляет также метод борьбы с паразитами, такими как грибы, и/или особенно насекомыми, и/или акаридами в очаге поражения (локусе), который включает обработку очага соединением формулы I, или его солью, или композицией, включающей его, которые определены выше. Предпочтительно, очаг включает паразитов самих по себе, или окружающую среду, атакуемую, или атакованную паразитами. Более предпочтительно, очаг включает паразитов самих по себе, запасы продовольствия, растений или животных, атакуемых, или атакованных паразитами, семена таких растений, или среду, в которой такие растения растут или должны расти. Особенно хорошо соединения формулы I и их композиции, определенные выше, могут использоваться в домашнем хозяйстве для распыления в комнатах с помощью спрея с целью подавления распространения домашних мух или других насекомых, в садоводстве или сельском хозяйстве - для обработки запасов урожая, особенно зерновых, для орошения с помощью спрея растущего урожая, например хлопка или риса, с целью подавления заражения грибами, насекомыми или другими паразитами, и в области медицины или ветеринарии, например, для обработки рогатого скота с помощью спрея для профилактики или лечения инвазии насекомых или других паразитов. Настоящее изобретение далее будет описано с помощью иллюстрации последующими неограничивающими примерами. В этих примерах структуры соединений подтверждают путем определения сдвигов в спектре 13C ЯМР (в м.д.), перечисленных в следующем порядке: бициклическая система; CH2 (и =CH, в случае присутствия); Si(алкил)3; другие группы. Другие примеры, попадающие в сферу изобретения, станут ясными для специалистов в свете приведенного здесь. ПРИМЕРЫ Пример 1 Получение 2-бензоилокси-3-(2'-триметилсилилэтил)-1,4-нафтохинона (Формула I: m = 1; n = 0; R1 и R2 вместе и R7 и R8 вместе одновременно представляют собой =O; R3 = -O-CO-C6H5; R4 = R5 = H; R6 = -CH2Si(CH3)3) 2-бензоилокси-1,4-нафтохинон (1,39 г, 5 ммолей), триметилсилилпропионовую кислоту (1,09 г, 7,5 ммолей) и нитрат серебра (523 мг, 3 ммоля) суспендируют в 40 мл водного ацетонитрила (1:1) и затем нагревают до 65oC. Раствор персульфата аммония (1,71 г, 7,5 ммолей) в 20 мл воды медленно добавляют к полученной смеси по каплям в течение 30 мин. После этого реакционную смесь перемешивают еще час при установленной температуре и затем охлаждают, добавляют диэтиловый эфир и удаляют водную фазу. Органическую фазу промывают насыщенным раствором бикарбоната натрия, затем насыщенным раствором хлорида натрия и высушивают над безводным сульфатом магния. После упаривания под вакуумом неочищенный продукт подвергают хроматографии, используя в качестве элюента петролейный эфир/этилацетат, получают 2- бензоилокси-3-(2'-триметилсилилэтил)-1,4-нафтохинон (879 мг) и перекристаллизовывают его из метанола. Т. пл.: 92-95oC. ЯМР- спектр: 184,4, 178,2, 150,3, 142,6, 134,0, 133,8, 132,1, 130,9, 126,6, 126,6; 18,8, 16,2; -2,0; 163,8, 128,0, 128,7, 130,4, 134,2(PhCO). Пример 2 Получение 2-гидрокси-3-(2'-триметилсилилэтил)-1,4-нафтохинона (Формула I: m = 1; n = 0; R1 и R2 вместе и R7 и R8 вместе одновременно представляют собой =O; R3 = -ОН; R4 = R5 = H; R6 = -CH2Si(CH3)3) Раствор 2-бензоилокси-3-(2'-триметилсилилэтил)-1,4-нафтохинона (270 мг, 0,71 ммоля), полученного по приведенному в примере 1 методу, в тетрагидрофуране (10 мл) обрабатывают 2N раствором гидроксида натрия (0,73 мл, 1,42 ммоля) и смесь перемешивают в течение ночи при комнатной температуре. Затем реакционную смесь упаривают под вакуумом, остаток помещают в диэтиловый эфир и подкисляют до pH 2 с помощью 1N соляной кислоты. Органическую фазу промывают насыщенным раствором хлорида натрия, высушивают над безводным сульфатом магния и упаривают под вакуумом. Неочищенный продукт подвергают хроматографии, используя в качестве элюента петролейный эфир/этилацетат, получают 2-гидрокси-3-(2'-триметилсилилэтил)-1,4-нафтохинон (163 мг) и перекристаллизовывают его из гексана. Т. пл.: 98-100oC. ЯМР спектр: 184,6, 181,6, 152,2, 134,7, 132,9, 132,8, 129,4, 127,3, 126,6, 126,0; 17,6, 15,7; -1,9. Пример 3 Получение 2-гидрокси-3-(5'-триметилсилилпентил)-1,4-нафтохинона (Формула I: m = 1; n = 0; R1 и R2 вместе и R7 и R8 вместе одновременно представляют собой =O; R3 = -ОН; R4 = R5 = H; R6 = -(CH2)4Si(CH3)3) 2-Гидрокси-3-(6'-триметилсилилгексил)-1,4-нафтохинон (337 мг, 1,02 ммоля), приготовленный из 2-бензоилокси-1,4-нафтохинона и триметилсилилгептановой кислоты с помощью последовательно примененных способов примеров 1 и 2, растворяют в диоксане (2,5 мл) в атмосфере азота. Добавляют раствор карбоната натрия (120 мг) в воде (2,5 мл) и затем избыток 30% (вес./об.) перекисии водорода (200 мкл). Смесь нагревают при 70oC в течение 40 мин, пока реакционная смесь, имеющая изначально красный цвет, не обесцветится. Реакционную смесь охлаждают, добавляют 20% (вес./об.) раствор сульфата меди (100 мкл) и перемешивают до прекращения образования пузырьков. Затем добавляют 25% (вес. /об. ) раствора гидроксида натрия (2 мл) и 20% (вес./об.) раствор сульфата меди (5 мл), после чего реакционную смесь нагревают при 70oC в течение 30 мин. Смесь охлаждают и подкисляют до pH 2 с помощью 1N соляной кислоты. Продукт экстрагируют в этиловый эфир, затем экстракт промывают насыщенным раствором хлорида натрия, высушивают над безводным сульфатом магния и упаривают под вакуумом. Неочищенный продукт подвергают хроматографии, используя в качестве элюента 5% диэтиловый эфир/гексан, и получают 2-гидрокси-3-(5'-триметилсилилпентил)-1,4-нафтохинон (202 мг), который перекристаллизовывают из гексана. Т. пл. : 73-75oC. ЯМР спектр: 184,6, 181,4, 153,0, 134,8, 132,9, 132,7, 129,4, 126,7, 126,0, 124,8; 33,6, 27,9, 33,7, 23,2, 16,5; -1,7. Пример 4 Получение 2-этаноилокси-3-(2'-триметилсилилэтил)-1,4-нафтохинона (Формула I: m = 1; n = 0; R1 и R2 вместе и R7 и R9 вместе одновременно представляют собой =O; R3 = -O-CO-CH3; R4 = R5 = H; R6 = -CH2Si(CH3)3 2-Бензоилокси-3-(2'-триметилсилилэтил)-1,4-нафтохинон (346 мг, 0,92 ммоля), полученный по методу примера 1, гидролизуют по методу примера 2, гидролизат ацелируют путем добавления пиридина (6 мл) и уксусного ангидрида (3 мл). Реакционную смесь оставляют на ночь, затем упаривают под вакуумом. Неочищенный продукт подвергают хроматографии, используя в качестве элюента этилацетат/петролейный эфир и получают 2-этаноилокси-3-(2'-триметилсилилэтил)-1,4-нафтохинон (265 мг), который перекристаллизовывают из гексана. Т. пл. : 85-87oC. ЯМР спектр: 184,3, 178,2, 149,8, 142,2, 134,0, 133,7, 132,0, 130,8, 126,5, 126,4; 18,6, 16,1; -2,1; 167,9, 20,2 (COCH3). Пример 5 Получение 2-гидрокси-3-(2'-триметилсилилэтил)-1,4-нафтохинона, 1-диметил ацеталя (Формула I: m = 1; n = 0; R1 = R2 = -OCH3; R3 = -ОН; R4 = R5 = H; R6 = -CH2Si(CH3)3; R7 и R8 вместе представляют собой =O) 2-Этаноилокси-3-(2'-триметилсилилэтил)-1,4-нафтохинон (3 г), полученный по способу, описанному в примере 4, растворяют в метаноле (100 мл) и добавляют раствор карбоната калия (1,5 г) в воде (5 мл). Реакционную смесь перемешиваю при комнатной температуре 2 часа, затем разбавляют водой (около 400 мл) и экстрагируют диэтиловым эфиром. Экстракт высушивают над безводным сульфатом натрия и упаривают растворитель, получая 2-гидрокси-3- (2'-триметилсилилэтил)-1,4-нафтохинон, 1-диметил ацеталь в виде твердого вещества бледно-желтого цвета, т. пл.: 102-104oC. ЯМР спектр: 183,6, 158,4, 135,2, 133,4, 132,7, 130,0, 126,2, 125,6, 125,2, 97,3; 16,8, 16,3; -2,1; 51,9 (2 x OMe). Примеры 6-13 Другие соединения формулы I получают посредством способов, сходных с приведенными выше в примерах 1-5, по детальным описаниям, приведенным в табл. 1. Соединения из этой таблицы идентифицируют ссылкой на формулу I. (В следующих примерах m = 1; n = 0; R1 и R2 вместе и R7 и R8 вместе одновременно представляют собой =O; R4 = R5 = H) Ниже приведены пики ЯМР спектров: Пример 6: ЯМР спектр: 184,7, 180,8, 151,3, 134,4, 132,9, 132,9, 129,7, 126,7, 126,0 125,5; 15,0; -0,8. Пример 7: 184,7, 181,5, 154,0, 134,8, 132,9, 132,8, 129,5, 127,6, 126,0 125,6; 27,1, 22,9, 17,0; -1,7. Пример 8: 184,6, 181,4, 152,9, 134,7, 132,9, 132,8, 129,4, 126,7, 126,0, 124,8; 32,1, 24,2, 23,1, 16,4; -1,7. Пример 9: 184,6, 181,4, 153,0, 134,7, 132,8, 132,6, 129,4, 126,7, 126,0, 124,8; 33,4, 29,5, 28,2, 23,8, 23,3, 16,5; -1,7. Пример 10: 184,7, 181,5, 153,0, 134,8, 132,9, 132,8, 129,4, 126,8, 126,0, 124,9; 33,5, 29,7, 29,2, 28,3, 23,9, 23,4, 16,6; -1,6. Пример 11: 184,7, 181,5, 153,0, 134,8, 132,9, 132,8, 129,4, 126,7, 126,0, 124,9; 33,6, 29,8, 29,4, 29,3, 28,3, 23,9, 23,3, 16,6; -1,6. Пример 12: 184,7, 181,5, 153,0, 134,8, 132,9, 132,8, 129,5, 126,8, 126,0, 124,9; 33,6, 29,8, 29,5, 29,4, 29,3, 28,3, 23,9, 23,4, 16,7; -1,7. Пример 13: 184,6, 181,4, 153,0, 134,7, 132,9, 132,8, 129,4, 126,7, 126,0, 124,8; 33,6, 29,8, 29,6, 29,6, 29,4, 29,3, 28,3, 23,9, 23,3, 16,6; -1,7. Пример 14 Получение 2-гидрокси-3-(8-(диметилэтилсилил)октил)-1,4-нафтохинона Формула I: m= 1; n = 0; R1 и R2 вместе и R7 и R8 вместе одновременно представляют собой =O; R3 = -ОН; R4 = R5 = H; R6 = -(CH2)7)7Si(CH3)2CH2CH3. К магниевой стружке (1,98 г, 81,5 ммолей) при комнатной температуре добавляют по каплям раствор 1,8-дибромоктана (11,1 г, 40,8 ммолей) в сухом ТГФ (50 мл). После того как прекратится выделение газа, смесь в течение 2 часов кипятят с обратным холодильником для получения октил димагний дибромида. После охлаждения до комнатной температуры медленно добавляют раствор хлордиметилэтилсилана (5,00 г, 40,8 ммолей) в ТГФ (5 мл). Реакционную смесь кипятят с обратным холодильником еще 1 час. Затем через охлажденную реакционную смесь пропускают газообразную двуокись углерода в течение 30 мин, после чего добавляют эфир (50 мл) и подкисляют разбавленной соляной кислотой. Водный слой отделяют и дополнительно экстрагируют эфиром (3 х 25 мл). Объединенные эфирные слои промывают водой (2 х 25 мл), насыщенным раствором хлорида натрия (50 мл), высушивают (MgSO4) и фильтруют. Растворитель упаривают при пониженном давлении, получая белое воскообразное вещество, которое экстрагируют гексаном (3 х 50 мл). Объединенные гексановые экстракты упаривают при пониженном давлении и получают бесцветную жидкость (5,94 г). Эта жидкость взаимодействует с 2-бензоилокси-1,4-нафтохиноном по методу, описанному в примере 1, и затем с помощью метода, описанного в примере 2, получают 2-гидрокси-3-(8-(диметилэтилсилил)октил)-1,4-нафтохинон (753 мг), который перекристаллизовывают из гексана, т. пл. 39-41oC. ЯМР спектр: 184,7, 181,5, 152,9, 134,8, 132,9, 132,8, 129,4, 126,8, 126,0, 124,8; 33,7, 29,8, 29,4, 29,3, 28,3, 23,9, 23,4, 14,8; 7,4, 6,9, -3,9. Примеры 15-17 Другие соединения формулы I получают посредством способов, идентичных описанным выше в примере 13, детали приведены в табл. 2. Соединения из этой таблицы идентифицируют ссылкой на формулу I. Наблюдаемые пики ЯМР приведены ниже: Пример 15 ЯМР спектр: 184,7, 181,5, 153,0, 134,8, 132,9, 132,9, 129,4, 126,8, 126,1, 124,8; 33,9, 29,8, 29,4, 29,3, 28,3, 23,8, 23,4, 11,3; 7,5, 3,3. Пример 16 ЯМР спектр: 184,7, 181,5, 153,0, 134,8, 132,9, 132,8, 129,5, 126,8, 126,0, 124,9; 34,0, 29,9, 29,5, 29,3, 28,3, 23,9, 23,4, 12,6; 18,7, 17,5, 15,6. Пример 17 ЯМР спектр: 184,7, 181,5, 153,1, 134,8, 133,0, 132,8, 129,5, 126,8, 126,0, 124,9; 33,7, 29,9, 29,4, 29,3, 28,3, 23,9, 23,4, 18,0; 18,4, 17,4, 15,3, -3,3. Пример 18 Получение 2-гидрокси-3-(8-(1-метил-(тетраметиленсилил)октил)-1,4- нафтохинона Формула I: m = 1; n = 0; R1 и R2 вместе и R7 и R8 вместе одновременно представляют собой =O; R3 = -ОН; R4 = R5 = H и R6 = -(CH2)7SiCH3(CH2)4. К магниевой стружке (4,5 г, 185 ммолей) медленно добавляют раствор дибромбутана (20,0 г, 92,6 ммолей) в сухом ТГФ (100 мл). После окончания добавления смесь в течение 1 часа кипятят с обратным холодильником (refluxed) и затем охлаждают до комнатной температуры. Добавляют по каплям раствор триметилсилилхлорида (13,8 г, 92,6 ммолей) в ТГФ (10 мл) и продолжают кипячение с обратным холодильником еще 30 мин. Охлажденный раствор добавляют по каплям к приготовленному заранее раствору октил димагний дибромида, как описано в примере 14. Реакционную смесь кипятят с обратным холодильником в течение 1 часа, охлаждают до комнатной температуры и барботирутот газообразную двуокись углерода через раствор в течение 30 мин. Затем подкисляют разбавленной соляной кислотой и экстрагируют эфиром (4 х 50 мл). Объединенные эфирные слои промывают водой (2 х 50 мл), насыщенным раствором хлорида натрия (50 мл) и высушивают (MgSO4). Фильтрация и упаривание растворителя при пониженном давлении приводят к получению не совсем белого воскообразного вещества, которое экстрагируют гексаном (3 х 50 мл). Объединенные гексановые экстракты упаривают при пониженном давлении и получают бледно-желтое масло. Эта жидкость взаимодействует с 2-бензоилокси-1,4-нафтохиноном по методу, описанному в примере 1, и затем с помощью метода, описанного в примере 2, получают 2-гидрокси-3-(8-(1-метил-(тетраметиленсилил)октил)- 1,4-нафтохинон (161 мг), т. пл. 42-44oC. ЯМР спектр: 184,7, 181,5, 153,0, 134,8, 132,9, 132,8, 129,4, 126,8, 126,1, 124,8; 33,5, 29,8, 29,4, 29,3, 28,3, 24,3, 23,4; 27,4, 15,1, 11,8, -3,2. Пример 19 Получение 2-гидрокси-3-(8-(1-метил-(пентаметиленсилил)октил)-1,4- нафтохинона Формула I: m = 1; n = 0; R1 и R2 вместе и R7 и R9 вместе одновременно представляют собой = O; R3 = -ОН; R4 = R5 = H и R6 = -(CH2)7SiCH3(CH2)5. С помощью метода, идентичного описанному в примере 17, используя вместо дибромбутана дибромпентан, получают 2-гидрокси-3- (8-(1-метил-(пентаметиленсилил)октил)-1,4-нафтохинон (10 мг), т. пл. 38-40oC. ЯМР спектр: 184,7, 181,5, 153,0, 134,8, 133,0, 132,9, 129,5, 126,8, 126,1, 124,9; 33,6, 29,8, 29,4, 29,3, 28,3, 23,7, 23,4, 24,3, 14,1; 30,2, 24,5, 12,9, -4,8. Пример 20 Получение 2-гидрокси-3-(3-триметилсилил-1-пропенил)-1,4-нафтохинона Формула I: m = 0; n = 0; R1 и R2 вместе и R7 и R8 вместе одновременно представляют собой =O; R3 = -ОН; R4 = R5 = H и R5 = -CH=CH-CH2Si(CH3)3. К раствору 3-триметилсилилпропанола (5,00 г, 37,8 ммолей) в дихлорметане (120 мл) при комнатной температуре, при перемешивании добавляют хлорхромат пиридиния (16,3 г, 75,6 ммолей). Смесь перемешивают в течение 2 часов, фильтруют через силикагель, элюируют эфиром. Фильтрат упаривают при пониженном давлении и получают бесцветную жидкость (3,96 г). К раствору этой жидкости (1,00 г) в дихлорметане (30 мл) при комнатной температуре при перемешивании добавляют 2-гидрокси-1,4-нафтохинон (1,11 г, 6,40 ммолей) и пирролидин (569 мг, 8,00 ммолей). Смесь перемешивают в течение 15 часов, затем добавляют п-толуол сульфоновую кислоту (3,04 г, 16,0 ммолей), и продолжают перемешивание при комнатной температуре еще 24 часа, и 3 часа кипятят с обратным холодильником. Смесь охлаждают и растворитель упаривают при пониженном давлении. Остаток растворяют в эфире (50 мл) и промывают водой (2 х 25 мл), разбавленной соляной кислотой (25 мл), водой (25 мл), насыщенным раствором хлорида натрия (25 мл) и высушивают (MgSO4). Затем фильтруют, упаривают растворитель при пониженном давлении и хроматографируют, элюируя смесью гексан/эфир, получая 2-гидрокси-3-(3-триметилсилил-1-пропенил)-1,4-нафтохинон (123 мг). Т. пл. 72-74oC. ЯМР спектр: 184,7, са 182, 150,5, 134,7, 133,0, 132,8, са 129, 126,9, 125,8, са 120; 142,5, 117,0, 27,4; -1,8. Пример 21 Получение 2-этаноилокси-3-(9-триметилсилилнонил)-1,4-нафтохинона Формула I: m = 1; n = 0; R1 и R2 вместе и R7 и R8 вместе одновременно представляют собой =O; R3 = -O-CO-CH3; R4 = R5 = H; R6 = -(CH2)8Si(CH3)3. С помощью метода, идентичного описанному в примере 4, из 2- гидрокси-3-(9-триметилсилилнонил)-1,4-нафтохинона, пример 12, получают 2-этаноилокси-3-(9-триметилсилилнонил)-1,4-нафтохинон, т. пл. 45-47oC. ЯМР спектр: 184,5, 178,1, 151,1, 139,9, 134,0, 133,8, 132,1, 130,9, 126,7, 126,6; 33,6, 29,7, 29,4, 29,4, 29,3, 28,5, 24,3, 24,0, 16,7; -1,6; 168,0, 20,4 (COCH3). Пример 22 Получение 2-пропаноилокси-3-(9-триметилсилилнонил)-1,4-нафтохинона Формула I: m = 1; n = 0; R1 и R2 вместе и R7 и R8 вместе одновременно представляют собой =O; R3 = -O-CO-CH2CH2CH3; R4 = R5 = H; R6 = -(CH2)8Si(CH3)3. К раствору 2-гидрокси-3-(9-триметилсилилнонил)-1,4-нафтохинона, пример 12, (100 мг, 0,27 ммолей) в сухом дихлорметане (10 мл) при комнатной температуре и при перемешивании добавляют пиридин (0,5 мл) и через 3 мин пропаноил хлорид (62 мг, 0,67 ммолей). Реакционную смесь перемешивают в течение 2 часов, разбавляют дихлорметаном (50 мл), промывают водой (2 х 30 мл), разбавленной соляной кислотой (30 мл), насыщенным раствором хлорида натрия (30 мл) и высушивают (MgSO4). Затем фильтруют, упаривают растворитель при пониженном давлении и хроматографируют, элюируя смесью гексан/эфир, получая 2-пропаноилокси-3-(9-триметилсилилнонил)-1,4-нафтохинон (112 мг). Т. пл. 41-43oC. ЯМР спектр: 184,6, 178,2, 151,2, 139,8, 134,0, 133,7, 132,1, 130,9, 126,7, 126,5, 33,6, 29,7, 29,4, 29,4, 29,3, 28,5, 24,3, 23,9, 16,7; -1,6; 171,6, 27,3, 9,1 (COCH2CH3). Пример 23 Получение 2-винилкарбонато-3-(9-триметилсилилнонил)-1,4-нафтохинона Формула I: m = 1; n=0; R1 и R2 вместе и R7 и R8 вместе одновременно представляют собой =O; R3 = -O-CO-O-CH=CH2; R4 = R5 = H; R6 = -(CH2)8Si(CH3)3. К раствору 2-гидрокси-3-(9-триметилсилилнонил)-1,4-нафтохинона, пример 12, (100 мг, 0,27 ммолей) в сухом дихлорметане (10 мл) при комнатной температуре и при перемешивании добавляют пиридин (0,5 мл) и через 3 мин винилхлорформиат (43 мг, 0,40 ммолей). Реакционную смесь перемешивают в течение 2 часов, разбавляют дихлорметаном (50 мл), промывают водой (2 х 30 мл), разбавленной соляной кислотой (30 мл), насыщенным раствором хлорида натрия (30 мл) и высушивают (MgSO4). Затем фильтруют, упаривают растворитель при пониженном давлении и хроматографируют, элюируя смесью гексан/эфир, получая 2-винилкарбонато-3-(9-триметилсилилнонил)-1,4-нафтохинон (79 мг). nD 1,5123. ЯМР спектр: 184,6, 178,0, 149,9, 139,9, 134,6, 134,3, 132,3, 130,9, 127,1, 126,8, 33,9, 30,6, 30,0, 29,7, 29,6, 29,6, 29,5, 28,8, 24,5, 24,2, 16,9, -1,3; 149,8, 142,8, 99,8 (-O-CO-O-CH=CH2). Пример 24 Получение 2-этоксиметокси-3-(9-триметилсилилнонил)-1,4-нафтохинона Формула I: m = 1; n = 0; R1 и R2 вместе и R7 и R8 вместе одновременно представляют собой =O; R3 =-O-CH2OCH2CH3; R4 = R5 = H; R6 = -(CH2)8Si(CH3)3. К раствору 2-гидрокси-3-(9-триметилсилилнонил)-1,4-нафтохинона, пример 12, (500 мг, 2,06 ммолей) в сухом дихлорметане (20 мл) при комнатной температуре и при перемешивании добавляют диизопропилэтиламин (1,33 г, 10,3 ммолей) и через 3 мин этоксиметилхлорид (831 мг, 10,3 ммолей) в дихлорметане (5 мл). Реакционную смесь перемешивают 1 час, разбавляют дихлорметаном (30 мл), промывают водой (2 х 20 мл), разбавленной соляной кислотой (20 мл), насыщенным раствором хлорида натрия (20 мл) и высушивают (MgSO4). Затем фильтруют, упаривают растворитель при пониженном давлении и хроматографируют, элюируя смесью гексан/эфир, и в результате получают 2-этоксиметокси-3-(9- триметилсилилнонил)-1,4-нафтохинон (567 мг). nD 1,5182. ЯМР спектр: 185,3, 181,6, 155,5, 137,1, 133,8, 133,2, 132,0, 131,4, 126,3, 126,2, 33,6, 30,1, 29,5, 29,4, 29,3, 28,9, 24,1, 23,9, 16,7, -1,6; 96,9, 65,8, 15,0 (O-CH2-O-CH2CH3). Пример 25 Получение 2-гидрокси-3-((1', 4', 4'-триметил-4-силациклогексил)-метил)- 1,4-нафтохинона (Формула I, как в примере 24, но R3 = ОН; R6 = -(CH5H8Si(CH3)3. К раствору 4,4-диметил-4-силациклогексанона (полученного способом, описанным в Sonderquist and Negron; J. Org. Chem.) (900 мг, 6,32 ммолей), этилцианоацетата (716 мг, 6,32 ммолей) и пиперидина (215 мг) в бензоле (30 мл) при комнатной температуре и при перемешивании добавляют уксусную кислоту (760 мг) и смесь кипятят с обратным холодильником в азеотропных условиях в течение 2,5 часов. Реакционную смесь охлаждают до комнатной температуры, разбавляют эфиром (30 мл) и промывают водой (2 х 25 мл), насыщенным раствором хлорида натрия (25 мл) и высушивают (MgSO4). Затем фильтруют, упаривают растворитель при пониженном давлении и хроматографируют, элюируя смесью гексан/эфир, и в результате получают бесцветную жидкость (0,52 г). Эту жидкость растворяют в эфире (5 мл) и при перемешивании добавляют по каплям к раствору метил магний бромида (30 мг, 1,8 ммолей) в эфире (20 мл) при 0oC в атмосфере азота. Смесь продолжают перемешивать еще 2 часа, затем добавляют эфир (25 мл), воду (10 мл) и подкисляют разбавленной соляной кислотой. Водный слой отделяют и дополнительно экстрагируют эфиром (2 х 25 мл), объединенные эфирные экстракты промывают водой (2 х 20 мл), насыщенным раствором хлорида натрия (20 мл) и высушивают (MgSO4). Затем фильтруют, упаривают растворитель при пониженном давлении и в результате получают бесцветное масло, которое обрабатывают гидроокисью калия (550 мг) в этиленгликоле и кипятят с обратным холодильником в течение 16 часов. Реакционную смесь охлаждают до комнатной температуры, разбавляют водой (40 мл) и промывают эфиром (2 х 25 мл). Водный слой подкисляют разбавленной соляной кислотой и экстрагируют этилацетатом (4 х 25 мл). Объединенные экстракты промывают водой (2 х 20 мл), насыщенным раствором хлорида натрия (20 мл) и высушивают (MgSO4). Затем фильтруют, упаривают растворитель при пониженном давлении и в результате получают почти бесцветную жидкость (300 мг). Из этой жидкости с помощью методов, описанных выше в примерах 1 и 2, получают 2-гидрокси-3-((1', 4',4'-триметил-4-силациклогексил) метил)-1,4-нафтохинон. Пример 26 Пестицидная активность Пестицидную активность против домашних мух, горчичных жуков (mustard beetles), клещей и белокрылки оценивают с помощью следующих методов. Муха домашняя (MD) (Musca domestica) Грудную клетку самок мух обрабатывают одним микролитром тестируемого соединения, растворенного в ацетоне. Для каждой дозы используют два повтора по 15 мух, и для каждого тестируемого соединения - по 6 доз. После обработки мух держат при температуре 20oC -положении группы R6 является атомом кремния. Соединение формулы V может затем взаимодействовать с подходящим основанием, например неорганическим основанием, таким как гидроксид натрия или калия, с образованием соответствующего соединения формулы I, в котором R3 представляет собой гидроксильную группу. Для получения других соединений формулы I могут использоваться комбинации способов получения производных, описанных выше. Соединения формул II и IV являются известными соединениями или могут быть приготовлены из известных соединений с помощью известных способов получения. Как упомянуто выше, было обнаружено, что соединения формулы I обладают пестицидной, например фунгицидной, и/или особенно инсектицидной, и/или акарицидной активностью. Соответственно, данное изобретение далее рассматривает пестицидные композиции, которые включают носитель и, в качестве активного ингредиента, соединение формулы I или его соль. Здесь также рассматривается способ приготовления таких композиций, который включает смешение и ассоциацию соединения формулы I, определенного выше, с как минимум одним носителем. Такие композиции могут содержать одно или смесь нескольких соединений настоящего изобретения. Различные изомеры или смеси изомеров могут иметь разные уровни или спектры активностей, и, следовательно, разные композиции могут включать индивидуальные изомеры или смеси изомеров. Композиции данного изобретения могут содержать от 0,001 до 95 вес.% активного ингредиента формулы I. Предпочтительно композиции данного изобретения в готовом для использования виде содержат от 0,001 до 25 вес.% активного ингредиента. Однако более высокие концентрации, а именно до 95 вес.%, могут иметь место в композициях, если активный ингредиент находится в твердом виде, как концентрат, который необходимо разводить перед использованием. Соединения настоящего изобретения можно смешивать с различными подходящими инертными носителями, такими как растворители, разбавители и/или поверхностно-активные вещества, с образованием в результате порошков, гранул, смачивающихся порошков, антикомариных спиралей, а также в виде других твердых форм или эмульсий, эмульгирующихся концентратов, спреев, аэрозолей и других жидких препаратов. Подходящие растворители и разбавители включают воду, алифатические и ароматические углеводороды, такие как ксилол или другие фракции нефти, и спирты, например этанол. Поверхностно-активные агенты могут быть анионного, катионного или неионного типа. Кроме того, могут быть включены антиоксиданты или другие стабилизаторы, а также отдушки и красители. Тип и пропорции этих инертных носителей такие, как обычно используют в пестицидных композициях. Кроме инертных носителей композиции данного изобретения могут также содержать один или несколько дополнительных активных ингредиентов. Эти дополнительные активные ингредиенты могут представлять собой соединения, отличные от соединений, рассматриваемых в данном изобретении, но обладающие пестицидной активностью и синергетическим эффектом с соединениями данного изобретения. Как указано выше, соединения формулы I могут использоваться для подавления распространения паразитов в домашнем хозяйстве, садоводстве, сельском хозяйстве, медицине и ветеринарии. Таким образом, в другом аспекте настоящее изобретение предлагает применение соединения формулы I или его соли, или композиции, которые определены выше, в качестве пестицида, например фунгицида, и/или особенно инсектицида, и/или акарицида. Настоящее изобретение представляет также метод борьбы с паразитами, такими как грибы, и/или особенно насекомыми, и/или акаридами в очаге поражения (локусе), который включает обработку очага соединением формулы I, или его солью, или композицией, включающей его, которые определены выше. Предпочтительно, очаг включает паразитов самих по себе, или окружающую среду, атакуемую, или атакованную паразитами. Более предпочтительно, очаг включает паразитов самих по себе, запасы продовольствия, растений или животных, атакуемых, или атакованных паразитами, семена таких растений, или среду, в которой такие растения растут или должны расти. Особенно хорошо соединения формулы I и их композиции, определенные выше, могут использоваться в домашнем хозяйстве для распыления в комнатах с помощью спрея с целью подавления распространения домашних мух или других насекомых, в садоводстве или сельском хозяйстве - для обработки запасов урожая, особенно зерновых, для орошения с помощью спрея растущего урожая, например хлопка или риса, с целью подавления заражения грибами, насекомыми или другими паразитами, и в области медицины или ветеринарии, например, для обработки рогатого скота с помощью спрея для профилактики или лечения инвазии насекомых или других паразитов. Настоящее изобретение далее будет описано с помощью иллюстрации последующими неограничивающими примерами. В этих примерах структуры соединений подтверждают путем определения сдвигов в спектре 13C ЯМР (в м.д.), перечисленных в следующем порядке: бициклическая система; CH2 (и =CH, в случае присутствия); Si(алкил)3; другие группы. Другие примеры, попадающие в сферу изобретения, станут ясными для специалистов в свете приведенного здесь. ПРИМЕРЫ Пример 1 Получение 2-бензоилокси-3-(2'-триметилсилилэтил)-1,4-нафтохинона (Формула I: m = 1; n = 0; R1 и R2 вместе и R7 и R8 вместе одновременно представляют собой =O; R3 = -O-CO-C6H5; R4 = R5 = H; R6 = -CH2Si(CH3)3) 2-бензоилокси-1,4-нафтохинон (1,39 г, 5 ммолей), триметилсилилпропионовую кислоту (1,09 г, 7,5 ммолей) и нитрат серебра (523 мг, 3 ммоля) суспендируют в 40 мл водного ацетонитрила (1:1) и затем нагревают до 65oC. Раствор персульфата аммония (1,71 г, 7,5 ммолей) в 20 мл воды медленно добавляют к полученной смеси по каплям в течение 30 мин. После этого реакционную смесь перемешивают еще час при установленной температуре и затем охлаждают, добавляют диэтиловый эфир и удаляют водную фазу. Органическую фазу промывают насыщенным раствором бикарбоната натрия, затем насыщенным раствором хлорида натрия и высушивают над безводным сульфатом магния. После упаривания под вакуумом неочищенный продукт подвергают хроматографии, используя в качестве элюента петролейный эфир/этилацетат, получают 2- бензоилокси-3-(2'-триметилсилилэтил)-1,4-нафтохинон (879 мг) и перекристаллизовывают его из метанола. Т. пл.: 92-95oC. ЯМР- спектр: 184,4, 178,2, 150,3, 142,6, 134,0, 133,8, 132,1, 130,9, 126,6, 126,6; 18,8, 16,2; -2,0; 163,8, 128,0, 128,7, 130,4, 134,2(PhCO). Пример 2 Получение 2-гидрокси-3-(2'-триметилсилилэтил)-1,4-нафтохинона (Формула I: m = 1; n = 0; R1 и R2 вместе и R7 и R8 вместе одновременно представляют собой =O; R3 = -ОН; R4 = R5 = H; R6 = -CH2Si(CH3)3) Раствор 2-бензоилокси-3-(2'-триметилсилилэтил)-1,4-нафтохинона (270 мг, 0,71 ммоля), полученного по приведенному в примере 1 методу, в тетрагидрофуране (10 мл) обрабатывают 2N раствором гидроксида натрия (0,73 мл, 1,42 ммоля) и смесь перемешивают в течение ночи при комнатной температуре. Затем реакционную смесь упаривают под вакуумом, остаток помещают в диэтиловый эфир и подкисляют до pH 2 с помощью 1N соляной кислоты. Органическую фазу промывают насыщенным раствором хлорида натрия, высушивают над безводным сульфатом магния и упаривают под вакуумом. Неочищенный продукт подвергают хроматографии, используя в качестве элюента петролейный эфир/этилацетат, получают 2-гидрокси-3-(2'-триметилсилилэтил)-1,4-нафтохинон (163 мг) и перекристаллизовывают его из гексана. Т. пл.: 98-100oC. ЯМР спектр: 184,6, 181,6, 152,2, 134,7, 132,9, 132,8, 129,4, 127,3, 126,6, 126,0; 17,6, 15,7; -1,9. Пример 3 Получение 2-гидрокси-3-(5'-триметилсилилпентил)-1,4-нафтохинона (Формула I: m = 1; n = 0; R1 и R2 вместе и R7 и R8 вместе одновременно представляют собой =O; R3 = -ОН; R4 = R5 = H; R6 = -(CH2)4Si(CH3)3) 2-Гидрокси-3-(6'-триметилсилилгексил)-1,4-нафтохинон (337 мг, 1,02 ммоля), приготовленный из 2-бензоилокси-1,4-нафтохинона и триметилсилилгептановой кислоты с помощью последовательно примененных способов примеров 1 и 2, растворяют в диоксане (2,5 мл) в атмосфере азота. Добавляют раствор карбоната натрия (120 мг) в воде (2,5 мл) и затем избыток 30% (вес./об.) перекисии водорода (200 мкл). Смесь нагревают при 70oC в течение 40 мин, пока реакционная смесь, имеющая изначально красный цвет, не обесцветится. Реакционную смесь охлаждают, добавляют 20% (вес./об.) раствор сульфата меди (100 мкл) и перемешивают до прекращения образования пузырьков. Затем добавляют 25% (вес. /об. ) раствора гидроксида натрия (2 мл) и 20% (вес./об.) раствор сульфата меди (5 мл), после чего реакционную смесь нагревают при 70oC в течение 30 мин. Смесь охлаждают и подкисляют до pH 2 с помощью 1N соляной кислоты. Продукт экстрагируют в этиловый эфир, затем экстракт промывают насыщенным раствором хлорида натрия, высушивают над безводным сульфатом магния и упаривают под вакуумом. Неочищенный продукт подвергают хроматографии, используя в качестве элюента 5% диэтиловый эфир/гексан, и получают 2-гидрокси-3-(5'-триметилсилилпентил)-1,4-нафтохинон (202 мг), который перекристаллизовывают из гексана. Т. пл. : 73-75oC. ЯМР спектр: 184,6, 181,4, 153,0, 134,8, 132,9, 132,7, 129,4, 126,7, 126,0, 124,8; 33,6, 27,9, 33,7, 23,2, 16,5; -1,7. Пример 4 Получение 2-этаноилокси-3-(2'-триметилсилилэтил)-1,4-нафтохинона (Формула I: m = 1; n = 0; R1 и R2 вместе и R7 и R9 вместе одновременно представляют собой =O; R3 = -O-CO-CH3; R4 = R5 = H; R6 = -CH2Si(CH3)3 2-Бензоилокси-3-(2'-триметилсилилэтил)-1,4-нафтохинон (346 мг, 0,92 ммоля), полученный по методу примера 1, гидролизуют по методу примера 2, гидролизат ацелируют путем добавления пиридина (6 мл) и уксусного ангидрида (3 мл). Реакционную смесь оставляют на ночь, затем упаривают под вакуумом. Неочищенный продукт подвергают хроматографии, используя в качестве элюента этилацетат/петролейный эфир и получают 2-этаноилокси-3-(2'-триметилсилилэтил)-1,4-нафтохинон (265 мг), который перекристаллизовывают из гексана. Т. пл. : 85-87oC. ЯМР спектр: 184,3, 178,2, 149,8, 142,2, 134,0, 133,7, 132,0, 130,8, 126,5, 126,4; 18,6, 16,1; -2,1; 167,9, 20,2 (COCH3). Пример 5 Получение 2-гидрокси-3-(2'-триметилсилилэтил)-1,4-нафтохинона, 1-диметил ацеталя (Формула I: m = 1; n = 0; R1 = R2 = -OCH3; R3 = -ОН; R4 = R5 = H; R6 = -CH2Si(CH3)3; R7 и R8 вместе представляют собой =O) 2-Этаноилокси-3-(2'-триметилсилилэтил)-1,4-нафтохинон (3 г), полученный по способу, описанному в примере 4, растворяют в метаноле (100 мл) и добавляют раствор карбоната калия (1,5 г) в воде (5 мл). Реакционную смесь перемешиваю при комнатной температуре 2 часа, затем разбавляют водой (около 400 мл) и экстрагируют диэтиловым эфиром. Экстракт высушивают над безводным сульфатом натрия и упаривают растворитель, получая 2-гидрокси-3- (2'-триметилсилилэтил)-1,4-нафтохинон, 1-диметил ацеталь в виде твердого вещества бледно-желтого цвета, т. пл.: 102-104oC. ЯМР спектр: 183,6, 158,4, 135,2, 133,4, 132,7, 130,0, 126,2, 125,6, 125,2, 97,3; 16,8, 16,3; -2,1; 51,9 (2 x OMe). Примеры 6-13 Другие соединения формулы I получают посредством способов, сходных с приведенными выше в примерах 1-5, по детальным описаниям, приведенным в табл. 1. Соединения из этой таблицы идентифицируют ссылкой на формулу I. (В следующих примерах m = 1; n = 0; R1 и R2 вместе и R7 и R8 вместе одновременно представляют собой =O; R4 = R5 = H) Ниже приведены пики ЯМР спектров: Пример 6: ЯМР спектр: 184,7, 180,8, 151,3, 134,4, 132,9, 132,9, 129,7, 126,7, 126,0 125,5; 15,0; -0,8. Пример 7: 184,7, 181,5, 154,0, 134,8, 132,9, 132,8, 129,5, 127,6, 126,0 125,6; 27,1, 22,9, 17,0; -1,7. Пример 8: 184,6, 181,4, 152,9, 134,7, 132,9, 132,8, 129,4, 126,7, 126,0, 124,8; 32,1, 24,2, 23,1, 16,4; -1,7. Пример 9: 184,6, 181,4, 153,0, 134,7, 132,8, 132,6, 129,4, 126,7, 126,0, 124,8; 33,4, 29,5, 28,2, 23,8, 23,3, 16,5; -1,7. Пример 10: 184,7, 181,5, 153,0, 134,8, 132,9, 132,8, 129,4, 126,8, 126,0, 124,9; 33,5, 29,7, 29,2, 28,3, 23,9, 23,4, 16,6; -1,6. Пример 11: 184,7, 181,5, 153,0, 134,8, 132,9, 132,8, 129,4, 126,7, 126,0, 124,9; 33,6, 29,8, 29,4, 29,3, 28,3, 23,9, 23,3, 16,6; -1,6. Пример 12: 184,7, 181,5, 153,0, 134,8, 132,9, 132,8, 129,5, 126,8, 126,0, 124,9; 33,6, 29,8, 29,5, 29,4, 29,3, 28,3, 23,9, 23,4, 16,7; -1,7. Пример 13: 184,6, 181,4, 153,0, 134,7, 132,9, 132,8, 129,4, 126,7, 126,0, 124,8; 33,6, 29,8, 29,6, 29,6, 29,4, 29,3, 28,3, 23,9, 23,3, 16,6; -1,7. Пример 14 Получение 2-гидрокси-3-(8-(диметилэтилсилил)октил)-1,4-нафтохинона Формула I: m= 1; n = 0; R1 и R2 вместе и R7 и R8 вместе одновременно представляют собой =O; R3 = -ОН; R4 = R5 = H; R6 = -(CH2)7)7Si(CH3)2CH2CH3. К магниевой стружке (1,98 г, 81,5 ммолей) при комнатной температуре добавляют по каплям раствор 1,8-дибромоктана (11,1 г, 40,8 ммолей) в сухом ТГФ (50 мл). После того как прекратится выделение газа, смесь в течение 2 часов кипятят с обратным холодильником для получения октил димагний дибромида. После охлаждения до комнатной температуры медленно добавляют раствор хлордиметилэтилсилана (5,00 г, 40,8 ммолей) в ТГФ (5 мл). Реакционную смесь кипятят с обратным холодильником еще 1 час. Затем через охлажденную реакционную смесь пропускают газообразную двуокись углерода в течение 30 мин, после чего добавляют эфир (50 мл) и подкисляют разбавленной соляной кислотой. Водный слой отделяют и дополнительно экстрагируют эфиром (3 х 25 мл). Объединенные эфирные слои промывают водой (2 х 25 мл), насыщенным раствором хлорида натрия (50 мл), высушивают (MgSO4) и фильтруют. Растворитель упаривают при пониженном давлении, получая белое воскообразное вещество, которое экстрагируют гексаном (3 х 50 мл). Объединенные гексановые экстракты упаривают при пониженном давлении и получают бесцветную жидкость (5,94 г). Эта жидкость взаимодействует с 2-бензоилокси-1,4-нафтохиноном по методу, описанному в примере 1, и затем с помощью метода, описанного в примере 2, получают 2-гидрокси-3-(8-(диметилэтилсилил)октил)-1,4-нафтохинон (753 мг), который перекристаллизовывают из гексана, т. пл. 39-41oC. ЯМР спектр: 184,7, 181,5, 152,9, 134,8, 132,9, 132,8, 129,4, 126,8, 126,0, 124,8; 33,7, 29,8, 29,4, 29,3, 28,3, 23,9, 23,4, 14,8; 7,4, 6,9, -3,9. Примеры 15-17 Другие соединения формулы I получают посредством способов, идентичных описанным выше в примере 13, детали приведены в табл. 2. Соединения из этой таблицы идентифицируют ссылкой на формулу I. Наблюдаемые пики ЯМР приведены ниже: Пример 15 ЯМР спектр: 184,7, 181,5, 153,0, 134,8, 132,9, 132,9, 129,4, 126,8, 126,1, 124,8; 33,9, 29,8, 29,4, 29,3, 28,3, 23,8, 23,4, 11,3; 7,5, 3,3. Пример 16 ЯМР спектр: 184,7, 181,5, 153,0, 134,8, 132,9, 132,8, 129,5, 126,8, 126,0, 124,9; 34,0, 29,9, 29,5, 29,3, 28,3, 23,9, 23,4, 12,6; 18,7, 17,5, 15,6. Пример 17 ЯМР спектр: 184,7, 181,5, 153,1, 134,8, 133,0, 132,8, 129,5, 126,8, 126,0, 124,9; 33,7, 29,9, 29,4, 29,3, 28,3, 23,9, 23,4, 18,0; 18,4, 17,4, 15,3, -3,3. Пример 18 Получение 2-гидрокси-3-(8-(1-метил-(тетраметиленсилил)октил)-1,4- нафтохинона Формула I: m = 1; n = 0; R1 и R2 вместе и R7 и R8 вместе одновременно представляют собой =O; R3 = -ОН; R4 = R5 = H и R6 = -(CH2)7SiCH3(CH2)4. К магниевой стружке (4,5 г, 185 ммолей) медленно добавляют раствор дибромбутана (20,0 г, 92,6 ммолей) в сухом ТГФ (100 мл). После окончания добавления смесь в течение 1 часа кипятят с обратным холодильником (refluxed) и затем охлаждают до комнатной температуры. Добавляют по каплям раствор триметилсилилхлорида (13,8 г, 92,6 ммолей) в ТГФ (10 мл) и продолжают кипячение с обратным холодильником еще 30 мин. Охлажденный раствор добавляют по каплям к приготовленному заранее раствору октил димагний дибромида, как описано в примере 14. Реакционную смесь кипятят с обратным холодильником в течение 1 часа, охлаждают до комнатной температуры и барботирутот газообразную двуокись углерода через раствор в течение 30 мин. Затем подкисляют разбавленной соляной кислотой и экстрагируют эфиром (4 х 50 мл). Объединенные эфирные слои промывают водой (2 х 50 мл), насыщенным раствором хлорида натрия (50 мл) и высушивают (MgSO4). Фильтрация и упаривание растворителя при пониженном давлении приводят к получению не совсем белого воскообразного вещества, которое экстрагируют гексаном (3 х 50 мл). Объединенные гексановые экстракты упаривают при пониженном давлении и получают бледно-желтое масло. Эта жидкость взаимодействует с 2-бензоилокси-1,4-нафтохиноном по методу, описанному в примере 1, и затем с помощью метода, описанного в примере 2, получают 2-гидрокси-3-(8-(1-метил-(тетраметиленсилил)октил)- 1,4-нафтохинон (161 мг), т. пл. 42-44oC. ЯМР спектр: 184,7, 181,5, 153,0, 134,8, 132,9, 132,8, 129,4, 126,8, 126,1, 124,8; 33,5, 29,8, 29,4, 29,3, 28,3, 24,3, 23,4; 27,4, 15,1, 11,8, -3,2. Пример 19 Получение 2-гидрокси-3-(8-(1-метил-(пентаметиленсилил)октил)-1,4- нафтохинона Формула I: m = 1; n = 0; R1 и R2 вместе и R7 и R9 вместе одновременно представляют собой = O; R3 = -ОН; R4 = R5 = H и R6 = -(CH2)7SiCH3(CH2)5. С помощью метода, идентичного описанному в примере 17, используя вместо дибромбутана дибромпентан, получают 2-гидрокси-3- (8-(1-метил-(пентаметиленсилил)октил)-1,4-нафтохинон (10 мг), т. пл. 38-40oC. ЯМР спектр: 184,7, 181,5, 153,0, 134,8, 133,0, 132,9, 129,5, 126,8, 126,1, 124,9; 33,6, 29,8, 29,4, 29,3, 28,3, 23,7, 23,4, 24,3, 14,1; 30,2, 24,5, 12,9, -4,8. Пример 20 Получение 2-гидрокси-3-(3-триметилсилил-1-пропенил)-1,4-нафтохинона Формула I: m = 0; n = 0; R1 и R2 вместе и R7 и R8 вместе одновременно представляют собой =O; R3 = -ОН; R4 = R5 = H и R5 = -CH=CH-CH2Si(CH3)3. К раствору 3-триметилсилилпропанола (5,00 г, 37,8 ммолей) в дихлорметане (120 мл) при комнатной температуре, при перемешивании добавляют хлорхромат пиридиния (16,3 г, 75,6 ммолей). Смесь перемешивают в течение 2 часов, фильтруют через силикагель, элюируют эфиром. Фильтрат упаривают при пониженном давлении и получают бесцветную жидкость (3,96 г). К раствору этой жидкости (1,00 г) в дихлорметане (30 мл) при комнатной температуре при перемешивании добавляют 2-гидрокси-1,4-нафтохинон (1,11 г, 6,40 ммолей) и пирролидин (569 мг, 8,00 ммолей). Смесь перемешивают в течение 15 часов, затем добавляют п-толуол сульфоновую кислоту (3,04 г, 16,0 ммолей), и продолжают перемешивание при комнатной температуре еще 24 часа, и 3 часа кипятят с обратным холодильником. Смесь охлаждают и растворитель упаривают при пониженном давлении. Остаток растворяют в эфире (50 мл) и промывают водой (2 х 25 мл), разбавленной соляной кислотой (25 мл), водой (25 мл), насыщенным раствором хлорида натрия (25 мл) и высушивают (MgSO4). Затем фильтруют, упаривают растворитель при пониженном давлении и хроматографируют, элюируя смесью гексан/эфир, получая 2-гидрокси-3-(3-триметилсилил-1-пропенил)-1,4-нафтохинон (123 мг). Т. пл. 72-74oC. ЯМР спектр: 184,7, са 182, 150,5, 134,7, 133,0, 132,8, са 129, 126,9, 125,8, са 120; 142,5, 117,0, 27,4; -1,8. Пример 21 Получение 2-этаноилокси-3-(9-триметилсилилнонил)-1,4-нафтохинона Формула I: m = 1; n = 0; R1 и R2 вместе и R7 и R8 вместе одновременно представляют собой =O; R3 = -O-CO-CH3; R4 = R5 = H; R6 = -(CH2)8Si(CH3)3. С помощью метода, идентичного описанному в примере 4, из 2- гидрокси-3-(9-триметилсилилнонил)-1,4-нафтохинона, пример 12, получают 2-этаноилокси-3-(9-триметилсилилнонил)-1,4-нафтохинон, т. пл. 45-47oC. ЯМР спектр: 184,5, 178,1, 151,1, 139,9, 134,0, 133,8, 132,1, 130,9, 126,7, 126,6; 33,6, 29,7, 29,4, 29,4, 29,3, 28,5, 24,3, 24,0, 16,7; -1,6; 168,0, 20,4 (COCH3). Пример 22 Получение 2-пропаноилокси-3-(9-триметилсилилнонил)-1,4-нафтохинона Формула I: m = 1; n = 0; R1 и R2 вместе и R7 и R8 вместе одновременно представляют собой =O; R3 = -O-CO-CH2CH2CH3; R4 = R5 = H; R6 = -(CH2)8Si(CH3)3. К раствору 2-гидрокси-3-(9-триметилсилилнонил)-1,4-нафтохинона, пример 12, (100 мг, 0,27 ммолей) в сухом дихлорметане (10 мл) при комнатной температуре и при перемешивании добавляют пиридин (0,5 мл) и через 3 мин пропаноил хлорид (62 мг, 0,67 ммолей). Реакционную смесь перемешивают в течение 2 часов, разбавляют дихлорметаном (50 мл), промывают водой (2 х 30 мл), разбавленной соляной кислотой (30 мл), насыщенным раствором хлорида натрия (30 мл) и высушивают (MgSO4). Затем фильтруют, упаривают растворитель при пониженном давлении и хроматографируют, элюируя смесью гексан/эфир, получая 2-пропаноилокси-3-(9-триметилсилилнонил)-1,4-нафтохинон (112 мг). Т. пл. 41-43oC. ЯМР спектр: 184,6, 178,2, 151,2, 139,8, 134,0, 133,7, 132,1, 130,9, 126,7, 126,5, 33,6, 29,7, 29,4, 29,4, 29,3, 28,5, 24,3, 23,9, 16,7; -1,6; 171,6, 27,3, 9,1 (COCH2CH3). Пример 23 Получение 2-винилкарбонато-3-(9-триметилсилилнонил)-1,4-нафтохинона Формула I: m = 1; n=0; R1 и R2 вместе и R7 и R8 вместе одновременно представляют собой =O; R3 = -O-CO-O-CH=CH2; R4 = R5 = H; R6 = -(CH2)8Si(CH3)3. К раствору 2-гидрокси-3-(9-триметилсилилнонил)-1,4-нафтохинона, пример 12, (100 мг, 0,27 ммолей) в сухом дихлорметане (10 мл) при комнатной температуре и при перемешивании добавляют пиридин (0,5 мл) и через 3 мин винилхлорформиат (43 мг, 0,40 ммолей). Реакционную смесь перемешивают в течение 2 часов, разбавляют дихлорметаном (50 мл), промывают водой (2 х 30 мл), разбавленной соляной кислотой (30 мл), насыщенным раствором хлорида натрия (30 мл) и высушивают (MgSO4). Затем фильтруют, упаривают растворитель при пониженном давлении и хроматографируют, элюируя смесью гексан/эфир, получая 2-винилкарбонато-3-(9-триметилсилилнонил)-1,4-нафтохинон (79 мг). nD 1,5123. ЯМР спектр: 184,6, 178,0, 149,9, 139,9, 134,6, 134,3, 132,3, 130,9, 127,1, 126,8, 33,9, 30,6, 30,0, 29,7, 29,6, 29,6, 29,5, 28,8, 24,5, 24,2, 16,9, -1,3; 149,8, 142,8, 99,8 (-O-CO-O-CH=CH2). Пример 24 Получение 2-этоксиметокси-3-(9-триметилсилилнонил)-1,4-нафтохинона Формула I: m = 1; n = 0; R1 и R2 вместе и R7 и R8 вместе одновременно представляют собой =O; R3 =-O-CH2OCH2CH3; R4 = R5 = H; R6 = -(CH2)8Si(CH3)3. К раствору 2-гидрокси-3-(9-триметилсилилнонил)-1,4-нафтохинона, пример 12, (500 мг, 2,06 ммолей) в сухом дихлорметане (20 мл) при комнатной температуре и при перемешивании добавляют диизопропилэтиламин (1,33 г, 10,3 ммолей) и через 3 мин этоксиметилхлорид (831 мг, 10,3 ммолей) в дихлорметане (5 мл). Реакционную смесь перемешивают 1 час, разбавляют дихлорметаном (30 мл), промывают водой (2 х 20 мл), разбавленной соляной кислотой (20 мл), насыщенным раствором хлорида натрия (20 мл) и высушивают (MgSO4). Затем фильтруют, упаривают растворитель при пониженном давлении и хроматографируют, элюируя смесью гексан/эфир, и в результате получают 2-этоксиметокси-3-(9- триметилсилилнонил)-1,4-нафтохинон (567 мг). nD 1,5182. ЯМР спектр: 185,3, 181,6, 155,5, 137,1, 133,8, 133,2, 132,0, 131,4, 126,3, 126,2, 33,6, 30,1, 29,5, 29,4, 29,3, 28,9, 24,1, 23,9, 16,7, -1,6; 96,9, 65,8, 15,0 (O-CH2-O-CH2CH3). Пример 25 Получение 2-гидрокси-3-((1', 4', 4'-триметил-4-силациклогексил)-метил)- 1,4-нафтохинона (Формула I, как в примере 24, но R3 = ОН; R6 = -(CH5H8Si(CH3)3. К раствору 4,4-диметил-4-силациклогексанона (полученного способом, описанным в Sonderquist and Negron; J. Org. Chem.) (900 мг, 6,32 ммолей), этилцианоацетата (716 мг, 6,32 ммолей) и пиперидина (215 мг) в бензоле (30 мл) при комнатной температуре и при перемешивании добавляют уксусную кислоту (760 мг) и смесь кипятят с обратным холодильником в азеотропных условиях в течение 2,5 часов. Реакционную смесь охлаждают до комнатной температуры, разбавляют эфиром (30 мл) и промывают водой (2 х 25 мл), насыщенным раствором хлорида натрия (25 мл) и высушивают (MgSO4). Затем фильтруют, упаривают растворитель при пониженном давлении и хроматографируют, элюируя смесью гексан/эфир, и в результате получают бесцветную жидкость (0,52 г). Эту жидкость растворяют в эфире (5 мл) и при перемешивании добавляют по каплям к раствору метил магний бромида (30 мг, 1,8 ммолей) в эфире (20 мл) при 0oC в атмосфере азота. Смесь продолжают перемешивать еще 2 часа, затем добавляют эфир (25 мл), воду (10 мл) и подкисляют разбавленной соляной кислотой. Водный слой отделяют и дополнительно экстрагируют эфиром (2 х 25 мл), объединенные эфирные экстракты промывают водой (2 х 20 мл), насыщенным раствором хлорида натрия (20 мл) и высушивают (MgSO4). Затем фильтруют, упаривают растворитель при пониженном давлении и в результате получают бесцветное масло, которое обрабатывают гидроокисью калия (550 мг) в этиленгликоле и кипятят с обратным холодильником в течение 16 часов. Реакционную смесь охлаждают до комнатной температуры, разбавляют водой (40 мл) и промывают эфиром (2 х 25 мл). Водный слой подкисляют разбавленной соляной кислотой и экстрагируют этилацетатом (4 х 25 мл). Объединенные экстракты промывают водой (2 х 20 мл), насыщенным раствором хлорида натрия (20 мл) и высушивают (MgSO4). Затем фильтруют, упаривают растворитель при пониженном давлении и в результате получают почти бесцветную жидкость (300 мг). Из этой жидкости с помощью методов, описанных выше в примерах 1 и 2, получают 2-гидрокси-3-((1', 4',4'-триметил-4-силациклогексил) метил)-1,4-нафтохинон. Пример 26 Пестицидная активность Пестицидную активность против домашних мух, горчичных жуков (mustard beetles), клещей и белокрылки оценивают с помощью следующих методов. Муха домашняя (MD) (Musca domestica) Грудную клетку самок мух обрабатывают одним микролитром тестируемого соединения, растворенного в ацетоне. Для каждой дозы используют два повтора по 15 мух, и для каждого тестируемого соединения - по 6 доз. После обработки мух держат при температуре 20oC 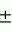 1oC и гибель оценивают через 24 и 48 часов после обработки. LD50 рассчитывают в микрограммах тестируемого соединения на муху (см. Sawicki et al. Bulletin of the World Health Organisation, 35, 893 (1966) и Sawicki et al., Entomologia and Exp. Appli 10, 253, (1967)). Горчичные жучки (PC) (Phaedon cochleariae Fab) Один микролитр раствора тестируемого соединения в ацетоне наносят на брюшко взрослым жукам, используя микрокапельный аппликатор. Обработанных жуков выдерживают в течение 48 часов, после чего оценивают их гибель. Используя 5 доз для сравнения; для каждой дозы по два повтора из 20-25 жуков. Значения LD50 рассчитывают так же, как для домашних мух. Клещи (TU) (Tetranychus urticae) 25 взрослых самок клещей погружают в 35 мкл раствора тестируемого соединения в смеси 1: 4 ацетон-вода на 30 секунд. Обработанных насекомых выдерживают при 21oC 1oC и гибель оценивают через 24 и 48 часов после обработки. LD50 рассчитывают в микрограммах тестируемого соединения на муху (см. Sawicki et al. Bulletin of the World Health Organisation, 35, 893 (1966) и Sawicki et al., Entomologia and Exp. Appli 10, 253, (1967)). Горчичные жучки (PC) (Phaedon cochleariae Fab) Один микролитр раствора тестируемого соединения в ацетоне наносят на брюшко взрослым жукам, используя микрокапельный аппликатор. Обработанных жуков выдерживают в течение 48 часов, после чего оценивают их гибель. Используя 5 доз для сравнения; для каждой дозы по два повтора из 20-25 жуков. Значения LD50 рассчитывают так же, как для домашних мух. Клещи (TU) (Tetranychus urticae) 25 взрослых самок клещей погружают в 35 мкл раствора тестируемого соединения в смеси 1: 4 ацетон-вода на 30 секунд. Обработанных насекомых выдерживают при 21oC 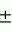 2oC и фиксируют гибель через 72 часа после обработки. Клещей, показывающих после этого периода повторяющиеся движения более чем одной двигательной конечности, считают живыми. Три повтора по 25 клещей каждый используют для каждой дозы, и 5 или 6 доз - для каждого тестируемого соединения. Значения LD50 рассчитывают в частях/млн раствора тестируемого соединения на насекомого. Тестирование проводили с использованием чувствительной породы клещей (GSS), полученных от Schering, AG, Berlin. Белокрылка (ВТ) (Bemisia Tabaci) Раствор тестируемого соединения в ацетоне (0,100 мл) помещают в стеклянный 10 мл сосуд и упаривают при вращении для получения пленки соединения. Тридцать взрослых белокрылок помещают внутрь сосуда, затем через 60 мин обработанных насекомых переносят на необработанные листовые диски хлопка, которые выдерживают во влажном виде на подложке из агарового геля. Температуру поддерживают равной 25oC и смертность оценивают после 48 часов. Выполняют по три повтора для каждого из 5-7 уровней доз каждого соединения. Значения LD50 рассчитывают, используя компьютерную программу Polo-PC, выпускаемую LeOra Software, Berkeley, California (см. M.R. Cahill and B. Hackett in Proceedings Brighton Crop Protection Conference, 1992). При проведении теста использовали чувствительную породу белокрылки (SUD-S) <, собранную в Судане в 1978 г. с хлопка. Результаты этих тестов приведены в табл. 3. Приведены значения для LD50 мкг/насекомое или для LD50 в частях/млн раствора тестируемого соединения, если не оговорено иначе. Пример 27 Афицидная активность Активность против устойчивых и чувствительных видов тли (Myzus Persicae (МР) и Aphis Gossypiae (AG) оценивали с помощью двух следующих методов. Поверхностное нанесение: Группы из 10-15 бескрылых взрослых особей брали из базовых культур (stock cultures) и помещали на диски из листьев (35 мм в диаметре), вырезанных из китайской капусты, и держали на агаровой подложке (25 мм глубиной) в одноразовых чашках (высотой 30 мм). Используя микроаппликатор Бекхарда (Burckhard microapplicator), тлей индивидуально обрабатывали 0,25 мкм капелькой раствора химиката нужной концентрации в ацетоне, контрольных тлей обрабатывали одним ацетоном. Смертность и другие показатели определяли через каждые 24 часа, включая в качестве конечной точки 72 часа после обработки. Метод погружения: Обхватывающее кольцо из флюона (fluon) наносят посередине внутренней стороны стеклянной трубки длиной 4 см и диаметром 1,5 см. К одному концу каждой трубки эластичными лентами присоединяют не проницаемую для насекомых сетку. Пятнадцать бескрылых взрослых особей осторожно переносят в трубки с помощью кисточки из меха соболя, после чего трубки закрывают сеткой с другой стороны. Трубки, содержащие тлей, погружают в раствор инсектицида на 10 секунд, высушивают на фильтровальной бумаге, переворачивают и открывают, чтобы высыпать тлей из конца трубки, который не погружали в раствор инсектицида. Через один час, когда тлей переносят на диски из листьев китайской капусты (35 мм диаметром), расположенные на агаровой подложке в одноразовых пластиковых чашках (высотой 30 мм), и ограничивают наложением конца флюона на открытый край чашки, определяют смертность (обычно нулевую или очень низкую). Чашки оставляют открытыми при постоянно поддерживаемых условиях: 25oC и непрерывном комнатном освещении. Смертность оценивают через 24, 48 и 72 часа. Для каждого соединения тестируют 5 или 6 дозовых уровней и для каждого уровня делают два повтора по 15 тлей. При проведении теста использовали чувствительные виды тлей (USIL), собранные в полях Восточной Англии, Великобритании, и полностью устойчивые виды (794Jz) (R3 эстераза чувствительная AChE), собранные в теплицах Великобритании. Результаты этого теста приведены в табл. 5. Значения даны в процентах смертности, скорректированных относительно контрольных данных, полученных для тестируемого раствора без активного ингредиента. Пример 28 Фунгицидная активность Тестирование антигрибковой активности заявленных соединений по отношению к выделенным культурам Aspergillus niger, Pyricularia oryzae (= Magnaporthe grisea) и Rhizoctonia solani проводили in vitro. Каждое соединение вводили в картофельный декстрозный агар в растворителе (50/50 этанол/ацетон) при дозировке 0,5 мл растворителя на 250 мл агара при условии, что автоклавированный агар предварительно плавили и охлаждали до 50oC. Каждое соединение тестировали при одной концентрации (100 мг/л). Каждое тестирование проводили обычно с двумя соединениями, включая три контроля: стандартный фунгицид (карбендазим при концентрации 1 или 5 мг/л или прохлораз при концентрации 1 мг/л); только в смеси этанол/ацетон; без добавок. Фунгициды, использованные как стандарты, могут рассматриваться как представители активных коммерчески доступных соединений. Тестирование каждого грибка проводили на агаре в четырех чашках Петри на одну обработку с тремя репликатными грибковыми колониями на плашку (одна колония от R. solani). A. niger и R. solani инкубировали 4 дня при 20-25oC, a P. oryzae - 7 дней. Затем увеличение диаметра колонии замеряли и использовали для определения активности. Результаты этих тестирований приведены в табл. 6. Значения даны в % ингибирования роста диаметра колонии на агаре. Дополнительно тестирования показали, что соединения формулы I проявляют высокую фунгицидную активность против широкого спектра грибков, вызывающих заболевания как у зерновых, так и у широколистных культур. Особенно высокую активность наблюдали против грибков, принадлежащих к родам Erysiphe, особенно Erysiphe graminis, Botrytis, особенно Botrytis fabae и Botrytis cinerea, а также Rhizoctonia, Pyricularia и Aspergillus, как иллюстрировано выше. В табл. 7 приведены значения пестицидной активности нафтохиноновых соединений по сравнению с известными ранее для того, чтобы лучше иллюстрировать относительную эффективность соединений настоящего изобретения. Приведенные величины активностей получены с помощью методов, описанных выше в примерах 27 и 28. Что касается известного нафтохинона из DE 3801743; EP 0300218 A1, значения его активности против Tetranychus меньше, чем для соответствующего трет-бутильного соединения (см. табл. A из EP 0300218 A1). Авторы настоящего изобретения тестировали это трет- бутильное соединение и в тестах, приведенных выше, определил, что его значения LC50 составляют 44 части/млн/насекомое против Tetranychus и 18 части/млн против Bemisia; значения LD50 составляют 16 мкг/насекомое против Musca и 0,53 мкг/насекомое против Phaedon; против Myzus смертность составляла 19%. Нижеприведенные примеры 29-31, выходящие за пределы настоящего изобретения, даются для демонстрации получения нафтохиноновых циклов с заместителями в 5, 6, 7 и/или 8 положениях. Пример 29 Получение 2-(трет-бутил) -3-гидрокси-6-метил-нафталин-1,4-диона и 2-(трет-бутил)-3-гидрокси-7-метил-нафталин-1,4 диона (а) Получение 6-метил-нафталин-1,4-диона Раствор 1,4-бензохинона (13,9 г, 128 ммоль) и изопрена (13,1 мл, 131 ммоль) перемешивают в ледяной уксусной кислоте (44 мл) в течение 68 часов при комнатной температуре. Смесь разводят водой (44 мл) и кипятят с обратным холодильником в течение 1,5 часа. Смесь охлаждают до комнатной температуры и последовательно к ней добавляют уксусную кислоту (84 мл) и хромовую кислоту [трихлорид хрома (29,4 г) в воде (30 мл)], а затем кипятят с обратным холодильником в течение 1,5 часа. После охлаждения смесь разводят водой (200 мл) и экстрагируют эфиром (3 х 50 мл). Объединенные эфирные фракции промывают разбавленным раствором гидроксида натрия (2М; 2 х 50 мл), водой (2 х 50 мл), насыщенным раствором хлорида натрия (50 мл) и сушат над сульфатом магния. После фильтрации и упаривания растворителя при пониженном давлении, а также повторной рекристаллизации из петролейного эфира было получено указанное в заголовке соединение (7 г). (b) 2-амино-6 и 7-метил-1,4-нафталин-1,4-диона К перемешиваемому раствору 6-метил нафталин-1,4-диона (2,1 г, 12 ммоль) в ледяной уксусной кислоте (60 мл) при комнатной температуре добавляют раствор азида натрия (1,58 г) в воде (5 мл). Смесь перемешивают в течение 2 дней, разбавляют водой (200 мл), перемешивают еще 15 мин и фильтруют. Фильтрат нейтрализуют бикарбонатом натрия и экстрагируют хлороформом (3 х 25 мл). Объединенные хлороформные экстракты промывают насыщенным раствором бикарбоната натрия, насыщенным раствором хлорида натрия и высушивают (CaSO4). После фильтрации, упаривания растворителя при пониженном давлении и хроматографии на силикагеле получают указанное в заголовке соединение (100 мг) в виде смеси изомеров в соотношении 3:2. (с) 2-гидроки-6- и -7-метил-1,4-нафталин-1,4-диона Смесь, содержащую аминометил нафталин-1,4-дион, приготовленную по методике (b) (200 мг), кипятят с обратным холодильником в воде (20 мл) и концентрированной серной кислоте (10 мл) в течение 20 мин. Охлажденную смесь переносят в лед с водой 50 г и экстрагируют эфиром (3 х 25 мл). Объединенные эфирные экстракты промывают водой, насыщенным раствором бикарбоната натрия, водой, насыщенным раствором хлорида натрия и сушат (MgSO4). После фильтрации, упаривания растворителя и очистки методом колоночной хроматографии на силикагеле получают указанное в заголовке соединение (68 мг). (d) Получение 2-(т-бутил)-3-гидрокси-6 и 7-метил-3-гидрокси- нафталин-1,4-дионов В результате стандартной процедуры радикального присоединения пероксисульфат/нитрата серебра к аминометильному соединению (64 мг, 0,34 ммоля) и триметилуксусной кислоты (52 мг, 0,51 ммоль) получают указанное в заголовке соединение в виде смеси изомеров в соотношении 3:2 (12 мг). Пример 30 Получение 2-(т-бутил)-6 и 7-диметил-3-гидрокси-нафталин-1,4-дионов Повторяют вышеописанные стадии от (а) до (d), заменяя изопрен на 2,3-диметил-1,3-бутадиен. Пример 31 Получение 2-(т-бутил)-3-гидрокси-5 и 8-метил-1,4-нафталин-1,4-дионов Повторяют вышеописанные стадии от (а) до (d), заменяя изопрен на пиперилен. (а) Получение 6-метил-1,4-нафталин-1,4-диона Раствор 1,4-бензохинона (13,9 г, 128 ммоль) и изопрена (13,1 мл, 131 ммоль) перемешивают в ледяной уксусной кислоте (44 мл) в течение 68 часов при комнатной температуре. Смесь разводят водой (44 мл) и кипятят с обратным холодильником в течение 1,5 часа. Смесь охлаждают до комнатной температуры и последовательно к ней добавляют уксусную кислоту (84 мл) и хромовую кислоту [триоксид хрома (29,4 г) в воде (30 мл)], а затем кипятят с обратным холодильником в течение 1,5 часа. После охлаждения смесь разводят водой (200 мл) и экстрагируют эфиром (3х50 мл). Объединенные эфирные фракции промывают разбавленным раствором гидроксида натрия (2М; 2х50 мл), водой (2х50 мл), насыщенным раствором натрия (50 мл) и сушат над сульфатом магния. После фильтрации и упаривания растворителя при пониженном давлении, а также повторной рекристаллизации из петролейного эфира получают указанные в заголовке соединения (7 г). 2oC и фиксируют гибель через 72 часа после обработки. Клещей, показывающих после этого периода повторяющиеся движения более чем одной двигательной конечности, считают живыми. Три повтора по 25 клещей каждый используют для каждой дозы, и 5 или 6 доз - для каждого тестируемого соединения. Значения LD50 рассчитывают в частях/млн раствора тестируемого соединения на насекомого. Тестирование проводили с использованием чувствительной породы клещей (GSS), полученных от Schering, AG, Berlin. Белокрылка (ВТ) (Bemisia Tabaci) Раствор тестируемого соединения в ацетоне (0,100 мл) помещают в стеклянный 10 мл сосуд и упаривают при вращении для получения пленки соединения. Тридцать взрослых белокрылок помещают внутрь сосуда, затем через 60 мин обработанных насекомых переносят на необработанные листовые диски хлопка, которые выдерживают во влажном виде на подложке из агарового геля. Температуру поддерживают равной 25oC и смертность оценивают после 48 часов. Выполняют по три повтора для каждого из 5-7 уровней доз каждого соединения. Значения LD50 рассчитывают, используя компьютерную программу Polo-PC, выпускаемую LeOra Software, Berkeley, California (см. M.R. Cahill and B. Hackett in Proceedings Brighton Crop Protection Conference, 1992). При проведении теста использовали чувствительную породу белокрылки (SUD-S) <, собранную в Судане в 1978 г. с хлопка. Результаты этих тестов приведены в табл. 3. Приведены значения для LD50 мкг/насекомое или для LD50 в частях/млн раствора тестируемого соединения, если не оговорено иначе. Пример 27 Афицидная активность Активность против устойчивых и чувствительных видов тли (Myzus Persicae (МР) и Aphis Gossypiae (AG) оценивали с помощью двух следующих методов. Поверхностное нанесение: Группы из 10-15 бескрылых взрослых особей брали из базовых культур (stock cultures) и помещали на диски из листьев (35 мм в диаметре), вырезанных из китайской капусты, и держали на агаровой подложке (25 мм глубиной) в одноразовых чашках (высотой 30 мм). Используя микроаппликатор Бекхарда (Burckhard microapplicator), тлей индивидуально обрабатывали 0,25 мкм капелькой раствора химиката нужной концентрации в ацетоне, контрольных тлей обрабатывали одним ацетоном. Смертность и другие показатели определяли через каждые 24 часа, включая в качестве конечной точки 72 часа после обработки. Метод погружения: Обхватывающее кольцо из флюона (fluon) наносят посередине внутренней стороны стеклянной трубки длиной 4 см и диаметром 1,5 см. К одному концу каждой трубки эластичными лентами присоединяют не проницаемую для насекомых сетку. Пятнадцать бескрылых взрослых особей осторожно переносят в трубки с помощью кисточки из меха соболя, после чего трубки закрывают сеткой с другой стороны. Трубки, содержащие тлей, погружают в раствор инсектицида на 10 секунд, высушивают на фильтровальной бумаге, переворачивают и открывают, чтобы высыпать тлей из конца трубки, который не погружали в раствор инсектицида. Через один час, когда тлей переносят на диски из листьев китайской капусты (35 мм диаметром), расположенные на агаровой подложке в одноразовых пластиковых чашках (высотой 30 мм), и ограничивают наложением конца флюона на открытый край чашки, определяют смертность (обычно нулевую или очень низкую). Чашки оставляют открытыми при постоянно поддерживаемых условиях: 25oC и непрерывном комнатном освещении. Смертность оценивают через 24, 48 и 72 часа. Для каждого соединения тестируют 5 или 6 дозовых уровней и для каждого уровня делают два повтора по 15 тлей. При проведении теста использовали чувствительные виды тлей (USIL), собранные в полях Восточной Англии, Великобритании, и полностью устойчивые виды (794Jz) (R3 эстераза чувствительная AChE), собранные в теплицах Великобритании. Результаты этого теста приведены в табл. 5. Значения даны в процентах смертности, скорректированных относительно контрольных данных, полученных для тестируемого раствора без активного ингредиента. Пример 28 Фунгицидная активность Тестирование антигрибковой активности заявленных соединений по отношению к выделенным культурам Aspergillus niger, Pyricularia oryzae (= Magnaporthe grisea) и Rhizoctonia solani проводили in vitro. Каждое соединение вводили в картофельный декстрозный агар в растворителе (50/50 этанол/ацетон) при дозировке 0,5 мл растворителя на 250 мл агара при условии, что автоклавированный агар предварительно плавили и охлаждали до 50oC. Каждое соединение тестировали при одной концентрации (100 мг/л). Каждое тестирование проводили обычно с двумя соединениями, включая три контроля: стандартный фунгицид (карбендазим при концентрации 1 или 5 мг/л или прохлораз при концентрации 1 мг/л); только в смеси этанол/ацетон; без добавок. Фунгициды, использованные как стандарты, могут рассматриваться как представители активных коммерчески доступных соединений. Тестирование каждого грибка проводили на агаре в четырех чашках Петри на одну обработку с тремя репликатными грибковыми колониями на плашку (одна колония от R. solani). A. niger и R. solani инкубировали 4 дня при 20-25oC, a P. oryzae - 7 дней. Затем увеличение диаметра колонии замеряли и использовали для определения активности. Результаты этих тестирований приведены в табл. 6. Значения даны в % ингибирования роста диаметра колонии на агаре. Дополнительно тестирования показали, что соединения формулы I проявляют высокую фунгицидную активность против широкого спектра грибков, вызывающих заболевания как у зерновых, так и у широколистных культур. Особенно высокую активность наблюдали против грибков, принадлежащих к родам Erysiphe, особенно Erysiphe graminis, Botrytis, особенно Botrytis fabae и Botrytis cinerea, а также Rhizoctonia, Pyricularia и Aspergillus, как иллюстрировано выше. В табл. 7 приведены значения пестицидной активности нафтохиноновых соединений по сравнению с известными ранее для того, чтобы лучше иллюстрировать относительную эффективность соединений настоящего изобретения. Приведенные величины активностей получены с помощью методов, описанных выше в примерах 27 и 28. Что касается известного нафтохинона из DE 3801743; EP 0300218 A1, значения его активности против Tetranychus меньше, чем для соответствующего трет-бутильного соединения (см. табл. A из EP 0300218 A1). Авторы настоящего изобретения тестировали это трет- бутильное соединение и в тестах, приведенных выше, определил, что его значения LC50 составляют 44 части/млн/насекомое против Tetranychus и 18 части/млн против Bemisia; значения LD50 составляют 16 мкг/насекомое против Musca и 0,53 мкг/насекомое против Phaedon; против Myzus смертность составляла 19%. Нижеприведенные примеры 29-31, выходящие за пределы настоящего изобретения, даются для демонстрации получения нафтохиноновых циклов с заместителями в 5, 6, 7 и/или 8 положениях. Пример 29 Получение 2-(трет-бутил) -3-гидрокси-6-метил-нафталин-1,4-диона и 2-(трет-бутил)-3-гидрокси-7-метил-нафталин-1,4 диона (а) Получение 6-метил-нафталин-1,4-диона Раствор 1,4-бензохинона (13,9 г, 128 ммоль) и изопрена (13,1 мл, 131 ммоль) перемешивают в ледяной уксусной кислоте (44 мл) в течение 68 часов при комнатной температуре. Смесь разводят водой (44 мл) и кипятят с обратным холодильником в течение 1,5 часа. Смесь охлаждают до комнатной температуры и последовательно к ней добавляют уксусную кислоту (84 мл) и хромовую кислоту [трихлорид хрома (29,4 г) в воде (30 мл)], а затем кипятят с обратным холодильником в течение 1,5 часа. После охлаждения смесь разводят водой (200 мл) и экстрагируют эфиром (3 х 50 мл). Объединенные эфирные фракции промывают разбавленным раствором гидроксида натрия (2М; 2 х 50 мл), водой (2 х 50 мл), насыщенным раствором хлорида натрия (50 мл) и сушат над сульфатом магния. После фильтрации и упаривания растворителя при пониженном давлении, а также повторной рекристаллизации из петролейного эфира было получено указанное в заголовке соединение (7 г). (b) 2-амино-6 и 7-метил-1,4-нафталин-1,4-диона К перемешиваемому раствору 6-метил нафталин-1,4-диона (2,1 г, 12 ммоль) в ледяной уксусной кислоте (60 мл) при комнатной температуре добавляют раствор азида натрия (1,58 г) в воде (5 мл). Смесь перемешивают в течение 2 дней, разбавляют водой (200 мл), перемешивают еще 15 мин и фильтруют. Фильтрат нейтрализуют бикарбонатом натрия и экстрагируют хлороформом (3 х 25 мл). Объединенные хлороформные экстракты промывают насыщенным раствором бикарбоната натрия, насыщенным раствором хлорида натрия и высушивают (CaSO4). После фильтрации, упаривания растворителя при пониженном давлении и хроматографии на силикагеле получают указанное в заголовке соединение (100 мг) в виде смеси изомеров в соотношении 3:2. (с) 2-гидроки-6- и -7-метил-1,4-нафталин-1,4-диона Смесь, содержащую аминометил нафталин-1,4-дион, приготовленную по методике (b) (200 мг), кипятят с обратным холодильником в воде (20 мл) и концентрированной серной кислоте (10 мл) в течение 20 мин. Охлажденную смесь переносят в лед с водой 50 г и экстрагируют эфиром (3 х 25 мл). Объединенные эфирные экстракты промывают водой, насыщенным раствором бикарбоната натрия, водой, насыщенным раствором хлорида натрия и сушат (MgSO4). После фильтрации, упаривания растворителя и очистки методом колоночной хроматографии на силикагеле получают указанное в заголовке соединение (68 мг). (d) Получение 2-(т-бутил)-3-гидрокси-6 и 7-метил-3-гидрокси- нафталин-1,4-дионов В результате стандартной процедуры радикального присоединения пероксисульфат/нитрата серебра к аминометильному соединению (64 мг, 0,34 ммоля) и триметилуксусной кислоты (52 мг, 0,51 ммоль) получают указанное в заголовке соединение в виде смеси изомеров в соотношении 3:2 (12 мг). Пример 30 Получение 2-(т-бутил)-6 и 7-диметил-3-гидрокси-нафталин-1,4-дионов Повторяют вышеописанные стадии от (а) до (d), заменяя изопрен на 2,3-диметил-1,3-бутадиен. Пример 31 Получение 2-(т-бутил)-3-гидрокси-5 и 8-метил-1,4-нафталин-1,4-дионов Повторяют вышеописанные стадии от (а) до (d), заменяя изопрен на пиперилен. (а) Получение 6-метил-1,4-нафталин-1,4-диона Раствор 1,4-бензохинона (13,9 г, 128 ммоль) и изопрена (13,1 мл, 131 ммоль) перемешивают в ледяной уксусной кислоте (44 мл) в течение 68 часов при комнатной температуре. Смесь разводят водой (44 мл) и кипятят с обратным холодильником в течение 1,5 часа. Смесь охлаждают до комнатной температуры и последовательно к ней добавляют уксусную кислоту (84 мл) и хромовую кислоту [триоксид хрома (29,4 г) в воде (30 мл)], а затем кипятят с обратным холодильником в течение 1,5 часа. После охлаждения смесь разводят водой (200 мл) и экстрагируют эфиром (3х50 мл). Объединенные эфирные фракции промывают разбавленным раствором гидроксида натрия (2М; 2х50 мл), водой (2х50 мл), насыщенным раствором натрия (50 мл) и сушат над сульфатом магния. После фильтрации и упаривания растворителя при пониженном давлении, а также повторной рекристаллизации из петролейного эфира получают указанные в заголовке соединения (7 г).
Формула изобретения1. Производные нафтохинона общей формулы I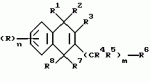 или его соль, где m = 0 или 1; n = 0; R1 и R2, каждый независимо представляет собой C1-C4 алкоксигруппу, или вместе они представляют собой группу =О; R3 представляет собой группу -OR10, где R10 представляет атом водорода, C1-6 алкил, замещенный C1-4 алкоксигруппой, или группу -COR11, где R11 представляет C1-6 алкильную группу, фенильную группу; R4 и R5, если присутствуют, каждый независимо представляет собой атом водорода, C1-C4 алкильную группу, или вместе с атомом углерода, к которому они присоединены, представляют собой замещенную C1-C4 алкильной группой C3-C8 циклоалкильную группу, содержащую в кольце один атом кремния; R6 представляет собой группу формулы (A)m-Si(R14)3, где каждый R14 представляет независимо C1-4 алкил или две группы R14 вместе с атомом кремния, находящимся между ними, образуют С3-8 силакарбоциклическое кольцо, А представляет C1-20 алкильную или алкенильную группу, R6 может дополнительно представлять атом водорода или алкоксигруппу, которая содержит один атом кремния и до 20 атомов углерода, R7 и R8 вместе представляют группу =О, когда R6 представляет собой необязательно замещенную группу, содержащую атом кремния, то атом кремния группы R6 не связан непосредственно с карбоциклом. 2. Соединение по п.1, где R4 и R5 представляют собой атом водорода или C1-4 алкильную группу. 3. Соединение по любому из предыдущих пунктов, где R6 представляет собой алкоксигруппу, которая содержит один атом кремния и до 20 атомов углерода. 4. Соединение по п.1, где R4 и R5 вместе с атомом углерода, находящимся между ними, представляют собой силациклоалкильную группу, содержащую в кольце от 3 до 8 атомов, замещенных C1-C4 алкильной группой. 5. Соединение по п.4, где R6 представляет собой алкоксигруппу, которая содержит один атом кремния и до 12 атомов углерода. 6. Соединение по любому из пп.1-5, где R6 представляет собой группу -(СН2)р -Si (R14)3, где р является числом от 1 до 15, предпочтительно от 1 до 10, особенно от 1 до 6, а каждый R14 независимо представляет собой C1-4 алкил, или две группы R14 вместе с атомом кремния, находящимся между ними, образуют С3-8 силакарбоциклическое кольцо. 7. Инсектоакарицидная и/или фунгицидная композиция, которая включает носитель и а качестве активного ингредиента соединение формулы (I) или его соль, по любому из пп.1 - 6 8. Способ борьбы с грибками, и/или насекомыми, и/или акаридами в локусе, включающий обработку локуса соединением формулы (I) или его солью по любому из пп.1 - 6, или композицией по п.7. 9. Производное нафтохинона по п. 1, обладающее инсектицидной, и/или акарицидной, и/или фунгицидной активностью. или его соль, где m = 0 или 1; n = 0; R1 и R2, каждый независимо представляет собой C1-C4 алкоксигруппу, или вместе они представляют собой группу =О; R3 представляет собой группу -OR10, где R10 представляет атом водорода, C1-6 алкил, замещенный C1-4 алкоксигруппой, или группу -COR11, где R11 представляет C1-6 алкильную группу, фенильную группу; R4 и R5, если присутствуют, каждый независимо представляет собой атом водорода, C1-C4 алкильную группу, или вместе с атомом углерода, к которому они присоединены, представляют собой замещенную C1-C4 алкильной группой C3-C8 циклоалкильную группу, содержащую в кольце один атом кремния; R6 представляет собой группу формулы (A)m-Si(R14)3, где каждый R14 представляет независимо C1-4 алкил или две группы R14 вместе с атомом кремния, находящимся между ними, образуют С3-8 силакарбоциклическое кольцо, А представляет C1-20 алкильную или алкенильную группу, R6 может дополнительно представлять атом водорода или алкоксигруппу, которая содержит один атом кремния и до 20 атомов углерода, R7 и R8 вместе представляют группу =О, когда R6 представляет собой необязательно замещенную группу, содержащую атом кремния, то атом кремния группы R6 не связан непосредственно с карбоциклом. 2. Соединение по п.1, где R4 и R5 представляют собой атом водорода или C1-4 алкильную группу. 3. Соединение по любому из предыдущих пунктов, где R6 представляет собой алкоксигруппу, которая содержит один атом кремния и до 20 атомов углерода. 4. Соединение по п.1, где R4 и R5 вместе с атомом углерода, находящимся между ними, представляют собой силациклоалкильную группу, содержащую в кольце от 3 до 8 атомов, замещенных C1-C4 алкильной группой. 5. Соединение по п.4, где R6 представляет собой алкоксигруппу, которая содержит один атом кремния и до 12 атомов углерода. 6. Соединение по любому из пп.1-5, где R6 представляет собой группу -(СН2)р -Si (R14)3, где р является числом от 1 до 15, предпочтительно от 1 до 10, особенно от 1 до 6, а каждый R14 независимо представляет собой C1-4 алкил, или две группы R14 вместе с атомом кремния, находящимся между ними, образуют С3-8 силакарбоциклическое кольцо. 7. Инсектоакарицидная и/или фунгицидная композиция, которая включает носитель и а качестве активного ингредиента соединение формулы (I) или его соль, по любому из пп.1 - 6 8. Способ борьбы с грибками, и/или насекомыми, и/или акаридами в локусе, включающий обработку локуса соединением формулы (I) или его солью по любому из пп.1 - 6, или композицией по п.7. 9. Производное нафтохинона по п. 1, обладающее инсектицидной, и/или акарицидной, и/или фунгицидной активностью.
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 05.07.2004 Извещение опубликовано: 20.02.2006 БИ: 05/2006 Популярные патенты: 2477044 Искусственная рыболовная приманка (варианты) ... между собой посредством клея или сварки, и имеет внутри корпуса пластину, выполненную из мягкого пластика, например силикона, имеющую профиль корпуса и переходящую в хвост, при этом корпус выполнен из упругого пористого материала, например поролона, а хвост выполнен из мягкого пластика, например силикона.Недостатком прототипа является недолговечность приманки ввиду возможности отрыва хвостовой части во время поклевок. Задачей изобретения является повышение долговечности мягкой приманки, имеющей хвостовую часть, например, в виде хвоста рыбки или лапок лягушки, или спиралевидного хвоста, за счет исключения ее отрыва во время поклевок, улучшение игры мягкой приманки в воде за ... 2105446 Плоскорежущая лапа ... 2 или больше на 20.50% чем толщина лапы 2. Скалывающий элемент 20 выполнен из износостойкого материала и на верхней плоскости 21 плоскорежущей лапы 2 закреплен контактной сваркой. Скалывающий элемент 20 (см. фиг.3) образован путем локального среза части листового материала плоскорежущей лапы 2 и деформацией срезанной части в направлении от нижней плоскости 22 лапы 2 к ее верхней плоскости 21. Образованная таким образом фронтальная грань 23 скалывающего элемента выступает над верхней плоскостью 21 лапы 2 на величину h, равную ее толщине t. Деформированные верхняя 24 и нижняя 25 плоскости скалывающего элемента 20 плавно сопрягаются с верхней 21 и нижней 22 плоскостями стрельчатой ... 2272840 Способ молекулярного маркирования пола хмеля обыкновенного (humulus lupulus l) ... ПМФ37 (Серебрянка Калистовская × от Смолистый)9 392-20 (?2-26) НИПТИХ-"- -"-10 406-7 НИПТИХГустяк (старинный местный сорт)ПМФ58 (Смолистый × от Смолистый) 11 417-1 НИПТИХСумерь ПМФ68 (Фредос, Бельгия × от Урожайный) 1242 7-2НИПТИХ -"--"- 1343 8-5НИПТИХ ПодвязныйПМФ57 (Смолистый × от Урожайный) 14 448-7 НИПТИХ-"- -"-15 458-9 НИПТИХ-"- -"-16 468-10 НИПТИХ-"- -"-17 479-13 НИПТИХЛейт Кластер (США) Свободное опыление 1848 11-11НИПТИХ Сумерь-"- 1949 11-17НИПТИХ -"--"- 2050 12-2НИПТИХ Истринский 15-"- 2158 13-9НИПТИХ -"--"- 2259 ... 2409937 Растение с высоким содержанием ребаудиозида а ... растений Stevia проблемой является способ идентификации растений Stevia. В качестве способа идентификации улучшенных растений Stevia можно думать о способах идентификации по высоте растений, форме листьев, и т.д., однако, поскольку Stevia не является самоопыляемым растением и имеет тенденцию к образованию гибридов, классификацией только по высоте растений, форме листьев и т.д., этого нельзя достичь. Кроме того, существует сравнительная идентификация на основе устойчивости к заболеваниям патогенами, специфичными для Stevia, однако, хотя увядшие листья и черные точки на листьях, которые имеют место только у Stevia, вызываются грибком Septoria и Alternaria, эти грибы живут в почве. ... 2440708 Комбинированное устройство для ротационного внутрипочвенного рыхления ... ввиду формирования ее пересекающихся потоков и снизить тяговое сопротивление устройства, исключив лобовое воздействие фрезерователя на необработанную почву. Вал фрезерователя 2 опирается на подшипники 5 рыхлящих пальцев 4, установленных на рампе 3, рампа 3 опирается на ротационные щелерезы 1. Механическая система, состоящая из вала фрезерователя 2, рампы 3, пальцев 4 и подшипников 5, имеет высокую жесткость на изгиб в направлении обработки почвы устройством. К подшипнику 5 вала фрезерователя 6 из подводящего канала 11 по каналу 10 в щелерезе 1, каналу 9 в рампе 3, сквозь канал 8 в рыхлящем пальце 4 подается вещество. Вещество смазывает промежуточные подшипники 5. К открытой ... |
Еще из этого раздела: 2462016 Устройство для протравливания семян 2121258 Устройство для вентилирования зерна или другого сыпучего материала (варианты) 2175189 Способ регенерации растений сорго в культуре in vitro 2033002 Орудие для междурядной обработки почвы 2399200 Устройство для обработки роговых образований животных, например крупного рогатого скота 2168887 Машина для добычи корней 2120752 Способ консервирования ксеногенных клеток печени 2447645 Аппарат для обмолота коробочек семян 2049387 Инкубатор индивидуального пользования 2423042 Электронно-оптический способ регулирования технологии производства агропродукции |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||