Способ получения трансгенного животного, экспрессирующего в молочной железе гранулоцитарный колониестимулирующий фактор человека и гибридный ген h-gm-1 для осуществления способаПатент на изобретение №: 2157846 Автор: Прокофьев М.И., Городецкий С.И., Черных В.Я., Мезина М.Н., Лагутина И.С., Косоруков В.С., Шепель Н.И. Патентообладатель: Прокофьев Михаил Иванович, Городецкий Станислав Иванович, Черных Венадий Яковлевич Дата публикации: 20 Октября, 2000 Начало действия патента: 25 Ноября, 1999 Адрес для переписки: 142712, Московская обл., Ленинский р-н, п/о "Горки Ленинские", ул. Административная 2, Прокофьеву М.И. Изображения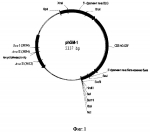    Человеческий гранулоцитарный колониестимулирующий фактор (Г-КСФ) получают путем экспрессии рекомбинантных белков в молочной железе трансгенных животных. Для получения белка Г-КСФ человека используют молоко трансгенных животных. Созданы оригинальные генные конструкции Г-КСФ человека на основе имеющейся геномной копии ДНК и регуляторных участков генов белков молока, обеспечивающие эффективную секрецию Г-КСФ с молоком трансгенных животных. Изобретение может быть использовано в иммунологии. 2 c.п. ф-лы, 3 ил. , , , ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУИзобретение относится к биотехнологии. Известен метод получения гранулоцитарного колониестимулирующего фактора (Г-КСФ) из таких источников, как кровь, где он в норме присутствует. Этот метод трудоемок и дорог в связи с низкой концентрацией биологически активных веществ и ограниченным количеством исходного сырья (Werner RG, Berthold W; Purification of proteins produced by biotechnological process. Arzneimittelforschung 1988 Mar; 38(3):422-8). Другой опасностью этого метода является возможность присутствия в конечной продукции инфекционных для человека агентов. Другим источником полезных биологически активных веществ являются получение их с использованием рекомбинантных организмов в биоферментерах (Am J Hosp Pharm 1989 Sep; 46(9): 1834-44). Получение белков таким методом сопряжено с определенными проблемами. Система синтеза прокариот не может правильно провести посттрансляционный процессинг белков - фолдинг, модификации белков, такие как гликозилирование, силиконирование и т.д. Показано, что для функциональной активности Г-КСФ важно гликозилирование. Гликозилированная форма Г-КСФ в 2 раза превосходит по способности стимулировать рост колоний гранулоцитов и в 20 раз быстрее приводит к положительному эффекту по сравнению с существующим коммерческим негликозилированным рекомбинантным препаратом Filgrastim (Nissen с. Glycosilation of recombinant human granulocyte colony stimulating factor for stability and potency. Eur. J. Cancer, 1994, 30A, Suppl 3: S12-4). Используя некоторые процессы, можно для отдельных веществ увеличить выход биологически активного белка, например, инсулин, проурокиназа. Однако для большинства веществ этот способ неприменим. Лучшими результатами отличается наработка белка в культуре клеток млекопитающих. Все необходимые модификации нормально происходят, но концентрация искомого белка низка, а сам процесс культивирования дорогостоящ и требует высокого технологического обеспечения. Известен метод получения биологически активных веществ с использованием трансгенных млекопитающих животных, таких как кролики, овцы, крупный рогатый скот, с секрецией этих веществ в кровяное русло. Этим достигается практически полная идентичность получаемых веществ нативным. Ограничением метода является значительная стоимость исходного сырья и невысокая концентрация в нем продуцируемых веществ, а также возможность неблагоприятного влияния получаемого белка на организм трансгенного животного (И.Л. Гольдман с соавт. Трансгенные сельскохозяйственные животные: экспрессия чужеродных генов. Биотехнология, 1996, N 9, с. 3-23). Известен метод получения трансгенных животных, экспрессирующих альфа-1-антитрипсин, фактор IX (Э.Д. Кларк, Р. Лейз, ППЛ Терапьютикс Лтд., "Способ получения трансгенной овцы", патент РФ Ru #2085587 C1, 1986) и гамма-интерферон человека (Лагутин О. В. с сотр, "Гибридный ген BLG-HIFN-G для экспрессии гамма-интерферона человека в молочной железе трансгенного животного", патент РФ N 2084525 C1, 1997) в молочной железе лактирующей самки. Авторами данного изобретения предложен способ получения трансгенных животных, предусматривающий конструирование генетической конструкции на основе плазмидной ДНК, кодирующей слитный белок hG-CSF под контролем промоторов генов белков молока, обеспечивающих секрецию рекомбинантного белка в молочной железе лактирующих самок, микроинъекцию фрагмента в пронуклеус оплодотворенной яйцеклетки и пересадки яйцеклетки в половые пути псевдобеременной самки. Этот метод обеспечивает высокую идентичность получаемого белка нативному, а также высокую концентрацию вещества в исходном сырье. Человеческий гранулоцитарный колониестимулирующий фактор (Г-КСФ) вызывает стимуляцию образования нейтрофилов и широко применяется в комбинации с химиотерапией при лечении онкологических больных, больных нейтрофилией и анемией. В настоящее время за рубежом рекомбинантный Г-КСФ получают из бактериальных клеток в виде препарата Нейпоген и Filgrastim. Использование прокариотов для получения рекомбинантных белков, как известно, не обеспечивает ряд посттрансляционных модификаций, в частности, гликозилирование, фолдинг белка и отщепление лишнего метионина с N-конца белка, что приводит к снижению биологической активности получаемого препарата. К тому же его стоимость очень высокая. Рекомбинантные белки, получаемые из трансгенных эукариотических организмов, например, путем направленной экспрессии в молоко трансгенных животных, в частности кроликов, лишены этих недостатков. Использование трансгенных животных позволяет с минимальными затратами получать достаточное количество препарата в максимально сжатые сроки. Концентрация искомого белка в молоке может достигать 5-15 г/л, что составляет до 50% общего белка молока. С этой целью авторами патента созданы оригинальные генные конструкции Г-КСФ человека на основе имеющейся геномной копии ДНК, обеспечивающие эффективную секрецию Г-КСФ с молоком трансгенных животных. Получены трансгенные кролики на основе методов, разработанных в Научно-производственном биотехнологическом центре по животноводству РАСХН. Созданный авторами гибридный ген для экспрессии Г-КСФ в молоко трансгенных животных характеризуются следующими признаками: - обеспечивают экспрессию человеческого белка Г-КСФ в молочной железе трансгенных животных; - состоят из: - фрагмента Kpn 1 и Cla 1 размером 0,9 тыс. п.н. 5"-фланкирующей области гена бета-казеина быка, содержащей промотор гена BLG (бета-лактоглобулин быка); - фрагмента размером 1,5 тыс.п.н., содержащего геномную копию гена Г-КСФ человека; - фрагмента размером 0,35 тыс.п.н., содержащий 3"-фланкирующую область гена бета-казеина быка; - участка полилинкера, содержащего уникальные сайты узнавания эндонуклеазами рестрикции EcoR I, Hind III, Sal I, BamH I, Xba I, Not 1. Схема вектора гибридного гена hGM-l приведена на фиг .1. Последовательность гибридного гена приведена на фиг. 3. Создание гибридного гена Г-КСФ человека и получение трансгенных животных иллюстрируется следующими примерами: ПРИМЕР 1. Создание гибридного гена h-GM-1. Схема конструкции приведена на фиг. 1. Из вектора pbBLG-3, содержащего геномную копию гена бета-лактоглобулина быка с фланкирующими его 5" и 3" последовательностями, по уникальным сайтам рестриктаз Kpn 1 и Cla 1 выделяют фрагмент 5"-фланкирующей области, содержащей промотор гена BLG и его сигнальный пептид. Из этого же вектора методом полимеразной цепной реакции со специфическими праймерами был выделен 3"-фланкирующий участок гена BLG. 5"-фрагмент был переклонирован в сайт рестриктазы Cla 1 в вектор phGCSF2, содержащий геномную копию гена Г-КСФ человека, перед ATG сайтом гена Г-КСФ. Правильность клонирования и сохранность рамки считывания проверяли методом секвенирования фрагмента конструкции, амплифицированного по специфическим праймерам CCT GCA GAG CTC AGA AGC GTG и AGG CGG CTC TCC CAT CCT GGG. Полученную конструкцию назвали p5LG-GCSF. 3"-фрагмент был переклонирован в сайт рестриктазы Xho 1 в вектор p5LG-GCSF, после стоп кодона кодирующей части гена Г-КСФ. Полученный вектор был проверен на правильность кодирующей последовательности методом секвенирования ключевых участков гибридного гена. Полученный вектор был назван phGM-1. При подготовке фрагмента к микроинъекции его вырезали из 20 мкг векторной ДНК phGM-1 эндонуклеазами Крп 1 и Not 1. Затем выделяли фрагмент из смеси методом фракционирования в агарозном геле и очищали фенол-хлороформным методом. Окончательную очистку проводили на наборе Genomic DNA Purification Kit (Promega). Окончательно растворяли фрагмент в буфере 0,1хТЕ (1 мМ Tris-CI, 0,1 мМ EDTA, pH 8,0). ПРИМЕР 2. Получение трансгенных кроликов В качестве доноров зигот используют половозрелых самок кроликов породы шиншилла в возрасте 5-7 месяцев. Для вызывания суперовуляции у доноров применяют гонадотропин сыворотки жеребых кобыл (Сергон, Чехия). Каждому донору инъецируют 100 ME сергона, через 48-72 часа самку спаривают с самцом и индуцируют овуляцию внутривенным введением 200 ME хорионического гонадотропина (Московский эндокринный завод). Для извлечения зигот у самок-доноров используют оперативное промывание яйцеводов in vivo (Adams C.E. Egg transfer in the rabbit. Mammalian egg transfer. Веса Ration: CRC Press, 1982. P. 29-48). В качестве анестетиков используют кетамин 5%, ромпун 2%. Наркотизированное животное фиксируют на операционном столе и выбривают шерсть в области брюха. Репродуктивный тракт обнажают через разрез по белой линии живота. В воронку яйцевода вводят полиэтиленовый катетер, в стенке рога матки металлической канюлей со стилетом делают отверстие, затем в просвет матки вводят теплую манипуляционную среду и направляют ее ток через соединение матки с фаллопиевыми трубами в яйцевод. Поиск оплодотворенных яйцеклеток (зигот) осуществляли на бинокулярной лупе Nikon при увеличении 40х. Зиготы с визуализированными пронуклеусами инъецировали 1-2 пл раствора ДНК в один пронуклеус (Brem G. et al. Production of transgenic, mice, rabbits and pigs by microinjection into pronuclei// Zuchthyg, 1985, v. 20, P. 251-252; Hammer R.E. et al. Production of transgenic rabbits, sheep and pigs by microinjection. Nature. 1985, V. 315, P. 680-683). Микроинъекции проводят в специальной камере, заполненной культуральной средой (PBS с добавлением 5% фетальной сыворотки). Камера состоит из двух параллельно расположенных силиконизированных покровных стекол, между которыми находится капля манипуляционной среды в виде столбика. Все остальное пространство заполняют минеральным маслом (Sigma, d=0,84 г/мл). Предназначенные для инъецирования зиготы помещают в столбик манипуляционной среды, удерживают на стеклянной пипетке и оценивают пронуклеусы с использованием инвертированного микроскопа Axiovert 35 при увеличении 400х. Раствор ДНК инъецируют с помощью микроинъекционной иглы, вытянутой из капиллярной трубочки с микрофиламентом (тонкостенное тугоплавкое стекло, диаметр 1 мм) на вертикальном пулере (НПО "Биоприбор" РАН). Микроинъекционные иглы заполняли раствором ДНК, используя действие капиллярных сил, затем устанавливали в манипуляторе. Положение обоих микроинструментов (фиксирующей пипетки и микроинъекционной иглы) регулируют с помощью микроманипуляторов (НПО "Биоприбор" РАН). Микроинъекционную иглу с инъецируемым растворам ДНК соединяют силиконовой трубочкой с микроинъектором. Об успехе микроинъекции судили по увеличению объема пронуклеуса. Инъецированные зиготы инкубируют 30-60 мин, чтобы удалить поврежденные. К дегенерированным относили зиготы с фрагментированной цитоплазмой и с поврежденной цитоплазматической мембраной. Зиготы, имеющие нормальный внешний вид, пересаживают реципиентным крольчихам, у которых половой цикл синхронизирован с циклом доноров. Самок-реципиентов спаривали с вазоэктомированным самцом и вводили хорионический гонадотропин в то же время, когда спаривали донорную самку с полноценным самцом. Возможна подготовка реципиента непосредственно перед трансплантацией эмбрионов. Эмбрионы трансплантировали в яйцеводы самок-реципиентов хирургическим способом. Для пересадки зигот используют стерильные катетеры для пересадки эмбрионов (Биомедикол, Россия). Реципиенту через воронку яйцевода вводили катетер, содержащий манипуляционную среду с зиготами. Каждому реципиенту пересаживали 15-20 зигот, распределяя их поровну между яйцеводами. После трансплантации эмбрионов, каждая крольчиха-реципиент находится в отдельной клетке на весь срок беременности. В течение 7-10 дней проводится санация операционного шва. На 14-16 дни после трансплантации эмбрионов методом пальпации устанавливают наличие плодов у реципиентов. Беременных реципиентов переводят на рацион кормления для сухральных и лактирующих самок. Окрол ожидают на 29-30 дни после трансплантации эмбрионов. В случае задержки окролов на следующий день после ожидаемой даты с целью стимуляции родов внутривенно инъецируют 3 ME окситоцина. Вели четкий учет числа родившихся крольчат. Через 5-7 дней всех крольчат метили и одновременно брали образцы ткани уха для анализа ДНК на интеграцию трансгена. Наличие интеграции определяли методом полимеразной цепной реакции (ПЦР) со специфическими праймерами GCA CAG CCT GTA GGT GGC ACA и CCT GCA GAG CTC AGA AGC GTG. Положительные по ПЦР пробы подтверждали методом блот-гибридизации (фиг. 2). В результате проведенных исследований было получено 2 живых трансгенных кролика (N 7 и N 25), а также 3 мертворожденных. Список литературы. И.Л. Гольдман с соавт. Трансгенные сельскохозяйственные животные: экспрессия чужеродных генов. Биотехнология, 1996, N 9, с. 3-23 Hammer R. E. et al. Production of transgenic rabbits, sheep and pigs by microinjection. Nature. 1985, V. 315, P.680-683. Э.Д. Кларк, P. Лейз, ППЛ Терапьютикс Лтд., "Способ получения трансгенной овцы", патент России Ru #2085587 C1, 1986. Nissen с. Glycosilation of recombinant human granulocyte colony stimulating factor for stability and potency. Eur. J. Cancer, 1994, 30A, Suppl 3: S12-4. Adams C.E. Egg transfer in the rabbit. Mammalian egg transfer. Веса Ration: CRC Press, 1982. P.29-48. Werner RG, Berthold W; Purification of proteins produced by biotechnological process. Arzneimittelforschung 1988 Mar; 38 (3):422-8. Am J Hosp Pharm 1989 Sep; 46(9):1834-44. Brem G. et al. Production of transgenic mice, rabbits and pigs by microinjection into pronuclei// Zuchthyg, 1985, v.20, P. 251-252.ФОРМУЛА ИЗОБРЕТЕНИЯ1. Гибридный ген h-GM-1 для экспрессии гранулоцитарного колониестимулирующего фактора человека (Г-КСФ), состоящий из фрагмента размером 0,9 тыс. п.н. 5"-фланкирующей области гена бетаказеина быка, содержащий промотор гена бета-лактоглобулина быка (BLG); фрагмента размером 1,5 тыс. п.н., содержащего геномную копию гена гранулоцитарного колониестимулирующего фактора (Г-КСФ) человека; фрагмента размером 0,35 тыс. п.н., содержащий 3"-фланкирующую область гена бета-казеина быка; и приведенный на фиг.3, обеспечивающий эффективную секрецию гранулоцитарного колониестимулирующего фактора человека (Г-КСФ) в молочной железе трансгенного животного. 2. Способ получения трансгенного животного, экспрессирующего в молочной железе гранулоцитарный колониестимулирующий фактор человека, путем микроинъецирования гибридного гена h-GM-1, описанного в п.1, в пронуклеус оплодотворенной яйцеклетки и последующим переносом этой яйцеклетки в половые пути псевдобеременной самки.Популярные патенты: 2165137 Машина для уборки корней лекарственных растений ... вершины которых смещены относительно оси ротора, достигается указанный выше технический результат. Проведенный заявителями анализ уровня технологий (способов) и техники, включающий поиск по патентным и научно-техническим источникам информации и выявление источников, содержащих сведения об аналогах заявленного изобретения, позволил установить, что заявителями не обнаружены аналоги, характеризующиеся признаками, идентичными всем существенным признакам заявленного изобретения. Предложенные ближайшие аналоги устройства позволили выявить совокупность существенных по отношению к усматриваемому заявителями техническому результату отличительных признаков в заявленном устройстве, ... 2492650 Микроэмульсионная бактерицидная композиция ... поддерживают pH в пределах от приблизительно 8 до приблизительно 13, и - предпочтительно - от приблизительно 9,5 до приблизительно 11,5. Примеры таких буферов включают, помимо прочих, следующие: четвертичная соль EDTA/HCl, тетраборат натрия/HCl и фосфатный буфер.Описанные в настоящем документе микроэмульсионные бактерицидные композиции имеют средний размер частиц в интервале от приблизительно 1 до приблизительно 500 нм, предпочтительно - от приблизительно 2 до приблизительно 150 нм, и более предпочтительно - от приблизительно 2,5 до приблизительно 80 нм. Размер и распределение частиц по образцу ОФА (орто-фталевый альдегид) можно определить с помощью анализатора размера частиц ... 2427999 Способ повышения плодородия мерзлотных засоленных почв в условиях криолитзоны ... учитываемых на МПА (утилизирующих органические источники азота) низкая - около 10-15 млн КОЕ/ г почвы;- реакция численности группы на запашку сидерата отмечалась к августу следующего после запашки года и была максимальной во второй год последействия; - динамика численности микроорганизмов, учитываемых на КАА (утилизирующие минеральные источники азота), была во многом сходной с таковой учитываемых на МПА.Таким образом, процессы минерализации зеленой массы в исследуемой почве в условиях криолитозоны крайне заторможены. Ответная реакция микрофлоры наблюдается только через год после запашки, а последействие сохраняется в течение 2-3 лет. Сидеральные удобрения оказывают ... 2075926 Устройство для группового учета молока на доильных установках ... поплавок 12 отпадает вниз. Наконечник 15, имеющий зауженное отверстие на верхнем конце, способствует появлению эффекта эжекции, при этом давление молока в отводной трубке 13 увеличивается. Большая часть молока при этом поступает в верхнюю камеру 1, где соединяется с большей частью молока, поступающего из первого делительного устройства и следует в отводящий патрубок 20. Меньшая часть молока через делительное отверстие 17 поступает в мензуру 18, с нанесенной на ней первой шкалой 19. Первая шкала 19 отградуирована в единицах, кратных предельному объему молока, накапливаемому в накопительной камере 8, а вторая шкала 10 - кратная количеству молока, прошедшему через первое делительное ... 2432394 Ингибирование образования биогенного сульфида посредством комбинации биоцида и метаболического ингибитора ... и метаболического ингибитора или их обоих меньше, чем примерно 50% их соответствующих MIC. Еще предпочтительнее, концентрации одного из биоцида и метаболического ингибитора или их обоих меньше, чем примерно 35% их соответствующих MIC. Наиболее предпочтительно, концентрации одного из биоцида и метаболического ингибитора или их обоих меньше, чем примерно 25% их соответствующих MIC.В предпочтительном варианте осуществления настоящего изобретения биоцид представляет собой альдегид, а метаболический ингибитор представляет собой нитрит и/или молибдат. Когда биоцид представляет собой альдегид, а метаболический ингибитор представляет собой нитрит и/или молибдат, то предпочтительно, чтобы ... |
Еще из этого раздела: 2067832 Способ борьбы с грибковыми инфекциями растений 2124820 Устройство для изменения объемного заряда в атмосфере 2184433 Рабочий орган щелевателя 2048055 Устройство для отрезания и погрузки сенажа и силоса 2289908 Способ получения рассады стевии 2020793 Способ выращивания растений и стаканчик для его осуществления 2195102 Устройство для отделения грунта и земли от корней и корневищ солодки в качестве лакричного сырья 2442301 Устройство почвообрабатывающего орудия 2236122 Устройство для содержания животных 2455815 Самоходный универсальный комбайн для уборки картофеля и топинамбура |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||