кднк, полученная из рнк, кодирующей фермент оксалатоксидазу, по существу чистая оксалатоксидаза для использования при обработке растений и способ борьбы с патогенезом растений, вызванным инфицированием грибами, секретирующими щавелевую кислотуПатент на изобретение №: 2136755 Автор: Л.Кристина Хартман (US), Сарджит С.Джохал (US), Марк Р.Шмитт (US) Патентообладатель: Зенека Лимитед (GB) Дата публикации: 10 Сентября, 1999 Начало действия патента: 24 Февраля, 1992 Адрес для переписки: 103735, Москва, ул.Ильинка 5/2, Союзпатент, Патентному поверенному Лебедевой Н.Г. Изображения    Ген, кодирующий фермент оксалатоксидазу, может быть использован для защиты растений от щавелевой кислоты, продуцируемой патогенными микроорганизмами. Продукт экспрессии гена - оксалатоксидаза - имеет оптимум pH 3,5, положительную термоустойчивость, протеазную устойчивость и представлен одной субъединицей массой около 25 кДа. Трансформация растения с использованием гена оксалатоксидазы стимулирует выработку растением фермента, катализирующего разрушение щавелевой кислоты, и тем самым предотвращает поражение растения патогенами. 3 с. и 6 з.п. ф-лы, 7 ил., 2 табл. , , , , , , , , , , , , ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУИзобретение относится к генетическому улучшению растений путем использования методов рекомбинантной ДНК. Конкретно, но не исключительно, изобретение относится к улучшению толерантности растений к болезням. С самого начала земледелия люди столкнулись с проблемой заболеваний растений. В течение всей истории достигнуты многочисленные успехи в борьбе с болезнями растений, примерами чего служат использование гибридных растений, пестицидов и усовершенствованной агротехнической практики. Однако, как любой фермер, садовод-любитель или увлеченный комнатным растениеводством может засвидетельствовать, вопросы болезней растений остаются развивающейся и постоянной проблемой культивирования растений. Это изобретение составляет главный шаг вперед в решении проблемы болезней растений путем использования давно известного факта, касающегося способа, с помощью которого определенные микробы, особенно грибы, поражают растения. Конкретно, это изобретение относится к средствам, с помощью которых замедляется или предупреждается фактическое проникновение в ткани растений этиологического (вызывающего заболевание) агента и, тем самым, предупреждается заболевание. И альтернативно, в случаях, когда инвазия полностью не предупреждается, настоящее изобретение дает растениям средства снижения воздействия инфекции и, тем самым, снижения или предупреждения гибели растений в результате болезни. Чтобы возбудителю болезни растения инфицировать растение, он должен быть способен проникнуть в растение и распространиться по нему. Возбудители болезней растений достигают этого разными путями. В основном это осуществляется путем секреции химических веществ, которые воздействуют на определенные компоненты и/или метаболические механизмы растения, которое поражается, т.е. хозяина для возбудителя. Главными группами веществ, которые секретируются возбудителями болезней растений и включены в механизмы возникновения заболевания, являются токсины, ферменты, полисахариды и/или другие эффекторы роста. Одним из таких химических веществ является щавелевая кислота или оксалат, которые могут разрушаться ферментом оксалатоксидазой. Хотя реакция, катализируемая оксалатоксидазой, хорошо известна, физико-химические свойства фермента, примером чего служит оксалатоксидаза ячменя, представлены в литературе неверно. Секреция щавелевой кислоты, как средства, при помощи которого возбудитель болезни растения поражает растения-хозяева, обычно обнаруживаются у множества родов грибов и особенно у родов Sclerotinia, Selerotium, Aspergillus, Streptomyces, Penicillium, Pythinm, Paxillus, Mycena, Leucostoma, Rhizoctonia u Schizophyolum. Грибы этих родов, особенно грибы рода Sclerotinia, как известно, вызывают деструктивные и фатальные заболевания многих широко культивируемых растений, включая полевые культуры, такие как подсолнечник, соя, бобы, рапс, люцерна, лен, сафлор, арахис и клевер, овощные культуры, такие как салат, томаты, тыква, картофель, морковь, горох, чечевица, капуста, спаржевая капуста, брюссельская капуста; цветы, такие как петунья и ромашка, и древесные виды, такие как персик. Болезни включают не только доуборочные заболевания в поле, но также послеуборочные заболевания в процессе перевозки и хранения. Признаки заболевания, вызываемые вышеупомянутыми видами грибов, варьируют в зависимости от растения-хозяина и частей растения-хозяина, поражаемых болезнью, так же как и от условий окружающей среды, во время воздействия возбудителя. Например, характерной чертой всех заболеваний, вызываемых Sclerotinia, является увядание и поникание листьев, после чего гриб быстро поражает "сердцевину" растения и прорастает в стебель. Заболевания является губительным для растения. В жидких культурах Sclerotinia наблюдаются уровни щавелевой кислоты, колеблющиеся в пределах от тысячи до десятков тысяч частей на миллион, в зависимости от среды роста, возраста культуры и других параметров. Некоторые растительные ткани, такие как листья бобов и подсолнечника, обработанные низкими концентрациями щавелевой кислоты, легко проявляют признаки увядания и гибели клеток, что говорит о значении щавелевой кислоты на более поздних стадиях заболевания. Точный механизм заболевания, вызываемого действием щавелевой кислоты после инфицирования, неизвестен, хотя существует ряд теорий, от хелатирования дивалентных металлов, препятствующего действию ферментов клеточных стенок растений и/или ключевых метаболических ферментов, до создания оптимальной микросреды, для действия гидролитических ферментов, секретируемых этими грибами. Несмотря на это, из имеющихся в наличии данных ясно, что щавелевая кислота является интегральным компонентом патогенного поражения. Данные для этого заключения были получены при нескольких исследованиях, включая излучение с использованием безоксалатных мутантов Sclerotinia, которые, по-видимому, обладают нормальным набором гидролитических ферментов и других факторов, но не вызывают симптоматику заболевания. Ревертанты этих оксалат-отрицательных мутантов продемонстрировали нормальное развитие заболевания и характерные признаки. Высокая степень вирулентности заболеваний, связанных с вышеупомянутыми родами грибов, хорошо известна. Например, листья выращиваемых в оранжерее растений подсолнечника, инфицированных Sclerotinia sclerotorum, часто демонстрируют увядание и межжилковый некроз через от 3 до 5 дней после заражения. Изучение этих растений показало наличие вызывающих увядание веществ в водных экстрактах повреждений подсемядольного колена (часть главного стебля зародыша растений или сеянцев ниже семядолей). Химические исследования, включая тонкослойную хроматографию и газожидкостную хроматографию, показали, что это вызывающее увядание вещество содержало щавелевую кислоту, и что увядшие листья инфицированных растений содержали в 15 раз больше щавелевой кислоты, чем листья здоровых растений. Как уже отмечалось, щавелевая кислота системно движется по растению, вызывая симптомы заболевания в тканях, которые удалены от первоначальной точки инфицирования и не обязательно инфицированы грибными гифами. На основании этого заявители предложили, что соответствующая идентификация, выделение и экспрессия разрушающего оксалат фермента, такого как оксалатоксидаза, оксалатдекарбоксилаза или подобного фермента растением может снизить почти полностью патогенность грибов, которые секретируют щавелевую кислоту в качестве ключевого компонента патогенеза. Соответственно заявители поставили и достигли цели идентификации и выделения гена протеина, который пригоден для интродукции оксалатоксидазной активности в растении и микробы, используя методы генной инженерии. Оксалаты встречаются обычно в некоторых видах растений в качестве продуктов, естественно вырабатываемых самими растениями. Природно присутствующие оксалаты, вырабатываемые растением, накапливаются в некоторых зеленых листовых овощах, таких как шпинат и ревень и в некоторых кормовых овощах. Хотя такие виды сельскохозяйственных культур являются потенциальными источниками пищевых витаминов и минеральных веществ, потребление их больших количеств токсично для людей, у которых оксалаты связываются с ионом кальция и выпадают в осадок в виде нерастворимого оксалата кальция в почках, приводя к гипероксальурии и разрушения почечной ткани. Также известно, что щавелевая кислота может реагировать с другими метаболитами растений, образуя оксалатные производные, которые высокотоксичны. В одном из примеров образуется соединение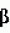 -N-оксалил-L- -N-оксалил-L-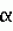 - -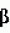 -диаминопропионовая кислота, которая является нейротоксином. Таким образом, присутствие щавелевой кислоты в некоторых видах растений исключает их использование в качестве пищи людей и животных. В частности, изобретатели определили характеристики фермента, пригодного для пресечения патогенеза, включающего щавелевую кислоту. Этот уникально охарактеризованный оксалатоксидазный фермент катализирует или иначе способствует реакции, включающей окислительное разрушение оксалата с получением двуокиси углерода и перекиси водорода. Общая форма этой реакции представляет собой: -диаминопропионовая кислота, которая является нейротоксином. Таким образом, присутствие щавелевой кислоты в некоторых видах растений исключает их использование в качестве пищи людей и животных. В частности, изобретатели определили характеристики фермента, пригодного для пресечения патогенеза, включающего щавелевую кислоту. Этот уникально охарактеризованный оксалатоксидазный фермент катализирует или иначе способствует реакции, включающей окислительное разрушение оксалата с получением двуокиси углерода и перекиси водорода. Общая форма этой реакции представляет собой:  Изучение этого фермента привело в результате не только к его идентификации, выделению и экспрессии, но также к определению его свойств и его клонированию, так что ген для экспрессии фермента в настоящее время уже существует и может быть интродуцирован в растения и экспрессирован в растениях, придавая им вследствие этого устойчивость к болезни, вызываемым грибами, у которых щавелевая кислота является угрожающим компонентом. Такая трансформация растений должна защищать трансформирование растения от повреждающего действия щавелевой кислоты, вызывающего заболевание. Еще более ценно будет то, что применение вышеупомянутых изобретений не ограничивается патогенезом растений. Еще одно преимущество этого изобретения состоит в интродукции оксалатоксидазного гена в растение, чтобы растение продуцировало щавелевую кислоту на низком уровне. Это могло бы быть особенно благоприятным для растений с высоким содержанием оксалатов, таких как арахис, свекла, шпинат, ревень, ячмень, какао и многие злаки. Смотрите, Libert and Franceschi (1987), J. Agric Food Chem. 35:926-938. Изобретение также имеет применение для широкомасштабного производства разрушающих оксалаты ферментов. Известна потребность в большом количестве разрушающих оксалат ферментов в ряде областей, включая потребность в их использовании в наборах для определения наличия и/или количестве щавелевой кислоты и для использования по деградации щавелевой кислоты, присутствующей в пищевых продуктах, и коммерческих технологических процессах. Например, микробная оксалатдекарбоксилаза использована в пивоваренном производстве (патент США N 4652452) и, как здесь показано, оксалат может также разрушаться при использовании оксалатоксидазы. Предметом настоящего изобретения является получение средств для разрушения щавелевой кислоты в растениях. В соответствии с настоящим изобретением получена кДНК, производимая из РНК, кодирующая фермент оксалатоксидазу и обладающая ДНК-последовательностью, представленной на фиг. 1, ее вариации, допускаемые дегенерацией генетического кода, и геномная ДНК, с которой гибридизуется вышеназванная кДНК. Изобретение, кроме того, представляет фермент, обладающий способностью разрушать оксалат, и характерный тем, что имеет единственную субъединицу размером примерно 25 килодальтон и, конкретно, по существу чистую оксалатоксидазу для использования при обработке растений, чтобы разрушить в них щавелевую кислоту, причем вышеназванная оксалатоксидаза имеет аминокислотную последовательность, показанную на фиг. 2, и характеризующуюся оптимумом pH 3,5, положительной тепловой стабильностью, единственной субъединицей размером примерно 25 килодальтон и устойчивостью к протеазам. Вышеназванная оксалатоксидаза может войти в состав рецептуры с агрохимически подходящим носителем для доставки вышеназванной оксалатоксидазы к растениям. Настоящее изобретение поэтому также представляет способ разрушения щавелевой кислоты в растении, включающий доставку к вышеназванному растению фермента, разрушающего щавелевую кислоту, так чтобы защитить вышеназванное растение от щавелевой кислоты. Предпочтительно, фермент является оксалатоксидазой. Доставка вышеназванного фермента, разрушающего щавелевую кислоту, может быть осуществлена нанесением на растение или на очаг поражения растения вышеназванного фермента в комбинации с агротехнически приемлемым носителем или, в качестве альтернативы, путем генетической трансформации генома растения с помощью гена, кодирующего вышеназванную оксалатоксидазу. Кроме того, изобретение представляет способ снижения содержания оксалата в ткани растения, состоящий в стабильном включении в геном растения гена, кодирующего фермент оксалатоксидазу, например, путем генетической трансформации. Подходящая генная конструкция для этой цели может включать промоторную последовательность, переходный пептид, структурную генную последовательность, кодирующую вышеназванный фермент оксалатоксидазу, и генную терминаторную последовательность. Следовательно, настоящее изобретение также представляет трансформированную растительную клетку, содержащую ген для экспрессии оксалатоксидазы. Вышеназванный ген может иметь последовательность такую, как на фиг. 1. Дополнительно, изобретение представляет собой способ борьбы с болезнями растений, вызванных инфицированием грибами, которые секретируют щавелевую кислоту, состоящий в стальном включении в геном вышеназванного растения путем трансформации гена, кодирующего оксалатоксидазу. Примерами родов грибов, которые секретируют щавелевую кислоту, являются: Selerotinia, Selerotium, Aspergillus, Streptomyces, Penicillium, Pythium, Paxillus, Myrena, Lencosfoma, Rhizoctonia, Whetzelinia and Schizophyllum. Одним из конкретных грибов, представляющих интерес с точки зрения этого изобретения, является Selerotinia Selerotorum, который инфицирует, например, подсолнечник (Helianthus annuns). Таким образом, в основном, настоящее изобретение широко направлено на понимание и определение применения разрушающего оксалат фермента, примером которого служит оксалатоксидаза, для коммерческого использования, такого как в пивоваренном производстве или в агротехнических целях, таких как снижение чувствительности растений к щавелевой кислоте или снижение концентрации эндогенной щавелевой кислоты в растении. Изобретатели пришли здесь к пониманию и объяснению, конкретно для агротехнического применения, что использование ферментов, разрушающих оксалаты, снижают гибель растений или разрушение от заболеваний или другой феномен, в которых щавелевая кислота играет решающую роль в инвазии. Изобретатели также поняли, что применение этого изобретения может привести в результате к предупреждению гибели растений и инфекции при заболеваниях, в которых щавелевая кислота играет решающую роль. Такие заболевания, в частности вызываются, среди прочих, грибами специфических родов, представленных здесь. Значение нового использования изобретателями разрушающих оксалат ферментов особенно повышается осознанием и открытием изобретателями, что физико-химические свойства оксалатоксидазы ячменя, сообщенные в литературе, неверны. Соответственно, изобретатели в значительной степени очистили и определили характеристики оксалатоксидазного фермента, ранее не описанные. Конечно, существенная очистка фермента, описание которой представлено в литературе, как здесь показано, неправильна. Конкретно, изобретатели раскрывают по существу чистую оксалатоксидазу, имеющую полный аминокислотный состав, показанный на фиг. 2, оптимум pH 3,5, нейтральную изоэлектрическую точку, положительную термостабильность, протеазную устойчивость и единственную субъединицу размером примерно 25 килодальтон. Здесь также представлено открытие в основном всех по существу чистых генов, кодирующих оксалатоксидазный фермент, с определенной последовательностью ДНК, показанной на фиг. 1. Ген кодирует оксалатоксидазный фермент, имеющий характеристики, представленные выше. В частности, ген кодирует фермент, проявляющий оксалатоксидазную активность, имеющий единственную субъединицу размером примерно 25 килодальтон, который специфично реагирует с антителами, индуцированными очищенной оксалатоксидазой ячменя, и имеет аминокислотную последовательность, показанную на фиг. 2. Изобретение также раскрывает вещества для применения в борьбе с патогенезом растений, вещества, которые включают химические соединения, проявляющие активность по разрушению щавелевой кислоты, в частности, оксалатоксидазную активность. Конкретно, вещество для обработки растений обладает оксалатоксидазной активностью на уровне, достаточном, чтобы разрушить щавелевую кислоту, продуцируемую возбудителями болезней. Будет понятно, что еще одним способом агротехнического использования такого вещества является соединение этих веществ с подходящим носителем, который приемлем агротехнически и дает возможность доставки этого вещества непосредственно к растению или в почву. Здесь также раскрывается растительная клетка, которая трансформирована геном, кодирующим экспрессию оксалатоксидазы или другого разрушающего оксалата фермента. Ген, кодирующий такой фермент, может включать последовательность ДНК, представленную на фиг. 1, которая по существу соответствует оксалатоксидазному ферменту, в значительной степени очищенному заявителями. Раскрывается способ обеспечения защиты от щавелевой кислоты растения, нуждающегося в этой защите. Способ включает доставку разрушающего щавелевую кислоту фермента в количестве достаточном, чтобы защитить растение от щавелевой кислоты к растению, нуждающемуся в такой защите. Предпочтительно, предполагается, что разрушающий щавелевую кислоту фермент, является оксалатоксидазой, кодируемой геном, имеющим структуру, показанную на фиг. 1, Методология обеспечения такой защиты может включать множество форм, включая трансформацию растения с помощью гена, кодирующего фермент, разрушающий щавелевую кислоту и, в частности, кодирующий оксалатоксидазу. И альтернативно, способ может включать получение фермента, разрушающего щавелевую кислоту в соединении с агротехнически приемлемым носителем для непосредственного нанесения на растение или внесения в почву, в которой растет растение. Очищенная оксалатоксидаза этого изобретения, ее применение в качестве средства борьбы с патогенезом и ее применение в трансформации растительной клетки представляют собой новаторский и уникальный подход к борьбе с болезнями растений, в которых щавелевая кислота играет роль ключевого компонента или в патогенезе, или на стадии заражения. Конечно, хорошо известно, что активность фермента оксалатоксидазы состоит в том, что он способствует разрушению щавелевой кислоты. Однако, только эти изобретатели были первыми, кто понял, что путем воздействия на щавелевую кислоту с ее химическим разрушением, например, ферментативной деградацией, можно получить в результате значительную агротехническую выгоду, придавая устойчивость к болезням, в которых щавелевая кислота играет решающую роль. Это изобретение имеет особые перспективы, так как главным бичом коммерческого возделывания агротехнически значимых растений, например, такой сельскохозяйственной культуры, как подсолнечник являются виды грибов, такие как Selerotinia, которые выделяют щавелевую кислоту. Преимущества авторского понимания изобретения могут быть воплощены или путем трансформации растений или путем применения оксалатоксидазы, как традиционного пестицида, наиболее вероятно в комбинации с подходящим носителем, который приемлем агротехнически. Одним из важных преимуществ при использовании оксалатоксидазы в качестве пестицида является то, что она экологически безвредна, не загрязняет и не повреждает растение. Если наружное применение фермента должно использоваться для защиты растения или части растения от возбудителя, нужно ожидать, что фермент будет растворяться (разбавляться) с получением жидкого раствора или суспензии, или смешиваться с твердым разбавителем, чтобы применяться в качестве дуста. Точный способ применения будет частично зависеть от конкретного возбудителя(лей) или целевых растений (намеченных к обработке). Детализированные способы адаптации основных методов применения для конкретных сельскохозяйственных культур и возбудителей можно найти в "Methods for evaluating pesticides for control of plant pathogens", K. D. Hieky, ed., The American Phytopathological Society, 1986. Вспомогательные вещества, которые могли бы быть добавлены в рецептуру, включают средства, способствующие солюбилизации, смачивающие вещества и стабилизаторы или средства, с помощью которых получался бы микроинкапсулированный продукт. Такие вспомогательные средства хорошо известны в данной области. При наружном применении могут также использоваться рекомбинантные микроорганизмы живые или превращенные в неживую форму способом, при котором не активируется фермент. Хотя, как сообщено в прототипах, оксалатоксидаза очищена и определены ее свойства, заявители открыли, что подобные литературные сообщения были неверны и что фермент, на самом деле, никогда не был очищен соответствующим образом и не были определены его характеристики. Будет понятно, что использованный здесь термин "оксалатоксидаза" относится к очищенной и охарактеризованной форме фермента, как представлено здесь, если нет других указаний. Различия между существующими в литературе сообщениями и очищенным и охарактеризованным ферментом настоящего изобретения представлены здесь в деталях и могут быть сжато собраны в табл. 1. Загрязненность коммерчески доступных оксалатоксидазных препаратов, так же как неправильное определение характеристик фермента и в литературе стали очевидны, когда изобретатели впервые очистили оксалатоксидазу из корней сеянцев ячменя. Использовали два метода. В одном примере очистка оксалатоксидазы из корней сеянцев ячменя включала гомогенизацию заморенной ткани с от 1 до 4 объемами воды и очистку из водного экстракта после фильтрации через марлю, чтобы удалить остатки. Раствор далее очищали центрифугированием при 18000g в течение 30 минут после тепловой обработки при 80oC в течение 3 минут, причем осадки на обоих стадиях отбрасывались; осадок протеина из супернатанта, получаемый при насыщении его сульфатом аммония (NH4)2SO4 до концентрации от 30% до 70% отделяли центрифугированием и диализировали в воду. Белок, полученный на стадии осаждения сульфатом аммония, снова растворенный фракционировали путем жидкостной экспресс-хроматографии белков ЖЭХБ используя колонку Mono S 10/10, уравновешенную 25 мМ ацетатом калия pH 4,8, элюировали градиентом NaCl от 0,0 до 0,4 М в том же самом буфере. Оксалатоксидазную активность определяли методом Sugiura et al. (1979). Chem. Pharm. Bull 27 (9): 2003. Пиковые фракции оксалатоксидазной активности объединяли, уравновешивали низкосолевым калийацетатным буфером pH 4,8 и повторно хроматографировали с использованием ЖЭХБ, колонки Mono S 5/5, элюировали буферами и NaCl-градиентом, как описано выше. Пиковые фракции из стадии Mono S 5/5 объединяли, уравновешивали 25 мМ Трис-Cl, pH 7,6, наносили на колонку Mono S 5/5 и элюировали градиентом NaCl от 0,0 до 0,4 м. Электрофорез в полиакриламидном геле с додецилсульфатом натрия фракций с пиковой оксалатоксидазной активностью показал наличие отчетливых белковых полос при окрашивании серебром на уровне примерно 25 и 38 - 40 килодальтон. Последующее фракционирование по размеру нативного белка на колонке для гельфильтрации Superose-12 (уравновешенной 50 мМ ацетата калия, pH 4,8) показало на ЖЭХБ хорошо выраженный пик активности, элюируемой в промежуток времени, соответствующий молекулярному весу примерно 25000. Никакой оксалатоксидазной активности не было обнаружено при элюировании в других фракциях, связанных с другим молекулярным весом. Второй метод включал применение детергантной экстракции, Корешки 4-7-дневных проростков ячменя измельчались в порошок в присутствии жидкого азота и сохранялись при -80oC. Хранение в этих условиях в результате не давало видимой потери активности. Сохраняемую ткань гомогенизировали в дистиллированной воде, содержащей 0,5% тауродезоксихолата натриевой соли, фильтровали и центрифугировали. Исследования на оксалатоксидазу двух фракций (супернатанта и осадка) показали, что обе фракции обладали активностью. Соответственно, осадок экстрагировали дистиллированной водой, содержащей 0,5% тауродезоксихолата. После истощающего диализа в дистиллированной воде добавляли сульфат аммония, чтобы сконцентрировать и фракционировать растворенную супернатантную пробу. Осажденные белки (фракции с 30 - 70% сульфата аммония) затем ресуспендировали в небольшом объеме дистиллированной воды, содержащей детергент, и обессоливали на небольшой гелевой проницаемой колонке (Sephadex 25). Активную фракцию пропускали через анионообменную колонку (ДЭАЭ), используя Трис-HCl, буфер pH 7,5, и элюирование связанного белка осуществляли, используя градиент хлорида натрия. Ферментативно активную фракцию концентрировали, обессоливали и затем пропускали через колонку Mono-Q (Phаrmacia). Затем опять использовали градиент хлорида натрия, чтобы элюировать белки. Определение активности показало, что оксалатоксидаза концентрировалась в 3 фракциях. При анализе этих фракций с помощью электрофореза в полиакриламидном геле с додецилсульфатом натрия было определено, что активность связана с полипептидом с молекулярным весом примерно 25 килодальтон. После очистки осуществлялось определение свойств очищенного гомогенного препарата оксалатоксидазы. Как уже указывалось и показано в табл. 1, свойства белка, полученные в результате этой очистки, явно отличаются от свойств, описанных в литературе. Это означает, что несмотря на попытки других опытных исследователей очистить оксалатоксидазный фермент, этого не случилось до настоящих работ заявителей, когда этот фермент был соответственно описан и идентифицирован через выяснение его физико-химических свойств. Результаты определения физико-химических свойств, предпринятого изобретателями, представлены в табл. 1. Для сравнения также представлены ранее изложенные в литературе характеристики фермента. Дальнейшее установление отличия фермента авторов изобретения, проявляющего оксалатоксидазную активность, можно увидеть в табл. 2. Как явно свидетельствует табл. 2, это изобретение устанавливает аминокислотное строение, отличное от сообщенного в литературе. Смотрите Chirihoga, J (1966) Archives of Biochemistry and Biophysies, 11b, 516 - 523. Частично очищенную оксалатоксидазу из корней проростков ячменя растворяли, подвергали катионообменной хроматографии с использованием колонки MonoS (25 мМ ацетат калия, pH 4,8 и элюировали градиентом хлорида калия от 0 до 4000 миллимолярного в том же самом буфере). Извлеченный энзиматически активный белок далее очищали препаративным электрофорезом в полиакриламидном геле с додецилсульфатом натрия. Определялась единственная полоса белка на уровне полосы с молекулярным весом примерно 25 килодальтон и затем вырезалась из геля. Влажные полоски геля измельчали, смешивали с адъювантом Фрейнда и вводили внутримышечно в заднюю часть бедренной мышцы ближе к пояснице кроликов. Кроликов повторно иммунизировали дополнительными количествами белка и проводили контроль проб крови, чтобы подтвердить образование противооксалатоксидазных специфических антител. Через примерно четыре месяца животных обескровливали. Полученные поликлональные кроличьи антитела имели очень высокий титр. Ген, кодирующий вырабатываемую ячменем оксалатоксидазу, имеющую структуру, показанную на фиг. 1, был клонирован, как показано на фиг. 4, с использованием библиотеки кДНК, полученной из корней ячменя. Вся РНК была получена из корня ячменя. Полиаденилированная РНК затем выделялась из общей РНК и использовалась для синтеза кДНК. Как общую, так и полиаленилированную РНК получали, используя коммерчески доступные наборы для выделения РНК и очистки мРНК в соответствии со стандартными инструкциями, приложенными к наборам (Pharmacia LKB Biotechrology Inc. ). Создание библиотеки было выполнено коммерчески (Clontech Laboratories). Вектором, выбранным для библиотеки, была лямбда gt 22. Использование этого вектора экспрессии было выбрано на основании высокого титра и специфичности оксалатоксидазной антисыворотки. Какой бы вектор экспрессии ни был выбран для использования при этой конверсии, выгодно, чтобы вектор позволял применение иммунологического определения белкового продукта оксалатоксидазных клонов ДНК. На основании среднего размера вставки в 1,8 килобаз для библиотеки кДНК и хорошего представительства, такого как число независимых клонов (1,7 Изучение этого фермента привело в результате не только к его идентификации, выделению и экспрессии, но также к определению его свойств и его клонированию, так что ген для экспрессии фермента в настоящее время уже существует и может быть интродуцирован в растения и экспрессирован в растениях, придавая им вследствие этого устойчивость к болезни, вызываемым грибами, у которых щавелевая кислота является угрожающим компонентом. Такая трансформация растений должна защищать трансформирование растения от повреждающего действия щавелевой кислоты, вызывающего заболевание. Еще более ценно будет то, что применение вышеупомянутых изобретений не ограничивается патогенезом растений. Еще одно преимущество этого изобретения состоит в интродукции оксалатоксидазного гена в растение, чтобы растение продуцировало щавелевую кислоту на низком уровне. Это могло бы быть особенно благоприятным для растений с высоким содержанием оксалатов, таких как арахис, свекла, шпинат, ревень, ячмень, какао и многие злаки. Смотрите, Libert and Franceschi (1987), J. Agric Food Chem. 35:926-938. Изобретение также имеет применение для широкомасштабного производства разрушающих оксалаты ферментов. Известна потребность в большом количестве разрушающих оксалат ферментов в ряде областей, включая потребность в их использовании в наборах для определения наличия и/или количестве щавелевой кислоты и для использования по деградации щавелевой кислоты, присутствующей в пищевых продуктах, и коммерческих технологических процессах. Например, микробная оксалатдекарбоксилаза использована в пивоваренном производстве (патент США N 4652452) и, как здесь показано, оксалат может также разрушаться при использовании оксалатоксидазы. Предметом настоящего изобретения является получение средств для разрушения щавелевой кислоты в растениях. В соответствии с настоящим изобретением получена кДНК, производимая из РНК, кодирующая фермент оксалатоксидазу и обладающая ДНК-последовательностью, представленной на фиг. 1, ее вариации, допускаемые дегенерацией генетического кода, и геномная ДНК, с которой гибридизуется вышеназванная кДНК. Изобретение, кроме того, представляет фермент, обладающий способностью разрушать оксалат, и характерный тем, что имеет единственную субъединицу размером примерно 25 килодальтон и, конкретно, по существу чистую оксалатоксидазу для использования при обработке растений, чтобы разрушить в них щавелевую кислоту, причем вышеназванная оксалатоксидаза имеет аминокислотную последовательность, показанную на фиг. 2, и характеризующуюся оптимумом pH 3,5, положительной тепловой стабильностью, единственной субъединицей размером примерно 25 килодальтон и устойчивостью к протеазам. Вышеназванная оксалатоксидаза может войти в состав рецептуры с агрохимически подходящим носителем для доставки вышеназванной оксалатоксидазы к растениям. Настоящее изобретение поэтому также представляет способ разрушения щавелевой кислоты в растении, включающий доставку к вышеназванному растению фермента, разрушающего щавелевую кислоту, так чтобы защитить вышеназванное растение от щавелевой кислоты. Предпочтительно, фермент является оксалатоксидазой. Доставка вышеназванного фермента, разрушающего щавелевую кислоту, может быть осуществлена нанесением на растение или на очаг поражения растения вышеназванного фермента в комбинации с агротехнически приемлемым носителем или, в качестве альтернативы, путем генетической трансформации генома растения с помощью гена, кодирующего вышеназванную оксалатоксидазу. Кроме того, изобретение представляет способ снижения содержания оксалата в ткани растения, состоящий в стабильном включении в геном растения гена, кодирующего фермент оксалатоксидазу, например, путем генетической трансформации. Подходящая генная конструкция для этой цели может включать промоторную последовательность, переходный пептид, структурную генную последовательность, кодирующую вышеназванный фермент оксалатоксидазу, и генную терминаторную последовательность. Следовательно, настоящее изобретение также представляет трансформированную растительную клетку, содержащую ген для экспрессии оксалатоксидазы. Вышеназванный ген может иметь последовательность такую, как на фиг. 1. Дополнительно, изобретение представляет собой способ борьбы с болезнями растений, вызванных инфицированием грибами, которые секретируют щавелевую кислоту, состоящий в стальном включении в геном вышеназванного растения путем трансформации гена, кодирующего оксалатоксидазу. Примерами родов грибов, которые секретируют щавелевую кислоту, являются: Selerotinia, Selerotium, Aspergillus, Streptomyces, Penicillium, Pythium, Paxillus, Myrena, Lencosfoma, Rhizoctonia, Whetzelinia and Schizophyllum. Одним из конкретных грибов, представляющих интерес с точки зрения этого изобретения, является Selerotinia Selerotorum, который инфицирует, например, подсолнечник (Helianthus annuns). Таким образом, в основном, настоящее изобретение широко направлено на понимание и определение применения разрушающего оксалат фермента, примером которого служит оксалатоксидаза, для коммерческого использования, такого как в пивоваренном производстве или в агротехнических целях, таких как снижение чувствительности растений к щавелевой кислоте или снижение концентрации эндогенной щавелевой кислоты в растении. Изобретатели пришли здесь к пониманию и объяснению, конкретно для агротехнического применения, что использование ферментов, разрушающих оксалаты, снижают гибель растений или разрушение от заболеваний или другой феномен, в которых щавелевая кислота играет решающую роль в инвазии. Изобретатели также поняли, что применение этого изобретения может привести в результате к предупреждению гибели растений и инфекции при заболеваниях, в которых щавелевая кислота играет решающую роль. Такие заболевания, в частности вызываются, среди прочих, грибами специфических родов, представленных здесь. Значение нового использования изобретателями разрушающих оксалат ферментов особенно повышается осознанием и открытием изобретателями, что физико-химические свойства оксалатоксидазы ячменя, сообщенные в литературе, неверны. Соответственно, изобретатели в значительной степени очистили и определили характеристики оксалатоксидазного фермента, ранее не описанные. Конечно, существенная очистка фермента, описание которой представлено в литературе, как здесь показано, неправильна. Конкретно, изобретатели раскрывают по существу чистую оксалатоксидазу, имеющую полный аминокислотный состав, показанный на фиг. 2, оптимум pH 3,5, нейтральную изоэлектрическую точку, положительную термостабильность, протеазную устойчивость и единственную субъединицу размером примерно 25 килодальтон. Здесь также представлено открытие в основном всех по существу чистых генов, кодирующих оксалатоксидазный фермент, с определенной последовательностью ДНК, показанной на фиг. 1. Ген кодирует оксалатоксидазный фермент, имеющий характеристики, представленные выше. В частности, ген кодирует фермент, проявляющий оксалатоксидазную активность, имеющий единственную субъединицу размером примерно 25 килодальтон, который специфично реагирует с антителами, индуцированными очищенной оксалатоксидазой ячменя, и имеет аминокислотную последовательность, показанную на фиг. 2. Изобретение также раскрывает вещества для применения в борьбе с патогенезом растений, вещества, которые включают химические соединения, проявляющие активность по разрушению щавелевой кислоты, в частности, оксалатоксидазную активность. Конкретно, вещество для обработки растений обладает оксалатоксидазной активностью на уровне, достаточном, чтобы разрушить щавелевую кислоту, продуцируемую возбудителями болезней. Будет понятно, что еще одним способом агротехнического использования такого вещества является соединение этих веществ с подходящим носителем, который приемлем агротехнически и дает возможность доставки этого вещества непосредственно к растению или в почву. Здесь также раскрывается растительная клетка, которая трансформирована геном, кодирующим экспрессию оксалатоксидазы или другого разрушающего оксалата фермента. Ген, кодирующий такой фермент, может включать последовательность ДНК, представленную на фиг. 1, которая по существу соответствует оксалатоксидазному ферменту, в значительной степени очищенному заявителями. Раскрывается способ обеспечения защиты от щавелевой кислоты растения, нуждающегося в этой защите. Способ включает доставку разрушающего щавелевую кислоту фермента в количестве достаточном, чтобы защитить растение от щавелевой кислоты к растению, нуждающемуся в такой защите. Предпочтительно, предполагается, что разрушающий щавелевую кислоту фермент, является оксалатоксидазой, кодируемой геном, имеющим структуру, показанную на фиг. 1, Методология обеспечения такой защиты может включать множество форм, включая трансформацию растения с помощью гена, кодирующего фермент, разрушающий щавелевую кислоту и, в частности, кодирующий оксалатоксидазу. И альтернативно, способ может включать получение фермента, разрушающего щавелевую кислоту в соединении с агротехнически приемлемым носителем для непосредственного нанесения на растение или внесения в почву, в которой растет растение. Очищенная оксалатоксидаза этого изобретения, ее применение в качестве средства борьбы с патогенезом и ее применение в трансформации растительной клетки представляют собой новаторский и уникальный подход к борьбе с болезнями растений, в которых щавелевая кислота играет роль ключевого компонента или в патогенезе, или на стадии заражения. Конечно, хорошо известно, что активность фермента оксалатоксидазы состоит в том, что он способствует разрушению щавелевой кислоты. Однако, только эти изобретатели были первыми, кто понял, что путем воздействия на щавелевую кислоту с ее химическим разрушением, например, ферментативной деградацией, можно получить в результате значительную агротехническую выгоду, придавая устойчивость к болезням, в которых щавелевая кислота играет решающую роль. Это изобретение имеет особые перспективы, так как главным бичом коммерческого возделывания агротехнически значимых растений, например, такой сельскохозяйственной культуры, как подсолнечник являются виды грибов, такие как Selerotinia, которые выделяют щавелевую кислоту. Преимущества авторского понимания изобретения могут быть воплощены или путем трансформации растений или путем применения оксалатоксидазы, как традиционного пестицида, наиболее вероятно в комбинации с подходящим носителем, который приемлем агротехнически. Одним из важных преимуществ при использовании оксалатоксидазы в качестве пестицида является то, что она экологически безвредна, не загрязняет и не повреждает растение. Если наружное применение фермента должно использоваться для защиты растения или части растения от возбудителя, нужно ожидать, что фермент будет растворяться (разбавляться) с получением жидкого раствора или суспензии, или смешиваться с твердым разбавителем, чтобы применяться в качестве дуста. Точный способ применения будет частично зависеть от конкретного возбудителя(лей) или целевых растений (намеченных к обработке). Детализированные способы адаптации основных методов применения для конкретных сельскохозяйственных культур и возбудителей можно найти в "Methods for evaluating pesticides for control of plant pathogens", K. D. Hieky, ed., The American Phytopathological Society, 1986. Вспомогательные вещества, которые могли бы быть добавлены в рецептуру, включают средства, способствующие солюбилизации, смачивающие вещества и стабилизаторы или средства, с помощью которых получался бы микроинкапсулированный продукт. Такие вспомогательные средства хорошо известны в данной области. При наружном применении могут также использоваться рекомбинантные микроорганизмы живые или превращенные в неживую форму способом, при котором не активируется фермент. Хотя, как сообщено в прототипах, оксалатоксидаза очищена и определены ее свойства, заявители открыли, что подобные литературные сообщения были неверны и что фермент, на самом деле, никогда не был очищен соответствующим образом и не были определены его характеристики. Будет понятно, что использованный здесь термин "оксалатоксидаза" относится к очищенной и охарактеризованной форме фермента, как представлено здесь, если нет других указаний. Различия между существующими в литературе сообщениями и очищенным и охарактеризованным ферментом настоящего изобретения представлены здесь в деталях и могут быть сжато собраны в табл. 1. Загрязненность коммерчески доступных оксалатоксидазных препаратов, так же как неправильное определение характеристик фермента и в литературе стали очевидны, когда изобретатели впервые очистили оксалатоксидазу из корней сеянцев ячменя. Использовали два метода. В одном примере очистка оксалатоксидазы из корней сеянцев ячменя включала гомогенизацию заморенной ткани с от 1 до 4 объемами воды и очистку из водного экстракта после фильтрации через марлю, чтобы удалить остатки. Раствор далее очищали центрифугированием при 18000g в течение 30 минут после тепловой обработки при 80oC в течение 3 минут, причем осадки на обоих стадиях отбрасывались; осадок протеина из супернатанта, получаемый при насыщении его сульфатом аммония (NH4)2SO4 до концентрации от 30% до 70% отделяли центрифугированием и диализировали в воду. Белок, полученный на стадии осаждения сульфатом аммония, снова растворенный фракционировали путем жидкостной экспресс-хроматографии белков ЖЭХБ используя колонку Mono S 10/10, уравновешенную 25 мМ ацетатом калия pH 4,8, элюировали градиентом NaCl от 0,0 до 0,4 М в том же самом буфере. Оксалатоксидазную активность определяли методом Sugiura et al. (1979). Chem. Pharm. Bull 27 (9): 2003. Пиковые фракции оксалатоксидазной активности объединяли, уравновешивали низкосолевым калийацетатным буфером pH 4,8 и повторно хроматографировали с использованием ЖЭХБ, колонки Mono S 5/5, элюировали буферами и NaCl-градиентом, как описано выше. Пиковые фракции из стадии Mono S 5/5 объединяли, уравновешивали 25 мМ Трис-Cl, pH 7,6, наносили на колонку Mono S 5/5 и элюировали градиентом NaCl от 0,0 до 0,4 м. Электрофорез в полиакриламидном геле с додецилсульфатом натрия фракций с пиковой оксалатоксидазной активностью показал наличие отчетливых белковых полос при окрашивании серебром на уровне примерно 25 и 38 - 40 килодальтон. Последующее фракционирование по размеру нативного белка на колонке для гельфильтрации Superose-12 (уравновешенной 50 мМ ацетата калия, pH 4,8) показало на ЖЭХБ хорошо выраженный пик активности, элюируемой в промежуток времени, соответствующий молекулярному весу примерно 25000. Никакой оксалатоксидазной активности не было обнаружено при элюировании в других фракциях, связанных с другим молекулярным весом. Второй метод включал применение детергантной экстракции, Корешки 4-7-дневных проростков ячменя измельчались в порошок в присутствии жидкого азота и сохранялись при -80oC. Хранение в этих условиях в результате не давало видимой потери активности. Сохраняемую ткань гомогенизировали в дистиллированной воде, содержащей 0,5% тауродезоксихолата натриевой соли, фильтровали и центрифугировали. Исследования на оксалатоксидазу двух фракций (супернатанта и осадка) показали, что обе фракции обладали активностью. Соответственно, осадок экстрагировали дистиллированной водой, содержащей 0,5% тауродезоксихолата. После истощающего диализа в дистиллированной воде добавляли сульфат аммония, чтобы сконцентрировать и фракционировать растворенную супернатантную пробу. Осажденные белки (фракции с 30 - 70% сульфата аммония) затем ресуспендировали в небольшом объеме дистиллированной воды, содержащей детергент, и обессоливали на небольшой гелевой проницаемой колонке (Sephadex 25). Активную фракцию пропускали через анионообменную колонку (ДЭАЭ), используя Трис-HCl, буфер pH 7,5, и элюирование связанного белка осуществляли, используя градиент хлорида натрия. Ферментативно активную фракцию концентрировали, обессоливали и затем пропускали через колонку Mono-Q (Phаrmacia). Затем опять использовали градиент хлорида натрия, чтобы элюировать белки. Определение активности показало, что оксалатоксидаза концентрировалась в 3 фракциях. При анализе этих фракций с помощью электрофореза в полиакриламидном геле с додецилсульфатом натрия было определено, что активность связана с полипептидом с молекулярным весом примерно 25 килодальтон. После очистки осуществлялось определение свойств очищенного гомогенного препарата оксалатоксидазы. Как уже указывалось и показано в табл. 1, свойства белка, полученные в результате этой очистки, явно отличаются от свойств, описанных в литературе. Это означает, что несмотря на попытки других опытных исследователей очистить оксалатоксидазный фермент, этого не случилось до настоящих работ заявителей, когда этот фермент был соответственно описан и идентифицирован через выяснение его физико-химических свойств. Результаты определения физико-химических свойств, предпринятого изобретателями, представлены в табл. 1. Для сравнения также представлены ранее изложенные в литературе характеристики фермента. Дальнейшее установление отличия фермента авторов изобретения, проявляющего оксалатоксидазную активность, можно увидеть в табл. 2. Как явно свидетельствует табл. 2, это изобретение устанавливает аминокислотное строение, отличное от сообщенного в литературе. Смотрите Chirihoga, J (1966) Archives of Biochemistry and Biophysies, 11b, 516 - 523. Частично очищенную оксалатоксидазу из корней проростков ячменя растворяли, подвергали катионообменной хроматографии с использованием колонки MonoS (25 мМ ацетат калия, pH 4,8 и элюировали градиентом хлорида калия от 0 до 4000 миллимолярного в том же самом буфере). Извлеченный энзиматически активный белок далее очищали препаративным электрофорезом в полиакриламидном геле с додецилсульфатом натрия. Определялась единственная полоса белка на уровне полосы с молекулярным весом примерно 25 килодальтон и затем вырезалась из геля. Влажные полоски геля измельчали, смешивали с адъювантом Фрейнда и вводили внутримышечно в заднюю часть бедренной мышцы ближе к пояснице кроликов. Кроликов повторно иммунизировали дополнительными количествами белка и проводили контроль проб крови, чтобы подтвердить образование противооксалатоксидазных специфических антител. Через примерно четыре месяца животных обескровливали. Полученные поликлональные кроличьи антитела имели очень высокий титр. Ген, кодирующий вырабатываемую ячменем оксалатоксидазу, имеющую структуру, показанную на фиг. 1, был клонирован, как показано на фиг. 4, с использованием библиотеки кДНК, полученной из корней ячменя. Вся РНК была получена из корня ячменя. Полиаденилированная РНК затем выделялась из общей РНК и использовалась для синтеза кДНК. Как общую, так и полиаленилированную РНК получали, используя коммерчески доступные наборы для выделения РНК и очистки мРНК в соответствии со стандартными инструкциями, приложенными к наборам (Pharmacia LKB Biotechrology Inc. ). Создание библиотеки было выполнено коммерчески (Clontech Laboratories). Вектором, выбранным для библиотеки, была лямбда gt 22. Использование этого вектора экспрессии было выбрано на основании высокого титра и специфичности оксалатоксидазной антисыворотки. Какой бы вектор экспрессии ни был выбран для использования при этой конверсии, выгодно, чтобы вектор позволял применение иммунологического определения белкового продукта оксалатоксидазных клонов ДНК. На основании среднего размера вставки в 1,8 килобаз для библиотеки кДНК и хорошего представительства, такого как число независимых клонов (1,7 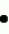 106), было выведено заключение, что библиотека должна содержать клон кДНК для оксалатоксидазного белка размером примерно 25 килодальтон. Первоначальный отбор из библиотеки выполнялся с помощью антисыворотки к оксалатоксидазе в соответствии со стандартными методиками, такими как? например, представленные у Huynh, T., et al., (1985) DNA Cloning Technigues: A Practikal Approach, D. Glover, ed. IRL Press, Oxford. Так как была получена информация по N-концевой аминокислотной последовательности зрелого оксалатоксидазного белка (за исключением N-концевого остатка), N-концевая последовательность была также использована для подтверждения идентичности любых клонов кДНК, определенных как положительные при первоначальном иммунологическом отборе. С помощью антисыворотки были просмотрены 1,2 106), было выведено заключение, что библиотека должна содержать клон кДНК для оксалатоксидазного белка размером примерно 25 килодальтон. Первоначальный отбор из библиотеки выполнялся с помощью антисыворотки к оксалатоксидазе в соответствии со стандартными методиками, такими как? например, представленные у Huynh, T., et al., (1985) DNA Cloning Technigues: A Practikal Approach, D. Glover, ed. IRL Press, Oxford. Так как была получена информация по N-концевой аминокислотной последовательности зрелого оксалатоксидазного белка (за исключением N-концевого остатка), N-концевая последовательность была также использована для подтверждения идентичности любых клонов кДНК, определенных как положительные при первоначальном иммунологическом отборе. С помощью антисыворотки были просмотрены 1,2  106 бляшек из библиотеки кДНК. Было получено четырнадцать потенциально положительных сигналов, один из которых был значительно сильнее, чем другие. Два последовательных цикла повторного отбора с помощью антисыворотки было выполнено для этих четырнадцати клонов, чтобы получить подтвержденные положительные изоляты из одной бляшки, которые должны быть охарактеризованы на молекулярном уровне. Бляшка номер 12 была затем использована для выделения и очистки оксалатоксидазных антител, в качестве показателя специфичности бляшечного сигнала, по стандартной методике, как описано, например у Huynh, T. et al., выше. Очищенные антитела из бляшки 12 были использованы как проба в Вестерн-блоттинге акриламидного геля с оксалатоксидазным белком. Бляшечные очищенные антитела специфично реагировали с оксалатоксидазной, демонстрируя картину, идентичную наблюдаемой с очищенными антителами в качестве пробы. Вставка (кДНК-продукт, клонированный в вектор лямбда 22) из бляшки 12 извлекали, используя стандартные методы полимеразной цепной реакции (ПЦР), примеры которой представлены у Ansnbel, F.M. et al., eds., (1988)> "The Polymerase Chain Reaetion", in Current Protorols in Molecnlar Biology, Greene Publishing Associates and Wiley Interscience, New VorK, pp. 15.01-15.4.6. Вставка в бляшке номер 12, как установлено, состоит из 650-750 пар оснований. Размер вставки в бляшке 12 соответствует белку размером примерно 25 кв. На основании первоначальной оценки размера вставки кДНК и результатов очистки антител из бляшки, бляшка номер 12 считалась наилучшим кандидатом для дальнейшего молекулярного анализа. Вставка номер 12, полученная PCR, была затем повторно клонирована в плазмидный вектор более подходящий для анализа. Вставка кДНК из клона 12 была также использована в качестве пробы в Назерн-блоттинге РНК корней ячменя, чтобы установить размер мРНК для оксалатоксидазы. Электрофорез в формальдегидном геле и перенос на нейлоновую мембрану проводились в соответствии с методиками, рекомендованными коммерческим поставщиком мембран Schleicher and Scbuell. Проба номер 12 гибридизовалась с единственным видом мРНК примерно длиной в 800-850 оснований. Дидезоксинуклеотидное секвенирование выполнялось на повторно клонированной вставке из бляшки 12. Были использованы коммерчески доступный набор для секвенирования Т7 (Pharmaria LKB Broteahrology Inc) и рекомендуемые производителем методики. Было определено, что вставка из корней ячменя имеет длину примерно в 690 оснований с некоторой неопределенностью в двух небольших областях, включающих не более 10 пар оснований каждая, C- конец и идентичность трех N-концевых оснований. Нуклеотидная последовательность вставки клона 12 схематически показана на фиг. 1. Затем была предсказана частичная белковая последовательность, исходя из нуклеотидной последовательности клона 12, и проведено сравнение с N-концевой аминокислотой последовательностью, полученной непосредственно из очищенной оксалатоксидазы. Это сравнение показано на фиг. 3. Ген, имеющий структуру, показанную на фиг.1, содержащий колирующую последовательность для зрелого оксалатоксидазного фермента должен быть связан с генетическими регуляторными элементами, которые необходимы для экспрессии структурного гена в определенной клетке-хозяине. Первым типом необходимого регуляторного элемента является генная промоторная область, которая содержит последовательности ДНК, распознаваемые биологическим механизмом растительной клетки и которая вызывает транскрипцию последовательности ДНК на информационную РНК (мРНК). Затем мРНК транслируется в коды продукции белков структурной генной областью. Промотор присоединяется перед или в 5" к гену оксалатоксидазы, что может быть выполнено известными стандартными методами. Смотрите, например, T. Maniatig, et. al., (1982) Molecular Cloning, Cold Spring Harbor Laborafory, New YorK, pp. 104-106. Промоторные области, которые могли бы быть использованы для экспрессии оксалатоксидазного гена в растительных клетках, включают промоторы, которые активны в широком ряде различных растительных тканей. Например, для этой цели может подойти промотор 35 S из вируса мозаики цветной капусты. Другим типом промотора, который мог бы использоваться в растительных клетках, является промотор, который экспрессирует в более ограничивающих условиях. В этот класс должны быть включены промоторы, активные только в определенных тканях растений и/или активность которых вызывается определенными стимулами, подобными повреждениям. Примером этого рода промоторов вероятно является 5"-регуляторная область из гена фенилаланинаммонийлиазы (PAL). Этот тип промотора обсуждается у Liang, X. et al. , (1989). PNAS, USA, 8:9284-9288. Экспрессия оксалатоксидазного гена в микробных хозяевах могла бы быть достигнута путем использования промоторов, полученных из микробных источников. Примеры таких промоторов должны включать trp - промотор для экспрессии в бактериях, таких как E. soli, как приведено у Amann E.et al., (1983) Gene, 25: 167-178 или промотор глицеральдегидфосфатдегидрогеназы (GAPD) для экспрессии в дрожжах, как приведено у Edens, L. et al., (1984), "Synthesis and Droressing of the Plant Protein Thanmatin in Geaost", Cell 37:629-633. Генные промоторные последовательности могут также быть получены частично или полностью из промоторных последовательностей, обнаруженных в клетках, отличных от клеток-хозяев, постольку, поскольку они удовлетворяют вышеприведенным критериям для транскрипции и трансляции. Вторым генетическим регуляторным элементом, присутствие которого могло бы быть желательно, но необязательно, примыкающим к оксалатоксидазному гену, является терминаторная последовательность или последовательность полиаденилирования, которая стимулирует эффективное прекращение транскрипции гена и у эукариот также способствует полиаденилированию, т.е. добавлению какого-то числа аденозиновых нуклеотидов на 3"-конце мРНК. Стандартные методы, известные в данной области, могут быть использованы для присоединения терминаторной области после или 3" к гену (cм., например, T. Maniatis, et al, выше, pp. 104-106). Примером такой последовательности терминаторной/ полиоденилирования для экспрессии в растениях была бы последовательность из октопинсинтетазного гена из Agrobacterium tume (facien) плазмиды Ti, как сообщили H. De Greve et al., (1982), "Nucleotide Seguen and tronscript map of the Agrobacterium tumefaciens Ti plasmid octopin synthase gene", J. Mol Appl. Genet. , 1, 499-511. Примером такого терминатора для экспрессии в микробных хозяевах является rho - независимая транскрипционная терминаторная последовательность из Salmonella typhimurium. См. , например. M.E.Winkler (1987), "Escherichia coli and Salmonella typhimurium: Cellular and Molecular Biology", F.C.Neibhardt, ed-in-chief; American Society for Microbiology. Генные терминаторые последовательности могут также быть получены частично или полностью из терминаторных последовательностей, обнаруженных в клетках, отличных от клеток-хозяев, постольку, поскольку они соответствуют вышеприведенным критериям для терминации транскрипции и полиаденилирования, необходимых для клетки-хозяина. Еще одним типом регуляторного элемента, который может быть присоединен к гену оксалатоксидазы, является последовательность ДНК, кодирующая сигнальный пептид. Сигнальный пептид присоединяется к амино-концу белка и дает возможность белку быть локализованным на клеточной стенке или секретироваться из клетки-хозяина. Во время процесса этой локализации сигнальный пептид отщепляется, предоставляя протеиновый продукт с последовательностью зрелого протеина. Последовательность ДНК для сигнального пептида встраивается между промоторной и кодирующей областью. Чтобы присоединить последовательность ДНК для сигнального пептида, могут быть использованы стандартные методы, известные в данной области (см., например, Maniatis, T., et al., выше, pp. 104-106). Примеры таких сигнальных последовательностей включали бы сигнальный пептид из гена-усилителя растений (hen, J. and Varner, J.E., anextracellular matrix protein in plants: characterization of a genjmic clone for carrat extension", EMBO J 4:2145-2151, 1985), из бактериального peIB (пектатлиазного) гена Erminia carotovora (Lei, S.P.et al., (1987), J. Bacteriol. 169, 4379) и из перпро-фактора дрожжей (Smith, R.A.,et al., Science 229: 1219-1229, 1985). Сигнальные пептидные последовательности могут быть получены полностью или частично из терминаторных последовательностей, обнаруженных к клетках, отличных от клетки-хозяина постольку, поскольку они отвечают вышеперечисленным критериям для процессинга и локализации протеина в клетке-хозяине. Для встраивания оксалатоксидазного гена в растение-хозяин мог бы использоваться любой из известных разнообразных методов введения чужеродных генов в растения. Методология для выполнения трансформации растений с помощью оксалатоксидазного гена должна меняться в зависимости от растения-хозяина. В качестве примера, для трансформации растений оксалатоксидазным геном была бы применима хорошо отработанная методология трансформации, опосредованной Agrobacterium. Опосредованная Agrobacterium трансформация с использованием оксадатоксидазного гена проводится по методике, хорошо известной в этой методологии. Прежде всего, генный кластер, пригодный для экспрессии в растениях, вводится в обезоруженный штамм Agrobacterium tumefariens, как промежуточный хозяин. Кластер оксалатоксидазного гена вводится в область Т-ДНК рекомбинантной плазмиды, содержащей маркерный ген, дающий возможность селекции, такой как ген, кодирующий неомициновую фосфотрансферазу II, фосфинотрицинацетилтрансферазу или тому подобное. Эта методология представлена во многих литературных публикациях, включая Horsch, et al., (1985), "A Simple and General Method for Transferring Genes Info Plants", Science 227:1229 - 1231. Частички растительной ткани, например листа, семядоли или подсемядольного колена, инкубировали вместе с бактериями в течение 2 - 3 дней перед тем как бактерии убивали, используя антибиотики, такие как карбенициллин. Дополнительные антибиотики, соответствующие использованным селектируемым маркерным генам, вводятся в среду культивирования растительной ткани, так что будут расти только трансформированные клетки. Растения, регенерированные из трансформированных клеток, затем испытываются на наличие и экспрессию оксалатоксидазного гена. Чтобы идентифицировать отдельные трансформанты, могут быть использованы иммуноисследования и определение оксалатоксидазной активности. В качестве функциональной пробы на интактные ткани может также использоваться толерантность к экзогенной щавелевой кислоте. Как отмечено, для трансформации растений существует несколько других методологий, кроме трансформации с Agrobacterium. Примеры таких других методов доставки ДНК включают электропорацию, т.е. химически индуцируемую доставку в протопласты, микроинъецирование, биолостикс, а также другие. Примером типа растений, который не особенно пригоден для опосредуемой Agrobacterium трансформации, является соя и определенные злаки, включая кукурузу. Очевидно, что для этих растений успех был бы получен при попытках трансформации растений с использованием других методологий, а не опосредованной Agrobacterium трансформации. Фиг.1 показывает последовательность кДНК, произведенную обратно из мРНК, кодирующей оксалатоксидазу проростков ячменя; фиг. 2 показывает аминокислотную последовательность, транслируемую с кДНК, показанной на фиг. 1; фиг. 3 показывает на диаграмме стратегию клонирования, использованную, чтобы клонировать ген оксалатоксидазы, и описанную детально в примерах 1 и 2; фиг. 4 показывает на диаграмме стратегию клонирования, описанную в примерах 3 и 4; фиг. 5 показывает структуру плазмиды pVBI; фиг. 6 показывает структуру плазмиды pBin19; фиг. 7 показывает структуру плазмиды p19HygA. Изобретение иллюстрируется следующими примерами. Пример 1. Создание оксалатоксидазного вектора не-секреции для трансформации томатов. (а) Воссоздание открытой рамки считывания полной длины оксалатоксиазы (ORF). Олигонуклеотиды 1219901A и 1219901A (компл.) были запрограммированы и синтезированы, чтобы создать линкер с Hind III сайтом на 5"-конце и BsaI сайтом на 3"-конце (см. схему в конце описания). Олигонуклеотиды ренатурировали и клонировали в клон # 22, вырезали с помощью Hind III и частично с BSAI, чтобы получить клон pOXOXI, содержащий зрелую оксалатоксидазную ORF, как показало пептидное секвенирование. После клонирования Hind III/BsaI, связанного с # 22, целостность зрелой оксалатоксидазной OPC была подтверждена секвенированием ДНК. (б) Встройка оксалатоксидазной ORF - в вектор экспрессии. Зрелая оксалатоксидазу кодирующая область была выделена из агарозы как фрагмент 700 bp Hind III/BamHI и концы превращали в тупые с помощью Т4ДНК-полимеразы. pNB33A разрезалась с помощью XbaI и PstI, векторный фрагмент выделялся из агарозы и концы превращали в тупые с помощью Т4-полимеразы. Эти два фрагмента с тупыми концами сшивали вместе, чтобы получить клон pNBOXOXI. Правильная ориентация оксалатоксидазной кодирующей области в pNBOXOXI подтверждалась секвенированием ДНК. (B) Перенос кластера экспрессии оксалатоксидазы в pBin19Ri. pBNOXOXI разрезали с помощью Hind III и частично с помощью EcoRI. Кластер экспрессии размером 1,9 кв выделялся из агарозы и клонировался в pBin19Ri (фигура 6), разрезался с помощью EcoRI и Hind III, чтобы получить клон pNOXI. Наличие кластера экспрессии оксалатоксидазы в клоне pNOXI подтверждалось путем рестрикции плазмидной ДНК с помощью EcoRI и Hind III. Пример 2. Создание вектора не-секреции оксалатоксидазы для трансформации подсолнечника. (а) Перенос кластера экспрессии оксалатоксидазы в pvBI. Фрагмент 2,1 кв EcoRI/Hind III, содержащий кластер экспрессии оксалатоксидазы, выделенный из pNOXOXI, описанный в примере 1 выше, клонировали в pvBI (фигура 5), разрезали с помощью EcoRI и Hind III, чтобы получить клон pvBOXI. Наличие кластера экспрессии оксалатоксидазы в клоне pvBOXI подтверждалось рестрикцией плазмидной ДНК с помощью EcoRI и Hind III. (б) Встройка гена устойчивости к гигромицину в pvBOXI. Фрагмент Hind III размером 2,3 кв, содержащий кластер устойчивости к гигромицину, выделяли из p19HYG и клонировали в pvBOXI, разрезали с Hind III, чтобы получить клон pHOXI. Наличие и ориентация гигромицинового кластера в клоне pHOXI подтверждались путем разрезания плазмидной ДНК с помощью EcoRI. Пример 3. Создание вектора секреции оксалатоксидазы для трансформации томатов. (а) Получение слияния вставочного переходного пептида/оксалатоксдазы с помощью ПЦР. Чтобы получить слияние зрелой оксалатоксидазы с вставочным переходным пептидом были запрограммированы и синтезированы олигонуклеотиды EXTOX-5 и EXTOX-3 (см. схему в конце описания). Олигонуклеотиды были использованы как праймеры ПЦР с pNBOXI в качестве матрицы. Полученный в результате ПЦР продукт 771 вр EXTOX, содержащий 23 аминокислоты вставочный переходный пептид слитый в рамке с областью, кодирующей зрелую оксалатоксидазу вырезался с помощью KpnI. (б) Встраивание продукта ПЦР EXTOX в pJRI (PUC). Разрезанный KpnI продукт ПЦР EXTOX, описанный выше, был клонирован в pJRI (pUC), разрезался KpnI, чтобы получить клон pJEXTOXI. Ориентация последовательности продукта ПЦР EXTOX в pJEXTOXI подтверждалась путем секвенирования ДНК. (в) перенос кластера экспрессии EXTOX в pBin19i. Кластер экспрессии вставки/оксалатоксидазы был выделен из pJEXTOXI как фрагмент EcoRI/Hind III размером 1,5 кв и клонирован в pBin19, разрезали EcoRI и Hind III, чтобы получить клон pNEXTOXI. Наличие кластера экспрессии в pNEXTOXI подтверждалось резанием плазмидной ДНК с помощью EcoRI и Hind III. Пример 4. Создание вектора секреции оксалатоксидазы для трансформации подсолнечника. (а) Выделение кластера экспрессии секреции и встраивание в pvBI. Кластер экспрессии вставки/оксалатоксидазы был выделен из pNEXTOXI как фрагмент EcoRI/Hind III размером 1,5 кв и клонирован в pvBI, разрезался с помощью EcoRI и Hind III, чтобы получить клон pVEXTOXI. Присутствие кластера экспрессии в pVEXTOXI подтверждалось путем разрезания плазмидной ДНК с помощью EcoRI и Hind III. (б) Встраивание гена устойчивости к гигромицину в pVEXTOXI. Фрагмент Hind III размером 2,3 кв, содержащий кластер устойчивости к гигромицину, был выделен из p19HYG и клонирован в pVEXTOXI, разрезался с помощью Hind III, чтобы получить клон pHEXTOXI. Присутствие и ориентация гигромицинового кластера в клоне pHEXTOXI подтверждались путем разрезания плазмидной ДНК с помощью EcoRI. 106 бляшек из библиотеки кДНК. Было получено четырнадцать потенциально положительных сигналов, один из которых был значительно сильнее, чем другие. Два последовательных цикла повторного отбора с помощью антисыворотки было выполнено для этих четырнадцати клонов, чтобы получить подтвержденные положительные изоляты из одной бляшки, которые должны быть охарактеризованы на молекулярном уровне. Бляшка номер 12 была затем использована для выделения и очистки оксалатоксидазных антител, в качестве показателя специфичности бляшечного сигнала, по стандартной методике, как описано, например у Huynh, T. et al., выше. Очищенные антитела из бляшки 12 были использованы как проба в Вестерн-блоттинге акриламидного геля с оксалатоксидазным белком. Бляшечные очищенные антитела специфично реагировали с оксалатоксидазной, демонстрируя картину, идентичную наблюдаемой с очищенными антителами в качестве пробы. Вставка (кДНК-продукт, клонированный в вектор лямбда 22) из бляшки 12 извлекали, используя стандартные методы полимеразной цепной реакции (ПЦР), примеры которой представлены у Ansnbel, F.M. et al., eds., (1988)> "The Polymerase Chain Reaetion", in Current Protorols in Molecnlar Biology, Greene Publishing Associates and Wiley Interscience, New VorK, pp. 15.01-15.4.6. Вставка в бляшке номер 12, как установлено, состоит из 650-750 пар оснований. Размер вставки в бляшке 12 соответствует белку размером примерно 25 кв. На основании первоначальной оценки размера вставки кДНК и результатов очистки антител из бляшки, бляшка номер 12 считалась наилучшим кандидатом для дальнейшего молекулярного анализа. Вставка номер 12, полученная PCR, была затем повторно клонирована в плазмидный вектор более подходящий для анализа. Вставка кДНК из клона 12 была также использована в качестве пробы в Назерн-блоттинге РНК корней ячменя, чтобы установить размер мРНК для оксалатоксидазы. Электрофорез в формальдегидном геле и перенос на нейлоновую мембрану проводились в соответствии с методиками, рекомендованными коммерческим поставщиком мембран Schleicher and Scbuell. Проба номер 12 гибридизовалась с единственным видом мРНК примерно длиной в 800-850 оснований. Дидезоксинуклеотидное секвенирование выполнялось на повторно клонированной вставке из бляшки 12. Были использованы коммерчески доступный набор для секвенирования Т7 (Pharmaria LKB Broteahrology Inc) и рекомендуемые производителем методики. Было определено, что вставка из корней ячменя имеет длину примерно в 690 оснований с некоторой неопределенностью в двух небольших областях, включающих не более 10 пар оснований каждая, C- конец и идентичность трех N-концевых оснований. Нуклеотидная последовательность вставки клона 12 схематически показана на фиг. 1. Затем была предсказана частичная белковая последовательность, исходя из нуклеотидной последовательности клона 12, и проведено сравнение с N-концевой аминокислотой последовательностью, полученной непосредственно из очищенной оксалатоксидазы. Это сравнение показано на фиг. 3. Ген, имеющий структуру, показанную на фиг.1, содержащий колирующую последовательность для зрелого оксалатоксидазного фермента должен быть связан с генетическими регуляторными элементами, которые необходимы для экспрессии структурного гена в определенной клетке-хозяине. Первым типом необходимого регуляторного элемента является генная промоторная область, которая содержит последовательности ДНК, распознаваемые биологическим механизмом растительной клетки и которая вызывает транскрипцию последовательности ДНК на информационную РНК (мРНК). Затем мРНК транслируется в коды продукции белков структурной генной областью. Промотор присоединяется перед или в 5" к гену оксалатоксидазы, что может быть выполнено известными стандартными методами. Смотрите, например, T. Maniatig, et. al., (1982) Molecular Cloning, Cold Spring Harbor Laborafory, New YorK, pp. 104-106. Промоторные области, которые могли бы быть использованы для экспрессии оксалатоксидазного гена в растительных клетках, включают промоторы, которые активны в широком ряде различных растительных тканей. Например, для этой цели может подойти промотор 35 S из вируса мозаики цветной капусты. Другим типом промотора, который мог бы использоваться в растительных клетках, является промотор, который экспрессирует в более ограничивающих условиях. В этот класс должны быть включены промоторы, активные только в определенных тканях растений и/или активность которых вызывается определенными стимулами, подобными повреждениям. Примером этого рода промоторов вероятно является 5"-регуляторная область из гена фенилаланинаммонийлиазы (PAL). Этот тип промотора обсуждается у Liang, X. et al. , (1989). PNAS, USA, 8:9284-9288. Экспрессия оксалатоксидазного гена в микробных хозяевах могла бы быть достигнута путем использования промоторов, полученных из микробных источников. Примеры таких промоторов должны включать trp - промотор для экспрессии в бактериях, таких как E. soli, как приведено у Amann E.et al., (1983) Gene, 25: 167-178 или промотор глицеральдегидфосфатдегидрогеназы (GAPD) для экспрессии в дрожжах, как приведено у Edens, L. et al., (1984), "Synthesis and Droressing of the Plant Protein Thanmatin in Geaost", Cell 37:629-633. Генные промоторные последовательности могут также быть получены частично или полностью из промоторных последовательностей, обнаруженных в клетках, отличных от клеток-хозяев, постольку, поскольку они удовлетворяют вышеприведенным критериям для транскрипции и трансляции. Вторым генетическим регуляторным элементом, присутствие которого могло бы быть желательно, но необязательно, примыкающим к оксалатоксидазному гену, является терминаторная последовательность или последовательность полиаденилирования, которая стимулирует эффективное прекращение транскрипции гена и у эукариот также способствует полиаденилированию, т.е. добавлению какого-то числа аденозиновых нуклеотидов на 3"-конце мРНК. Стандартные методы, известные в данной области, могут быть использованы для присоединения терминаторной области после или 3" к гену (cм., например, T. Maniatis, et al, выше, pp. 104-106). Примером такой последовательности терминаторной/ полиоденилирования для экспрессии в растениях была бы последовательность из октопинсинтетазного гена из Agrobacterium tume (facien) плазмиды Ti, как сообщили H. De Greve et al., (1982), "Nucleotide Seguen and tronscript map of the Agrobacterium tumefaciens Ti plasmid octopin synthase gene", J. Mol Appl. Genet. , 1, 499-511. Примером такого терминатора для экспрессии в микробных хозяевах является rho - независимая транскрипционная терминаторная последовательность из Salmonella typhimurium. См. , например. M.E.Winkler (1987), "Escherichia coli and Salmonella typhimurium: Cellular and Molecular Biology", F.C.Neibhardt, ed-in-chief; American Society for Microbiology. Генные терминаторые последовательности могут также быть получены частично или полностью из терминаторных последовательностей, обнаруженных в клетках, отличных от клеток-хозяев, постольку, поскольку они соответствуют вышеприведенным критериям для терминации транскрипции и полиаденилирования, необходимых для клетки-хозяина. Еще одним типом регуляторного элемента, который может быть присоединен к гену оксалатоксидазы, является последовательность ДНК, кодирующая сигнальный пептид. Сигнальный пептид присоединяется к амино-концу белка и дает возможность белку быть локализованным на клеточной стенке или секретироваться из клетки-хозяина. Во время процесса этой локализации сигнальный пептид отщепляется, предоставляя протеиновый продукт с последовательностью зрелого протеина. Последовательность ДНК для сигнального пептида встраивается между промоторной и кодирующей областью. Чтобы присоединить последовательность ДНК для сигнального пептида, могут быть использованы стандартные методы, известные в данной области (см., например, Maniatis, T., et al., выше, pp. 104-106). Примеры таких сигнальных последовательностей включали бы сигнальный пептид из гена-усилителя растений (hen, J. and Varner, J.E., anextracellular matrix protein in plants: characterization of a genjmic clone for carrat extension", EMBO J 4:2145-2151, 1985), из бактериального peIB (пектатлиазного) гена Erminia carotovora (Lei, S.P.et al., (1987), J. Bacteriol. 169, 4379) и из перпро-фактора дрожжей (Smith, R.A.,et al., Science 229: 1219-1229, 1985). Сигнальные пептидные последовательности могут быть получены полностью или частично из терминаторных последовательностей, обнаруженных к клетках, отличных от клетки-хозяина постольку, поскольку они отвечают вышеперечисленным критериям для процессинга и локализации протеина в клетке-хозяине. Для встраивания оксалатоксидазного гена в растение-хозяин мог бы использоваться любой из известных разнообразных методов введения чужеродных генов в растения. Методология для выполнения трансформации растений с помощью оксалатоксидазного гена должна меняться в зависимости от растения-хозяина. В качестве примера, для трансформации растений оксалатоксидазным геном была бы применима хорошо отработанная методология трансформации, опосредованной Agrobacterium. Опосредованная Agrobacterium трансформация с использованием оксадатоксидазного гена проводится по методике, хорошо известной в этой методологии. Прежде всего, генный кластер, пригодный для экспрессии в растениях, вводится в обезоруженный штамм Agrobacterium tumefariens, как промежуточный хозяин. Кластер оксалатоксидазного гена вводится в область Т-ДНК рекомбинантной плазмиды, содержащей маркерный ген, дающий возможность селекции, такой как ген, кодирующий неомициновую фосфотрансферазу II, фосфинотрицинацетилтрансферазу или тому подобное. Эта методология представлена во многих литературных публикациях, включая Horsch, et al., (1985), "A Simple and General Method for Transferring Genes Info Plants", Science 227:1229 - 1231. Частички растительной ткани, например листа, семядоли или подсемядольного колена, инкубировали вместе с бактериями в течение 2 - 3 дней перед тем как бактерии убивали, используя антибиотики, такие как карбенициллин. Дополнительные антибиотики, соответствующие использованным селектируемым маркерным генам, вводятся в среду культивирования растительной ткани, так что будут расти только трансформированные клетки. Растения, регенерированные из трансформированных клеток, затем испытываются на наличие и экспрессию оксалатоксидазного гена. Чтобы идентифицировать отдельные трансформанты, могут быть использованы иммуноисследования и определение оксалатоксидазной активности. В качестве функциональной пробы на интактные ткани может также использоваться толерантность к экзогенной щавелевой кислоте. Как отмечено, для трансформации растений существует несколько других методологий, кроме трансформации с Agrobacterium. Примеры таких других методов доставки ДНК включают электропорацию, т.е. химически индуцируемую доставку в протопласты, микроинъецирование, биолостикс, а также другие. Примером типа растений, который не особенно пригоден для опосредуемой Agrobacterium трансформации, является соя и определенные злаки, включая кукурузу. Очевидно, что для этих растений успех был бы получен при попытках трансформации растений с использованием других методологий, а не опосредованной Agrobacterium трансформации. Фиг.1 показывает последовательность кДНК, произведенную обратно из мРНК, кодирующей оксалатоксидазу проростков ячменя; фиг. 2 показывает аминокислотную последовательность, транслируемую с кДНК, показанной на фиг. 1; фиг. 3 показывает на диаграмме стратегию клонирования, использованную, чтобы клонировать ген оксалатоксидазы, и описанную детально в примерах 1 и 2; фиг. 4 показывает на диаграмме стратегию клонирования, описанную в примерах 3 и 4; фиг. 5 показывает структуру плазмиды pVBI; фиг. 6 показывает структуру плазмиды pBin19; фиг. 7 показывает структуру плазмиды p19HygA. Изобретение иллюстрируется следующими примерами. Пример 1. Создание оксалатоксидазного вектора не-секреции для трансформации томатов. (а) Воссоздание открытой рамки считывания полной длины оксалатоксиазы (ORF). Олигонуклеотиды 1219901A и 1219901A (компл.) были запрограммированы и синтезированы, чтобы создать линкер с Hind III сайтом на 5"-конце и BsaI сайтом на 3"-конце (см. схему в конце описания). Олигонуклеотиды ренатурировали и клонировали в клон # 22, вырезали с помощью Hind III и частично с BSAI, чтобы получить клон pOXOXI, содержащий зрелую оксалатоксидазную ORF, как показало пептидное секвенирование. После клонирования Hind III/BsaI, связанного с # 22, целостность зрелой оксалатоксидазной OPC была подтверждена секвенированием ДНК. (б) Встройка оксалатоксидазной ORF - в вектор экспрессии. Зрелая оксалатоксидазу кодирующая область была выделена из агарозы как фрагмент 700 bp Hind III/BamHI и концы превращали в тупые с помощью Т4ДНК-полимеразы. pNB33A разрезалась с помощью XbaI и PstI, векторный фрагмент выделялся из агарозы и концы превращали в тупые с помощью Т4-полимеразы. Эти два фрагмента с тупыми концами сшивали вместе, чтобы получить клон pNBOXOXI. Правильная ориентация оксалатоксидазной кодирующей области в pNBOXOXI подтверждалась секвенированием ДНК. (B) Перенос кластера экспрессии оксалатоксидазы в pBin19Ri. pBNOXOXI разрезали с помощью Hind III и частично с помощью EcoRI. Кластер экспрессии размером 1,9 кв выделялся из агарозы и клонировался в pBin19Ri (фигура 6), разрезался с помощью EcoRI и Hind III, чтобы получить клон pNOXI. Наличие кластера экспрессии оксалатоксидазы в клоне pNOXI подтверждалось путем рестрикции плазмидной ДНК с помощью EcoRI и Hind III. Пример 2. Создание вектора не-секреции оксалатоксидазы для трансформации подсолнечника. (а) Перенос кластера экспрессии оксалатоксидазы в pvBI. Фрагмент 2,1 кв EcoRI/Hind III, содержащий кластер экспрессии оксалатоксидазы, выделенный из pNOXOXI, описанный в примере 1 выше, клонировали в pvBI (фигура 5), разрезали с помощью EcoRI и Hind III, чтобы получить клон pvBOXI. Наличие кластера экспрессии оксалатоксидазы в клоне pvBOXI подтверждалось рестрикцией плазмидной ДНК с помощью EcoRI и Hind III. (б) Встройка гена устойчивости к гигромицину в pvBOXI. Фрагмент Hind III размером 2,3 кв, содержащий кластер устойчивости к гигромицину, выделяли из p19HYG и клонировали в pvBOXI, разрезали с Hind III, чтобы получить клон pHOXI. Наличие и ориентация гигромицинового кластера в клоне pHOXI подтверждались путем разрезания плазмидной ДНК с помощью EcoRI. Пример 3. Создание вектора секреции оксалатоксидазы для трансформации томатов. (а) Получение слияния вставочного переходного пептида/оксалатоксдазы с помощью ПЦР. Чтобы получить слияние зрелой оксалатоксидазы с вставочным переходным пептидом были запрограммированы и синтезированы олигонуклеотиды EXTOX-5 и EXTOX-3 (см. схему в конце описания). Олигонуклеотиды были использованы как праймеры ПЦР с pNBOXI в качестве матрицы. Полученный в результате ПЦР продукт 771 вр EXTOX, содержащий 23 аминокислоты вставочный переходный пептид слитый в рамке с областью, кодирующей зрелую оксалатоксидазу вырезался с помощью KpnI. (б) Встраивание продукта ПЦР EXTOX в pJRI (PUC). Разрезанный KpnI продукт ПЦР EXTOX, описанный выше, был клонирован в pJRI (pUC), разрезался KpnI, чтобы получить клон pJEXTOXI. Ориентация последовательности продукта ПЦР EXTOX в pJEXTOXI подтверждалась путем секвенирования ДНК. (в) перенос кластера экспрессии EXTOX в pBin19i. Кластер экспрессии вставки/оксалатоксидазы был выделен из pJEXTOXI как фрагмент EcoRI/Hind III размером 1,5 кв и клонирован в pBin19, разрезали EcoRI и Hind III, чтобы получить клон pNEXTOXI. Наличие кластера экспрессии в pNEXTOXI подтверждалось резанием плазмидной ДНК с помощью EcoRI и Hind III. Пример 4. Создание вектора секреции оксалатоксидазы для трансформации подсолнечника. (а) Выделение кластера экспрессии секреции и встраивание в pvBI. Кластер экспрессии вставки/оксалатоксидазы был выделен из pNEXTOXI как фрагмент EcoRI/Hind III размером 1,5 кв и клонирован в pvBI, разрезался с помощью EcoRI и Hind III, чтобы получить клон pVEXTOXI. Присутствие кластера экспрессии в pVEXTOXI подтверждалось путем разрезания плазмидной ДНК с помощью EcoRI и Hind III. (б) Встраивание гена устойчивости к гигромицину в pVEXTOXI. Фрагмент Hind III размером 2,3 кв, содержащий кластер устойчивости к гигромицину, был выделен из p19HYG и клонирован в pVEXTOXI, разрезался с помощью Hind III, чтобы получить клон pHEXTOXI. Присутствие и ориентация гигромицинового кластера в клоне pHEXTOXI подтверждались путем разрезания плазмидной ДНК с помощью EcoRI.
ФОРМУЛА ИЗОБРЕТЕНИЯ1. кДНК, полученная из РНК, кодирующей фермент оксалатоксидазу, и имеющая нуклеотидную последовательность как представлено на фиг.1 или ее вариации в соответствии с вырожденностью генетического кода. 2. По существу, чистая оксалатоксидаза для использования при обработке растений с целью разрушения в них щавелевой кислоты, причем оксалатоксидаза имеет аминокислотную последовательность, представленную на фиг.2, и характеризуется оптимумом pH 3,5, положительной термоустойчивостью, единственной субъединицей массой примерно 25 кДа и устойчивостью к протеазам. 3. Оксалатоксидаза по п.2, отличающаяся тем, что дополнительно содержит агротехнически приемлемый носитель для ее доставки к растению. 4. Способ борьбы с патогенезом растений, вызванным инфицированием грибами, секретирующими щавелевую кислоту, включающий стабильное введение в геном упомянутого растения путем трансформации гена, кодирующего фермент, деградирующий оксалат. 5. Способ по п.4, отличающийся тем, что геном растения трансформируют генной конструкцией, включающей последовательность промотора, последовательность, кодирующую транзитный пептид, последовательность структурного гена, кодирующего оксалатоксидазу, и последовательность гена-терминатора. 6. Способ по п.5, отличающийся тем, что упомянутый структурный ген имеет нуклеотидную последовательность, представленную на фиг.1. 7. Способ по любому из пп.4 - 6, отличающийся тем, что гриб является грибом рода, выбираемого из группы грибов, секретирующих щавелевую кислоту, включающей Sclerotinia, Sclerotium, Aspergillus, Streptomyces, Penicillium, Pythium, Paxillius, Mycena, Leucosfoma, Rhizoctonia и Schizophyllum. 8. Способ по п. 7, отличающийся тем, что грибом является Sclerotinia Sclerotorum. 9. Способ по любому из пп.4 - 8, отличающийся тем, что растением является подсолнечник (Helianthus annuus).Популярные патенты: 2312500 Способ защиты смородины от вредителей и болезней ... формирования, фитосанитарные очистки, на приобретения и применения пестицидов в годы плодоношения, снижается себестоимость продукции и обеспечивается его экологическая безопасность.Срезка кустов после посадки восстанавливает также нарушенное при выкопке саженцев равновесие между корневой системой и надземной частью растений, способствует образованию гораздо большего числа побегов за счет усиления притока питательных веществ к оставшимся в почве почкам, усиливает ростовые процессы, ускоряет формирование кустов и вступление их в пору полного плодоношения. Данные результатов способа приведены в таблицах 1-3. Предлагаемый способ может быть реализован в любом сельскохозяйственном ... 2492632 Способ орошения ... конический оголовок. Напорный бачок при этом прикреплен к радиатору охлаждения для отопления помещения парника с одновременным охлаждением и конденсацией пара. Радиатор охлаждения представляет собой металлические пластины с воздушными прослойками.Таким образом, работа бачка и увлажнение корнеобитаемой массы растения осуществляется периодическими напусками. На стенке парового котла закреплен с помощью винта и гайки через пружину клапан давления котла (фиг.2). Пружиной с помощью шайбы с прокладкой он закрывает либо открывает отверстия в стенке парового котла.В качестве генератора тепла может быть использован газ или электричество. Перфорированная трубка может служить опорной ... 2256318 Инъектор для капельного орошения ... элементом, взвеси и иловатые частицы не выводятся из корпуса. По мере их накопления в донной части корпуса 2 водозапорный клапан 7 перекрывает входное отверстие 3 и устройство перестает работать. Это устройство не предусмотрено для подачи воды в корнеобитаемый горизонт. Самым близким аналогом к заявленному объекту является инъектор для капельного орошения, включающий водовыпуск и пористый корпус, в котором с целью обеспечения регулируемой подачи воды, повышения надежности полива и упрощения конструкции он снабжен регулятором давления, выполненным в виде сменного пористого элемента (SU, авторское свидетельство №812237. М.кл3 А 01 G 25/02. Инъектор для капельного орошения / ... 2278488 Способ создания пастбищных экосистем весенне-летнего срока использования ... по п.1, отличающийся тем, что обработку почвы проводят лемешными лущильниками на глубину 0,16÷0,22 м непосредственно перед посевом с выравниванием рельефа и боронованием в два следа. 4. Способ по п.1, отличающийся тем, что при благоприятных погодных условиях проводят ранневесенний высев семян трав в последней декаде февраля - первой декаде марта.5. Способ по п.1, отличающийся тем, что семена кустарников и полукустарников высевают в рядки с шириной междурядий 0,7 м на глубину до 0,5 см. 6. Способ по п.1, отличающийся тем, что семена травянистых растений высевают в междурядья полукустарников на глубину 1÷3 см. 7. Способ по п.1, отличающийся тем, что нормы высева для ... 2253227 Устройство для регулирования температуры в улье ... светоизлучатель, фотоприемник, нагревательный элемент, клеммы для подключения источника питания, первый вход нагревательного элемента соединен с первым входом силового коммутирующего элемента, а второй вход - с первой клеммой для подключения источника питания, второй вход силового коммутирующего элемента соединен со второй клеммой для подключения источника питания, первые входы датчиков внутриульевой температуры и внешней температуры объединены и соединены с первым входом светоизлучателя, второй вход датчика внешней температуры соединен с первым входом задатчика внешней температуры, второй вход датчика температуры в улье соединен с первым входом задатчика внутриульевой ... |
Еще из этого раздела: 2241327 Многоопорная дождевальная машина 2093016 Устройство для водоподачи 2502259 Способ получения водорастворимого бактерицидного препарата 2145478 Гранулированное либо пеллетированное средство для защиты растений, способ его получения и способ борьбы с грибами 2429594 Палец штампосварной для режущего аппарата (варианты) и способ его изготовления 2023363 Пневматическая сеялка 2489835 Гнездовой высевающий аппарат для посева проросших семян овощных культур 2264082 Способ восстановления полей бурой водоросли ламинарии 2125366 Доильный аппарат 2192734 Устройство для производства прессованных кип из корней лекарственных растений |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||