Способ получения таксола и таксанов из эмбриональных культур растений рода taxusПатент на изобретение №: 2120740 Автор: Ли, Бо-Сик (KR), Сан Санг-Хо (KR) Патентообладатель: Форест Генетик Рисеч Инститют Форести, Администрейшн (KR) Дата публикации: 27 Октября, 1998 Изображения  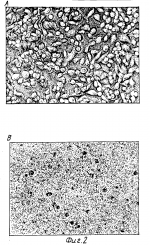 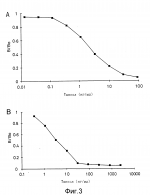 Изобретение относится к биотехнологии и предназначено для получения таксола в промышленном масштабе. Способ предусматривает использовать в качестве эксплантов вычлененные зиготные эмбрионы из семян Тисса вида Taxus cuspidata. Культивируют каллусную ткань до образования соматических эмбриоидов, затем до получения эмбриогенного каллуса. Последний пассируют в жидкую питательную среду и культивируют на среде Гамборга m B5, содержащей 2-4 ppm 2,4 D (2,4-дихлорфеноксиуксусной кислоты) для увеличения клеточной массы. После чего продолжают культивирование на среде Мурасиге и Скуга MS или Гамборга m B5, содержащих 1-2 ppm N AA ( 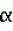 - нафтилуксусной кислоты, стимулирующей выход целевого продукта. Выделение целевого продукта ведут экстракцией из соматических эмбрионов на стадии культивирования каллуса или из эмбриогенного каллуса на стадии культивирования дезинфицированных эмбрионов. Можно выделить целевой продукт из клеточной суспензионной массы и культуральной среды. Способ обеспечивает более высокий выход таксола и таксонов. 6 з.п.ф-лы, 4 ил, 3 табл.
Область использования изобретения. Изобретение относится к способу получения таксола и его производных из соматических эмбрионов и/или культуральной среды и в особенности касается способа культивирования зиготных эмбрионов или соматических эмбрионов для получения полиэмбрионов или эмбриогенного каллуса. Известный уровень техники. Таксол представляет собой алкалоид, выделенный из растений рода Taxus (тисс) и обладающий значительной противоопухолевой активностью по отношению к различным линиям клеток злокачественных опухолей, в том числе линии меланомных клеток B16. Известно, что в основном таксол содержится в коре растения Taxus brevifolia (тисс коротколистный) в количестве 0,02% на грамм сухого веса. Несмотря на то, что был успешно осуществлен общий синтез таксола, этот процесс, по-видимому, не может быть использован для крупномасштабного коммерческого получения данного вещества из-за своей высокой стоимости. Кроме того, был успешно осуществлен частичный синтез таксол-подобного соединения (например, таксотера, taxotere) при использовании баккатина III или 10-деацетилбаккатина III. Однако эти достижения столкнулись с указанным выше ограничением. Таким образом, таксол может быть получен только из редко встречающихся природных источников, например сырой древесины тиссового дерева. Поскольку содержание таксола в древесине тисса очень не велико, для получения 1 кг таксола необходимо срубить 2000-4000 деревьев, и производство таксола из природных источников в нужном объеме нанесет существенный урон лесным экосистемам. Соответственно, были предприняты попытки получения таксола и родственных ему соединений из клеток и тканевых культур растений рода Taxus species. Например, в патенте США 5019504 описан способ получения таксола или таксол-подобных алкалоидов путем культивирования тканей коры, камбия, иголок и корней различных видов тисса в питательной среде для получения каллуса или суспензионных клеточных культур с последующим выделением таксола или таксол-подобных алкалоидов. Однако с помощью описанного метода можно получить только 1,0 - 3,0 мг таксола из 1 л культуральной среды, в которой выращивалась суспензия клеток. В указанном патенте отмечается, что из коры тиссового дерева можно непосредственным образом получить оптимальный выход таксола, а также производить данный алкалоид путем индукции недифференцированной клеточной массы (каллуса) и/или получения суспензионных клеточных культур из пролиферирующего каллуса и культивирования данных тканей. До настоящего времени вышеуказанный метод, подразумевающий использование различных тканей тиссового дерева, не применяется в коммерческих целях из-за низкой таксолообразующей способности соответствующих клеток и непригодности различных этапов способа для крупномасштабного получения вторичных метаболитов. В Заявке РСТ WO 92/013961 раскрывается способ получения таксола путем культивирования тканей различных видов тисса (Taxus) преимущественно женских гаметофитов, и выделения указанного алкалоида из каллуса или суспензионных клеточных культур, полученных на основе гаметофитов. Данный способ обеспечивает получение 0,05% таксола по сухому весу суспензионных клеточных культур. Описанные способы не позволяют получать достаточное количество таксола в промышленном масштабе и до сих пор их пытаются усовершенствовать с целью повышения выхода таксола. Поэтому можно предположить, что существует необходимость в разработке улучшенного метода повышения содержания таксола в клетках и/или культуральной среде, а также отбора таксолообразующих клеточных линий с целью решения проблемы промышленного получения таксола в больших количествах. В данных обстоятельствах авторы изобретения занимались разработкой способы получения таксола в промышленном масштабе и в первую очередь неожиданно обнаружили, что зиготные эмбрионы содержат гораздо больше таксола в пересчете на сухой вес по сравнению с другими тканями, как это сообщалось раннее. Авторы изобретения провели дальнейшие исследования, направленные на разработку способа увеличения массы эмбрионов, поскольку их размеры сами по себе очень малы, чтобы эмбрионы можно было использовать для коммерческого получения таксола. В результате авторы неожиданно обнаружили, что масса эмбрионов увеличивается в несколько сотен тысяч раз по сравнению с первоначальной, при культивировании эмбрионов в питательной среде с целью индукции соматических эмбрионов или эмбриогенного каллуса. В основе настоящего изобретения лежат вышеприведенные положения. Сущность изобретения. Таким образом, задача изобретения заключается в разработке способа получения таксола путем экстрагирования тканей растений рода Taxus, характеризующегося тем, что указанные ткани представляют собой зиготные эмбрионы. Изобретение заключается в разработке способа получения таксола и таксанов, состоящего из следующих этапов: (а) получения живых зиготных эмбрионов растений различных видов тисса (Taxus) и дезинфицирования их; (б) культивирования указанных дезинфицированных эмбрионов в культуральной среде для получения каллуса из эмбрионов; (в) культивирования каллуса, полученного, как указано в (б) для получения соматических эмбрионов из каллуса; (г) культивирования дезинфицированных эмбрионов (а) или соматических эмбрионов, полученных как указано на стадии (в), для получения эмбриогенного каллуса; (д) культивирования соматических эмбрионов (в) или эмбриогенного каллуса (г); и (е) выделения таксола и таксанов из культуральной среды и клеточной суспензионной массы. Настоящее изобретение отличается от известных, указанных выше технических решений тем, что основано на открытии авторов, которое заключается в том, что зиготные эмбрионы содержат неожиданно большое количество таксола и дальнейшее увеличение массы эмбрионов происходит за счет индукции соматических эмбрионов или эмбриогенного каллуса. Соответственно, преимущество предложенного технического решения по сравнению с известными заключается в возможности его использования для получения таксола в промышленном масштабе путем культивирования соматических эмбрионов или эмбриогенного каллуса в жидкой питательной среде. Другие воплощения настоящего изобретения могут быть легко осуществимы специалистами в данной области исследований на основе приведенного ниже описания. На фиг. 1 (А) приведена храматограмма стандартных таксанов, полученная методом жидкостной хроматографии высокого разрешения (HPLC); на фиг.1(B) - HPLC- хроматограмма очищенной культуральной среды, полученной как описано в примере 7; на фиг.2 (А) - фотография злокачественных опухолевых клеток крысы без обработки экстрактом, полученным согласно примеру 7 (см. экспериментальный пример 1); на фиг 2(B) - фотография злокачественных опухолевых клеток крысы, обработанных экстрактом, полученным согласно примеру 7 (см.экспериментальный пример 1); на фиг.3(А) показана стандартная кривая, полученная методом ELISA; на фиг. 3(B) - кривая, полученная методом ELISA, как описано в экспериментальном примере 2; на фиг.4 приведена диаграмма, отражающая влияние различных сред, предназначенных для образования продукта, на выход таксола (см. пример 8). Подробное описание изобретения. Авторы изобретения анализировали содержание таксола в 24000 деревьев тисса остроконечного (Taxus cuspidata), произрастающих в национальном лесном массиве Кореи. Несмотря на то, что содержание таксола значительно варьировало от дерева к дереву, авторы обнаружили, что при использовании наиболее продуктивных деревьев в 100 г высушенных иголок и коры получают 2,0 мг и 4,5 мг таксола соответственно. Таким образом, в первую очередь задача изобретения заключается в разработке способа получения таксола, причем таксол экстрагируют из эмбрионов растений различных видов тисса (Taxus). Использование деревьев тисса не ограничивается каким-либо определенным видом, и могут быть использованы все растения, принадлежащие к роду Taxus. Тем не менее преимущество отдается тиссу остроконечному (Taxus cuspidata). Для экстракции таксола из эмбрионов в принципе может быть применен любой метод. Однако, в основном, экстракцию таксола из эмбрионов можно осуществить путем помещения лиофилизированного порошка эмбрионов в спирт, преимущественно метанол. К сожалению, размеры зиготных эмбрионов очень невелики и эмбрионы содержат более 90% воды. Огромное количество эмбрионов необходимо для получения чрезвычайно малого количества таксола, и экстракция таксола непосредственно из эмбрионов нецелесообразна с экономической точки зрения. Соответственно, авторы изобретения провели интенсивные исследования по разработке способа получения таксола в промышленном масштабе, решающего указанные выше проблемы, и в результате добились увеличения массы эмбрионов в сотни тысяч раз при использовании технологии культивирования тканей, в особенности посредством индукции соматических эмбрионов и эмбриогенного каллуса. Таким образом, вторая задача изобретения состоит в разработке способа получения таксола или его производных путем индукции соматических эмбрионов или эмбриогенного каллуса из зиготных эмбрионов растений различных видов тисса (Taxus), культивирования указанных соматических эмбрионов или эмбриогенного каллуса в жидкой питательной среде с помощью шейкера или биореактора и выделения таксола из культуральной среды и клеток. Одним из отличительных признаков настоящего изобретения является увеличение массы эмбрионов в десятки и сотни тысяч раз путем индукции соматических эмбрионов или эмбриогенного каллуса, в то время как простой индукцией каллуса из различных тканей, за исключением эмбрионов, трудно добиться такого увеличения массы, возможно благодаря различной способности к делению меристемных клеток. Индукция эмбриогенного каллуса позволяет увеличить массу эмбрионов в сотни тысяч раз и таким образом является очень важным обстоятельством. Индукция соматических эмбрионов или эмбриогенного каллуса из зиготных эмбрионов и получение таксола или его производных будет описано ниже. Для асептического культивирования эмбрионов зрелые или незрелые семена различных видов тисса (Taxus), собранные в период времени с августа по ноябрь, следует дезинфицировать или поверхностно стерилизовать. Дезинфекция или поверхностная стерилизация семян может быть осуществлена известными методами. Например, семена помещают в 70%-ный этанол на 30-60 секунд, затем 2-3 раза промывают стерилизованной водой и поверхностно стерилизуют 1-3%-ным (по объему) раствором гипохлорита натрия в течение 24 ч. Поверхностно стерилизованные семена промывают более 5 раз стерилизованной водой и отделяют эмбрионы. Эмбрионы могут быть использованы для экстракции таксола описанными выше методами. Кроме того, эмбрионы помещают на твердую питательную среду для индукции каллуса. Индукцию соматических эмбрионов можно проводить с помощью методов преэмбриогенных детерминированных клеток(P E D C , от англ. Pre-Embryogenic Determined Cell) или индуцированных эмбриогенных детерминированных клеток (IEDC, от англ. Induced Embryogenic Determined Cell). Индукция соматических эмбрионов методом PEDC осуществляется следующим образом. Эмбрионы культивируют на твердой питательной среде с добавлением 1-нафтален-уксусной кислоты (NAA, от англ. naphtalene acetic acid), кинетина и 2,4-D для индукции каллуса. После этого небольшие кусочки каллуса размножают путем субкультивирования на питательной среде, содержащей необходимое количество макро- и микроэлементов и витаминов. С целью индукции и размножения каллуса без ограничений могут быть использованы обычные для культивирования растительных тканей. Например, среды B5 (модифицированная среда Гамборга B5), Дурзан, MS (среда Мурашиге и Скуг), WPM (Ллоид и МакКоун), DKW (Драйвер-Волнат), GO (Грессхофф и Доу), SH (среда Шенка и Хилдебрандта) или LP (Куорин и Лепиовер). Понятно, что могут иметь место различные модификации указанных питательных сред, например добавления или исключения каких-либо компонентов, а также изменения их количественного соотношения. Среди прочих других предпочтительно используются среды mB5 или Дурзан. На промежуточном этапе соматического эмбриогенеза для индукции может быть использована та же самая среда, что и для быстрого выращивания каллуса, или же среда, отличная от ростовой. Для получения наибольшего количества соматических эмбрионов преимущественно используется среда mB5. Поскольку большинство перечисленных выше питательных сред коммерчески доступны и хорошо известны, их приобретение заинтересованными лицами не вызывает сложностей. Таким образом, любой специалист в данной области исследований может подобрать и/или оптимизировать подходящую культуральную среду для индукции и быстрого выращивания каллуса. Например, это может быть среда mB5, преимущественно используемая согласно настоящему изобретению, которая представляет собой модифицированную среду B5 Гамборга. Ее состав приведен в табл. 1. Помимо этого, методика IEDC для получения соматических эмбрионов может осуществляться путем культивирования эмбрионов в описанной выше среде, в которую альтернативно добавлены различные гормоны роста растений. В первоначальные культуры добавляют 2-4 ppm (фемтомоля -10-16 мол 2,4-D. Когда на поверхности эмбрионов формируется каллус и клеточная масса увеличивается в 10-20 раз, субкультивирование обычно продолжают в той же самой среде, содержащей половинную концентрацию ауксина. Поскольку большая часть каллуса теряет ростовые свойства из-за выделения непролиферирующими клетками фенольных соединений, в питательную среду добавляют 0,5% (вес на объем) активированного угля или 1-2% (вес на объем) поливинилпирролидона. Каллус субкультивируют на среде, свободной от регулятора роста, в течение 2-4 месяцев для формирования соматических эмбрионов из меристемных тканей каллуса. Сформированные таким образом соматические эмбрионы содержат большое количество таксола или его производных (далее таксанов) и могут быть непосредственно использованы для экстракции таксанов которую осуществляют известными методами, в особенности методом, описанным ниже. Однако соматические эмбрионы преимущественно используются для индукции эмбриогенного каллуса с целью дальнейшего увеличения клеточной массы. Согласно настоящему изобретению, относительно большое количество таксанов может быть получено путем экстракции эмбриогенного каллуса, так же как и соматических эмбрионов. Эмбриогенный каллус может быть получен при культивировании соматических эмбрионов, полученных методом PEDC или IEDC, как описано выше, или при культивировании зиготных эмбрионов. Методика получения эмбриогенного каллуса заключается в следующем. Дезинфицированные эмбрионы или соматические эмбрионы культивируют в течение 2-4 месяцев на твердой питательной среде, пригодной для индукции каллуса, в которую добавляют 1,0-4,0 ppm NAA и 0,5-2,0 ppm кинетина, предпочтительно 2,0 ppm NAA и 1,0 ppm кинетина. Вместо NAA и кинетина в среду может быть добавлено 1,4 ppm 2,4-D. Индуцированный каллус затем культивируют на той же самой среде с добавлением 1-5 ppm цитокина, например бензиламинопурина, кинетина или зеатина, в течение 1-2 месяцев для формирования эмбриоидов на поверхности каллуса. Далее эмбриоиды культивируют на той же самой питательной среде с 2-10 ppm 2,4-D при t около 26oC в течение 2-3 месяцев в условиях светового режима 16 ч света/8 ч темноты. Указанная процедура позволяет получить эмбриогенный каллус в чрезвычайно большом количестве, которое в сотни тысяч раз превышает первоначальную массу эмбрионов. Эмбриогенный каллус имеет разнообразную окраску, например от желтой и коричневой до зеленой. Для индукции и пролиферации эмбриогенного каллуса могут быть использованы различные тканевые культуры и соответствующие определенным растительным клеткам питательные среды. Полученный, как описано выше, эмбриогенный каллус содержит большое количество таксола и может быть непосредственно использован для экстракции таксола и таксанов. Экстракцию эмбриогенного каллуса осуществляют известными методами, предпочтительно методом, описанным ниже. С целью увеличения массы эмбриогенного каллуса в процессе промышленного производства, эмбриогенный каллус асептически нарезают для получения отдельных клеток или небольших клеточных агрегатов. Чтобы получить суспензионные культуры, 10% /по объему/ указанных клеток вносят в 250-мл конические флаконы, содержащие 50 мл жидкой питательной среды с добавлением 2 ppm 2,4-D. Для длительного культивирования преимущественно используют биореакторы с воздушным или механическим перемешиванием. Культивирование в биореакторах осуществляют при использовании двух различных культуральных сред: одной для роста клеток (ростовая среда) и другой - для получения таксанов (среда для получения продукта). В качестве ростовой среды преимущественно используют среду mB5 с добавлением 2-4 ppm 2,4-D, а в качестве среды для получения продукта - MS с добавлением 2-10 ppm NAA. Следует отметить, что среда для получения продукта предпочтительно содержит стимуляторы для увеличения выхода таксола, которые могут быть получены из грибов, а также представлять собой экстракт женских гаметофитов (1,5 мл/л), фенилаланин (50-300 мМ) и GA3 (0,5-1,0 ppm). Примерами грибов, из которых получают стимуляторы, служат Cytospora аbietis ATCC N 38688 и Penicillium minioluteum (Dierckx) NRRL 18467. Клетки грибов растирают в порошок и последовательно экстрагируют для получения экстракта. Кроме того, предпочтительно использование экстракта из культивируемых грибов рода Pestalotiopsis, который добавляют в питательную среду в количестве 0,5-1,0 мл/л. Таксол обнаруживается в самих клетках и, кроме того, секретируется в культуральную среду. Соответственно, после завершения этапа культивирования в жидкой питательной среде таксол и таксаны выделяют из культур или среды с помощью хорошо известных методик. Отделение клеток от культуральной среды осуществляют путем центрифугирования (например, при 1000 g в течение 5-10 мин) или декантирования. В последнем случае культуры оставляют на 24 ч для осаждения клеток и сливают культуральную среду. Остатки среды отсасывают пастеровской пипеткой с помощью вакуумного насоса. Таксаны получают из соматических эмбрионов или эмбриогенного каллуса, а также из культуральной среды путем экстракции с помощью спирта или смеси метанола и метиленхлорида в соотношении 1:1. Осадок клеток, образовавшийся в результате центрифугирования, может быть разрушен ультразвуком (Branson 250) и использован для экстракции. Согласно настоящему изобретению могут быть получены как таксол, так и различные производные таксола. К последним относятся 10-деацетилбаккатин III, баккатин III, 10-деацетил таксол, цефанолманнин и 7-эпи-10-деацетил таксол /см. фиг. 1(B)/. Производные таксола могут быть использованы как сами по себе, так и в качестве исходных компонентов для синтеза таксола, если это необходимо. Свойства таксанов, выделенных из соматических эмбрионов и эмбриогенного каллуса, полученных путем индукции при культивировании зиготных эмбрионов, исследуют с помощью HPLC, теста цитотоксичности и твердофазного иммуноферментного анализа (ELISA) при использовании таксола и шести его производных, которые являются стандартами NCI. Настоящее изобретение более подробно описано в нижеследующих примерах, но не ограничивается ими. Пример 1. Получение таксола из зиготных эмбрионов различных видов тисса (Taxus). Собирают семена с лучших деревьев Taxus cuspidata. Эмбрионы высушивают в ваккумной печи при температуре около 40oC в течение трех дней, чтобы содержание воды составляло менее 10%, и взвешивают. Затем эмбрионы замораживают в жидком азоте и растирают в порошок, который помещают в инкубатор, содержащий в 100 раз большее количество метанола /по весу/, и выдерживают при температуре около 28oC в течение 7 дней. Полученный экстракт пропускают через мембранный фильтр с размерами пор 0,2 мкм и анализируют на содержание таксола с помощью HPLC. С тех же самых деревьев собирают иголки и кору, полученный материал обрабатывают и анализируют на содержание таксола согласно описанной выше методике. Полученные результаты приведены в табл. 2. Пример 2. соматические эмбрионы получают из эмбрионов с помощью методики PEDC. Семена Taxus cuspidata поверхностно стерилизуют, помещая их в 700-ный этанол и 2%-ный гипохлорит натрия на 50 с и 24 ч соответственно и затем 3-5 раз отмывая дистиллированной водой. В качестве культуральной среды используют среду mB5 /состав и соотношение компонентов приведены в табл. 1/ с добавлением 2,0 ppm NAA, 0,5 ppm кинетина и 0,5 ppm 2,4-D. In vitro культуры выращивают в специальной комнате при to 26oC в течение 8 недель. За это время эмбрионы увеличиваются в размерах, и на поверхности большинства из них индуцируется каллус. Зеленые кусочки каллуса вырезают и культивируют в среде mB5 без добавления каких-либо регуляторов роста растений в течение 3 месяцев для индукции соматических эмбрионов. Пример 3. Соматические эмбрионы получают из зиготных эмбрионов с помощью методики IEDC. Семена Taxus cuspidata стерилизуют согласно методике, описанной в примере 2, и выделяют из них эмбрионы, которые затем культивируют в среде Дурзан с добавлением 2 ppm 2,4-D при 23-28oC в течение 2 недель. Через 2 недели культивирования все эмбрионы полностью покрываются индуцированным из них каллусом. Через 4 недели масса каллуса увеличивается в несколько десятков раз по сравнению с первоначальной. Чтобы избежать ингибирования роста каллуса и гибели клеток под воздействием секретируемого ими фенола, проводят пересев каллуса при использовании той же самой ростовой среды, но в которую добавлено около 1% поливинилпирролидона. После 8 недель культивирования, когда средний диаметр каллусной массы достигает 1-1,5 см, каллус помещают в среду mB5, не содержащую регуляторов роста растений, в которой каллус подращивают с целью индукции соматических эмбрионов. В некоторых из них наблюдается индукция корней. Пример 4. Для индукции эмбриогенного каллуса в качестве исходного материала используют стерилизованные зиготные эмбрионы (пример 2) и соматические эмбрионы (примеры 3, 4). Указанные выше эмбрионы культивируют при 23-28oC около 2,5 месяцев в среде mB5 с добавлением 2,0 ppm NAA и 1,0 ppm кинетина для индукции каллуса. После завершения индукции каллуса проводят субкультивирование каллуса примерно в течение 6 недель в этой питательной среде с добавлением 3 ppm зеатина и получают желтовато-зеленые эмбриоиды. Эмбриоиды культивируют в указанной питательной среде, содержащей 3 ppm 2,4-D при 26oC около 2 месяцев при световом режиме 16/8 ч (свет/темнота) для образования эмбриогенного каллуса, масса которого в сотни тысяч раз превышает первоначальную массу эмбрионов. Эмбриогенный каллус по морфологии отличается от обычного каллуса, полученного из различных тканей тисса, и иногда выглядит как зиготные эмбрионы. Однако поверхность эмбриогенного каллуса состоит из разнообразных по цвету участков: красных, желтых, темно-зеленых, светло-коричневых, темно-зеленых и черных. Клеточную массу каждого цвета разрезают лезвием для получения небольших клеточных агрегатов, которые затем субкультивируют в жидкой среде в течение 2-4 недель. После удаления крупных скоплений клеток из указанных культур отдельные клетки и/или небольшие клеточные агрегаты вносят в пластмассовые чашки Петри, содержащие 20 мл культуральной среды. Через 4 недели жидкостного культивирования отбирают различным образом окрашенные клетки. Такая визуальная селекция для получения клеточных линий, имеющих различную цветовую окраску, является обычной процедурой в данной области исследований. Пример 5. Соматические эмбрионы, полученные, как описано в примерах 2 и 3 или эмбриогенный каллус, полученный как описано в примере 4, высушивают при 25oC и растворяют в 1 мкл метиленхлорида. Добавляют 1 мкл дистиллированной воды, перемешивают в течение 10 с и затем центрифугируют при 25000 g. Осадок высушивают при 25oC, растворяют в 50 мкл метанола и пропускают раствор через фильтр с размером пор 0,2 мкм для получения экстракта. Экстракты анализируют методом HPLC при использовании обратно-фазовой микропористой колонки в сравнении с контрольной кривой (коэффициент корреляции 0,999), построенной с помощью известных стандартных препаратов. Результаты HPLC показывают, что пик стандартных таксанов и тех, которые содержатся в опытных экстрактах (см. выше), выявляется при одном и том же времени задержки (14,3 мин). Пример 6. Соматические эмбрионы (примеры 2 и 3) и эмбриогенный каллус (пример 4) экстрагируют для получения таксанов, как описано ниже. Каждые 0,5 г соматических эмбрионов (пример 2 и 3) и эмбриогенного каллуса (пример 4) помещают в центрифужную пробирку и добавляют 2 мкл гексена. Смесь хорошо перемешивают с помощью стеклянной палочки, хранят при -20oC в течение 12 ч и центрифугируют при 25oC и 25000 g 20 мин. К преципитатам добавляют смесь метанола и этиленхлорида и обрабатывают ультразвуком в соникаторе Branson 250. Полученный раствор центрифугируют при 25000 g и преципитаты высушивают при 60oC до полной потери влажности с целью получения экстрактов. Экстракты анализируют на содержание таксола и получают следующие результаты: экстракт соматических эмбрионов (пример 2) содержит 0,21-0,27 мг таксола на 1 г сухих клеток (общее содержание таксола составляет 0,5-1,2 мг), экстракт соматических эмбрионов по примеру 3 содержит 0,20-0,27 мг таксола на 1 г сухих клеток (общее содержание таксола - 0,55-1,1 мг) и экстракт эмбриогенного каллуса (пример 4) содержит 0,23-0,28 мг таксола на 1 г сухого веса (общее содержание таксола - 0,6-1,4 мг). Пример 7. Для получения большой массы эмбриогенного каллуса, полученного, как описано в примере 4, его культивируют в биореакторе с лопастным перемешиванием. Эмбриогенный каллус, полученный согласно примеру 4, вносят в количестве до 10% (по объему) в 250-мл колбу Эрленмейера, содержащую 50 мл жидкой среды mB5 с добавлением 2 ppm 2,4-D. После 18 дней культивирования при 25-28oC в стерильных условиях устанавливается стационарная фаза. Культуры помещают в пятилитровый биореактор с лопастным перемешиванием, содержащий среду MS с добавлением 2 ppm NAA (среда для получения продукта). Культивирование проводят при 25-28oC в течение 30 дней в аэробных условиях. По истечении этого срока культуральную суспензию оставляют на 24 ч для осаждения клеток и отделяют клетки от культуральной среды. Для наиболее полного удаления среды используют пастеровскую пипетку. Полученные клетки и культуральную среду подвергают экстракции для выделения таксола и его производных, как описано в примере 5. Результаты HPLC показывают, что пики стандартного препарата таксола и его производных /фиг 1(А)/, а также таксола и его производных, полученных в результате экстракции /фиг.1 (А)/, выявляются при одном и том же времени задержки, что свидетельствует об идентичности известных и полученных путем экстракции веществ. Установлено, что содержание таксола составляет 0,09 мг на 1 г высушенных клеток, в то время как в культуральной среде выявляется около 8 мг таксола на 1 л среды. Пример 8. Для определения зависимости выхода таксола от типа культуральной среды, культуры, полученные как описано в примере 7, помещают в различные питательные среды, такие как MS, mB5, WPM, OKW, Дурзан, Уайт, LP, GO, B5, DCR или SH. Во все исследуемые среды добавляют 2ppm NAA и в сбалансированных количествах факторы микроокружения. Время культивирования составляют около 20 дней. Результаты исследований приведены на фиг.4. Как видно из представленной диаграммы, образование таксола существенно зависит от типа культуральной среды, и наибольшей выход таксола наблюдается при использовании сред MS и mB5. Пример 9. С целью выхода увеличения таксола и таксанов в среду для получения продукта могут быть добавлены различные стимуляторы. Влияние стимуляторов на образование таксола оценивают следующим образом. (1) Согласно настоящему изобретению, в среду для получения продукта в качестве стимулятора образования таксола добавляют экстракт гриба Pestalotiopsis sp., который встречается на различных видах тисса. Ткани растений, например семена или внутренний слой коры, помещают в 70%-ный этанол, поверхностно стерилизуют с помощью 15%-ного H2O2 в течение 15 мин и затем опять помещают в 70%-ный этанол. После этого ткани четыре или более раз отмывают стерильной дистиллированной водой для удаления химических веществ. Таким образом поверхностно-стерилизованные ткани помещают на следующие среды: агаровую среду с солодовым экстрактом (20,0 г солодового экстракта, 5,0 г пептона и 1 л дистиллированной воды), ростовую агаровую среду (40 г глюкозы, 10 г бактосоутона, 1 г ацетата натрия, 50 мг бензоата натрия, 20,0 г агара и 1 л дистиллированной воды) и водную среду (20,0 г агара на 1 л дистиллированной воды). Культуры помещают в термостат, контролирующий рост клеток, при использовании светового режима 12 ч темноты/12 ч дня. После того как в течение трех дней обнаруживается рост грибов Pestalotiopsis sp., их далее культивируют на солодовом экстракте и ростовой агаровой среде (3 г дрожжевого экстракта, 5 г бактосоутона, 0,5 Mg SO4, 5 г глюкозы и 10 г/л сахарозы) в течение 4 дней. В определенное время культуральную среду центрифугируют для отделения клеток. Клетки высушивают, размельчают в порошок и экстрагируют метанолом для получения углеводной фракции. Полученный, как описано выше, углеводный экстракт Pestalotiopsis sp. добавляют к среде для получения продукта в количестве 1 ppm и осуществляют культивирование и анализ полученных результатов, согласно примеру 7. Результаты исследований приведены в табл. 3. (2) Процедуру, описанную в примере 7, повторяют, за тем исключением, что в качестве стимуляторов в среду для получения продукта добавляют экстракт женских гаметофитов (2 мл/л, (фенилаланин (100 мМ) или гиббереллиновую кислоту. Результаты исследований приведены в табл. 3. Экспериментальный пример 1. Биологические свойства таксола, полученного с помощью эмбриональных культур тиссового дерева, исследуют в цитотоксическом тесте при использовании раковых клеток крысы. Указанная методика обычно основывается на том, что таксол способен вызывать гибель отдельных раковых клеток на стадии метафазы клеточного деления. Раковые клетки крысы, полученные из Центрального исследовательского центра Пасифик Корпорейшн в г. Сигнале, Куонгги-до, Корея, помещают в пластиковые флаконы, содержащие среду для культивирования животных клеток. На ранней стадии культивирования, когда наступает деление клеток, в одну партию флаконов добавляют каплю экстракта, полученного, как описано в примере 7, в то время как в другие флаконы экстракта не добавляют (контроль). Затем исследуют процесс клеточного деления и жизнеспособность раковых клеток. Результаты исследований приведены на фиг. 2(A) и 2(B). Как видно из фиг. 2(A) и 2(B), в контрольных флаконах выявляется эффективный рост раковых клеток фиг. 2(A)), в то время как во флаконах, содержащих опытный экстракт, наблюдается гибель раковых клеток (фиг. 2(B), которая начинается через 3 ч после добавления экстракта и полностью завершается в течение последующих 24 ч. Экспериментальный пример 2. Идентификацию таксанов, полученных из эмбриональных культур тиссового дерева, осуществляют с помощью твердофазного иммуноферментного метода (ELISA) при использовании моноклональных антител, как описано ниже. Набор антител TAO1, специфичных к таксолу, и набор антител TAO3, специфичных к таксанам, купленные у Биотехнологической группы в Гавайях, применяют следующим образом. Антигенные препараты таксола и таксанов разводят в 100 раз фосфатным буферным раствором (PBS) и по 100 мкл раствора вносят в лунки планшета для постановки ELISA. После инкубирования в течение 1 ч при 25oC планшет отмывают раствором TBS-T (отмывающий раствор) по крайней мере 4 раза и добавляют в лунки 50 мкл PBST (фосфатный буферный раствор с твином). Готовят последовательные трехкратные разведения стандартных препаратов таксола, таксанов и экстрактов, полученных согласно примеру 7, и добавляют в соответствующие лунки. Антитела к таксолу и таксанам разводят PBST в 100 и 1000 раз соответственно, и по 50 мкл каждого разведения вносят в лунки. После инкубирования при 25oC в течение 1 ч планшет отмывают с помощью TBS-T четыре раза. 100 мкл пероксидазы хрена разводят PBST в 2000 раз и вносят в лунки, планшет инкубируют при 25oC в течение 1 ч и затем отмывают TBS-T 4 раза. Далее в лунки добавляют 200 мкл OPD ( - нафтилуксусной кислоты, стимулирующей выход целевого продукта. Выделение целевого продукта ведут экстракцией из соматических эмбрионов на стадии культивирования каллуса или из эмбриогенного каллуса на стадии культивирования дезинфицированных эмбрионов. Можно выделить целевой продукт из клеточной суспензионной массы и культуральной среды. Способ обеспечивает более высокий выход таксола и таксонов. 6 з.п.ф-лы, 4 ил, 3 табл.
Область использования изобретения. Изобретение относится к способу получения таксола и его производных из соматических эмбрионов и/или культуральной среды и в особенности касается способа культивирования зиготных эмбрионов или соматических эмбрионов для получения полиэмбрионов или эмбриогенного каллуса. Известный уровень техники. Таксол представляет собой алкалоид, выделенный из растений рода Taxus (тисс) и обладающий значительной противоопухолевой активностью по отношению к различным линиям клеток злокачественных опухолей, в том числе линии меланомных клеток B16. Известно, что в основном таксол содержится в коре растения Taxus brevifolia (тисс коротколистный) в количестве 0,02% на грамм сухого веса. Несмотря на то, что был успешно осуществлен общий синтез таксола, этот процесс, по-видимому, не может быть использован для крупномасштабного коммерческого получения данного вещества из-за своей высокой стоимости. Кроме того, был успешно осуществлен частичный синтез таксол-подобного соединения (например, таксотера, taxotere) при использовании баккатина III или 10-деацетилбаккатина III. Однако эти достижения столкнулись с указанным выше ограничением. Таким образом, таксол может быть получен только из редко встречающихся природных источников, например сырой древесины тиссового дерева. Поскольку содержание таксола в древесине тисса очень не велико, для получения 1 кг таксола необходимо срубить 2000-4000 деревьев, и производство таксола из природных источников в нужном объеме нанесет существенный урон лесным экосистемам. Соответственно, были предприняты попытки получения таксола и родственных ему соединений из клеток и тканевых культур растений рода Taxus species. Например, в патенте США 5019504 описан способ получения таксола или таксол-подобных алкалоидов путем культивирования тканей коры, камбия, иголок и корней различных видов тисса в питательной среде для получения каллуса или суспензионных клеточных культур с последующим выделением таксола или таксол-подобных алкалоидов. Однако с помощью описанного метода можно получить только 1,0 - 3,0 мг таксола из 1 л культуральной среды, в которой выращивалась суспензия клеток. В указанном патенте отмечается, что из коры тиссового дерева можно непосредственным образом получить оптимальный выход таксола, а также производить данный алкалоид путем индукции недифференцированной клеточной массы (каллуса) и/или получения суспензионных клеточных культур из пролиферирующего каллуса и культивирования данных тканей. До настоящего времени вышеуказанный метод, подразумевающий использование различных тканей тиссового дерева, не применяется в коммерческих целях из-за низкой таксолообразующей способности соответствующих клеток и непригодности различных этапов способа для крупномасштабного получения вторичных метаболитов. В Заявке РСТ WO 92/013961 раскрывается способ получения таксола путем культивирования тканей различных видов тисса (Taxus) преимущественно женских гаметофитов, и выделения указанного алкалоида из каллуса или суспензионных клеточных культур, полученных на основе гаметофитов. Данный способ обеспечивает получение 0,05% таксола по сухому весу суспензионных клеточных культур. Описанные способы не позволяют получать достаточное количество таксола в промышленном масштабе и до сих пор их пытаются усовершенствовать с целью повышения выхода таксола. Поэтому можно предположить, что существует необходимость в разработке улучшенного метода повышения содержания таксола в клетках и/или культуральной среде, а также отбора таксолообразующих клеточных линий с целью решения проблемы промышленного получения таксола в больших количествах. В данных обстоятельствах авторы изобретения занимались разработкой способы получения таксола в промышленном масштабе и в первую очередь неожиданно обнаружили, что зиготные эмбрионы содержат гораздо больше таксола в пересчете на сухой вес по сравнению с другими тканями, как это сообщалось раннее. Авторы изобретения провели дальнейшие исследования, направленные на разработку способа увеличения массы эмбрионов, поскольку их размеры сами по себе очень малы, чтобы эмбрионы можно было использовать для коммерческого получения таксола. В результате авторы неожиданно обнаружили, что масса эмбрионов увеличивается в несколько сотен тысяч раз по сравнению с первоначальной, при культивировании эмбрионов в питательной среде с целью индукции соматических эмбрионов или эмбриогенного каллуса. В основе настоящего изобретения лежат вышеприведенные положения. Сущность изобретения. Таким образом, задача изобретения заключается в разработке способа получения таксола путем экстрагирования тканей растений рода Taxus, характеризующегося тем, что указанные ткани представляют собой зиготные эмбрионы. Изобретение заключается в разработке способа получения таксола и таксанов, состоящего из следующих этапов: (а) получения живых зиготных эмбрионов растений различных видов тисса (Taxus) и дезинфицирования их; (б) культивирования указанных дезинфицированных эмбрионов в культуральной среде для получения каллуса из эмбрионов; (в) культивирования каллуса, полученного, как указано в (б) для получения соматических эмбрионов из каллуса; (г) культивирования дезинфицированных эмбрионов (а) или соматических эмбрионов, полученных как указано на стадии (в), для получения эмбриогенного каллуса; (д) культивирования соматических эмбрионов (в) или эмбриогенного каллуса (г); и (е) выделения таксола и таксанов из культуральной среды и клеточной суспензионной массы. Настоящее изобретение отличается от известных, указанных выше технических решений тем, что основано на открытии авторов, которое заключается в том, что зиготные эмбрионы содержат неожиданно большое количество таксола и дальнейшее увеличение массы эмбрионов происходит за счет индукции соматических эмбрионов или эмбриогенного каллуса. Соответственно, преимущество предложенного технического решения по сравнению с известными заключается в возможности его использования для получения таксола в промышленном масштабе путем культивирования соматических эмбрионов или эмбриогенного каллуса в жидкой питательной среде. Другие воплощения настоящего изобретения могут быть легко осуществимы специалистами в данной области исследований на основе приведенного ниже описания. На фиг. 1 (А) приведена храматограмма стандартных таксанов, полученная методом жидкостной хроматографии высокого разрешения (HPLC); на фиг.1(B) - HPLC- хроматограмма очищенной культуральной среды, полученной как описано в примере 7; на фиг.2 (А) - фотография злокачественных опухолевых клеток крысы без обработки экстрактом, полученным согласно примеру 7 (см. экспериментальный пример 1); на фиг 2(B) - фотография злокачественных опухолевых клеток крысы, обработанных экстрактом, полученным согласно примеру 7 (см.экспериментальный пример 1); на фиг.3(А) показана стандартная кривая, полученная методом ELISA; на фиг. 3(B) - кривая, полученная методом ELISA, как описано в экспериментальном примере 2; на фиг.4 приведена диаграмма, отражающая влияние различных сред, предназначенных для образования продукта, на выход таксола (см. пример 8). Подробное описание изобретения. Авторы изобретения анализировали содержание таксола в 24000 деревьев тисса остроконечного (Taxus cuspidata), произрастающих в национальном лесном массиве Кореи. Несмотря на то, что содержание таксола значительно варьировало от дерева к дереву, авторы обнаружили, что при использовании наиболее продуктивных деревьев в 100 г высушенных иголок и коры получают 2,0 мг и 4,5 мг таксола соответственно. Таким образом, в первую очередь задача изобретения заключается в разработке способа получения таксола, причем таксол экстрагируют из эмбрионов растений различных видов тисса (Taxus). Использование деревьев тисса не ограничивается каким-либо определенным видом, и могут быть использованы все растения, принадлежащие к роду Taxus. Тем не менее преимущество отдается тиссу остроконечному (Taxus cuspidata). Для экстракции таксола из эмбрионов в принципе может быть применен любой метод. Однако, в основном, экстракцию таксола из эмбрионов можно осуществить путем помещения лиофилизированного порошка эмбрионов в спирт, преимущественно метанол. К сожалению, размеры зиготных эмбрионов очень невелики и эмбрионы содержат более 90% воды. Огромное количество эмбрионов необходимо для получения чрезвычайно малого количества таксола, и экстракция таксола непосредственно из эмбрионов нецелесообразна с экономической точки зрения. Соответственно, авторы изобретения провели интенсивные исследования по разработке способа получения таксола в промышленном масштабе, решающего указанные выше проблемы, и в результате добились увеличения массы эмбрионов в сотни тысяч раз при использовании технологии культивирования тканей, в особенности посредством индукции соматических эмбрионов и эмбриогенного каллуса. Таким образом, вторая задача изобретения состоит в разработке способа получения таксола или его производных путем индукции соматических эмбрионов или эмбриогенного каллуса из зиготных эмбрионов растений различных видов тисса (Taxus), культивирования указанных соматических эмбрионов или эмбриогенного каллуса в жидкой питательной среде с помощью шейкера или биореактора и выделения таксола из культуральной среды и клеток. Одним из отличительных признаков настоящего изобретения является увеличение массы эмбрионов в десятки и сотни тысяч раз путем индукции соматических эмбрионов или эмбриогенного каллуса, в то время как простой индукцией каллуса из различных тканей, за исключением эмбрионов, трудно добиться такого увеличения массы, возможно благодаря различной способности к делению меристемных клеток. Индукция эмбриогенного каллуса позволяет увеличить массу эмбрионов в сотни тысяч раз и таким образом является очень важным обстоятельством. Индукция соматических эмбрионов или эмбриогенного каллуса из зиготных эмбрионов и получение таксола или его производных будет описано ниже. Для асептического культивирования эмбрионов зрелые или незрелые семена различных видов тисса (Taxus), собранные в период времени с августа по ноябрь, следует дезинфицировать или поверхностно стерилизовать. Дезинфекция или поверхностная стерилизация семян может быть осуществлена известными методами. Например, семена помещают в 70%-ный этанол на 30-60 секунд, затем 2-3 раза промывают стерилизованной водой и поверхностно стерилизуют 1-3%-ным (по объему) раствором гипохлорита натрия в течение 24 ч. Поверхностно стерилизованные семена промывают более 5 раз стерилизованной водой и отделяют эмбрионы. Эмбрионы могут быть использованы для экстракции таксола описанными выше методами. Кроме того, эмбрионы помещают на твердую питательную среду для индукции каллуса. Индукцию соматических эмбрионов можно проводить с помощью методов преэмбриогенных детерминированных клеток(P E D C , от англ. Pre-Embryogenic Determined Cell) или индуцированных эмбриогенных детерминированных клеток (IEDC, от англ. Induced Embryogenic Determined Cell). Индукция соматических эмбрионов методом PEDC осуществляется следующим образом. Эмбрионы культивируют на твердой питательной среде с добавлением 1-нафтален-уксусной кислоты (NAA, от англ. naphtalene acetic acid), кинетина и 2,4-D для индукции каллуса. После этого небольшие кусочки каллуса размножают путем субкультивирования на питательной среде, содержащей необходимое количество макро- и микроэлементов и витаминов. С целью индукции и размножения каллуса без ограничений могут быть использованы обычные для культивирования растительных тканей. Например, среды B5 (модифицированная среда Гамборга B5), Дурзан, MS (среда Мурашиге и Скуг), WPM (Ллоид и МакКоун), DKW (Драйвер-Волнат), GO (Грессхофф и Доу), SH (среда Шенка и Хилдебрандта) или LP (Куорин и Лепиовер). Понятно, что могут иметь место различные модификации указанных питательных сред, например добавления или исключения каких-либо компонентов, а также изменения их количественного соотношения. Среди прочих других предпочтительно используются среды mB5 или Дурзан. На промежуточном этапе соматического эмбриогенеза для индукции может быть использована та же самая среда, что и для быстрого выращивания каллуса, или же среда, отличная от ростовой. Для получения наибольшего количества соматических эмбрионов преимущественно используется среда mB5. Поскольку большинство перечисленных выше питательных сред коммерчески доступны и хорошо известны, их приобретение заинтересованными лицами не вызывает сложностей. Таким образом, любой специалист в данной области исследований может подобрать и/или оптимизировать подходящую культуральную среду для индукции и быстрого выращивания каллуса. Например, это может быть среда mB5, преимущественно используемая согласно настоящему изобретению, которая представляет собой модифицированную среду B5 Гамборга. Ее состав приведен в табл. 1. Помимо этого, методика IEDC для получения соматических эмбрионов может осуществляться путем культивирования эмбрионов в описанной выше среде, в которую альтернативно добавлены различные гормоны роста растений. В первоначальные культуры добавляют 2-4 ppm (фемтомоля -10-16 мол 2,4-D. Когда на поверхности эмбрионов формируется каллус и клеточная масса увеличивается в 10-20 раз, субкультивирование обычно продолжают в той же самой среде, содержащей половинную концентрацию ауксина. Поскольку большая часть каллуса теряет ростовые свойства из-за выделения непролиферирующими клетками фенольных соединений, в питательную среду добавляют 0,5% (вес на объем) активированного угля или 1-2% (вес на объем) поливинилпирролидона. Каллус субкультивируют на среде, свободной от регулятора роста, в течение 2-4 месяцев для формирования соматических эмбрионов из меристемных тканей каллуса. Сформированные таким образом соматические эмбрионы содержат большое количество таксола или его производных (далее таксанов) и могут быть непосредственно использованы для экстракции таксанов которую осуществляют известными методами, в особенности методом, описанным ниже. Однако соматические эмбрионы преимущественно используются для индукции эмбриогенного каллуса с целью дальнейшего увеличения клеточной массы. Согласно настоящему изобретению, относительно большое количество таксанов может быть получено путем экстракции эмбриогенного каллуса, так же как и соматических эмбрионов. Эмбриогенный каллус может быть получен при культивировании соматических эмбрионов, полученных методом PEDC или IEDC, как описано выше, или при культивировании зиготных эмбрионов. Методика получения эмбриогенного каллуса заключается в следующем. Дезинфицированные эмбрионы или соматические эмбрионы культивируют в течение 2-4 месяцев на твердой питательной среде, пригодной для индукции каллуса, в которую добавляют 1,0-4,0 ppm NAA и 0,5-2,0 ppm кинетина, предпочтительно 2,0 ppm NAA и 1,0 ppm кинетина. Вместо NAA и кинетина в среду может быть добавлено 1,4 ppm 2,4-D. Индуцированный каллус затем культивируют на той же самой среде с добавлением 1-5 ppm цитокина, например бензиламинопурина, кинетина или зеатина, в течение 1-2 месяцев для формирования эмбриоидов на поверхности каллуса. Далее эмбриоиды культивируют на той же самой питательной среде с 2-10 ppm 2,4-D при t около 26oC в течение 2-3 месяцев в условиях светового режима 16 ч света/8 ч темноты. Указанная процедура позволяет получить эмбриогенный каллус в чрезвычайно большом количестве, которое в сотни тысяч раз превышает первоначальную массу эмбрионов. Эмбриогенный каллус имеет разнообразную окраску, например от желтой и коричневой до зеленой. Для индукции и пролиферации эмбриогенного каллуса могут быть использованы различные тканевые культуры и соответствующие определенным растительным клеткам питательные среды. Полученный, как описано выше, эмбриогенный каллус содержит большое количество таксола и может быть непосредственно использован для экстракции таксола и таксанов. Экстракцию эмбриогенного каллуса осуществляют известными методами, предпочтительно методом, описанным ниже. С целью увеличения массы эмбриогенного каллуса в процессе промышленного производства, эмбриогенный каллус асептически нарезают для получения отдельных клеток или небольших клеточных агрегатов. Чтобы получить суспензионные культуры, 10% /по объему/ указанных клеток вносят в 250-мл конические флаконы, содержащие 50 мл жидкой питательной среды с добавлением 2 ppm 2,4-D. Для длительного культивирования преимущественно используют биореакторы с воздушным или механическим перемешиванием. Культивирование в биореакторах осуществляют при использовании двух различных культуральных сред: одной для роста клеток (ростовая среда) и другой - для получения таксанов (среда для получения продукта). В качестве ростовой среды преимущественно используют среду mB5 с добавлением 2-4 ppm 2,4-D, а в качестве среды для получения продукта - MS с добавлением 2-10 ppm NAA. Следует отметить, что среда для получения продукта предпочтительно содержит стимуляторы для увеличения выхода таксола, которые могут быть получены из грибов, а также представлять собой экстракт женских гаметофитов (1,5 мл/л), фенилаланин (50-300 мМ) и GA3 (0,5-1,0 ppm). Примерами грибов, из которых получают стимуляторы, служат Cytospora аbietis ATCC N 38688 и Penicillium minioluteum (Dierckx) NRRL 18467. Клетки грибов растирают в порошок и последовательно экстрагируют для получения экстракта. Кроме того, предпочтительно использование экстракта из культивируемых грибов рода Pestalotiopsis, который добавляют в питательную среду в количестве 0,5-1,0 мл/л. Таксол обнаруживается в самих клетках и, кроме того, секретируется в культуральную среду. Соответственно, после завершения этапа культивирования в жидкой питательной среде таксол и таксаны выделяют из культур или среды с помощью хорошо известных методик. Отделение клеток от культуральной среды осуществляют путем центрифугирования (например, при 1000 g в течение 5-10 мин) или декантирования. В последнем случае культуры оставляют на 24 ч для осаждения клеток и сливают культуральную среду. Остатки среды отсасывают пастеровской пипеткой с помощью вакуумного насоса. Таксаны получают из соматических эмбрионов или эмбриогенного каллуса, а также из культуральной среды путем экстракции с помощью спирта или смеси метанола и метиленхлорида в соотношении 1:1. Осадок клеток, образовавшийся в результате центрифугирования, может быть разрушен ультразвуком (Branson 250) и использован для экстракции. Согласно настоящему изобретению могут быть получены как таксол, так и различные производные таксола. К последним относятся 10-деацетилбаккатин III, баккатин III, 10-деацетил таксол, цефанолманнин и 7-эпи-10-деацетил таксол /см. фиг. 1(B)/. Производные таксола могут быть использованы как сами по себе, так и в качестве исходных компонентов для синтеза таксола, если это необходимо. Свойства таксанов, выделенных из соматических эмбрионов и эмбриогенного каллуса, полученных путем индукции при культивировании зиготных эмбрионов, исследуют с помощью HPLC, теста цитотоксичности и твердофазного иммуноферментного анализа (ELISA) при использовании таксола и шести его производных, которые являются стандартами NCI. Настоящее изобретение более подробно описано в нижеследующих примерах, но не ограничивается ими. Пример 1. Получение таксола из зиготных эмбрионов различных видов тисса (Taxus). Собирают семена с лучших деревьев Taxus cuspidata. Эмбрионы высушивают в ваккумной печи при температуре около 40oC в течение трех дней, чтобы содержание воды составляло менее 10%, и взвешивают. Затем эмбрионы замораживают в жидком азоте и растирают в порошок, который помещают в инкубатор, содержащий в 100 раз большее количество метанола /по весу/, и выдерживают при температуре около 28oC в течение 7 дней. Полученный экстракт пропускают через мембранный фильтр с размерами пор 0,2 мкм и анализируют на содержание таксола с помощью HPLC. С тех же самых деревьев собирают иголки и кору, полученный материал обрабатывают и анализируют на содержание таксола согласно описанной выше методике. Полученные результаты приведены в табл. 2. Пример 2. соматические эмбрионы получают из эмбрионов с помощью методики PEDC. Семена Taxus cuspidata поверхностно стерилизуют, помещая их в 700-ный этанол и 2%-ный гипохлорит натрия на 50 с и 24 ч соответственно и затем 3-5 раз отмывая дистиллированной водой. В качестве культуральной среды используют среду mB5 /состав и соотношение компонентов приведены в табл. 1/ с добавлением 2,0 ppm NAA, 0,5 ppm кинетина и 0,5 ppm 2,4-D. In vitro культуры выращивают в специальной комнате при to 26oC в течение 8 недель. За это время эмбрионы увеличиваются в размерах, и на поверхности большинства из них индуцируется каллус. Зеленые кусочки каллуса вырезают и культивируют в среде mB5 без добавления каких-либо регуляторов роста растений в течение 3 месяцев для индукции соматических эмбрионов. Пример 3. Соматические эмбрионы получают из зиготных эмбрионов с помощью методики IEDC. Семена Taxus cuspidata стерилизуют согласно методике, описанной в примере 2, и выделяют из них эмбрионы, которые затем культивируют в среде Дурзан с добавлением 2 ppm 2,4-D при 23-28oC в течение 2 недель. Через 2 недели культивирования все эмбрионы полностью покрываются индуцированным из них каллусом. Через 4 недели масса каллуса увеличивается в несколько десятков раз по сравнению с первоначальной. Чтобы избежать ингибирования роста каллуса и гибели клеток под воздействием секретируемого ими фенола, проводят пересев каллуса при использовании той же самой ростовой среды, но в которую добавлено около 1% поливинилпирролидона. После 8 недель культивирования, когда средний диаметр каллусной массы достигает 1-1,5 см, каллус помещают в среду mB5, не содержащую регуляторов роста растений, в которой каллус подращивают с целью индукции соматических эмбрионов. В некоторых из них наблюдается индукция корней. Пример 4. Для индукции эмбриогенного каллуса в качестве исходного материала используют стерилизованные зиготные эмбрионы (пример 2) и соматические эмбрионы (примеры 3, 4). Указанные выше эмбрионы культивируют при 23-28oC около 2,5 месяцев в среде mB5 с добавлением 2,0 ppm NAA и 1,0 ppm кинетина для индукции каллуса. После завершения индукции каллуса проводят субкультивирование каллуса примерно в течение 6 недель в этой питательной среде с добавлением 3 ppm зеатина и получают желтовато-зеленые эмбриоиды. Эмбриоиды культивируют в указанной питательной среде, содержащей 3 ppm 2,4-D при 26oC около 2 месяцев при световом режиме 16/8 ч (свет/темнота) для образования эмбриогенного каллуса, масса которого в сотни тысяч раз превышает первоначальную массу эмбрионов. Эмбриогенный каллус по морфологии отличается от обычного каллуса, полученного из различных тканей тисса, и иногда выглядит как зиготные эмбрионы. Однако поверхность эмбриогенного каллуса состоит из разнообразных по цвету участков: красных, желтых, темно-зеленых, светло-коричневых, темно-зеленых и черных. Клеточную массу каждого цвета разрезают лезвием для получения небольших клеточных агрегатов, которые затем субкультивируют в жидкой среде в течение 2-4 недель. После удаления крупных скоплений клеток из указанных культур отдельные клетки и/или небольшие клеточные агрегаты вносят в пластмассовые чашки Петри, содержащие 20 мл культуральной среды. Через 4 недели жидкостного культивирования отбирают различным образом окрашенные клетки. Такая визуальная селекция для получения клеточных линий, имеющих различную цветовую окраску, является обычной процедурой в данной области исследований. Пример 5. Соматические эмбрионы, полученные, как описано в примерах 2 и 3 или эмбриогенный каллус, полученный как описано в примере 4, высушивают при 25oC и растворяют в 1 мкл метиленхлорида. Добавляют 1 мкл дистиллированной воды, перемешивают в течение 10 с и затем центрифугируют при 25000 g. Осадок высушивают при 25oC, растворяют в 50 мкл метанола и пропускают раствор через фильтр с размером пор 0,2 мкм для получения экстракта. Экстракты анализируют методом HPLC при использовании обратно-фазовой микропористой колонки в сравнении с контрольной кривой (коэффициент корреляции 0,999), построенной с помощью известных стандартных препаратов. Результаты HPLC показывают, что пик стандартных таксанов и тех, которые содержатся в опытных экстрактах (см. выше), выявляется при одном и том же времени задержки (14,3 мин). Пример 6. Соматические эмбрионы (примеры 2 и 3) и эмбриогенный каллус (пример 4) экстрагируют для получения таксанов, как описано ниже. Каждые 0,5 г соматических эмбрионов (пример 2 и 3) и эмбриогенного каллуса (пример 4) помещают в центрифужную пробирку и добавляют 2 мкл гексена. Смесь хорошо перемешивают с помощью стеклянной палочки, хранят при -20oC в течение 12 ч и центрифугируют при 25oC и 25000 g 20 мин. К преципитатам добавляют смесь метанола и этиленхлорида и обрабатывают ультразвуком в соникаторе Branson 250. Полученный раствор центрифугируют при 25000 g и преципитаты высушивают при 60oC до полной потери влажности с целью получения экстрактов. Экстракты анализируют на содержание таксола и получают следующие результаты: экстракт соматических эмбрионов (пример 2) содержит 0,21-0,27 мг таксола на 1 г сухих клеток (общее содержание таксола составляет 0,5-1,2 мг), экстракт соматических эмбрионов по примеру 3 содержит 0,20-0,27 мг таксола на 1 г сухих клеток (общее содержание таксола - 0,55-1,1 мг) и экстракт эмбриогенного каллуса (пример 4) содержит 0,23-0,28 мг таксола на 1 г сухого веса (общее содержание таксола - 0,6-1,4 мг). Пример 7. Для получения большой массы эмбриогенного каллуса, полученного, как описано в примере 4, его культивируют в биореакторе с лопастным перемешиванием. Эмбриогенный каллус, полученный согласно примеру 4, вносят в количестве до 10% (по объему) в 250-мл колбу Эрленмейера, содержащую 50 мл жидкой среды mB5 с добавлением 2 ppm 2,4-D. После 18 дней культивирования при 25-28oC в стерильных условиях устанавливается стационарная фаза. Культуры помещают в пятилитровый биореактор с лопастным перемешиванием, содержащий среду MS с добавлением 2 ppm NAA (среда для получения продукта). Культивирование проводят при 25-28oC в течение 30 дней в аэробных условиях. По истечении этого срока культуральную суспензию оставляют на 24 ч для осаждения клеток и отделяют клетки от культуральной среды. Для наиболее полного удаления среды используют пастеровскую пипетку. Полученные клетки и культуральную среду подвергают экстракции для выделения таксола и его производных, как описано в примере 5. Результаты HPLC показывают, что пики стандартного препарата таксола и его производных /фиг 1(А)/, а также таксола и его производных, полученных в результате экстракции /фиг.1 (А)/, выявляются при одном и том же времени задержки, что свидетельствует об идентичности известных и полученных путем экстракции веществ. Установлено, что содержание таксола составляет 0,09 мг на 1 г высушенных клеток, в то время как в культуральной среде выявляется около 8 мг таксола на 1 л среды. Пример 8. Для определения зависимости выхода таксола от типа культуральной среды, культуры, полученные как описано в примере 7, помещают в различные питательные среды, такие как MS, mB5, WPM, OKW, Дурзан, Уайт, LP, GO, B5, DCR или SH. Во все исследуемые среды добавляют 2ppm NAA и в сбалансированных количествах факторы микроокружения. Время культивирования составляют около 20 дней. Результаты исследований приведены на фиг.4. Как видно из представленной диаграммы, образование таксола существенно зависит от типа культуральной среды, и наибольшей выход таксола наблюдается при использовании сред MS и mB5. Пример 9. С целью выхода увеличения таксола и таксанов в среду для получения продукта могут быть добавлены различные стимуляторы. Влияние стимуляторов на образование таксола оценивают следующим образом. (1) Согласно настоящему изобретению, в среду для получения продукта в качестве стимулятора образования таксола добавляют экстракт гриба Pestalotiopsis sp., который встречается на различных видах тисса. Ткани растений, например семена или внутренний слой коры, помещают в 70%-ный этанол, поверхностно стерилизуют с помощью 15%-ного H2O2 в течение 15 мин и затем опять помещают в 70%-ный этанол. После этого ткани четыре или более раз отмывают стерильной дистиллированной водой для удаления химических веществ. Таким образом поверхностно-стерилизованные ткани помещают на следующие среды: агаровую среду с солодовым экстрактом (20,0 г солодового экстракта, 5,0 г пептона и 1 л дистиллированной воды), ростовую агаровую среду (40 г глюкозы, 10 г бактосоутона, 1 г ацетата натрия, 50 мг бензоата натрия, 20,0 г агара и 1 л дистиллированной воды) и водную среду (20,0 г агара на 1 л дистиллированной воды). Культуры помещают в термостат, контролирующий рост клеток, при использовании светового режима 12 ч темноты/12 ч дня. После того как в течение трех дней обнаруживается рост грибов Pestalotiopsis sp., их далее культивируют на солодовом экстракте и ростовой агаровой среде (3 г дрожжевого экстракта, 5 г бактосоутона, 0,5 Mg SO4, 5 г глюкозы и 10 г/л сахарозы) в течение 4 дней. В определенное время культуральную среду центрифугируют для отделения клеток. Клетки высушивают, размельчают в порошок и экстрагируют метанолом для получения углеводной фракции. Полученный, как описано выше, углеводный экстракт Pestalotiopsis sp. добавляют к среде для получения продукта в количестве 1 ppm и осуществляют культивирование и анализ полученных результатов, согласно примеру 7. Результаты исследований приведены в табл. 3. (2) Процедуру, описанную в примере 7, повторяют, за тем исключением, что в качестве стимуляторов в среду для получения продукта добавляют экстракт женских гаметофитов (2 мл/л, (фенилаланин (100 мМ) или гиббереллиновую кислоту. Результаты исследований приведены в табл. 3. Экспериментальный пример 1. Биологические свойства таксола, полученного с помощью эмбриональных культур тиссового дерева, исследуют в цитотоксическом тесте при использовании раковых клеток крысы. Указанная методика обычно основывается на том, что таксол способен вызывать гибель отдельных раковых клеток на стадии метафазы клеточного деления. Раковые клетки крысы, полученные из Центрального исследовательского центра Пасифик Корпорейшн в г. Сигнале, Куонгги-до, Корея, помещают в пластиковые флаконы, содержащие среду для культивирования животных клеток. На ранней стадии культивирования, когда наступает деление клеток, в одну партию флаконов добавляют каплю экстракта, полученного, как описано в примере 7, в то время как в другие флаконы экстракта не добавляют (контроль). Затем исследуют процесс клеточного деления и жизнеспособность раковых клеток. Результаты исследований приведены на фиг. 2(A) и 2(B). Как видно из фиг. 2(A) и 2(B), в контрольных флаконах выявляется эффективный рост раковых клеток фиг. 2(A)), в то время как во флаконах, содержащих опытный экстракт, наблюдается гибель раковых клеток (фиг. 2(B), которая начинается через 3 ч после добавления экстракта и полностью завершается в течение последующих 24 ч. Экспериментальный пример 2. Идентификацию таксанов, полученных из эмбриональных культур тиссового дерева, осуществляют с помощью твердофазного иммуноферментного метода (ELISA) при использовании моноклональных антител, как описано ниже. Набор антител TAO1, специфичных к таксолу, и набор антител TAO3, специфичных к таксанам, купленные у Биотехнологической группы в Гавайях, применяют следующим образом. Антигенные препараты таксола и таксанов разводят в 100 раз фосфатным буферным раствором (PBS) и по 100 мкл раствора вносят в лунки планшета для постановки ELISA. После инкубирования в течение 1 ч при 25oC планшет отмывают раствором TBS-T (отмывающий раствор) по крайней мере 4 раза и добавляют в лунки 50 мкл PBST (фосфатный буферный раствор с твином). Готовят последовательные трехкратные разведения стандартных препаратов таксола, таксанов и экстрактов, полученных согласно примеру 7, и добавляют в соответствующие лунки. Антитела к таксолу и таксанам разводят PBST в 100 и 1000 раз соответственно, и по 50 мкл каждого разведения вносят в лунки. После инкубирования при 25oC в течение 1 ч планшет отмывают с помощью TBS-T четыре раза. 100 мкл пероксидазы хрена разводят PBST в 2000 раз и вносят в лунки, планшет инкубируют при 25oC в течение 1 ч и затем отмывают TBS-T 4 раза. Далее в лунки добавляют 200 мкл OPD (  -фенилендиамина) и планшет инкубируют при 25oC в течение 1 ч до развития окраски. С помощью автоматического считывающего устройства измеряют поглощение при 490 нм. Результаты исследований приведены на фиг. 3(A) для стандартного препарата таксола и на фиг. 3(B) - для культуральной среды, полученной согласно примеру 7. Приведенные данные свидетельствуют о том, что в эмбриональных культурах различных видов тисса (Taxus) обнаруживается активность таксола. Очевидно, что приведенное выше детальное описание изобретения лишь иллюстрирует его, и могут иметь место другие модификации и варианты изобретения, не выходящие за его пределы и не меняющие его сущность. -фенилендиамина) и планшет инкубируют при 25oC в течение 1 ч до развития окраски. С помощью автоматического считывающего устройства измеряют поглощение при 490 нм. Результаты исследований приведены на фиг. 3(A) для стандартного препарата таксола и на фиг. 3(B) - для культуральной среды, полученной согласно примеру 7. Приведенные данные свидетельствуют о том, что в эмбриональных культурах различных видов тисса (Taxus) обнаруживается активность таксола. Очевидно, что приведенное выше детальное описание изобретения лишь иллюстрирует его, и могут иметь место другие модификации и варианты изобретения, не выходящие за его пределы и не меняющие его сущность.
Формула изобретения1. Способ получения таксола и таксанов из эмбриональных культур растений Taxus, включающий вычленение экспланта, его дезинфицирование и культивирование на твердой питательной среде до индукции каллуса, пересадку каллуса в жидкую питательную среду для последующего получения клеточной суспензионной культуры, выделение целевого продукта, отличающийся тем, что в качестве экспланта вычленяют зиготные эмбрионы из семян, каллусную ткань культивируют до образования соматических эмбриоидов, после чего культивируют до получения эмбриогенного каллуса, который пассируют в жидкую питательную среду и культивируют вначале на питательной среде до увеличения клеточной массы, а затем на среде, стимулирующей выход целевого продукта, при этом выделение целевого продукта осуществляют из соматических эмбрионов на стадии культивирования каллуса или из эмбриогенного каллуса на стадии культивирования дезинфицированных эмбрионов или из клеточной суспензионной массы и культуральной среды. 2. Способ по п. 1, отличающийся тем, что индуцирование соматических эмбрионов осуществляют по методике PEDC-преэмбриогенных детерминированных клеток или IEDC-индуцированных эмбриогенных детерминированных клеток. 3. Способ по п. 1, отличающийся тем, среда для увеличения клеточной массы представляет собой модифицированную среду Гамборга mB5, содержащую 2-4 ppm 2,4 D, а среда для стимуляции выхода целевого продукта представляет собой среду Мурасиге и Скуга MS или Гамборга mB5, содержащие 1-2 ppmNAA. 4. Способ по п. 1, отличающийся тем, что среда для стимуляции выхода целевого продукта содержит в качестве стимулятора углеводную фракцию, полученную экстракцией грибов, растущих на различных видах Тисса, или экстракт женских гаметофитов различных видов Тисса или фенилаланин или гибберелин. 5. Способ по п. 4, отличающийся тем, что в качестве стимулятора используют экстракт грибов рода Pestalotiopsis sp. 6. Способ по п. 1, отличающийся тем, что культивирование зиготных и соматических эмбрионов для получения каллусной ткани осуществляют на твердой питательной среде, содержащей 1,0-4,0 ppm NAA и 0,5-2,0 ppm кинетина, а культивирование полученной каллусной ткани осуществляют на той же среде, содержащей 1-5 ppm цитокинина, бензиламинопурина, или N-изопентениламинопурина, или кинетина, или зеатина, до формирования эмбриоидов, которые культивируют на той же среде, содержащей 2-10 ppm 2,4D до образования эмбриогенного каллуса. 7. Способ по п. 1, отличающийся тем, что экспланты вычленяют от Тисса вида Taxus cuspidata.MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 07.07.2000 Извещение опубликовано: 27.10.2004 БИ: 30/2004 Популярные патенты: 2269243 Капсулированный посадочный материал с регулируемыми свойствами и способ его получения ... или снос ветром.Капсулирование семян по данному способу обеспечивает незначительный расход питательных веществ в сравнении со сплошной или рядовой обработкой посевных площадей органическими и неорганическими удобрениями.Использование капсулированного посадочного материала снижает расход удобрений за счет адресной доставки их к каждому растению индивидуально.Использование капсулированного посадочного материала повышает устойчивость растений к заморозкам и к засухе.Пористая структура оболочки является эффективным носителем стимуляторов роста, микро- и макроэлементов, гербицидов и инсектицидов.Пористая структура оболочки улучшает дренаж, способствует развитию более разветвленной ... 2468582 Инсектицидно-фунгицидный состав и способ борьбы с вредителями и болезнями крестоцветных культур ... установок по обработке семян, которых практически нет в коллективных и фермерских хозяйствах. В связи с этим использование этих препаратов в нашей стране крайне ограничено.Наиболее близкими к заявляемой группе изобретений (прототипом) являются известные инсектицидно-фунгицидный состав и способ борьбы с вредителями и болезнями с/х культур (патент РФ 2402215, по заявке 2009123795 от 22.06.2009, опубликованный 27.10.2010), которые могут быть использованы для борьбы с почвообитающими вредителями с целью повышения урожайности с/х культур, в частности крестоцветных, путем обработки их семян. Состав содержит фунгицид ТМТД (34,6-14,6 мас.%), инсектицид ДИАЗИНОН (11,7-25,0 ... 2084132 Устройство для выращивания растений ... известного устройства является то, что оно не обеспечивает возможность перемещения корневой системы в процессе роста растений, отсутствует контроль солевого состава и влажности непосредственно в растильне, что в конечном счете не обеспечивает в достаточной степени нормальных условий жизнеобеспечения корневых систем растений и, следовательно, снижает урожайность выращиваемых культур. Была поставлена задача создания устройства для выращивания растений, обеспечивающего улучшение условий жизнеобеспечения корневых систем растений. Заявляемым изобретением решена задача улучшения условий жизнеобеспечения корневых систем растений, что стимулирует рост растений и, следовательно, ... 2288561 Устройство для предпосевной обработки семян растений ... Константинович,Федоров Михаил Анатольевич,Филиппов Денис Александрович (73) Патентообладатель: Общество с ограниченной ответственностью "ПЛАЗМАС" Договор № РД0043309 зарегистрирован 13.11.2008 Извещение опубликовано: 27.12.2008 БИ: 36/2008 MM4A Досрочное прекращение действия патента из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 14.07.2010 Дата публикации: ... 2426302 Всепогодная теплица ... 111 входит в углубление 112, и в этом положении секционные части 11a и 11b связаны и скреплены друг с другом. Хотя это и не показано, секционные части 11b и 11с связаны и скреплены друг с другом аналогичным образом.Как показано на фиг.2, на земле в два ряда на расстоянии, равном ширине теплицы 1, расположено множество опорных блоков 30. Каждый опорный блок 30 имеет преимущественно U-образную форму в поперечном разрезе, как это показано на фиг.5, при этом нижний участок каждой секционной части входит в U-образный участок опорного блока 30. Опорный блок 30 изготовлен из бетона. На фиг.2 показано, что часть опорного блока 30 находится под землей для крепления опорного блока 30 на ... |
Еще из этого раздела: 2053664 Медогонка 2167648 Средство для защиты от укусов кровососущих насекомых (варианты) и способ его получения 2228022 Способ ведения виноградных кустов 2114107 Производные триазола, способ их получения и инсектоакарицидная композиция 2161402 Способ акселерационного содержания и разведения кроликов 2404898 Устройство на воздушной подушке для разбрасывателей органоминеральных удобрений 2150193 Установка для бесфреонового охлаждения молока 2180475 Устройство для поштучной подачи предметов, в частности семян сельскохозяйственных культур 2403705 Способ автоматического управления температурно-световым режимом в теплице 2182765 Имитатор звуков рыб |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||