Производные маркфортин-парагерквамида, способ подавления вредителей растений, насекомых или нематод штамм грибаПатент на изобретение №: 2107687 Автор: Бюнг Хюн Ли[KR], Ренейт Н.Тейлор[US], Ховард А.Вейли[US], Стефен Дж.Нельсон[US], Винсент П.Маршал[US] Патентообладатель: Дзе Апджон Компани (US) Дата публикации: 27 Марта, 1998 Изображения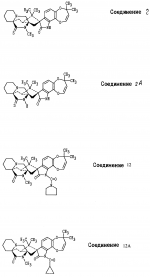 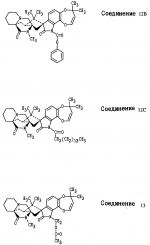 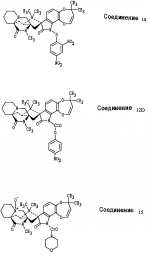 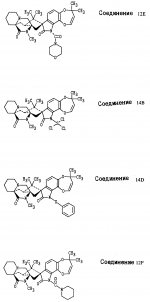 Раскрыты 18-тиомаркфортин производные природных продуктов маркфортин А, В и С, С-13 тиопарагерквамида и их производные, новые N-1 маркфортины А, В и С и их производные, новый N-1 парагерквамид и его производные, полезные в лечении и предупреждении инфекций, вызванных гельминтами и членистоногими у животных и растений. Синтетические производные имеют формулу 1. 3 с. и 4 з. п. ф-лы, 2 табл. 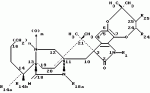 .
Маркфортины являются известными соединениями и описаны Polonsky et al. B. Journal of the Cemical Society Chemical Communications, 1980, 601-602 (Маркфотин A) и Tetrahedron Letters, 1981, 22 1977-1980 (Маркфотины B и C). Соединения являются грибковыми метаболитами Penicillium rogneforti. Макрофортины структурно относятся к парагерквамидам, которые также являются известными соединениями Парагерквамиды раскрыты Yamazaki at al Tefraheolron Letters 1981 22 135-136, и Blanchflower et.al. Journal of Antibiotirs, 1991, 44, 492-497. Патент США 4 866 060 и 4 923 867 описывают применение маркфортинов A, B и C и нескольких их производных, как пригодных для лечения и профилактики болезней, вызываемых паразитами у животных. Парагерквамид имеет следующую структуру: .
Маркфортины являются известными соединениями и описаны Polonsky et al. B. Journal of the Cemical Society Chemical Communications, 1980, 601-602 (Маркфотин A) и Tetrahedron Letters, 1981, 22 1977-1980 (Маркфотины B и C). Соединения являются грибковыми метаболитами Penicillium rogneforti. Макрофортины структурно относятся к парагерквамидам, которые также являются известными соединениями Парагерквамиды раскрыты Yamazaki at al Tefraheolron Letters 1981 22 135-136, и Blanchflower et.al. Journal of Antibiotirs, 1991, 44, 492-497. Патент США 4 866 060 и 4 923 867 описывают применение маркфортинов A, B и C и нескольких их производных, как пригодных для лечения и профилактики болезней, вызываемых паразитами у животных. Парагерквамид имеет следующую структуру: 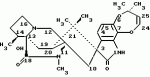 Макркфотрин A имеет следующую структуру: Макркфотрин A имеет следующую структуру: 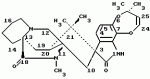 Маркфортин B имеет следующую структуру: Маркфортин B имеет следующую структуру: 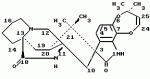 Маркфортин C имеет следующую структуру: Маркфортин C имеет следующую структуру: 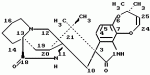 WO 91/09961 (опубл. 11 июня 1991 г.) описывает различные производные маркфортина и парагерквамида и их (12) окисей также как и получение VW 29919 (парагерквамид) и VM 55596 (N(12) окись парагерквамида) (помимо прочего) из Penicillinm Sp. IMI 332995. Патент США 4 873 247 описывает производные парагеркамида и штамм Penicillinm charlessi MF 5123 (ATCC 20841) для получения парагерквамида. Патент США 4 978 656 (также как и EP 390532-A, EP-301742-A) описывает различные синтетические производные, а также получение парагерквамида из Penicilli um charlelli MF 5123 (ATCC 20841). Парагерквамид является соединением, продуцируемым при определенных условиях грибкового организмом Penicillium paraherguei. WO 92/00300 (опубл. 9 января 1992 г.) раскрывает синтезы соединений, относящихся к парагерквамиду, полученных из (продуцированных) Penicillium paraherguei депонированном в С. А. В. International Mycological Institute, Ferry Lane, Kew, London под номером CMI 68220. Данное изобретение касается синтезов C-18 тиомаркфортинов A, B и C и их производных, C-18 тиопарагерквамида и его производных, новых N - I маркфортинов, A, B и C и их производных, нового N - I парагерквамида и его производных, и применения этих соединений в качестве прооивопаразитных агентов. Цель изобретения состоит в описании этих производных тиомаркфортина, тиопарагерквамида, маркфортина и парагерквамида. Кроме того, целью данного изобретения является описание способа получения этих соединений. Дальнейшая цель состоит в описании применения данных соединений в качестве противопаразитных агентов в лечении и профилактике болезней, вызываемых паразитами. Кроме того, дальнейшей целью является описание композиций для лечения заболеваний, вызываемых паразитами, содержащих новые соединения данного изобретения в качестве их активного ингредиента. Соединения данного изобретения представлены формулой I: WO 91/09961 (опубл. 11 июня 1991 г.) описывает различные производные маркфортина и парагерквамида и их (12) окисей также как и получение VW 29919 (парагерквамид) и VM 55596 (N(12) окись парагерквамида) (помимо прочего) из Penicillinm Sp. IMI 332995. Патент США 4 873 247 описывает производные парагеркамида и штамм Penicillinm charlessi MF 5123 (ATCC 20841) для получения парагерквамида. Патент США 4 978 656 (также как и EP 390532-A, EP-301742-A) описывает различные синтетические производные, а также получение парагерквамида из Penicilli um charlelli MF 5123 (ATCC 20841). Парагерквамид является соединением, продуцируемым при определенных условиях грибкового организмом Penicillium paraherguei. WO 92/00300 (опубл. 9 января 1992 г.) раскрывает синтезы соединений, относящихся к парагерквамиду, полученных из (продуцированных) Penicillium paraherguei депонированном в С. А. В. International Mycological Institute, Ferry Lane, Kew, London под номером CMI 68220. Данное изобретение касается синтезов C-18 тиомаркфортинов A, B и C и их производных, C-18 тиопарагерквамида и его производных, новых N - I маркфортинов, A, B и C и их производных, нового N - I парагерквамида и его производных, и применения этих соединений в качестве прооивопаразитных агентов. Цель изобретения состоит в описании этих производных тиомаркфортина, тиопарагерквамида, маркфортина и парагерквамида. Кроме того, целью данного изобретения является описание способа получения этих соединений. Дальнейшая цель состоит в описании применения данных соединений в качестве противопаразитных агентов в лечении и профилактике болезней, вызываемых паразитами. Кроме того, дальнейшей целью является описание композиций для лечения заболеваний, вызываемых паразитами, содержащих новые соединения данного изобретения в качестве их активного ингредиента. Соединения данного изобретения представлены формулой I: 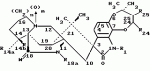 где m - 0 или 1; n = 1; W = 5 или 0, R14a или R14b - атом водорода; R24 и R25 образуют двойную связь; R18a - атом водорода или C1-C7 - алкил; R1 - атом водорода; -C(O)R1 группа (где R1 - цикло C3-C8 - алкил, феноксикарбонил, -C(O)-C2-C24-алкил, нитрофеноксикарбонил, 1,3-диоксо-2H-изоиндолил, динитробензолсульфенил, трихлорметилсульфенил, C1-C4-алкоксикарбонилсульфенил, бензолсульфонил, тетрагидрофуранил, 1,4-диокси-C2-C7-алкенил или R1 - группа -C(O)-NR4R5, где R4 и R5 вместе с атомом азота образуют насыщенное гетероциклическое кольцо: пирролидинил, морфолинил, пиперазинил, незамещенный или замещенных C1-C4-алкилом, C1-C4-алканоилом, C1C4-алкоксикарбонилом, 1,3- бензодиоксолил -C1-C4-алкилом, пиридинилом, галогенпиридинилом, фенилом (незамещенным или замещенным атомом галогена), хлоркарбонилом, трифтор C1-C4-алкоксикарбонилом, трифтор C1-C4-алкилтиадиазолинилом, или R4 и R5 образуют пиперидинил, незамещенный или замещенный фенилом или моно- или ди-замещенный C1-C4-алкилом, или их фармацевтически приемлемые соли, или их гидраты. Другой аспект данного изобретения составляет 18-тиомаркифтортин или производные формулы II где m - 0 или 1; n = 1; W = 5 или 0, R14a или R14b - атом водорода; R24 и R25 образуют двойную связь; R18a - атом водорода или C1-C7 - алкил; R1 - атом водорода; -C(O)R1 группа (где R1 - цикло C3-C8 - алкил, феноксикарбонил, -C(O)-C2-C24-алкил, нитрофеноксикарбонил, 1,3-диоксо-2H-изоиндолил, динитробензолсульфенил, трихлорметилсульфенил, C1-C4-алкоксикарбонилсульфенил, бензолсульфонил, тетрагидрофуранил, 1,4-диокси-C2-C7-алкенил или R1 - группа -C(O)-NR4R5, где R4 и R5 вместе с атомом азота образуют насыщенное гетероциклическое кольцо: пирролидинил, морфолинил, пиперазинил, незамещенный или замещенных C1-C4-алкилом, C1-C4-алканоилом, C1C4-алкоксикарбонилом, 1,3- бензодиоксолил -C1-C4-алкилом, пиридинилом, галогенпиридинилом, фенилом (незамещенным или замещенным атомом галогена), хлоркарбонилом, трифтор C1-C4-алкоксикарбонилом, трифтор C1-C4-алкилтиадиазолинилом, или R4 и R5 образуют пиперидинил, незамещенный или замещенный фенилом или моно- или ди-замещенный C1-C4-алкилом, или их фармацевтически приемлемые соли, или их гидраты. Другой аспект данного изобретения составляет 18-тиомаркифтортин или производные формулы II 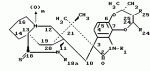 или N-1-маркфтортин IV или N-1-маркфтортин IV 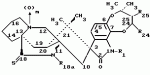 где заместитель имеют те же значения, что и для формулы I. Предпочтительны соединения I, где R1 - где заместитель имеют те же значения, что и для формулы I. Предпочтительны соединения I, где R1 - 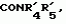 , а , а 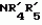 - насыщенный гетероцикл. Примеры гетероциклов, образованных -NR4R5, - насыщенный гетероцикл. Примеры гетероциклов, образованных -NR4R5, 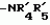 , являются 4-морфолин, 4-фенил-1-пиперазин, 4-(2-пиридинил)-1-пиперазин, 2,6-диметил-4-морфолин, 1-пирролидин, 4-метил-1-пиперазин, 1-пиперидин, 4-фенил-1-пиперидин, 2-метилпиперидин, 3-метилпиперидин, 4-метилпиперидин, N-метилпиперазин, 1-метилгомопиперазин, 1-ацетилпиперазин Предпочтительными соединениями изобретения являются 18-тиомаркфортин A (соединение 2), 18-тиомаркфортин B (соединение 2A), 1-пирролидинил-маркфортин A (соединение 12), 1-циклопропилкарбонил-маркфортин A (соединение 12A), 1-феноксикарбонил-маркфортин A (соединение 12B), 1-пальмитоил-маркфортин A (соединение 12C), 1-(4-нитрофеноксикарбонил)-маркфортин A (соединение 12D), 1-(1-пиперидинкарбонил)-маркфортин A (соединение 12F), 1-[[4-(этоксикарбонил)пиперазин-1-ил] карбонил]-маркфортин A (соединение 12G), 1-[[4-(бензил)пиперазин-1-ил]карбонил]-маркфортин A (соединение 12H), 1-[[4-(1,3-бензодиоксол-5-илметил)пиперазин-1-ил] карбонил]- -маркфортин A (соединение 12I), 1-[[4-(метил)пиперазин-1-ил]карбонил]-маркфортин A (соединение 12J), 1-(1,3-дигидро-1,3-диоксо-2H-изоиндол-2-ил)-маркфтортин A (соединение 12K), 1-[[4-(пиридин-2-ил)пиперазин-1-ил] карбонил] -маркфортин A (соединение 12L), 1-[[4-(фенил)пиперазин-1-ил]карбонил]-маркфортин A (соединение 12M), 1-[[4-(хлорокарбонил)пиперазин-1-ил] карбонил] -маркфортин A (соединение 12N), 10,10''-(1,4-дикарбонилпиперазин)бис(6', 7',8',9',10',10'a- гексагидро-1', 1', 4,4,12'-пентаметил)-[2'S-[2'альфа, 3'а.альфа, 9'а.альфа, 10/2'''R*, 3'''aS* 9'''aS, 10'''aR*)10'a.бета]]-спиро[4H,8H-[1,4]диоксепино[2,3-g]индол- 8,2'(3'H)-[1H,4H-3a,9a](иминометано циклопента[b]хинолизин]-9,11'(10H)-дион (соединение 120), 1-[[4-(фенил)пиперидин-1-ил]карбонил]-маркфортин A (соединение 12P), 1-[[4-(диметил)пиперидин-1-ил]карбонил]-маркфортин A (соединение 12Q), 1-[[4-(5-хлорпиридазин-3-ил)пиперазин-1-ил] карбонил] -маркфортин A (соединение 12R), 1-[[4-(4-хлорфенил)пиперазин-1-ил] карбонил] -маркфортин A (соединение 12S), 10,10''-(1,4-диоксо-2-бутен)бис(6', 7',8',9',10',10'a-гексагидро- 1',1', 4,4,12'-пентаметил)-[2'S-[2'. альфа. , 3'a. альфа. , 9'a.альфа, 10(2'''R*, 3'''aS*, 9'''aS*, 10'''aR*) 10'a, бета]]-спиро[4H, 8H-[1,4]диоксепино[2,3-g] индол-8,2'(3'H)- [1H, 4H-3a, 9a] (иминометано)циклопента[b] хинолизин] -9,11'(10H)-дион (соединение 12T), 1-[[4-(трихлороэтоксикарбонил)пиперазин-1-ил] карбонил] - маркфортин A (соединение 12U), 1-[[4-(3-трифторометил-тиадиазол-1-ил)пиперазин-1-ил] карбонил] - маркфортин A (соединение 12V), 1-ацетоксиметил-маркфортин A (соединение 13) 1-(2,4-динитробензолсульфенил)-маркфортин A (соединение 14), 1-(4-морфолиносульфенил)-маркфортин A (соединение 14A), 1-(трихлорометилсульфенил)-маркфортин A (соединение 14B), 1-(метоксикарбонилсульфенил)-маркфортин A (соединение 14C), 1-(бензолсульфенил)-маркфортин A (соединение 14D), 1-(4-морфолинкарбонил)-маркфортина AN-окись (соединение 15), 1-(2-тетрагидрофуранил)-маркфортин A (соединение 16). Фармацевтически приемлемые соли означают соли, полезные при назначении соединений данного изобретения в качестве лекарств, эти соли включают мезилат, гидрохлорид, гидробромид, гидроиодид, сульфат, фосфат, ацетат, пропионат, лактат, малеат, малат, сукцинат, тартрат и тому подобные. Эти соли могут быть в гидратированной форме. Соединение формулы II приготавливают следующими способами. Неожиданно было найдено, что обработка маркфортинов A, B и C или соответственно их замещенных C-24, C-25, N-1 и N-18a производных пентасульфидом фосфора или предпочтительно 2,4-бис(метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4-дисульфидом (реагент Lawesson'a) селективно дает соответствующие 18-тио-производные. Подходящие C-24, C-25, N-1 и N-18a замещенные производные маркфортинов A, B и C для этой реакции легко приготавливают способами, приведенными в [1] описание которого включено здесь в качестве ссылки. Реакции проводятся в подходящем инертном растворителе, таком, как пиридин, коллидин, толуол (предпочтительно), ксилол, диоксан, тетрагидрофуран и тому подобных, при температурах 10 - 180oC, предпочтительно 80 - 140oC. Или же C-24, C-25 и N-1 производные могут быть приготовлены из 18-тиомаркфортинов. Например, большая серия аналогов 18-тиомаркфортина может быть приготовлен алкилированием или ацилированием N-1 и N-18a замещенных 18-тиомаркфортинов. Такие производные могут быть легко приготовлены последовательной обработкой раствора 18-тиомаркфортина A, N-18a-замещенного 18-тиомаркфортина B или N-18a-замещенного 18-тиомаркфортина C в протонном органическом растворителе, таком, как тетрагидрофуран, диэтиловый эфир, бензол и тому подобные, избытком сильного основания, такого, как гидрид калия (предпочтительно), гидрид натрия, бутиллития, трет.-бутилат калия и тому подобного, с последующей обработкой подходящим алкилирующим или ацилирующим агентом при температурах в интервале 0 - 50oC от 0,25 до 48 ч. Подходящие алкилирующие агенты включают алкил бромиды, алкил иодиды, алкил сульфонаты, алкенил иодиды, алкинил бромиды, алкоксиалкил хлориды и тому подобное. Подходящие ацилирующие агенты включают ацил ангидриды, ацил хлориды, ацил бромиды, замещенные бензолсульфонил хлориды, замещенные бензолсульфоновые ангидриды, сульфенил хлориды, изоцианаты, карбамоил хлориды, хлорформиаты и тому подобные. Дополнительные серии производных могут быть произведены путем модификации C24-C25 двойной связи 18-тиомаркфортионов A, B и C. 24, 25 дигидро аналоги легко приготавливаются перемешиванием раствора подходящего 18-тиомаркфортина в спиртовом растворителе, таком, как метанол, этанол, пропанол и тому подобном с катализатором, таким как палладий, платина, трис (трифенилфосфин) - хлорородий и тому подобные в присутствии газообразного водорода. Продукт, который является аналогом 24,25-дигидро-18-иомаркфортина, может быть выделен и очищен с использованием методов, известных для специалиста в данной технике. Следует отметить, что описанные выше реакции по модификации другой части 18-тиомаркфортин структуры могу также применяться к 24, 25-дигидро 18-тиомаркфортин аналогам для приготовления соответствующих 24, 25 - дигидро аналогов. Дополнительно модифицированные по C24-C25 двойной связи аналоги 18-тиомаркфортинов могут быть получены через 24, 25 дибромид, который легко приготавливают обработкой раствора 18-тиоомаркфортинов в галогенизированном растворителе, таком, как дихлорметан, хлороформ, четырехлористый углерод и тому подобные I молярным эквивалентом брома при интервале температур от -20 до 25oC за время от 0,25 до 8 ч. Этот способ дает соответствующее производное 24,25-дибромо 24,25-дигидро-18-тиомаркфортина, которое может быть выделено и очищено использованием методов, известных для специалистов в данной технике. Следует отметить, что 24,25 дихлоро-аналог может быть приготовлен замещением брома на хлор в описанном выше способе. Аналоги 24,25 - дибромо 24,25-дигидро-18-маркофортина, описанные выше, используются в качестве промежуточных соединений для получения дополнительных производных. Так, обработка раствора дибромида в спиртовом растворителе, таком, как метанол, этанол, пропанол и тому подобные, сильным основанием, таким как 1,8 диазабицикло [5.4.0] ундек-7-ен (ДВИ)при интервале температур 0 - 30oC в течение 0,25 - 24 ч дает аналоги 24-алкокси-25 бромо-24, 25 дигидро-18-тиомаркфортина, которые могут быть выделены и очищены использованием методов, известных для специалистов в данной технике. Эти 24 алкокси, 25-бромо производные могут быть дебромированы обработкой раствора соединения в апротонном органическом растворителе, таком, как бензол, толуол, гексан и тому подобные, восстанавливающим агентом на основе гидрида олова, таким, как три-бутил олово гидрид, три-пентил олово гидрид и тому подобные с добавлением или без добавления радикального инициатора, такого как азобис-изобутиронитрил (AIBN) при интервале температур 25 - 120 oC в течение 0,5 - 48 ч. Этот способ дает соответствующие производные 24-алкокси-18-тиомаркфортина (R24= низший алкокси в общей структуре), которые могут быть выделены и очищены использованием методов, известных для специалистов в данной технике. Основные способы получения гетероароматических N - окисей могут быть найдены в Chapter II of "Chemistry of the Heterocyclic N-Dxides" A.R. Kattitzky and T.M.Ladowski, pyblished 1971 Academic Press (Vol.19 of ORGANIC CHEMISTRY - A Series of Monographs). Обычно N - окись образуется взаимодействием а надкорбоновой кислотой в апротонном растворителе. Наиболее удобно использовать ароматическую надкислоту в неполярном растворителе, поскольку реакция обычно может быть проведена при комнатной температуре. Подходящие ароматические надкислоты включают надбензойную кислоту, хлоронадбензойную кислоту и перефталевую кислоту. Соединение формулы IV приготавливают алкилированием или ацилированием N-1 маркфортина A и N-18a замещенных маркфортинов B и C. Эти производные легко могут быть приготовлены последовательной обработкой раствора маркфортина A или N-18a замещенных маркфортинов B и C в апротонном органическом растворителе, таком как, тетрагидрофуран, диэтиловый эфир, бензол и тому подобные с избытком сильного основания, такого, как гидрид калия (предпочтительно), гидрид натрия, бутиллития, трет.-бутилат калия, и тому подобных, с последующей обработкой подходящим алкиллирующим или ацилирующим агентом при интервале температур 0-50oC в течение 0,25 - 48 ч. Подходящие алкилирующие или ацилирующие агенты включают алканоилоксиалкил бромиды, аминосульфенилхлориды, фосфорил хлориды, фосфонил хлориды, ацил ангидриды, ацил хлориды, ацил бромиды, замещенные бензолсульфенил хлориды, карбамоил хлориды, замещенные феноксихлорформиаты и тому подобные. Обработка маркфортина A и N-18a замещенных маркфортинов B и C и C24-C25 модифицированных маркфортинов при этих условиях дает 1-N-замеещнные аналоги, которые могут быть выделены и очищены использованием методов, известных для специалистов в данной технике. Приготовление исходного материала Парагервамид выделяют из Penicillium Sp. IMI 332995 и/или Penicillium charlessi МГ 5123 (АТСС 20841), используя стандартные ферментативные и разделительные методики. Выделение детально описано в патентах США 4973247 и 4978656, а также EP 390532-A, EP-301742-A и WD91/09961 (все включены здесь в качестве ссылок). N-18a замещенные маркфортины B и C и C24-C25 мидифицированные маркфортины легко приготавливаются способами, приведенными в [1]. Маркфортины A, B и C выделены, наряду с ранее известным роквефортином, как грибковые метаболиты Anicillinm roguerforti с использованием стандартных ферментативной и разделительной методике. Выделение, равно как и аналитические и структурные характеристики маркфортина A, детально описаны в Polonsky et al Journal of the Chemical Sosiiety Chemical Communisations 1980, 601-602. Выделение, равно как и аналитические и структурные характеристики маркфортинов B и C, описаны детально в Polonsky et al Ketrahedron Letters 1981, 22, 1977-1980. Альтернативно и более предпочтительно, Маркфортины A и C могут быть выделены из Penicillium sp. ИС 7780 (порядковый номер штамма в Коллекции культур ИС 7780, The Upjohn Company, Kalamazoo, MI). Этот штамм был выделен из образца почвы, отобранного в Illinois, депонированного в США Department of Alricnetnre patent cnltnre collection in Peoria, IL и внесенного в каталог под номером NRRL 18887. Для дальнейшей характеризации грибка было проведено таксономическое исследование согласно методам и материалам, описанным I. John Pitt, The Genus Pinicillium, Acodemic Press, L ondon, (1979). Споры и поверхности гиф были исследованы путем электронной сканирующей микроскопии согласно методам Dietz, A. and Matthews, J. Appl. Microlilogy 18: 694-696 (1969). Интактные конидиофоры наблюдались визуально с помощью световой микроскопии [A.H.S. Onions et al, Smith's Introduction to Industrial Mycology, John Wiley and Sons, New York, pp 301-302 (1979)] после приготовления микроскопического препарата культур(ы): стеклянную чашку Петри, содержащую стеклянные шарики, микроскопический препарат и покровное стекло стерилизуют. Небольшой блок картофельного агара с декстрозой помещают на микроскопический препарат и инокулируют по четырем сторонам грибковой структурой. Покровное стекло помещают на инокулированный блок агара и добавляют стерильной воды для поддержания влажности. Камеру инкубируют в течение шести дней при 24oC. Микроскопический препарат приготавливают, удаляя покровное стекло и помещая его на каплю лактофеноловой хлопковой синены. Характеристики штамма Penicillium sp. ИС 7780 (NRRL 18887) следующие. Морфология - бимутовчатая кисть (две точки ветвления между конидией и ножкой). Эти ветвления (метулы) поддерживают несущие структуры фиалиды и конидии. Конидиофоры (приблизительно 35 мкм) заканчиваются в мутовках 2-5 (10-14 мкм) метул. Фиалиды имели форму колбочек (как древнегреческий сосуд для вина) в мутовках от 2-5 (7 мкм). Конидии были гладкие и сфероидальные (2 мкм), обычно образующие длинный гиностелий. Стенки ножек были гладкие. Культуру инокулировали на три чашки Петри на дрожжевой агар Чапека (СУА), из которых одна имела 6 см в диаметре, другая содержала агар с солодовым экстрактом (MEA) и агар с 25%-ным нитратом глицерина (G 25 N). Инокуляция была проведена из полутвердой суспензии (0,5 мл 0,2% агара с 0,05% Твин 80). Инокулирующую петлю с конидиями ввели в пробирку и перемешали. Петлю с суспензией инокулировали в образец в три места на каждую чашку. Для введения инокулята в 6 см чашки была использована игла. Использованный инкубационный режим: одна CYA чашка плюс MEA и G 25 N чашка при 24oC, одна CYA чашка при 37oC и 6 см CYA чашка при 5oC. Через семь дней диаметры, цвета и другие характеристики колоний были зарегистрированы и помещены далее в табл. 1. На картофельном декстрозном PDA, Difco) агаре на нижней части или на обратной стороне колонии появляется темно-красный цвет. Половой стадии не было отмечено. Эти результаты в культуре (NRRL 18887) определяли по Penicillium. Определителю для определения подкультуры. По Penicillium определителю, только пеницилиновый тип определяет подрод, к которому относится вид. Этот вид имеет некоторые характеристики, которые отличают его от Biverticillium подрода. Например, его кисти являются мутовчатыми. Вид надежно производит колонии более чем 10 мм в диаметре за 7 дней на агаре с нитратом глицерина. Метулы оказываются длиннее, чем фиалиды и в мутовках от 2-5. Эти характеристики позволяют отнести этот штамм Penicillium sp. (NRRL 18887) к подроду Furcatum. Вышеприведенное описание иллюстрирует штамм Penicillium ИС 7780 (NRRL 18887), который может быть использован в производстве Маркфортина и его производных. Кроме того, данное изобретение также включает мутанты описанного выше микроорганизма. Например, те мутанты, которые получены естественной селекцией, или мутанты, полученные мутирующими агентами, включающими ионизирующее облучение, такое, как ультрафиолетовое излучение, или химическими мутагенами, такими, как нитрозогуанидин, или тому подобными обработками, также входят в цель данного изобретения. Предметом и предназначением данного изобретения является также включение взаимных или внутренних генетических процессов рекомбинации с помощью генетических методик, хорошо известных для специалистов в данной области техники, таких как, например, конъюгация, трансульция (transultion) и методики генной инженерии. Penicillium sp. ИС 7780 (NRRL 18887) может быть культивирован в аэробных условиях тем методом, который обычно применяется в технике культивации известного штамма рода Penicillium. В качестве компонентов среды могут быть использованы какие-либо хорошо известные питательные вещества для Penicillium. Например, в качестве ассимилируемого источника углерод, глюкоза, глицерин, мальтоза, декстрин, крахмал, лактоза, сахароза, меласс, соевое масло, хлопкового семени масло и т.д. , предпочтительно глюкоза и глицерин могут быть использованы и в качестве ассимилируемого источника азота, соевая мука, арахисовая мука, хлопкового семени мука, рыбная мука, жидкая кукурузная пропитка, пептон, рис, отруби, мясной экстракт, дрожжи, дрожжевой экстракт, нитрат натрия, нитрат аммония, сульфат аммония и т.д. могут быть использованы. И такие неорганические соли, как хлористый натрий, фосфаты натрия, карбонат кальция и т.д. могут быть добавлены к среде для культур. При необходимости могут также быть добавлены незначительные количества соли металла. Кроме того, незначительные количества тяжелых металлов могут быть добавлены при необходимости. В частности, в культивации Penicillium sp. (NRRL 19997) в аэробных условиях с успехом могут быть использованы обычные методы аэробной культивации, такие как, например, выращивание на сухом остатке, выращивание при аэрации и перемешивании (взбалтывании), выращивание при встряхивании и т.д. К ферментативной среде должны быть добавлены следы металлов, например цинк, магний, марганец, кобальт, железо и тому подобные, поскольку должен поддерживаться уровень реверс-осмоса воды. В проведении культивации при аэрации и взбалтывании могут быть успешно применены противопенные агенты, например силиконовое масло, растительные масла, ПАВ и т.д. pH среды обычно может быть в интервале pH 3-9 и предпочтительно в нейтральной области или около нее, и температуры культивации обычно могут быть 20-30oC, в частности предпочтительны около 21oC. Культивация может продолжаться до тех пор, пока Маркфортин A будет значительно аккумулироваться в среде для культуры, обычно от 20 до 240 ч, предпочтительно 48 - 168 ч, и после культивации Маркфортин A может быть изолирован и выделен из жидкой среды для культур (культуральный бульон) путем подходящей комбинации различных методов. Например, это может быть экстракция органическим растворителем, например диэтиловым эфиром, этил ацетатом или хлороформом; растворение в более полярном растворителе, например, ацетоне или спирте; удаление примесей менее растворителем, например петролейным эфиром или гексаном, абсорбционная хроматография на активированном углероде или силикагеле; гель фильтрация через колонку "сефадекса" (поставляемого Pharmacia Co., Ltd США) и тому подобное. Маркфортин B может быть приготовлен из Маркфортина A путем биотрансформации использованием микроорганизма в водой питательной среде, содержащей ассимилируемый источник азота при аэробных условиях. Данное изобретение также дает биологически чистые культуры (организмы, полученные из коллекции культур, как очевидно открытые организмы) рода Cunnirghamella характеризуемые как виды, выделенные из группы, состоящей из NRRL 1368, 1393 или 3655 и ATCC 8688 a. Метод использования членов рода Cunnirghamella, характеризуемых как виды, выделенные из группы, состоящей из NRRK 1368, 1393 или 3655 и ATCC 8688а, для получения Маркфортина B, который включает присоединение Макрфортина A к метаболизируемым культурам названных микроорганизмов. Путем "биотрансформации" означает использование микроорганизмов или выделение частично очищенных энзимов для превращения данного субстрата в полезный продукт. Н.С. Davies, et al, "Biotransformations in Dreparative Organic Chemistrg", Akademic Press, N.Y., 1989, p.IX. Путем "метаболизации" означает проведение процессов метаболизма. Определение метаболизма может быть найдено в A.L.Lehninger, "Principlles of Biochemistry", Worth Pnbl., New York, 1982, p.333. Путем использования нового метода данного изобретения Маркфортин B получают добавлением Маркфортина A к растущим культурам названных организмов. Род Cunnirghamella является предпочтительным для выполнения этого превращения, включая Cunnirghamella echinulata sublp. elegans (-) NRRL 13b8, Cunninghamella blakesleeana (+) ATTC 8b88a Cunnirghamella echinufata subsp. elegans NRRL 1393, Cunnirghamella echinulata NRRL 3655; в частности штамм NRRL 3655 является предпочтительным. Подкультура Cunnirghamella echinulata subsp. elegans (-) была взята на депозит Budapest Treaty in the permanent collection of the Northem Region Research Center, ARS; U.S. Dept of Agriculture; Peoria, Illinois, USA. Ей присвоили номер NRRL 1368. Подкультура Cunninghamella echinulata subsp. elegans (-) была также взята на депозит of the Budapest Treaty in the permanent collection of the American Tupe Culture Collection, Rockville, MD, США. Ей присвоен номер ATCC 8688b. Подкультура Cunnirghamella blakesleeana (+) взята на депозит of Budapest Treaty in the permanent collection of the American Tupe Culture Collection, Rockville, MD, USA. Ей присвоен номер ATCC 8688a. Подкультура Cunnirghamella echinulata subsp. elegans (-) взята на депозит of the Budapest Treaty in the permanent collection of the Northem Region Research Center, ARS; U.S. Dept of Agriculture; Peoria, Illinois, США. Ее порядковый номер NRRL 1393. Подкультура Cunnirghamella echinulata subsp. elegans (-) взята на депозит of the Budapest Treaty in the permanent collection of the American Tupe Culture Collection, Rockville, MD, USA. Ей присвоен порядковый номер ATCC 10028b. Подкультура Cunnirghamella echinulata была взята на депозит of the Budapest Treaty in the permanent collection of the Nocthern Region Research Center, ARS; U.S. Dept of Agriculture; Peoria, Illinois, USA. Ей присвоен номер NRRL 3655. Использование этих микроорганизмов в способе данного изобретения выражается в получении Маркфортина B из Маркфортина A. Маркфортин B получается, когда Cunnirghamella echinulata subsp. elegans (-) NRRL 13b8, Cunnirghamella blakeslleana (+) ATTC 8b88a Cunnirghamella echinulata subsp. elegans NRRL 1393, Cunnirghamella echinulata NRRL 3b55 ферментируется в водной питательной среде при условиях аэробного погружения в присутствии Маркфортина A. Типично микроорганизм ферментируется в питательной среде, содержащей источник углерода и белковый материал. Предпочтительные источники углерода включают глюкозу, жженный сахар, сахарозу, глицерин, крахмал, кукурузный крахмал, лактозу, декстрин, мелассу и тому подобные. Предпочтительные источники азота включают хлопковую муку (мука из хлопкового семени), жидкую кукурузную пропитку, дрожжи, автолизированные пивные дрожжи с сухим веществом молока, соевую муку, кукурузную муку, сухое вещество молока, казеин переваренный панкреатическим ферментом, вытяжки пептонные животного происхождения, вытяжки из мяса и костей и тому подобные. Преимущественно могут быть использованы комбинации этих источников углерода и азота. Нет необходимости добавлять следы металлов, например, цинка, магния, марганца, кобальта, железа и тому подобных, поскольку в качестве компонентов среды используется вода из-под крана и неочищенные ингредиенты. Производство Маркфортина B может быть индуцировано при некоторой температуре, способствующей удовлетворительному росту микроорганизма приблизительно между 23 и 32oC и предпочтительно примерно при 28oC. Обычно оптимальное образование Маркфортина B происходит приблизительно в период 1 до 4 дней после добавления Маркфортина A к растущей культуре и предпочтительно за период около 2 дней. Ферментативный бульон обычно остается от слабо кислого до основного (pH 5,8-9,0) во время ферментации. Конечное pH зависит отчасти от наличия буфера, если присутствует и отчасти от начальной pH среды для культур. Выгодно регулировать pH около 6,5-7,5 и предпочтительно 7,2 перед стерилизацией. Когда рост проводится во встряхиваемой колбе или большом сосуде и сборниках, предпочтительно использовать вегетативную форму микроорганизма для инокуляции, вместо того, чтобы использовать форму спор, чтобы избежать явно выраженной задержки в продуцировании Маркфортина B и сопутствующего неэффективного использования оборудования. Таким образом, желательно получать вегетативный инокулят в водной питательной среде путем инокулирования этой среды аликвотной пробой почвы или культуры на скошенном агаре. Когда молодой, активный вегетативный посевной материал таким образом выделен, его переносят асептически в другие встряхиваемые пробирки или сборники. Среда, в которой вегетативный инокулят получают, может быть той же самой или отличной от той, что использована для получения Маркфортина B, длительность процесса адекватна росту получаемого микроорганизма. Могут быть использованы различные способы выделения и очистки Маркфортина A из ферментативного бульона, например путем метода абсорбционной хроматографии с последующей элюацией подходящим растворителем, колоночной хроматографии, распределительной хроматографии и кристаллизацией из растворителей, а также комбинацией этих методов. Предпочтительным способом выделения Маркфортина B является экстракция из (необработанного) цельного пива. Методы колоночной хроматографии, предпочтительно на силикагеле, используются для осуществления начальной очистки. Конечная очистка Маркфортина B достигается хроматографией и кристаллизацией из органических растворителей. Метод A далее иллюстрирует способ биотрансформации изобретения. Указанные соединения данного изобретения неожиданно оказались сильно действующими антипаразитарными агентами против эндо и экто паразитов, в частности гельминтов (паразитических червей) и членистоногих, которые приводят к многочисленным болезням вызванным паразитами у человека, животных и растений. Болезни, вызываемые паразитами, могут обуславливаться как эндопаразитами, так и эктопаразитами. Эндопаразиты - это такие паразиты, которые живут внутри тела хозяина, либо внутри органа (такого, как желудок, легкое, сердце, кишечник и т.д.) либо просто под кожей. Эктопаразиты это такие паразиты, которые живут на наружной поверхности хозяина, но все же вытягивают питательные вещества из хозяина. Болезни, вызванные эндопаразитами, обычно называемые гельминтозами, являются следствием заражения хозяина паразитическими червями, известными как гельминты. Гельминтозы представляют широко распространенную и серьезную мировую экономическую проблему, связанную с инфекцией домашних животных, таких, как свиньи, лошади, овцы, крупный рогатый скот, козы, собаки, кошки и домашняя птица. Многие из этих инфекций вызываются группой червей, называемых нематодами, которые вызывают заболевания различных органов у животных во всем мире. Эти заболевания часто серьезны и могут привести к смерти инфицированного животного. Наиболее общие роды нематод, инфицирующие упомянутых выше животных, включают Haemonchus, Trichostrongylus, Ostertagia, Nematodirus, Cooperia, Ascaris, Bunostomum, Oesophagostomum, Chabertia, Trichuris, Strongylus, Trichonema, Dictyocaulus, Capillaria, Heterakis, Toxocara, Ascaridia, Oxyuris, Ancylostoma, Uncinaria, Tokascaris, and Parascaris. Многие паразиты являются видоспецифичными (инфицируют только одного хозяина) и большинство также имеет предпочтительный участок инфицирования животных. Так, Haemonchus и Ostertagia преимущественно инфицируют желудок, тогда как Nematodirus и Cooperia в основном атакуют кишечник. Другие паразиты предпочитают задерживаться в сердце, глазах, легких, кровеносных сосудах и тому подобном, тогда как иные неподвижные являются подкожными паразитами. Гельминтозы могут приводить к слабости, потере в весе, анемии, повреждения кишечника, недостатку питания и повреждению других органов. Если это заболевание оставить без лечения, оно может привести к смерти животного. Инфекция, вызванная эктопаразитическими членистоногими, такими как клещи, клещики, вши, осенние жигалки, жигалки коровьи малые, падальные мухи, блохи и т.п. является также серьезной проблемой. Инфицирование этими паразитами выражается в потере крови, кожных повреждениях, может помешать нормальному усвоению пищи и привести к потере веса. Эти заражения могут также привести к развитию серьезных заболеваний, таких как энцефалиты, анаплазмозам, оспа у свиней и т.п., которые могут привести к фатальному исходу. Животные могут быть инфицированы несколькими видами паразитов одновременно, поскольку заражение одним паразитом может ослабить животное и сделать его более восприимчивым к инфицированию вторым видом паразитов. Таким образом соединение с широким спектром активности имеет преимущества при лечении таких заболеваний. Соединения данного изобретения имеют неожиданно высокую активность против этих паразитов и в дополнение являются также активными против Dirofilaria у собак, Nematospiroides и Suphacia у грызунов, жалящих насекомых и мигрирующих личино двукрылых, таких как Hypodorma sp. у крупного рогатого скота и Gastrophilus у лошадей. Данные соединения также полезны против эндо и экто паразитов, которые приводят к заболеваниям, вызванным паразитами у человека. Примеры таких эндопаразитов, которые инфицируют человека, включают гастро энтеральных паразитов рода Ancylostoma, Necator, Ascaris, Strongyloides, Trichinella, Capillaria, Trichuris, Enterobius и т.п. Другие эндопаразиты, которые инфицируют человека, находятся в крови и других органах. Примерами таких паразитов являются ниточные черви Wucheria, Brugia, Onchocerca и тому подобные, также как внекишечные фазы кишечных червей Strongylides и Trichinella. Это паразиты, которые паразитируют на человеке, включают членистоногих, таких, как клещи, блохи, клещики, вши и тому подобные и как с домашними животными, инфицирование этими паразитами может выражаться в развитии серьезных и даже фатальных болезней. Настоящие соединения являются активными против этих эндо и экто паразитов и, кроме того, также активны против жалящих насекомых и других двукрылых паразитов, которые надоедают человеку. Текущие соединения, когда применяются орально или парентерально, назначаются в дозах в пределах приблизительно 0,05 - 20 мг/кг веса тела животного. Данные соединения также полезны против находящихся в помещении вредителей, таких, как Blatella sp (тараканы), Tineola sp (платяная моль), Attagenus sp. (кожееды), Musca domestira (комнатная муха) и против Solenopsis Invicta (муравей Рихтера). Кроме того, соединения полезны против сельскохозяйственных вредителей, таких, как тля (Acyrthiosiphon sp.), саранча и хлопковый долгоносик, а также против вредных насекомых, разъедающих зерна при хранении, таких, как Tribolium sp. , и против насекомых на незавершенных стадиях развития, живущих в растительной ткани. Соединения также полезны в качестве нематоцида для контроля нематод в почве, который может иметь важное значение для сельского хозяйства. При использовании в качестве противопаразитных агентов для животных соединения данного изобретения могут быть назначены внутренне либо орально, либо путем инъекций, либо локально в виде жидкого орошения или в качестве шампуня. Для орального применения соединения могут быть назначены в форме капсулы, таблетки, шариков для вливания лекарства или иначе, они могут быть смешаны с едой для животных. Капсулы, таблетки и шарики содержат активный ингредиент в комбинации с соответствующим связующим носителем, таким, как крахмал, тальк, стеарат магния, или дикальций фосфат. Эти единичные дозировочные формы приготавливают путем тесного смешения активных ингредиентов с подходящими растворители, наполнители, дезинтеррирующих агентов, суспендирующих агентов и/или связующих веществ, так, чтобы получались однородные растворы или суспензии. Инертные ингредиенты это такие, которые не будут взаимодействовать с настоящими соединениями и которые не токсичны для животных, подлежащих лечению. Подходящие инертные ингредиенты включают крахмал, лактозу, тальк, стеарат магния, растительные смолы и масла и тому подобные. Эти составы могут содержать широкое количество разнообразных активных и неактивных ингредиентов, зависящих от многочисленных факторов, таких, как размер и тип вида животного и типа и серьезности инфекции. Активные ингредиенты могут также назначаться в виде добавок к пище путем простого смешивания соединения с кормом или нанесением соединения на поверхность корма. Иначе активный ингредиент может быть смешан с инертным носителем и образовавшаяся композиция может быть затем или смешана с кормом или непосредственно скормлена животному. Подходящие инертные носители включают кукурузную муку, цитрусовую муку, ферментативные остатки, соевую муку грубого помола, сухие крупы и т.п. Активные ингредиенты тесно перемешиваются с этими инертными носителями путем размалывания, взбалтывания, дробления или галтования, так что конечная композиция содержит 0,001-5,0 мас.% активного ингредиента. Иначе соединения могут быть назначены парантерально через инъекции состава, содержащего активный ингредиент, растворенный в инертном жидком носителе. Инъекция может осуществляться внутримышечно, интраруминально, внутритрахеально или подкожно. Составы для инъекций содержат активный ингредиент, смешанный с соответствующим инертным жидким носителем. Приемлемые жидкие носители включают растительные масла, таки, как арахисовое масло, хлопковое масло, кунжутное масло и тому подобные, а также органические растворители, такие, как солкеталь, глицерол формал и тому подобные. В качестве альтернативы могут также использоваться водные парентеральные составы. Растительные масла являются растворением или суспендированием активного ингредиента в жидком носителе, так что конечный состав содержит 0,005-20 мас.% активного ингредиента. Актуальное применение данных соединений состоит в возможности использования жидких оросителей или шампуней, содержащих текущие соединения в виде водных растворов или суспензий. Эти составы обычно содержат суспендирующий агент, такой, как бентонит, и обычно должны также содержать противопенный агент. Приемлемыми являются составы, содержащие 0,005-20 мас.% данных соединений. Настоящие соединения главным образом полезны как противопаразитарные агенты для лечения и/или предупреждения гельминтозов у домашних животных, таких, как крупный рогатый скот, овцы, лошади, собаки, козы, свиньи и домашняя птица. Они также полезны в предупреждении и лечении инфекций от паразитов, вызванной эктопаразитами у этих животных, такими, как клещи, клещики, вши, жигалки и тому подобными. Они являются также эффективными при лечении инфекций, вызванных паразитами у человека. В лечении таких инфекций соединения данного изобретения могут использоваться индивидуально или в комбинации друг с другом или с другими не родственными противопаразитарными агентами. Дозы настоящих соединений, необходимые для лучших результатов, зависят от нескольких факторов, таких, как вид и размер животного, тип и серьезность инфекции, метод лечения и используемые соединения. Оральное лечение настоящими соединениями при уровне доз 0,005-50 мг на 1 кг веса тела животного либо в единичной дозе, либо в нескольких дозах, проводимое в течение нескольких дней, дает хорошие результаты. Единичная доза одного из настоящих соединений обычно дает отличный контроль, однако повторные дозы могут быть даны для предотвращения повторной инфекции или для видов паразитов, которые изредка остаются. Техника лечения этими соединениями животных известна для специалистов, работающих в ветеринарной области. Соединения данного изобретения могут быть также использованы для борьбы с сельскохозяйственными вредителями, которые уничтожают урожай либо на полях, либо при хранении. Соединения применяются для таких целей в виде жидкостей для опрыскивания, пылевидных препаратов, эмульсий и тому подобного либо для растущих растений, либо для собранного урожая. Методики применения этих соединений для подобных целей известны для работающих в области сельского хозяйства специалистов. Следующие примеры не ограничивают рамки объема данного изобретения. Пример 1. Получение и выделение Маркфортина A Способ ферментации семян Семенные ферментанты инокулируют, используя агаровые пробки культуры Penicillium sp. ИС 7780 (NRRL 18887), хранившиеся в жидком азоте. Три пробки размораживают и используют в качестве инокулята. GS - 7 составляют из глюкозы и хлопковой муки (марки "Pharmamedia" "by Traders Protein, Procterk Gamble Oilseed Products Co., Memphis, TN, U.S.A. Используют водопроводную воду без дополнительной очистки для гидратации компонентов среды и pH среды доводят до 7,2 с помощью NH4OH. Среду распределяют в не содержащие перегородки колбы, представляющие закрытую систему, по 300 мл на 1000 мл колбу и стерилизуют путем автоклавирования при 121oC в течение 30 мин. Каждую колбу с закрытой системой, содержащую 300 мл GS - 7 среды, инокулировали тремя агаровыми пробками культуры Penicillium sp. 7780 (NRRL 18887) и встряхивали на роторном вибраторе при 250 об/мин в течение 36 ч при 22oC. Способ вторичной ферментации семян Культуры спелых семян используют в качестве инокулята для вторичной среды при 0,3% дозе введения. Вторичная среда составляется из моногидрата глюкозы (марки Cerelose by C.P.C. International) 25 г, муки хлопкового семени (марки "Pharmamedia") 25 г MgCl2 , являются 4-морфолин, 4-фенил-1-пиперазин, 4-(2-пиридинил)-1-пиперазин, 2,6-диметил-4-морфолин, 1-пирролидин, 4-метил-1-пиперазин, 1-пиперидин, 4-фенил-1-пиперидин, 2-метилпиперидин, 3-метилпиперидин, 4-метилпиперидин, N-метилпиперазин, 1-метилгомопиперазин, 1-ацетилпиперазин Предпочтительными соединениями изобретения являются 18-тиомаркфортин A (соединение 2), 18-тиомаркфортин B (соединение 2A), 1-пирролидинил-маркфортин A (соединение 12), 1-циклопропилкарбонил-маркфортин A (соединение 12A), 1-феноксикарбонил-маркфортин A (соединение 12B), 1-пальмитоил-маркфортин A (соединение 12C), 1-(4-нитрофеноксикарбонил)-маркфортин A (соединение 12D), 1-(1-пиперидинкарбонил)-маркфортин A (соединение 12F), 1-[[4-(этоксикарбонил)пиперазин-1-ил] карбонил]-маркфортин A (соединение 12G), 1-[[4-(бензил)пиперазин-1-ил]карбонил]-маркфортин A (соединение 12H), 1-[[4-(1,3-бензодиоксол-5-илметил)пиперазин-1-ил] карбонил]- -маркфортин A (соединение 12I), 1-[[4-(метил)пиперазин-1-ил]карбонил]-маркфортин A (соединение 12J), 1-(1,3-дигидро-1,3-диоксо-2H-изоиндол-2-ил)-маркфтортин A (соединение 12K), 1-[[4-(пиридин-2-ил)пиперазин-1-ил] карбонил] -маркфортин A (соединение 12L), 1-[[4-(фенил)пиперазин-1-ил]карбонил]-маркфортин A (соединение 12M), 1-[[4-(хлорокарбонил)пиперазин-1-ил] карбонил] -маркфортин A (соединение 12N), 10,10''-(1,4-дикарбонилпиперазин)бис(6', 7',8',9',10',10'a- гексагидро-1', 1', 4,4,12'-пентаметил)-[2'S-[2'альфа, 3'а.альфа, 9'а.альфа, 10/2'''R*, 3'''aS* 9'''aS, 10'''aR*)10'a.бета]]-спиро[4H,8H-[1,4]диоксепино[2,3-g]индол- 8,2'(3'H)-[1H,4H-3a,9a](иминометано циклопента[b]хинолизин]-9,11'(10H)-дион (соединение 120), 1-[[4-(фенил)пиперидин-1-ил]карбонил]-маркфортин A (соединение 12P), 1-[[4-(диметил)пиперидин-1-ил]карбонил]-маркфортин A (соединение 12Q), 1-[[4-(5-хлорпиридазин-3-ил)пиперазин-1-ил] карбонил] -маркфортин A (соединение 12R), 1-[[4-(4-хлорфенил)пиперазин-1-ил] карбонил] -маркфортин A (соединение 12S), 10,10''-(1,4-диоксо-2-бутен)бис(6', 7',8',9',10',10'a-гексагидро- 1',1', 4,4,12'-пентаметил)-[2'S-[2'. альфа. , 3'a. альфа. , 9'a.альфа, 10(2'''R*, 3'''aS*, 9'''aS*, 10'''aR*) 10'a, бета]]-спиро[4H, 8H-[1,4]диоксепино[2,3-g] индол-8,2'(3'H)- [1H, 4H-3a, 9a] (иминометано)циклопента[b] хинолизин] -9,11'(10H)-дион (соединение 12T), 1-[[4-(трихлороэтоксикарбонил)пиперазин-1-ил] карбонил] - маркфортин A (соединение 12U), 1-[[4-(3-трифторометил-тиадиазол-1-ил)пиперазин-1-ил] карбонил] - маркфортин A (соединение 12V), 1-ацетоксиметил-маркфортин A (соединение 13) 1-(2,4-динитробензолсульфенил)-маркфортин A (соединение 14), 1-(4-морфолиносульфенил)-маркфортин A (соединение 14A), 1-(трихлорометилсульфенил)-маркфортин A (соединение 14B), 1-(метоксикарбонилсульфенил)-маркфортин A (соединение 14C), 1-(бензолсульфенил)-маркфортин A (соединение 14D), 1-(4-морфолинкарбонил)-маркфортина AN-окись (соединение 15), 1-(2-тетрагидрофуранил)-маркфортин A (соединение 16). Фармацевтически приемлемые соли означают соли, полезные при назначении соединений данного изобретения в качестве лекарств, эти соли включают мезилат, гидрохлорид, гидробромид, гидроиодид, сульфат, фосфат, ацетат, пропионат, лактат, малеат, малат, сукцинат, тартрат и тому подобные. Эти соли могут быть в гидратированной форме. Соединение формулы II приготавливают следующими способами. Неожиданно было найдено, что обработка маркфортинов A, B и C или соответственно их замещенных C-24, C-25, N-1 и N-18a производных пентасульфидом фосфора или предпочтительно 2,4-бис(метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4-дисульфидом (реагент Lawesson'a) селективно дает соответствующие 18-тио-производные. Подходящие C-24, C-25, N-1 и N-18a замещенные производные маркфортинов A, B и C для этой реакции легко приготавливают способами, приведенными в [1] описание которого включено здесь в качестве ссылки. Реакции проводятся в подходящем инертном растворителе, таком, как пиридин, коллидин, толуол (предпочтительно), ксилол, диоксан, тетрагидрофуран и тому подобных, при температурах 10 - 180oC, предпочтительно 80 - 140oC. Или же C-24, C-25 и N-1 производные могут быть приготовлены из 18-тиомаркфортинов. Например, большая серия аналогов 18-тиомаркфортина может быть приготовлен алкилированием или ацилированием N-1 и N-18a замещенных 18-тиомаркфортинов. Такие производные могут быть легко приготовлены последовательной обработкой раствора 18-тиомаркфортина A, N-18a-замещенного 18-тиомаркфортина B или N-18a-замещенного 18-тиомаркфортина C в протонном органическом растворителе, таком, как тетрагидрофуран, диэтиловый эфир, бензол и тому подобные, избытком сильного основания, такого, как гидрид калия (предпочтительно), гидрид натрия, бутиллития, трет.-бутилат калия и тому подобного, с последующей обработкой подходящим алкилирующим или ацилирующим агентом при температурах в интервале 0 - 50oC от 0,25 до 48 ч. Подходящие алкилирующие агенты включают алкил бромиды, алкил иодиды, алкил сульфонаты, алкенил иодиды, алкинил бромиды, алкоксиалкил хлориды и тому подобное. Подходящие ацилирующие агенты включают ацил ангидриды, ацил хлориды, ацил бромиды, замещенные бензолсульфонил хлориды, замещенные бензолсульфоновые ангидриды, сульфенил хлориды, изоцианаты, карбамоил хлориды, хлорформиаты и тому подобные. Дополнительные серии производных могут быть произведены путем модификации C24-C25 двойной связи 18-тиомаркфортионов A, B и C. 24, 25 дигидро аналоги легко приготавливаются перемешиванием раствора подходящего 18-тиомаркфортина в спиртовом растворителе, таком, как метанол, этанол, пропанол и тому подобном с катализатором, таким как палладий, платина, трис (трифенилфосфин) - хлорородий и тому подобные в присутствии газообразного водорода. Продукт, который является аналогом 24,25-дигидро-18-иомаркфортина, может быть выделен и очищен с использованием методов, известных для специалиста в данной технике. Следует отметить, что описанные выше реакции по модификации другой части 18-тиомаркфортин структуры могу также применяться к 24, 25-дигидро 18-тиомаркфортин аналогам для приготовления соответствующих 24, 25 - дигидро аналогов. Дополнительно модифицированные по C24-C25 двойной связи аналоги 18-тиомаркфортинов могут быть получены через 24, 25 дибромид, который легко приготавливают обработкой раствора 18-тиоомаркфортинов в галогенизированном растворителе, таком, как дихлорметан, хлороформ, четырехлористый углерод и тому подобные I молярным эквивалентом брома при интервале температур от -20 до 25oC за время от 0,25 до 8 ч. Этот способ дает соответствующее производное 24,25-дибромо 24,25-дигидро-18-тиомаркфортина, которое может быть выделено и очищено использованием методов, известных для специалистов в данной технике. Следует отметить, что 24,25 дихлоро-аналог может быть приготовлен замещением брома на хлор в описанном выше способе. Аналоги 24,25 - дибромо 24,25-дигидро-18-маркофортина, описанные выше, используются в качестве промежуточных соединений для получения дополнительных производных. Так, обработка раствора дибромида в спиртовом растворителе, таком, как метанол, этанол, пропанол и тому подобные, сильным основанием, таким как 1,8 диазабицикло [5.4.0] ундек-7-ен (ДВИ)при интервале температур 0 - 30oC в течение 0,25 - 24 ч дает аналоги 24-алкокси-25 бромо-24, 25 дигидро-18-тиомаркфортина, которые могут быть выделены и очищены использованием методов, известных для специалистов в данной технике. Эти 24 алкокси, 25-бромо производные могут быть дебромированы обработкой раствора соединения в апротонном органическом растворителе, таком, как бензол, толуол, гексан и тому подобные, восстанавливающим агентом на основе гидрида олова, таким, как три-бутил олово гидрид, три-пентил олово гидрид и тому подобные с добавлением или без добавления радикального инициатора, такого как азобис-изобутиронитрил (AIBN) при интервале температур 25 - 120 oC в течение 0,5 - 48 ч. Этот способ дает соответствующие производные 24-алкокси-18-тиомаркфортина (R24= низший алкокси в общей структуре), которые могут быть выделены и очищены использованием методов, известных для специалистов в данной технике. Основные способы получения гетероароматических N - окисей могут быть найдены в Chapter II of "Chemistry of the Heterocyclic N-Dxides" A.R. Kattitzky and T.M.Ladowski, pyblished 1971 Academic Press (Vol.19 of ORGANIC CHEMISTRY - A Series of Monographs). Обычно N - окись образуется взаимодействием а надкорбоновой кислотой в апротонном растворителе. Наиболее удобно использовать ароматическую надкислоту в неполярном растворителе, поскольку реакция обычно может быть проведена при комнатной температуре. Подходящие ароматические надкислоты включают надбензойную кислоту, хлоронадбензойную кислоту и перефталевую кислоту. Соединение формулы IV приготавливают алкилированием или ацилированием N-1 маркфортина A и N-18a замещенных маркфортинов B и C. Эти производные легко могут быть приготовлены последовательной обработкой раствора маркфортина A или N-18a замещенных маркфортинов B и C в апротонном органическом растворителе, таком как, тетрагидрофуран, диэтиловый эфир, бензол и тому подобные с избытком сильного основания, такого, как гидрид калия (предпочтительно), гидрид натрия, бутиллития, трет.-бутилат калия, и тому подобных, с последующей обработкой подходящим алкиллирующим или ацилирующим агентом при интервале температур 0-50oC в течение 0,25 - 48 ч. Подходящие алкилирующие или ацилирующие агенты включают алканоилоксиалкил бромиды, аминосульфенилхлориды, фосфорил хлориды, фосфонил хлориды, ацил ангидриды, ацил хлориды, ацил бромиды, замещенные бензолсульфенил хлориды, карбамоил хлориды, замещенные феноксихлорформиаты и тому подобные. Обработка маркфортина A и N-18a замещенных маркфортинов B и C и C24-C25 модифицированных маркфортинов при этих условиях дает 1-N-замеещнные аналоги, которые могут быть выделены и очищены использованием методов, известных для специалистов в данной технике. Приготовление исходного материала Парагервамид выделяют из Penicillium Sp. IMI 332995 и/или Penicillium charlessi МГ 5123 (АТСС 20841), используя стандартные ферментативные и разделительные методики. Выделение детально описано в патентах США 4973247 и 4978656, а также EP 390532-A, EP-301742-A и WD91/09961 (все включены здесь в качестве ссылок). N-18a замещенные маркфортины B и C и C24-C25 мидифицированные маркфортины легко приготавливаются способами, приведенными в [1]. Маркфортины A, B и C выделены, наряду с ранее известным роквефортином, как грибковые метаболиты Anicillinm roguerforti с использованием стандартных ферментативной и разделительной методике. Выделение, равно как и аналитические и структурные характеристики маркфортина A, детально описаны в Polonsky et al Journal of the Chemical Sosiiety Chemical Communisations 1980, 601-602. Выделение, равно как и аналитические и структурные характеристики маркфортинов B и C, описаны детально в Polonsky et al Ketrahedron Letters 1981, 22, 1977-1980. Альтернативно и более предпочтительно, Маркфортины A и C могут быть выделены из Penicillium sp. ИС 7780 (порядковый номер штамма в Коллекции культур ИС 7780, The Upjohn Company, Kalamazoo, MI). Этот штамм был выделен из образца почвы, отобранного в Illinois, депонированного в США Department of Alricnetnre patent cnltnre collection in Peoria, IL и внесенного в каталог под номером NRRL 18887. Для дальнейшей характеризации грибка было проведено таксономическое исследование согласно методам и материалам, описанным I. John Pitt, The Genus Pinicillium, Acodemic Press, L ondon, (1979). Споры и поверхности гиф были исследованы путем электронной сканирующей микроскопии согласно методам Dietz, A. and Matthews, J. Appl. Microlilogy 18: 694-696 (1969). Интактные конидиофоры наблюдались визуально с помощью световой микроскопии [A.H.S. Onions et al, Smith's Introduction to Industrial Mycology, John Wiley and Sons, New York, pp 301-302 (1979)] после приготовления микроскопического препарата культур(ы): стеклянную чашку Петри, содержащую стеклянные шарики, микроскопический препарат и покровное стекло стерилизуют. Небольшой блок картофельного агара с декстрозой помещают на микроскопический препарат и инокулируют по четырем сторонам грибковой структурой. Покровное стекло помещают на инокулированный блок агара и добавляют стерильной воды для поддержания влажности. Камеру инкубируют в течение шести дней при 24oC. Микроскопический препарат приготавливают, удаляя покровное стекло и помещая его на каплю лактофеноловой хлопковой синены. Характеристики штамма Penicillium sp. ИС 7780 (NRRL 18887) следующие. Морфология - бимутовчатая кисть (две точки ветвления между конидией и ножкой). Эти ветвления (метулы) поддерживают несущие структуры фиалиды и конидии. Конидиофоры (приблизительно 35 мкм) заканчиваются в мутовках 2-5 (10-14 мкм) метул. Фиалиды имели форму колбочек (как древнегреческий сосуд для вина) в мутовках от 2-5 (7 мкм). Конидии были гладкие и сфероидальные (2 мкм), обычно образующие длинный гиностелий. Стенки ножек были гладкие. Культуру инокулировали на три чашки Петри на дрожжевой агар Чапека (СУА), из которых одна имела 6 см в диаметре, другая содержала агар с солодовым экстрактом (MEA) и агар с 25%-ным нитратом глицерина (G 25 N). Инокуляция была проведена из полутвердой суспензии (0,5 мл 0,2% агара с 0,05% Твин 80). Инокулирующую петлю с конидиями ввели в пробирку и перемешали. Петлю с суспензией инокулировали в образец в три места на каждую чашку. Для введения инокулята в 6 см чашки была использована игла. Использованный инкубационный режим: одна CYA чашка плюс MEA и G 25 N чашка при 24oC, одна CYA чашка при 37oC и 6 см CYA чашка при 5oC. Через семь дней диаметры, цвета и другие характеристики колоний были зарегистрированы и помещены далее в табл. 1. На картофельном декстрозном PDA, Difco) агаре на нижней части или на обратной стороне колонии появляется темно-красный цвет. Половой стадии не было отмечено. Эти результаты в культуре (NRRL 18887) определяли по Penicillium. Определителю для определения подкультуры. По Penicillium определителю, только пеницилиновый тип определяет подрод, к которому относится вид. Этот вид имеет некоторые характеристики, которые отличают его от Biverticillium подрода. Например, его кисти являются мутовчатыми. Вид надежно производит колонии более чем 10 мм в диаметре за 7 дней на агаре с нитратом глицерина. Метулы оказываются длиннее, чем фиалиды и в мутовках от 2-5. Эти характеристики позволяют отнести этот штамм Penicillium sp. (NRRL 18887) к подроду Furcatum. Вышеприведенное описание иллюстрирует штамм Penicillium ИС 7780 (NRRL 18887), который может быть использован в производстве Маркфортина и его производных. Кроме того, данное изобретение также включает мутанты описанного выше микроорганизма. Например, те мутанты, которые получены естественной селекцией, или мутанты, полученные мутирующими агентами, включающими ионизирующее облучение, такое, как ультрафиолетовое излучение, или химическими мутагенами, такими, как нитрозогуанидин, или тому подобными обработками, также входят в цель данного изобретения. Предметом и предназначением данного изобретения является также включение взаимных или внутренних генетических процессов рекомбинации с помощью генетических методик, хорошо известных для специалистов в данной области техники, таких как, например, конъюгация, трансульция (transultion) и методики генной инженерии. Penicillium sp. ИС 7780 (NRRL 18887) может быть культивирован в аэробных условиях тем методом, который обычно применяется в технике культивации известного штамма рода Penicillium. В качестве компонентов среды могут быть использованы какие-либо хорошо известные питательные вещества для Penicillium. Например, в качестве ассимилируемого источника углерод, глюкоза, глицерин, мальтоза, декстрин, крахмал, лактоза, сахароза, меласс, соевое масло, хлопкового семени масло и т.д. , предпочтительно глюкоза и глицерин могут быть использованы и в качестве ассимилируемого источника азота, соевая мука, арахисовая мука, хлопкового семени мука, рыбная мука, жидкая кукурузная пропитка, пептон, рис, отруби, мясной экстракт, дрожжи, дрожжевой экстракт, нитрат натрия, нитрат аммония, сульфат аммония и т.д. могут быть использованы. И такие неорганические соли, как хлористый натрий, фосфаты натрия, карбонат кальция и т.д. могут быть добавлены к среде для культур. При необходимости могут также быть добавлены незначительные количества соли металла. Кроме того, незначительные количества тяжелых металлов могут быть добавлены при необходимости. В частности, в культивации Penicillium sp. (NRRL 19997) в аэробных условиях с успехом могут быть использованы обычные методы аэробной культивации, такие как, например, выращивание на сухом остатке, выращивание при аэрации и перемешивании (взбалтывании), выращивание при встряхивании и т.д. К ферментативной среде должны быть добавлены следы металлов, например цинк, магний, марганец, кобальт, железо и тому подобные, поскольку должен поддерживаться уровень реверс-осмоса воды. В проведении культивации при аэрации и взбалтывании могут быть успешно применены противопенные агенты, например силиконовое масло, растительные масла, ПАВ и т.д. pH среды обычно может быть в интервале pH 3-9 и предпочтительно в нейтральной области или около нее, и температуры культивации обычно могут быть 20-30oC, в частности предпочтительны около 21oC. Культивация может продолжаться до тех пор, пока Маркфортин A будет значительно аккумулироваться в среде для культуры, обычно от 20 до 240 ч, предпочтительно 48 - 168 ч, и после культивации Маркфортин A может быть изолирован и выделен из жидкой среды для культур (культуральный бульон) путем подходящей комбинации различных методов. Например, это может быть экстракция органическим растворителем, например диэтиловым эфиром, этил ацетатом или хлороформом; растворение в более полярном растворителе, например, ацетоне или спирте; удаление примесей менее растворителем, например петролейным эфиром или гексаном, абсорбционная хроматография на активированном углероде или силикагеле; гель фильтрация через колонку "сефадекса" (поставляемого Pharmacia Co., Ltd США) и тому подобное. Маркфортин B может быть приготовлен из Маркфортина A путем биотрансформации использованием микроорганизма в водой питательной среде, содержащей ассимилируемый источник азота при аэробных условиях. Данное изобретение также дает биологически чистые культуры (организмы, полученные из коллекции культур, как очевидно открытые организмы) рода Cunnirghamella характеризуемые как виды, выделенные из группы, состоящей из NRRL 1368, 1393 или 3655 и ATCC 8688 a. Метод использования членов рода Cunnirghamella, характеризуемых как виды, выделенные из группы, состоящей из NRRK 1368, 1393 или 3655 и ATCC 8688а, для получения Маркфортина B, который включает присоединение Макрфортина A к метаболизируемым культурам названных микроорганизмов. Путем "биотрансформации" означает использование микроорганизмов или выделение частично очищенных энзимов для превращения данного субстрата в полезный продукт. Н.С. Davies, et al, "Biotransformations in Dreparative Organic Chemistrg", Akademic Press, N.Y., 1989, p.IX. Путем "метаболизации" означает проведение процессов метаболизма. Определение метаболизма может быть найдено в A.L.Lehninger, "Principlles of Biochemistry", Worth Pnbl., New York, 1982, p.333. Путем использования нового метода данного изобретения Маркфортин B получают добавлением Маркфортина A к растущим культурам названных организмов. Род Cunnirghamella является предпочтительным для выполнения этого превращения, включая Cunnirghamella echinulata sublp. elegans (-) NRRL 13b8, Cunninghamella blakesleeana (+) ATTC 8b88a Cunnirghamella echinufata subsp. elegans NRRL 1393, Cunnirghamella echinulata NRRL 3655; в частности штамм NRRL 3655 является предпочтительным. Подкультура Cunnirghamella echinulata subsp. elegans (-) была взята на депозит Budapest Treaty in the permanent collection of the Northem Region Research Center, ARS; U.S. Dept of Agriculture; Peoria, Illinois, USA. Ей присвоили номер NRRL 1368. Подкультура Cunninghamella echinulata subsp. elegans (-) была также взята на депозит of the Budapest Treaty in the permanent collection of the American Tupe Culture Collection, Rockville, MD, США. Ей присвоен номер ATCC 8688b. Подкультура Cunnirghamella blakesleeana (+) взята на депозит of Budapest Treaty in the permanent collection of the American Tupe Culture Collection, Rockville, MD, USA. Ей присвоен номер ATCC 8688a. Подкультура Cunnirghamella echinulata subsp. elegans (-) взята на депозит of the Budapest Treaty in the permanent collection of the Northem Region Research Center, ARS; U.S. Dept of Agriculture; Peoria, Illinois, США. Ее порядковый номер NRRL 1393. Подкультура Cunnirghamella echinulata subsp. elegans (-) взята на депозит of the Budapest Treaty in the permanent collection of the American Tupe Culture Collection, Rockville, MD, USA. Ей присвоен порядковый номер ATCC 10028b. Подкультура Cunnirghamella echinulata была взята на депозит of the Budapest Treaty in the permanent collection of the Nocthern Region Research Center, ARS; U.S. Dept of Agriculture; Peoria, Illinois, USA. Ей присвоен номер NRRL 3655. Использование этих микроорганизмов в способе данного изобретения выражается в получении Маркфортина B из Маркфортина A. Маркфортин B получается, когда Cunnirghamella echinulata subsp. elegans (-) NRRL 13b8, Cunnirghamella blakeslleana (+) ATTC 8b88a Cunnirghamella echinulata subsp. elegans NRRL 1393, Cunnirghamella echinulata NRRL 3b55 ферментируется в водной питательной среде при условиях аэробного погружения в присутствии Маркфортина A. Типично микроорганизм ферментируется в питательной среде, содержащей источник углерода и белковый материал. Предпочтительные источники углерода включают глюкозу, жженный сахар, сахарозу, глицерин, крахмал, кукурузный крахмал, лактозу, декстрин, мелассу и тому подобные. Предпочтительные источники азота включают хлопковую муку (мука из хлопкового семени), жидкую кукурузную пропитку, дрожжи, автолизированные пивные дрожжи с сухим веществом молока, соевую муку, кукурузную муку, сухое вещество молока, казеин переваренный панкреатическим ферментом, вытяжки пептонные животного происхождения, вытяжки из мяса и костей и тому подобные. Преимущественно могут быть использованы комбинации этих источников углерода и азота. Нет необходимости добавлять следы металлов, например, цинка, магния, марганца, кобальта, железа и тому подобных, поскольку в качестве компонентов среды используется вода из-под крана и неочищенные ингредиенты. Производство Маркфортина B может быть индуцировано при некоторой температуре, способствующей удовлетворительному росту микроорганизма приблизительно между 23 и 32oC и предпочтительно примерно при 28oC. Обычно оптимальное образование Маркфортина B происходит приблизительно в период 1 до 4 дней после добавления Маркфортина A к растущей культуре и предпочтительно за период около 2 дней. Ферментативный бульон обычно остается от слабо кислого до основного (pH 5,8-9,0) во время ферментации. Конечное pH зависит отчасти от наличия буфера, если присутствует и отчасти от начальной pH среды для культур. Выгодно регулировать pH около 6,5-7,5 и предпочтительно 7,2 перед стерилизацией. Когда рост проводится во встряхиваемой колбе или большом сосуде и сборниках, предпочтительно использовать вегетативную форму микроорганизма для инокуляции, вместо того, чтобы использовать форму спор, чтобы избежать явно выраженной задержки в продуцировании Маркфортина B и сопутствующего неэффективного использования оборудования. Таким образом, желательно получать вегетативный инокулят в водной питательной среде путем инокулирования этой среды аликвотной пробой почвы или культуры на скошенном агаре. Когда молодой, активный вегетативный посевной материал таким образом выделен, его переносят асептически в другие встряхиваемые пробирки или сборники. Среда, в которой вегетативный инокулят получают, может быть той же самой или отличной от той, что использована для получения Маркфортина B, длительность процесса адекватна росту получаемого микроорганизма. Могут быть использованы различные способы выделения и очистки Маркфортина A из ферментативного бульона, например путем метода абсорбционной хроматографии с последующей элюацией подходящим растворителем, колоночной хроматографии, распределительной хроматографии и кристаллизацией из растворителей, а также комбинацией этих методов. Предпочтительным способом выделения Маркфортина B является экстракция из (необработанного) цельного пива. Методы колоночной хроматографии, предпочтительно на силикагеле, используются для осуществления начальной очистки. Конечная очистка Маркфортина B достигается хроматографией и кристаллизацией из органических растворителей. Метод A далее иллюстрирует способ биотрансформации изобретения. Указанные соединения данного изобретения неожиданно оказались сильно действующими антипаразитарными агентами против эндо и экто паразитов, в частности гельминтов (паразитических червей) и членистоногих, которые приводят к многочисленным болезням вызванным паразитами у человека, животных и растений. Болезни, вызываемые паразитами, могут обуславливаться как эндопаразитами, так и эктопаразитами. Эндопаразиты - это такие паразиты, которые живут внутри тела хозяина, либо внутри органа (такого, как желудок, легкое, сердце, кишечник и т.д.) либо просто под кожей. Эктопаразиты это такие паразиты, которые живут на наружной поверхности хозяина, но все же вытягивают питательные вещества из хозяина. Болезни, вызванные эндопаразитами, обычно называемые гельминтозами, являются следствием заражения хозяина паразитическими червями, известными как гельминты. Гельминтозы представляют широко распространенную и серьезную мировую экономическую проблему, связанную с инфекцией домашних животных, таких, как свиньи, лошади, овцы, крупный рогатый скот, козы, собаки, кошки и домашняя птица. Многие из этих инфекций вызываются группой червей, называемых нематодами, которые вызывают заболевания различных органов у животных во всем мире. Эти заболевания часто серьезны и могут привести к смерти инфицированного животного. Наиболее общие роды нематод, инфицирующие упомянутых выше животных, включают Haemonchus, Trichostrongylus, Ostertagia, Nematodirus, Cooperia, Ascaris, Bunostomum, Oesophagostomum, Chabertia, Trichuris, Strongylus, Trichonema, Dictyocaulus, Capillaria, Heterakis, Toxocara, Ascaridia, Oxyuris, Ancylostoma, Uncinaria, Tokascaris, and Parascaris. Многие паразиты являются видоспецифичными (инфицируют только одного хозяина) и большинство также имеет предпочтительный участок инфицирования животных. Так, Haemonchus и Ostertagia преимущественно инфицируют желудок, тогда как Nematodirus и Cooperia в основном атакуют кишечник. Другие паразиты предпочитают задерживаться в сердце, глазах, легких, кровеносных сосудах и тому подобном, тогда как иные неподвижные являются подкожными паразитами. Гельминтозы могут приводить к слабости, потере в весе, анемии, повреждения кишечника, недостатку питания и повреждению других органов. Если это заболевание оставить без лечения, оно может привести к смерти животного. Инфекция, вызванная эктопаразитическими членистоногими, такими как клещи, клещики, вши, осенние жигалки, жигалки коровьи малые, падальные мухи, блохи и т.п. является также серьезной проблемой. Инфицирование этими паразитами выражается в потере крови, кожных повреждениях, может помешать нормальному усвоению пищи и привести к потере веса. Эти заражения могут также привести к развитию серьезных заболеваний, таких как энцефалиты, анаплазмозам, оспа у свиней и т.п., которые могут привести к фатальному исходу. Животные могут быть инфицированы несколькими видами паразитов одновременно, поскольку заражение одним паразитом может ослабить животное и сделать его более восприимчивым к инфицированию вторым видом паразитов. Таким образом соединение с широким спектром активности имеет преимущества при лечении таких заболеваний. Соединения данного изобретения имеют неожиданно высокую активность против этих паразитов и в дополнение являются также активными против Dirofilaria у собак, Nematospiroides и Suphacia у грызунов, жалящих насекомых и мигрирующих личино двукрылых, таких как Hypodorma sp. у крупного рогатого скота и Gastrophilus у лошадей. Данные соединения также полезны против эндо и экто паразитов, которые приводят к заболеваниям, вызванным паразитами у человека. Примеры таких эндопаразитов, которые инфицируют человека, включают гастро энтеральных паразитов рода Ancylostoma, Necator, Ascaris, Strongyloides, Trichinella, Capillaria, Trichuris, Enterobius и т.п. Другие эндопаразиты, которые инфицируют человека, находятся в крови и других органах. Примерами таких паразитов являются ниточные черви Wucheria, Brugia, Onchocerca и тому подобные, также как внекишечные фазы кишечных червей Strongylides и Trichinella. Это паразиты, которые паразитируют на человеке, включают членистоногих, таких, как клещи, блохи, клещики, вши и тому подобные и как с домашними животными, инфицирование этими паразитами может выражаться в развитии серьезных и даже фатальных болезней. Настоящие соединения являются активными против этих эндо и экто паразитов и, кроме того, также активны против жалящих насекомых и других двукрылых паразитов, которые надоедают человеку. Текущие соединения, когда применяются орально или парентерально, назначаются в дозах в пределах приблизительно 0,05 - 20 мг/кг веса тела животного. Данные соединения также полезны против находящихся в помещении вредителей, таких, как Blatella sp (тараканы), Tineola sp (платяная моль), Attagenus sp. (кожееды), Musca domestira (комнатная муха) и против Solenopsis Invicta (муравей Рихтера). Кроме того, соединения полезны против сельскохозяйственных вредителей, таких, как тля (Acyrthiosiphon sp.), саранча и хлопковый долгоносик, а также против вредных насекомых, разъедающих зерна при хранении, таких, как Tribolium sp. , и против насекомых на незавершенных стадиях развития, живущих в растительной ткани. Соединения также полезны в качестве нематоцида для контроля нематод в почве, который может иметь важное значение для сельского хозяйства. При использовании в качестве противопаразитных агентов для животных соединения данного изобретения могут быть назначены внутренне либо орально, либо путем инъекций, либо локально в виде жидкого орошения или в качестве шампуня. Для орального применения соединения могут быть назначены в форме капсулы, таблетки, шариков для вливания лекарства или иначе, они могут быть смешаны с едой для животных. Капсулы, таблетки и шарики содержат активный ингредиент в комбинации с соответствующим связующим носителем, таким, как крахмал, тальк, стеарат магния, или дикальций фосфат. Эти единичные дозировочные формы приготавливают путем тесного смешения активных ингредиентов с подходящими растворители, наполнители, дезинтеррирующих агентов, суспендирующих агентов и/или связующих веществ, так, чтобы получались однородные растворы или суспензии. Инертные ингредиенты это такие, которые не будут взаимодействовать с настоящими соединениями и которые не токсичны для животных, подлежащих лечению. Подходящие инертные ингредиенты включают крахмал, лактозу, тальк, стеарат магния, растительные смолы и масла и тому подобные. Эти составы могут содержать широкое количество разнообразных активных и неактивных ингредиентов, зависящих от многочисленных факторов, таких, как размер и тип вида животного и типа и серьезности инфекции. Активные ингредиенты могут также назначаться в виде добавок к пище путем простого смешивания соединения с кормом или нанесением соединения на поверхность корма. Иначе активный ингредиент может быть смешан с инертным носителем и образовавшаяся композиция может быть затем или смешана с кормом или непосредственно скормлена животному. Подходящие инертные носители включают кукурузную муку, цитрусовую муку, ферментативные остатки, соевую муку грубого помола, сухие крупы и т.п. Активные ингредиенты тесно перемешиваются с этими инертными носителями путем размалывания, взбалтывания, дробления или галтования, так что конечная композиция содержит 0,001-5,0 мас.% активного ингредиента. Иначе соединения могут быть назначены парантерально через инъекции состава, содержащего активный ингредиент, растворенный в инертном жидком носителе. Инъекция может осуществляться внутримышечно, интраруминально, внутритрахеально или подкожно. Составы для инъекций содержат активный ингредиент, смешанный с соответствующим инертным жидким носителем. Приемлемые жидкие носители включают растительные масла, таки, как арахисовое масло, хлопковое масло, кунжутное масло и тому подобные, а также органические растворители, такие, как солкеталь, глицерол формал и тому подобные. В качестве альтернативы могут также использоваться водные парентеральные составы. Растительные масла являются растворением или суспендированием активного ингредиента в жидком носителе, так что конечный состав содержит 0,005-20 мас.% активного ингредиента. Актуальное применение данных соединений состоит в возможности использования жидких оросителей или шампуней, содержащих текущие соединения в виде водных растворов или суспензий. Эти составы обычно содержат суспендирующий агент, такой, как бентонит, и обычно должны также содержать противопенный агент. Приемлемыми являются составы, содержащие 0,005-20 мас.% данных соединений. Настоящие соединения главным образом полезны как противопаразитарные агенты для лечения и/или предупреждения гельминтозов у домашних животных, таких, как крупный рогатый скот, овцы, лошади, собаки, козы, свиньи и домашняя птица. Они также полезны в предупреждении и лечении инфекций от паразитов, вызванной эктопаразитами у этих животных, такими, как клещи, клещики, вши, жигалки и тому подобными. Они являются также эффективными при лечении инфекций, вызванных паразитами у человека. В лечении таких инфекций соединения данного изобретения могут использоваться индивидуально или в комбинации друг с другом или с другими не родственными противопаразитарными агентами. Дозы настоящих соединений, необходимые для лучших результатов, зависят от нескольких факторов, таких, как вид и размер животного, тип и серьезность инфекции, метод лечения и используемые соединения. Оральное лечение настоящими соединениями при уровне доз 0,005-50 мг на 1 кг веса тела животного либо в единичной дозе, либо в нескольких дозах, проводимое в течение нескольких дней, дает хорошие результаты. Единичная доза одного из настоящих соединений обычно дает отличный контроль, однако повторные дозы могут быть даны для предотвращения повторной инфекции или для видов паразитов, которые изредка остаются. Техника лечения этими соединениями животных известна для специалистов, работающих в ветеринарной области. Соединения данного изобретения могут быть также использованы для борьбы с сельскохозяйственными вредителями, которые уничтожают урожай либо на полях, либо при хранении. Соединения применяются для таких целей в виде жидкостей для опрыскивания, пылевидных препаратов, эмульсий и тому подобного либо для растущих растений, либо для собранного урожая. Методики применения этих соединений для подобных целей известны для работающих в области сельского хозяйства специалистов. Следующие примеры не ограничивают рамки объема данного изобретения. Пример 1. Получение и выделение Маркфортина A Способ ферментации семян Семенные ферментанты инокулируют, используя агаровые пробки культуры Penicillium sp. ИС 7780 (NRRL 18887), хранившиеся в жидком азоте. Три пробки размораживают и используют в качестве инокулята. GS - 7 составляют из глюкозы и хлопковой муки (марки "Pharmamedia" "by Traders Protein, Procterk Gamble Oilseed Products Co., Memphis, TN, U.S.A. Используют водопроводную воду без дополнительной очистки для гидратации компонентов среды и pH среды доводят до 7,2 с помощью NH4OH. Среду распределяют в не содержащие перегородки колбы, представляющие закрытую систему, по 300 мл на 1000 мл колбу и стерилизуют путем автоклавирования при 121oC в течение 30 мин. Каждую колбу с закрытой системой, содержащую 300 мл GS - 7 среды, инокулировали тремя агаровыми пробками культуры Penicillium sp. 7780 (NRRL 18887) и встряхивали на роторном вибраторе при 250 об/мин в течение 36 ч при 22oC. Способ вторичной ферментации семян Культуры спелых семян используют в качестве инокулята для вторичной среды при 0,3% дозе введения. Вторичная среда составляется из моногидрата глюкозы (марки Cerelose by C.P.C. International) 25 г, муки хлопкового семени (марки "Pharmamedia") 25 г MgCl2 6H2O 329,8 мг; MnSO4 6H2O 329,8 мг; MnSO4 H2O 11,4 мг; FeSO4 H2O 11,4 мг; FeSO4 7H2O 3,2 мг; ; Na2MoO4 7H2O 3,2 мг; ; Na2MoO4 2H2O 1,8 мг; CaCl2 2H2O 1,8 мг; CaCl2 2H2O 367,6 мг; NaCl 84,2 мг; KCl 5,8 мг; ZnSO4 2H2O 367,6 мг; NaCl 84,2 мг; KCl 5,8 мг; ZnSO4 7H2O 0,1 мг; CoCl2 7H2O 0,1 мг; CoCl2 6H2O 0,1 мг; CuSO4 6H2O 0,1 мг; CuSO4 5H2O 3,1 мг и противопенного силикона (марки SAC - 471 Antifoam) 0,5 мл на 1 л воды для обеспечения обратного осмоса. Компоненты среды достаточные для получения 200 л вторичной среды для семян гидратируются в воде с показателем обратного осмоса до q. s. объема 190 л в 250-литровом ферментере. После составления pH среды доводят до 7,2 с помощью NH4OH и затем среду стерилизуют при 121oC в течение 30 мин. Две колбы закрытой системы с культурой спелых первоначальных семян используют как инокулят при 0,3% дозе введения. Вторичную культуру семян инкубируют при 22oC, с 125 slm аэрацией при противодавлении 5H2O 3,1 мг и противопенного силикона (марки SAC - 471 Antifoam) 0,5 мл на 1 л воды для обеспечения обратного осмоса. Компоненты среды достаточные для получения 200 л вторичной среды для семян гидратируются в воде с показателем обратного осмоса до q. s. объема 190 л в 250-литровом ферментере. После составления pH среды доводят до 7,2 с помощью NH4OH и затем среду стерилизуют при 121oC в течение 30 мин. Две колбы закрытой системы с культурой спелых первоначальных семян используют как инокулят при 0,3% дозе введения. Вторичную культуру семян инкубируют при 22oC, с 125 slm аэрацией при противодавлении 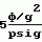 (0,35 кг/см2) и 250 об/мин в течение 36 ч. Способ проведения ферментации Среду продуцирования составляют из свекольной мелассы 50 г рыбной муки (марки Henhaden Select Fish Meal) 16 г, дрожжевого экстракта (марки Fidro) 10 г; MgCl2 (0,35 кг/см2) и 250 об/мин в течение 36 ч. Способ проведения ферментации Среду продуцирования составляют из свекольной мелассы 50 г рыбной муки (марки Henhaden Select Fish Meal) 16 г, дрожжевого экстракта (марки Fidro) 10 г; MgCl2 6H2O 329,8 мг; MnSO4 6H2O 329,8 мг; MnSO4 H2O 11,4 мг; FeSO4 H2O 11,4 мг; FeSO4 7H2O 3,29 мг; Na2MoO4 7H2O 3,29 мг; Na2MoO4 2H2O 1,8 мг; CaCl2 2H2O 1,8 мг; CaCl2 2H2O 367,6 мг; NaCl 84,2 мг; KCl 5,8 мг; ZnSO4 2H2O 367,6 мг; NaCl 84,2 мг; KCl 5,8 мг; ZnSO4 7H2O 0,1 мг; CoCl2 7H2O 0,1 мг; CoCl2 6H2O 0,1 мг CuSO4 6H2O 0,1 мг CuSO4 5H2O 3,1 мг и противопенного силикона (марки SAG - 471) 0,5 мл на 1 л воды с показателем обратного осмоса. Компоненты среды, достаточные для 5,000 л среды, гидратируют в воде с показателем обратного осмоса до объема 4,700 л в 5,000 л ферментере. После составления pH среды доводят до 7,0 с помощью KOH, и затем среду стерилизуют при 123oC в течение 30 мин. Культура спелых вторичных семян используется как инокулят при 1,0% дозе введения. Культуру инкубируют при 22oC с 2,500 slm аэрацией, при 5 psig обратном давлении и 250 об/мин в течение 96 ч. Выделение маркфортина A С 4900 л ферментированного объема собирают клетки, выросшие в культуре, пропуская через тонко измельчающий миксер в сосуд для сбора клеток. После переноса добавляют 4% мас/об диатомовой земли и 1/2 объема метилен хлорида. Раствор собранных клеток затем фильтруют, используя пресс для фильтрования. Отфильтрованный осадок промывают 2 раза 10% объемом метилен хлорида. Полученный фильтрат декантируют с целью удаления водной фазы. Оставшуюся фазу метилен хлорида, обогащенную продуктом, концентрируют затем до объема 44 л. Концентрат затем доводят до нужной кондиции, используя 20% от концентрата объем (9 л) метилен хлорида и диатомовую землю на фильтре. 53 л доведенного до кондиции концентрата затем очищают для отделения Маркфортина A от других компонентов с помощью хроматографии на силикагеле и кристаллизации. Перед хроматографией доведенный до кондиции концентрат разделяют на четыре приблизительно равных аликвотных пробы. Каждую аликвотную пробу хроматографируют на заново набитой колонке диаметром 9'', наполненной 25 кг сухого силикагеля (объем наполнителя 59 л). Загруженные колонки элюируют 120 л 10% ацетона в метилен хлориде, 120 л 20% ацетона в метилен хлориде, 120 л 30% ацетона в метилен хлориде, 160 л 40% ацетона в метилен хлориде и 130 л ацетона, собирая 30 и 40% элюаты фракциями по 20 л. Элюаты анализируют методом ТСХ, используя например систему растворителей, составленную из 6% изопропанола и 0,3% гидроокиси аммония в метилен хлориде, для проявления пластинок силикагеля. Фракции Маркфортина A (содержащие небольшое количество Маркфортина A, который хроматографически выходит вместе с A) кристаллизуют из ацетона. Соответствующие фракции (40-100 л) концентрируют при пониженном давлении до приблизительно 5 л. Раствор (или слабую суспензию) переносят затем в роторный испаритель и продолжают концентрировать при пониженном давлении. Во время проведения концентрации добавляют несколько 1 л порций ацетона до полного удаления метилен хлорида. Оставшуюся ацетоновую суспензию (приблизительно 1 л объем) охлаждают в течение ночи, и кристаллы Маркфортина A собирают и промывают несколькими небольшими порциями охлажденного ацетона и сушат при пониженном давлении. Такие кристаллы могут содержать в качестве примеси некоторый процент Маркфортина. Повторная перекристаллизация из метилен/хлорид/ацетона (удаление метилен хлорида как описано) дает чистый Маркфортина A. Пример 1A. Получение и выделение Маркфортинов A и C Способ первичной ферментации семян Семенные ферментаты инокулируют, используя агаровые пробки культуры Penicillium sp. ИС 7780 (NRRL 18887), хранившиеся в жидком азоте. Три пробки размораживают и используют в качестве инокулята для 100 мл GS - 7 среды для посева. GS - 7 составляют из глюкозы и хлопкового семени муки (марки "Pharmamedia" by Traders Protein, Procter & Gamble Oilseed Products Co., Memphis, TN, U.S.A. добавляя каждый компонент при концентрации 25 г/л водопроводной воды. После составления pH GS - 7 доводят до 7,2, используя NH4OH. Среду автоклавируют в объемах по 100 мл в 500 мл неперегороженных ферментационных колбах в течение 30 мин. Стерильную GS - 7 инокулируют, как описано выше, и встряхивают при 250 об/мин в течение 35-58 ч, при 23oC. Способ проведения ферментации (колба вибратора) Культуры спелых семян используют в качестве инокулята для среды продуцирования при 1% дозе введения. Среду продуцирования составляют из 45 г глюкозы, 25 г казеина ферментативного пищеварения (марки Peptonized Milk Nutrient by Sheffield Products, Norwich, N. Y. U.S.A. 2,5 г дрожжевого экстракта (марки Bacto Yeast Extract Code: 0127 by Difco Laboratories, Detroit, MI) на 1 л водопроводной воды. После составления pH продуцируемой среды доводят до 7,0, используя гидроокись калия. Эту среду затем автоклавируют в течение 30 мин в объемах по 100 мл, содержащихся в 500 мл перегороженных колбах для ферментации. Стерильную среду продуцирования инокулируют, как описано выше, и встряхивают 7-14 дней при 250 об/мин при 21oC. Способ проведения ферментации (сборники Labraferm tanks) Культуры спелых семян используют в качестве инокулята для стерильной среды продуцирования при 0,5% дозе введения. Среда продуцирования описана выше. После доведения pH среды до 7,0 использованием KOH 10 л этой среды автоклавировали в течение 90 мин в 12 л сборниках Labroferm tanks (New Brunswier Scientific Co., Inc.). Сборники инокулировали при 0,5% дозе введения и перемешивали при 500 об/мин при 20oC в течение 5-9 дней. Скорость потока воздуха поддерживали между 10-15 л/мин. Выделение Маркфортинов A и C Вест ферментативный бульон (35 л) мацерируют при низкой скорости в большом промышленном смесителе Waring'a и затем смешивают с равным объемом метилен хлорида. Смесь оставляют на ночь при охлаждении и затем центрифугируют для разрушения эмульсии. Образовавшийся слой прозрачного метилен хлорида сливают и упаривают при пониженном давлении. Концентрированный раствор остатка (37,4 г) в метилен хлориде наносят на колонку, заполненную суспензией силикагеля (1 кг), в метилен хлориде. Колонку элюируют возрастающими концентрациями ацетона в метилен хлориде (10%, 20%, 30%, 40% и 50% ацетона). Фракции анализируют ТСХ и соответствующие фракции упаривают и кристаллизуют из ацетона для получения Маркфортина A и Маркфортина C. Пример 1B. Получение и выделение Маркфортинов A и C. Способ ферментации семян Семенные ферментанты инокулируют, используя агаровые пробки культуры Penicillium sp. ИС 7780 (NRRL 18887), хранившиеся в жидком азоте. Три пробки размораживают и используют в качестве инокулята для 100 мл GS - 7 семенной среды. GS - 7 составляют из глюкозы муки из хлопкового семени (марки "Pharmamedia" by Traders Protein, Procter & Gamble Oilseed Products Co., Memphis, TN, U.S.A., добавляя каждый компонент при концентрации 25 г/л водопроводной воды. После составления pH GS - 7 доводят до 7,2, используя NH4OH. Среду автоклавируют в объемах по 100 мл в неперегороженных ферментационных колбах в течение 30 мин. Стерильную GS - 7 инокулируют, как описано выше, и встряхивают при 250 об/мин в течение 35 - 58 ч при 23oC. Способ проведения ферментации (встряхиваемая колба) Культуры спелых семян используют в качестве инокулята для среды продуцирования при 1% дозе введения. Среду продуцирования составляют из глюкозы 20 г, глицерина 15 мл из муки хлопкового cемени (марки "Pharmamedia" by Traders Protein, Procter Gamble Oilseed Products (o., Memphis, TN, U.S.A) 20 г соевой муки 10 г, K2HPO4 3 г на 1 л водопроводной воды. После составления pH среды продуцирования доводят до 6,8, используя гидроокись калия. Эту среду затем автоклавируют в течение 30 мин в объемах по 100 мл в 500 мл перегороженных ферментационных колбах. Стерильную среду продуцирования инокулируют, как описано выше, и встряхивают 7 - 14 дней при 250 об/мин при 21oC. Способ проведения ферментации (Labraferm сборники) Культуры спелых семян используют в качестве инокулята для стерильной среды продуцирования при 0,5% дозе введения. Среда продуцирования описана выше. После доведения pH до 7,0 использованием KOH, 10 л этой среды автоклавируют в течение 90 мин в 12 л сборниках (Labroferm tanks (New Brunswick Scientific Co., Inc). Сборники инокулируют при 0,5% дозе введения и перемешивают при 500 об/мин при 20oC в течение 5 - 9 дней. Скорость потока воздуха поддерживают между 10 - 15 л/мин. Выделение Маркфортинов A и C Весь ферментативный бульон (35 л) марцерируют при низкой скорости в большом промышленном смесителе Waring'a и затем смешивают с равным объемом метилен хлорида. Смесь оставляют на ночь при охлаждении и затем центрифугируют для разрушения эмульсии. Образовавшийся слой прозрачного метилен хлорида сливают и упаривают при пониженном давлении. Концентрированный раствор остатка (37,4 г) в метилен хлориде наносят на колонку, заполненную силикагелевой 91 кг) суспензией, в метилен хлориде. Колонку элюируют возрастающими концентрациями ацетона в метилен хлориде (10%, 20%, 30%, 40% и 50% ацетона). Фракции анализируют TCX и соответствующие фракции упаривают и кристаллизуют из ацетона для получения Маркфортина A и Маркфортина C. Пример 2. 18-тиомаркфортин A (Соединение 2) Раствор 30 г маркфортина A и 22 мг 2,4-бис-(метоксифенил)-1,3-дитиа-2,; -дифосфетан-2,4-дисульфида (реагент Lawesson's) в 5 мл толуола нагревают до кипения с обратным холодильником в атмосфере азота в течение 18 ч. Смесь охлаждают и растворитель отгоняют при пониженном давлении. Остаток подвергают препаративной хроматографии (TCX) на пластинах из силикагеля, используя 10% ацетон в метилен хлориде в качестве элюента, для получения 18-тиомаркфортина А.Т. пл. 128 - 260oC. FAB-MS 494 (M+ + H) Согласно общему способу примера 2, но использованием соответствующего маркфортин исходного материала приготовлены приведенные ниже другие соединения 18-тиомаркфортина: 1-метил-18-тиомаркфортин A 1-бензил-18-тиоамаркфортин A 1-этил-18-тиомаркфортин B 1-бензил-18-тиомаркфортин B 18a-этил-18-тиомаркфортин B 18a-бензил-18-тиомаркфортин B 18a-метоксиэтоксиметил-18-тиомаркфортин B 18a-аллил-18-тиомаркфортин B 18a-пропаргил-18-тиомаркфортин B 1,18a-бис-этил-18-тиомаркфортин B 1,18a-бис-бензил-18-тиомаркфортин B 18a-этил-24-метокси-18-тиомаркфортин B 18-тиомаркфортин B (Соединение # 2A) FAB-MS 480 (M+ + H) 18a-этил-24,25- дигидро-18-тиомаркфортин B 1-пропил-18-тиомаркфортин C 1-бензил-18-тиомаркфортин С 18a-пропил-18-тиомаркфортин C 18a-бензил-18-тиомаркфортин C 18a-метоксиэтил-18-тиомаркфортин C 18a-аллил-18-тиомаркфортин C 18a-пропаргил-18-тиомаркфортин C 1,18a-бис-пропил-18-тиомаркфортин C 1,18a-бис-бензил-18-тиомаркфортин C 18-тиомаркфортин C 1-пальмитоил-18-тиомаркфортин A 1-деканоил-18-тиомаркфортин A 1-деканоил-18-тиомаркфортин B Пример 3. 24, 25 дигидро-18-тиомаркфортин A Смесь, состоящую из 15 мг 5% палладия на углероде и 18-тиомаркфортина A (30 мг, 0,6 ммоль) в 1 мл метанола, энергично перемешивают в атмосфере водорода в течение 45 мин. Реакционную смесь фильтруют через Целит 5H2O 3,1 мг и противопенного силикона (марки SAG - 471) 0,5 мл на 1 л воды с показателем обратного осмоса. Компоненты среды, достаточные для 5,000 л среды, гидратируют в воде с показателем обратного осмоса до объема 4,700 л в 5,000 л ферментере. После составления pH среды доводят до 7,0 с помощью KOH, и затем среду стерилизуют при 123oC в течение 30 мин. Культура спелых вторичных семян используется как инокулят при 1,0% дозе введения. Культуру инкубируют при 22oC с 2,500 slm аэрацией, при 5 psig обратном давлении и 250 об/мин в течение 96 ч. Выделение маркфортина A С 4900 л ферментированного объема собирают клетки, выросшие в культуре, пропуская через тонко измельчающий миксер в сосуд для сбора клеток. После переноса добавляют 4% мас/об диатомовой земли и 1/2 объема метилен хлорида. Раствор собранных клеток затем фильтруют, используя пресс для фильтрования. Отфильтрованный осадок промывают 2 раза 10% объемом метилен хлорида. Полученный фильтрат декантируют с целью удаления водной фазы. Оставшуюся фазу метилен хлорида, обогащенную продуктом, концентрируют затем до объема 44 л. Концентрат затем доводят до нужной кондиции, используя 20% от концентрата объем (9 л) метилен хлорида и диатомовую землю на фильтре. 53 л доведенного до кондиции концентрата затем очищают для отделения Маркфортина A от других компонентов с помощью хроматографии на силикагеле и кристаллизации. Перед хроматографией доведенный до кондиции концентрат разделяют на четыре приблизительно равных аликвотных пробы. Каждую аликвотную пробу хроматографируют на заново набитой колонке диаметром 9'', наполненной 25 кг сухого силикагеля (объем наполнителя 59 л). Загруженные колонки элюируют 120 л 10% ацетона в метилен хлориде, 120 л 20% ацетона в метилен хлориде, 120 л 30% ацетона в метилен хлориде, 160 л 40% ацетона в метилен хлориде и 130 л ацетона, собирая 30 и 40% элюаты фракциями по 20 л. Элюаты анализируют методом ТСХ, используя например систему растворителей, составленную из 6% изопропанола и 0,3% гидроокиси аммония в метилен хлориде, для проявления пластинок силикагеля. Фракции Маркфортина A (содержащие небольшое количество Маркфортина A, который хроматографически выходит вместе с A) кристаллизуют из ацетона. Соответствующие фракции (40-100 л) концентрируют при пониженном давлении до приблизительно 5 л. Раствор (или слабую суспензию) переносят затем в роторный испаритель и продолжают концентрировать при пониженном давлении. Во время проведения концентрации добавляют несколько 1 л порций ацетона до полного удаления метилен хлорида. Оставшуюся ацетоновую суспензию (приблизительно 1 л объем) охлаждают в течение ночи, и кристаллы Маркфортина A собирают и промывают несколькими небольшими порциями охлажденного ацетона и сушат при пониженном давлении. Такие кристаллы могут содержать в качестве примеси некоторый процент Маркфортина. Повторная перекристаллизация из метилен/хлорид/ацетона (удаление метилен хлорида как описано) дает чистый Маркфортина A. Пример 1A. Получение и выделение Маркфортинов A и C Способ первичной ферментации семян Семенные ферментаты инокулируют, используя агаровые пробки культуры Penicillium sp. ИС 7780 (NRRL 18887), хранившиеся в жидком азоте. Три пробки размораживают и используют в качестве инокулята для 100 мл GS - 7 среды для посева. GS - 7 составляют из глюкозы и хлопкового семени муки (марки "Pharmamedia" by Traders Protein, Procter & Gamble Oilseed Products Co., Memphis, TN, U.S.A. добавляя каждый компонент при концентрации 25 г/л водопроводной воды. После составления pH GS - 7 доводят до 7,2, используя NH4OH. Среду автоклавируют в объемах по 100 мл в 500 мл неперегороженных ферментационных колбах в течение 30 мин. Стерильную GS - 7 инокулируют, как описано выше, и встряхивают при 250 об/мин в течение 35-58 ч, при 23oC. Способ проведения ферментации (колба вибратора) Культуры спелых семян используют в качестве инокулята для среды продуцирования при 1% дозе введения. Среду продуцирования составляют из 45 г глюкозы, 25 г казеина ферментативного пищеварения (марки Peptonized Milk Nutrient by Sheffield Products, Norwich, N. Y. U.S.A. 2,5 г дрожжевого экстракта (марки Bacto Yeast Extract Code: 0127 by Difco Laboratories, Detroit, MI) на 1 л водопроводной воды. После составления pH продуцируемой среды доводят до 7,0, используя гидроокись калия. Эту среду затем автоклавируют в течение 30 мин в объемах по 100 мл, содержащихся в 500 мл перегороженных колбах для ферментации. Стерильную среду продуцирования инокулируют, как описано выше, и встряхивают 7-14 дней при 250 об/мин при 21oC. Способ проведения ферментации (сборники Labraferm tanks) Культуры спелых семян используют в качестве инокулята для стерильной среды продуцирования при 0,5% дозе введения. Среда продуцирования описана выше. После доведения pH среды до 7,0 использованием KOH 10 л этой среды автоклавировали в течение 90 мин в 12 л сборниках Labroferm tanks (New Brunswier Scientific Co., Inc.). Сборники инокулировали при 0,5% дозе введения и перемешивали при 500 об/мин при 20oC в течение 5-9 дней. Скорость потока воздуха поддерживали между 10-15 л/мин. Выделение Маркфортинов A и C Вест ферментативный бульон (35 л) мацерируют при низкой скорости в большом промышленном смесителе Waring'a и затем смешивают с равным объемом метилен хлорида. Смесь оставляют на ночь при охлаждении и затем центрифугируют для разрушения эмульсии. Образовавшийся слой прозрачного метилен хлорида сливают и упаривают при пониженном давлении. Концентрированный раствор остатка (37,4 г) в метилен хлориде наносят на колонку, заполненную суспензией силикагеля (1 кг), в метилен хлориде. Колонку элюируют возрастающими концентрациями ацетона в метилен хлориде (10%, 20%, 30%, 40% и 50% ацетона). Фракции анализируют ТСХ и соответствующие фракции упаривают и кристаллизуют из ацетона для получения Маркфортина A и Маркфортина C. Пример 1B. Получение и выделение Маркфортинов A и C. Способ ферментации семян Семенные ферментанты инокулируют, используя агаровые пробки культуры Penicillium sp. ИС 7780 (NRRL 18887), хранившиеся в жидком азоте. Три пробки размораживают и используют в качестве инокулята для 100 мл GS - 7 семенной среды. GS - 7 составляют из глюкозы муки из хлопкового семени (марки "Pharmamedia" by Traders Protein, Procter & Gamble Oilseed Products Co., Memphis, TN, U.S.A., добавляя каждый компонент при концентрации 25 г/л водопроводной воды. После составления pH GS - 7 доводят до 7,2, используя NH4OH. Среду автоклавируют в объемах по 100 мл в неперегороженных ферментационных колбах в течение 30 мин. Стерильную GS - 7 инокулируют, как описано выше, и встряхивают при 250 об/мин в течение 35 - 58 ч при 23oC. Способ проведения ферментации (встряхиваемая колба) Культуры спелых семян используют в качестве инокулята для среды продуцирования при 1% дозе введения. Среду продуцирования составляют из глюкозы 20 г, глицерина 15 мл из муки хлопкового cемени (марки "Pharmamedia" by Traders Protein, Procter Gamble Oilseed Products (o., Memphis, TN, U.S.A) 20 г соевой муки 10 г, K2HPO4 3 г на 1 л водопроводной воды. После составления pH среды продуцирования доводят до 6,8, используя гидроокись калия. Эту среду затем автоклавируют в течение 30 мин в объемах по 100 мл в 500 мл перегороженных ферментационных колбах. Стерильную среду продуцирования инокулируют, как описано выше, и встряхивают 7 - 14 дней при 250 об/мин при 21oC. Способ проведения ферментации (Labraferm сборники) Культуры спелых семян используют в качестве инокулята для стерильной среды продуцирования при 0,5% дозе введения. Среда продуцирования описана выше. После доведения pH до 7,0 использованием KOH, 10 л этой среды автоклавируют в течение 90 мин в 12 л сборниках (Labroferm tanks (New Brunswick Scientific Co., Inc). Сборники инокулируют при 0,5% дозе введения и перемешивают при 500 об/мин при 20oC в течение 5 - 9 дней. Скорость потока воздуха поддерживают между 10 - 15 л/мин. Выделение Маркфортинов A и C Весь ферментативный бульон (35 л) марцерируют при низкой скорости в большом промышленном смесителе Waring'a и затем смешивают с равным объемом метилен хлорида. Смесь оставляют на ночь при охлаждении и затем центрифугируют для разрушения эмульсии. Образовавшийся слой прозрачного метилен хлорида сливают и упаривают при пониженном давлении. Концентрированный раствор остатка (37,4 г) в метилен хлориде наносят на колонку, заполненную силикагелевой 91 кг) суспензией, в метилен хлориде. Колонку элюируют возрастающими концентрациями ацетона в метилен хлориде (10%, 20%, 30%, 40% и 50% ацетона). Фракции анализируют TCX и соответствующие фракции упаривают и кристаллизуют из ацетона для получения Маркфортина A и Маркфортина C. Пример 2. 18-тиомаркфортин A (Соединение 2) Раствор 30 г маркфортина A и 22 мг 2,4-бис-(метоксифенил)-1,3-дитиа-2,; -дифосфетан-2,4-дисульфида (реагент Lawesson's) в 5 мл толуола нагревают до кипения с обратным холодильником в атмосфере азота в течение 18 ч. Смесь охлаждают и растворитель отгоняют при пониженном давлении. Остаток подвергают препаративной хроматографии (TCX) на пластинах из силикагеля, используя 10% ацетон в метилен хлориде в качестве элюента, для получения 18-тиомаркфортина А.Т. пл. 128 - 260oC. FAB-MS 494 (M+ + H) Согласно общему способу примера 2, но использованием соответствующего маркфортин исходного материала приготовлены приведенные ниже другие соединения 18-тиомаркфортина: 1-метил-18-тиомаркфортин A 1-бензил-18-тиоамаркфортин A 1-этил-18-тиомаркфортин B 1-бензил-18-тиомаркфортин B 18a-этил-18-тиомаркфортин B 18a-бензил-18-тиомаркфортин B 18a-метоксиэтоксиметил-18-тиомаркфортин B 18a-аллил-18-тиомаркфортин B 18a-пропаргил-18-тиомаркфортин B 1,18a-бис-этил-18-тиомаркфортин B 1,18a-бис-бензил-18-тиомаркфортин B 18a-этил-24-метокси-18-тиомаркфортин B 18-тиомаркфортин B (Соединение # 2A) FAB-MS 480 (M+ + H) 18a-этил-24,25- дигидро-18-тиомаркфортин B 1-пропил-18-тиомаркфортин C 1-бензил-18-тиомаркфортин С 18a-пропил-18-тиомаркфортин C 18a-бензил-18-тиомаркфортин C 18a-метоксиэтил-18-тиомаркфортин C 18a-аллил-18-тиомаркфортин C 18a-пропаргил-18-тиомаркфортин C 1,18a-бис-пропил-18-тиомаркфортин C 1,18a-бис-бензил-18-тиомаркфортин C 18-тиомаркфортин C 1-пальмитоил-18-тиомаркфортин A 1-деканоил-18-тиомаркфортин A 1-деканоил-18-тиомаркфортин B Пример 3. 24, 25 дигидро-18-тиомаркфортин A Смесь, состоящую из 15 мг 5% палладия на углероде и 18-тиомаркфортина A (30 мг, 0,6 ммоль) в 1 мл метанола, энергично перемешивают в атмосфере водорода в течение 45 мин. Реакционную смесь фильтруют через Целит и фильтрат упаривают при пониженном давлении. Препаративная тонкослойная хроматография остатка на 0,5 мм пластине силикагеля, элюируемой 3% метанолом в метилен хлориде, дает 24, 25-дигидро 18-тиомаркфортин A. Пример 4. 24,25-дибромо-24,25-дигидро 18-тиомаркфортин A Раствор брома в хлороформе (0,4 мл 12M раствора, 0,048 ммоль) добавляют по каплям к охлажденному (ледяная баня) раствору 18-тиомаркфортина A (20 мг, 0,04 ммоль) в 2 мл хлороформа. Образовавшийся желтый раствор перемешивают при комнатной температуре в течение 15 мин и затем упаривают в токе азота. Препаративная тонкослойная хроматография остатка на 0,5 мм пластине силкагеля, элюируемой 2% метанолом в метилен хлориде, дает 24, 25 - дибромо-24,25-дигидро-18-тиомаркфортин А. Пример 5. 24-метокси-24,25-дигидро 18-тиомаркфтортин В Раствор брома в хлороформе (0,6 мл, 0,12 М раствора, 0,072 ммоль) добавляют по каплям к охлажденному (ледяная баня) раствору 18-тиомаркфортина В (28 мг, 0,06 ммоль) в 2 мл хлороформа. Образовавшийся желтый раствор перемешивают при комнатной температуре в течение 10 мин, затем при 0oC в течение 20 мин, затем упаривают в токе азота. Желтый твердый остаток растворяют в 2 мл метанола, затем добавляют 1,8-диазабицикло [5,4,0]ундек-7-ен (ДВИ, 0,015 мл, 0,10 ммоль). Раствор перемешивают при комнатной температуре 90 мин, затем упаривают при пониженном давлении. Препаративная тонкослойная хроматография остатка на 1,0 мм пластине силикагеля, элюируемой 2% метанолом в метилен хлориде, дает 24-метокси-25-бромо-24,25-дигидро-18-тиомаркфортина В. Полученный таким образом 24-метокси-25-бромо-24,25-дигидро-18-тиомаркфортин В растворяют в 2 мл сухого толуола, затем добавляют трибутилин гидрид (1,2 мл, 0,45 ммоль). Раствор перемешивают при 100oC 16 ч, затем упаривают при пониженном давлении. Препаративная тонкослойная хроматография остатка на 2,0 мл пластине силикагеля, элюируемой 2% метанолом в метилен хлориде, дает 24-метокси-24,25-дигидро-18-тиомаркфторин В. Пример 6. 24-пропокси 24,25-дигидро-18-тиомаркфтортин А Замещение метанола на пропанол в способе, описанном выше для 24-метокси 24,25- дигидро-18-тиомаркфортина В (пример 5), и применение модифицированной методики к 20 г 18-тиомакрфортина А дает маслянистый остаток. Препаративная тонклослойная хроматография сырого продукта на 0,5 мм пластине силикагеле, элюируемого 2% метанолом в метилен хлориде, дает 24-пропокси-24,25-дигидро-18-тиомаркфтортин А. Пример 7. 1-(диметилкарбамоил)-18-тиомаркфтортин А Гидрид калия (50 мг 25% масляной дисперсии) добавляют к раствору 18-тиомакрфортина А (15 мл, 0,030 ммоль) в 1 мл сухого тетрагидрофурана. Раствор перемешивают при комнатной температуре в течение 2 ч, затем добавляют диметилкарбамоилхлорид (0,028 мл, 0,30 ммоль). Смесь перемешивают при комнатной температуре 18 ч, затем распределяют между 5% водным бикарбонатом натрия (1 мл) и метилен хлоридом (1 мл). Слои разделяют, и водный слой экстрагируют метилен хлоридом (2 мл). Объединенные экстракты высушивают сульфатом магния, отфильтровывают и упаривают при пониженном давлении. Препаративная тонкослойная хроматография остатка на пластине силикагеля, элюируемого 25% ацетоном в гексане, дает 1-(диметилкарбомоил)-18-тиомаркфортин А. Согласно примеру 7, но использованием соответствующего маркфортин исходного материала приготавливают приведенные ниже другие соединения 18-тиомаркфортина: 1-ацетоксиметил-18-тиомаркфортин А 1-диэтоксифосфорил-18-тиомаркфортин А 1-циклопропилкарбонил-18-тиомаркфортин А 1-диметилсульфамоил-18-тиомаркфортин А 1-(1-пиперидинил)тиокарбонил-18-тиомаркфортин А 1-сукциноил-18-тиомаркфороин А 1-(2,4-динитробензолсульфенил)-18-тиомаркфортин А 1-(4-морфолиносульфенил-18-тиомаркфортин А 1-(п-толуолсульфонил)-18-тиомаркфортин А 1-ацетил-18-тиомаркфортин А 1-метоксикарбонил-18-тиомаркфортин А 1-(п-толуолсульфонил)-18-тиомаркфортин В 1-(2,4-динитробензол сульфонил)-18а-этил-24-метокси-24,25-дигидро 1-(п-бромбензол сульфонил)-18-тиомаркфортин С 1-пропионил-18-тиомаркфортин С 1-(4-карбетокси-1,3-тиазолидин-3ил)карбонил-18-тиомакрфортин А. Пример 8. 1-бензил-18-тио-маркфторин А Гидрид калия (75 мл 25% масляной дисперсии) добавляют к раствору 18-тиомаркфортина А (15 мг, 0,030 ммоля) в 1 мл сухого тетрагидрофурана. Раствор перемешивают при комнатной температуре 2 ч, затем добавляют бензил бромид (0,025 мл, 0,21 ммоль). Смесь перемешивают при комнатной температуру 3 ч, затем распределяют между водой (1 мл) и метилен хлоридом (1 мл). Слои разделяют и водный слой экстрагируют метилен хлоридом (2 мл). Объединенные экстракты высушивают сульфатом магния, фильтруют и упаривают при пониженном давлении. Препаративная тонкослойная хроматография остатка на 1,0 мм пластине силикагеля, элюируемого 3% матенолом в метилен хлориде, дает 1-бензил-18-тиомаркфторини А. Согласно примеру 8, но использованием соответствующего маркфтортин исходного препарата приготавливают приведенные ниже другие соединения 18-тиомаркфтортина: 1, 18а-бис-этилен-18-тиомаркфортин В; 1-аллил-18-тиомаркфортин А; 1-метоксиметил-18-тиомаркфортин А; 1-пропаргил-18-тиомаркфортин А; 1-бензил-18а-тил-18-тиомаркфортин В; Пример 9. Halmonchus contortus /Trichostrongylus colubriformis / Tird Assay: Это in vivo (в живом организме) испытание используют песчанок зараженных двумя важными целевыми паразитами жвачных животных, H.contortus (H.C) и T. colubriformis (T. C) (могут быть использованы чувствительные против гельминтов или резистентные черви). Первоначально активность определяют только против H. contortus, как описано в G.A.Conder et al, T.Parasitol, 76, 168-170(1990), тогда, как на последующих стадиях изучают активность против обоих видов паразитов, используя приемы, описанные в G.A. Conderetal., T.Parasitol. 77, 621-623 (1991). Активность приведена далее в табл. 2. Пример 10. Согласно примеру 2, но использованием соответствующего парагерквамид/тиопарагерквамид исходного препарата приготавливают приведенные ниже другие соединения 18-тиопарагерквамида: 18-тиопарагерквамид 1-метил-18-тиопарагерквамид 1-этил-18-тиопарагерквамид 1-бензил-18-тиопарагерквамид 1-пальмитол-18-тиопарагерквамид 1-деканоил-18-тиопарагерквамид Пример 10а. Согласно примеру 7, но использованием соответствующего тиопарагерквамид исходного препарата приготавливают приведенные ниже другие соединения 18-тиопарагерквамида: 1-ацетоксиметил-18-тиомаркфтортин 1-диэтоксифосфорил-18-тиопарагерквамид 1-циклопропилкарбонил-18-тиопарагерквамид 1-диметиолсульфамоил-18-тиопарагерквамид 1-(1-пиперидинил)тиокарбонил-18-тиопарагерквамид 1-сукционил-18-тиопарагерквамид 1-(2,4-динитробензосульфенил)-18-тиопарагерквамид 1-(4-морфолиносульфенил)-18-тиопарагерквамид 1-(п-толуолсульфонил)-18-типорагерквамид 1-ацетил-18-тиопарагерквамид 1-метоксикарбонил-18-тиопарагерквамид Пример 11. Согласно примеру 8, но использованием соответствующего парагерквамид исходного материала приготавливают приведенные ниже другие соединения 18-тиопарагерквамида: 1,18а-бис-этил-18-тиопарагеркваимд 1-аллил-18-тиопарагерквамид; 1-метоксиметил-18-тиопарагерквамид; 1-пропаргил-18-тиопарагерквамид; 1-бензил-18а-этил-18-тиопарагерквамид. Пример 12. 1-пирролидинил-маркфортин А, соедин. 12. Гидрид калия (50 мг 25% масляной дисперсии) добавляют к раствору маркфортина А (15 мг,0,030 ммоль) в 1 мл сухого тетрагидрофурана. Раствор перемешивают при комнатной температуре 2 ч, затем добавляют пирролидинилкарбонил (40 мг, 0,30 ммоль). Смесь перемешивают при комнатной температуре 18 ч, затем распределяют между 5% водным бикарбонатом натрия (1 мл) и метилен хлоридом (1 мл). Слои разделяют и водный слой экстрагируют метилен хлоридом (2 мл). Объединенные экстракты высушивают сульфатом магния, фильтруют и упаривают при пониженном давлении. Препаративная тонкослойная хроматография на пластине силикагеля, элюируемого 25% ацетоном в гексане, дает 1-пирролидинил карбонил-маркфортины А Здесь и далее в тексте: 1) в спектрах 1H-ЯМР (ПМР) s - синглет - brs уширенный синглет m - мультиплет d - дуплет t - триплет dd - двойной дуплет 2) Элемент. анализ: calc - рассчитано obsd - найдено H1 NMR(CDCl3) и фильтрат упаривают при пониженном давлении. Препаративная тонкослойная хроматография остатка на 0,5 мм пластине силикагеля, элюируемой 3% метанолом в метилен хлориде, дает 24, 25-дигидро 18-тиомаркфортин A. Пример 4. 24,25-дибромо-24,25-дигидро 18-тиомаркфортин A Раствор брома в хлороформе (0,4 мл 12M раствора, 0,048 ммоль) добавляют по каплям к охлажденному (ледяная баня) раствору 18-тиомаркфортина A (20 мг, 0,04 ммоль) в 2 мл хлороформа. Образовавшийся желтый раствор перемешивают при комнатной температуре в течение 15 мин и затем упаривают в токе азота. Препаративная тонкослойная хроматография остатка на 0,5 мм пластине силкагеля, элюируемой 2% метанолом в метилен хлориде, дает 24, 25 - дибромо-24,25-дигидро-18-тиомаркфортин А. Пример 5. 24-метокси-24,25-дигидро 18-тиомаркфтортин В Раствор брома в хлороформе (0,6 мл, 0,12 М раствора, 0,072 ммоль) добавляют по каплям к охлажденному (ледяная баня) раствору 18-тиомаркфортина В (28 мг, 0,06 ммоль) в 2 мл хлороформа. Образовавшийся желтый раствор перемешивают при комнатной температуре в течение 10 мин, затем при 0oC в течение 20 мин, затем упаривают в токе азота. Желтый твердый остаток растворяют в 2 мл метанола, затем добавляют 1,8-диазабицикло [5,4,0]ундек-7-ен (ДВИ, 0,015 мл, 0,10 ммоль). Раствор перемешивают при комнатной температуре 90 мин, затем упаривают при пониженном давлении. Препаративная тонкослойная хроматография остатка на 1,0 мм пластине силикагеля, элюируемой 2% метанолом в метилен хлориде, дает 24-метокси-25-бромо-24,25-дигидро-18-тиомаркфортина В. Полученный таким образом 24-метокси-25-бромо-24,25-дигидро-18-тиомаркфортин В растворяют в 2 мл сухого толуола, затем добавляют трибутилин гидрид (1,2 мл, 0,45 ммоль). Раствор перемешивают при 100oC 16 ч, затем упаривают при пониженном давлении. Препаративная тонкослойная хроматография остатка на 2,0 мл пластине силикагеля, элюируемой 2% метанолом в метилен хлориде, дает 24-метокси-24,25-дигидро-18-тиомаркфторин В. Пример 6. 24-пропокси 24,25-дигидро-18-тиомаркфтортин А Замещение метанола на пропанол в способе, описанном выше для 24-метокси 24,25- дигидро-18-тиомаркфортина В (пример 5), и применение модифицированной методики к 20 г 18-тиомакрфортина А дает маслянистый остаток. Препаративная тонклослойная хроматография сырого продукта на 0,5 мм пластине силикагеле, элюируемого 2% метанолом в метилен хлориде, дает 24-пропокси-24,25-дигидро-18-тиомаркфтортин А. Пример 7. 1-(диметилкарбамоил)-18-тиомаркфтортин А Гидрид калия (50 мг 25% масляной дисперсии) добавляют к раствору 18-тиомакрфортина А (15 мл, 0,030 ммоль) в 1 мл сухого тетрагидрофурана. Раствор перемешивают при комнатной температуре в течение 2 ч, затем добавляют диметилкарбамоилхлорид (0,028 мл, 0,30 ммоль). Смесь перемешивают при комнатной температуре 18 ч, затем распределяют между 5% водным бикарбонатом натрия (1 мл) и метилен хлоридом (1 мл). Слои разделяют, и водный слой экстрагируют метилен хлоридом (2 мл). Объединенные экстракты высушивают сульфатом магния, отфильтровывают и упаривают при пониженном давлении. Препаративная тонкослойная хроматография остатка на пластине силикагеля, элюируемого 25% ацетоном в гексане, дает 1-(диметилкарбомоил)-18-тиомаркфортин А. Согласно примеру 7, но использованием соответствующего маркфортин исходного материала приготавливают приведенные ниже другие соединения 18-тиомаркфортина: 1-ацетоксиметил-18-тиомаркфортин А 1-диэтоксифосфорил-18-тиомаркфортин А 1-циклопропилкарбонил-18-тиомаркфортин А 1-диметилсульфамоил-18-тиомаркфортин А 1-(1-пиперидинил)тиокарбонил-18-тиомаркфортин А 1-сукциноил-18-тиомаркфороин А 1-(2,4-динитробензолсульфенил)-18-тиомаркфортин А 1-(4-морфолиносульфенил-18-тиомаркфортин А 1-(п-толуолсульфонил)-18-тиомаркфортин А 1-ацетил-18-тиомаркфортин А 1-метоксикарбонил-18-тиомаркфортин А 1-(п-толуолсульфонил)-18-тиомаркфортин В 1-(2,4-динитробензол сульфонил)-18а-этил-24-метокси-24,25-дигидро 1-(п-бромбензол сульфонил)-18-тиомаркфортин С 1-пропионил-18-тиомаркфортин С 1-(4-карбетокси-1,3-тиазолидин-3ил)карбонил-18-тиомакрфортин А. Пример 8. 1-бензил-18-тио-маркфторин А Гидрид калия (75 мл 25% масляной дисперсии) добавляют к раствору 18-тиомаркфортина А (15 мг, 0,030 ммоля) в 1 мл сухого тетрагидрофурана. Раствор перемешивают при комнатной температуре 2 ч, затем добавляют бензил бромид (0,025 мл, 0,21 ммоль). Смесь перемешивают при комнатной температуру 3 ч, затем распределяют между водой (1 мл) и метилен хлоридом (1 мл). Слои разделяют и водный слой экстрагируют метилен хлоридом (2 мл). Объединенные экстракты высушивают сульфатом магния, фильтруют и упаривают при пониженном давлении. Препаративная тонкослойная хроматография остатка на 1,0 мм пластине силикагеля, элюируемого 3% матенолом в метилен хлориде, дает 1-бензил-18-тиомаркфторини А. Согласно примеру 8, но использованием соответствующего маркфтортин исходного препарата приготавливают приведенные ниже другие соединения 18-тиомаркфтортина: 1, 18а-бис-этилен-18-тиомаркфортин В; 1-аллил-18-тиомаркфортин А; 1-метоксиметил-18-тиомаркфортин А; 1-пропаргил-18-тиомаркфортин А; 1-бензил-18а-тил-18-тиомаркфортин В; Пример 9. Halmonchus contortus /Trichostrongylus colubriformis / Tird Assay: Это in vivo (в живом организме) испытание используют песчанок зараженных двумя важными целевыми паразитами жвачных животных, H.contortus (H.C) и T. colubriformis (T. C) (могут быть использованы чувствительные против гельминтов или резистентные черви). Первоначально активность определяют только против H. contortus, как описано в G.A.Conder et al, T.Parasitol, 76, 168-170(1990), тогда, как на последующих стадиях изучают активность против обоих видов паразитов, используя приемы, описанные в G.A. Conderetal., T.Parasitol. 77, 621-623 (1991). Активность приведена далее в табл. 2. Пример 10. Согласно примеру 2, но использованием соответствующего парагерквамид/тиопарагерквамид исходного препарата приготавливают приведенные ниже другие соединения 18-тиопарагерквамида: 18-тиопарагерквамид 1-метил-18-тиопарагерквамид 1-этил-18-тиопарагерквамид 1-бензил-18-тиопарагерквамид 1-пальмитол-18-тиопарагерквамид 1-деканоил-18-тиопарагерквамид Пример 10а. Согласно примеру 7, но использованием соответствующего тиопарагерквамид исходного препарата приготавливают приведенные ниже другие соединения 18-тиопарагерквамида: 1-ацетоксиметил-18-тиомаркфтортин 1-диэтоксифосфорил-18-тиопарагерквамид 1-циклопропилкарбонил-18-тиопарагерквамид 1-диметиолсульфамоил-18-тиопарагерквамид 1-(1-пиперидинил)тиокарбонил-18-тиопарагерквамид 1-сукционил-18-тиопарагерквамид 1-(2,4-динитробензосульфенил)-18-тиопарагерквамид 1-(4-морфолиносульфенил)-18-тиопарагерквамид 1-(п-толуолсульфонил)-18-типорагерквамид 1-ацетил-18-тиопарагерквамид 1-метоксикарбонил-18-тиопарагерквамид Пример 11. Согласно примеру 8, но использованием соответствующего парагерквамид исходного материала приготавливают приведенные ниже другие соединения 18-тиопарагерквамида: 1,18а-бис-этил-18-тиопарагеркваимд 1-аллил-18-тиопарагерквамид; 1-метоксиметил-18-тиопарагерквамид; 1-пропаргил-18-тиопарагерквамид; 1-бензил-18а-этил-18-тиопарагерквамид. Пример 12. 1-пирролидинил-маркфортин А, соедин. 12. Гидрид калия (50 мг 25% масляной дисперсии) добавляют к раствору маркфортина А (15 мг,0,030 ммоль) в 1 мл сухого тетрагидрофурана. Раствор перемешивают при комнатной температуре 2 ч, затем добавляют пирролидинилкарбонил (40 мг, 0,30 ммоль). Смесь перемешивают при комнатной температуре 18 ч, затем распределяют между 5% водным бикарбонатом натрия (1 мл) и метилен хлоридом (1 мл). Слои разделяют и водный слой экстрагируют метилен хлоридом (2 мл). Объединенные экстракты высушивают сульфатом магния, фильтруют и упаривают при пониженном давлении. Препаративная тонкослойная хроматография на пластине силикагеля, элюируемого 25% ацетоном в гексане, дает 1-пирролидинил карбонил-маркфортины А Здесь и далее в тексте: 1) в спектрах 1H-ЯМР (ПМР) s - синглет - brs уширенный синглет m - мультиплет d - дуплет t - триплет dd - двойной дуплет 2) Элемент. анализ: calc - рассчитано obsd - найдено H1 NMR(CDCl3)  0,83(s, 3H), 1,21(s, 3H), 1,45(s, 3H), 1,3-2,4(m, 17H), 2,38(d, 1H), 2,6-2,8(m, 2H), 2,84(d, 1H), 3,00(s, 3H), 3,4-3,6(m, 4H), 3,72(d, 1H), 4,85(d, 1H), 6,41(d, 1H), 6,84(s, 2H) Согласно общему способу примера 12, но использованием соответствующего макрфортин исходного препарата и карбонил хлорида приготавливают приведенные ниже другие соединения макрфортина: 1 - диэтоксифосфорил - макрфортин А 1 - циклопропилкарбонил - маркфортин А, соед. #12А. 1H NMR (CDCl3) 0,83(s, 3H), 1,21(s, 3H), 1,45(s, 3H), 1,3-2,4(m, 17H), 2,38(d, 1H), 2,6-2,8(m, 2H), 2,84(d, 1H), 3,00(s, 3H), 3,4-3,6(m, 4H), 3,72(d, 1H), 4,85(d, 1H), 6,41(d, 1H), 6,84(s, 2H) Согласно общему способу примера 12, но использованием соответствующего макрфортин исходного препарата и карбонил хлорида приготавливают приведенные ниже другие соединения макрфортина: 1 - диэтоксифосфорил - макрфортин А 1 - циклопропилкарбонил - маркфортин А, соед. #12А. 1H NMR (CDCl3)  0,82(s, 3H), 1.05(s, 3H), 1,05(s, 3H), 1,44(2s, 6H), 0,9-1,7(m, 8H), 1,7-3,0(m, 11H), 3,14(s, 3H), 3,80(d, 1H), 4,84(d, 1H), 6,28(d, 1H), 6,88(s, 2H). 1-(1-пиперидинил)тиокарбонил-макрфортин А 1-сукционил-макрофортин А 1-феноксикарбонил-маркфортин А Соед. #12B. 1H NMR (CDCl3) 0,82(s, 3H), 1.05(s, 3H), 1,05(s, 3H), 1,44(2s, 6H), 0,9-1,7(m, 8H), 1,7-3,0(m, 11H), 3,14(s, 3H), 3,80(d, 1H), 4,84(d, 1H), 6,28(d, 1H), 6,88(s, 2H). 1-(1-пиперидинил)тиокарбонил-макрфортин А 1-сукционил-макрофортин А 1-феноксикарбонил-маркфортин А Соед. #12B. 1H NMR (CDCl3)  0,83(s, 3H), 1,09(s, 3H), 1,3-1,5(m, 1H), 1,42(s, 3H), 1,46(s, 3H), 1,5-3,0(m, 13H), 3,14(s, 3H), 3,70(d, 1H), 4,83(d, 1H), 6,27(d, 1H), 6,90(3, 2H), 7,2-7,5(m, 5H). 1-(2,4-дихлорофеноксикарбонил)-18а-аллил-маркфортин B 1-(4-оксапентаноил)-18а-метил-маркфортин C 1-пальмитоил-маркфортин А, Соед. #12C FABS-MS 716(M+ + H) 1-(4-нитрофеноксикарбонил)-маркфортин А, Соед. # 12D 1H NMR (CDCl3) 0,83(s, 3H), 1,09(s, 3H), 1,3-1,5(m, 1H), 1,42(s, 3H), 1,46(s, 3H), 1,5-3,0(m, 13H), 3,14(s, 3H), 3,70(d, 1H), 4,83(d, 1H), 6,27(d, 1H), 6,90(3, 2H), 7,2-7,5(m, 5H). 1-(2,4-дихлорофеноксикарбонил)-18а-аллил-маркфортин B 1-(4-оксапентаноил)-18а-метил-маркфортин C 1-пальмитоил-маркфортин А, Соед. #12C FABS-MS 716(M+ + H) 1-(4-нитрофеноксикарбонил)-маркфортин А, Соед. # 12D 1H NMR (CDCl3) 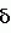 0,90(s, 3H), 1,09(s, 3H), 1,3-1,5(m, 1H), 1,44(s, 3H), 1,47(s, 3H), 1,5-2,9(m, 13H), 3,14(s, 3H), 3,70(d, 1H), 4,86(d, 1H), 6,23(d, 1H), 6,93(ABg, 2H), 7,48(d, 2H), 8,32(d, 2H). 1-(1-пиперидинкарбонил)маркфортин А, соед. #12F FAB-MS 589(M+ + H); H RNS m/z (M+ + H, C34H44N4O5 + H1) calc 589.3390, obsd 589.3398 1-[[4-(этоксикарбонил)пиперазин-1-ил] карбонил] - маркфортин А, соед. # 12G FAB-MS 662(M+ + H); 684 (M+ + Na); HRMS m/z (M+ + H, C36H47N5O7 + H1), calc 662,3553, obsd 662.3569 1-[[4-(бензил)пиперазин-1-ил]карбонил] - маркфортин А, соед. # 12H 1H NMR (300mHz, CDCl3):0,80(s, 3H), 1,26(s, 3H), 1,41(s, 3H), 1,45(s, 3H), 1,2-2,9(m, H), 2,98(s, 3H), 3,4-3,8(m, 8H), 6,41(d, 1H), 6,84(s, 2H), 7,2-7,5(m, 5H), FAB-MS 680 (M+ + H); 702(M+ + Na) 1-[[4-(1,3-бензодиоксол-5-илметил)пиперазин-1-ил] карбонил] - маркфортин А, соед. # 12I 1H NMR (300m Hz, CDCl3): 0,80(s, 3H), 1,00-2,60(m, 15H), 1,41(s, 3H), 1,45(s, 3H), 2,63(t, 1H), 2,84(d, 1H), 2,98(s, 3H), 3,45-3,80(m, 8H), 4,85(d, 1H), 5,95(3, 2H), 6,41(d, 1H), 6,70-6,90(m, 5H) FAB-MS 724 (M+ + H) 1-[[4-(метил)пиперазил-1-карбонил]-маркфортин А, Соед. # 12J 1H NMR (300mHz, CDCl3):0.82 (s, 3H),1.26 (s, 3H), 1.40 - 2.72 (m, 20H), 1.41 (s, 3H), 1.44 (s, 3H), 2.82 (d, 1H) 2.99 (s, 3H), 3.40-3.81 (m, 5H), 4.85 (d, 1H), 6.41 (d, 1H), 6.84 (s, 2H). FAB-MS 604 (M++H)$ HRMS m/z (M++H, C4H45N5O5+H1), Calc 604.30499, obsd 604.3506 1-(1,3-дигидро-1,3-диоксо-2H-изоиндол-2-ил)-маркфортин А, Соед. # 12К FABS-MS 665 (VH) 1-[[4-пиридин-2-ил)пиперазин-1-ил] карбонил] -маркфортин А, Соед. 12 # L 1H NMR (300m Hz, CDCl3) : 0,84 (s, 3H), 1.10-2.30 (m, 12H), 1.41 (s, 3H), 1.44 (s, 3H), 2.40 (d, 2H), 2.67 (t, 2H), 2.85 (d, 1H), 3.00 (s, 3H), 3.45-3.85 (m, 9H), 4.85 (d, 1H), 6.40 (d, 1H). 6.60-6.70 (m, 2H), 6.85 (s, 2H), 7.52 (t, 1H), 8,15-8.22 (m. 1H), FAB-MS 667 (M++H) 1-[[4-(фенил)пиперазин-1-ил] карбонил] -маркфортин А, Соед. # 12M 1H NMR (300 m Hz, CDCl3): 0,84(s, 3H), 1.20-2.50 (m, 11H), 1.22 (s, 3H), 1.42 (s, 3H), 1.45 (s, 3H), 2.67 (t, 1H), 2.85 (d, 1H), 3.00 (s, 3H), 3.10-3.91 (m, 9H), 4.85 (d, 1H), 6.40 (d, 1H), 6.85 (s, 2H), 6.90-7.00 (m, 3H), 7.25-7.38 (m, 2H) 1-[[4-(хлорокарбонил)пиперазин-1-ил]карбонил]-маркфортин А.Соед. # 12N 1H NMR (300m Hz, CDCl3): 0.74 (s, 3H), 1.18 (s, 3H), 1.30-2.65 (m. 20H), 2.74 (d, 1H), 2.81 (s, 3H), 3.48-3.90 (m, 8H), 4.30 (d, 1H), 6.32 (d, 1H), 6.80 (s, 2H), FAB-MS 652 (M++H) 10,10'' - (1,4-дикарбонилпиперазин)бис(6', 7',8',9',10',10' агексагидро-1', 1', 4,4,12 - пентаметил)-[2'S - [2' альфа, 3'a, альфа, 9'a альфа, 10/2''' R*, 3'''a S*, 10'''a R*), 10'a. бета]] - S пиро [4H, 8H - [1,4] диоксепино [2,3-g]индол - 8,2' (3'н) - [1H, 4H - 3a, 9a] (иминометано) циклопента [b] хинолизин] - 9, II' (10H) - дион, Соед. # 12O FAB-M5 1093 (M++H) 1-[[4-(фенил) пиперидин-1-ил] карбонил]-маккфортин А, Соед. #12P 1H NMR (300m Hz, CDCl3); 0.76 (s, 3H) 1.10 - 2.30 (m, 13H), 1.14 (s, 3H), 1.35 (s, 3H), 1.38 (s 3H), 2.33 (d, 1H), 2.52-3.00 (m, 8H), 3.00 - 3.20 (m, 1H), 3.50 - 3.75 (m, 2H), 4.05 (d, 1H), 4.33 (d, 1H), 4.79 (dd, 1H), 6.35 (dd, 1H), 6.78 (s, 2H), 7.10 - 7.30 (m, 5H). FAB-MS 665 (M++ H) 1-[[4-(диметил)пиперидин-1-ил] карбонил] - маркфортин A, Соед. 12Q 1H NMR(300m Hz, CDCl3); 0.75 (s, 3H), 0.90 - 1.95 (m, 13H), 0.92 (s, 3H), 0.96 (s 3H), 1.14 (s, 3H), 1.34 (s, 3H), 1.37 (s,3H), 2.08 (d, 1H), 2.20 (brs, 1H), 2.33 (d, 1H), 2.60 (t, 2H), 2.77 (d, 1H), 2.92 (s, 3H), 3.45 - 3.75 (m, 4H), 4.77 (d 1H), 6.33 (d, 1H), 6.77 (s, 2H). FAB-MS 617( M+ + H) 1-[[4-(5-хлоропиридазин-3-ил)пиперазин-1-ил] карбонил] - маркфортин А, Соед. 12 R 1H NMR (300m Hz, CDCl3): 0.83 (s, 3H), 1.20-2.30 (m, 11H), 1.22 (s 3H), 1.42 (s, 3H), 1.44 (s, 3H), 2.45 (d, 1H), 2.65 (t, 2H), 2.83 (s, 1H), 2.99 (s, 3H), 3.60-3.85 (m, 8H), 4.86 (d, 1H), 6.40 (d, 1H), 6.86 (s, 2H), 6.92 (d, 1H), 7.29 (d, 1H). FAB -MS 702 (M+ + H). 1-[[4-хлорофенил)пиперазин-1-ил] карбонил] - маркфортин A, Соед.# 12S 1HNMR (300m Hz, CDCl3); 0.84(s, 3H), 1.20 - 2.30 (m, 9H), 1.26(s, 3H), 1.42 (s, 3H), 1.45 (s, 3H), 2.40 (d, 1H), 2.60 - 2.75 (m, 2H), 2.85 (d, 1H), 3.00 (s, 3H), 3.15 - 3.30 (m, 4H), 3.49(d, 1H), 3.52 - 3.84 (m, 5H), 4.85 (d, 1H), 6.39 (d, 1H), 3.15 - 3,30 (m, 4H), 3.49 (d, 1H), 3.52 - 3.84 (m, 5H), 4.85 (d, 1H), 6.39 (d, 1H), 6.80 - 6.90 (m, 4H), 7.23 (d, 2H). 10'10''-(1,4-диоксо-2-бутен)бис(6', 7', 8', 9', 10'a- гексагидро- 1',1', 4,4,12'-пентаметил)- [2'S - 2'альфа, 3'a альфа, 3'a альфа, 9'a, альфа, 10(2'''R*, 3''' a S* 9'''a S*, 10'''a R*), 10"a бета]]-S-пиро[4H, 8H-[1,4] диоксепино[2,3-g] индол-8,2'(3'H)-[1H, 4H-3a, 9a](иминометано)циклопента [b] хинолизин]-9, 11'(10H)-дион, соед.# 12T FAB - MS 1035 (M+ + H) 1-[[4-(трихлороэтоксикарбонил)пиперазин-1-ил] карбонил] -маркфортин A, соед.# 12U 1H NMR (300m Hz, CDCL3: 0.75 (s,3H), 1.1-1.85 (m,8H), 1.15 (s 3H), 1.34 (s,3H), 1.34 (s,3H), 1.92 (d,1H), 2.00-2.40(m,2H), 2.34 (d,1H), 2.55 (t,24), 2.7b (d,1H), 2.91 (s,3H), 3.42-3.75 (m, 8H), 4.65-4.77 (m,2H), 4.79 (d,1H), 6.33 (d,1H), 6.79 (s,2H), FAB-MS 764 (M+H); HRMS m/z (M++ H, C6H44Cl3N5O7+H1), сalc 764.2384, obsd 764.2366 1-[[4-(3-трифторметил-тиадиазол-1ил)пиперазин-1-ил] карбонил]-маркфортин A, соед.# 12V NMR (300m Hz, CDCl3): 0.83 (s,3H), 1.26 (s,34), 1.30-2.30 (m,11H), 1.42 (s, 3H), 1.45 (S,3H), 2.42 (d,1H), 2.55-2.72 (m,2H), 2.84 (d,1H), 2.99 (S, 3H), 3.60-3.90 (m,8H), 4.87 (d,1H), 6.30 (d,1H), 6.88 (s,2H), FAB-MS742 (M+ + H); HRMS m/z (M+ + H, C36H42F3N7S1+H1), calc 742.2998, obcd 742.3038 Пример 13. 1-ацетоксиметил-маркфортин A, Соед.#13 Гидрид натрия (467 мг 60% масляной дисперсии) добавляют к раствору маркфортина A(850 мг, 1,78 ммоль) в 1 мл тетрагидрофурана. Раствор перемешивают при комнатной температуре в течение 4 ч и затем добавляют метил бромоацетат (280 мг 1,82 ммоль). Смесь перемешивают при комнатной температуре 8 ч, затем распределяют между 5% бикарбонатом натрия (1 мл) и метилен хлоридом (1 мл). Слои разделяют и водный слой экстрагируют метилен хлоридом (2 мл). Объединенные экстракты высушивают сульфатом магния, отфильтровывают и упаривают при пониженном давлении. Хроматографии на пластине силикалегя, элюируемого первоначально 5%, затем 10% ацетоном в метилен хлориде, дает 1 ацетоксиметил-маркфортин A в виде бесцветного масла: 1H NMR (CDCl3) 0,90(s, 3H), 1,09(s, 3H), 1,3-1,5(m, 1H), 1,44(s, 3H), 1,47(s, 3H), 1,5-2,9(m, 13H), 3,14(s, 3H), 3,70(d, 1H), 4,86(d, 1H), 6,23(d, 1H), 6,93(ABg, 2H), 7,48(d, 2H), 8,32(d, 2H). 1-(1-пиперидинкарбонил)маркфортин А, соед. #12F FAB-MS 589(M+ + H); H RNS m/z (M+ + H, C34H44N4O5 + H1) calc 589.3390, obsd 589.3398 1-[[4-(этоксикарбонил)пиперазин-1-ил] карбонил] - маркфортин А, соед. # 12G FAB-MS 662(M+ + H); 684 (M+ + Na); HRMS m/z (M+ + H, C36H47N5O7 + H1), calc 662,3553, obsd 662.3569 1-[[4-(бензил)пиперазин-1-ил]карбонил] - маркфортин А, соед. # 12H 1H NMR (300mHz, CDCl3):0,80(s, 3H), 1,26(s, 3H), 1,41(s, 3H), 1,45(s, 3H), 1,2-2,9(m, H), 2,98(s, 3H), 3,4-3,8(m, 8H), 6,41(d, 1H), 6,84(s, 2H), 7,2-7,5(m, 5H), FAB-MS 680 (M+ + H); 702(M+ + Na) 1-[[4-(1,3-бензодиоксол-5-илметил)пиперазин-1-ил] карбонил] - маркфортин А, соед. # 12I 1H NMR (300m Hz, CDCl3): 0,80(s, 3H), 1,00-2,60(m, 15H), 1,41(s, 3H), 1,45(s, 3H), 2,63(t, 1H), 2,84(d, 1H), 2,98(s, 3H), 3,45-3,80(m, 8H), 4,85(d, 1H), 5,95(3, 2H), 6,41(d, 1H), 6,70-6,90(m, 5H) FAB-MS 724 (M+ + H) 1-[[4-(метил)пиперазил-1-карбонил]-маркфортин А, Соед. # 12J 1H NMR (300mHz, CDCl3):0.82 (s, 3H),1.26 (s, 3H), 1.40 - 2.72 (m, 20H), 1.41 (s, 3H), 1.44 (s, 3H), 2.82 (d, 1H) 2.99 (s, 3H), 3.40-3.81 (m, 5H), 4.85 (d, 1H), 6.41 (d, 1H), 6.84 (s, 2H). FAB-MS 604 (M++H)$ HRMS m/z (M++H, C4H45N5O5+H1), Calc 604.30499, obsd 604.3506 1-(1,3-дигидро-1,3-диоксо-2H-изоиндол-2-ил)-маркфортин А, Соед. # 12К FABS-MS 665 (VH) 1-[[4-пиридин-2-ил)пиперазин-1-ил] карбонил] -маркфортин А, Соед. 12 # L 1H NMR (300m Hz, CDCl3) : 0,84 (s, 3H), 1.10-2.30 (m, 12H), 1.41 (s, 3H), 1.44 (s, 3H), 2.40 (d, 2H), 2.67 (t, 2H), 2.85 (d, 1H), 3.00 (s, 3H), 3.45-3.85 (m, 9H), 4.85 (d, 1H), 6.40 (d, 1H). 6.60-6.70 (m, 2H), 6.85 (s, 2H), 7.52 (t, 1H), 8,15-8.22 (m. 1H), FAB-MS 667 (M++H) 1-[[4-(фенил)пиперазин-1-ил] карбонил] -маркфортин А, Соед. # 12M 1H NMR (300 m Hz, CDCl3): 0,84(s, 3H), 1.20-2.50 (m, 11H), 1.22 (s, 3H), 1.42 (s, 3H), 1.45 (s, 3H), 2.67 (t, 1H), 2.85 (d, 1H), 3.00 (s, 3H), 3.10-3.91 (m, 9H), 4.85 (d, 1H), 6.40 (d, 1H), 6.85 (s, 2H), 6.90-7.00 (m, 3H), 7.25-7.38 (m, 2H) 1-[[4-(хлорокарбонил)пиперазин-1-ил]карбонил]-маркфортин А.Соед. # 12N 1H NMR (300m Hz, CDCl3): 0.74 (s, 3H), 1.18 (s, 3H), 1.30-2.65 (m. 20H), 2.74 (d, 1H), 2.81 (s, 3H), 3.48-3.90 (m, 8H), 4.30 (d, 1H), 6.32 (d, 1H), 6.80 (s, 2H), FAB-MS 652 (M++H) 10,10'' - (1,4-дикарбонилпиперазин)бис(6', 7',8',9',10',10' агексагидро-1', 1', 4,4,12 - пентаметил)-[2'S - [2' альфа, 3'a, альфа, 9'a альфа, 10/2''' R*, 3'''a S*, 10'''a R*), 10'a. бета]] - S пиро [4H, 8H - [1,4] диоксепино [2,3-g]индол - 8,2' (3'н) - [1H, 4H - 3a, 9a] (иминометано) циклопента [b] хинолизин] - 9, II' (10H) - дион, Соед. # 12O FAB-M5 1093 (M++H) 1-[[4-(фенил) пиперидин-1-ил] карбонил]-маккфортин А, Соед. #12P 1H NMR (300m Hz, CDCl3); 0.76 (s, 3H) 1.10 - 2.30 (m, 13H), 1.14 (s, 3H), 1.35 (s, 3H), 1.38 (s 3H), 2.33 (d, 1H), 2.52-3.00 (m, 8H), 3.00 - 3.20 (m, 1H), 3.50 - 3.75 (m, 2H), 4.05 (d, 1H), 4.33 (d, 1H), 4.79 (dd, 1H), 6.35 (dd, 1H), 6.78 (s, 2H), 7.10 - 7.30 (m, 5H). FAB-MS 665 (M++ H) 1-[[4-(диметил)пиперидин-1-ил] карбонил] - маркфортин A, Соед. 12Q 1H NMR(300m Hz, CDCl3); 0.75 (s, 3H), 0.90 - 1.95 (m, 13H), 0.92 (s, 3H), 0.96 (s 3H), 1.14 (s, 3H), 1.34 (s, 3H), 1.37 (s,3H), 2.08 (d, 1H), 2.20 (brs, 1H), 2.33 (d, 1H), 2.60 (t, 2H), 2.77 (d, 1H), 2.92 (s, 3H), 3.45 - 3.75 (m, 4H), 4.77 (d 1H), 6.33 (d, 1H), 6.77 (s, 2H). FAB-MS 617( M+ + H) 1-[[4-(5-хлоропиридазин-3-ил)пиперазин-1-ил] карбонил] - маркфортин А, Соед. 12 R 1H NMR (300m Hz, CDCl3): 0.83 (s, 3H), 1.20-2.30 (m, 11H), 1.22 (s 3H), 1.42 (s, 3H), 1.44 (s, 3H), 2.45 (d, 1H), 2.65 (t, 2H), 2.83 (s, 1H), 2.99 (s, 3H), 3.60-3.85 (m, 8H), 4.86 (d, 1H), 6.40 (d, 1H), 6.86 (s, 2H), 6.92 (d, 1H), 7.29 (d, 1H). FAB -MS 702 (M+ + H). 1-[[4-хлорофенил)пиперазин-1-ил] карбонил] - маркфортин A, Соед.# 12S 1HNMR (300m Hz, CDCl3); 0.84(s, 3H), 1.20 - 2.30 (m, 9H), 1.26(s, 3H), 1.42 (s, 3H), 1.45 (s, 3H), 2.40 (d, 1H), 2.60 - 2.75 (m, 2H), 2.85 (d, 1H), 3.00 (s, 3H), 3.15 - 3.30 (m, 4H), 3.49(d, 1H), 3.52 - 3.84 (m, 5H), 4.85 (d, 1H), 6.39 (d, 1H), 3.15 - 3,30 (m, 4H), 3.49 (d, 1H), 3.52 - 3.84 (m, 5H), 4.85 (d, 1H), 6.39 (d, 1H), 6.80 - 6.90 (m, 4H), 7.23 (d, 2H). 10'10''-(1,4-диоксо-2-бутен)бис(6', 7', 8', 9', 10'a- гексагидро- 1',1', 4,4,12'-пентаметил)- [2'S - 2'альфа, 3'a альфа, 3'a альфа, 9'a, альфа, 10(2'''R*, 3''' a S* 9'''a S*, 10'''a R*), 10"a бета]]-S-пиро[4H, 8H-[1,4] диоксепино[2,3-g] индол-8,2'(3'H)-[1H, 4H-3a, 9a](иминометано)циклопента [b] хинолизин]-9, 11'(10H)-дион, соед.# 12T FAB - MS 1035 (M+ + H) 1-[[4-(трихлороэтоксикарбонил)пиперазин-1-ил] карбонил] -маркфортин A, соед.# 12U 1H NMR (300m Hz, CDCL3: 0.75 (s,3H), 1.1-1.85 (m,8H), 1.15 (s 3H), 1.34 (s,3H), 1.34 (s,3H), 1.92 (d,1H), 2.00-2.40(m,2H), 2.34 (d,1H), 2.55 (t,24), 2.7b (d,1H), 2.91 (s,3H), 3.42-3.75 (m, 8H), 4.65-4.77 (m,2H), 4.79 (d,1H), 6.33 (d,1H), 6.79 (s,2H), FAB-MS 764 (M+H); HRMS m/z (M++ H, C6H44Cl3N5O7+H1), сalc 764.2384, obsd 764.2366 1-[[4-(3-трифторметил-тиадиазол-1ил)пиперазин-1-ил] карбонил]-маркфортин A, соед.# 12V NMR (300m Hz, CDCl3): 0.83 (s,3H), 1.26 (s,34), 1.30-2.30 (m,11H), 1.42 (s, 3H), 1.45 (S,3H), 2.42 (d,1H), 2.55-2.72 (m,2H), 2.84 (d,1H), 2.99 (S, 3H), 3.60-3.90 (m,8H), 4.87 (d,1H), 6.30 (d,1H), 6.88 (s,2H), FAB-MS742 (M+ + H); HRMS m/z (M+ + H, C36H42F3N7S1+H1), calc 742.2998, obcd 742.3038 Пример 13. 1-ацетоксиметил-маркфортин A, Соед.#13 Гидрид натрия (467 мг 60% масляной дисперсии) добавляют к раствору маркфортина A(850 мг, 1,78 ммоль) в 1 мл тетрагидрофурана. Раствор перемешивают при комнатной температуре в течение 4 ч и затем добавляют метил бромоацетат (280 мг 1,82 ммоль). Смесь перемешивают при комнатной температуре 8 ч, затем распределяют между 5% бикарбонатом натрия (1 мл) и метилен хлоридом (1 мл). Слои разделяют и водный слой экстрагируют метилен хлоридом (2 мл). Объединенные экстракты высушивают сульфатом магния, отфильтровывают и упаривают при пониженном давлении. Хроматографии на пластине силикалегя, элюируемого первоначально 5%, затем 10% ацетоном в метилен хлориде, дает 1 ацетоксиметил-маркфортин A в виде бесцветного масла: 1H NMR (CDCl3) 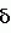 0.75 (3H, s) 1.08 (3H, s), 1.43 (3H, s), 1.45 (3H, s), 2.05 (3H, s), 3.12 (3H, s), 4.86 (1H, d, J = 8), 5,85 (1H, d, J = 8), 5.96 (1H, d, J = 8), 6.26 (1H, d, J = 8), 6.77 (1H, d, J = 7), 6.86 (1H, d, J = 7). Согласно примеру 13, но использованием соответствующего маркфортин исходного материала приготавливают приведенные ниже другие соединения маркфортина: 1-т-бутирилоксиметил-маркфортин A 1-бензоилоесиметил-маркфортин A 1-т-бутирилоксиметил-маркфортин A 1-ацетоксиметил-18а-бензил маркфортин B 1-3,4-дихлоробензоилокси-маркфортин C Пример 14. 1-(2,4-динитробензолсульфенил)-маркфортин A, Соед. 14 Маркфортин A (75 мг, о,15 ммоль) добавляют к суспензии гидрида калия (180 мг, 1,50 ммоль, 35 мас.% в растит. масле) в ТГФ (6 мл) при 5oC с последующим добавлением 2,4-динитробензолсульфенил хлорида (73 мг, 0,30 ммоль). Реакционную смесь затем перемешивают 3 ч при 5oC. После разбавления водой и экстракции хлороформом, сырой продукт хроматографируют на 1 мм пластине силикагеля (ТСХ), элюируя 30% ацетоном в метилен хлориде, получая 1-(2,4-динитробензолсульфенил)-маркфортин A (90 мг, 89,1%) в виде желтого твердого продукта. Т.пл. 155 - 160oC (разл.). 1H NMR (CDCl3); 0.75 (3H, s) 1.08 (3H, s), 1.43 (3H, s), 1.45 (3H, s), 2.05 (3H, s), 3.12 (3H, s), 4.86 (1H, d, J = 8), 5,85 (1H, d, J = 8), 5.96 (1H, d, J = 8), 6.26 (1H, d, J = 8), 6.77 (1H, d, J = 7), 6.86 (1H, d, J = 7). Согласно примеру 13, но использованием соответствующего маркфортин исходного материала приготавливают приведенные ниже другие соединения маркфортина: 1-т-бутирилоксиметил-маркфортин A 1-бензоилоесиметил-маркфортин A 1-т-бутирилоксиметил-маркфортин A 1-ацетоксиметил-18а-бензил маркфортин B 1-3,4-дихлоробензоилокси-маркфортин C Пример 14. 1-(2,4-динитробензолсульфенил)-маркфортин A, Соед. 14 Маркфортин A (75 мг, о,15 ммоль) добавляют к суспензии гидрида калия (180 мг, 1,50 ммоль, 35 мас.% в растит. масле) в ТГФ (6 мл) при 5oC с последующим добавлением 2,4-динитробензолсульфенил хлорида (73 мг, 0,30 ммоль). Реакционную смесь затем перемешивают 3 ч при 5oC. После разбавления водой и экстракции хлороформом, сырой продукт хроматографируют на 1 мм пластине силикагеля (ТСХ), элюируя 30% ацетоном в метилен хлориде, получая 1-(2,4-динитробензолсульфенил)-маркфортин A (90 мг, 89,1%) в виде желтого твердого продукта. Т.пл. 155 - 160oC (разл.). 1H NMR (CDCl3); 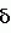 0.86 - 0.97 (m, 3H), 1.13 - 1.45 (m, 15H), 1.56 - 1.78 (m, 5H), 1.86 (m, 1H), 2.00 (m, 1H), 2.15 (d, 1H), 2.30 (m, 1H), 2.45 (d, 1H), 2.67 (bd, 1H), 2.79 (d, 1H), 2.97 (m, 1H), 3.08 (s, 3H), 3,74 (d, 1H), 4.76 (bd, 1H), 5.85 (d, 1H), 6,87 (d, 1H), 6.97 (d, 1H), 7.28 (m, 0.5H), 7.62 (m, 0.5H), 8.36 (dd, 1H), 9.16 (d, 1H). Согласно примеру 14, но использованием соответствующего маркфортин исходного материала приготавливают приведенные ниже другие соединения маркфортина: 1-(4-морфолиносульфенил)-маркфортин A, Соед. # 14A FAB-MS; m/e, 595 (m+ + H) 1-(трихлорометилсульфенил)-маркфортин A, Соед. # 14B FAB-MS; m/e, 626, 628, 630 (M+ + H) 1-(метоксикарбонилсульфенил)-маркфортин A, Соед. # 14C) FAB-MS; m/e, 568 (M+ + H) 1-(бензолсульфенил)-маркфортин A, Соед. # 14D FAB-MS; m/e, 586 (M+ + H) 1-трихлорометилсульфенил-18а-этил-маркфортин B 1-этоксикарбонилсульфенил-18а-метил-маркфортин C Пример 15. 1-(4-морфолинкарбонил)-маркфортина A N-окись, Соед. # 15 1-(4-Морфолинокарбонил)-маркфортин A (Соед. # 12E, 15 мг) обрабатывают 3-хлоронадбензойной кислотой (15 мг) в метилен хлориде (2 мл) при 0oC в течение 10 мин. Смесь распределяют между 5% бикарбонатом натрия (2 мл) и метилен хлоридом (2 мл). Слои разделяют и водный слой экстрагируют метилен хлоридом (2 мл). Объединенные экстракты высушивают сульфатом магния, отфильтровывают и упаривают при пониженном давлении. Остаток хроматографируют на 0,5 мм пластине силикагеля для препаративной тонкослойной хроматографии, элюируя 10% метанолом в метилен хлориде, получают указанное в заглавии соединение (10 мг) в виде твердого продукта. FAB - MS; 607 (M+ + H). Пример 16 1-(2-тетрагилрофуранил)маркфортин A, Соед. # 16 Карбонилимидазол (50 мг) добавляют к раствору маркфортина A (60 мг) в 6 мл тетрагидрофурана. Смесь нагревают до кипения с обратным холодильником и добавляют гидрид калия (120 мг). Образующуюся смесь перемешивают, продолжая кипятить с обратным холодильником в течение 1 ч. Осадок отфильтровывают и фильтрат концентрируют. Остаток хроматографируют на пластине силикагеля, элюируя 25% ацетоном в метиленхлориде, и получают названное в заглавии соединение (30 мг) в виде твердого продукта. HRM S (FAB); m/e (M+ + H), C32H41N3O5 + H), calc. 548, 3124, obsd. 548, 3086. Пример 17. 1-(4-морфолинкарбонил)-маркфортин A, Соед. # 12E Маркфортин A (1 г, 2,1 ммоль) в ТГФ (25 мл, очищенный перегонкой над металлическим натрием от бензофенона) и гидрид калия (35 мас.% 0,5 г, 4,4 ммоль) перемешивают 0,5 ч при комнатной температуре в атмосфере азота. Затем через шприц добавляют морфолинкарбонил хлорид (1 мл, 8,4 ммоль). После 3 ч перемешивания при комнатной температуре мутную реакционную смесь охлаждают на ледяной бане и быстро прекращают реакцию добавлением по каплям охлажденного насыщенного раствора карбоната натрия (5 мл). Затем смесь разбавляют водой (75 мл) и экстрагируют CH2Cl2 (175 мл). Органический слой сушат над сульфатом магния, отфильтровывают и концентрируют получения сырого продукта, содержащего масло. Хроматография на силикагеле (2% к 5% MeOH/CH2Cl2) дает 1-морфолинкарбонил-маркфортин А. (Хроматография на силикагеле на хроматотроне (4% MeOH/CH2Cl2) является лучшим методом очистки для 1-морфолинкарбонил-маркфортина А) 1H NMR (300 MHz, CDCl3); 0.86 - 0.97 (m, 3H), 1.13 - 1.45 (m, 15H), 1.56 - 1.78 (m, 5H), 1.86 (m, 1H), 2.00 (m, 1H), 2.15 (d, 1H), 2.30 (m, 1H), 2.45 (d, 1H), 2.67 (bd, 1H), 2.79 (d, 1H), 2.97 (m, 1H), 3.08 (s, 3H), 3,74 (d, 1H), 4.76 (bd, 1H), 5.85 (d, 1H), 6,87 (d, 1H), 6.97 (d, 1H), 7.28 (m, 0.5H), 7.62 (m, 0.5H), 8.36 (dd, 1H), 9.16 (d, 1H). Согласно примеру 14, но использованием соответствующего маркфортин исходного материала приготавливают приведенные ниже другие соединения маркфортина: 1-(4-морфолиносульфенил)-маркфортин A, Соед. # 14A FAB-MS; m/e, 595 (m+ + H) 1-(трихлорометилсульфенил)-маркфортин A, Соед. # 14B FAB-MS; m/e, 626, 628, 630 (M+ + H) 1-(метоксикарбонилсульфенил)-маркфортин A, Соед. # 14C) FAB-MS; m/e, 568 (M+ + H) 1-(бензолсульфенил)-маркфортин A, Соед. # 14D FAB-MS; m/e, 586 (M+ + H) 1-трихлорометилсульфенил-18а-этил-маркфортин B 1-этоксикарбонилсульфенил-18а-метил-маркфортин C Пример 15. 1-(4-морфолинкарбонил)-маркфортина A N-окись, Соед. # 15 1-(4-Морфолинокарбонил)-маркфортин A (Соед. # 12E, 15 мг) обрабатывают 3-хлоронадбензойной кислотой (15 мг) в метилен хлориде (2 мл) при 0oC в течение 10 мин. Смесь распределяют между 5% бикарбонатом натрия (2 мл) и метилен хлоридом (2 мл). Слои разделяют и водный слой экстрагируют метилен хлоридом (2 мл). Объединенные экстракты высушивают сульфатом магния, отфильтровывают и упаривают при пониженном давлении. Остаток хроматографируют на 0,5 мм пластине силикагеля для препаративной тонкослойной хроматографии, элюируя 10% метанолом в метилен хлориде, получают указанное в заглавии соединение (10 мг) в виде твердого продукта. FAB - MS; 607 (M+ + H). Пример 16 1-(2-тетрагилрофуранил)маркфортин A, Соед. # 16 Карбонилимидазол (50 мг) добавляют к раствору маркфортина A (60 мг) в 6 мл тетрагидрофурана. Смесь нагревают до кипения с обратным холодильником и добавляют гидрид калия (120 мг). Образующуюся смесь перемешивают, продолжая кипятить с обратным холодильником в течение 1 ч. Осадок отфильтровывают и фильтрат концентрируют. Остаток хроматографируют на пластине силикагеля, элюируя 25% ацетоном в метиленхлориде, и получают названное в заглавии соединение (30 мг) в виде твердого продукта. HRM S (FAB); m/e (M+ + H), C32H41N3O5 + H), calc. 548, 3124, obsd. 548, 3086. Пример 17. 1-(4-морфолинкарбонил)-маркфортин A, Соед. # 12E Маркфортин A (1 г, 2,1 ммоль) в ТГФ (25 мл, очищенный перегонкой над металлическим натрием от бензофенона) и гидрид калия (35 мас.% 0,5 г, 4,4 ммоль) перемешивают 0,5 ч при комнатной температуре в атмосфере азота. Затем через шприц добавляют морфолинкарбонил хлорид (1 мл, 8,4 ммоль). После 3 ч перемешивания при комнатной температуре мутную реакционную смесь охлаждают на ледяной бане и быстро прекращают реакцию добавлением по каплям охлажденного насыщенного раствора карбоната натрия (5 мл). Затем смесь разбавляют водой (75 мл) и экстрагируют CH2Cl2 (175 мл). Органический слой сушат над сульфатом магния, отфильтровывают и концентрируют получения сырого продукта, содержащего масло. Хроматография на силикагеле (2% к 5% MeOH/CH2Cl2) дает 1-морфолинкарбонил-маркфортин А. (Хроматография на силикагеле на хроматотроне (4% MeOH/CH2Cl2) является лучшим методом очистки для 1-морфолинкарбонил-маркфортина А) 1H NMR (300 MHz, CDCl3); 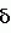 0.81 (s, 3H), 1.21 (s, 3H), 1.19 - 1.94 (m, 8H), 1.41 (s, 3H), 1.45 (s, 3H), 1.98 (d, 1H), 2.08 - 2.28 (m, 2H), 2.40 (d, 1H), 2.62 (t, 2H), 2.82 (d, 1H), 2.99 (s, 3H), 3.50 - 3.86 (m, 8H), 4.86 (d, 1H), 6.41 (d, 1H), 6.85 (s, 2H), FAB-MS 591 (M+ + H); HRMS M/Z (M+ + H, C33H42N4O6 + H1), calc. 591.3182, obsd 591. 3200. Пример 18. Согласно примеру 12, но использованием соответствующего парагерквамид исходного материала приготавливают приведенные ниже другие соединения парагерквамида: 1-диэтоксифосфорил-парагерквамид 1-циклопропилкарбнил-парагеоквамид 1-(1-пиперидинил)тиокарбонил-парагерквамид 1-сукциноил-парагерквамид 1-(4-карбэтокси-1,3-тиазолидин-3-ил)карбонил-парагерквамид 1-феноксикарбонил-парагерквамид 1-пирролидинил-парагерквамид 1-пиперидинилкарбонил-парагерквамид 1-(4-морфолинкарбонил)-парагерквамид Пример 19. Согласно примеру 13, но использованием соответствующего парагерквамид исходного материала приготавливают приведенные ниже другие соединения парагерквамида. 1-т-бутирилоксиметил-парагерквамид 1-бензолоксиметил-парагерквамид 1-ацетоксиметил-18a-парагерквамид 1-3,4-дихлоробензоидокси-парагерквамид Пример 20. Согласно примеру 14, но использованием соответствующего парагерквамид исходного материала, приготавливают приведенные ниже другие соединения парагерквамида: 1-(2,4-динитробензосульфенил)-парагерквамид 1-(4-морфолиносульфенил)-парагерквамид 1-трихлорометилсульфенил-18a-этил-парагерквамид 1-этоксикарбонилсульфенил-18a-метил-парагерквамид 1-пальмитол-парагерквамид Методика A A. Семенной ферментат Cunninghamtlla cchinulata subsp elegans (-) NRRL 1368, Cunningha-mella blakesleeana (+) Atcc SbSSa, Cunnirghamella echinulata subsp. sllgans (-) NRRL 1393, Cunnirghamella echinulata NRRL 3655. Замороженные агаровые пробки NRRL 1368 или 1393, АТТС 8688a или предпочтительно NRRL 3655 (хранившиеся в жидком азоте "LN2") асептически переносят в 100 мл объем GS-7 (стерильной) среды, содержащейся в 500 мл широкогорлой колбе для встряхивания. GS-7 составляют из (Cerelose) и Pharmamelig (Фармасреды), каждую добавляют в концентрации 25 г/л водопроводной воды. pH среды доводят до 7,2 используя гидроокись аммония. Среду стерилизуют автоклавированием в течение 30 мин. Инокулированную GS-7 встряхивают при 150-300 (желательно 250 об/мин) при 21-30oC, предпочтительно около 28oC в течение 24-72 ч (предпочтительно около 48-72 ч). Этот фермент используют для инокуляции процесса биотрасформации при приблизительно от 1 до 5% дозе (предпочтительно около 5% дозе). B. Способ биотрансформации 100 мл объемы GS-7, содержащиеся в 500 мл широкогорлых колбах, для ферментата инокулируют 48-72 ч семенным ферментатом при приблизительно 1 - 5% дозе (желательно около 5% дозе). Инокулированную CS-7 встряхивают при приблизительно 250 об/мин при 28oC в течение 24-48 ч. За это время к ферментату добавляют Маркфортин A, растворенный в диметилформамиде (ДМФ), в интервале между 10-12 мг/колбу, предпочтительно при 10 мг на 0,4 мл ДМФ на 100 мл колбу/ферментат. Ферментацию в присутствии Маркфортин A продолжают, как указано ранее, в течение 24-72 ч. Содержимое 100 колб, каждая содержащая 100 мл ферментата, как описано в методике для биотрансформации, который встряхивался при 28oC в течение 24-72 ч с последующим добавлением Маркфортина A (0,010 г на колбу, общее количество 1 г) в ДМФ (0,2 мл на колбу, 20 мл), обрабатывают CH2Cl2 (100 мл) на каждую колбу. Содержимое объединяют и перемешивают в wacihg смесителе 5 мин. Смесь центрифугирует и декантируют образующийся водный слой, Органический слой собирают, высушивают (сульфат натрия), фильтруют и концентрируют. Компоненты сырой смеси разделяют серией колоночных хроматографий, используя соотношение силикагель - твердый экстракт 50 - 125 : 1. Колонки элюируют либо 2-5% метанолом в CH2Cl2, либо 15-60% ацетоном в CH2Cl2. От этих хроматографических фракций отделяют Маркфортин B. HRMS(FAB); m/e найдено: 4642563; рассчитано: для C27H33N3)O4 + H, 4642549. При желании маркфортин B может быть перекристаллизован из смеси метилен хлорид/ацетон. Например, раствор маркфортина B в метилен хлориде концентрируют при остаточном давлении на роторном испарителе. Концентрат разбавляют порциями ацетона во время концентрации, пока не останется суспензия маркфортина B в ацетоне. 0.81 (s, 3H), 1.21 (s, 3H), 1.19 - 1.94 (m, 8H), 1.41 (s, 3H), 1.45 (s, 3H), 1.98 (d, 1H), 2.08 - 2.28 (m, 2H), 2.40 (d, 1H), 2.62 (t, 2H), 2.82 (d, 1H), 2.99 (s, 3H), 3.50 - 3.86 (m, 8H), 4.86 (d, 1H), 6.41 (d, 1H), 6.85 (s, 2H), FAB-MS 591 (M+ + H); HRMS M/Z (M+ + H, C33H42N4O6 + H1), calc. 591.3182, obsd 591. 3200. Пример 18. Согласно примеру 12, но использованием соответствующего парагерквамид исходного материала приготавливают приведенные ниже другие соединения парагерквамида: 1-диэтоксифосфорил-парагерквамид 1-циклопропилкарбнил-парагеоквамид 1-(1-пиперидинил)тиокарбонил-парагерквамид 1-сукциноил-парагерквамид 1-(4-карбэтокси-1,3-тиазолидин-3-ил)карбонил-парагерквамид 1-феноксикарбонил-парагерквамид 1-пирролидинил-парагерквамид 1-пиперидинилкарбонил-парагерквамид 1-(4-морфолинкарбонил)-парагерквамид Пример 19. Согласно примеру 13, но использованием соответствующего парагерквамид исходного материала приготавливают приведенные ниже другие соединения парагерквамида. 1-т-бутирилоксиметил-парагерквамид 1-бензолоксиметил-парагерквамид 1-ацетоксиметил-18a-парагерквамид 1-3,4-дихлоробензоидокси-парагерквамид Пример 20. Согласно примеру 14, но использованием соответствующего парагерквамид исходного материала, приготавливают приведенные ниже другие соединения парагерквамида: 1-(2,4-динитробензосульфенил)-парагерквамид 1-(4-морфолиносульфенил)-парагерквамид 1-трихлорометилсульфенил-18a-этил-парагерквамид 1-этоксикарбонилсульфенил-18a-метил-парагерквамид 1-пальмитол-парагерквамид Методика A A. Семенной ферментат Cunninghamtlla cchinulata subsp elegans (-) NRRL 1368, Cunningha-mella blakesleeana (+) Atcc SbSSa, Cunnirghamella echinulata subsp. sllgans (-) NRRL 1393, Cunnirghamella echinulata NRRL 3655. Замороженные агаровые пробки NRRL 1368 или 1393, АТТС 8688a или предпочтительно NRRL 3655 (хранившиеся в жидком азоте "LN2") асептически переносят в 100 мл объем GS-7 (стерильной) среды, содержащейся в 500 мл широкогорлой колбе для встряхивания. GS-7 составляют из (Cerelose) и Pharmamelig (Фармасреды), каждую добавляют в концентрации 25 г/л водопроводной воды. pH среды доводят до 7,2 используя гидроокись аммония. Среду стерилизуют автоклавированием в течение 30 мин. Инокулированную GS-7 встряхивают при 150-300 (желательно 250 об/мин) при 21-30oC, предпочтительно около 28oC в течение 24-72 ч (предпочтительно около 48-72 ч). Этот фермент используют для инокуляции процесса биотрасформации при приблизительно от 1 до 5% дозе (предпочтительно около 5% дозе). B. Способ биотрансформации 100 мл объемы GS-7, содержащиеся в 500 мл широкогорлых колбах, для ферментата инокулируют 48-72 ч семенным ферментатом при приблизительно 1 - 5% дозе (желательно около 5% дозе). Инокулированную CS-7 встряхивают при приблизительно 250 об/мин при 28oC в течение 24-48 ч. За это время к ферментату добавляют Маркфортин A, растворенный в диметилформамиде (ДМФ), в интервале между 10-12 мг/колбу, предпочтительно при 10 мг на 0,4 мл ДМФ на 100 мл колбу/ферментат. Ферментацию в присутствии Маркфортин A продолжают, как указано ранее, в течение 24-72 ч. Содержимое 100 колб, каждая содержащая 100 мл ферментата, как описано в методике для биотрансформации, который встряхивался при 28oC в течение 24-72 ч с последующим добавлением Маркфортина A (0,010 г на колбу, общее количество 1 г) в ДМФ (0,2 мл на колбу, 20 мл), обрабатывают CH2Cl2 (100 мл) на каждую колбу. Содержимое объединяют и перемешивают в wacihg смесителе 5 мин. Смесь центрифугирует и декантируют образующийся водный слой, Органический слой собирают, высушивают (сульфат натрия), фильтруют и концентрируют. Компоненты сырой смеси разделяют серией колоночных хроматографий, используя соотношение силикагель - твердый экстракт 50 - 125 : 1. Колонки элюируют либо 2-5% метанолом в CH2Cl2, либо 15-60% ацетоном в CH2Cl2. От этих хроматографических фракций отделяют Маркфортин B. HRMS(FAB); m/e найдено: 4642563; рассчитано: для C27H33N3)O4 + H, 4642549. При желании маркфортин B может быть перекристаллизован из смеси метилен хлорид/ацетон. Например, раствор маркфортина B в метилен хлориде концентрируют при остаточном давлении на роторном испарителе. Концентрат разбавляют порциями ацетона во время концентрации, пока не останется суспензия маркфортина B в ацетоне.
Формула изобретения1. Производные маркфортин/парагерквамида формулы I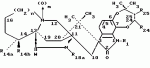 где m = 0 или 1; n = 1; W = S или О; R14а и R14b - атом водорода; R24 и R25 образуют двойную связь; R18а - атом водорода или С1 - С7 - алкил; R1 - атом водорода, -С(О)R1 - группа (где R1 - цикло С3 - С8-алкил), феноксикарбонил, -С(О)-С2-С24-алкил, нитрофеноксикарбонил, 1,3-диоксо-2Н-изоиндолил, динитробензолсульфенил, трихлорметилсульфенил, С1 - С4-алкоксикарбонилсульфенил, бензолсульфонил, тетрагидрофуранил, 1,4-диокси-С2-С7-алкенил или R1 -группа-С(О)NR4R5, где R4 и R5 вместе с атомом азота образуют насыщенное гетероциклическое кольцо, выбранное из: пирролидинил, морфолинил, пиперазинил, необязательно замещенных С1 - С4-алкилом, С1-С4-алканоилом, C1-С4-алкоксикарбонилом, 1,3-бензодиоксолил-С1 - С4-алкилом, пиридинилом, галогенпиридинилом, фенилом (необязательно замещенным атомом галогена), хлоркарбонилом, трифтор-С1-С4-алкоксикарбонилом, трифтор-С1-С4-алкилтиадиазолинилом, либо R4 и R5 образуют пиперидинил, необязательно замещенный фенилом или моно- или дизамещенный С1-С4-алкилом, или их фармацевтически приемлемые соли, или их гидраты. 2. Соединение по п.1, отличающееся тем, что группа R1 представляет собой - где m = 0 или 1; n = 1; W = S или О; R14а и R14b - атом водорода; R24 и R25 образуют двойную связь; R18а - атом водорода или С1 - С7 - алкил; R1 - атом водорода, -С(О)R1 - группа (где R1 - цикло С3 - С8-алкил), феноксикарбонил, -С(О)-С2-С24-алкил, нитрофеноксикарбонил, 1,3-диоксо-2Н-изоиндолил, динитробензолсульфенил, трихлорметилсульфенил, С1 - С4-алкоксикарбонилсульфенил, бензолсульфонил, тетрагидрофуранил, 1,4-диокси-С2-С7-алкенил или R1 -группа-С(О)NR4R5, где R4 и R5 вместе с атомом азота образуют насыщенное гетероциклическое кольцо, выбранное из: пирролидинил, морфолинил, пиперазинил, необязательно замещенных С1 - С4-алкилом, С1-С4-алканоилом, C1-С4-алкоксикарбонилом, 1,3-бензодиоксолил-С1 - С4-алкилом, пиридинилом, галогенпиридинилом, фенилом (необязательно замещенным атомом галогена), хлоркарбонилом, трифтор-С1-С4-алкоксикарбонилом, трифтор-С1-С4-алкилтиадиазолинилом, либо R4 и R5 образуют пиперидинил, необязательно замещенный фенилом или моно- или дизамещенный С1-С4-алкилом, или их фармацевтически приемлемые соли, или их гидраты. 2. Соединение по п.1, отличающееся тем, что группа R1 представляет собой -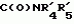 и и 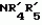 - насыщенное гетероциклическое кольцо, как определено в п.1. 3. Соединение по п.2, где насыщенное гетероциклическое кольцо выбрано из 4-морфолина, 4-фенил-1-пиперазина, 4-(2-пиридинил)-1-пиперазина, 2,6-диметил-4-морфолина, 1-пирролидина, 4-метил-1-пиперазина, 1-пиперидина, 4-фенил-1-пиперидина, 4-фенилпиперидина, 2-метилпиперидина, 3-метилпиперидина, 4-метилпиперидина, N-метилпиперидина, 1-метилгомопиперазина, 1-ацетилпиперазина. 4. Соединения по пп.1 - 3, обладающие антигельминтными и акарицидными свойствами. 5. Способ подавления насекомых или нематод - вредителей растений, включающий обработку пораженных культур препаратом, состоящим из активного компонента и носителя, отличающийся тем, что в качестве активного компонента используют соединение по пп.1 - 3. 6. Штамм гриба Penicillium sp. NRRL 18887, продуцент маркфортина А и/или маркфортина С. 7. Соединение по п.1, отличающееся тем, что оно представляет собой 18-тиомаркфортин А (соединение 2), 18-тиомаркфортин В (соединение 2А), 1-пирролидинил-маркфортин А (соединение 12), 1-циклопропилкарбонил-маркфортин А (соединение 12А), 1-феноксикарбонил-маркфортин А (соединение 12В), 1-пальмитоил-маркфортин А (соединение 12С), 1-(4-нитрофеноксикарбонил)-маркфортин А (соединение 12D), 1-(1-пиперидинкарбонил)-маркфортин А (соединение 12F), 1-[[4-(этоксикарбонил)пиперазин 1-ил]карбонил]-маркфортин А (соединение 12G), 1-[[4-(бензил)пиперазин-1-ил] карбонил]-маркфортин А (соединение 12Н), 1-[[4-(1,3-бензодиоксол-5-илметил)пиперазин-1-ил] карбонил]-маркфортин А (соединение 12I), 1-[[4-(метил)пиперазин-1-ил] карбонил] -маркфортин А (соединение 12J), 1-(1,3-дигидро-1,3-диоксо-2Н-изоиндол-2-ил)-маркфортин А (соединение 12К), 1-[[4-(пиридин-2-ил)пиперазин-1-ил] карбонил] -маркфортин А (соединение 12L), 1-[[4-(фенил)пиперазин-1-ил] карбонил]-маркфортин А (соединение 12М), 1-[[4-хлоро-карбонил)пиперазин-1-ил] карбонил] -маркфортин А (соединение 12N), 10,10''-(1,4-дикарбонилпиперазин) бис(6', 7',8', 9', 10',10'а-гексагидро-1', 1',4,4,12'-пентаметил)-[2'S-[2'. альфа, 3'а.альфа, 9'а.альфа,10] 2''' R*, 3'''аS* 9'''аS, 10'''аR*)-10'а. бета]]-спиро[4Н,8Н-(1,4-диоксепино)- 2,3-g[индол-8,2'-(3'Н)] 1Н, 4Н-3а,9а[(иминометано циклопента [b] хинолизин] -9,11'-(10Н)-дион (соединение 12О), 1-[[4-(фенил)пиперидин-1-ил] карбонил] -маркфортин А (соединение 12Р), 1-[[4-(диметил)пиперидин-1-ил]карбонил]-маркфортин А (соединение 12Q), 1-[[4-(5-хлоропиридазин-3-ил)пиперазин-1-ил] карбонил] -маркфортин А (соединение 12R), 1-[[4-(4-хлорофенил)пиперазин- 1-ил] карбонил]-маркфортин А (соединение 12S), 10,10''-(1,4-диоксо-2-бутен)бис (6', 7',8',9',10',10а-гексагидро-1',1', 4,4,12'-пентаметил)-[2'S-[2'.альфа, 3'а.альфа, 9'а.альфа, 10(2'''R*, 3'''аS* 9''' аS*, 10'''аR*) 10'а.бета]]-спиро[4Н,8Н-(1,4-диоксепино)-2,3- g[индол-8,2'(3'Н)-1Н, 4Н-3а, 9а] (иминометано)циклопента [b] хинолизин]-9,11'-(10Н)-дион (соединение 12Т), 1-[[4-(трихлороэтоксикарбонил) пиперазин-1-ил] карбонил] -маркфортин А (соединение 12U), 1-[[4-(3-трифторометил-тиадиазол-1-ил)пиперазин -1-ил] карбонил)-маркфортин А (соединение 12V). - насыщенное гетероциклическое кольцо, как определено в п.1. 3. Соединение по п.2, где насыщенное гетероциклическое кольцо выбрано из 4-морфолина, 4-фенил-1-пиперазина, 4-(2-пиридинил)-1-пиперазина, 2,6-диметил-4-морфолина, 1-пирролидина, 4-метил-1-пиперазина, 1-пиперидина, 4-фенил-1-пиперидина, 4-фенилпиперидина, 2-метилпиперидина, 3-метилпиперидина, 4-метилпиперидина, N-метилпиперидина, 1-метилгомопиперазина, 1-ацетилпиперазина. 4. Соединения по пп.1 - 3, обладающие антигельминтными и акарицидными свойствами. 5. Способ подавления насекомых или нематод - вредителей растений, включающий обработку пораженных культур препаратом, состоящим из активного компонента и носителя, отличающийся тем, что в качестве активного компонента используют соединение по пп.1 - 3. 6. Штамм гриба Penicillium sp. NRRL 18887, продуцент маркфортина А и/или маркфортина С. 7. Соединение по п.1, отличающееся тем, что оно представляет собой 18-тиомаркфортин А (соединение 2), 18-тиомаркфортин В (соединение 2А), 1-пирролидинил-маркфортин А (соединение 12), 1-циклопропилкарбонил-маркфортин А (соединение 12А), 1-феноксикарбонил-маркфортин А (соединение 12В), 1-пальмитоил-маркфортин А (соединение 12С), 1-(4-нитрофеноксикарбонил)-маркфортин А (соединение 12D), 1-(1-пиперидинкарбонил)-маркфортин А (соединение 12F), 1-[[4-(этоксикарбонил)пиперазин 1-ил]карбонил]-маркфортин А (соединение 12G), 1-[[4-(бензил)пиперазин-1-ил] карбонил]-маркфортин А (соединение 12Н), 1-[[4-(1,3-бензодиоксол-5-илметил)пиперазин-1-ил] карбонил]-маркфортин А (соединение 12I), 1-[[4-(метил)пиперазин-1-ил] карбонил] -маркфортин А (соединение 12J), 1-(1,3-дигидро-1,3-диоксо-2Н-изоиндол-2-ил)-маркфортин А (соединение 12К), 1-[[4-(пиридин-2-ил)пиперазин-1-ил] карбонил] -маркфортин А (соединение 12L), 1-[[4-(фенил)пиперазин-1-ил] карбонил]-маркфортин А (соединение 12М), 1-[[4-хлоро-карбонил)пиперазин-1-ил] карбонил] -маркфортин А (соединение 12N), 10,10''-(1,4-дикарбонилпиперазин) бис(6', 7',8', 9', 10',10'а-гексагидро-1', 1',4,4,12'-пентаметил)-[2'S-[2'. альфа, 3'а.альфа, 9'а.альфа,10] 2''' R*, 3'''аS* 9'''аS, 10'''аR*)-10'а. бета]]-спиро[4Н,8Н-(1,4-диоксепино)- 2,3-g[индол-8,2'-(3'Н)] 1Н, 4Н-3а,9а[(иминометано циклопента [b] хинолизин] -9,11'-(10Н)-дион (соединение 12О), 1-[[4-(фенил)пиперидин-1-ил] карбонил] -маркфортин А (соединение 12Р), 1-[[4-(диметил)пиперидин-1-ил]карбонил]-маркфортин А (соединение 12Q), 1-[[4-(5-хлоропиридазин-3-ил)пиперазин-1-ил] карбонил] -маркфортин А (соединение 12R), 1-[[4-(4-хлорофенил)пиперазин- 1-ил] карбонил]-маркфортин А (соединение 12S), 10,10''-(1,4-диоксо-2-бутен)бис (6', 7',8',9',10',10а-гексагидро-1',1', 4,4,12'-пентаметил)-[2'S-[2'.альфа, 3'а.альфа, 9'а.альфа, 10(2'''R*, 3'''аS* 9''' аS*, 10'''аR*) 10'а.бета]]-спиро[4Н,8Н-(1,4-диоксепино)-2,3- g[индол-8,2'(3'Н)-1Н, 4Н-3а, 9а] (иминометано)циклопента [b] хинолизин]-9,11'-(10Н)-дион (соединение 12Т), 1-[[4-(трихлороэтоксикарбонил) пиперазин-1-ил] карбонил] -маркфортин А (соединение 12U), 1-[[4-(3-трифторометил-тиадиазол-1-ил)пиперазин -1-ил] карбонил)-маркфортин А (соединение 12V).
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 14.11.1998 Номер и год публикации бюллетеня: 21-2001 Извещение опубликовано: 27.07.2001 Популярные патенты: 2446688 Композиция для получения растительного организма с улучшенным содержанием сахара и ее применение ... pBI могут быть pBIG, pBIN 19, pBI101, pBI121, pBI221 или т.п. В векторе экспрессии промотор не ограничивается каким либо конкретным промотором, при условии, что в растительном организме он принимает участие в экспрессии гена, может быть использован соответствующий известный промотор. Промоторами могут быть, например, промотор вируса 35S мозаики цветной капусты (CaMV35S), промотор актина, промотор нопалин синтетазы, промотор гена PR1a табака, промотор гена малой субъединицы рибулозо-1,5-дифосфаткарбоксилазы/оксидазы томата и т.п. Из числа указанных промоторов предпочтительно можно использовать промотор вируса 35S мозаики цветной капусты или промотор актина. При введении в ... 2092036 Способ микроразмножения стевии stevia rebaudiana l. ... мг/л. Экспланты выдерживают в условиях относительной влажности 70% фотопериоде 16 ч, освещении люминесцентными лампами ЛБ-80 при температуре 25 26oC. Через 2 недели из эксплантированной почки вырастает побег с каллусной тканью на базальной части (фиг. 1). Затем через 1 неделю увеличивается каллусная ткань и зарождается большое количество почек и регенерантов (фиг. 2). Через 1 неделю происходит сильный рост регенерантов с корнеобразованием у части из них (приблизительно 20%), пригодных для посадки сразу в грунт (фиг. 3). Оставшиеся регенеранты черенкуют и пересаживают в среду МС (фиг. 4) с содержанием фитогормонов мг/л: ИУК 5, ГК 2. Через 2 недели побеги укореняются и готовы к ... 2254705 Способ уплотнения и герметизации консервируемых кормов в рулонах ... h2 между фиксирующим штырем 11 и опорами 12 должно обеспечивать свободный доступ к центру нижней плоскости рулона при опущенном вниз фиксаторе 7 с опорой (фиг.7). В стояк вварен патрубок с двухходовым краном 14, соединяющим стояк с атмосферой или с вакуум-проводом 15 (фиг.1, 3). На каждый заготавливаемый рулон корма в комплекте устройства должны быть герметизирующий чехол 16 (фиг.7, 8) из пленочного материала, уплотняющая втулка 17, пробка 18 с клапаном 19 для выпуска газов (фиг.2), стягивающий пояс 20 (фиг.8). Изделия устройства по позициям 10, 17, 18, 19 и 20 используются многократно в течение ряда лет. Герметизирующий чехол 16 снимается с рулонов при выгрузке их из хранилища. ... 2023363 Пневматическая сеялка ... воздухопроводящие патрубки 5 с источником сжатого воздуха. Наружные концы материалопроводов содержат распылители 6, обеспечивающие направление факела материала вдоль продольной оси материалопровода. В качестве одного из возможных решений такого распылителя использована известная конструкция пластинчатого распылителя. Причем для обеспечения геометрически правильного сопряжения факелов распыла удобрений от смежных распылителей с целью обеспечения равномерного распределения материала по поверхности почвы интервал между наружными концами смежных материалопроводов с распылителями (величина h) выдержан одинаковым, а в рабочую ширину захвата сеялки (Вр) и конструктивную ширину сеялки ... 2010519 Способ биологической борьбы с вредителями растений ... в тот момент, когда птенцы "станут на крыло", т. е. будут способны к самообеспечению кормом. При этом новое поколение птиц получит устойчивый кормовой закрепленный рефлекс (установку) на поедание именно этого вида (видов) вредителей. На следующий сезон адаптации взрослых птиц на вредителей произойдет уже быстрее. Через несколько поколений рефлекс закрепителя окончательно, и потребность в проведении способа будет уменьшена или совсем отпадет. Способ будет иметь преимущество во всех сельскохозяйственных зонах. Положительным моментом является экологическая чистота, поля не загрязняются химическими средствами борьбы. В объеме изолированной сеткой, на высоком металлическом листе ... |
Еще из этого раздела: 2114555 Способ электродиагностики вымени крупного рогатого скота и устройство для его осуществления 2048055 Устройство для отрезания и погрузки сенажа и силоса 2027757 Способ получения растений - регенерантов in vitro 2120709 Рама плуга 2182889 Дезинфицирующее средство 2157612 Способ уборки корней растений, преимущественно лакрицы, и устройство для его осуществления 2054249 Способ зимовки открытопузырных рыб 2275801 Способ выращивания рыбы в рисовых чеках (варианты) 2216908 Комбайн для уборки урожая с кустарников 2175477 Способ борьбы с тлями |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||