Способ получения растений - регенерантов in vitroПатент на изобретение №: 2027757 Автор: Внучкова В.А., Аш О.А. Патентообладатель: Всероссийский научно-исследовательский институт сельскохозяйственной биотехнологии Дата публикации: 27 Января, 1995 Использование: биотехнология растений, культивирование тканей и клеток, микроклонирование. Сущность изобретения: растения - регенеранты получают in vitro, при этом для увеличения регенерации в питательные среды для инициации каллуса и формирования регенерантов дополнительно вводят ацетон в количестве 10000 - 20000 мг/л. Изобретение относится к биотехнологии, а именно к получению регенератов in vitro. Развитие методов биотехнологии, в основе которых лежит выращивание изолированных органов, тканей и клеток на искусственных питательных средах с последующей регенерацией целых растений, определяет все большее внедрение их в практику сельского хозяйства. Они способны значительно ускорить селекционный процесс и значительно расширить границы воздействия человека на живую природу. При разработке методов in vitro, где требуется получение регенерантов для внедрения в процесс селекции, имеют дело с возникновением меристематических зон из каллуса и формированием из последних растений. Эта методика необходима, в первую очередь, при микроклонировании растений, а также для получения сомаклональной вариабельности и при работе на селективных средах, включающих в себя какой-либо селективный фактор (соль, гербициды, токсины фитопатогенных грибов и пр.). В литературе имеются исследования, посвященные разработке способов формирования регенерантов зерновых, в частности пшеницы из каллусной ткани зародыша [1-2] . При использовании этих способов зародыши вычленяют из незрелых зерновок и высаживают на питательную среду для инициации каллуса. Культивирование посаженных зародышей осуществляют в темноте при t = 26оС. Материал просматривают каждые 2-3 дн. с тем, чтобы удалить основной проросток в случае его роста и тем самым способствовать формированию каллуса на поверхности щитка. Визуально формирование каллуса отмечается на 6-10 д., однако рост основного проростка тормозит этот процесс и его приходится обламывать по крайней мере 2 раза, что очень осложняет работу. Нарастание каллуса на щитке может происходить в течение 1-3 нед. и больше. За это время на каллусах оформляются видимые плотные очаги, отличающиеся от рыхлого оводненного каллуса по консистенции и цвету. Каллус с плотными участками оказывается морфогенным и при пересадке его или только одних плотных участков на среду для регенерации формируются сначала зеленые листообразные структуры, а спустя: 2-3 нед. проростки. Следует отметить, что с началом морфогенетического процесса плотный участок, представляющий собой кластер эмбриональных клеток, легко разделяется на отдельности (эмбриоиды), каждая из которых дает проросток, также отсаживаемый отдельно. От посадки экспланта на питательные среды и до выхода растений - регенерантов работа проходит в три этапа: 1. - индукция каллуса и заложение меристематических зон; 2. - формирование регенерантов; 3. - подращивание растений и ускорение их перед высадкой в грунт. На каждом из этих этапов среды отличаются заменой одних добавок на другие, их количеством и соотношением. Такая замена позволяет направлять процесс или в сторону каллусообразования или органогенеза с развитием корней или регенерантов. В процессе разработки оптимальной среды для получения регенерантов из каллуса пшеницы выбрана универсальная среда Мурасиге и Скуга, выпускаемая промышленностью в готовом виде, которая включает в себя следующие компоненты, мг/л : макросоли: NH4NO3 1650; KNO3 1900; MgSO4  7H2O 370; CaCl2 7H2O 370; CaCl2  2H2O 440; KH2PO4 170; микросоли: MnSO4 2H2O 440; KH2PO4 170; микросоли: MnSO4  H2O 22,3; H3BO3 6,2; ZnSO4 H2O 22,3; H3BO3 6,2; ZnSO4 7 H2O 8,6; CoCl2 7 H2O 8,6; CoCl2 6 H2O 0,025; CuSO4 6 H2O 0,025; CuSO4 5 H2O 0,025, NaMoO4 5 H2O 0,025, NaMoO4 2 H2O 0,25; KI 0,83; витамины: тиамин 0,1-10,0; миноинозитол 80-100; пиридоксин 0,5-1,0; никотиновая кислота 0,5-1,0. Исходя из этапов работы по получению растений - регенерантов на указанной среде для каждого этапа предназначаются следующие добавки при культивировании зерновых, в частности пшеницы, мг/л: Среда I (для индукции каллуса и формирования меристематических зон). Среда Мурасиге и Скуга, сахароза 20000-30000, мг/л, агар-агар 6000-7000 мг/л. Дихлорфеноксиуксусная кислота (2,4-Д) 1,5-2,5 мг/л. Среда II (для формирования регенерантов). Среда Мурасиге и Скуга, сахароза 10000-15000 мг/л, агар-агар 6000-7000 мг/л, 2 H2O 0,25; KI 0,83; витамины: тиамин 0,1-10,0; миноинозитол 80-100; пиридоксин 0,5-1,0; никотиновая кислота 0,5-1,0. Исходя из этапов работы по получению растений - регенерантов на указанной среде для каждого этапа предназначаются следующие добавки при культивировании зерновых, в частности пшеницы, мг/л: Среда I (для индукции каллуса и формирования меристематических зон). Среда Мурасиге и Скуга, сахароза 20000-30000, мг/л, агар-агар 6000-7000 мг/л. Дихлорфеноксиуксусная кислота (2,4-Д) 1,5-2,5 мг/л. Среда II (для формирования регенерантов). Среда Мурасиге и Скуга, сахароза 10000-15000 мг/л, агар-агар 6000-7000 мг/л, 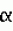 -нафтилуксусная кислота (АНУ) и кинетин по 0,5-1,0 мг/л. Среда III (для подращивания растений и укоренения их). Среда Мурасиге и Скуга, сахароза 10000-15000 мг/л, агар-агар 6000-7000 мг/л. Добавок нет. При посадке незрелых зародышей зерновых, в частности пшеницы, имеет место массовая регенерация растений. И тем не менее число растений - регенерантов сильно колеблется, в первую очередь, в зависимости от генотипа, но также и от состава культуральных сред. Целью изобретения является разработка способа получения регенерантов растений in vitro, дающего большее количество растений, особенно на селективных средах. Поставленная цель достигается с помощью способа получения регенерантов in vitro, включающего посадку экспланта на питательную среду для инициации каллуса и закладки меристематических зон, выращивание проростков при пересадке меристематических зон на питательную среду для оформления их в регенеранты, а также подращивание и ускорение растений до пересадки в грунт, отличительным признаком которого является то, что в среды для инициации каллуса и формирования регенерантов дополнительно вводят ацетон в количестве 10000-20000 мг/л. Использование ацетона в питательных средах для получения регенерантов высших растений в научно-технической и патентной литературе не описано, что позволяет считать, что предлагаемый способ соответствует критерию изобретения "новизна". Как известно, ацетон относится к группе кетоновых тел, которая включает ацетон, ацетоуксусную кислоту и -нафтилуксусная кислота (АНУ) и кинетин по 0,5-1,0 мг/л. Среда III (для подращивания растений и укоренения их). Среда Мурасиге и Скуга, сахароза 10000-15000 мг/л, агар-агар 6000-7000 мг/л. Добавок нет. При посадке незрелых зародышей зерновых, в частности пшеницы, имеет место массовая регенерация растений. И тем не менее число растений - регенерантов сильно колеблется, в первую очередь, в зависимости от генотипа, но также и от состава культуральных сред. Целью изобретения является разработка способа получения регенерантов растений in vitro, дающего большее количество растений, особенно на селективных средах. Поставленная цель достигается с помощью способа получения регенерантов in vitro, включающего посадку экспланта на питательную среду для инициации каллуса и закладки меристематических зон, выращивание проростков при пересадке меристематических зон на питательную среду для оформления их в регенеранты, а также подращивание и ускорение растений до пересадки в грунт, отличительным признаком которого является то, что в среды для инициации каллуса и формирования регенерантов дополнительно вводят ацетон в количестве 10000-20000 мг/л. Использование ацетона в питательных средах для получения регенерантов высших растений в научно-технической и патентной литературе не описано, что позволяет считать, что предлагаемый способ соответствует критерию изобретения "новизна". Как известно, ацетон относится к группе кетоновых тел, которая включает ацетон, ацетоуксусную кислоту и 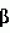 -оксимасляную кислоту. В организме ацетон распадается на СО2 и Н2О. Способ получения регенерантов in vitro на средах, содержащих ацетон, был апробирован на разных культурах, в том числе пшенице, луке, чесноке, капусте и рапсе. П р и м е р 1 (контроль). Незрелые зародыши пшеницы культивировались на питательной среде следующего состава, мг/л: макро- и микросоли по Мурасиге и Скугу, сахароза 30000, агар-агар 7000; витамины: тиамин 10, миоинозитол 100, пиридоксин и никотиновая кислота по 1,0, 2,4-Д 2,5 (в среде для инициации каллуса или меристематических зон) или АНУ и кинетин по 1,0 (в среде для регенерации). рН 5,6-5,8. На среду I высаживают незрелые зародыши пшеницы щитком вверх в возрасте 10-14 д. после опыления по 20 пробирок каждого образца по 6 зародышей в каждой пробирке - всего 120 зародышей каждого образца. Через 1-2 д. после посадки начинает расти заложенный основной проросток, который следует обломать. Еще через 3-7 д. необходимо просмотреть пробирки и удалить продолжающие расти остатки основного побега. Через 7-10 д. после посадки на поверхности щитка отмечают образование каллуса и его последующее нарастание. В зависимости от генотипа процент образования каллуса составляет 76-85% от числа посаженных зародышей. Каллусы находятся на этой среде 21-28 д. - до появления плотных участков - меристематических очагов, после чего плотные участки переносятся на среду II, на которой из них в течение 4-8 нед. образуются проростки в зависимости от генотипа в 25-30% случаев. Оставшийся после переноса каллус высаживают на среду I для дальнейшего нарастания каллуса и формирования в нем новых меристем. Возможно культивирование незрелых зародышей пшеницы на среде Мурасиге и Скуга следующего содержания, мг/л: сахароза 20000, агар-агар 60000, тиамин 1,0, миоинозитол 80, пиридоксин и никотиновая кислота по 0,5, 2,4-Д 1,5 (в среде для инициации каллуса и меристематических зон) или АНУ и кинетин по 0,6 (в среде для регенерации). рН = 5,6-5,8. На этих средах получены результаты, аналогичные вышеприведенным, с той разницей, что при уменьшении количества 2,4-Д с 2,5 до 1,5 мг/л происходит на 2-3 д. ускорение во времени заложения меристематических зон. Эты данные дают возможность сформулировать основную (базовую) среду I и II для дальнейшей работы, мг/л: среда Мурасиге и Скуга, агар-агар 6500, сахароза 30000, тиамин 10,0, миоинозитол 100, пиридоксин и никотиновая кислота по 0,5, 2,4-Д (в среде I) 2,0 или АНУ и кинетин (в среде II) 0,5 и кинетин 1,0. Полученные проростки переносились на среду III для подращивания и ускорения. Не отмечено разницы в подращивании и укоренении на средах, составленных по- максимуму или по- минимуму (сахароза 15000 мг/л, агар-агар 7000 мг/л или сахароза 10000 мг/л, агар-агар 6000 мг/л. Поэтому для подращивания и укоренения можно рекомендовать в качестве оптимального варианта среду Мурасиге и Скуга, содержащую сахарозу 12000 мг/л и агар-агар 6000 мг/л (базовая среда III). Хорошо развитые растения из пробирок были высажены в грунт, где они дали семена. Следует отметить нарушение в отдельных колосьях растений регенерантов (Ро) фертильности некоторых цветков, которое исчезало у растений первого поколения (Р1). П р и м е р 2 (опыт). Проводят культивирование незрелых зародышей пшеницы на среде с ацетоном следующего состава, мг/л: базовая среда I или II плюс ацетон 5000, 10000, 20000 и 50000. Незрелые зародыши тех же образцов пшеницы культивируют вышеописанным способом (пример 1) щитком вверх в возрасте 10-14 д. после опыления по 20 пробирок каждого варианта по 6 зародышей в каждой пробирке - всего 120 зародышей каждого образца. Просмотр посадок через 2-3 д. обнаружил, что рост основного проростка угнетен: проростки не переходят к росту вообще или растут слабо и в крайнем случае требуется однократное их обламывание, что значительно облегчает работу. В этом воздействии - первое значимое преимущество сред с ацетоном. Дальнейшее развитие каллуса идет интенсивно и через 12-15 д. в нем закладываются меристематические зоны, которые после переноса их на среду для регенерации во множестве формируют регенеранты. Число меристематических зон на среде с ацетоном составляет 87-95% по отношению к числу посаженных зародышей. На этой среде получено 53-65% регенерантов. Следует подчеркнуть высокую активность и непрерывность процесса закладки меристематических зон и связанное с этим увеличение числа регенерантов на среде с ацетоном по сравнению с контролем. Этот эффект является вторым значимым преимуществом сред с ацетоном для получения регенерантов пшениц из каллусной ткани in vitro. Апробировано культивирование незрелых зародышей на базовой среде с ацетоном 5000, 10000, 20000 и 50000 мг/л. Лучшими вариантами по выходу каллуса, меристематических зон и регенерантов следует считать варианты с содержанием ацетона 10000 и 20000 мг/л, при этом между этими вариантами не было принципиальной разницы. При содержании ацетона в среде 5000 мг/л наблюдался слабый эффект. Культивирование зародышей на среде с содержанием ацетона 50000 мг/л привело к гибели эксплантов, поэтому этот вариант не учитывается. Регенеранты, полученные на среде II, подращивались и укоренялись на базовой среде III и высаживались в грунт, где они давали семена. Следует подчеркнуть, что фертильность растений Ро в грунте в варианте 10000 и 20000 мг/л ацетона была в целом практически равна таковой в контроле, но у отдельных растений в колосьях было до 50% стерильных цветков. Как и в контроле, растения Р1 полностью восстанавливали фертильность. Кроме того, у растений Ро и Р1 отмечена высокая кустистость (10-30, стеблей), при этом основная часть побегов была продуктивной. В контроле кустистость была обычной для яровых пшениц - 2-5 побегов. В высокой кустистости опытных растений яровой пшеницы дающей возможность получить в Р1 больший урожай зерна с одного куста - третье преимущество сред с ацетоном для получения регенерантов пшениц из каллусной ткани in vitro. Пример 2 дает возможность рекомендовать среду с ацетоном для пшениц следующего составa: базовая среда плюс ацетон 15000 мг/л. Cледует отметить, что настоящие исследования прошли экспериментальную проверку в течение 3 лет, при этом получены однозначные результаты. В связи с крайне интересными данными способ был апробирован также на культуре in vitro лука при формировании регенерантов и получены аналогичные результаты. П р и м е р 3 (контроль). Проводят культивирование тканей донца луковиц лука с целью микроклонирования их для быстрого размножения новых сортов и ценных селекционных образцов, а также для вегетативного размножения гибридов F1-F2 (когда требуется сохранить их без расщепления) или стерильных межвидовых гибридов. Поскольку донце лука содержит меристематические клетки, для микроклонирования не требуется образования каллуса и закладки в нем меристематических зон, поэтому среда I упраздняется. Посадку экспланта производят на среду II (для регенерации), представленную базовой средой, содержащей вместо кинетина 2,5-3,5 мг/л бензиламинопурина (БАП). Для посадки луковицу освобождают от сухих чешуй, стерилизуют, отмывают стерильной водой, снимают первый ряд сочных чешуй и обрезают так, чтобы донце с остатками сочных чешуй (не более 0,5 см длиной) можно было разрезать на 5-6 участков (0,5 х 0,5 см). Каждый участок высаживается на питательную среду. Следует отметить, что экспланты, взятые с периферийных участков донца дают больше регенерантов, чем взятые из центральных участков. Культивирование проходит на свету при освещении 10-15 тыс.пкс, длине дня 16 ч и t = 20-25оС. Через 2-3 нед появляются первые регенеранты в виде тонких зеленых иголочек, которые по мере их появления освобождают от исходных чешуй и тканей и пересаживают или на среду II для нарастания новых регенерантов, или на среду III для подращивания и укоренения. Показано, что при культивировании эксплантов на среде II, содержащей 2,5 или 3,5 мг/л БАП нет принципиальной разницы с точки зрения выхода регенерантов. Поэтому рекомендуется оптимальная среда - базовая + БАП 3,0 мг/л. Показано, что от 1 экспланта на этой среде можно получить в течение 2,5-3,5 мес. 50-70 растений, причем работу по микроклонированию можно проводить в любое время года. П р и м е р 4 (опыт). Вышеописанным способом проводят культивирование тканей донца лука на базовой среде + БАП 3,0 мг/л + ацетон 10000-20000 мг/л. Не было принципиальной разницы в развитии регенерантов между вариантами 10000 и 20000 мг/л ацетона в среде. Поэтому следует считать оптимальной среду с ацетоном для микроклонирования лука, мг/л: базовая среда + БАП 3,0 + ацетон 20000. На этой среде количество регенерантов увеличилось в 3,5 раза, что составило, в зависимости от генотипа, за 2,5-3,5 мес. 150-300 регенерантов от одного экспланта. Аналогичные данные получены при микроклонировании чеснока. П р и м е р 5. Известно, что регенерация различных сортов и разновидностей капусты затруднена, что служит большим препятствием для работы in vitro и методами генной инженерии с этим объектом. Поэтому был произведен эксперимент по получению регенерантов на среде с ацетоном. Для этого семядоли проростков белокочанной капусты сортов Амагер и Июньская 10, а также капусты брокколи после стерилизации высаживали на агаризированную среду II, представленную базовой средой и содержащей вместо кинитина 2,5-3,5 мг/л БАП. Культивирование проходило на свету при освещении 10-15 тыс.лкс, длине дня 16 ч. и t = 20-25оС. Показано, что на указанных средах ни в одном случае посадки эксплантов не было регенерантов. Поэтому произвели высадку семядолей на среду II с содержанием БАП 3,0 мг/л и дополненную ацетоном 10000-30000 мг/л. На среде с ацетоном 20000 мг/л отмечено появление максимального количества регенерантов: у сорта Амагер число эксплантов с регенерантами составило 10% (в контроле 0%), у сорта Июньская 10 - 80% (в контроле 0%), у брокколи - 11% (в контроле 0%). При посадке эксплантов на среду с ацетоном 10000 мг/л регенерантов практически не было. При посадке на среды, содержащие 30000 мг/л, регенеранты были несколько изуродованными (со скрученными листьями). Таким образом следует считать оптимальной среду с ацетоном для получения регенерантов капусты из семядолей: базовая среда + БАП 3,0 мг/л + ацетон 20000 мг/л. При посадке гипокотиля проростков капусты на оптимальную среду с ацетоном у брокколи получено 44% эксплантов с регенерантами, в контроле - 13%. Аналогичные результаты получены и при посадке in vitro тканей рапса. Таким образом на основании приведенного материала можно сделать вывод, что введение ацетона в питательную среду имеет преимущество в технике получения регенерантов in vitro. -оксимасляную кислоту. В организме ацетон распадается на СО2 и Н2О. Способ получения регенерантов in vitro на средах, содержащих ацетон, был апробирован на разных культурах, в том числе пшенице, луке, чесноке, капусте и рапсе. П р и м е р 1 (контроль). Незрелые зародыши пшеницы культивировались на питательной среде следующего состава, мг/л: макро- и микросоли по Мурасиге и Скугу, сахароза 30000, агар-агар 7000; витамины: тиамин 10, миоинозитол 100, пиридоксин и никотиновая кислота по 1,0, 2,4-Д 2,5 (в среде для инициации каллуса или меристематических зон) или АНУ и кинетин по 1,0 (в среде для регенерации). рН 5,6-5,8. На среду I высаживают незрелые зародыши пшеницы щитком вверх в возрасте 10-14 д. после опыления по 20 пробирок каждого образца по 6 зародышей в каждой пробирке - всего 120 зародышей каждого образца. Через 1-2 д. после посадки начинает расти заложенный основной проросток, который следует обломать. Еще через 3-7 д. необходимо просмотреть пробирки и удалить продолжающие расти остатки основного побега. Через 7-10 д. после посадки на поверхности щитка отмечают образование каллуса и его последующее нарастание. В зависимости от генотипа процент образования каллуса составляет 76-85% от числа посаженных зародышей. Каллусы находятся на этой среде 21-28 д. - до появления плотных участков - меристематических очагов, после чего плотные участки переносятся на среду II, на которой из них в течение 4-8 нед. образуются проростки в зависимости от генотипа в 25-30% случаев. Оставшийся после переноса каллус высаживают на среду I для дальнейшего нарастания каллуса и формирования в нем новых меристем. Возможно культивирование незрелых зародышей пшеницы на среде Мурасиге и Скуга следующего содержания, мг/л: сахароза 20000, агар-агар 60000, тиамин 1,0, миоинозитол 80, пиридоксин и никотиновая кислота по 0,5, 2,4-Д 1,5 (в среде для инициации каллуса и меристематических зон) или АНУ и кинетин по 0,6 (в среде для регенерации). рН = 5,6-5,8. На этих средах получены результаты, аналогичные вышеприведенным, с той разницей, что при уменьшении количества 2,4-Д с 2,5 до 1,5 мг/л происходит на 2-3 д. ускорение во времени заложения меристематических зон. Эты данные дают возможность сформулировать основную (базовую) среду I и II для дальнейшей работы, мг/л: среда Мурасиге и Скуга, агар-агар 6500, сахароза 30000, тиамин 10,0, миоинозитол 100, пиридоксин и никотиновая кислота по 0,5, 2,4-Д (в среде I) 2,0 или АНУ и кинетин (в среде II) 0,5 и кинетин 1,0. Полученные проростки переносились на среду III для подращивания и ускорения. Не отмечено разницы в подращивании и укоренении на средах, составленных по- максимуму или по- минимуму (сахароза 15000 мг/л, агар-агар 7000 мг/л или сахароза 10000 мг/л, агар-агар 6000 мг/л. Поэтому для подращивания и укоренения можно рекомендовать в качестве оптимального варианта среду Мурасиге и Скуга, содержащую сахарозу 12000 мг/л и агар-агар 6000 мг/л (базовая среда III). Хорошо развитые растения из пробирок были высажены в грунт, где они дали семена. Следует отметить нарушение в отдельных колосьях растений регенерантов (Ро) фертильности некоторых цветков, которое исчезало у растений первого поколения (Р1). П р и м е р 2 (опыт). Проводят культивирование незрелых зародышей пшеницы на среде с ацетоном следующего состава, мг/л: базовая среда I или II плюс ацетон 5000, 10000, 20000 и 50000. Незрелые зародыши тех же образцов пшеницы культивируют вышеописанным способом (пример 1) щитком вверх в возрасте 10-14 д. после опыления по 20 пробирок каждого варианта по 6 зародышей в каждой пробирке - всего 120 зародышей каждого образца. Просмотр посадок через 2-3 д. обнаружил, что рост основного проростка угнетен: проростки не переходят к росту вообще или растут слабо и в крайнем случае требуется однократное их обламывание, что значительно облегчает работу. В этом воздействии - первое значимое преимущество сред с ацетоном. Дальнейшее развитие каллуса идет интенсивно и через 12-15 д. в нем закладываются меристематические зоны, которые после переноса их на среду для регенерации во множестве формируют регенеранты. Число меристематических зон на среде с ацетоном составляет 87-95% по отношению к числу посаженных зародышей. На этой среде получено 53-65% регенерантов. Следует подчеркнуть высокую активность и непрерывность процесса закладки меристематических зон и связанное с этим увеличение числа регенерантов на среде с ацетоном по сравнению с контролем. Этот эффект является вторым значимым преимуществом сред с ацетоном для получения регенерантов пшениц из каллусной ткани in vitro. Апробировано культивирование незрелых зародышей на базовой среде с ацетоном 5000, 10000, 20000 и 50000 мг/л. Лучшими вариантами по выходу каллуса, меристематических зон и регенерантов следует считать варианты с содержанием ацетона 10000 и 20000 мг/л, при этом между этими вариантами не было принципиальной разницы. При содержании ацетона в среде 5000 мг/л наблюдался слабый эффект. Культивирование зародышей на среде с содержанием ацетона 50000 мг/л привело к гибели эксплантов, поэтому этот вариант не учитывается. Регенеранты, полученные на среде II, подращивались и укоренялись на базовой среде III и высаживались в грунт, где они давали семена. Следует подчеркнуть, что фертильность растений Ро в грунте в варианте 10000 и 20000 мг/л ацетона была в целом практически равна таковой в контроле, но у отдельных растений в колосьях было до 50% стерильных цветков. Как и в контроле, растения Р1 полностью восстанавливали фертильность. Кроме того, у растений Ро и Р1 отмечена высокая кустистость (10-30, стеблей), при этом основная часть побегов была продуктивной. В контроле кустистость была обычной для яровых пшениц - 2-5 побегов. В высокой кустистости опытных растений яровой пшеницы дающей возможность получить в Р1 больший урожай зерна с одного куста - третье преимущество сред с ацетоном для получения регенерантов пшениц из каллусной ткани in vitro. Пример 2 дает возможность рекомендовать среду с ацетоном для пшениц следующего составa: базовая среда плюс ацетон 15000 мг/л. Cледует отметить, что настоящие исследования прошли экспериментальную проверку в течение 3 лет, при этом получены однозначные результаты. В связи с крайне интересными данными способ был апробирован также на культуре in vitro лука при формировании регенерантов и получены аналогичные результаты. П р и м е р 3 (контроль). Проводят культивирование тканей донца луковиц лука с целью микроклонирования их для быстрого размножения новых сортов и ценных селекционных образцов, а также для вегетативного размножения гибридов F1-F2 (когда требуется сохранить их без расщепления) или стерильных межвидовых гибридов. Поскольку донце лука содержит меристематические клетки, для микроклонирования не требуется образования каллуса и закладки в нем меристематических зон, поэтому среда I упраздняется. Посадку экспланта производят на среду II (для регенерации), представленную базовой средой, содержащей вместо кинетина 2,5-3,5 мг/л бензиламинопурина (БАП). Для посадки луковицу освобождают от сухих чешуй, стерилизуют, отмывают стерильной водой, снимают первый ряд сочных чешуй и обрезают так, чтобы донце с остатками сочных чешуй (не более 0,5 см длиной) можно было разрезать на 5-6 участков (0,5 х 0,5 см). Каждый участок высаживается на питательную среду. Следует отметить, что экспланты, взятые с периферийных участков донца дают больше регенерантов, чем взятые из центральных участков. Культивирование проходит на свету при освещении 10-15 тыс.пкс, длине дня 16 ч и t = 20-25оС. Через 2-3 нед появляются первые регенеранты в виде тонких зеленых иголочек, которые по мере их появления освобождают от исходных чешуй и тканей и пересаживают или на среду II для нарастания новых регенерантов, или на среду III для подращивания и укоренения. Показано, что при культивировании эксплантов на среде II, содержащей 2,5 или 3,5 мг/л БАП нет принципиальной разницы с точки зрения выхода регенерантов. Поэтому рекомендуется оптимальная среда - базовая + БАП 3,0 мг/л. Показано, что от 1 экспланта на этой среде можно получить в течение 2,5-3,5 мес. 50-70 растений, причем работу по микроклонированию можно проводить в любое время года. П р и м е р 4 (опыт). Вышеописанным способом проводят культивирование тканей донца лука на базовой среде + БАП 3,0 мг/л + ацетон 10000-20000 мг/л. Не было принципиальной разницы в развитии регенерантов между вариантами 10000 и 20000 мг/л ацетона в среде. Поэтому следует считать оптимальной среду с ацетоном для микроклонирования лука, мг/л: базовая среда + БАП 3,0 + ацетон 20000. На этой среде количество регенерантов увеличилось в 3,5 раза, что составило, в зависимости от генотипа, за 2,5-3,5 мес. 150-300 регенерантов от одного экспланта. Аналогичные данные получены при микроклонировании чеснока. П р и м е р 5. Известно, что регенерация различных сортов и разновидностей капусты затруднена, что служит большим препятствием для работы in vitro и методами генной инженерии с этим объектом. Поэтому был произведен эксперимент по получению регенерантов на среде с ацетоном. Для этого семядоли проростков белокочанной капусты сортов Амагер и Июньская 10, а также капусты брокколи после стерилизации высаживали на агаризированную среду II, представленную базовой средой и содержащей вместо кинитина 2,5-3,5 мг/л БАП. Культивирование проходило на свету при освещении 10-15 тыс.лкс, длине дня 16 ч. и t = 20-25оС. Показано, что на указанных средах ни в одном случае посадки эксплантов не было регенерантов. Поэтому произвели высадку семядолей на среду II с содержанием БАП 3,0 мг/л и дополненную ацетоном 10000-30000 мг/л. На среде с ацетоном 20000 мг/л отмечено появление максимального количества регенерантов: у сорта Амагер число эксплантов с регенерантами составило 10% (в контроле 0%), у сорта Июньская 10 - 80% (в контроле 0%), у брокколи - 11% (в контроле 0%). При посадке эксплантов на среду с ацетоном 10000 мг/л регенерантов практически не было. При посадке на среды, содержащие 30000 мг/л, регенеранты были несколько изуродованными (со скрученными листьями). Таким образом следует считать оптимальной среду с ацетоном для получения регенерантов капусты из семядолей: базовая среда + БАП 3,0 мг/л + ацетон 20000 мг/л. При посадке гипокотиля проростков капусты на оптимальную среду с ацетоном у брокколи получено 44% эксплантов с регенерантами, в контроле - 13%. Аналогичные результаты получены и при посадке in vitro тканей рапса. Таким образом на основании приведенного материала можно сделать вывод, что введение ацетона в питательную среду имеет преимущество в технике получения регенерантов in vitro.
Формула изобретенияСПОСОБ ПОЛУЧЕНИЯ РАСТЕНИЙ - РЕГЕНЕРАНТОВ IN VITRO, включающий посадку экспланта на питательную среду для инициации каллуса и закладки меристематических зон, получение проростков при пересадке меристематических зон на питательную среду для формирования регенерантов, подращивание и укоренение растений на питательной среде до высадки их в грунт, отличающийся тем, что в питательные среды для инициации каллуса и формирования регенерантов дополнительно вводят ацетон в количестве 10000-20000 мг/л.MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Номер и год публикации бюллетеня: 27-2000 Извещение опубликовано: 27.09.2000 Популярные патенты: 2139657 Инсектицидная композиция ... а в качестве растворителя углеводородный или спиртовый растворитель при следующем соотношении компонентов, мас.%: тетраметрин 0,01-0,60, перметрин 0,01-0,50, 0,0-диметил-0-(2,2 дихлорвинил)фосфат 0,05-1,00, пиперонилбутоксид 0,01-2,00, 2,5 фурандион, дигидро-3-(тетрапропенил) 0,01-0,50 углеводородный пропеллент 20,00-60,00, углеводородный или спиртовый растворитель - остальное. Технический результат - создание инсектицидной композиции с повышенным острым и ограниченным и регулируемым остаточным инсектицидным действием и, как следствие, обеспечивающей сокращение требуемого количества санитарных обработок помещений. 4 табл. , , , , ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ... 2177226 Способ защиты растений от болезней, регулирования их роста и защитно-стимулирующий комплекс для его осуществления ... жидкости могут производить начиная с протравливания семенного материала, а вегетирующие растения обрабатывают при их высоте от 0,001 метра до цветения и позднее. В качестве прилипателей при протравливании семенного материала могут использоваться полимерные композиции, клей КМЦ и другие вещества с массовыми процентами не более 0,08. Поставленная цель в защитно-стимулирующем комплексе "Полиазофос-К" для защиты растений от болезней и регулировании их роста по славянской технологии, включающем аммофос, сернокислую медь, мочевину, аммиак или (и) углекислый натрий и воду, достигается тем, что сернокислая медь вводится в комплекс в качестве макроэлемента, то есть в массовых процентах, не ... 2169462 Улей (варианты), способ его сборки и способ круглогодичного содержания в нем пчел ... холодной пятидневки в осенне-зимнем периоде и средняя для наиболее жаркого месяца в весенне-летнем периоде, К; V - объем улья, мм3; A=(2...3)10-8 1/(ммК) - коэффициент, принимаемый для осенне-зимнего содержания пчелиной семьи; A= (11...13)10-8 1/(ммК) - для весенне-летнего периода содержания пчел. Из представленного материала заявки следует, что цилиндрический улей более предпочтителен, т.к. соответствует природным ульям в виде дупел и достигнута цель настоящего изобретения - обеспечено круглогодичное содержание пчелиных семей в ульях цилиндрической формы. Формула изобретения 1. Улей для осенне-зимнего содержания пчелиной семьи, содержащий гнездовой корпус с основным и ... 2154939 Способ выращивания кроликов и устройство для его осуществления ... навоза. Гнездовое отделение имеет стационарное исполнение и сообщается с клеткой при помощи задвижки. К недостаткам рассматриваемой конструкции двухъярусной клетки для кроликов можно отнести следующее. В известном устройстве предложено использовать задвижку в гнездовом отделении с целью разделения самца от самки или самки от крольчат с последующей их ловлей и переноской обслуживающим персоналом в другие помещения, что влечет за собой значительные затраты ручного труда и способствует возникновению стрессовых состояний у животных. Известное устройство по сбору мочи и экскрементов не позволяет сохранить физиологически обусловленную технологичность помета кроликов, имеющего влажность ... 2414113 Способ и комплекс для обработки зерна, семян или плодоовощной продукции озоном ... размером отверстий, увеличивающимся в направлении движения озоногазовой смеси, обработку озоногазовой смесью массы зерна, семян или плодоовощной продукции осуществляют первично путем продувания озоногазовой смеси, полученной путем смешивания озонокислородной смеси, вырабатываемой в озонаторной установке, с газом носителем, через перфорированную трубу и повторно - озоногазовой смесью для повторного использования, полученной путем ее отбора после продувания и смешивания со вновь выработанной в озонаторной установке в количестве, необходимом для поддержания постоянной концентрации озона в озоногазовой смеси, разложение после окончания обработки излишней озоногазовой смеси в деструкторе, ... |
Еще из этого раздела: 2012206 Инсектицидная композиция для борьбы с тараканами 2420945 Гидравлическая система сельхозмашины 2050341 Устройство для переработки органического субстрата в биогумус 2294617 Устройство для отрезания и погрузки силоса и сенажа 2054235 Лесопосадочная машина 2159030 Способ широкорядного посева пропашных культур 2492633 Устройство для автоматического полива 2197796 Рабочий орган ручного почвообрабатывающего орудия 2263431 Устройство для предпосевной обработки семян 2253239 Способ производства средства для обработки растений (варианты) |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||