Способ подготовки трансплантатовПатент на изобретение №: 2097009 Автор: Азнабаев М.Т., Лобанов С.А., Еникеев Д.А., Никова Г.А. Патентообладатель: Уфимский научно-исследовательский институт глазных болезней Дата публикации: 27 Ноября, 1997 Адрес для переписки: подача заявки06.10.1994 публикация патента27.11.1997 Изображения Изобретение относится к медицине, а именно к офтальмохирургии и может быть использовано для пластической и реконструктивной хирургии радужки глаза. Сущность изобретения заключается в том, что трансплантат из биологических тканей помещают в раствор витального красителя Эванса Голубого с концентрацией 0,005-0,1% и выдерживают в течение 24-48 ч при температуре 18-24oC, затем окрашенные трансплантаты помещают в раствор уксусной кислоты с концентрацией от 0,2-0,5% на 15-60 мин, после чего хранят в консерванте 70%-м спирте. Трансплантаты, изготовленные по предлагаемому способу, позволяют полноценно восстановить анатомическую целостность радужки глаза, достигнуть функционального и косметического эффекта, не требуют дорогостоящего оборудования, технологичны и нетрудоемки в изготовлении, позволяют сделать большой запас пластического материала. 1 табл. ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУИзобретение относится к медицине, а именно к офтальмохирургии и может быть использовано для пластической и реконструктивной хирургии радужки глаза. В настоящее время для иридопластики используют трансплантационные материалы, изготовленные из радужки глаза донора, аутоконъюнктивы, склеры, стенки сосудов (патент РФ N 2005449, 1994), которые удовлетворительно переносятся, не вызывают реакции отторжения, но не всегда позволяют достигнуть косметического эффекта. Важной и актуальной задачей иридопластики трансплантантами остается разработка способов получения окрашенных трансплантационных материалов, для достижения косметического эффекта с использованием красителей, не оказывающих вредного или токсического действия на клетки и ткани глаза. Прототипом изобретения является способ косметического протезирования переднего отрезка глаза (авт. св. СССР N 1337086 A 61 F 9/00, 1987), в котором, с целью увеличения стойкости косметического эффекта и уменьшения послеоперационных осложнений, внутрироговично имплантируют, предварительно окрашенную под цвет парной радужки, аллогенную заднюю капсулу хрусталика. Недостатками прототипа являются: сложность и трудоемкость при заборе материала; ограниченное количество трансплантационного материала; травматизм при внутрироговичном введении, что приводит к формированию бельма; сложность манипуляций при операции; отсутствие восстановления анатомической целостности и функций радужки глаза; невозможно применить при полной или почти полной аниридии. Технический результат изобретения заключается в достижении и повышении стойкости косметического эффекта, снижении послеоперационных осложнений, создания запаса трансплантационного материала и снижения его себестоимости. Технический результат достигается способом подготовки трансплантатов для иридопластики путем окрашивания их, отличающийся тем, что трансплантат из биологических тканей помещают в раствор витального красителя Эванса Голубого с концентрацией 0,005-0,1% и выдерживают в течение 24-48 ч при комнатной температуре 18-24oC и последующей консервацией в 70%-м спирте. Известно, что многие красители используют не только для проведения гистологических и гистохимических исследований, при культивировании клеток и тканей, но и вводят животным прижизненно для типирования исследуемых структур. Однако применение большинства красителей не всегда позволяет добиться желаемых положительных результатов. В одних случаях краситель легко вымывается из трансплантатов после окрашивания (метиленовый голубой, нильский синий и др.), в других случаях является цитотоксичным для клеток и тканей глаза (азур-эозин, альциановый синий и др.). Краситель Эванса Голубого (Ч) применяют в гистохимии для прижизненного окрашивания мукополисахариднопротеиновых комплексов, выявления основного вещества соединительной ткани и для изучения накоплений витальных веществ фагоцитирующими элементами соединительной ткани. По МРТУ 6-09-6602-70 мелкокристаллический порошок темно-фиолетового цвета, максимум светопоглащения раствора 1:100000, нм 605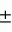 5, оптическая плотность раствора в максимуме кривой светопоглощения не менее 0,970. (Фрайштат Д.М. Реактивы и препараты для микроскопии. Справочник. М. Химия, 1980, с.445-446). Были найдены опытным путем оптимальные значения концентраций и время окрашивания трансплантатов в голубой цвет при использовании витального красителя Эванса Голубого. При окрашивании биологических тканей в растворах красителя Эванса Голубого с концентрацией менее 0,004% и временем выдерживания меньше 24 ч трансплантат приобретает бледно-голубой цвет, что не соответствует окраске радужки и не позволяет добиться косметического эффекта при иридопластике. При концентрации раствора красителя Эванса Голубого более 0,1% и временем выдерживания более 48 ч трансплантат приобретает интенсивно синее окрашивание с фиолетовым оттенком, что не соответствует естественной окраске радужки глаза и не способствует достижению косметического эффекта. В природе радужки с таким цветом не встречаются. Способ приготовления трансплантатов из биологических тканей для иридопластики осуществляется следующим образом. Трансплантаты, после консервации в 70%-м спирте в течение 30 сут, помещают в дистиллированную воду на 30-60 мин, а затем переносят в водный раствор витального красителя Эванса Голубого с концентрацией 0,005-0,1% (0,005% 0,1% 0,02% 0,05% 0,1%) в течение 24-48 ч при температуре 18-24oC для окрашивания трансплантатов в голубой и оттенки голубого цвета, синий цвет. После этого трансплантат тщательно отмывают в дистиллированной воде при температуре 24-30oC и постоянном перемешивании, часто сменяя воду по мере ее окрашивания и добиваются стойкого сохранения окраски трансплантатом, без изменения цвета воды. Затем окрашенный трансплантат помещают в раствор уксусной кислоты с концентрацией 0,2-0,5% при температуре 18-24oC и выдерживают в течение 15-60 мин при постоянном перемешивании, после этого отмывают в воде до исчезновения запаха уксусной кислоты и затем помещают в 70% спирт на ночь, сменяя утром на 96% этиловый спирт, где находится 24 ч при температуре 18-24oC, после этого трансплантат помещают в консервант (70% спирт), где он и хранится до реализации. Нами были проведены спектрофотометрические исследования 32 радужек глаз доноров (умерших людей), консервированных в 70%-м спирте. Замеры проводились в разных участках зрачковой и цилиарной зонах радужки и определяли величину пропускания (Т) света через объект, т.е. ткань радужки. Опытным путем были определены границы минимальных и максимальных значений величины пропускания света через ткань радужки. Толщина радужки не везде одинаковая, с учетом этого были взяты средние значения, составившие от 285 5, оптическая плотность раствора в максимуме кривой светопоглощения не менее 0,970. (Фрайштат Д.М. Реактивы и препараты для микроскопии. Справочник. М. Химия, 1980, с.445-446). Были найдены опытным путем оптимальные значения концентраций и время окрашивания трансплантатов в голубой цвет при использовании витального красителя Эванса Голубого. При окрашивании биологических тканей в растворах красителя Эванса Голубого с концентрацией менее 0,004% и временем выдерживания меньше 24 ч трансплантат приобретает бледно-голубой цвет, что не соответствует окраске радужки и не позволяет добиться косметического эффекта при иридопластике. При концентрации раствора красителя Эванса Голубого более 0,1% и временем выдерживания более 48 ч трансплантат приобретает интенсивно синее окрашивание с фиолетовым оттенком, что не соответствует естественной окраске радужки глаза и не способствует достижению косметического эффекта. В природе радужки с таким цветом не встречаются. Способ приготовления трансплантатов из биологических тканей для иридопластики осуществляется следующим образом. Трансплантаты, после консервации в 70%-м спирте в течение 30 сут, помещают в дистиллированную воду на 30-60 мин, а затем переносят в водный раствор витального красителя Эванса Голубого с концентрацией 0,005-0,1% (0,005% 0,1% 0,02% 0,05% 0,1%) в течение 24-48 ч при температуре 18-24oC для окрашивания трансплантатов в голубой и оттенки голубого цвета, синий цвет. После этого трансплантат тщательно отмывают в дистиллированной воде при температуре 24-30oC и постоянном перемешивании, часто сменяя воду по мере ее окрашивания и добиваются стойкого сохранения окраски трансплантатом, без изменения цвета воды. Затем окрашенный трансплантат помещают в раствор уксусной кислоты с концентрацией 0,2-0,5% при температуре 18-24oC и выдерживают в течение 15-60 мин при постоянном перемешивании, после этого отмывают в воде до исчезновения запаха уксусной кислоты и затем помещают в 70% спирт на ночь, сменяя утром на 96% этиловый спирт, где находится 24 ч при температуре 18-24oC, после этого трансплантат помещают в консервант (70% спирт), где он и хранится до реализации. Нами были проведены спектрофотометрические исследования 32 радужек глаз доноров (умерших людей), консервированных в 70%-м спирте. Замеры проводились в разных участках зрачковой и цилиарной зонах радужки и определяли величину пропускания (Т) света через объект, т.е. ткань радужки. Опытным путем были определены границы минимальных и максимальных значений величины пропускания света через ткань радужки. Толщина радужки не везде одинаковая, с учетом этого были взяты средние значения, составившие от 285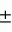 35 мкм до 437 35 мкм до 437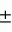 25 мкм. Для окрашивания трансплантатов из стенки кадаверных сосудов был использован витальный краситель Эванса Голубого. Водные растворы этого красителя позволили добиться стойкого окрашивания трансплантационных материалов из стенки кадаверных сосудов в голубой и синий цвета и сохранения окрашивания в течение длительного времени, как при хранении трансплантатов (до 16 мес), так и при иридопластике этими трансплантатами в эксперименте (12 мес). Учитывая структурные и прочностное особенности трансплантатов из стенки кадаверных сосудов их толщина составляет 180-350 мкм. Для их окрашивания были приготовлены растворы красителя Эванса Голубого с равной концентрацией от 0,001% 0,002% 0,005% 0,01% 0,02% 0,04% 0,05% 0,08% 0,1% В эти растворы красителей помещают трансплантаты и через каждые сутки (24 ч) проводят спектрофотометрические исследования, предварительно отмыв в дистиллированной воде от избытка красителя Эванса Голубого. Опытным путем, с учетом спектрофотометрических результатов исследования окрашенных трансплантатов, определяют оптимальные параметры границ концентраций растворов Эванса Голубого, составившие 0,005-0,1% (0,005% 0,01% 0,02% 0,05% 0,08% 0,1%) и время выдерживания трансплантатов в красителях, составившие 24-48 ч, позволяющие окрашивать трансплантационные материалы из стенки кадаверных сосудов в требуемый цвет. После этого окрашенные трансплантаты помещают в раствор уксусной кислоты с концентрацией 0,2-0,5% в течение 15-60 мин при температуре 18-24oC, затем отмывают в дистиллированной воде при постоянном перемешивании до исчезновения запаха, переносят в 70% спирт на ночь, утром помещают в 96% спирт на 24 ч, а затем в свежую порцию 70% спирта консервант, где и хранят до момента реализации. Зависимость окрашивания биологических тканей из стенки кадаверных сосудов от концентрации красителя Эванса Голубого по данным спектрофотометрических исследований представлена в таблице. Пример 1. Для получения трансплантатов из стенки кадаверных сосудов, окрашенных в светло-голубой цвет, их помещают в раствор красителя Эванса Голубого с концентрацией 0,005% на 24 ч при комнатной температуре 18oC, затем отмывают в воде и помещают в раствор уксусной кислоты с концентрацией 0,2% при температуре 18oC на 15 мин при постоянном перемешивании, далее отмывают в воде до исчезновения запаха уксусной кислоты, переносят в 70% спирт на ночь, сменяя утром на 96% этиловый спирт, где трансплантаты находятся 24 ч при температуре 18oC, затем помещают в консервант (70% этиловый спирт). Пример 2. Для получения трансплантатов из стенки кадаверных сосудов, окрашенных в голубой цвет, их помещают в раствор красителя Эванса Голубого с концентрацией 0,02% на 36 ч при комнатной температуре 18oC, затем отмывают в воде и помещают в раствор уксусной кислоты с концентрацией 0,3% при температуре 18oC на 30 мин при постоянном перемешивании, далее отмывают в воде до исчезновения запаха уксусной кислоты, переносят в 70% спирт на ночь, сменяя утром на 96% этиловый спирт, где трансплантаты находятся 24 ч при температуре 18oC, затем помещают в консервант (70% этиловый спирт). Пример 3. Для получения трансплантатов из стенки кадаверных сосудов, окрашенных в синий цвет, их помещают в раствор красителя Эванса Голубого с концентрацией 0,1% на 48 ч при комнатной температуре 18oC, затем отмывают в воде и помещают в раствор уксусной кислоты с концентрацией 0,5% на 60 мин при температуре 18oC при постоянном перемешивании, далее отмывают в воде до исчезновения запаха уксусной кислоты, переносят в 70% спирт на ночь, сменяя утром на 96% этиловый спирт, где находится 24 ч при температуре 18oC, затем помещают в консервант 70% этиловый спирт. В эксперименте на лабораторных животных была прослежена нетоксичность трансплантатов из стенки кадаверных сосудов, окрашенных красителем Эванса Голубого (ЛД50>5 г/кг при введении в желудок крысам, что позволяет отнести эти трансплантаты к IV классу опасности веществ "мало токсичные и мало опасные"). Краситель Эванса Голубого в условиях однократного подкожного введения 0,5 мл раствора с концентрацией 1% животным не вызывает их гибели, что позволяет отнести его по степени воздействия на организм к IY классу опасности веществ "мало токсичные и мало опасные". При ежедневных инстилляциях на роговицу кроликам и крысам в течение 28 сут 1% водного раствора Эванса Голубого не выявлено признаков интоксикации, изменения внешнего вида, отклонений в поведении, двигательной активности и динамики увеличения массы тела животных. Также оставались в норме содержание в сыворотке крови общего белка, глюкозы, холестерина, не отличалось от контрольного количества эритроцитов и лейкоцитов в крови. Трансплантаты из стенки кадаверных сосудов для иридопластики с внешним диаметром 12 мм, внутренним 3 мм, толщиной 310 25 мкм. Для окрашивания трансплантатов из стенки кадаверных сосудов был использован витальный краситель Эванса Голубого. Водные растворы этого красителя позволили добиться стойкого окрашивания трансплантационных материалов из стенки кадаверных сосудов в голубой и синий цвета и сохранения окрашивания в течение длительного времени, как при хранении трансплантатов (до 16 мес), так и при иридопластике этими трансплантатами в эксперименте (12 мес). Учитывая структурные и прочностное особенности трансплантатов из стенки кадаверных сосудов их толщина составляет 180-350 мкм. Для их окрашивания были приготовлены растворы красителя Эванса Голубого с равной концентрацией от 0,001% 0,002% 0,005% 0,01% 0,02% 0,04% 0,05% 0,08% 0,1% В эти растворы красителей помещают трансплантаты и через каждые сутки (24 ч) проводят спектрофотометрические исследования, предварительно отмыв в дистиллированной воде от избытка красителя Эванса Голубого. Опытным путем, с учетом спектрофотометрических результатов исследования окрашенных трансплантатов, определяют оптимальные параметры границ концентраций растворов Эванса Голубого, составившие 0,005-0,1% (0,005% 0,01% 0,02% 0,05% 0,08% 0,1%) и время выдерживания трансплантатов в красителях, составившие 24-48 ч, позволяющие окрашивать трансплантационные материалы из стенки кадаверных сосудов в требуемый цвет. После этого окрашенные трансплантаты помещают в раствор уксусной кислоты с концентрацией 0,2-0,5% в течение 15-60 мин при температуре 18-24oC, затем отмывают в дистиллированной воде при постоянном перемешивании до исчезновения запаха, переносят в 70% спирт на ночь, утром помещают в 96% спирт на 24 ч, а затем в свежую порцию 70% спирта консервант, где и хранят до момента реализации. Зависимость окрашивания биологических тканей из стенки кадаверных сосудов от концентрации красителя Эванса Голубого по данным спектрофотометрических исследований представлена в таблице. Пример 1. Для получения трансплантатов из стенки кадаверных сосудов, окрашенных в светло-голубой цвет, их помещают в раствор красителя Эванса Голубого с концентрацией 0,005% на 24 ч при комнатной температуре 18oC, затем отмывают в воде и помещают в раствор уксусной кислоты с концентрацией 0,2% при температуре 18oC на 15 мин при постоянном перемешивании, далее отмывают в воде до исчезновения запаха уксусной кислоты, переносят в 70% спирт на ночь, сменяя утром на 96% этиловый спирт, где трансплантаты находятся 24 ч при температуре 18oC, затем помещают в консервант (70% этиловый спирт). Пример 2. Для получения трансплантатов из стенки кадаверных сосудов, окрашенных в голубой цвет, их помещают в раствор красителя Эванса Голубого с концентрацией 0,02% на 36 ч при комнатной температуре 18oC, затем отмывают в воде и помещают в раствор уксусной кислоты с концентрацией 0,3% при температуре 18oC на 30 мин при постоянном перемешивании, далее отмывают в воде до исчезновения запаха уксусной кислоты, переносят в 70% спирт на ночь, сменяя утром на 96% этиловый спирт, где трансплантаты находятся 24 ч при температуре 18oC, затем помещают в консервант (70% этиловый спирт). Пример 3. Для получения трансплантатов из стенки кадаверных сосудов, окрашенных в синий цвет, их помещают в раствор красителя Эванса Голубого с концентрацией 0,1% на 48 ч при комнатной температуре 18oC, затем отмывают в воде и помещают в раствор уксусной кислоты с концентрацией 0,5% на 60 мин при температуре 18oC при постоянном перемешивании, далее отмывают в воде до исчезновения запаха уксусной кислоты, переносят в 70% спирт на ночь, сменяя утром на 96% этиловый спирт, где находится 24 ч при температуре 18oC, затем помещают в консервант 70% этиловый спирт. В эксперименте на лабораторных животных была прослежена нетоксичность трансплантатов из стенки кадаверных сосудов, окрашенных красителем Эванса Голубого (ЛД50>5 г/кг при введении в желудок крысам, что позволяет отнести эти трансплантаты к IV классу опасности веществ "мало токсичные и мало опасные"). Краситель Эванса Голубого в условиях однократного подкожного введения 0,5 мл раствора с концентрацией 1% животным не вызывает их гибели, что позволяет отнести его по степени воздействия на организм к IY классу опасности веществ "мало токсичные и мало опасные". При ежедневных инстилляциях на роговицу кроликам и крысам в течение 28 сут 1% водного раствора Эванса Голубого не выявлено признаков интоксикации, изменения внешнего вида, отклонений в поведении, двигательной активности и динамики увеличения массы тела животных. Также оставались в норме содержание в сыворотке крови общего белка, глюкозы, холестерина, не отличалось от контрольного количества эритроцитов и лейкоцитов в крови. Трансплантаты из стенки кадаверных сосудов для иридопластики с внешним диаметром 12 мм, внутренним 3 мм, толщиной 310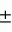 35 мкм, окрашенные красителем Эванса Голубого с концентрацией растворов 0,005-0,1% в течение 48 ч, не оказывают аллергизирующего действия, не вызывают патологических изменений со стороны органа зрения, кожи и внутренних органов (легких, печени, почек). Трансплантаты, окрашенные красителем Эванса Голубого, при иридопластике в эксперименте не вызывают каких-либо отрицательных эффектов, при этом прослеживалось в течение длительного времени (12 мес) сохранение стойкого косметического эффекта после операции. В эксперименте на кроликах при иридопластике предложенными трансплантатами из стенки кадаверных сосудов наблюдалось ареактивное течение послеоперационного периода. Животные наблюдались в течение длительного периода до 1 года и выводились из эксперимента на 3, 7, 14, 21, 30, 60, 90, 180, 360 сутки. Гистологические и электронно-микроскопические исследования доказывают замещение трансплантата тканью радужки глаза реципиента с явлениями нарастающей дифференцировки клеточных элементов во вновь образованной ткани на месте трансплантата. Трансплантат при этом выполняет каркасную функцию и используется организмом как строительный материал для построения собственной ткани на месте трансплантата. Полученные трансплантаты из стенки кадаверных сосудов позволяют полноценно восстановить анатомическую целостность радужки глаза, достигнуть функционального эффекта, правильно сформировать зрачок и повысить остроту зрения за счет уменьшения светорассеивания, исчезновения светобоязни, создают надежную преграду между стекловидным телом и передней камерой, благодаря чему уменьшается опасность послеоперационной отслойки сетчатки. Предлагаемый способ подготовки трансплантатов для иридопластики не требует дорогостоящего оборудования и реактивов, работы высококвалифицированного специалиста, технологичен, нетрудоемок, позволяет сделать большой запас пластического материала (из одной аорты до тысячи трансплантатов), обладает по сравнению с прототипом следующими преимуществами: ареактивностью в послеоперационном периоде, отсутствием аллергических, иммунологических и воспалительных реакций, простотой получения окрашенных трансплантатов, большим выходом конечного продукта, большим сроком годности, меньшей себестоимостью, длительным и стойким сохранением косметического эффекта в послеоперационный период. Экспериментальные и морфологические исследования (гистологические, гистохимические, электронно-микроскопические), проведенные на лабораторных животных позволяют сделать вывод об отсутствии цитотоксичности при иридопластике трансплантатами, окрашенными красителем Эванса Голубого с концентрацией растворов до 1% В клинике УФНИИ глазных болезней для замещения обширных дефектов радужной оболочки использовались трансплантаты из стенки кадаверных сосудов, окрашенные в голубой цвет одному больному (история болезни N 2362) и в серый цвет одному больному (история болезни N 4776). В обоих случаях производилась иридопластика трансплантатами как один из этапов реконструкции переднего отрезка глаза после травмы. Пример. Больной Г. 24 года, получил травму левого глаза 3 месяца назад - проникающее ранение роговицы с выпадением оболочек. Первичная хирургическая обработка проведена по месту жительства. В институт обратился по поводу травматической катаракты, рубца роговицы и дефекта радужки левого глаза. Острота зрения поврежденного глаза равнялась светоощущению с правильной проекцией света, офтальмотонус в состоянии компенсации. В нижнем секторе 5-8 ч полная колобома радужки с ровными краями. Рубец роговицы паралимбально на 5-7 ч. Хрусталик мутный, рефлекса с глазного дна не видно. Правый глаз здоров, острота зрения 1,0. Поле зрения и офтальмотонус в норме. На левом глазу проведена операция экстракция травматической катаракты и закрытие колобомы трансплантатом, окрашенный в голубой цвет. Операция осуществлялась следующим образом: произведена обработка операционного поля по обычной методике. Акинезия и ретробульбарная анестезия проводилась 2% раствором новокаина 5 мл, эпибульбарная анестезия 0,5 раствором дикаина. Конъюнктива отсепарована от лимба на 5-9 ч, передняя камера вскрыта по лимбу, разрез расширен от 5 до 9 ч. Трансплантат фиксирован 2-мя узловыми швами 10/0 к зрачковому краю колобомы с обеих сторон. Через нижнюю часть колобомы произведена экстракапсулярная экстракция катаракты, наложены узловые П-образные швы на нижний край трансплантата и склеру, завязаны на склере. Края колобомы и трансплантата на протяжении от зрачка к корню фиксированы 4-мя узловыми швами. Передняя камера герметизирована наложением узловых швов 8/0 на роговицу, конъюнктива ушита непрерывно. Для восстановления тургора глаза в переднюю камеру введен стерильный физраствор. Закапаны дезинфицирующие капли, введен парабульбарно антибиотик и 0,5 дексазона. Операция и послеоперационный период протекали без осложнений. На 12 день после операции глаз почти спокоен. При выписке на левом глазу передняя камера глубокая, зрачок правильной формы, диаметр 3 мм. В стекловидном теле плавающие помутнения. Глазное дно без видимых изменений. Острота зрения и ВГД в норме. Срок наблюдения 2,5 года. В нижнем секторе роговичный рубец, передняя камера глубокая, зрачок в центре, слабо реагирует на цвет, трансплантат по цвету не отличается от радужной оболочки глаза, наблюдается некоторая депигментация радужки по краям трансплантата, в стекловидном теле помутнения. Острота зрения равняется 0,8, глазное дно без патологии. Таким образом, использование предложенного способа окрашивания трансплантатов для иридопластики позволяет получить хороший косметический эффект при замещении обширных колобом у лиц с голубым цветом радужной оболочки. Операция не сопровождается аллергическими и иммунологическими реакциями. 35 мкм, окрашенные красителем Эванса Голубого с концентрацией растворов 0,005-0,1% в течение 48 ч, не оказывают аллергизирующего действия, не вызывают патологических изменений со стороны органа зрения, кожи и внутренних органов (легких, печени, почек). Трансплантаты, окрашенные красителем Эванса Голубого, при иридопластике в эксперименте не вызывают каких-либо отрицательных эффектов, при этом прослеживалось в течение длительного времени (12 мес) сохранение стойкого косметического эффекта после операции. В эксперименте на кроликах при иридопластике предложенными трансплантатами из стенки кадаверных сосудов наблюдалось ареактивное течение послеоперационного периода. Животные наблюдались в течение длительного периода до 1 года и выводились из эксперимента на 3, 7, 14, 21, 30, 60, 90, 180, 360 сутки. Гистологические и электронно-микроскопические исследования доказывают замещение трансплантата тканью радужки глаза реципиента с явлениями нарастающей дифференцировки клеточных элементов во вновь образованной ткани на месте трансплантата. Трансплантат при этом выполняет каркасную функцию и используется организмом как строительный материал для построения собственной ткани на месте трансплантата. Полученные трансплантаты из стенки кадаверных сосудов позволяют полноценно восстановить анатомическую целостность радужки глаза, достигнуть функционального эффекта, правильно сформировать зрачок и повысить остроту зрения за счет уменьшения светорассеивания, исчезновения светобоязни, создают надежную преграду между стекловидным телом и передней камерой, благодаря чему уменьшается опасность послеоперационной отслойки сетчатки. Предлагаемый способ подготовки трансплантатов для иридопластики не требует дорогостоящего оборудования и реактивов, работы высококвалифицированного специалиста, технологичен, нетрудоемок, позволяет сделать большой запас пластического материала (из одной аорты до тысячи трансплантатов), обладает по сравнению с прототипом следующими преимуществами: ареактивностью в послеоперационном периоде, отсутствием аллергических, иммунологических и воспалительных реакций, простотой получения окрашенных трансплантатов, большим выходом конечного продукта, большим сроком годности, меньшей себестоимостью, длительным и стойким сохранением косметического эффекта в послеоперационный период. Экспериментальные и морфологические исследования (гистологические, гистохимические, электронно-микроскопические), проведенные на лабораторных животных позволяют сделать вывод об отсутствии цитотоксичности при иридопластике трансплантатами, окрашенными красителем Эванса Голубого с концентрацией растворов до 1% В клинике УФНИИ глазных болезней для замещения обширных дефектов радужной оболочки использовались трансплантаты из стенки кадаверных сосудов, окрашенные в голубой цвет одному больному (история болезни N 2362) и в серый цвет одному больному (история болезни N 4776). В обоих случаях производилась иридопластика трансплантатами как один из этапов реконструкции переднего отрезка глаза после травмы. Пример. Больной Г. 24 года, получил травму левого глаза 3 месяца назад - проникающее ранение роговицы с выпадением оболочек. Первичная хирургическая обработка проведена по месту жительства. В институт обратился по поводу травматической катаракты, рубца роговицы и дефекта радужки левого глаза. Острота зрения поврежденного глаза равнялась светоощущению с правильной проекцией света, офтальмотонус в состоянии компенсации. В нижнем секторе 5-8 ч полная колобома радужки с ровными краями. Рубец роговицы паралимбально на 5-7 ч. Хрусталик мутный, рефлекса с глазного дна не видно. Правый глаз здоров, острота зрения 1,0. Поле зрения и офтальмотонус в норме. На левом глазу проведена операция экстракция травматической катаракты и закрытие колобомы трансплантатом, окрашенный в голубой цвет. Операция осуществлялась следующим образом: произведена обработка операционного поля по обычной методике. Акинезия и ретробульбарная анестезия проводилась 2% раствором новокаина 5 мл, эпибульбарная анестезия 0,5 раствором дикаина. Конъюнктива отсепарована от лимба на 5-9 ч, передняя камера вскрыта по лимбу, разрез расширен от 5 до 9 ч. Трансплантат фиксирован 2-мя узловыми швами 10/0 к зрачковому краю колобомы с обеих сторон. Через нижнюю часть колобомы произведена экстракапсулярная экстракция катаракты, наложены узловые П-образные швы на нижний край трансплантата и склеру, завязаны на склере. Края колобомы и трансплантата на протяжении от зрачка к корню фиксированы 4-мя узловыми швами. Передняя камера герметизирована наложением узловых швов 8/0 на роговицу, конъюнктива ушита непрерывно. Для восстановления тургора глаза в переднюю камеру введен стерильный физраствор. Закапаны дезинфицирующие капли, введен парабульбарно антибиотик и 0,5 дексазона. Операция и послеоперационный период протекали без осложнений. На 12 день после операции глаз почти спокоен. При выписке на левом глазу передняя камера глубокая, зрачок правильной формы, диаметр 3 мм. В стекловидном теле плавающие помутнения. Глазное дно без видимых изменений. Острота зрения и ВГД в норме. Срок наблюдения 2,5 года. В нижнем секторе роговичный рубец, передняя камера глубокая, зрачок в центре, слабо реагирует на цвет, трансплантат по цвету не отличается от радужной оболочки глаза, наблюдается некоторая депигментация радужки по краям трансплантата, в стекловидном теле помутнения. Острота зрения равняется 0,8, глазное дно без патологии. Таким образом, использование предложенного способа окрашивания трансплантатов для иридопластики позволяет получить хороший косметический эффект при замещении обширных колобом у лиц с голубым цветом радужной оболочки. Операция не сопровождается аллергическими и иммунологическими реакциями.
ФОРМУЛА ИЗОБРЕТЕНИЯСпособ подготовки трансплантатов из биологической ткани путем ее обработки красителем, отмывки с последующим хранением в консерванте, отличающийся тем, что в качестве биологической ткани используют стенки кадаверных сосудов, а обработку проводят путем помещения в раствор витального красителя Эванса Голубого с концентрацией от 0,005 до 0,1% выдерживают при 18 24oС в течение 24 48 ч, затем помещают в 0,2 0,5%-ный раствор уксусной кислоты на 15 60 мин, а в качестве консерванта используют 70%-ный раствор этилового спирта.Популярные патенты: 2241344 Способ производства зеленого корма ... продукции животноводства. 1 з.п. ф-лы. Изобретение относится к сельскохозяйственному производству, а именно производству зеленых кормов, используемых как подкормка или основной корм для всех видов сельскохозяйственных животных и птицы.Известны способы производства зеленого корма (Кругляков Ю.А. Оборудование для непрерывного выращивания зеленого корма гидропонным способом. М.: Агропромиздат, 1991; Образцов А.С., Пиуткин С.Н. Гидропонный корм из ячменя на субстрате из соломы // Кормопроизводство, 1980, №10; Базаров Е.И., Широков Ю.А. Агрозооэнергетика. - М.: Агропромиздат, 1987), включающие предварительную подготовку, проращивание семян, их размещение на вегетационной поверхности, ... 2175189 Способ регенерации растений сорго в культуре in vitro ... морфогенеза ИУК и кинетин, отличающийся тем, что для получения и размножения эмбриогенных каллусных культур используют модифицированную среду Мурасиге и Скуга с концентрацией ионов NO3 - и NH4 +, составляющей 61-88 mM для ионов NO3 -, и 48-78 mM для ионов NH4 +. 2. Способ по п.1, отличающийся тем, что концентрация ионов предпочтительно составляет для NO3 - - 72,4 mM, а для NH4 + - 62,5 mM. MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 14.12.2001 Номер и год публикации бюллетеня: 19-2003 Извещение опубликовано: ... 2243658 Способ повышения урожайности картофеля и томатов ... -5 М гиббереллинов А4+7, описанный в (Leonard М, Kinet J. - M., Bodson М; Bernier G. Enhanced Inflorescence Development in Tomato by Growth Substance Treatment in Relation to C-Assimilate Distribution (Стимуляция развития цветочной кисти томатов путем обработки регулятором роста в связи с распределением 14С-ассимилятов в растении) //Physiol. Plant. - 1983. - V. 57. - Fasc. 1. - Р. 85-89). Обработку растений начинали через 6 дней после появления цветочной кисти и проводили 5 раз с интервалом 2 дня. Такая обработка стимулировала фотосинтез листьев, усиливала приток 14С-ассимилятов в кисть. Этот способ принят за прототип. К недостаткам известного способа можно отнести:1. Эффект ... 2305931 Способ регенерации растений клевера лугового при генетической трансформации ... сомаклональной вариабельности у растений-регенерантов РП 150 и их полной идентичности исходному генотипу.Таким образом, предлагаемый способ регенерации позволяет в процессе генетической трансформации на основе одного и того же генотипа, используя конструкции, несущие различные целевые гены, направленно создавать целый ряд генетических аналогов, полностью сохраняя при этом без изменения все ценные признаки исходного образца клевера лугового; получать и поддерживать in vitro морфогенные культуры, способные к длительной пролиферации на селективных средах и массовой регенерации канами-цинустойчивых растений клевера лугового; контролировать сомаклональную изменчивость и ... 2232490 Машина для обработки почвы ... - силового регулятора-подъемника рабочих органов, на фиг.5в - схема фиксатора защиты лап, на фиг.5г - схема фиксатора защиты плуга, на фиг.5д - схема фиксатора и пружины настройки, на фиг.5е - схема фиксатора секции плуга, на фиг.5ж - схема фиксатора культиватора, плоскореза, на фиг.5з - схема подъема силой тяги, на фиг.5и - схема секции плоскорезов, на фиг.5к - схема дисковой батареи, на фиг.5л - схема секции самоподъема и самозаглубления, на фиг.6а - схема ролика-отвала плуга, вид сбоку, на фиг.6б - схема ролика-отвала плуга, вид сверху, на фиг.6в - трубчатая стойка, на фиг.6г - схема наклона стойки, на фиг.6д - схема самовращающихся роликов за отвалом, вид сбоку, на фиг.6е - ... |
Еще из этого раздела: 2391812 Способ выращивания растений в условиях защищенного грунта, устройство для выращивания растений в условиях защищенного грунта и сборно-разборный многоярусный стеллаж для выращивания растений в условиях защищенного грунта 2056100 Доильный стакан 2075933 Композиция для иммунизации растений от различных фитопатогенов 2473211 Приспособление для автоматической дойки молочного скота 2411718 Устройство для внутрипочвенного импульсного дискретного полива растений 2218756 Способ изготовления антипаразитарного ошейника 2154296 Зерноуборочная машина, преимущественно зерноуборочный комбайн, с мультипроцессорным управляющим устройством 2141756 Способ многоуровневого культивирования растений и устройство для его осуществления 2241322 Навесное устройство трактора 2121263 Способ лесоводственной оценки технологического комплекса машин |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||