Производные n-(пирид-5-ил)циклопропанкарбоксамида и их стереоизомеры и фунгицидная композицияПатент на изобретение №: 2066314 Автор: Дон Роберт Бейкер[US], Карл Джозеф Фишер[US], Пол Энтони Вортингтон[GB], Ян Ричард Мэттьюз[GB], Дэвид Бартоломеу[GB], Патрик Джелф Кроули[GB] Патентообладатель: Империал Кемикал Индастриз ПЛС (GB), Ай-Си-Ай Америказ Инк. (US) Дата публикации: 10 Сентября, 1996 Адрес для переписки: подача заявки04.01.1991 публикация патента10.09.1996 Изображения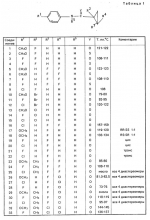 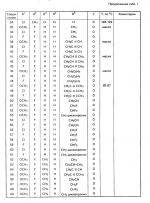   Использование: в сельском хозяйстве. Сущность изобретения: производные N-(пирид-5-ил)циклопропанкарбоксамида общей формулы I и их стереоизомеры, где R1 - галоген, (С1-C4)алкокси, R2 - водород, галоген, метил, R3 и R4 независимо друг от друга водород или галоген при условии, что R2, R3 и R4 не могут одновременно являться водородом и при условии что, когда R2 - метил, то тогда один из R3 или R4 отличен от водорода, Х группа N(R5)-C(=Y)-, где R5 водород, (C1-C4)-алкил, бензил, (С2-С4)алкенил, (С2-С4)алкинил и У-кислород и фунгицидная композиция, содержащая в качестве активного ингредиента 0,0005-95 проц. мас. соединения по п.1 в смеси с фунгицидно приемлемым носителем или разбавителем. 2 c. и 4 з.п.ф-лы, 3 табл. Структура соединений формулы I: 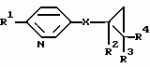 , , , , , ,
, , , , , , ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУНастоящее изобретение относится к производным пиридилциклопропана, которые используются в качестве фунгицидов, к процессам их получения, фунгицидным композициям, содержащим эти соединения и к методам их использования в борьбе против грибков, особенно с грибковыми инфекциями у растений. Согласно настоящему изобретению, обеспечивается получение соединения общей формулы (I)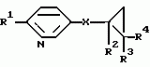 и его стереоизомера, где R1 водород, С1-4 алкокси, С1-4 алкил, С2-4 алкенил, С2-4 алкинил, С1-4 алкилгалоид, С1-4 алкоксигалоид, СОР или циано-; R2, R3 и R4 независимо являются водородом, галогеном или метил-, причем R2, R3 и R4 все одновременно не являются водородом, а если один из них метил, то по крайней мере один из двух оставшихся не является водородом; и его стереоизомера, где R1 водород, С1-4 алкокси, С1-4 алкил, С2-4 алкенил, С2-4 алкинил, С1-4 алкилгалоид, С1-4 алкоксигалоид, СОР или циано-; R2, R3 и R4 независимо являются водородом, галогеном или метил-, причем R2, R3 и R4 все одновременно не являются водородом, а если один из них метил, то по крайней мере один из двух оставшихся не является водородом; 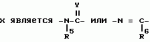 где R5 водород, С1-4 алкил (произвольно замещенный галогеном или циано-группой), произвольно замещенный бензил, С2-4 алкенил, С2-4 алкинил, циано, СОR, C1-4 тиоалкокси, С1-4 тиоалкоксигалоид или SN-R7R8; R7 и R8 независимо являются C1-4 алкил или СO2R: Y кислород или сера; R6 C1-4 алкокси, C1-4 тиоалкокси или -NR9R10; a R9 и R10 независимо являются водородом, С1-4 алкил, арил или аралкил или R9 и R10 объединяются, образуя произвольно замещенное гетероциклическое кольцо (например, пирролидин, пиперидин, морфолин, 1, 2, 4 триазол, имидазол, пиразол), а R C1-4алкил или C1-7циклоалкил. Соединения, заявленные в изобретении, можно получить в виде смесей геометрических изомеров Е и Z по двойной связи, причем эти смеси изомеров можно разделить с помощью известных методов, и такие изомеры составляют часть настоящего изобретения. Алкильные группы, а также алкильные части аралкила, алкокси и тиоалкокси содержат от 1 до 4 атомов углерода и являются либо прямыми, либо разветвленными цепочечными группами, например, втор-бутил или трет-бутил. Алкенильные группы содержат от 2 до 4 атомов углерода и представляют собой алк-1-енил, алк-2-енил или алк-3-енил, например, винил, 2-проп-1-енил, 1-про-1-енил0 аллил, 2-бут-2-енил, 1-(2-метилпроп-1-енил), 1-бут-1-енил, 1-(1метилпроп-2-енил), 1-(2-метил-проп-2-енил), 1-бут-1-енил или 1-бут-3-енил. Алкильные группы содержат от 2 до 4 атомов углерода и представляют собой, например, этинил, проп-1-ил, пропаргил или 2-бут-3-инил. Галогены включают фтор, хлор, бром и иод. Циклоалкильные группы содержат от 3 до 7 атомов углерода и представляют собой, например, циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Алкилгалоидные группы и алкилгалоидные части алкоксигалоидных и тиоалкоксигалоидных групп содержат от 1 до 4 атомов углерода и представляют собой, например, метилгалоид, этилгалоид, пропилгалоид или бутилгалоид, в которых галогеном являются фтор, хлор, бром или иод. Например, алкилгалоидными группами являются фторметил, хлорметил, фторэтил, хлорэтил, трифторметил или трихлорметил. R9 и R10 вместе образуют произвольно замещенное гетероциклическое кольцо, лучше всего 3-х или 7-членные циклы, например, азиридин, азетидин, пирролидин, пиперидин, гексаметиленимин, морфолин, имидазол, пиразол или 1,2,4-триазол, 1,2,3-триазол, пиррол или тетразол. Арилы или арильные части аралкилов это, предпочтительнее всего, фенил, и произвольно замещены галогеном, алкилом, алкилгалоидом, алкокси-, алкоксигалоидом, циано-, нитро-, СОR" или фенилом, а R водород, гидрокси-, С1-4алкил или С1-4алкокси. Произвольные заместители фенильной части бензила те же, что и для арила (см. выше). С одной точки зрения, настоящее изобретение обеспечивает получение соединения, имеющего общую формулу (I): где R5 водород, С1-4 алкил (произвольно замещенный галогеном или циано-группой), произвольно замещенный бензил, С2-4 алкенил, С2-4 алкинил, циано, СОR, C1-4 тиоалкокси, С1-4 тиоалкоксигалоид или SN-R7R8; R7 и R8 независимо являются C1-4 алкил или СO2R: Y кислород или сера; R6 C1-4 алкокси, C1-4 тиоалкокси или -NR9R10; a R9 и R10 независимо являются водородом, С1-4 алкил, арил или аралкил или R9 и R10 объединяются, образуя произвольно замещенное гетероциклическое кольцо (например, пирролидин, пиперидин, морфолин, 1, 2, 4 триазол, имидазол, пиразол), а R C1-4алкил или C1-7циклоалкил. Соединения, заявленные в изобретении, можно получить в виде смесей геометрических изомеров Е и Z по двойной связи, причем эти смеси изомеров можно разделить с помощью известных методов, и такие изомеры составляют часть настоящего изобретения. Алкильные группы, а также алкильные части аралкила, алкокси и тиоалкокси содержат от 1 до 4 атомов углерода и являются либо прямыми, либо разветвленными цепочечными группами, например, втор-бутил или трет-бутил. Алкенильные группы содержат от 2 до 4 атомов углерода и представляют собой алк-1-енил, алк-2-енил или алк-3-енил, например, винил, 2-проп-1-енил, 1-про-1-енил0 аллил, 2-бут-2-енил, 1-(2-метилпроп-1-енил), 1-бут-1-енил, 1-(1метилпроп-2-енил), 1-(2-метил-проп-2-енил), 1-бут-1-енил или 1-бут-3-енил. Алкильные группы содержат от 2 до 4 атомов углерода и представляют собой, например, этинил, проп-1-ил, пропаргил или 2-бут-3-инил. Галогены включают фтор, хлор, бром и иод. Циклоалкильные группы содержат от 3 до 7 атомов углерода и представляют собой, например, циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Алкилгалоидные группы и алкилгалоидные части алкоксигалоидных и тиоалкоксигалоидных групп содержат от 1 до 4 атомов углерода и представляют собой, например, метилгалоид, этилгалоид, пропилгалоид или бутилгалоид, в которых галогеном являются фтор, хлор, бром или иод. Например, алкилгалоидными группами являются фторметил, хлорметил, фторэтил, хлорэтил, трифторметил или трихлорметил. R9 и R10 вместе образуют произвольно замещенное гетероциклическое кольцо, лучше всего 3-х или 7-членные циклы, например, азиридин, азетидин, пирролидин, пиперидин, гексаметиленимин, морфолин, имидазол, пиразол или 1,2,4-триазол, 1,2,3-триазол, пиррол или тетразол. Арилы или арильные части аралкилов это, предпочтительнее всего, фенил, и произвольно замещены галогеном, алкилом, алкилгалоидом, алкокси-, алкоксигалоидом, циано-, нитро-, СОR" или фенилом, а R водород, гидрокси-, С1-4алкил или С1-4алкокси. Произвольные заместители фенильной части бензила те же, что и для арила (см. выше). С одной точки зрения, настоящее изобретение обеспечивает получение соединения, имеющего общую формулу (I): 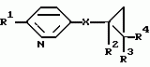 (I) и его стереоизомеры, где R1 водород, галоген, С1-4алкокси, С1-4алкил, С2-4алкенил, С2-4алкинил, С1-4алкилгалоид, С1-4алкоксигалоид, СОR или циано-; R2, R3 и R4 независимо являются водородом, галогеном или метил-, причем R2, R3 и R4 все одновременно не являются водородом, а если один из них метил, то по крайней мере один из двух оставшихся не является водородом; (I) и его стереоизомеры, где R1 водород, галоген, С1-4алкокси, С1-4алкил, С2-4алкенил, С2-4алкинил, С1-4алкилгалоид, С1-4алкоксигалоид, СОR или циано-; R2, R3 и R4 независимо являются водородом, галогеном или метил-, причем R2, R3 и R4 все одновременно не являются водородом, а если один из них метил, то по крайней мере один из двух оставшихся не является водородом; 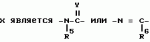 где R5 водород, С1-4алкил (произвольно замещенный галогеном или циано-группой), произвольно замещенный бензил, С2-4алкенил, С2-4алкинил, циано, СОR, C1-4тиоалкокси, С1-4тиоалкоксигалоид или R7R8; R7 и R8 независимо являются С1-4алкил или СO2R; Y кислород или сера; R6алкокси, С1-4тиоалкокси или R9R10; a R9 и R10 независимо являются водородом, С1-4алкил, арил или аралкил или R9 и R10 объединяются, образуя произвольно замещенное гетероциклическое кольцо (например, пирролидин, пиперидин, морфолин, 1,2,4-триазол, имидазол, пиразол), а R C1-4алкил или C3-7циклоалкил. С другой стороны настоящее изобретение обеспечивает получение соединения, имеющего общую формулу (I): где R5 водород, С1-4алкил (произвольно замещенный галогеном или циано-группой), произвольно замещенный бензил, С2-4алкенил, С2-4алкинил, циано, СОR, C1-4тиоалкокси, С1-4тиоалкоксигалоид или R7R8; R7 и R8 независимо являются С1-4алкил или СO2R; Y кислород или сера; R6алкокси, С1-4тиоалкокси или R9R10; a R9 и R10 независимо являются водородом, С1-4алкил, арил или аралкил или R9 и R10 объединяются, образуя произвольно замещенное гетероциклическое кольцо (например, пирролидин, пиперидин, морфолин, 1,2,4-триазол, имидазол, пиразол), а R C1-4алкил или C3-7циклоалкил. С другой стороны настоящее изобретение обеспечивает получение соединения, имеющего общую формулу (I): 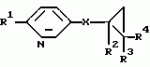 (I) и его стереоизомеры, где R1 -водород, фтор, хлор или С1-4алкокси; R3 и R4 независимо представляют собой водород, метил, хлор, фтор или бром; R2 водород или метил, или фтор, когда R3 водород или метил, а R4 водород, или хлор, когда и R3, и R4 являются водородом; причем R2, R3 и R4 все одновременно не являются водородом, а если один из них метил, по крайней мере один из двух оставшихся не является водородом; (I) и его стереоизомеры, где R1 -водород, фтор, хлор или С1-4алкокси; R3 и R4 независимо представляют собой водород, метил, хлор, фтор или бром; R2 водород или метил, или фтор, когда R3 водород или метил, а R4 водород, или хлор, когда и R3, и R4 являются водородом; причем R2, R3 и R4 все одновременно не являются водородом, а если один из них метил, по крайней мере один из двух оставшихся не является водородом; 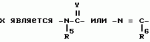 где R5 водород, С1-4алкил (произвольно замещенный галогеном или циано-группой), произвольно замещенный бензил, C2-4алкинил, или С2-4алкенил; Y кислород или сера; R6-C1-4алкокси или -NR9R10; R9 и R10 независимо являются водородом, С1-4алкил, арил или аралкил или R9 и R10 объединяются, образуя произвольно замещенное гетероциклическое кольцо. Со следующей точки зрения настоящее изобретение обеспечивает получение соединения общей формулы (I): где R5 водород, С1-4алкил (произвольно замещенный галогеном или циано-группой), произвольно замещенный бензил, C2-4алкинил, или С2-4алкенил; Y кислород или сера; R6-C1-4алкокси или -NR9R10; R9 и R10 независимо являются водородом, С1-4алкил, арил или аралкил или R9 и R10 объединяются, образуя произвольно замещенное гетероциклическое кольцо. Со следующей точки зрения настоящее изобретение обеспечивает получение соединения общей формулы (I): 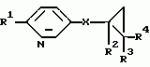 (I) и его стереоизомеров, где R1 фтор, хлор или С1-4алкокси (в особенности метокси); R3 и R4 независимо представляют собой водород, хлор, фтор или бром; R2 водород, или фтор, хлор или бром, когда R3 и R4 оба представляют собой водород, или, R2, R3 и R4 все являются хлором; причем R2, R3 и R4 все одновременно не являются водородом; (I) и его стереоизомеров, где R1 фтор, хлор или С1-4алкокси (в особенности метокси); R3 и R4 независимо представляют собой водород, хлор, фтор или бром; R2 водород, или фтор, хлор или бром, когда R3 и R4 оба представляют собой водород, или, R2, R3 и R4 все являются хлором; причем R2, R3 и R4 все одновременно не являются водородом; 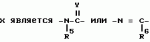 где R5 водород, С1-4алкил (произвольно замещенный галогеном или циано-группой), произвольно замещенный бензил, С2-4алкинил (особенно пропаргил и бут-2-инил) или С2-4алкенил (особенно алил); Y кислород или сера; R6 C1-4алкокси или -NR9R10; R9 и R10 независимо представляют собой водород, С1-4алкил, арил или аралкил или R9 и R10 объединяются, образуя произвольно замещенное гетероциклическое кольцо. C еще одной точки зрения настоящее изобретение обеспечивает получение соединения, имеющего общую формулу (IX): где R5 водород, С1-4алкил (произвольно замещенный галогеном или циано-группой), произвольно замещенный бензил, С2-4алкинил (особенно пропаргил и бут-2-инил) или С2-4алкенил (особенно алил); Y кислород или сера; R6 C1-4алкокси или -NR9R10; R9 и R10 независимо представляют собой водород, С1-4алкил, арил или аралкил или R9 и R10 объединяются, образуя произвольно замещенное гетероциклическое кольцо. C еще одной точки зрения настоящее изобретение обеспечивает получение соединения, имеющего общую формулу (IX): 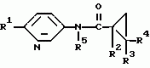 (IX) и его стереоизомеров, где R1 фтор, хлор или метокси; R2 и R4 оба являются водородом, а R3 фтор, либо R2 водород, а R3 и R4 оба являются фтором, либо R2 фтор, а R3 и R4 оба являются водородом; R5 водород, С1-4алкил (произвольно замещенный фтором или циано-группой), бензил (в котором фенильная часть произвольно замещена галогеном, алкилом, алкилгалоидом, алкокси, алкоксигалидом, циано- или нитро-группами), С2-4алкинил (особенно пропаргил и бут-2-инил) или С2-4алкенил (особенно аллил). С другой точки зрения настоящее изобретение обеспечивает получение соединения, имеющего общую формулу (IX): (IX) и его стереоизомеров, где R1 фтор, хлор или метокси; R2 и R4 оба являются водородом, а R3 фтор, либо R2 водород, а R3 и R4 оба являются фтором, либо R2 фтор, а R3 и R4 оба являются водородом; R5 водород, С1-4алкил (произвольно замещенный фтором или циано-группой), бензил (в котором фенильная часть произвольно замещена галогеном, алкилом, алкилгалоидом, алкокси, алкоксигалидом, циано- или нитро-группами), С2-4алкинил (особенно пропаргил и бут-2-инил) или С2-4алкенил (особенно аллил). С другой точки зрения настоящее изобретение обеспечивает получение соединения, имеющего общую формулу (IX): 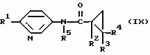 (IX) и его стереизомеров, где R1 метокси; R2 и R4 оба являются водородом, а R3 фтор, или R2 водород, а R3 и R4 оба являются фтором, либо R2 фтор, а R3 и R4 оба являются водородом; R5 водород, С1-2алкил (произвольно замещенный фтором или циано-группой), бензил (в котором фенильная часть произвольно замещена галогеном, алкилом, алкилгалоидом, алкокси, алкоксигалидом, циано- или нитро-группами), пропаргил аллил или бут-2-инил. Со следующей точки зрения изобретение обеспечивает получение соединения, имеющего формулу (XV): (IX) и его стереизомеров, где R1 метокси; R2 и R4 оба являются водородом, а R3 фтор, или R2 водород, а R3 и R4 оба являются фтором, либо R2 фтор, а R3 и R4 оба являются водородом; R5 водород, С1-2алкил (произвольно замещенный фтором или циано-группой), бензил (в котором фенильная часть произвольно замещена галогеном, алкилом, алкилгалоидом, алкокси, алкоксигалидом, циано- или нитро-группами), пропаргил аллил или бут-2-инил. Со следующей точки зрения изобретение обеспечивает получение соединения, имеющего формулу (XV): 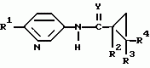 (XV) и его стереоизомеров; где R1 C1-4алкокси (особенно метокси) или галоген (особенно фтор), Y кислород или сера, а R2, R3 и R4 представляют собой водород или фтор, причем они все одновременно не являются водородом. Примеры соединений настоящего изобретения, имеющих формулу (I), приведены в таблице 1, где Х является (XV) и его стереоизомеров; где R1 C1-4алкокси (особенно метокси) или галоген (особенно фтор), Y кислород или сера, а R2, R3 и R4 представляют собой водород или фтор, причем они все одновременно не являются водородом. Примеры соединений настоящего изобретения, имеющих формулу (I), приведены в таблице 1, где Х является 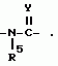 В таблице 2 приведены данные протонного ЯМР выборочно для некоторых соединений, приведенных в таблице 1. Химические сдвиги измерены в м.д. по отношению к тетраметилсилану, в качестве растворителя везде был использован дейтерохлороформ. Использованы следующие сокращения: S синглет dc дублет сложных сигналов d дублет br.s широкий синглет c комплекс m4 квартет. Соединения общей формулы (I), где х-группа В таблице 2 приведены данные протонного ЯМР выборочно для некоторых соединений, приведенных в таблице 1. Химические сдвиги измерены в м.д. по отношению к тетраметилсилану, в качестве растворителя везде был использован дейтерохлороформ. Использованы следующие сокращения: S синглет dc дублет сложных сигналов d дублет br.s широкий синглет c комплекс m4 квартет. Соединения общей формулы (I), где х-группа 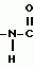 и соединения общей формулы (II): и соединения общей формулы (II): 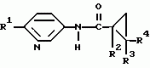 (II) где R1, R2, R3 и R4 определены выше, могут быть получены сочетанием амина общей формулы (III): (II) где R1, R2, R3 и R4 определены выше, могут быть получены сочетанием амина общей формулы (III): 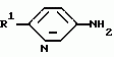 где R1 определен выше, к карбоновой кислоте общей формулы (IV): где R1 определен выше, к карбоновой кислоте общей формулы (IV): 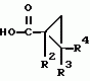 (IV) где R2, R3 и R4 определены выше, с помощью методов, описанных в литературе. Присоединение обычно достигается с использованием 1,3-дициклогексилкарбодиимида (DCC) или 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорида. Альтернативный процесс включает в себя преобразование кислоты (IV) в хлор-производное кислоты формулы (V) или в ее имидазольное производное формулы (VI): (IV) где R2, R3 и R4 определены выше, с помощью методов, описанных в литературе. Присоединение обычно достигается с использованием 1,3-дициклогексилкарбодиимида (DCC) или 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорида. Альтернативный процесс включает в себя преобразование кислоты (IV) в хлор-производное кислоты формулы (V) или в ее имидазольное производное формулы (VI): 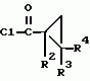 (V) (V) 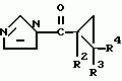 (VI) за которым следует реакция этих промежуточных продуктов с амином (III). Хлорпроизводные кислоты (V) получают реакцией карбоновой кислоты (IV) с тионилхлоридом или оксалилхлоридом в инертном растворителе типа метиленхлорида. Имидазольные производные кислоты (VI) можно получить, обрабатывая карбоновую кислоту (IV) карбонил ди-имидазолом в таком инертном растворителе, как, например, метиленхлорид. Амины общей формулы (III) можно получить с помощью методов, описанных в литературе. Карбоновые кислоты общей формулы (IV) можно получить реакцией метилкетона общей формулы (VII): (VI) за которым следует реакция этих промежуточных продуктов с амином (III). Хлорпроизводные кислоты (V) получают реакцией карбоновой кислоты (IV) с тионилхлоридом или оксалилхлоридом в инертном растворителе типа метиленхлорида. Имидазольные производные кислоты (VI) можно получить, обрабатывая карбоновую кислоту (IV) карбонил ди-имидазолом в таком инертном растворителе, как, например, метиленхлорид. Амины общей формулы (III) можно получить с помощью методов, описанных в литературе. Карбоновые кислоты общей формулы (IV) можно получить реакцией метилкетона общей формулы (VII): 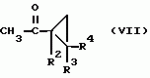 (VII) R2, R3 и R4 определены выше, с подходящим окислителем, например, гипобромитом натрия. Метилкетоны (VII) получают описанным в литературе методами (См. например, Lutz Fitijer. Syntesis, 1977, р. 189). Тиоамидные соединения общей формулы (VIII), где группа Х соединения общей формулы (I) является: (VII) R2, R3 и R4 определены выше, с подходящим окислителем, например, гипобромитом натрия. Метилкетоны (VII) получают описанным в литературе методами (См. например, Lutz Fitijer. Syntesis, 1977, р. 189). Тиоамидные соединения общей формулы (VIII), где группа Х соединения общей формулы (I) является: 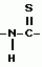 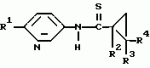 (VIII) могут быть получены обработкой амидов общей формулы (II) подходящими сульфурирующими реагентами, такими как пентасульфид фосфора, реагент Лоуессона или реагент Беллоу, в подходящем растворителе (например, в толуоле или в дихлорметане). Соединения общей формулы (IX), где Х-группой соединения общей формулы (I) является (VIII) могут быть получены обработкой амидов общей формулы (II) подходящими сульфурирующими реагентами, такими как пентасульфид фосфора, реагент Лоуессона или реагент Беллоу, в подходящем растворителе (например, в толуоле или в дихлорметане). Соединения общей формулы (IX), где Х-группой соединения общей формулы (I) является 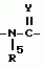 (R5 может быть не обязательно водородом), а Y кислород, может быть получено (как показано на приведенной ниже схеме 1) обработкой амида общей формулы (II) алкилирующим агентом общей формулы (ХI), где L атом галогена или любая другая легко уходящая группа и основанием (например, гидроксидом калия или гидроксидом натрия) в подходящем растворителе (например, в диметилсульфоксиде или в диметилформамиде). Схема 1 (R5 может быть не обязательно водородом), а Y кислород, может быть получено (как показано на приведенной ниже схеме 1) обработкой амида общей формулы (II) алкилирующим агентом общей формулы (ХI), где L атом галогена или любая другая легко уходящая группа и основанием (например, гидроксидом калия или гидроксидом натрия) в подходящем растворителе (например, в диметилсульфоксиде или в диметилформамиде). Схема 1 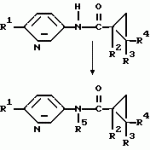 Соединения общей формулы (XV), где Х-группа соединения общей формулы (I) является Соединения общей формулы (XV), где Х-группа соединения общей формулы (I) является 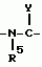 где группа R5 не водород, а Y сера, могут быть получены (как показано на приведенной ниже Схеме 2) обработкой амидов общей формулы (IX) подходящими сульфурирующими реагентами, например, пентасульфидом фосфора реагентом Лоуессона или реагентом Беллоу, в подходящем растворителе (например, в толуоле или в дихлорметане). Схема 2 где группа R5 не водород, а Y сера, могут быть получены (как показано на приведенной ниже Схеме 2) обработкой амидов общей формулы (IX) подходящими сульфурирующими реагентами, например, пентасульфидом фосфора реагентом Лоуессона или реагентом Беллоу, в подходящем растворителе (например, в толуоле или в дихлорметане). Схема 2 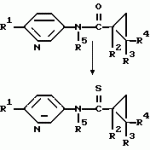 Соединения общей формулы (XII), где Х-группой соединения общей формулы (I) является -N= C(R6)-, а группа R6 определена выше, могут быть получены (как показано на приведенной ниже схеме 3) обработкой амида общей формулы (II) имидоилирующими реагентами, например, пентахлоридом фосфора, пентабромидом фосфора или тетрахлоридом углерода, и трифенилфосфином с образованием галоида имидоила (ХIII) в качестве промежуточного продукта, где М галоген. После этого галоид имидола (XIII) реагирует с соединением R6H, (XIV) в присутствии подходящего основания (например, триэтиламина или гидрида натрия) в подходящем растворителе (например, в тетрагидрофуране или в дихлорметане). Схема 3 Соединения общей формулы (XII), где Х-группой соединения общей формулы (I) является -N= C(R6)-, а группа R6 определена выше, могут быть получены (как показано на приведенной ниже схеме 3) обработкой амида общей формулы (II) имидоилирующими реагентами, например, пентахлоридом фосфора, пентабромидом фосфора или тетрахлоридом углерода, и трифенилфосфином с образованием галоида имидоила (ХIII) в качестве промежуточного продукта, где М галоген. После этого галоид имидола (XIII) реагирует с соединением R6H, (XIV) в присутствии подходящего основания (например, триэтиламина или гидрида натрия) в подходящем растворителе (например, в тетрагидрофуране или в дихлорметане). Схема 3 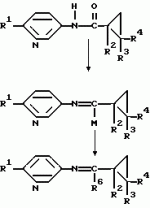 Карбоновые кислоты общей формулы (IV) описаны в литературе, либо их можно получить гидролизом их эфиров, описанных в литературе, используя также известные и описанные методы. Карбоновые кислоты общей формулы (XVI): Карбоновые кислоты общей формулы (IV) описаны в литературе, либо их можно получить гидролизом их эфиров, описанных в литературе, используя также известные и описанные методы. Карбоновые кислоты общей формулы (XVI): 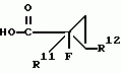 (XVI) где R11 водород или метил, а R12 фтор или хлор, могут быть получены либо так, как показано ниже на схеме 4, либо подходящим образом применяя методы, описанные в ЕР-А2-0351647 и ЕР-А2-0351650. Схема 4 (XVI) где R11 водород или метил, а R12 фтор или хлор, могут быть получены либо так, как показано ниже на схеме 4, либо подходящим образом применяя методы, описанные в ЕР-А2-0351647 и ЕР-А2-0351650. Схема 4 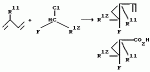 Таким образом, реакция бутадиена общей формулы (XVII) с соединением общей формулы (XVIII) в присутствии 1-хлор-2,3-эпоксипропана (эпихлоргидрина) при подходящей температуре дает соединение общей формулы (XIX). Окисление соединения общей формулы (XIX) при подходящих условиях (например, используя перманганат калия) дает карбоновую кислоту общей формулы (XVI). С других точек зрения настоящее изобретение обеспечивает процессы, как было описано выше, получения соединений, заявленных в изобретении, а также заявленных промежуточных продуктов, 1-фтор-циклопропан карбоновой кислоты и ее хлор-производного, имидазольного производного этой кислоты, солей и эфиров этой кислоты. Соединения, заявленные в изобретении, являются активными фунгицидами и могут быть использованы для контроля за одним или более болезнетворных организмов, описанных ниже: Pyricularia oryzal риса. Puccinia recondita, Puccinia striiformis и другие ржавчинные грибы пшеницы, Puccinia hordei Puccinia striiformis и другие ржавчинные грибы на ячмене, ржавчинные грибы на других хозяевах паразитов, например, кофе, груше, яблонях, земляном орехе, овощах и декоративных растениях. Erysiphe graminis (ложная мучистая роса) на ячмене и пшенице и другие виды ложной мучнистой росы на различных хозяевах, например, Sphaertheca macularis на хмеле, Sphaerotheca fuliginea на тыквенных (например, на огурцах), Podosphaera leucotricha на яблоках и Uncinula necator на виноградных лозах. Виды Helminthosporium, Rhynehosporium, Septoria, Pyrenoрhora, Pseudocercosporella herpotrichoides и Gaeumannomyces graminis на хлебных злаках. Cercospora personata на земляном орехе и другие специфические виды Cercospora на других хозяевах, например, на сахарной свекле, бананах, соевых бобах и рисе. Botrytis cinerea (серая плесень) на томатах, землянике, овощах, винограде и других хозяевах, Alternaria на овощах (например, на огурцах), на масличном семени редьки, яблоках, томатах и на других хозяевах. Venturia inaequalis (парша) на яблоках. Plasmopara viticola на винограде. Другие пушистые виды ложной мучнистой росы, например, Bremia lactucae на латуке, Peronospora на соевых бобах, табаке, луке и на других хозяевах, Pseudoperonospora humuli на хмеле и Pseudoperonospora cubensis на тыквенных. Phytopthora infestans на картофеле и томатах, и другие виды Phytophtora на овощах, землянике, авокадо, перце, декоративных растениях, табаке, какао и на других хозяевах. Thanatephorus cucumeris на рисе и другие виды на различных хозяевах, таких как пшеница и ячмень, овощи, хлопок и торф. Некоторые из соединений показывают широкий спектр активности против ржавчинных грибов in vitro. Они могут также обладать активностью против различных болезней, возникающих на фруктах после сбора урожая (например, Penicilliun digitatum и italicum и Trichoderma viride на апельсинах, Gloeosporium musarum на бананах и Botrytis cinerea на винограде). Далее некоторые из соединений могут быть активными в виде покрытий семян против таких болезней, как Fusarium, Septoria, Tilletia (твердая головня семян пшеницы), Ustilago и Helminthosporium на хлебных злаках, Rhizoctonia solani на хлопке и Pyricuiaria на рисе. Соединения могут продвигаться по ткани растения акропетально (от основания к верхушке)/локально. Кроме того, соединения могут быть активными в газовой фазе против болезненных ржавчинных грибов растений. Изобретение, таким образом, обеспечивает метод борьбы с грибковыми заболеваниями растений, включающий обработку самого растения, его семян, непосредственно очага поражения болезнью растения или семян эффективным против заболевания количеством соединения, как описано выше, а также создание композиций, содержащих это соединение. Соединения могут быть использованы непосредственно для агротехнических целей, однако обычно их вводят в композиции, используя носители или разбавители. Изобретение, таким образом, обеспечивает получение фунгицидных композиций, состоящих из описанного выше соединения и подходящего носителя или дилюэнта. Соединения могут быть использованы целым рядом способов. Например, они могут быть применены непосредственно или введенными в композиции, непосредственно к листьям растений, к семенам или к среде, в которой выращивают растения или в которую их должны сажать, их можно распрыскивать, распылять или применять в виде пены или пласты, а также в виде паров или в виде медленного выделяющих вещество гранул. Воздействовать можно на любую часть растения, как то: на листву, ветви или корни, на почву, окружающую корни, либо на семена до их проpащивания, на почву в целом, на воду, в которой растет рис или на системы выращивания гидропонным способом. Соединения, заявленные в изобретении, можно также вводить внутрь растений, либо опрыскивать растения, используя электродинамические опрыскиватели или другие методы, использующие малые объемы. Термин "растение", используемый здесь, включает в себя рассаду, кусты и деревья. Кроме того, фунгицидные методы, описанные в изобретении, включают предупреждающую, защитную, профилактическую и уничтожающую болезни обработку. Соединения желательно использовать для агротехнических и садоводческих целей в виде композиций. Тип композиции, используемой в данный момент, зависит от конкретных целей. Композиции могут быть в виде распыляемых порошков или гранул, включающих активный ингредиент (соединение, заявленное в изобретении) и твердый носитель или дилюэнт, например, такие наполнители как каолин, бентонит, кизельгур, доломит, карбонат кальция, тальк, порошковую магнезию, наполнительную землю, гипс, диатомовую землю и фарфоровую глину. Такие гранулы могут быть преобразованы в гранулы, подходящие для введения в почву без дальнейшей обработки. Эти гранулы могут быть получены путем пропитывания наполнителя активным ингредиентом или путем гранулирования смеси активного ингредиента и порошкообразного наполнителя. Композиции для покрытия семян могут включать агент (например, минеральное масло), способствующий адгезии композиции на семенах; в других случаях активный ингредиент для обработки семян может быть приготовлен с использованием органического растворителя (например, метилпирролидона, пропиленгликоля или диметилформамида). Композиции могут быть также в виде увлажненных порошков или диспергированных в воде гранул, содержащих увлажняющие или диспергирующие агенты, чтобы облегчить диспергию в жидкостях. Порошки и гранулы также могут содержать наполнители и взвешенные агенты. Эмульгирующиеся концентраты или эмульсии можно приготовить растворением активного ингредиента в органическом растворителе, произвольно содержащем увлажняющий или эмульгирующий агент с последующими добавлением этой смеси в воду, которая также может содержать увлажняющий или эмульгирующий агент. Подходящими для этой цели органическими растворителями являются ароматические растворители, например алкилбензолы и алкилнафталины, кетоны, такие как циклогексанон и метилциклогексанон, хлорированные углеводороды, такие как хлорбензол и трихлорэтан, спирты, такие как бензиловый, фурфуриловый, бутанол и гликолевые эфиры. Суспензии концентратов крупных частиц нерастворимых веществ можно приготовить путем дробления на капли или шарики с диспергирующим агентом и со взвешенным агентом, чтобы предотвратить осаждение твердого вещества. Композиции, которые должны быть в виде аэрозолей, где вещество находится в контейнере при давлении топлива, например, фтортрихлорметана или дихлордифторметана. Соединения, заявленные в изобретении, можно смешивать в сухом виде с пиротехнической смесью, чтобы получить композиции, подходящую для получения в окружающем пространстве дыма, содержащего соединение. Кроме того, соединение может быть использовано в микрокапсульном виде. Оно также может быть изготовлено в виде биоразлагающихся полимерных композиций, чтобы получить медленное, контролируемое высвобождение активной субстанции. Путем введения походящих добавок, например, добавок для улучшения распределения, адгезивной способности и сопротивляемости дождю обрабатываемых поверхностей можно получить различные композиции, лучше приспособленные для всевозможных целей. Заявленные в изобретении соединения могут быть использованы в виде смесей с удобрениями (например, азотными, калиевыми или фосфорными). Желательно изготавливать композиции, содержащие гранулы удобрения, покрытые соединением. Такие гранулы содержат до 25% (по весу) соединения. Таким образом, изобретение обеспечивает также получение композиций, содержащих удобрение и соединение общей формулы (I), а также соль или комплекс этого соединения с металлом. Увлажненные порошки, эмульгированные концентраты и суспензии обычно содержат поверхностно-активные вещества, например увлажняющие агенты, диспергирующие агенты, эмульгирующие агенты или взвешенные агенты. Эти агенты могут быть катионными, анионными или неионными. Подходящими катионными агентами являются четвертичные соединения аммиака, например, цетилтриметиламмонийбромид. Подходящими анионными агентами являются мыла, соли алифатических моноэфиров серной кислоты (например, лаурилсульфат натрия), и соли сульфированных ароматических соединений (например, додецилбензолсульфонат натрия, лигосульфонат натрия, кальция или аммония, бутилнафталенсульфонат, также смесь натрий диизопропил и триизопропил-нафталинсульфонаты). Подходящими неионными агентами являются продукты конденсации оксида этилена с жирными спиртами, такими как олеиловый или цетиловый спирт, или с алкил-фенолами, такими как октил- или ионилфенол и октилкрезол. Другими неионными агентами являются неполные эфиры, полученные из жирных кислот с длинной цепочкой, и гекситангидриды, продукты конденсации упомянутых неполных эфиров с оксидом этилена, а также лецитины. Подходящими взвешенными агентами являются гидрофильные коллоиды (например, поливинилпирролидон и натрий-карбоксиметилцеллюлоза), и набухающие глины, такие как бентонит или аттапульгит. Композиции для использования в виде водных дисперсий или эмульсий обычно изготавливают в форме концентрата, содержащего большую часть активного ингредиента, причем перед использованием концентрат необходимо разбавлять водой. Желательно, чтобы концентраты сохранялись в течение длительного периода времени, сохраняя способность растворяться в воде, образуя водные препараты, остающиеся гомогенными в течение достаточного периода времени, чтобы их можно было использовать с помощью подходящего оборудования для распыления. Концентраты могут содержать до 95% лучше всего 10-85% например, 25-60% (по весу) активного ингредиента. После разбавления для приготовления водных проб такие пробы могут содержать варьируемые количества активного ингредиента, в зависимости от желаемых целей, но могут быть использованы водные препараты, содержащие от 0,0005% или 0,01% до 10% (по весу) активного ингредиента. Композиции, заявленные в настоящем изобретении, могут содержать и другие соединения, обладающие биологической активностью, например, соединения, имеющие сходную или добавочную фунгицидную активность, или те, которые могут регулировать рост растений или обладают гербицидными или инсектицидными свойствами. Фунгицидное соединение, которое может быть тем соединением, которое способно препятствовать болезням колосьев хлебных злаков (например, пшеницы), таким как Septoria Gibberella и Helminthosporium, болезням почвы и семян, а также пушистой и порошкообразной мучнистой росе винограда, порошкообразной мучнистой росе и парша яблок, и т.д. При включении других фунгицидов композиция может обладать более широким спектром активности, чем соединение общей формулы (I), будучи примененным без добавок. Следующие из других фунгицидных соединений могут приводить к совместному эффекту в отношении фунгицидной активности вместе с соединением общей формулы (I). Ниже приведены примеры фунгицидных соединений, которые могут быть включены в композиции, заявленные в настоящем изобретении. (PS)-1-аминопропилфосфоновая кислоты, (RS)-4-(4-хлорфенил)- 2-фенил-2-(1Н-1,2,4-триазол-1-ил-метил)бутиронитрил, (Z)-N-бут-2-анилоксиметил-2-хлор-2", 6"-диэтилацетанилид, 1-(2-циано 2-метоксииминоацетил)-3-этил мочевина, 1-[(2RS, 4RS; 2RS, 4RS)-4-бром-2-(2,4-дихлорфенил)тетрагидрофурфурил] -1Н-1,2,4-триазол-3 -(2,4-дихлорфенил)-2-(1Н-1,2,4-триазол-1-ил)-хиназолин-4(3Н)-он, 3-хлор-4-4-метил-2-(1Н-1,2,4-триазол-1-метил)-1,3-диоксолан-2-ил фенил-4-хлорфениловый эфир, 4-бром-2-циано-N, N-диметил-6-трифторметилбензимидазол-1-сульфонамид, 5-этил-5,8-дигидро-8-оксо(1,3)-диоксоло(4,5-g)хинолин-7-карбоновая кислота, L-[N-(3-хлор-2,6-ксилил)-2-метоксиацетамидо] Таким образом, реакция бутадиена общей формулы (XVII) с соединением общей формулы (XVIII) в присутствии 1-хлор-2,3-эпоксипропана (эпихлоргидрина) при подходящей температуре дает соединение общей формулы (XIX). Окисление соединения общей формулы (XIX) при подходящих условиях (например, используя перманганат калия) дает карбоновую кислоту общей формулы (XVI). С других точек зрения настоящее изобретение обеспечивает процессы, как было описано выше, получения соединений, заявленных в изобретении, а также заявленных промежуточных продуктов, 1-фтор-циклопропан карбоновой кислоты и ее хлор-производного, имидазольного производного этой кислоты, солей и эфиров этой кислоты. Соединения, заявленные в изобретении, являются активными фунгицидами и могут быть использованы для контроля за одним или более болезнетворных организмов, описанных ниже: Pyricularia oryzal риса. Puccinia recondita, Puccinia striiformis и другие ржавчинные грибы пшеницы, Puccinia hordei Puccinia striiformis и другие ржавчинные грибы на ячмене, ржавчинные грибы на других хозяевах паразитов, например, кофе, груше, яблонях, земляном орехе, овощах и декоративных растениях. Erysiphe graminis (ложная мучистая роса) на ячмене и пшенице и другие виды ложной мучнистой росы на различных хозяевах, например, Sphaertheca macularis на хмеле, Sphaerotheca fuliginea на тыквенных (например, на огурцах), Podosphaera leucotricha на яблоках и Uncinula necator на виноградных лозах. Виды Helminthosporium, Rhynehosporium, Septoria, Pyrenoрhora, Pseudocercosporella herpotrichoides и Gaeumannomyces graminis на хлебных злаках. Cercospora personata на земляном орехе и другие специфические виды Cercospora на других хозяевах, например, на сахарной свекле, бананах, соевых бобах и рисе. Botrytis cinerea (серая плесень) на томатах, землянике, овощах, винограде и других хозяевах, Alternaria на овощах (например, на огурцах), на масличном семени редьки, яблоках, томатах и на других хозяевах. Venturia inaequalis (парша) на яблоках. Plasmopara viticola на винограде. Другие пушистые виды ложной мучнистой росы, например, Bremia lactucae на латуке, Peronospora на соевых бобах, табаке, луке и на других хозяевах, Pseudoperonospora humuli на хмеле и Pseudoperonospora cubensis на тыквенных. Phytopthora infestans на картофеле и томатах, и другие виды Phytophtora на овощах, землянике, авокадо, перце, декоративных растениях, табаке, какао и на других хозяевах. Thanatephorus cucumeris на рисе и другие виды на различных хозяевах, таких как пшеница и ячмень, овощи, хлопок и торф. Некоторые из соединений показывают широкий спектр активности против ржавчинных грибов in vitro. Они могут также обладать активностью против различных болезней, возникающих на фруктах после сбора урожая (например, Penicilliun digitatum и italicum и Trichoderma viride на апельсинах, Gloeosporium musarum на бананах и Botrytis cinerea на винограде). Далее некоторые из соединений могут быть активными в виде покрытий семян против таких болезней, как Fusarium, Septoria, Tilletia (твердая головня семян пшеницы), Ustilago и Helminthosporium на хлебных злаках, Rhizoctonia solani на хлопке и Pyricuiaria на рисе. Соединения могут продвигаться по ткани растения акропетально (от основания к верхушке)/локально. Кроме того, соединения могут быть активными в газовой фазе против болезненных ржавчинных грибов растений. Изобретение, таким образом, обеспечивает метод борьбы с грибковыми заболеваниями растений, включающий обработку самого растения, его семян, непосредственно очага поражения болезнью растения или семян эффективным против заболевания количеством соединения, как описано выше, а также создание композиций, содержащих это соединение. Соединения могут быть использованы непосредственно для агротехнических целей, однако обычно их вводят в композиции, используя носители или разбавители. Изобретение, таким образом, обеспечивает получение фунгицидных композиций, состоящих из описанного выше соединения и подходящего носителя или дилюэнта. Соединения могут быть использованы целым рядом способов. Например, они могут быть применены непосредственно или введенными в композиции, непосредственно к листьям растений, к семенам или к среде, в которой выращивают растения или в которую их должны сажать, их можно распрыскивать, распылять или применять в виде пены или пласты, а также в виде паров или в виде медленного выделяющих вещество гранул. Воздействовать можно на любую часть растения, как то: на листву, ветви или корни, на почву, окружающую корни, либо на семена до их проpащивания, на почву в целом, на воду, в которой растет рис или на системы выращивания гидропонным способом. Соединения, заявленные в изобретении, можно также вводить внутрь растений, либо опрыскивать растения, используя электродинамические опрыскиватели или другие методы, использующие малые объемы. Термин "растение", используемый здесь, включает в себя рассаду, кусты и деревья. Кроме того, фунгицидные методы, описанные в изобретении, включают предупреждающую, защитную, профилактическую и уничтожающую болезни обработку. Соединения желательно использовать для агротехнических и садоводческих целей в виде композиций. Тип композиции, используемой в данный момент, зависит от конкретных целей. Композиции могут быть в виде распыляемых порошков или гранул, включающих активный ингредиент (соединение, заявленное в изобретении) и твердый носитель или дилюэнт, например, такие наполнители как каолин, бентонит, кизельгур, доломит, карбонат кальция, тальк, порошковую магнезию, наполнительную землю, гипс, диатомовую землю и фарфоровую глину. Такие гранулы могут быть преобразованы в гранулы, подходящие для введения в почву без дальнейшей обработки. Эти гранулы могут быть получены путем пропитывания наполнителя активным ингредиентом или путем гранулирования смеси активного ингредиента и порошкообразного наполнителя. Композиции для покрытия семян могут включать агент (например, минеральное масло), способствующий адгезии композиции на семенах; в других случаях активный ингредиент для обработки семян может быть приготовлен с использованием органического растворителя (например, метилпирролидона, пропиленгликоля или диметилформамида). Композиции могут быть также в виде увлажненных порошков или диспергированных в воде гранул, содержащих увлажняющие или диспергирующие агенты, чтобы облегчить диспергию в жидкостях. Порошки и гранулы также могут содержать наполнители и взвешенные агенты. Эмульгирующиеся концентраты или эмульсии можно приготовить растворением активного ингредиента в органическом растворителе, произвольно содержащем увлажняющий или эмульгирующий агент с последующими добавлением этой смеси в воду, которая также может содержать увлажняющий или эмульгирующий агент. Подходящими для этой цели органическими растворителями являются ароматические растворители, например алкилбензолы и алкилнафталины, кетоны, такие как циклогексанон и метилциклогексанон, хлорированные углеводороды, такие как хлорбензол и трихлорэтан, спирты, такие как бензиловый, фурфуриловый, бутанол и гликолевые эфиры. Суспензии концентратов крупных частиц нерастворимых веществ можно приготовить путем дробления на капли или шарики с диспергирующим агентом и со взвешенным агентом, чтобы предотвратить осаждение твердого вещества. Композиции, которые должны быть в виде аэрозолей, где вещество находится в контейнере при давлении топлива, например, фтортрихлорметана или дихлордифторметана. Соединения, заявленные в изобретении, можно смешивать в сухом виде с пиротехнической смесью, чтобы получить композиции, подходящую для получения в окружающем пространстве дыма, содержащего соединение. Кроме того, соединение может быть использовано в микрокапсульном виде. Оно также может быть изготовлено в виде биоразлагающихся полимерных композиций, чтобы получить медленное, контролируемое высвобождение активной субстанции. Путем введения походящих добавок, например, добавок для улучшения распределения, адгезивной способности и сопротивляемости дождю обрабатываемых поверхностей можно получить различные композиции, лучше приспособленные для всевозможных целей. Заявленные в изобретении соединения могут быть использованы в виде смесей с удобрениями (например, азотными, калиевыми или фосфорными). Желательно изготавливать композиции, содержащие гранулы удобрения, покрытые соединением. Такие гранулы содержат до 25% (по весу) соединения. Таким образом, изобретение обеспечивает также получение композиций, содержащих удобрение и соединение общей формулы (I), а также соль или комплекс этого соединения с металлом. Увлажненные порошки, эмульгированные концентраты и суспензии обычно содержат поверхностно-активные вещества, например увлажняющие агенты, диспергирующие агенты, эмульгирующие агенты или взвешенные агенты. Эти агенты могут быть катионными, анионными или неионными. Подходящими катионными агентами являются четвертичные соединения аммиака, например, цетилтриметиламмонийбромид. Подходящими анионными агентами являются мыла, соли алифатических моноэфиров серной кислоты (например, лаурилсульфат натрия), и соли сульфированных ароматических соединений (например, додецилбензолсульфонат натрия, лигосульфонат натрия, кальция или аммония, бутилнафталенсульфонат, также смесь натрий диизопропил и триизопропил-нафталинсульфонаты). Подходящими неионными агентами являются продукты конденсации оксида этилена с жирными спиртами, такими как олеиловый или цетиловый спирт, или с алкил-фенолами, такими как октил- или ионилфенол и октилкрезол. Другими неионными агентами являются неполные эфиры, полученные из жирных кислот с длинной цепочкой, и гекситангидриды, продукты конденсации упомянутых неполных эфиров с оксидом этилена, а также лецитины. Подходящими взвешенными агентами являются гидрофильные коллоиды (например, поливинилпирролидон и натрий-карбоксиметилцеллюлоза), и набухающие глины, такие как бентонит или аттапульгит. Композиции для использования в виде водных дисперсий или эмульсий обычно изготавливают в форме концентрата, содержащего большую часть активного ингредиента, причем перед использованием концентрат необходимо разбавлять водой. Желательно, чтобы концентраты сохранялись в течение длительного периода времени, сохраняя способность растворяться в воде, образуя водные препараты, остающиеся гомогенными в течение достаточного периода времени, чтобы их можно было использовать с помощью подходящего оборудования для распыления. Концентраты могут содержать до 95% лучше всего 10-85% например, 25-60% (по весу) активного ингредиента. После разбавления для приготовления водных проб такие пробы могут содержать варьируемые количества активного ингредиента, в зависимости от желаемых целей, но могут быть использованы водные препараты, содержащие от 0,0005% или 0,01% до 10% (по весу) активного ингредиента. Композиции, заявленные в настоящем изобретении, могут содержать и другие соединения, обладающие биологической активностью, например, соединения, имеющие сходную или добавочную фунгицидную активность, или те, которые могут регулировать рост растений или обладают гербицидными или инсектицидными свойствами. Фунгицидное соединение, которое может быть тем соединением, которое способно препятствовать болезням колосьев хлебных злаков (например, пшеницы), таким как Septoria Gibberella и Helminthosporium, болезням почвы и семян, а также пушистой и порошкообразной мучнистой росе винограда, порошкообразной мучнистой росе и парша яблок, и т.д. При включении других фунгицидов композиция может обладать более широким спектром активности, чем соединение общей формулы (I), будучи примененным без добавок. Следующие из других фунгицидных соединений могут приводить к совместному эффекту в отношении фунгицидной активности вместе с соединением общей формулы (I). Ниже приведены примеры фунгицидных соединений, которые могут быть включены в композиции, заявленные в настоящем изобретении. (PS)-1-аминопропилфосфоновая кислоты, (RS)-4-(4-хлорфенил)- 2-фенил-2-(1Н-1,2,4-триазол-1-ил-метил)бутиронитрил, (Z)-N-бут-2-анилоксиметил-2-хлор-2", 6"-диэтилацетанилид, 1-(2-циано 2-метоксииминоацетил)-3-этил мочевина, 1-[(2RS, 4RS; 2RS, 4RS)-4-бром-2-(2,4-дихлорфенил)тетрагидрофурфурил] -1Н-1,2,4-триазол-3 -(2,4-дихлорфенил)-2-(1Н-1,2,4-триазол-1-ил)-хиназолин-4(3Н)-он, 3-хлор-4-4-метил-2-(1Н-1,2,4-триазол-1-метил)-1,3-диоксолан-2-ил фенил-4-хлорфениловый эфир, 4-бром-2-циано-N, N-диметил-6-трифторметилбензимидазол-1-сульфонамид, 5-этил-5,8-дигидро-8-оксо(1,3)-диоксоло(4,5-g)хинолин-7-карбоновая кислота, L-[N-(3-хлор-2,6-ксилил)-2-метоксиацетамидо]  -бутиролактон, алдиморф, анилазин, беналазин, беномил, билоксазол, бинапакрил, битертанол, бластисидин S, бупиримат, бутиобат, каптафол, каптан, карбендазим, карбоксин, хлорбенз-тиазон, хлоронеб, хлортанолин, хлорзолинат, медь-содержащие соединения, такие как оксихлорид меди, сульфат меди, и Бордосская смесь, циклогексимид, цимоксанил, кипроконазол, кипрофурам, ди-2-пиридил дисульфид-1,1"-диоксид, дихлорфлуанид, дихлон, дихлобутразол, дихломезин, дихлоран, дифеноконазол, диметаморф, диметиримол, диниконазол, динокап, дитаморф, диметиримол, диниконазол, динокап, диталимфос, дитианон, додеморф, додин, эдифенфос, этаконазол, этиримол, этил (Z)-N-бензил-N-([метил(метиотиоэтилиденамино-окси-карбонил)амино] тио(-b- аланинат, этридиазол, фенапанил, фенаримол, фенфурам, фенпиклонил, фенпропидин, фенпропиморф, фентинацетат, фентин гидроксид, флутоланин, флутриафол, флусилазол, фольпет, фозетил-аллюминий, фуберидазол, фуралаксил, фурконазол-цис, газатин, гексаконазол, гидроксиизоксазол, имазалин, имибенконазол, ипробенфос, ипродион, изопротиолан, казугамицин, манкозеб, манеб, мепанипирим, мепронил, металаксил, метфуроксам, метсульфовакс, миклобутанил, N-(4-метил-6-проп-1-инилпиримидин-2-ил)анилин, неоазолин, никель диметилдитиокарбомат, нитротал-изопропил, нуаримол, офурас, ртутьсодержащие органические соединения, оксадиксил, оксикарбоксин, пефуразоат, пенконазол, пенцикурон, феназиноксид, фталид, полиоксид D, полирам, пробеназол, прохлораз, процимодон, пропамокарб, пропиконазол, пропинеб, протиокарб, пиразофос, пирифенокс, пирохилон, пироксифур, пирролнитрин, хинометионат, хинтозен, SSF-109, стрептомицин, сера, тебуконазол, техлофталам, текназен, тетра-коназол, тиобендазол, тициофен, тиофанат-метил, тирам, толклофос-метил, триацетатная соль, 1,1"-иминода(окта-метилен)диганидина, триадимефон, тридименол, триазбутил, трициклазол, тридеморф, трифорин, валидамицин А, винклозолин, зарималид и зинеб. Соединения общей формулы (I) могут быть смешаны с землей, торфом или с любой другой средой, в которой находятся корни, для защиты растений от фунгальных болезней почвы, торфа и листьев. Подходящими инсектицидами, которые можно ввести в композиции, заявленные в настоящем изобретении, могут являться бупрофезин, карбарил, карбофуран, карбосульфан, хлорпирифос, циклопротрин, деметон-S-метил, диазинон, диметоат, этофенпрокс, фенитротион, фенобукарб, фентион, формотион, изпрокарб, изоксатион, монокротофос, фентоат, пиримикарб, пропафос и ХМС. Соединениями, регулирующими рост растений, являются соединения, контролирующие сорняки или образование семян, либо селективно контролирующие рост нежелательных растений (например, трав). Примерами соединений, могущими контролировать и регулировать рост растений, и которые могут быть использованы вместе с соединениями, заявленными в настоящем изобретении, являются 3,6-дихлорпиколиновая кислота, 1-(4-хлорфенил)-4,6-диметил-2-оксо-1,2-дигидропиридин-3-карбоновая кислота, метил-3,6-дихлоранизат, абсцисиковая кислота, азулам, бензоилпроп-этил, карбетамид, даминозид, дифензокат, дикегуляк, этефон, фенпентезол, флуоридамид, глифозат, глифозин, гидроксибензонитрилы (например, бромксинил), инабенфид, изопиримол, длинноцепочечные жирные спирты и кислоты, малеиновый гидразид, мефлюидид, морфактины (например, хлорфторэкол), паклобутразол, феноксиуксусные кислоты (например, 2,4-D или МСРА), замещенная бензойная кислота (например, трииодбензойная кислота), замещенные четвертичные аммониевые и фосфониевые основания (например, хлормекуатхлорфониум или мепикатхлорид), текназен, ауксины (например, индолилуксусная кислота, индолилмасляная кислота, нафтилуксусная кислота или нафтоксиуксусная кислота), цитокинины (например, бензимидазол, бензиладенин, бензиламинопурин, дифенилмочевина или кинетин), гиббереллины (например, GA3, GA4 или GA7) и триапентенол. Следующие примеры иллюстрируют изобретение. Пример 1. Этот пример иллюстрирует получение N-(2-метокси-5-пиридил)-1-фторциклопропанкарбоксамида (соединение N 1 в таблице 1). 1-Фторциклопропилметилкетон получали, как описано в Synthesis p. 189 (1977). Сырой кетон (1,2 г, 11,8 ммолей) по каплям добавляли к водному раствору гипобромита натрия (получен из 12,4 г гидроксида натрия и 4 мл брома) при 0oC. Смесь перемешивали при 25oC в течении 41/2 часов, выливали на лед и подкисляли до точки метилоранжа с помощью 5% водной хлористоводородной кислоты. Кислоту эксрагировали 40 мл эфира; экстракт осушали над безводным сульфатом магния, отфильтровывали и концентрировали в вакууме, получая сырую 1-фторциклопропанкарбоновую кислоту. Выход 0,84 г, 70% чистоты (определено методом газовой хроматографии). 1-Фторциклопропанкарбоновую кислоту (сырую) (0,84 г, 0,0081 моля) добавляли двумя порциями к раствору метиленхлорида (50 мл) и карбонил диимидазола (1,31 г, 0,0081 моля). Реакцию проводили в течение 1 часа, после чего 5-амино-2-метоксипиридин (0,83 мл, 0,0081 моля) добавляли в виде одной порции. Реакционную смесь оставляли при комнатной температуре на 1 час. После этого реакционную смесь промывали насыщенным бикарбонатом натрия (50 мл), 5% хлористоводородной кислотой (20 мл) и насыщенным раствором бикарбоната натрия (25 мл); высушивали над безводным сульфатом магния, отфильтровывали и выпаривали в вакууме, получая 0,5 г сырого N-(2-метокси-5-пиридил)-1-фторциклопропанкарбоксамида. Полученную ранее промытую кислоту экстрагировали метиленхлоридом (3 х 50 мл); экстракт промывали насыщенным бикарбонатом натрия, осушали над безводным сульфатом магния и выпаривали в вакууме, получая 0,2 г чистого продукта. Пример 2. Этот пример иллюстрирует получение 1-фторциклопропан карбоновой кислоты. Раствор гипобромита натрия добавляя по каплям бром (19,66 г) к раствору гидроксида натрия (19,67 г) в воде (100 мл) при 0-10oC. После завершения добавления раствор охлаждали до 0oC. Чистый 1-фторциклопропил метил кетон (1,90 г) добавляли по каплям в течение одной минуты. После окончания добавления реакционную смесь нагревали до комнатной температуры и перемешивали в течение 3 1/2 часов. Реакционную смесь выливали на лед и подкисляли до рН 3,5 с помощью 5% водного раствора хлористоводородной кислоты. Избыток брома удаляли, добавляя бисульфат натрия до тех пор, пока не исчезала коричневая окраска. Смесь экстрагировали диэтиловым эфиром (три раза). Органические фазы соединяли и промывали насыщенным солевым раствором. Органические экстракты высушивали (безводный сульфат магния), фильтровали и удаляли растворитель на роторном испарителе при пониженном давлении при 40oC, получая желаемое соединение в виде прозрачного неокрашенного масла (1,25 г). 1H ЯМР (CDCl3): d 1,44 (S, 2H); 1,50 (d, 2H); 9,53 (br.s, 1H) м.д. Пример 3. Этот пример иллюстрирует получение 2,2-дифторциклопропан карбоновой кислоты. Смесь перманганата калия (3,49 г), воды (25 мл) и 2,2-дифтор-1-винилциклопропана (1,15 г) перемешивали при комнатной температуре в течение 18 часов. Смесь фильтровали. Фильтрат подкисляли 20% хлористоводородной кислотой (100 мл) и экстрагировали дихлорметаном (4 х 100 мл). Сложные органические экстракты промывали насыщенным солевым раствором (50 мл) и высушивали над безводным сульфатом магния. Фильтрование, после которого удаляли растворитель из фильтрата на роторном испарителе при пониженном давлении при 46oC, приводило к получению желаемого соединения в виде прозрачного неокрашенного масла (1,17 г). [Литературные ссылки: ЕР 0 351 647 А2 и 109, (1976), 2350]/ 1H ЯМР (CDCl3): d 1,75-1,90 (c, 1H); 2,04-2,16 (c, 1H); 2,18 (S, 1H); 2,40-2,51 (c, 1H) м.д. Пример 4. Этот пример иллюстрирует получение 2,2-дифтор-1-метилциклопропан карбоновой кислоты. Смесь 2,2-дифтор-1-метил-1-винилциклопропана (2 г), перманганата калия (5,36 г) и воды (24 мл) перемешивали при комнатной температуре в течение 24 часов. Смесь фильтровали. Фильтрат подкисляли до рН 2 с помощью хлористоводородной кислоты и экстрагировали диэтиловым эфиром. Сложные органические экстракты осушали над безводным сульфонатом магния. Фильтрование, после которого удаляли растворитель из фильтрата на роторном испарителе при пониженном давлении при 40oC, приводило к получению желаемого соединения в виде белого твердого порошка (1,25 г). 1H ЯМР (CDCl3): d 1,35-1,42 (c, 1H); 1,45 (c, 3H); 2,20-2,31 (c, 1H) м. д. (Кислые протоны не наблюдались). Пример 5. Этот пример иллюстрирует получение 2-хлор-2-фторциклопропан карбоновой кислоты. Смесь перманганата калия (21,69 г), воды (200 мл) и 1-хлор-1-фтор-2-винилциклопропана (8,27 г) перемешивали при комнатной температуре в течение 24 часов. Смесь фильтровали. Фильтрат подкисляли до рН 2 с помощью концентрированной хлористоводородной кислоты и экстрагировали дихлорметаном (три раза). Сложные органические экстракты промывали насыщенным солевым раствором и осушали на безводный сульфатом магния. Фильтрование, после которого удаляли растворитель из фильтрата на роторном испарителе при пониженном давлении при 40oC, приводило к получению желаемого соединения в виде прозрачного бесцветного масла (4,49 г). [Литературные ссылки: Chem. Ber. (1976), 109, 2350. 1H ЯМР (CDCl3): d 1,62-2,05 (c, 1H); 2,21-2,64 (c, 1H); 2,70 (c, 1H) м.д. (Кислотные протоны не наблюдались). Пример 6. Этот пример иллюстрирует получение 2-хлор-2-фтор-1-метил циклопропан карбоновой кислоты. Смесь перманганата калия (28,45 г), воды (200 мл) и 2-хлор-2-фтор-1-метил-1-метил-1-винилциклопропана (12,11 г) перемешивали при комнатной температуре в течение 24 часов. Cмесь фильтровали. Фильтрат подкисляли до рН 2 с помощью концентрированной хлористоводородной кислоты и экстрагировали диэтиловым эфиром (три раза). Сложные органические экстракты промывали насыщенным солевым раствором и осушали над безводным сульфатом магния. Фильтрование после которого удаляли растворитель на роторном испарителе при пониженном давлении при 40oC, приводило к получению желаемого соединения в виде прозрачного бесцветного масла (9,33 г). [Литературная ссылка: EP 0351647 A2] 1H ЯМР (CDCl3): d 1,29-1,60 (c, 4H); 2,07-2,50 (c, 1H); м.д. (Кислотные протоны не наблюдались). Пример 7 Этот пример иллюстрирует получение 2,2-хлор-1-метилциклопропан карбонил хлорида. Оксалил хлорид (20,23 г) добавляли к 2,2-дихлор-1-метилциклопропан карбоновой кислоте (8,45 г) при комнатной температуре. Смесь перемешивали в течение 18 часов. Избыток оксалил хлорида удаляли дистилляцией при атмосферном давлении (63-65oC), получая желаемое соединение в виде прозрачного масла (7,18 г), которое при стоянии опять приобретало коричневую окраску. 1H ЯМР (CDCl3): d 1,63- (d, 1H); 1,77 (s, 3H); 2,38 (d, 1H) м.д. Пример 8. Этот пример иллюстрирует получение N-(2-метокси-5-пиридил)-1-фторциклопропан карбоксида (Соединение N 1 в таблице 1). К раствору 5-амино-2-метоксипиридина (1,19 г) и 4-диметиламинопиридина (0,195 г) в сухом дихлорметане (40 мл) при комнатной температуре добавляли 1-фторциклопропан карбоновую кислоту (1,0 г) и 1-этил-3-(3-диметиламинопропил) карбодиимид гидрохлорид (1,84 г). Полученную реакционную смесь перемешивали при комнатной температуре в течение 17 часов. Реакционную смесь выливали в воду и экстрагировали дихлорметаном (три раза). Экстракты соединяли и осушали над безводным сульфатом магния. Фильтрование, после которого удаляли растворитель из фильтрата на роторном испарителе, приводило к получению коричневого масла, которого очищали методом импульсной хроматографии на двуокиси кремния, используя в качестве элюэнта смесь н-гександиэтиловый эфир (1:1). Проводили перекристаллизацию из петролейного эфира (60-80oC), получая желаемое соединение в виде белого твердого вещества (356 мг). Пример 9. Этот пример иллюстрирует получение N-(2-фтор-5-пиридил)-2-фторциклопропан карбоксамида (Соединение N 3 в таблице 1). К раствору 5-амино-2-фторпиридина (1,34 г) и 4-диметиламинопиридина (0,248 г) в сухом дихлорметане (40 мл) при комнатной температуре добавляли 1-фторциклопропан карбоновую кислоту (1,25 г) и 1-этил-3-(3-диметиламинопропил) карбодиимида гидрохлорид (2,31 г). Полученную реакционную смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь выливали в воду и экстрагировали дихлорметаном (три раза). Экстракты соединяли и осушали над безводным сульфатом магния. Фильтрование, после которого удаляли растворитель на роторном испарителе, приводило к получению коричневого масла, которое очищали импульсной хроматографией, на двуокиси кремния, используя в качестве элюента смесь н-гексан:этилацетат (2:1). Проводили перекристаллизацию из смеси н-гексан/этилацетат, получая желаемое соединение в виде белого твердого вещества (65 мг). Пример 10. Этот пример иллюстрирует получение N-(2-метокси-5-пиридил)-1-бромциклопропан карбоксамида (Соединение N 10 в таблице 1). К смеси 5-амино-2-метоксипиридина (0,767 г), триэтиламина (10 мл) и сухого дихлорметана (40 мл) добавляли 1-бромциклопропанкарбонил хлорид (1 г). Наблюдалась экзотерма (около +10oC). Реакционную смесь перемешивали в течение 24 часов. Реакционную смесь выливали в воду и экстрагировали дихлорметаном (три раза). Сложные органические экстракты промывали 5% хлористоводородной кислотой, осушали (безводный сульфат магния) и обесцвечивали (активированный древесный уголь). Смесь фильтровали и удаляли растворитель из фильтрата на роторном испарителе при пониженном давлении при 40oC, получая масло. Масло очищали импульсной хроматографией на колонке с двуокисью кремния, элюируя смесью н-гексан: этилацетат (3: 1), после чего перекристаллизовывали из смеси н-гексан/диэтиловый эфир, получая желаемое соединение в виде белого твердого вещества (0,84 г). Пример 11. Этот пример иллюстрирует получение N-(2-метокси-5-пиридил)-2,2-дифторциклопропан карбоксамида (соединение N 5 в таблице 1). К раствору 5-амино-2-метоксипиридина (0,305 г) и 4-диметиламинонитрипиридина (0,03 г) в сухом дихлорметане (10 мл) при комнатной температуре добавляли 2,2-дифторциклопропан карбоновую кислоту (0,3 г) и 1-этил-3-(3-диметиламинопропил) карбодиимида гидрохлорид (0,472 г). Полученную реакционную смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь вливали в воду и экстрагировали дихлорметаном (три раза). Сложные органические экстракты осушали над безводным сульфатом магния. Фильтрование, после которого удаляли растворитель на роторном испарителе, приводило к получению коричневого масла, которое очищали импульсной хроматографией на двуокиси кремния, используя в качестве элюента смесь н-гексан/этилацетат (1: 1). После перекристаллизации из смеси н-гептан/этилацетат получали желаемое соединение в виде белого твердого вещества (123 мг). Пример 12. Этот пример иллюстрирует получение N-(2-метокси-5-пиридил)-2-фторциклопропан карбоксамида (соединения NN 17 и 18 в таблице 1). N-(2-метокси-5-пиридил)-2-хлор-2-фторциклопропан карбоксамид (0,3 г), этанол (10 мл), этилендиамин (0,2 г) и никель Ренея (0,5 г) помещали в автоклав. Смесь нагревали до 120oC в атмосфере водорода при давлении 34 Бара в течение 16 часов. Реакционную смесь выливали в этилацетат и фильтровали. Удаление растворителя из фильтрата на роторном испарителе при пониженном давлении при 40oC приводило к получению коричневого масла, которое, как оказалось, содержит 4 диастереомера: (1R, 2S), (1S, 2R), (1R, 2R) и (1S, 2S). Было выделено две пары энантиомеров с помощью метода импульсной хроматографии на колонке с двуокисью кремния, причем в качестве элюента использовали смесь н-гексан-этилацетат (1:1). Два выделенных рацемата представляли собой: Рацемат А (соединение N 17 в таблице 1), состоящий из N-(2-метокси-5-пиридил)-(1R, 2R)-2-фторциклопропан карбоксамида и N-(2-метоксипиридил)-(1S, 1R)-2-(фторциклопропан карбоксамида; и Рацемат В (соединение N 18 в таблице 1), состоящий из N-(2-метокси-5-пиридил)-(1S, 2R)-2-фторциклопропан карбоксамида и N-(2-метокси-5-пиридил)-(1R, 2S)-2-фторциклопропан карбоксамида. Оба рацемата перекристаллизовывали из смеси н-гексан/этилацетат. [Этот метод гидродехлорирования был заимствован из патент ЕР 0351650 А2] Пример 13. Этот пример иллюстрирует получение N-(2-метокси-5-пиридил)-2,2-дифтор-1-метилциклопропан карбоксамида (соединение N 23 в таблице 1). К раствору 5-амино-2-метоксипиридина (0,364 г) и 4-диметиламинопиридина (0,037 г) в сухом дихлорметане (10 мл) при комнатной температуре добавляли 2,2-дифтор-1-метилциклопропанкарбоновую кислоту (0,400 г) и 1-этил-3-(3-диметиламинопропил) карбодиимида гидрохлорид (0,565 г). Полученную реакционную смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь выливали в воду и экстрагировали дихлорметаном (три раза). Органические экстракты соединяли и осушали над безводным сульфатом магния. Фильтрование, после которого удаляли растворитель из фильтрата на роторном испарителе, приводило к получению коричневого масла, которое очищали методом импульсной хроматографии на двуокиси кремния, используя в качестве элюента смесь н-гексан/этилацетат (1:1). Проводили перекристаллизацию из смеси н-гексан/этилацетата и получали желаемое соединение в виде белого твердого вещества (360 мг). Пример 14. Этот пример иллюстрирует получение N-(2-метокси-5-пиридил)-2-хлор-2-фторциклопропан карбоксамида (соединение N 26 в таблице 1). К раствору 5-амино-2-метоксипиридина (0,537 г) и 4-диметиламинопиридина (0,053 г) в сухом дихлорметане (10 мл) при комнатной температуре добавляли 2-хлор-2-фтор-циклопропанкаробоновую кислоту (0,6 г) и 1-этил-3-(3-диметиламинопропил) карбодиимида дихлорид (1,25 г). Полученную реакционную смесь перемешивали при комнатной температуре в течение 72 часов. Реакционную смесь выливали в воду и экстрагировали дихлорметаном (три раза). Органические экстракты собирали и осушали над безводным сульфатом магния. Фильтрование, после которого удаляли растворитель из фильтрата на роторном испарителе, приводило к получению коричневого масла, которое очищали методом импульсной хроматографии на двуокиси кремния, используя в качестве элюента смесь н-гексан/этилацетат (1:1). После перекристаллизации из смеси н-гексан/этилацетат получали желаемое соединение в виде белого твердого вещества (392 мг). Пример 15. Этот пример иллюстрирует получение N-(2-метокси-5-пиридил)-2-хлор-2-фтор-1-метилпропан карбоксамида (соединение N 29 в таблице 1). К раствору 5-амино-2-метоксипиридина (0,33 г) и 4-диметиламинопиридина (0,025 г) в сухом дихлорметане (10 мл) при комнатной температуре добавляли 2-хлор-2-фтор-1-метилциклопропанкарбоновую кислоту (0,4 г) и 1-этил-3-(3-диметиламинопропил) карбоксимида гидрохлорид (1,01 г). Полученную реакционную смесь перемешивали в течение 24 часов при комнатной температуре. Реакционную смесь выливали в воду и экстрагировали дихлорметаном (три раза). Органические экстракты соединяли и осушали над безводным сульфатом магния. Фильтрование, после которого удаляли растворитель из фильтрата на роторном испарителе, приводило к получению коричневого масла, которое очищали методом импульсной хроматографии на двуокиси кремния, используя в качестве элюента смесь гексан:этилацетат (1:1) и получали желаемое соединение в виде коричневого масла (470 мг). Пример 16. Этот пример иллюстрирует получение N-(2-метокси-5-пиридил)-2,2-дихлор-1-метилциклопропан карбоксамида (соединение N 32 в таблице 1). К раствору 5-амино-2-метоксипиридина (4,96 г) и 4-диметиламинопиридина (0,488 г) в сухом дихлорметане (100 мл) при комнатной температуре добавляли 2,2-дихлор-1-метилциклопропанкарбоновую кислоту (4,88 г, Aldrich) и 1-этил-3-(3-диметиламинопропил)-карбодиимида гидрохлорид (7,68 г). Полученную реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь выливали в воду и экстрагировали дихлорметаном (три раза). Органические экстракты соединяли и осушали над безводным сульфатом магния. Фильтрование, после которого растворитель удаляли из фильтрата на роторном испарителе, приводило к получению коричневого масла, которое очищали методом перекристаллизации из смеси н-гексан/этилацетат, получая желаемое соединение в виде белого твердого вещества (3,48 мг). Пример 17. Этот пример иллюстрирует получение N-метил-N-(2-метокси-5-пиридил)-1-фторциклопропан карбоксамида (соединение N 35 в таблице 1). К смеси гидроксида калия (0,203 г) и диметилсульфоксида (10 мл) добавляли N-(2-метокси-5-пиридил)-1-фторциклопропан карбоксамида (0,19 г) в диметилсульфоксиде (5 мл). К реакционной смеси добавляли раствор метилиодида (0,257 г) в диметилисульфоксиде (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь выливали в воду и экстрагировали дихлорметаном (три раза). Сложные органические экстракты промывали водой и осушали над безводным сульфатом магния. Фильтрование, после которого удаляли растворитель из фильтрата на роторном испарителе при пониженном давлении при 40oC, приводило к получению масла, которое очищали импульсной хроматографией на колонке с двуокисью кремния, используя в качестве элюента смесь н-гексан: диэтиловый эфир (3:1). В результате получали желаемое соединение в виде легкого желтого масла (95 мг). Пример 18. Этот пример иллюстрирует получение N-пропаргил-N-(2-метокси-5-пиридил)-1-фторциклопропан карбоксамида (соединение N 38 в таблице 1). К смеси гидроксида калия (0,18 г) и диметилсульфоксида (10 мл) добавляли раствор N-(2-метокси-5-пиридил)-1-фторциклопропан карбоксамида (0,17 г) в диметилсульфоксиде (5 мл). Раствор пропаргил бромида (0,24 г) в диметилсульфоксиде (5 мл) и толуоле (5 мл) добавляли к реакционной смеси. Реакционную смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь выливали в воду и экстрагировали дихлорметаном (три раза). Сложные органические экстракты промывали водой и осушали над безводным сульфатом магния. Фильтрование, после которого удаляли растворитель из фильтрата на роторном испарителе при пониженном давлении при 40oC, приводило к получению масла, которое очищали методом импульсной хроматографии на колонке с двуокисью кремния, используя в качестве элюента смесь н-гексан:диэтиловый эфир (3:1), получая желаемое соединение в виде желтого масла (0,128 г). Пример 19. Этот пример иллюстрирует получение N-аллил-N-(2-метокси-5-пиридил)-1-фторциклопропанкарбоксамида (соединение N 41 в таблице 1). К смеси гидроксида калия (0,16 г) и диметилсульфоксида (10 мл) добавляли раствор N-(2-метокси-5-пиридил)-1-фторциклопропан карбоксамида (0,15 г) в диметилсульфоксиде (5 мл). Раствор аллилбромида (0,173 г) в диметилсульфоксиде (5 мл) добавляли к реакционной смеси. Реакционную смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь выливали в воду и экстрагировали дихлорметаном (три раза). Сложные органические экстракты промывали водой и осушали над безводным сульфатом магния. Фильтрование, после которого удаляли растворитель из фильтрата на роторном испарителе при пониженном давлении при 40oC, приводило к получению масла, которое очищали методом импульсной хроматографии на колонке с двуокисью кремния, используя в качестве элюента смесь н-гексан:этилацетат (3: 1), получая желаемое соединение в виде оранжевого масла (0,132 г). Пример 20. Этот пример иллюстрирует получение N-бензил-N-(2-метокси-5-пиридил)-1-фторциклопропан карбоксамида (соединение N 44 в таблице 1). К смеси гидроксида калия (0,173 г) и диметилсульфоксида (10 мл) добавляли раствор N-(2-метокси-5-пиридил)-1-фторциклопропан карбоксамида (0,263 г) в диметилсульфоксиде (5 мл). К реакционной смеси добавляли раствор бензилбромида (0,265 г) в диметилсульфоксиде (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь вливали в воду и экстрагировали дихлорметаном (три раза). Сложные органические экстракты промывали водой и осушали над безводным сульфатом магния. Фильтрование, после которого удаляли растворитель из фильтрата на роторном испарителе при пониженном давлении при 40oC, приводило к получению масла, которое чистили методом импульсной хроматографии на колонке с двуокисью кремния, используя в качестве элюента смесь н-гексан:диэтиловый эфир (6:4). В результате получали желаемое соединение в виде бледно-желтого масла (140 мг). Пример 21. Этот пример иллюстрирует получение N-бут-2-инил-N-(2-метокси-5-пиридил)-1-фторциклопропан карбоксамида (соединение N 47 в таблице 1). К смеси гидроксида калия (0,436 г) и диметилсульфоксида (10 мл) добавляли раствор N-(2-метокси-5-пиридил)-1-фторциклопропан карбоксамида (0,41 г) в диметилсульфоксиде (5 мл). К реакционной смеси добавляли раствор метилпропагилбромида (0,52 г) в диметилсульфоксиде (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь выливали в воду и экстрагировали дихлорметаном (три раза). Сложные органические экстракты промывали водой и осушали над безводным сульфатом магния. Фильтрование, после которого удаляли растворитель из фильтрата на роторном испарителе при пониженном давлении при 40oC, приводило к получению масла, которое очищали методом импульсной хроматографии на колонке с двуокисью кремния, используя в качестве элюента смесь н-гексан:диэтиловый эфир (6: 4), получая бесцветное кристаллическое твердое вещество. Перекристаллизация из н-гексана приводила к получению желаемого соединения в виде белого твердого вещества (301 г). Далее следуют примеры композиций, пригодных для использования в агротехнике и садоводстве, которые могут быть составлены на основе соединений, заявленных в изобретении. Такие композиции формируют другую точку зрения на изобретение. Процентные соотношения приведены по весу. Пример 22. Эмульгующийся концентрат получен смешиванием и перемешиванием ингредиентов до их растворения. Соединение N 1 в таблице 1 10% Бензиловый спирт 30% Додецилбензолсульфонат кальция 5% Нонилфенолэтоксилат (13 молей этилен оксида) 10% Алкилбензолы 45% Пример 23. Активный ингредиент растворяли в дихлорметилене и полученной жидкостью опрыскивали гранулы аттапульгитной глины. После этого растворитель испарялся, образуя гранулированную композицию. Соединение N 1 в таблице 1 5% Аттапульгитные гранулы 95% Пример 24. Композиция, пригодная для обработки семя, была получена измельчением и смешиванием трех ингредиентов. Соединение N 1 в таблице 1 50% Минеральное масло 2% Фарфоровая глина 48% Пример 25. Распыляемый порошок получен измельчением и смешиванием активного ингредиента с тальком. Соединение N 1 в таблице 1 5% Тальк 95% Пример 26. Концентрат суспензии получен дроблением ингредиента на шарики с образованием водной суспензии почвенной смеси с водой. Соединение N 1 в таблице 1 40% Лигносульфонат натрия 10% Бентонитовая глина 1% Вода 49% Такой состав может быть использован для опрыскивания при разбавлении водой, а также его можно применять непосредственно для обработки семян. Пример 27. Увлажненная порошковая композиция получена смешиванием и измельчением ингредиентов до тех пор, пока они до конца не перемешаются. Соединение N 1 в таблице 1 25% Лаурилсульфат натрия 2% Лигносульфонат натрия 5% Двуокись кремния 25% Фарфоровая клина 43% Пример 28. Соединения были проверены в качестве средств против множества грибковых заболеваний листьев растений. Методика применения их для таких целей следующая. Растения были выращены на измельченных компостах (N 1 и 2) с диаметром миничастиц 4 см. Тестовое соединение было введено в композицию либо путем измельчения на шарики с Dispersol T, либо в виде раствора в ацетоне (или в смеси ацетон/этанол), который разбавляли до нужной концентрации непосредственно перед использованием. Для борьбы с поражениями листьев составы (100 ч/млн. активного ингредиента) применяли для опрыскивания листвы, а также для обработки корней растений в почве. Опрыскивание проводили до тех пор, пока на листьях еще удерживался раствор, а дозы для корневой обработки имели максимальную концентрацию, эквивалентную примерно 40 ч/млн. активного ингредиента в сухой почве. При опрыскивании хлебных злаков добавляли Твин 20, чтобы получить конечную концентрацию, равную 0,05% В большинстве тестов соединение применяли к корням в почве и к листьям (путем опрыскивания) за день или два до того, как заражали растения болезнями. Исключение составляли тест на Erysiphe graminis в котором растение заражали за 24 часа до обработки. Лиственные болезнетворные организмы вводили путем опрыскивания суспензиями их спор лиственного покрова тестовых растений. После заражения растения были помещены в подходящее для распространения инфекции окружение и затем инкубированы до тех пор, пока заражение не было готово для оценки. Период времени между заражением и оценкой варьировался от четырех до четырнадцати дней, в зависимости от болезни и окружения. Контроль заражения был проведен в соответствии со следующей градацией: 4 нет заражения 3 от следов до 5% заражения на необработанных растениях 3 6-25% заражения на необработанных растениях 1 26-59% заражения на необработанных растениях 0 60-100% заражения на необработанных растениях. Результаты приведены в таблице 3. -бутиролактон, алдиморф, анилазин, беналазин, беномил, билоксазол, бинапакрил, битертанол, бластисидин S, бупиримат, бутиобат, каптафол, каптан, карбендазим, карбоксин, хлорбенз-тиазон, хлоронеб, хлортанолин, хлорзолинат, медь-содержащие соединения, такие как оксихлорид меди, сульфат меди, и Бордосская смесь, циклогексимид, цимоксанил, кипроконазол, кипрофурам, ди-2-пиридил дисульфид-1,1"-диоксид, дихлорфлуанид, дихлон, дихлобутразол, дихломезин, дихлоран, дифеноконазол, диметаморф, диметиримол, диниконазол, динокап, дитаморф, диметиримол, диниконазол, динокап, диталимфос, дитианон, додеморф, додин, эдифенфос, этаконазол, этиримол, этил (Z)-N-бензил-N-([метил(метиотиоэтилиденамино-окси-карбонил)амино] тио(-b- аланинат, этридиазол, фенапанил, фенаримол, фенфурам, фенпиклонил, фенпропидин, фенпропиморф, фентинацетат, фентин гидроксид, флутоланин, флутриафол, флусилазол, фольпет, фозетил-аллюминий, фуберидазол, фуралаксил, фурконазол-цис, газатин, гексаконазол, гидроксиизоксазол, имазалин, имибенконазол, ипробенфос, ипродион, изопротиолан, казугамицин, манкозеб, манеб, мепанипирим, мепронил, металаксил, метфуроксам, метсульфовакс, миклобутанил, N-(4-метил-6-проп-1-инилпиримидин-2-ил)анилин, неоазолин, никель диметилдитиокарбомат, нитротал-изопропил, нуаримол, офурас, ртутьсодержащие органические соединения, оксадиксил, оксикарбоксин, пефуразоат, пенконазол, пенцикурон, феназиноксид, фталид, полиоксид D, полирам, пробеназол, прохлораз, процимодон, пропамокарб, пропиконазол, пропинеб, протиокарб, пиразофос, пирифенокс, пирохилон, пироксифур, пирролнитрин, хинометионат, хинтозен, SSF-109, стрептомицин, сера, тебуконазол, техлофталам, текназен, тетра-коназол, тиобендазол, тициофен, тиофанат-метил, тирам, толклофос-метил, триацетатная соль, 1,1"-иминода(окта-метилен)диганидина, триадимефон, тридименол, триазбутил, трициклазол, тридеморф, трифорин, валидамицин А, винклозолин, зарималид и зинеб. Соединения общей формулы (I) могут быть смешаны с землей, торфом или с любой другой средой, в которой находятся корни, для защиты растений от фунгальных болезней почвы, торфа и листьев. Подходящими инсектицидами, которые можно ввести в композиции, заявленные в настоящем изобретении, могут являться бупрофезин, карбарил, карбофуран, карбосульфан, хлорпирифос, циклопротрин, деметон-S-метил, диазинон, диметоат, этофенпрокс, фенитротион, фенобукарб, фентион, формотион, изпрокарб, изоксатион, монокротофос, фентоат, пиримикарб, пропафос и ХМС. Соединениями, регулирующими рост растений, являются соединения, контролирующие сорняки или образование семян, либо селективно контролирующие рост нежелательных растений (например, трав). Примерами соединений, могущими контролировать и регулировать рост растений, и которые могут быть использованы вместе с соединениями, заявленными в настоящем изобретении, являются 3,6-дихлорпиколиновая кислота, 1-(4-хлорфенил)-4,6-диметил-2-оксо-1,2-дигидропиридин-3-карбоновая кислота, метил-3,6-дихлоранизат, абсцисиковая кислота, азулам, бензоилпроп-этил, карбетамид, даминозид, дифензокат, дикегуляк, этефон, фенпентезол, флуоридамид, глифозат, глифозин, гидроксибензонитрилы (например, бромксинил), инабенфид, изопиримол, длинноцепочечные жирные спирты и кислоты, малеиновый гидразид, мефлюидид, морфактины (например, хлорфторэкол), паклобутразол, феноксиуксусные кислоты (например, 2,4-D или МСРА), замещенная бензойная кислота (например, трииодбензойная кислота), замещенные четвертичные аммониевые и фосфониевые основания (например, хлормекуатхлорфониум или мепикатхлорид), текназен, ауксины (например, индолилуксусная кислота, индолилмасляная кислота, нафтилуксусная кислота или нафтоксиуксусная кислота), цитокинины (например, бензимидазол, бензиладенин, бензиламинопурин, дифенилмочевина или кинетин), гиббереллины (например, GA3, GA4 или GA7) и триапентенол. Следующие примеры иллюстрируют изобретение. Пример 1. Этот пример иллюстрирует получение N-(2-метокси-5-пиридил)-1-фторциклопропанкарбоксамида (соединение N 1 в таблице 1). 1-Фторциклопропилметилкетон получали, как описано в Synthesis p. 189 (1977). Сырой кетон (1,2 г, 11,8 ммолей) по каплям добавляли к водному раствору гипобромита натрия (получен из 12,4 г гидроксида натрия и 4 мл брома) при 0oC. Смесь перемешивали при 25oC в течении 41/2 часов, выливали на лед и подкисляли до точки метилоранжа с помощью 5% водной хлористоводородной кислоты. Кислоту эксрагировали 40 мл эфира; экстракт осушали над безводным сульфатом магния, отфильтровывали и концентрировали в вакууме, получая сырую 1-фторциклопропанкарбоновую кислоту. Выход 0,84 г, 70% чистоты (определено методом газовой хроматографии). 1-Фторциклопропанкарбоновую кислоту (сырую) (0,84 г, 0,0081 моля) добавляли двумя порциями к раствору метиленхлорида (50 мл) и карбонил диимидазола (1,31 г, 0,0081 моля). Реакцию проводили в течение 1 часа, после чего 5-амино-2-метоксипиридин (0,83 мл, 0,0081 моля) добавляли в виде одной порции. Реакционную смесь оставляли при комнатной температуре на 1 час. После этого реакционную смесь промывали насыщенным бикарбонатом натрия (50 мл), 5% хлористоводородной кислотой (20 мл) и насыщенным раствором бикарбоната натрия (25 мл); высушивали над безводным сульфатом магния, отфильтровывали и выпаривали в вакууме, получая 0,5 г сырого N-(2-метокси-5-пиридил)-1-фторциклопропанкарбоксамида. Полученную ранее промытую кислоту экстрагировали метиленхлоридом (3 х 50 мл); экстракт промывали насыщенным бикарбонатом натрия, осушали над безводным сульфатом магния и выпаривали в вакууме, получая 0,2 г чистого продукта. Пример 2. Этот пример иллюстрирует получение 1-фторциклопропан карбоновой кислоты. Раствор гипобромита натрия добавляя по каплям бром (19,66 г) к раствору гидроксида натрия (19,67 г) в воде (100 мл) при 0-10oC. После завершения добавления раствор охлаждали до 0oC. Чистый 1-фторциклопропил метил кетон (1,90 г) добавляли по каплям в течение одной минуты. После окончания добавления реакционную смесь нагревали до комнатной температуры и перемешивали в течение 3 1/2 часов. Реакционную смесь выливали на лед и подкисляли до рН 3,5 с помощью 5% водного раствора хлористоводородной кислоты. Избыток брома удаляли, добавляя бисульфат натрия до тех пор, пока не исчезала коричневая окраска. Смесь экстрагировали диэтиловым эфиром (три раза). Органические фазы соединяли и промывали насыщенным солевым раствором. Органические экстракты высушивали (безводный сульфат магния), фильтровали и удаляли растворитель на роторном испарителе при пониженном давлении при 40oC, получая желаемое соединение в виде прозрачного неокрашенного масла (1,25 г). 1H ЯМР (CDCl3): d 1,44 (S, 2H); 1,50 (d, 2H); 9,53 (br.s, 1H) м.д. Пример 3. Этот пример иллюстрирует получение 2,2-дифторциклопропан карбоновой кислоты. Смесь перманганата калия (3,49 г), воды (25 мл) и 2,2-дифтор-1-винилциклопропана (1,15 г) перемешивали при комнатной температуре в течение 18 часов. Смесь фильтровали. Фильтрат подкисляли 20% хлористоводородной кислотой (100 мл) и экстрагировали дихлорметаном (4 х 100 мл). Сложные органические экстракты промывали насыщенным солевым раствором (50 мл) и высушивали над безводным сульфатом магния. Фильтрование, после которого удаляли растворитель из фильтрата на роторном испарителе при пониженном давлении при 46oC, приводило к получению желаемого соединения в виде прозрачного неокрашенного масла (1,17 г). [Литературные ссылки: ЕР 0 351 647 А2 и 109, (1976), 2350]/ 1H ЯМР (CDCl3): d 1,75-1,90 (c, 1H); 2,04-2,16 (c, 1H); 2,18 (S, 1H); 2,40-2,51 (c, 1H) м.д. Пример 4. Этот пример иллюстрирует получение 2,2-дифтор-1-метилциклопропан карбоновой кислоты. Смесь 2,2-дифтор-1-метил-1-винилциклопропана (2 г), перманганата калия (5,36 г) и воды (24 мл) перемешивали при комнатной температуре в течение 24 часов. Смесь фильтровали. Фильтрат подкисляли до рН 2 с помощью хлористоводородной кислоты и экстрагировали диэтиловым эфиром. Сложные органические экстракты осушали над безводным сульфонатом магния. Фильтрование, после которого удаляли растворитель из фильтрата на роторном испарителе при пониженном давлении при 40oC, приводило к получению желаемого соединения в виде белого твердого порошка (1,25 г). 1H ЯМР (CDCl3): d 1,35-1,42 (c, 1H); 1,45 (c, 3H); 2,20-2,31 (c, 1H) м. д. (Кислые протоны не наблюдались). Пример 5. Этот пример иллюстрирует получение 2-хлор-2-фторциклопропан карбоновой кислоты. Смесь перманганата калия (21,69 г), воды (200 мл) и 1-хлор-1-фтор-2-винилциклопропана (8,27 г) перемешивали при комнатной температуре в течение 24 часов. Смесь фильтровали. Фильтрат подкисляли до рН 2 с помощью концентрированной хлористоводородной кислоты и экстрагировали дихлорметаном (три раза). Сложные органические экстракты промывали насыщенным солевым раствором и осушали на безводный сульфатом магния. Фильтрование, после которого удаляли растворитель из фильтрата на роторном испарителе при пониженном давлении при 40oC, приводило к получению желаемого соединения в виде прозрачного бесцветного масла (4,49 г). [Литературные ссылки: Chem. Ber. (1976), 109, 2350. 1H ЯМР (CDCl3): d 1,62-2,05 (c, 1H); 2,21-2,64 (c, 1H); 2,70 (c, 1H) м.д. (Кислотные протоны не наблюдались). Пример 6. Этот пример иллюстрирует получение 2-хлор-2-фтор-1-метил циклопропан карбоновой кислоты. Смесь перманганата калия (28,45 г), воды (200 мл) и 2-хлор-2-фтор-1-метил-1-метил-1-винилциклопропана (12,11 г) перемешивали при комнатной температуре в течение 24 часов. Cмесь фильтровали. Фильтрат подкисляли до рН 2 с помощью концентрированной хлористоводородной кислоты и экстрагировали диэтиловым эфиром (три раза). Сложные органические экстракты промывали насыщенным солевым раствором и осушали над безводным сульфатом магния. Фильтрование после которого удаляли растворитель на роторном испарителе при пониженном давлении при 40oC, приводило к получению желаемого соединения в виде прозрачного бесцветного масла (9,33 г). [Литературная ссылка: EP 0351647 A2] 1H ЯМР (CDCl3): d 1,29-1,60 (c, 4H); 2,07-2,50 (c, 1H); м.д. (Кислотные протоны не наблюдались). Пример 7 Этот пример иллюстрирует получение 2,2-хлор-1-метилциклопропан карбонил хлорида. Оксалил хлорид (20,23 г) добавляли к 2,2-дихлор-1-метилциклопропан карбоновой кислоте (8,45 г) при комнатной температуре. Смесь перемешивали в течение 18 часов. Избыток оксалил хлорида удаляли дистилляцией при атмосферном давлении (63-65oC), получая желаемое соединение в виде прозрачного масла (7,18 г), которое при стоянии опять приобретало коричневую окраску. 1H ЯМР (CDCl3): d 1,63- (d, 1H); 1,77 (s, 3H); 2,38 (d, 1H) м.д. Пример 8. Этот пример иллюстрирует получение N-(2-метокси-5-пиридил)-1-фторциклопропан карбоксида (Соединение N 1 в таблице 1). К раствору 5-амино-2-метоксипиридина (1,19 г) и 4-диметиламинопиридина (0,195 г) в сухом дихлорметане (40 мл) при комнатной температуре добавляли 1-фторциклопропан карбоновую кислоту (1,0 г) и 1-этил-3-(3-диметиламинопропил) карбодиимид гидрохлорид (1,84 г). Полученную реакционную смесь перемешивали при комнатной температуре в течение 17 часов. Реакционную смесь выливали в воду и экстрагировали дихлорметаном (три раза). Экстракты соединяли и осушали над безводным сульфатом магния. Фильтрование, после которого удаляли растворитель из фильтрата на роторном испарителе, приводило к получению коричневого масла, которого очищали методом импульсной хроматографии на двуокиси кремния, используя в качестве элюэнта смесь н-гександиэтиловый эфир (1:1). Проводили перекристаллизацию из петролейного эфира (60-80oC), получая желаемое соединение в виде белого твердого вещества (356 мг). Пример 9. Этот пример иллюстрирует получение N-(2-фтор-5-пиридил)-2-фторциклопропан карбоксамида (Соединение N 3 в таблице 1). К раствору 5-амино-2-фторпиридина (1,34 г) и 4-диметиламинопиридина (0,248 г) в сухом дихлорметане (40 мл) при комнатной температуре добавляли 1-фторциклопропан карбоновую кислоту (1,25 г) и 1-этил-3-(3-диметиламинопропил) карбодиимида гидрохлорид (2,31 г). Полученную реакционную смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь выливали в воду и экстрагировали дихлорметаном (три раза). Экстракты соединяли и осушали над безводным сульфатом магния. Фильтрование, после которого удаляли растворитель на роторном испарителе, приводило к получению коричневого масла, которое очищали импульсной хроматографией, на двуокиси кремния, используя в качестве элюента смесь н-гексан:этилацетат (2:1). Проводили перекристаллизацию из смеси н-гексан/этилацетат, получая желаемое соединение в виде белого твердого вещества (65 мг). Пример 10. Этот пример иллюстрирует получение N-(2-метокси-5-пиридил)-1-бромциклопропан карбоксамида (Соединение N 10 в таблице 1). К смеси 5-амино-2-метоксипиридина (0,767 г), триэтиламина (10 мл) и сухого дихлорметана (40 мл) добавляли 1-бромциклопропанкарбонил хлорид (1 г). Наблюдалась экзотерма (около +10oC). Реакционную смесь перемешивали в течение 24 часов. Реакционную смесь выливали в воду и экстрагировали дихлорметаном (три раза). Сложные органические экстракты промывали 5% хлористоводородной кислотой, осушали (безводный сульфат магния) и обесцвечивали (активированный древесный уголь). Смесь фильтровали и удаляли растворитель из фильтрата на роторном испарителе при пониженном давлении при 40oC, получая масло. Масло очищали импульсной хроматографией на колонке с двуокисью кремния, элюируя смесью н-гексан: этилацетат (3: 1), после чего перекристаллизовывали из смеси н-гексан/диэтиловый эфир, получая желаемое соединение в виде белого твердого вещества (0,84 г). Пример 11. Этот пример иллюстрирует получение N-(2-метокси-5-пиридил)-2,2-дифторциклопропан карбоксамида (соединение N 5 в таблице 1). К раствору 5-амино-2-метоксипиридина (0,305 г) и 4-диметиламинонитрипиридина (0,03 г) в сухом дихлорметане (10 мл) при комнатной температуре добавляли 2,2-дифторциклопропан карбоновую кислоту (0,3 г) и 1-этил-3-(3-диметиламинопропил) карбодиимида гидрохлорид (0,472 г). Полученную реакционную смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь вливали в воду и экстрагировали дихлорметаном (три раза). Сложные органические экстракты осушали над безводным сульфатом магния. Фильтрование, после которого удаляли растворитель на роторном испарителе, приводило к получению коричневого масла, которое очищали импульсной хроматографией на двуокиси кремния, используя в качестве элюента смесь н-гексан/этилацетат (1: 1). После перекристаллизации из смеси н-гептан/этилацетат получали желаемое соединение в виде белого твердого вещества (123 мг). Пример 12. Этот пример иллюстрирует получение N-(2-метокси-5-пиридил)-2-фторциклопропан карбоксамида (соединения NN 17 и 18 в таблице 1). N-(2-метокси-5-пиридил)-2-хлор-2-фторциклопропан карбоксамид (0,3 г), этанол (10 мл), этилендиамин (0,2 г) и никель Ренея (0,5 г) помещали в автоклав. Смесь нагревали до 120oC в атмосфере водорода при давлении 34 Бара в течение 16 часов. Реакционную смесь выливали в этилацетат и фильтровали. Удаление растворителя из фильтрата на роторном испарителе при пониженном давлении при 40oC приводило к получению коричневого масла, которое, как оказалось, содержит 4 диастереомера: (1R, 2S), (1S, 2R), (1R, 2R) и (1S, 2S). Было выделено две пары энантиомеров с помощью метода импульсной хроматографии на колонке с двуокисью кремния, причем в качестве элюента использовали смесь н-гексан-этилацетат (1:1). Два выделенных рацемата представляли собой: Рацемат А (соединение N 17 в таблице 1), состоящий из N-(2-метокси-5-пиридил)-(1R, 2R)-2-фторциклопропан карбоксамида и N-(2-метоксипиридил)-(1S, 1R)-2-(фторциклопропан карбоксамида; и Рацемат В (соединение N 18 в таблице 1), состоящий из N-(2-метокси-5-пиридил)-(1S, 2R)-2-фторциклопропан карбоксамида и N-(2-метокси-5-пиридил)-(1R, 2S)-2-фторциклопропан карбоксамида. Оба рацемата перекристаллизовывали из смеси н-гексан/этилацетат. [Этот метод гидродехлорирования был заимствован из патент ЕР 0351650 А2] Пример 13. Этот пример иллюстрирует получение N-(2-метокси-5-пиридил)-2,2-дифтор-1-метилциклопропан карбоксамида (соединение N 23 в таблице 1). К раствору 5-амино-2-метоксипиридина (0,364 г) и 4-диметиламинопиридина (0,037 г) в сухом дихлорметане (10 мл) при комнатной температуре добавляли 2,2-дифтор-1-метилциклопропанкарбоновую кислоту (0,400 г) и 1-этил-3-(3-диметиламинопропил) карбодиимида гидрохлорид (0,565 г). Полученную реакционную смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь выливали в воду и экстрагировали дихлорметаном (три раза). Органические экстракты соединяли и осушали над безводным сульфатом магния. Фильтрование, после которого удаляли растворитель из фильтрата на роторном испарителе, приводило к получению коричневого масла, которое очищали методом импульсной хроматографии на двуокиси кремния, используя в качестве элюента смесь н-гексан/этилацетат (1:1). Проводили перекристаллизацию из смеси н-гексан/этилацетата и получали желаемое соединение в виде белого твердого вещества (360 мг). Пример 14. Этот пример иллюстрирует получение N-(2-метокси-5-пиридил)-2-хлор-2-фторциклопропан карбоксамида (соединение N 26 в таблице 1). К раствору 5-амино-2-метоксипиридина (0,537 г) и 4-диметиламинопиридина (0,053 г) в сухом дихлорметане (10 мл) при комнатной температуре добавляли 2-хлор-2-фтор-циклопропанкаробоновую кислоту (0,6 г) и 1-этил-3-(3-диметиламинопропил) карбодиимида дихлорид (1,25 г). Полученную реакционную смесь перемешивали при комнатной температуре в течение 72 часов. Реакционную смесь выливали в воду и экстрагировали дихлорметаном (три раза). Органические экстракты собирали и осушали над безводным сульфатом магния. Фильтрование, после которого удаляли растворитель из фильтрата на роторном испарителе, приводило к получению коричневого масла, которое очищали методом импульсной хроматографии на двуокиси кремния, используя в качестве элюента смесь н-гексан/этилацетат (1:1). После перекристаллизации из смеси н-гексан/этилацетат получали желаемое соединение в виде белого твердого вещества (392 мг). Пример 15. Этот пример иллюстрирует получение N-(2-метокси-5-пиридил)-2-хлор-2-фтор-1-метилпропан карбоксамида (соединение N 29 в таблице 1). К раствору 5-амино-2-метоксипиридина (0,33 г) и 4-диметиламинопиридина (0,025 г) в сухом дихлорметане (10 мл) при комнатной температуре добавляли 2-хлор-2-фтор-1-метилциклопропанкарбоновую кислоту (0,4 г) и 1-этил-3-(3-диметиламинопропил) карбоксимида гидрохлорид (1,01 г). Полученную реакционную смесь перемешивали в течение 24 часов при комнатной температуре. Реакционную смесь выливали в воду и экстрагировали дихлорметаном (три раза). Органические экстракты соединяли и осушали над безводным сульфатом магния. Фильтрование, после которого удаляли растворитель из фильтрата на роторном испарителе, приводило к получению коричневого масла, которое очищали методом импульсной хроматографии на двуокиси кремния, используя в качестве элюента смесь гексан:этилацетат (1:1) и получали желаемое соединение в виде коричневого масла (470 мг). Пример 16. Этот пример иллюстрирует получение N-(2-метокси-5-пиридил)-2,2-дихлор-1-метилциклопропан карбоксамида (соединение N 32 в таблице 1). К раствору 5-амино-2-метоксипиридина (4,96 г) и 4-диметиламинопиридина (0,488 г) в сухом дихлорметане (100 мл) при комнатной температуре добавляли 2,2-дихлор-1-метилциклопропанкарбоновую кислоту (4,88 г, Aldrich) и 1-этил-3-(3-диметиламинопропил)-карбодиимида гидрохлорид (7,68 г). Полученную реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь выливали в воду и экстрагировали дихлорметаном (три раза). Органические экстракты соединяли и осушали над безводным сульфатом магния. Фильтрование, после которого растворитель удаляли из фильтрата на роторном испарителе, приводило к получению коричневого масла, которое очищали методом перекристаллизации из смеси н-гексан/этилацетат, получая желаемое соединение в виде белого твердого вещества (3,48 мг). Пример 17. Этот пример иллюстрирует получение N-метил-N-(2-метокси-5-пиридил)-1-фторциклопропан карбоксамида (соединение N 35 в таблице 1). К смеси гидроксида калия (0,203 г) и диметилсульфоксида (10 мл) добавляли N-(2-метокси-5-пиридил)-1-фторциклопропан карбоксамида (0,19 г) в диметилсульфоксиде (5 мл). К реакционной смеси добавляли раствор метилиодида (0,257 г) в диметилисульфоксиде (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь выливали в воду и экстрагировали дихлорметаном (три раза). Сложные органические экстракты промывали водой и осушали над безводным сульфатом магния. Фильтрование, после которого удаляли растворитель из фильтрата на роторном испарителе при пониженном давлении при 40oC, приводило к получению масла, которое очищали импульсной хроматографией на колонке с двуокисью кремния, используя в качестве элюента смесь н-гексан: диэтиловый эфир (3:1). В результате получали желаемое соединение в виде легкого желтого масла (95 мг). Пример 18. Этот пример иллюстрирует получение N-пропаргил-N-(2-метокси-5-пиридил)-1-фторциклопропан карбоксамида (соединение N 38 в таблице 1). К смеси гидроксида калия (0,18 г) и диметилсульфоксида (10 мл) добавляли раствор N-(2-метокси-5-пиридил)-1-фторциклопропан карбоксамида (0,17 г) в диметилсульфоксиде (5 мл). Раствор пропаргил бромида (0,24 г) в диметилсульфоксиде (5 мл) и толуоле (5 мл) добавляли к реакционной смеси. Реакционную смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь выливали в воду и экстрагировали дихлорметаном (три раза). Сложные органические экстракты промывали водой и осушали над безводным сульфатом магния. Фильтрование, после которого удаляли растворитель из фильтрата на роторном испарителе при пониженном давлении при 40oC, приводило к получению масла, которое очищали методом импульсной хроматографии на колонке с двуокисью кремния, используя в качестве элюента смесь н-гексан:диэтиловый эфир (3:1), получая желаемое соединение в виде желтого масла (0,128 г). Пример 19. Этот пример иллюстрирует получение N-аллил-N-(2-метокси-5-пиридил)-1-фторциклопропанкарбоксамида (соединение N 41 в таблице 1). К смеси гидроксида калия (0,16 г) и диметилсульфоксида (10 мл) добавляли раствор N-(2-метокси-5-пиридил)-1-фторциклопропан карбоксамида (0,15 г) в диметилсульфоксиде (5 мл). Раствор аллилбромида (0,173 г) в диметилсульфоксиде (5 мл) добавляли к реакционной смеси. Реакционную смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь выливали в воду и экстрагировали дихлорметаном (три раза). Сложные органические экстракты промывали водой и осушали над безводным сульфатом магния. Фильтрование, после которого удаляли растворитель из фильтрата на роторном испарителе при пониженном давлении при 40oC, приводило к получению масла, которое очищали методом импульсной хроматографии на колонке с двуокисью кремния, используя в качестве элюента смесь н-гексан:этилацетат (3: 1), получая желаемое соединение в виде оранжевого масла (0,132 г). Пример 20. Этот пример иллюстрирует получение N-бензил-N-(2-метокси-5-пиридил)-1-фторциклопропан карбоксамида (соединение N 44 в таблице 1). К смеси гидроксида калия (0,173 г) и диметилсульфоксида (10 мл) добавляли раствор N-(2-метокси-5-пиридил)-1-фторциклопропан карбоксамида (0,263 г) в диметилсульфоксиде (5 мл). К реакционной смеси добавляли раствор бензилбромида (0,265 г) в диметилсульфоксиде (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь вливали в воду и экстрагировали дихлорметаном (три раза). Сложные органические экстракты промывали водой и осушали над безводным сульфатом магния. Фильтрование, после которого удаляли растворитель из фильтрата на роторном испарителе при пониженном давлении при 40oC, приводило к получению масла, которое чистили методом импульсной хроматографии на колонке с двуокисью кремния, используя в качестве элюента смесь н-гексан:диэтиловый эфир (6:4). В результате получали желаемое соединение в виде бледно-желтого масла (140 мг). Пример 21. Этот пример иллюстрирует получение N-бут-2-инил-N-(2-метокси-5-пиридил)-1-фторциклопропан карбоксамида (соединение N 47 в таблице 1). К смеси гидроксида калия (0,436 г) и диметилсульфоксида (10 мл) добавляли раствор N-(2-метокси-5-пиридил)-1-фторциклопропан карбоксамида (0,41 г) в диметилсульфоксиде (5 мл). К реакционной смеси добавляли раствор метилпропагилбромида (0,52 г) в диметилсульфоксиде (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь выливали в воду и экстрагировали дихлорметаном (три раза). Сложные органические экстракты промывали водой и осушали над безводным сульфатом магния. Фильтрование, после которого удаляли растворитель из фильтрата на роторном испарителе при пониженном давлении при 40oC, приводило к получению масла, которое очищали методом импульсной хроматографии на колонке с двуокисью кремния, используя в качестве элюента смесь н-гексан:диэтиловый эфир (6: 4), получая бесцветное кристаллическое твердое вещество. Перекристаллизация из н-гексана приводила к получению желаемого соединения в виде белого твердого вещества (301 г). Далее следуют примеры композиций, пригодных для использования в агротехнике и садоводстве, которые могут быть составлены на основе соединений, заявленных в изобретении. Такие композиции формируют другую точку зрения на изобретение. Процентные соотношения приведены по весу. Пример 22. Эмульгующийся концентрат получен смешиванием и перемешиванием ингредиентов до их растворения. Соединение N 1 в таблице 1 10% Бензиловый спирт 30% Додецилбензолсульфонат кальция 5% Нонилфенолэтоксилат (13 молей этилен оксида) 10% Алкилбензолы 45% Пример 23. Активный ингредиент растворяли в дихлорметилене и полученной жидкостью опрыскивали гранулы аттапульгитной глины. После этого растворитель испарялся, образуя гранулированную композицию. Соединение N 1 в таблице 1 5% Аттапульгитные гранулы 95% Пример 24. Композиция, пригодная для обработки семя, была получена измельчением и смешиванием трех ингредиентов. Соединение N 1 в таблице 1 50% Минеральное масло 2% Фарфоровая глина 48% Пример 25. Распыляемый порошок получен измельчением и смешиванием активного ингредиента с тальком. Соединение N 1 в таблице 1 5% Тальк 95% Пример 26. Концентрат суспензии получен дроблением ингредиента на шарики с образованием водной суспензии почвенной смеси с водой. Соединение N 1 в таблице 1 40% Лигносульфонат натрия 10% Бентонитовая глина 1% Вода 49% Такой состав может быть использован для опрыскивания при разбавлении водой, а также его можно применять непосредственно для обработки семян. Пример 27. Увлажненная порошковая композиция получена смешиванием и измельчением ингредиентов до тех пор, пока они до конца не перемешаются. Соединение N 1 в таблице 1 25% Лаурилсульфат натрия 2% Лигносульфонат натрия 5% Двуокись кремния 25% Фарфоровая клина 43% Пример 28. Соединения были проверены в качестве средств против множества грибковых заболеваний листьев растений. Методика применения их для таких целей следующая. Растения были выращены на измельченных компостах (N 1 и 2) с диаметром миничастиц 4 см. Тестовое соединение было введено в композицию либо путем измельчения на шарики с Dispersol T, либо в виде раствора в ацетоне (или в смеси ацетон/этанол), который разбавляли до нужной концентрации непосредственно перед использованием. Для борьбы с поражениями листьев составы (100 ч/млн. активного ингредиента) применяли для опрыскивания листвы, а также для обработки корней растений в почве. Опрыскивание проводили до тех пор, пока на листьях еще удерживался раствор, а дозы для корневой обработки имели максимальную концентрацию, эквивалентную примерно 40 ч/млн. активного ингредиента в сухой почве. При опрыскивании хлебных злаков добавляли Твин 20, чтобы получить конечную концентрацию, равную 0,05% В большинстве тестов соединение применяли к корням в почве и к листьям (путем опрыскивания) за день или два до того, как заражали растения болезнями. Исключение составляли тест на Erysiphe graminis в котором растение заражали за 24 часа до обработки. Лиственные болезнетворные организмы вводили путем опрыскивания суспензиями их спор лиственного покрова тестовых растений. После заражения растения были помещены в подходящее для распространения инфекции окружение и затем инкубированы до тех пор, пока заражение не было готово для оценки. Период времени между заражением и оценкой варьировался от четырех до четырнадцати дней, в зависимости от болезни и окружения. Контроль заражения был проведен в соответствии со следующей градацией: 4 нет заражения 3 от следов до 5% заражения на необработанных растениях 3 6-25% заражения на необработанных растениях 1 26-59% заражения на необработанных растениях 0 60-100% заражения на необработанных растениях. Результаты приведены в таблице 3.
ФОРМУЛА ИЗОБРЕТЕНИЯПроизводные N-(пирид-5-ил)циклопропанкарбоксамида общей формулы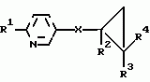 где R1 является галогеном или C1-C4-алкокси, R2 является водородом, галогеном или метилом, R3 и R4 являются независимо друг от друга водородом или галогеном при условии, что R2, R3 и R4 не могут одновременно являться водородом и при условии, что, когда R2 является метилом, то тогда по крайней мере один из R3 или R4 отличен от водорода, X является группой где R1 является галогеном или C1-C4-алкокси, R2 является водородом, галогеном или метилом, R3 и R4 являются независимо друг от друга водородом или галогеном при условии, что R2, R3 и R4 не могут одновременно являться водородом и при условии, что, когда R2 является метилом, то тогда по крайней мере один из R3 или R4 отличен от водорода, X является группой 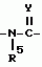 где R5 является водородом, (C1-C4)-алкилом, бензилом, (C2-C4)-алкенилом или (C2-C4)-алкинилом и У является кислородом и их стереоизомеры. 2. Производные по п.1, в которой R1 является фтором, хлором или метоксигруппой, R2 является фтором или бромом, когда R3 и R4 оба являются водородом, или R2 является метилом, когда R3 является водородом, фтором или хлором и R4 является фтором или хлором, X группа где R5 является водородом, (C1-C4)-алкилом, бензилом, (C2-C4)-алкенилом или (C2-C4)-алкинилом и У является кислородом и их стереоизомеры. 2. Производные по п.1, в которой R1 является фтором, хлором или метоксигруппой, R2 является фтором или бромом, когда R3 и R4 оба являются водородом, или R2 является метилом, когда R3 является водородом, фтором или хлором и R4 является фтором или хлором, X группа 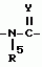 где R5 водород, (C1-C4)-алкил, бензил, (C2-C4)-алкенил или (C2-C4)-алкинил и Y кислород. 3. Производные или их стереоизомеры формулы по пп. 1 и 2, в которой R1 является фтором, хлором или метоксигруппой, R2 является фтором или бромом, когда R3 и R4 и оба являются водородом. 4. Производные или их стереоизомеры по п.1 общей формулы где R5 водород, (C1-C4)-алкил, бензил, (C2-C4)-алкенил или (C2-C4)-алкинил и Y кислород. 3. Производные или их стереоизомеры формулы по пп. 1 и 2, в которой R1 является фтором, хлором или метоксигруппой, R2 является фтором или бромом, когда R3 и R4 и оба являются водородом. 4. Производные или их стереоизомеры по п.1 общей формулы 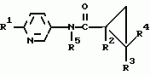 в которой R1 является фтором, хлором или метоксигруппой, R2 и R4 оба являются водородом и R3 является фтором, или R2 является водородом и R3 и R4 оба являются фтором, или R2 является фтором и R4 и R4 оба являются водородом, R5 является водородом, (C1-C4)-алкилом, бензилом, (C2-C4)-алкенилом или (C2-С4)-алкинилом. 5. Производные общей формулы по п.4, в которой R1 является метоксигруппой, R2 и R4 оба являются водородом и R3 является фтором, или R2 является водородом и R3 и R4 оба являются фтором, или R2 является фтором и R3 и R4 оба являются водородом, и R5 является водородом, метилом, бензилом, пропаргилом, аллилом или бут-2-ином. 6. Фунгицидная композиция, содержащая 0,0005-95 мас. производного N-(пирид-5-ил)циклопропанкарбоксамида в смеси с фунгицидно приемлемым носителем или разбавителем, отличающаяся тем, что она в качестве производного N-(пирид-5-ил)циклопропанкарбоксамида содержит соединения общей формулы по п.1. в которой R1 является фтором, хлором или метоксигруппой, R2 и R4 оба являются водородом и R3 является фтором, или R2 является водородом и R3 и R4 оба являются фтором, или R2 является фтором и R4 и R4 оба являются водородом, R5 является водородом, (C1-C4)-алкилом, бензилом, (C2-C4)-алкенилом или (C2-С4)-алкинилом. 5. Производные общей формулы по п.4, в которой R1 является метоксигруппой, R2 и R4 оба являются водородом и R3 является фтором, или R2 является водородом и R3 и R4 оба являются фтором, или R2 является фтором и R3 и R4 оба являются водородом, и R5 является водородом, метилом, бензилом, пропаргилом, аллилом или бут-2-ином. 6. Фунгицидная композиция, содержащая 0,0005-95 мас. производного N-(пирид-5-ил)циклопропанкарбоксамида в смеси с фунгицидно приемлемым носителем или разбавителем, отличающаяся тем, что она в качестве производного N-(пирид-5-ил)циклопропанкарбоксамида содержит соединения общей формулы по п.1.Популярные патенты: 2421965 Способ возделывания зерновых колосовых культур ... составляет 750-850 рублей на одну обработку. А аналогичная обработка метионином сокращает экономические затраты, при расходе 5 г/т семян или 5 г/га стоимость препарата составляет 100 рублей, что в 7-8 раз дешевле. Кроме того, использование антибиотических препаратов, таких как Фитолавин 300, отрицательно воздействует на полезную микрофлору агробиоценозов, а метионин совершенно безвреден (не изменяет сложившийся видовой состав микроорганизмов в экосистеме).Способ прошел испытания на базе Кубанского государственного аграрного университета и в Ростовской области (ЗАО «Аксайская земля») в 2008-2009 гг. Формула изобретения Способ возделывания зерновых колосовых ... 2197817 Поплавок для рыболовных удочек и снастей ... обеспечить высокой чувствительности поплавка, так как регулирование осуществляют только за счет увеличения веса поплавка, снижает его грузоподъемность. Поплавок имеет постоянный объем воздушной камеры, а частичное наполнение ее водой, увеличивая общий и удельный вес, снижает его плавучесть, уменьшая при этом чувствительность и видимость на поверхности воды. Шарообразная форма поплавка в высокой степени подвержена волновым колебаниям воды, что снижает возможность определения воздействия рыбы на наживку на крючке. Этот поплавок закрепляется на леске через две проушины и является несъемным с лески без полного разбора рыболовной снасти. При использовании предлагаемого поплавка может ... 2175189 Способ регенерации растений сорго в культуре in vitro ... 170 регенерантов против 31 по прототипу. Таким образом, приведенные данные и их анализ показывают, что среда M2 по предлагаемому способу с увеличенной концентрацией ионов NO3 - и NH4 + в сочетании с добавкой аминокислот (L-аспарагином и L-пролином) значительно усиливает рост ЭК сорго и его регенерационную способность, т.е. позволяет получать большую частоту культур с ЭК, его большую массу и большее количество растений-регенерантов по сравнению с прототипом и другими средами и может использоваться в прикладных и фундаментальных работах, связанных с получением больших количеств ЭК и растений-регенерантов у разных сортообразцов сорго. Формула изобретения 1. Способ регенерации ... 2200377 Сельскохозяйственный агрегат ... 8 вдоль бруса 5 (см. фиг. 9). Затем в случае необходимости, когда передний брус 5 имеет значительный вылет, трос 12 заводят за шарнир 18 и присоединяют с помощью крюка 13 к проушине 17 балласта 16. Вращением рукоятки 15 лебедки 11 перемещают балласт 16 к краю рамы плуга 1, создавая противовес переднему брусу 5 и уравновешивая изгибающий момент (см. фиг. 11). Далее передний брус 5, балласт 16 и подвижную втулку 8 фиксируют с помощью пальцев. После этого перемещают вертикальные стойки 21 и 22 вертикально вниз, устанавливая необходимую глубину боронования. Выбранную высоту стоек 21 и 22 фиксируют пальцами 28. Затем вращением распорного винта 9 производят натяжение цепного модуля 19. ... 2114107 Производные триазола, способ их получения и инсектоакарицидная композиция ... вредного воздействия на реакцию, которые включают, например, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан, диглим, или т. п.; ароматические углеводороды, такие как бензол, толуол, хлорбензол или т.п.; алифатические углеводороды, такие как пентан, гексан, петролейный эфир или т.п.; галоидированные углеводороды, такие как дихлорметан, дихлорэтан, хлороформ, четыреххлористый углерод, дихлорбензол или т.п.; апротонные полярные растворители, такие как N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид или т.п. и их смеси. Обычно количество используемого газообразного аммиака составляет 5,0-10,0 моль на 1 моль соединения общей формулы (VI). Температура ... |
Еще из этого раздела: 2048744 Устройство для регулирования температуры воздуха в теплице 2201244 Препарат для защиты животных и растений 2054249 Способ зимовки открытопузырных рыб 2397634 Жалюзийное решето 2130247 Замкнутый пневмосепаратор 2420949 Способ оценки потенциальной урожайности семянок сафлора красильного 2016512 Средство для борьбы против стресса у рыб и способ борьбы со стрессом у рыб 2236124 Способ создания местообитания и адаптации молоди объектов аквакультуры в водных экосистемах 2040900 Фунгицидное средство 2459398 Способ рекультивации почв, загрязненных минерализованными водами |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||