Раствор для хранения роговицыПатент на изобретение №: 2498570 Автор: Бикбов Мухаррам Мухтарамович (RU), Никитин Николай Александрович (RU), Суркова Валентина Константиновна (RU) Патентообладатель: Государственное бюджетное учреждение "Уфимский научно-исследовательский институт глазных болезней Академии наук Республики Башкортостан" (RU) Дата публикации: 20 Ноября, 2013 Начало действия патента: 3 Мая, 2012 Адрес для переписки: 450077, г.Уфа, ул. Пушкина, 90, Уфимский НИИ глазных болезней, патентный отдел Изображения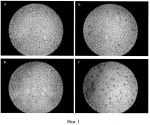 Изобретение относится к офтальмологии. Раствор для хранения роговицы содержит смесь биологических сред M199 и DMEM, хондроитина сульфат, L-аланил-L-глутамин, 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновую кислоту (HEPES), пируват натрия, Изобретение относится к области медицины, в частности к офтальмологии, и может быть использовано для длительного сохранения роговичного трансплантата, используемого для послойной и сквозной кератопластик. Кератопластика широко используется для восстановления зрения при дистрофических, дегенеративных и воспалительных процессах роговицы. Главной проблемой такого метода лечения является отсутствие оптимальных сред для сохранения жизнедеятельности клеточных элементов важной оптической оболочки глаза, какой является роговица. Среди сред, используемых для консервации, известна среда McCarey-Kaufman, включающая среду 199, буферный раствор HEPES 25 мМоль, декстран 40 кДа, и гентамицин [American journal of ophthalmology, vol.79, N 1, 1975, с.115-120]. Недостатками данной среды являются: отек стромы за счет падения энергетического потенциала эндотелия, определяющего жизнеспособность и трансплантабельность (через 72 ч), достаточно узкий профиль антибиотика, входящего в среду (гентамицин), а также отсутствие противогрибковой защиты. Известен раствор для консервации роговицы, содержащий HEPES буфер, 1%-ный раствор декстрана, ионы натрия, калия, магния в виде растворимых солей 1%-ного содержания, антибиотики широкого спектра действия в ед. активности, противогрибковые препараты в ед. активности, BSS раствор [заявка RU 2007101966, опубликована 27.07.2008]. Известен раствор для хранения роговицы, содержащий гиалуроновую кислоту с молекулярной массой от 50000 до 15000 Да и ее фармацевтически приемлемую соль в концентрации от 1 до 20 мг/мл, дополнительно может включать антибиотик из группы гентамицина, пенициллина G и стрептомицина, при этом хранение производят при температуре раствора 2-8°C [патент RU 2184448, 2002 г.]. Наиболее близким аналогом изобретения является среда для консервации роговицы глаза, созданная в России на базе МНТК "Микрохирургия глаза", Москва, содержащая базовые среды M199, F12 и DMEM в соотношении 1:1:2, хондроитин-сульфат - 2,7 мас.%, декстран-40-2,0 мас.%, антибиотик гентамицин-сульфат-0,00014 мас.%, антимикотик амфотерицин В - 0,00015 мас.% [патент RU 2069951, 1996 г.]. Максимальный срок хранения донорского материала при использовании данной среды составляет 6 суток. Недостатком данной среды является недостаточная осмолярность применяемого декстрана, обусловливающая развитие отека роговицы, и проявляющего в отношении эндотелиоцитов токсический эффект (Zhao M. et al., 2008). Задачей данного изобретения является разработка состава консервирующего раствора для продолжительного времени хранения донорских роговиц, предназначенных для сквозной, послойной и эндотелиальной кератопластик, в период между взятием и применением донорского материала. Технический результат при использовании изобретения - увеличение срока хранения роговицы за счет создания оптимальных для жизнеспособной роговицы условий хранения. Указанный технический результат достигается тем, что раствор для хранения роговицы, содержащий смесь биологических сред M199 и DMEM (таблица), хондроитина сульфат, L-аланил-L-глутамин, 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновую кислоту (HEPES), пируват натрия, гентамицина сульфат, амфотерицин В, согласно изобретению дополнительно содержит 2,3,5,7,8-пентагидрокси-6-этилнафталиндион-1,4 (эхинохром А) и гидроксиэтилкрахмал при следующем содержании компонентов, мас.%: среда M1990,64 среда DMEM0,447 гидроксиэтилкрахмал 5-10хондроитина сульфат 2,5эхинохром А 0,001-0,01L-аланил-L-глутамин 0,05425буфер HEPES0,5958 пируват натрия0,0055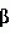 -гидроксибутират натрия0,151 гентамицина сульфат 0,01амфотерицин В 0,0000250дистиллированная вода до 100 -гидроксибутират натрия0,151 гентамицина сульфат 0,01амфотерицин В 0,0000250дистиллированная вода до 100Изобретение иллюстрируется фигурой, на которой представлена морфологическая картина при окраске трипановым синим и ализариновым красным: а) 3 сутки, б) 6 сутки, в) 9 сутки, г) 12 сутки. Изобретение основано на следующих предположениях: 1) в ходе хранения донорского материала при низкой температуре на фоне пониженной энергетической активности клеточного аппарата происходит апоптоз с образованием свободно-радикальных фрагментов, способствующих гибели близлежащих клеток. В ходе применения антиоксидантов вероятность цитолиза эндотелиоцитов значительно снижается; 2) сбалансированный раствор на базе поликомпонентных сред (таких как M199 и DMEM), дополненный осмолярным соединением, должен быть достаточным для поддержания натуральной формы роговицы. Такая среда является подходящей в отличие от других растворов, в которых содержится декстран. Увеличение срока хранения роговицы в предлагаемом растворе достигается за счет следующего: 1. С целью снижения риска повреждения клеточных структур радикалами, образующимися в ходе метаболизма, используется эхинохром А в концентрации 0,001-0,01% мас./объем. 2. Для повышения осмотического давления до значений водянистой влаги используется гидроксиэтилкрахмал 200/0,5, с молекулярной массой 200000 Да, в концентрации 5-10% мас./объем. Выбор компонентов консервирующего раствора основывается на моделировании физиологических условий хранения корнео-склерального лоскута. В результате создана среда, в которой жизнеспособность клеточных элементов роговицы удерживается в течение 10-12 дней хранения при температуре 2-6°C. Раствор для консервации роговицы производят в стерильных условиях (стерильный бокс и ламинарный поток воздуха на рабочем столе) с использованием стерильной посуды. Для приготовления 100 мл консервационного раствора в колбу с 80 мл дистиллированной воды насыпают сухую среду M199 в количестве 640 мг и DMEM - 447 мг (таблица)), После их полного растворения в раствор добавляют антибиотик гентамицин до конечной концентрации 10 мг и антимикотик амфотерицин В - 25 мкг. Далее в раствор насыпают 54,25 мг L-аланил-L-глутамина; 595,8 мг HEPES; 1-10 мг эхинохрома А; 5,5 мг пирувата натрия; 151 мг В стерильном боксе выкраивают корнеосклеральный лоскут общим диаметром 13,0-13,5 мм и помещают в герметичный флакон с 10 мл консерванта, который хранится в условиях глубокой гипотермии (4-6°C) сроком до 10-12 суток. Роговичные лоскуты в данном поликомпонентном растворе сохраняют жизнеспособность клеток и тканевую структуру на весь срок консервации. Это обеспечивает высокие оптические и трансплантационные свойства донорского материала, как для сквозной, так и для послойной кератопластики. Использование данной среды позволяет создать региональный банк корнеосклеральных лоскутов на базе ГБУ "Уфимский НИИ глазных болезней АН РБ". Использование материала, консервированного в данной среде, позволяет проводить экстренные и плановые кератопластики после предварительного тестирования донорского материала на HIV, HBV, HCV и Treponema pallidum. Пример. 1. Донор мужского пола Р., 47 лет, скончался на фоне острого инфаркта миокарда. Через 14 часов после смерти, в морге изъяты глазные яблоки, которые в стерильных условиях при t=6-8°C доставлены в ГБУ "Уф НИИ ГБ АН РБ"; параллельно в лабораторию для исключения инфекционного поражения донорского материала на анализ вышеуказанных инфекций отправлена венозная кровь. Обработку донорского материала проводили в 3 этапа: 1) ополаскивание глазного яблока в 0,5% растворе поливинилпиролидона йодина (PVP-I), растворенного в дистилированной воде с добавлением гидроксида натрия (NaOH) до рН=5,0-6,3; 2) ополаскивание в растворе 1% тиосульфата натрия (0,08-1,2%), растворенного в физиологическом растворе; 3) ополаскивание в физиологическом растворе. Вырезание корнеосклерального лоскута проводилось в стерильных условиях стерильными инструментами с соблюдением правил асептики. Далее на эндотелиальном микроскопе Konan KeratoAnalyzer ЕКА-10 проводили оценку плотности клеток эндотелиального слоя. Результаты анализа показали, что плотность клеток составляет 3200 кл./мм2. Для объективной оценки качества хранения проводилось морфологическое исследование эндотелиоцитов в различные сроки хранения. Для этого применен метод M.J. Taylor and C.J. Hunt (1981), основанный на использовании трипанового синего и ализаринового красного (фигура 1).Как видно из фигуры, на третьи сутки морфологическая структура эндотелия полностью сохранена; на 6 сутки отмечается небольшое расширение границ между несколькими клетками и появление единичных погибших клеток (прокрашены красным в верхнем секторе); на 9 сутки визуализируется укрупнение ряда клеток ввиду их слияния с близлежащими; на 12 сутки отмечается нарушение межклеточного контакта (красные точки на углах клеток), появление как разрушающихся (ядро прокрашено синим), так и погибших клеток. Неорганические солиг %  L-Серин3,0(6)·10 -3NaHCO3 0,22L-Треонин 5,17(3)·10-3CaCl 2 (безводный)2·10-2 L-Триптофан1,2·10 -3MgSO4 (безводный) 9,77·10-3 L-Тирозин·2Na·2H2O 7,326(3)·10-3KCI 4·10-2 L-Валин4,78(6)·10-3 NaCl0,(6) Аланил-глутамин5,425·10 -2NaH2PO 4 (безводный)1,35·10-2 Витаминыг % FeSO4·7H2O 3,3·10-5 р-амино-бензойная кислота3,(3)·10 -3Fe(NO3) 3·9H2O3,(3)·10 -9CH3COONa·3H 2O5,528(6)·10-3 Аскорбиновая кисота3,(3)·10 -6NaHSO4·H 2O1,0(6)·10-6 D-Биотин6,(6)·10 -3Аминокислоты г %Кальциферол6,(6)·10 -6L-Алании 1,(6)·10-3Холин лорид 1,(6)·10-4 L-Аргинин·HCl7,4(6)·10-3 Фолиевая кислота1,34·10 -4L-Аспарагиновая кислота 2·10-3 Менадин1,0(6)·10-6 L-Цистеин·HCl·моногидрат 6,(6)·10-6 мио-Инозитол2,3(6)·10-4 L-Цистин-2HCl 3,819·10-3Никотинамид 1,35·10-4 L-Глутаминовая кислота5,0·10-3 Никотиновая кислота 1,(6)·10-6Глицин 4,(3)·10-3 D-Пантеноновая кислота·1/2Са 1,34·10-4L-Гистидин·HCl·моногидрат 2,8(6)·10-3 Пиридоксал·HCl1,(6)·10-6 Гидрокси-L-пролин 6,(6)·10-4Пиридоксин·HCl 1,35·10-4 L-Изолейцин6,16·10-3 Ретинола ацетат9,(3)·10 -6L-Лейцин 4·10-3Рибофлавин 1,4·10-5L-Лизин-HCl 9,54·10-3 Тиамин·HCl1,34·10-4 L-Метионин 2·10-3DL- L-Серин3,0(6)·10 -3NaHCO3 0,22L-Треонин 5,17(3)·10-3CaCl 2 (безводный)2·10-2 L-Триптофан1,2·10 -3MgSO4 (безводный) 9,77·10-3 L-Тирозин·2Na·2H2O 7,326(3)·10-3KCI 4·10-2 L-Валин4,78(6)·10-3 NaCl0,(6) Аланил-глутамин5,425·10 -2NaH2PO 4 (безводный)1,35·10-2 Витаминыг % FeSO4·7H2O 3,3·10-5 р-амино-бензойная кислота3,(3)·10 -3Fe(NO3) 3·9H2O3,(3)·10 -9CH3COONa·3H 2O5,528(6)·10-3 Аскорбиновая кисота3,(3)·10 -6NaHSO4·H 2O1,0(6)·10-6 D-Биотин6,(6)·10 -3Аминокислоты г %Кальциферол6,(6)·10 -6L-Алании 1,(6)·10-3Холин лорид 1,(6)·10-4 L-Аргинин·HCl7,4(6)·10-3 Фолиевая кислота1,34·10 -4L-Аспарагиновая кислота 2·10-3 Менадин1,0(6)·10-6 L-Цистеин·HCl·моногидрат 6,(6)·10-6 мио-Инозитол2,3(6)·10-4 L-Цистин-2HCl 3,819·10-3Никотинамид 1,35·10-4 L-Глутаминовая кислота5,0·10-3 Никотиновая кислота 1,(6)·10-6Глицин 4,(3)·10-3 D-Пантеноновая кислота·1/2Са 1,34·10-4L-Гистидин·HCl·моногидрат 2,8(6)·10-3 Пиридоксал·HCl1,(6)·10-6 Гидрокси-L-пролин 6,(6)·10-4Пиридоксин·HCl 1,35·10-4 L-Изолейцин6,16·10-3 Ретинола ацетат9,(3)·10 -6L-Лейцин 4·10-3Рибофлавин 1,4·10-5L-Лизин-HCl 9,54·10-3 Тиамин·HCl1,34·10-4 L-Метионин 2·10-3DL-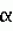 -Токоферола 6,(6)10-6 L-Фенилаланин 3,8(6)·10-3фосфат·2Na -Токоферола 6,(6)10-6 L-Фенилаланин 3,8(6)·10-3фосфат·2Na  L-Пролин 2,(6)·10-3Прочие г %D-Глюкоза 0,1 L-Пролин 2,(6)·10-3Прочие г %D-Глюкоза 0,1 Гуанин·HCl 2·10-5Рибоза 3,(3)·10-5 Гипоксантин2,2(6)·10-3 Гуанин·HCl 2·10-5Рибоза 3,(3)·10-5 Гипоксантин2,2(6)·10-3 s2-DT-окси-D-рибоза 3,(3)·10-5 Фенол красный-Na1,(3)·10-3 Аденина сульфат 6,(6)·10-4Пировиноградная кислота-Na3,(6)·10-3 Аденозина трифосфат·2Na 6,(6)·10-5Тимин 2·10-5Аденозина монофосфат·Na1,(3)·10-5 Твин 801,(3)·10 -3Холестерол 1,(3)·10-5Урацил 2·10-5Глутатион (восстановленный)3,(3)·10-6 Ксантин2,0(6)·10 -5 s2-DT-окси-D-рибоза 3,(3)·10-5 Фенол красный-Na1,(3)·10-3 Аденина сульфат 6,(6)·10-4Пировиноградная кислота-Na3,(6)·10-3 Аденозина трифосфат·2Na 6,(6)·10-5Тимин 2·10-5Аденозина монофосфат·Na1,(3)·10-5 Твин 801,(3)·10 -3Холестерол 1,(3)·10-5Урацил 2·10-5Глутатион (восстановленный)3,(3)·10-6 Ксантин2,0(6)·10 -5
Формула изобретенияРаствор для хранения роговицы, содержащий смесь биологических сред M199 и DMEM, хондроитина сульфат, L-аланил-L-глутамин, 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновую кислоту (HEPES), пируват натрия, 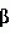 -гидроксибутират натрия0,151 гентамицина сульфат 0,01амфотерицин В 0,0000250дистиллированная вода до 100 -гидроксибутират натрия0,151 гентамицина сульфат 0,01амфотерицин В 0,0000250дистиллированная вода до 100Популярные патенты: 2159721 Способ и устройство для крепления двигателя мотокультиватора ... фиксации положения в корпусе двигателя установлен штифт 15, а в опорном элементе выполнено соответствующее под него отверстие 16. В опорном элементе выполнены попарно расположенные по окружности фиксирующие выступы 17 с впадинами 18 и разнесенные по радиусу с шагом, обеспечивающим поворот руля в ту или иную сторону на оптимальный угол в 30o, не вызывая при этом изменения в прикладываемом при работе усилии на руль. В опорном элементе имеется также кольцевая внутренняя проточка 19 (фиг. 5) с радиальным углом , равным радиальному углу выступов 17, для фиксации угла поворота руля. Хомут имеет соответственно выступам двигателя радиальные окна 20, расположенные друг от друга под углом ... 2496309 Зубчатое устройство для вычесывания домашних животных с механизмом выброса шерсти ... содержит зубчатую часть, ручку и выбрасывающую шерсть часть. Зубчатая часть содержит множество зубцов, размещенных в ряд, и множество граничных сегментов. Зазор существует между каждой соседней парой зубцов. Выбрасывающая шерсть часть содержит кромку, которая может перемещаться между первым положением и вторым положением относительно зубчатой части. Способ также содержит шаг продвижения зубцов зубчатой части относительно меха домашнего животного с приложением внешнего усилия к ручке в то время, когда выбрасывающая шерсть часть находится в первом положении. Продвижение ведет к попаданию части выпавшей шерсти меха домашнего животного в зазоры между зубцами зубчатой части и ... 2115638 Способ переработки органических отходов животного происхождения в кормовой белок и биогумус ... и животного происхождения, в биогумус. Известный способ включает приготовление субстрата путем смешивания компонентов, одним из которых являются отходы животного происхождения - навоз и птичий помет, внесение в него червей и/или их коконов, укладку субстрата в емкость и компостирование при влажности 65 - 80% с последующим отделением червей от полученного биогумуса. Плотность заселения компостной массы червями составляет 15-25 тыс. особей на 1 м2 (патент РФ 2057743, кл. C 05 F 3/06, опубл. 10.04.96). Недостатками известного способа являются сезонность переработки, низкая плотность червей в субстрате, сложность получения гумуса заданного состава, трудности при отделении от ... 2150193 Установка для бесфреонового охлаждения молока ... Зеликовский И.А., Каплан Л.Г. Малые холодильные машины и установки. М.: Пищевая промышленность, 1979). Недостатком этой установки, как и других фреоновых холодильных установок, являются большие затраты энергии на охлаждение молока, так как отвод тепла от молока происходит через две металлические стенки: в молочной ванне и во фреоновом испарителе. Кроме того, фреоны нарушают экологический баланс в природе, разрушают атмосферный озон и подлежат запрету международными соглашениями. Известна установка для бесфреонового охлаждения молока, содержащая резервуар для молока, вакуумную емкость, линию дросселирования с терморегулирующим вентилем, насос высокого вакуума, насос низкого ... 2141196 Способ получения растений с комплексной устойчивостью к фитостеринзависимым вредителям ... селекции, которая занимает от 5 до 8 лет, а также позволяет получать сразу необходимое число растений для воспроизводства посадочного материала. Этот результат достигается тем, что получение растений с комплексной устойчивостью к фитостеринзависимым вредителям, основанное на клеточной селекции и отличающееся тем, что селекцию проводят на уровне микрокаллусов, получаемых из протопластов известным методом (4), которые выращивают на первичной питательной среде, содержащей агар, макро и микросоли, сахарозу, добавки фитогормонов ауксина и цитокинина при температуре и длине светового дня, соответствующим активному делению клеток до формирования микрокаллуса, после чего микрокаллусы ... |
Еще из этого раздела: 2235450 Малогабаритная машина для обескрыливания, очистки и сортирования лесных семян 2415570 Искусственное роение и борьба с естественным роением пчелиных семей 2234219 Композиция для отпугивания паразитов 2181542 Способ хранения эритроцитов в условиях охлаждения при отсутствии кислорода (варианты) 2055465 Система приготовления и подачи питательного раствора в теплице 2185045 Способ посева, устройство для его осуществления и семявысевающий аппарат конструкции ибрагимова 2488422 Сеть фильтров 2256318 Инъектор для капельного орошения 2076594 Установка для промышленного разведения дождевых червей 2197796 Рабочий орган ручного почвообрабатывающего орудия |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||