Штамм trichoderma harzianum rifai - продуцент ингибитора вируса кольцевой пятнистости табака (tobacco ringspot virus)Патент на изобретение №: 2475528 Автор: Смирнова Ирина Павловна (RU), Шнейдер Юрий Андреевич (RU) Патентообладатель: Государственное образовательное учреждение высшего профессионального образования "Российский университет дружбы народов" (РУДН) (RU) Дата публикации: 27 Сентября, 2012 Начало действия патента: 24 Марта, 2011 Адрес для переписки: 117198, Москва, ГСП, ул. Миклухо-Маклая, 6, РУДН, отдел интеллектуальной собственности Изобретение относится к биотехнологии. Штамм Trichoderma harzianum Rifai, обладающий L-лизин-альфа-оксидазной активностью, депонирован во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) под регистрационным номером ВКПМ F-180 и может быть использован в агробиотехнологии и растениеводстве. Изобретение позволяет снизить потери декоративных и овощных культур. 1 табл., 2 пр. Изобретение относится к биохимии и может найти применение в агробиотехнологии, микробиологии и растениеводстве. Известен ингибитор вируса герпеса простого 1-го типа [1], известен ингибитор вируса иммунодефицита человека [2]. В качестве ингибитора использовался метаболит штамма Trichoderma harzianum Rifai - гомогенный фермент L-лизин- Вирус кольцевой пятнистости табака (TRSV) является фитопатогенным вирусом и относится к семейству Неповирусов (Nepoviruses), которые передаются от растения к растению с помощью нематоды Xiphinema americanum и других нематод рода Xiphinema [3, 4]. TRSV также легко передаются с помощью сока, при прививке, а также есть сведения о передаче через семена. TRSV был впервые обнаружен на табачных плантациях в штате Виржиния и описан в 1927 году. Вирус имеет широкий спектр растений хозяев, в который входят полевые сельскохозяйственные культуры, декоративные растения и сорняки. Наибольшие потери наблюдаются на сое (Glycine max), винограде (Vitis vinifera) и чернике (Vaccinium corymbosum), а также табаке (Nicotiana tabacum) и на ряде декоративных и тыквенных культур. Вирус встречается в природе, как на однолетних, так и на многолетних культурах. К растениям хозяевам этого вируса, помимо вышеперечисленных растений, относятся яблоня домашняя (Malus domestica), черешня (Prunus avium), кизил (Cornus), баклажан (Solanum melongena), томат (Lycopersicon esculentum), перец (Capsicum), огурец (Cucumis sativus), фасоль (Phaseolus vulgaris), анемона (Anemone), гладиолус (Gladiolus), ирис (Iris), пеларгония (Pelargonium), петуния (Petunia). Название вируса происходит от того, что его самым распространенным симптомом являются хлоротические кольцевые пятна на листьях инфицированного растения [5]. Вирус является эндемическим заболеванием в странах центральной и восточной части Северной Америки, от южной части провинции Онтарио в Канаде и долины Рио-Гранде в Техасе. Распространение зараженных растений произошло с помощью саженцев. Кроме того, вирус был выделен из различных видов растений в других частях мира, в том числе гладиолуса в Японии и Австралии, ириса в Нидерландах, петунии, стручкового перца, баклажана и сои в Индии, папайи в Нигерии, сои и люпина в бывшем СССР и бахчевых в Иране. Естественная передача TRSV ограничивается странами Америки, и не было доказано естественного распространения на другие континенты [3, 4]. Техническим результатом изобретения является снижение потерь декоративных и овощных культур, вызванных вирусом кольцевой пятнистости табака Tobacco ringspot virus. Технический результат достигается тем, что штамм Trichoderma harzianum Rifai является продуцентом ингибитора вируса кольцевой пятнистости табака (Tobacco ringspot virus). Штамм депонирован во Всероссийской коллекции промышленных микроорганизмов под Морфолого-биохимическая характеристика штамма Штамм Trichoderma harzianum Rifai на среде сусло-агар образует колонии быстрорастущие. Мицелий гриба бесцветный, септированный, распростертый. На 4-е - 5-е сутки роста появляются дерновинки с конидиеносцами, подушковидные, сначала белые, со временем желто или темно-зеленого цвета. Фиалиды бутыльчатые /9-12µ/ расположены мутовками по 3 и более. На каждой фиалиде образуются конидии, склеенные в головку. Конидии гриба округлые, гладкие, мелкие /3-5 µ/, в проходящем свете бледно-зеленые, а в массе - темные. На агаризованной среде Чапека колонии штамма-продуцента быстрорастущие, но слабо спороносящие. Штамм хорошо растет на среде Чапека, однако лучший рост наблюдается на среде сусло-агаре. Агар и желатину не разжижает, молоко не пептонизирует. Аэробный гриб. Температурный оптимум +28-+29°C. На картофельно-декстрозном агаре наблюдается снижение интенсивности роста, образование воздушного мицелия и спороношения. Оптимальные условия роста гриба при pH 4-6, однако, может расти и при pH от 1,5 до 9. Trichoderma harziatum Rifai в одинаковой степени усваивает как аммонийные, так и азотнокислые соли. Лучшим источником азота из органических соединений является пептон. Хорошо растет на средах с аспарагином и с глутаминовой кислотой. Лучшими источниками углерода являются ксилоза, глюкоза, сахароза, лактоза, галактоза, маннит, крахмал. На средах с этими сахарами наблюдается интенсивный рост. Слабо усваиваются спирты метиловый, этиловый, дульцит. Хорошо усваивает в качестве источника углерода пшеничные отруби. Инокулят гриба, выросший на среде с пшеничными отрубями, дает положительный результат при использовании его при ферментации на средах разного состава. Штамм Trichoderma harzianum Rifai обладает L-лизин- Сущность метода заключается во взаимодействии всей образующейся в реакции H2O2 с О-дианизидингидрохлоридом. Инкубационная смесь содержала 20 мкг пероксидазы, 250 мкг О-дианизидингидрохлорида и 0,1-0,5 мг белка в 1 мл конечного объема. После 20 мин инкубирования в термостате при температуре 37°C пробы охлаждали до 4°C. Оптическую плотность окрашенных растворов опытной и контрольной (без субстрата) проб измеряли на спектрофотометре СФ-16 при 540 нм против второй контрольной пробы (без пероксидазы). Для построения калибровочной кривой молярность свежеприготовленного раствора H2O2 определяли перманганатометрией. Субстратами служили L и DL-формы аминокислот («Reanal», Венгрия). Применяли 0,05 М фосфатный буфер. В качестве катализатора пероксидазной реакции использовали пероксидазу фирмы «Reanal», а в качестве донора протонов - О-дианизидингидрохлорид («Merck», ФРГ). За единицу активности принимали количество фермента, катализирующего образование 1 мкмоль H2O2 за 1 мин при температуре 37°C. Удельную активность фермента выражали числом единиц активности на 1 мг белка или 1 мл культуральной жидкости. Белок определяли по методу Лоури. В качестве стандарта использовали 0,05%-ный раствор кристаллического бычьего альбумина («Reanal», Венгрия). Для оценки чистоты препарата использовали электрофорез в 10% ПААГ в присутствии додецилсульфата натрия, а также капиллярный электрофорез на установке "Капель 105" производства фирмы Люмекс (Санкт-Петербург). Получение КЛО (концентрат неочищенного фермента L-лизин- Посевной материал (косяки с культурой триходермы) выращивают на среде сусло-агар в течение 14 суток в термостате при температуре +28°C. С целью получения инокулята для глубинного культивирования используют среду с пшеничными отрубями, имеющую следующий состав: пшеничные отруби - 20, NaNO3 - 11,4%, раствор - 1,4 мл, H2O - 10 мл. Инокулят выращивают в термостате при температуре +28°C в течение 12-14 суток и используют для посева на ферментационную среду. Ферментацию триходермы проводят в колбах на 250 мл на термостатированном встряхивателе типа 357 (ПНР) при температуре +28°C в течение 5 суток, амплитуда Ферментационная среда имеет следующий состав: пшеничные отруби - 5 г, NaNO 3 - 0,9 г; H2O - до 100 мл, начальный pH среды - 5,5-6,0. Количество инокулята, выросшего на твердой среде с пшеничными отрубями, составляло 0,5-1 г от всего количества. Модифицированная среда включала (с целью повышения активности фермента) 1% стерильной культуральной жидкости продуцента лизина - Brevibacterium sp. (биостимулятора) перед ферментацией триходермы. Среда для продуцента лизина - бактерии Brevibacterium sp. имела состав (в г на 100 мл среды): 1. Меласса - 12 г 2. Кукурузный экстракт - 1 г 3. NH4Cl - 0,5 г 4. (NH4)2HPO4 - 0,1 г 5. (NH4)2SO4 - 1 г 6. Мел - 2 г 7. pH - 7,4-7,6. Выращивание бактериального стимулятора происходило в течение 72 часов при температуре +28°-+32°C. Полученную культуральную жидкость, которая имела активность, превышающую исходную в 2,5 раза (таблица), использовали для получения КЛО. Активность L-лизин-  -оксидазная активность Trichoderma harziatum Rifai в присутствии продуктов метаболизма бактериального происхождения (8-е сутки роста). Без стимулятора (контроль) С биостимулятором (Brevibacterium sp.) Удельная активность, Ед/мг Удельная активность, Ед/мг 3,08,3 -оксидазная активность Trichoderma harziatum Rifai в присутствии продуктов метаболизма бактериального происхождения (8-е сутки роста). Без стимулятора (контроль) С биостимулятором (Brevibacterium sp.) Удельная активность, Ед/мг Удельная активность, Ед/мг 3,08,3 Условия культивирования штамма Trichoderma harzianum Rifai Ферментация штамма производилась на оборудовании Опытной технологической установки ИБФМ РАН им. Г.К.Скрябина (г.Пущино). Использовали ферментер типа БИОР-01 производства ОКБ ТБМ, г.Кириши, объемом 100 л с коэффициентом заполнения 0,6. Ферментер оснащен магнитной мешалкой, фильтрами тонкой очистки воздуха, датчиками температуры и pH. Питательную среду готовили непосредственно в аппарате. Для этого в аппарат заливали 60 л водопроводной воды, вносили 1% пшеничных отрубей, стимулятор - 0,1%, 1,3% сульфата аммония, значение pH 5,8-6,0 устанавливали 10% раствором HCl. Пшеничные отруби и стимулятор предварительно замачивали в 10 литрах воды в течение 4-х часов, стерилизовали в автоклаве 1 час при температуре +125°C. Затем подготовленный ферментер засевали посевным материалом из колб. Посевная доза не менее 5%. Культивирование проводили при температуре +26°C, расход воздуха на протяжении всей ферментации 30 л / мин, скорость вращения мешалки 200 об/мин. Величину pH в процессе роста корректировали до 6,5. Продолжительность выращивания составила 94-98 часов, конечные значения pH от 5,3 до 7,5. По окончании ферментации культуральную жидкость направляли на участок предварительной очистки, где мицелий гриба отделяли фильтрованием под вакуумом на нутч-фильтре. Вес полученной биомассы составил 3,5 кг. Полученный нативный раствор подвергали дополнительному сепарированию на сепараторе типа ОСБ при 9000 об/мин в течение часа при температуре +2-+4°C. Затем нативный раствор в объеме 55 л, полученный после отделения биомассы, концентрировали до 1,5 л (КЛО). Рибонуклеиновую кислоту (РНК) вируса кольцевой пятнистости табака выделяли из декоративного горшечного растения бальзамина (лат.ImpatiensL) семейства Balsaminaceae. Производили замораживание при t° минус 20°C растительных образцов (листья декоративной культуры - бальзамин). Затем образцы растирали в фарфоровой ступке до гомогенного состояния с добавлением лизирующего буфера из набора «Проба НК» фирма ООО «Агродиагностика». Из предварительно приготовленных образцов выделяли РНК с использованием наборов «Проба НК» фирмы ООО «Агродиагностика» по протоколу из набора. Для постановки обратной транскрипции (ОТ) в пробирки была добавлена следующая смесь для ОТ: ОТ-буфер AMV фирмы «Promega» (250 mM Трис-HCl, 250 mM KCl, 50 mM MgCl2, 2,5 mM spermidine, 50 mM DTT) - 5 µ1, смесь дНТФ фирмы ЗАО «Диалат ЛТД» (дА, дТ, дГ, дЦ - по 200 µM каждого) - 2,5 µl, РНазин - 40 ед. (1 µl), ревертаза AMV фирмы «Promega» (10 U/µl) - 3 µl, вода до общего объема 20 µl, РНК образца - 5 µl. Реакция обратной транскрипции (процесс образования двуцепочечной ДНК на матрице одноцепочечной РНК) происходил при температуре +42°C в течение 1 часа, при температуре +95°C - 5 мин. На этапе обратной транскрипции к выделенной и очищенной РНК вируса кольцевой пятнистости табака был добавлен концентрат культуральной жидкости в разных разведениях (от 1 до 0,05 Ед/мл). Далее для реакции амплификации готовили следующую смесь: 10×MagMIX - 2025 фирмы ЗАО «Диалат-ЛТД» - 2,5 µl на образец, праймеры TRSV прямые (F) и обратные (R) - по 2 µl (10 pmol/µl) на образец, кДНК - 5 µl, вода до 25 µl, минеральное масло. В результате выделена комплементарная-дезоксирибонуклеиновая кислота (кДНК). Для получения продуктов реакции (ампликонов) проводили нагревание смеси по следующей схеме: один цикл при температуре +96°C в течение 15 мин, 35 циклов при температуре +95°C в течение 30 с, при температуре +60°C в течение 30 с и при температуре +72°C в течение 30 с; один цикл при температуре +72°C в течение 10 мин. Хранение осуществляли при температуре +4°C. Полученные ампликоны (многократно увеличенное число копий изучаемого участка кДНК) вносили в 1,5% агарозный гель, после чего получали электрофореграммы и оценивали полученные результаты. Пример 1 После проведения обратной транскрипции к образцам выделенной кДНК был добавлен фермент в концентрациях 1 Ед/мл и 2,5 Ед/мл. Также был взят контрольный образец кДНК, в который не был добавлен фермент. На электрофореграмме наличие светлой полосы в контрольном образце свидетельствовало о сохранении вируса, отсутствие полосы означало его разрушение. При концентрации 1 Ед/мл и более кДНК вируса разрушается, при этом не наблюдается образования светлой полосы. Пример 2 После проведения обратной транскрипции к образцам выделенной кДНК был добавлен фермент в разных концентрациях (1, 0,5, 0,25, 0,1, 0,05 Ед/мл). Также был взят контрольный образец кДНК без добавления фермента. На электрофореграмме наличие светлой полосы в контрольном образце свидетельствовало о сохранении вируса, отсутствие полосы, означало его разрушение. При концентрации более 0,25 Ед/мл кДНК вируса разрушалось, при этом не наблюдалось образования темной полосы. При большем разведении фермента вирусная кДНК сохраняется и наблюдается светлая полоса, которая усиливается при уменьшении концентрации фермента. Источники информации 1. Ингибитор вируса герпеса простого I-го типа. Патент РФ 2. Ингибитор вируса иммунодефицита человека. Патент РФ 3. Brown, D. J. F., and Boag, В. 1988. An examination of methods used to extract virus-vector nematodes (Nematoda: Longidoridae and Trichodoridae) from soil samples. Nematol. Mediterr. 16:93-99. 4. Brown, D. J. F., and Halbrendt, J. M. 1992. The virus vector potential of Xiphinema americanum and related species. (Abstr.) J. Nematol. 24:584. 5. Смирнова И.П., Алексеев С.Б. Биосинтез противоопухолевого фермента L-лизин- Формула изобретенияШтамм Trichoderma harzianum Rifai - продуцент ингибитора вируса кольцевой пятнистости табака (Tobacco ringspot virus) депонирован во Всероссийской коллекции промышленных микроорганизмов под Популярные патенты: 2236122 Устройство для содержания животных ... высоты бурта (1,5 м) раструб 52, а из помещения 9 - посредством параллельно соединенных к коллектору 45 воздуховодов 23 через патрубки 24 с перфорацией, размещенных специально на уровне немного выше подстилки. При этом перфорация в патрубках 24 обеспечивает равномерный отсос газов и воздуха с поверхности формируемого для ферментации навоза. Воздушно-газовые потоки вентилятором 46 подаются в коробчатые ассимиляторы 47, внутри которых распыляется форсункой-распылителем вода из водопровода 48. Пары воды ведут к ассимиляции газа, который в виде углекислоты и аммиачной воды собирается на скошенном дне ассимиляторов 47, откуда под напором воздуха через патрубки 49 перетекают в сборную ... 2427999 Способ повышения плодородия мерзлотных засоленных почв в условиях криолитзоны ... почв Якутии в 1912-1929 гг. (К.К.Никифоров, Р.И.Аболин, Г.И.Доленко, К.Д.Глинка, Г.Н.Огнев, Красюк). Е.И.Цыпленкин и др. (1941) влияние многолетней мерзлоты понимали шире, включая биологические, химические и физические аспекты почвообразования и их воздействия на возделываемые сельскохозяйственные культуры. Образование в средней части почвы пересушенного горизонта они объясняли конденсирующим действием мерзлоты, которая благодаря низким температурам притягивает к себе капиллярную и парообразную воду, разрывая этим капиллярную связь с вышележащим увлажненным горизонтом.В.Г.Зольников (1954) действие многолетней мерзлоты на процесс почвообразования связывал с ограничением ... 2421109 Способ роспуска закристаллизовавшегося меда и устройство для его осуществления ... массы меда с обеспечением получения быстро обнажающихся слоев меда, а также возможности дальнейшего его разогрева без опасного для качества меда перегрева и разжижения массы меда для его стекания. Устройство для роспуска закристаллизовавшегося меда содержит станину, на которой размещены приспособление для фиксирования емкости с медом в наклонно-опрокинутом положении и блок СВЧ-генератора с излучателем в виде круглого волновода. Круглый волновод излучателя СВЧ-генератора выполнен в виде короткозамкнутого отрезка многомодового волновода, обеспечивающего колебания энергии, которые не имеют продольной составляющей по поверхности волновода. При этом открытый конец волновода ... 2169462 Улей (варианты), способ его сборки и способ круглогодичного содержания в нем пчел ... ... 2043709 Система управления работой форсунки разбрызгивателя ... контактной площадки самоотвода в исходное положение моторедуктора при отключении реле 22 запуска, зона 29 торможения моторедуктора для закорачивания обмотки двигателя (безынерционный останов), при включенном реле 22 зона игнорируется, исходное положение 30, подвижный контакт 31 концевого переключателя, жестко закрепленными на оси моторедуктора, ось (вал) 32 моторедуктора. Назначение вывода модулей. Синтезатор временных интервалов: А1, А2 подключение резистора коррекции времени начала дозы (Тдп от исходного положения концевика). А3,А4 регулировка длительности подачи дозы (или работы форсунки). А4,А5 регулиpовка длительности паузы между включениями моторедуктора. А6 выход импульса ... |
Еще из этого раздела: 2395497 Способ стимулирования роста подсолнечника регулятором роста 2028749 Капустоуборочная машина 2310308 Способ определения выполненности семян сельскохозяйственных культур и устройство для его осуществления 2492650 Микроэмульсионная бактерицидная композиция 2444885 Посевной агрегат 2175477 Способ борьбы с тлями 2088063 Широкозахватный сельскохозяйственный агрегат 2500104 Способ приготовления препарата костной ткани и набор для его осуществления 2438305 Способ выращивания цыплят-бройлеров 2083070 Способ предпосевной обработки семян и устройство для его осуществления |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
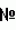 F-180 (Москва, Дорожный 1-й проезд, д.1, ФГУПГосНИИгенетики, 1982 г.).
F-180 (Москва, Дорожный 1-й проезд, д.1, ФГУПГосНИИгенетики, 1982 г.).