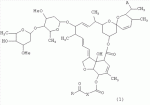
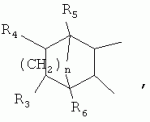
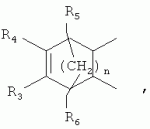
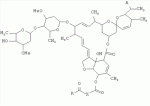
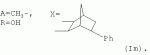
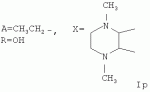
5-о-производные авермектина, способ их получения и антипаразитарные средства на их основеПатент на изобретение №: 2472801 Автор: Заварзин Игорь Викторович (RU), Джафаров Мамед Хангусейнович (RU), Колобов Алексей Владиславович (RU), Чернобурова Елена Ивановна (RU), Бобова Татьяна Александровна (RU) Патентообладатель: Заварзин Игорь Викторович (RU), Джафаров Мамед Хангусейнович (RU), Колобов Алексей Владиславович (RU), Чернобурова Елена Ивановна (RU), Бобова Татьяна Александровна (RU) Дата публикации: 20 Января, 2013 Начало действия патента: 11 Мая, 2011 Адрес для переписки: 119991, Москва, Ленинский пр-кт, 47, ИОХ РАН, патентный отдел, Г.Н. Капустиной Изобретение относится к неизвестным ранее 5-O-производным авермектина общей формулы I: где: А=Ме или Et, R=OH, OAlk или NR 1R2, где: R1, R2=H,Alk, X=-(CH2)n-, где: n=2-12,
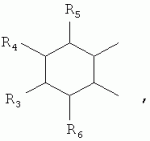
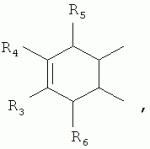
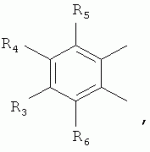
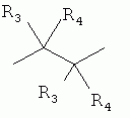
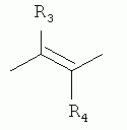
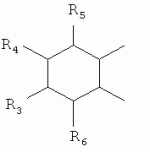
где: R3, R4, R 5, R6=Н, Alk, Ph или Наl; n=1-5; или Х представляет собой гетероциклический фрагмент. Изобретение также относится к способу получения указанных соединений. Технический результат - получение новых соединений, которые проявляют антипаразитарную активность и могут быть использованы в качестве антипразитарных средств в медицине, ветеринарии, а также в сельскохозяйственной, рыбной промышленности и в других областях, связанных с разведением животных, в качестве антипаразитарных средств. 3 н. и 3 з.п. ф-лы, 1 табл., 27 пр. Изобретение относится к области химии макролидов, а именно к неизвестным ранее 5-O-производным авермектина, обладающим антипаразитарной активностью, способу их получения и антипаразитарным средствам на их основе, которые могут найти применение в медицине, ветеринарии, а также в сельскохозяйственной, рыбной промышленности и в других областях, связанных с разведением животных, в качестве антипаразитарных средств. Актуальной задачей медицины и ветеринарии является обновление ассортимента противопаразитарных средств. Используемые в настоящее время препараты (такие, как «вермокс» [Агольцев В.А., Ноздрачев И.П., Панферов В.И., Мошненко З.Д., Бурлакова В.Г. «Способ лечения аспергиллеза у кроликов», Патент РФ В связи с этим для достижения лечебного эффекта приходится постоянно увеличивать дозировку известных препаратов, что приводит к неоправданному накоплению этих препаратов в организме человека и животных, а также существенно увеличивает стоимость лечения. Наиболее близким к заявленным соединениям общей формулы I по структуре и свойствам является авермектин B формулы (II): где: R=СН3- или CH3 CH2-, которые получают в виде смеси 2-х соединений - метального производного (20%) и этильного производного (80%), имеющих приблизительно одинаковую антипаразитарную активность (в литературе такую смесь называют авермектином B) [Мирзаев М.Н., Савченков С.Н., Жарова Т.П., Девришов Д.А., Воронин Е.С. «Биотехнологические аспекты создания неинъекционных форм противопаразитарных препаратов на основе авермектинов», Проблемы инфекционных и инвазионных болезней в животноводстве на современном этапе. - М., 1999. - С.272-273]. На основе соединения формулы II были созданы антипаразитарные препараты. В результате длительного применения их у паразитов, против которых применяется данный препарат, развилась резистентность. Для достижения лечебного эффекта приходится постоянно увеличивать дозировку известных препаратов, что приводит к неоправданному накоплению этих препаратов в организме человека и животных, а также существенно увеличивает стоимость лечения. Задачей настоящего изобретения является расширение ассортимента соединений, обладающих антипаразитарной активностью, разработка способа их получения и создание антипаразитарных средств на их основе. Поставленная задача достигается предлагаемыми новыми соединениями - 5-O-производными авермектина общей формулы I: где: А=Me или Et R=ОН, OAlk или NR1R2 где: R 1, R2=H, Alk Х=-(СН2 )n-, где: n=2-12
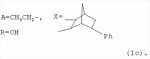
где: R3, R4, R 5, R6=Н, Alk, Ph или Hal; n=1-5; или X представляет собой гетероциклический фрагмент, а также способом их получения, заключающимся в том, что авермектин В подвергают взаимодействию с соответствующим ангидридом в среде органического растворителя в присутствии катализатора аминного типа с последующим выделением целевого продукта в виде соответствующей кислоты либо в виде алкилового эфира, полученного алкилированием кислоты, либо в виде амида, полученного действием амина на алкиловый эфир. Процесс можно проводить при температуре от 15°C до 60°C, преимущественно при комнатной температуре. В качестве органического растворителя преимущественно используют пиридин либо смесь диметилформамида (ДМФА) и пиридина. В качестве катализатора аминного типа используют, например, триэтиламин, диметиламинопиридин. Предлагаемые вещества - 5-O-производные авермектина формулы I можно использовать в качестве антипаразитарных средств. До настоящего времени не были известны производные авермектина, содержащие заместители предложенного типа в 5 положении авермектинового цикла. Не было никаких данных о том, что такие вещества можно получить из авкермектина B. Не было также никаких данных, позволяющих предположить, что вещества формулы I может обладать антипаразитарной активностью и его можно использовать в качестве антипаразитарного средства. Таким образом, заявляемое изобретение соответствует критерию «новизна» и «изобретательский уровень». Изобретение иллюстрируется примерами, не ограничивающими его объем. Пример 1. Получение соединения формулы I. К раствору 0,00035 M вещества авермектина В (300 мг) в пиридине (10 мл) прибавляют 0,0075 M янтарного ангидрида (300 мг) и каталитическое количество 4-диметиламинопиридин (DMAP). Реакционную смесь перемешивают (контроль по ТСХ). Затем реакционную смесь выливают в воду. Выпавший осадок отфильтровывают, промывают водой, сушат в вакууме. Получают 340 мг продукта Ia. Выход (92%). Найдено (%): C 64,32; H 7,67. C52H76O 17. Вычислено (%): C 64,20; H 7,82. В масс-спектре имеется пик молекулярного иона 973 [М+Н]+. Доказательство структуры продукта Ia основано также на данных 1H - ЯМР-спектра (появление дополнительного сигнала в области 2,75 м.д., который соответствует сигналам протонов -СН2-групп сукцинатного фрагмента), ИК-спектроскопии (наличие в спектре в области 3440 см-1 сигнала кислотной OH-группы). В масс-спектрометре, полученном методом электронной эмиссии, имеется пик молекулярного иона 973 [М+Н]+ . Элементный анализ соответствует расчетным данным. Пример 2. Аналогично примеру 1, но процесс проводят в среде смеси ДМФА и пиридина при температуре 15-20°C, получают продукт Ia с выходом 87%. Пример 3. Аналогично примеру 1, но процесс проводят в присутствии каталитического количества триэтиламина, получают продукт Ia с выходом 75%. Пример 4. Получение соединения формулы I. Аналогично примеру 1, но процесс проводят с использованием малеинового ангидрида, получают продукт Ib. Выход (92%). Найдено (%): C 64,72; H 7,67. C52H 74O17. Вычислено (%): C 64,33; H 7,62. В масс-спектре имеется пик молекулярного иона 971 [М+Н]+. Пример 5. Получение соединения формулы I. Аналогично примеру 1, но процесс проводят с использованием ангидрида 5-фенилбицикло[2.2.1]гептан-2,3-дикарбоновой кислоты, получают продукт Iс. Выход (74%). Найдено (%): C 67,32; H 7,57. C63H86O17. Вычислено (%): C 67,80; H 7,71. В масс-спектре имеется пик молекулярного иона 1116 [М+Н]+. Пример 6. Получение соединения формулы I.
Аналогично примеру 1, но процесс проводят с использованием, ангидрида циклогексан-1,2-дикарбоновой кислоты, получают продукт Id. Выход (65%). Найдено (%): C 64,97; H 7,64. C56H82O17. Вычислено (%): C 65,43; H 7,98. В масс-спектре имеется пик молекулярного иона 1028 [М+Н]+. Пример 7. Получение соединения формулы I.
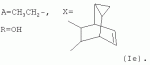
Аналогично примеру 1, но процесс проводят с использованием ангидрида трицикло[3.2.2.02,4]нон-8-ен-6,7-дикарбоновой кислоты, получают продукт Ie. Выход (72%). Найдено (%): C 66,32; H 7,87. C59H82O17. Вычислено (%): C66,48; H 7,71. В масс-спектре имеется пик молекулярного иона 1064 [М+Н]+. Пример 8. Получение соединения формулы I.
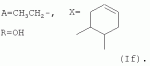
Аналогично примеру 1, но процесс проводят с использованием ангидрида циклогекс-4-ен-1,2-дикарбоновой кислоты, получают продукт If. Выход (59%). Найдено (%): C 65,12; H 7,77. C56H80O17. Вычислено (%): C 65,56; H 7,80. В масс-спектре имеется пик молекулярного иона 1026 [М+Н]+. Пример 9. Получение соединения формулы I.
Аналогично примеру 1, но процесс проводят с использованием ангидрида бензол-1,2-дикарбоновой кислоты, получают продукт Ig. Выход (63%). Найдено (%): C 65,33; H 7,60. C 56H80O17. Вычислено (%): C 65,82; H 7,44. В масс-спектре имеется пик молекулярного иона 1022 [М+Н] +. Пример 10. Получение соединения формулы I.
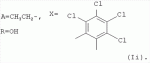
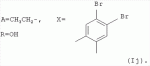
Аналогично примеру 1, но процесс проводят с использованием ангидрида бицикло[2.2.1]гепт-5-ен-2,3-дикарбоновой кислоты, получают продукт Ih. Выход (67%). Найдено (%): C 66,30; H 7,67. C57H80O17. Вычислено (%): C 65,96; H 7,71. В масс-спектре имеется пик молекулярного иона 1038 [М+Н]+. Пример 11. Получение соединения формулы I. Аналогично примеру 1, но процесс проводят с использованием ангидрида 3,4,5,6-тетрахлорбензол-1,2-дикарбоновой кислоты, получают продукт Ii. Выход (71%). Найдено (%): C 57,32; H 6,67. C56H72Cl4O17 . Вычислено (%): C 57,98; H 6,21. Пример 12. Получение соединения формулы I. Аналогично примеру 1, но процесс проводят с использованием ангидрида 4,5-дибромбензол-1,2-дикарбоновой кислоты, получают продукт Ij. Выход (57%). Найдено (%): C57,36; H 6,57. C56H74Br2O17 . Вычислено (%): C 57,00; H 6,28. Пример 13. Получение соединения формулы I. Аналогично примеру 1, но процесс проводят с использованием тетраметил янтарного ангидрида, получают продукт Ih. Выход (72%). Найдено (%): C 65,32; H 8,60. C56 H84O17. Вычислено (%): C 65,37; H 8,17. В масс-спектре имеется пик молекулярного иона 1029 [М+Н] +. Пример 14. Получение соединения формулы I. Продукт Ia растворили в эфире и добавили раствор диазометана в эфире. Реакционную смесь перемешивают (контроль по ТСХ). Затем растворитель удаляют. Остаток промывают гексаном, затем промывают водой, сушат в вакууме. Получили продукт Ik. Выход (74%). Найдено (%): C 64,22; H 7,87. C53H 78O17. Вычислено (%): C 64,50; H 7,91. В масс-спектре имеется пик молекулярного иона 987 [М+Н]+. Пример 15. Получение соединения формулы I. Продукт Ik растворили в сухом эфире и добавили диэтиламин при охлаждении, Реакционную смесь перемешивают (контроль по ТСХ). Затем растворитель удаляют. Остаток промывают гексаном, затем промывают водой, сушат в вакууме. Получили продукт Il. Выход (75%). Найдено (%): C 65,98; H 8,66. C56 H85NO16. Вычислено (%): C 65,43; H 8,27. В масс-спектре имеется пик молекулярного иона 1028 [М+Н] +. Пример 16. Получение соединения формулы I.
Процесс ведут аналогично примеру 5, фильтрат после удаления осадка упаривают досуха под вакуумом, экстрагируют хлористым метиленом, промывают водой, сушат над сульфатом магния. Из остатка после удаления растворителя получают продукт Im. Выход (6,4%). Найдено (%): C 67,26; H 7,27. C62H84 O17. Вычислено (%): C 67,57; H 7,62. В масс-спектре имеется пик молекулярного иона 1102 [М+Н]+. Пример 17. Получение соединения формулы I.
Процесс ведут аналогично примеру 8, фильтрат после удаления осадка упаривают досуха под вакуумом, экстрагируют хлористым метиленом, промывают водой, сушат над сульфатом магния. Из остатка после удаления растворителя получают продукт In. Выход (5,7%). Найдено (%): C 65,22; H 7,97. C55H78 O17. Вычислено (%): C 65,28; H 7,71. В масс-спектре имеется пик молекулярного иона 1012 [М+Н]+. Пример 18. Получение соединения формулы Iо. Аналогично примеру 1, но процесс проводят с использованием ангидрида 2,3-пиридиндикарбоновой кислоты, получают Iо. Выход 46%. Найдено (%): С 64,79; Н 7,21, N 1,46. C55H75NO17. Вычислено (%): С 64,63; Н 7,40, N 1,37. Масс-спектр (ЭУ, 70 ЭВ), m/z (I отн (%)): 1021.
Пример 19. Получение соединения формулы Iр. Аналогично примеру 1, но процесс проводят с использованием 1,4-диметилгексагидрофуро-[3,4-b]-пиразин-5,7-диона, получают Iр. Выход 56%. Найдено (%): С 63,79; Н 7,81, N 2,43. C56H84N2O17. Вычислено (%): С 63,62; Н 8,01, N 2,65. Масс-спектр (ЭУ, 70 ЭВ), m/z (I отн (%)): 1056.
Пример 20. Получение соединения формулы Iq. Аналогично примеру 1, но процесс проводят с использованием 1Н, 3Н-фуро[3,4-с]-фуран-1,3-диона, получают Iq. Выход 52%. Найдено (%): С 63,99; Н 7,51. C54H 74O18. Вычислено (%): С 64,14; Н 7,38. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 1010. Пример 21. Получение соединения формулы Ir. Аналогично примеру 1, но процесс проводят с использованием тетрагидро-4Н,6Н-фуро[3,4-с][1,2,5]-оксадиазол-4,6-диона, получают Ir. Выход 52%. Найдено (%): С 61,82; Н 7,01, N 2,58. C52H72N2O 18. Вычислено (%): С 61,65; Н 7,16; N 2,76. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 1012.
Пример 22. Получение соединения формулы Is. Аналогично примеру 1, но процесс проводят с использованием 1Н,3Н-тиено[3,4-с]-фуран-1,3-диона, получают Is. Выход 43%. Найдено (%): С 63,32; Н 7,15, S3,32. C54 H74O17S. Вычислено (%): С 63,14; Н 7,26; S 3,12. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 1026.
Пример 23. Получение соединения формулы It. Аналогично примеру 1, но процесс проводят с использованием 5-метилтетрагидро-1Н-фуро[3,4-с]пиррол-1,3(3aH)-диона, получают It. Выход 51%. Найдено (%): С 64,32; Н 7,77, N 1,51. C55H81NO17. Вычислено (%): С 64,25; Н 7,94; N 1,36. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 1027.
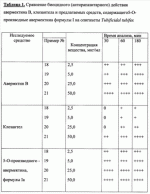
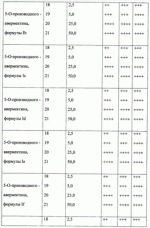
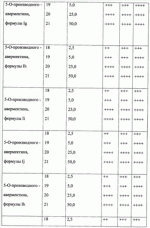
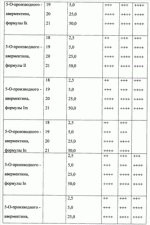
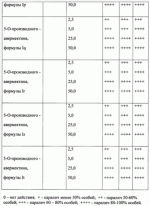
При изучении противопаразитарной активности был использован экспресс-метод оценки биоцидной активности с применением олигохет Tubificidal tubifex в качестве тест-объектов [Дриняев В.А., Чижов В.Н., Ковалев В.Н., Мирзаев М.Н. «Способ определения нематоцидной активности авермектинов», патент РФ При определении активности исследуемое вещество растворяют в воде при определенной концентрации, затем в полученное средство (препарат) вносят олигохеты по 10-20 особей и выдерживают в течение 1-3 ч, после чего подсчитывают общее количество олигохет А в каждом из растворов исследуемого вещества, количество активно подвижных нематод В, количество нематод с нарушенной подвижностью С и количество неподвижных нематод D, вычисляют процент смертности нематод в каждом разведении по формуле 1-[В+(С 0,5)+(D 0)]/А100, находят концентрацию исследуемого образца, при которой смертность олигохет составляет 50% (СК 50), и определяют противопаразитарную активность путем сравнения СК50 исследуемого образца и эталонного образца известной концентрации. Пример 24. Проводили определение нематоцидной активности с использованием предлагаемого средства при концентрации 2,5 мкг/мл. Пример 25. Проводили определение нематоцидной активности с использованием предлагаемого средства при концентрации 5 мкг/мл. Пример 26. Проводили определение нематоцидной активности с использованием предлагаемого средства при концентрации 25 мкг/мл. Пример 27. Проводили определение нематоцидной активности с использованием предлагаемого средства при концентрации 50 мкг/мл. Результаты исследования средств, содержащих соединение общей формулы I приведены в таблице 1. Анализ данных таблицы свидетельствует, что предлагаемые антипаразитарные средства более активны по сравнению с известными средствами. Так, например, как видно из таблицы 1, известное средство «клозантел» значительно уступает предлагаемому средству. Что же касается авермектина В, то при его использовании для поражения 80-100% олигохет при концентрации 25 мкг/мл необходима экспозиция в течение 180 минут, тогда как при использовании предлагаемых средств для достижения такого же эффекта требуется в шесть раз меньше времени (30 минут). Таким образом, технический результат предлагаемого изобретения заключается в получении 5-О-производных авермектина формулы I, обладающих антипаразитарной активностью, и создании более эффективных антипаразитарных средств, которые могут быть использованы для борьбы с паразитами в меньших концентрациях по сравнению известными средствами, в том числе и с авермектином В формулы II. Предлагаемое средство является более эффективным, что позволяет существенно снизить используемую концентрацию средства, его стоимость, а также расширить ассортимент антипаразитарных средств. Формула изобретения1. 5-O-Производные авермектина общей формулы I: 2. Соединения по п.1, обладающее антипаразитарной активностью. 3. Способ получения соединений по пп.1 и 2, заключающийся в том, что авермектин В обрабатывают соответствущим ангидридом в среде органического растворителя в присутствии катализатора аминного типа с последующим выделением целевого продукта в виде соответствующей кислоты либо в виде алкилового эфира, полученного алкилированием кислоты либо в виде амида, полученного действием амина на алкиловый эфир. 4. Способ по п.3, отличающийся тем, что в качестве органического растворителя используют пиридин либо смесь диметилформамида и пиридина. 5. Способ по п.3, отличающийся тем, что в качестве катализатора аминного типа используют, например, триэтиламин, диметиламинопиридин. 6. Антипаразитарные средства на основе 5-O-производных авермектина общей формулы I по пп.1 и 2. Популярные патенты: 2502793 Масло, семена и растения подсолнечника с модифицированным распределением жирных кислот в молекуле триацилглицерина ... (iv)Применяя значения, приведенные для Sl, S2, S3, U1 , U2 и U3 в таблице 3, путем следующего умозаключения можно рассчитать значение коэффициентa распределения для различных TAG:a) для тринасыщенных типов TAG (SSS):SSS (%)=S1S2 S3/10000 (i)Подставляя значения для S1, S2 и S3 из таблицы 3, получаем: S1S2S3=[(2S-S 2) ]×S2×[(3S-S2)(1- )]=(3S -S2 )×S2×(3S-3S -S2-S2 )=3SS2 -S2 2 )×(3S-3S -S2-S2 )=9S2S2 -9S2S2 2-3SS2 2 +3SS2 2 2-3SS2 2 +3SS2 2 2+S2 3 -S2 3 2=(-9S2S2 +6SS2 2-S2 3) 2+(9S2S2+6SS2 2+S2 3) (v)Путем перестановки членов в уравнении (i) получаемS1S2S3 -10000SSS(%)=0Подставляя значения для S1 ... 2265314 Устройство системы зашторивания теплиц с регулируемым ходом ... поводок 9 (возможно с роликами 10), закрепленный на балке зашторивания 3 предыдущего пролета, поддерживающий дополнительную штангу и входящий при движении поочередно в контакт с упорами 8 (фиг.3). Расстояние между упорами 8 обеспечивает свободный ход поводка 9, за счет которого уменьшается ход зашторивания уменьшенного пролета.Через всю теплицу параллельно движению зашторивания с определенным шагом натянуты струны 11, поддерживающие шторный экран в пространстве пролета. Эти струны являются дополнительным поддерживающим элементом так же и для балок зашторивания 3 и 7.Принцип действия устройства системы зашторивания с регулируемым ходом следующий. При включении системы зашторивания ... 2161400 Способ определения активности агентов ... 1980, N 3. 2. Патент Российской Федерации N 2108710, Кл. A 01 H 1/04, 1998. Формула изобретения 1. Способ определения активности агентов - биостимуляторов, удобрений, биопрепаратов, ядохимикатов, токсинов и патогенов, включающий выращивание биологических тест-объектов при воздействии агентов в различной концентрации в условиях визуально доступного наблюдения с периодической оценкой результатов, отличающийся тем, что выращивание биологических тест-объектов производят в водных растворах или взвесях агентов в помещенных в освещаемый биотермостат сферических стеклянных пробирках с перехватом по диаметру в их средней части и/или в четырехкамерных стаканчиках со сферическими ... 2440708 Комбинированное устройство для ротационного внутрипочвенного рыхления ... зацепления открытой зубчатой передачи в ротационном щелерезе 1, сообщенный с каналом 10, выполненным в диске щелереза 1.Предлагаемое комбинированное устройство для ротационного внутрипочвенного рыхления работает следующим образом.В процессе движения агрегата устройство заглублено в почву. Ротационные щелерезы 1 производят нарезание водопоглощающих щелей и выполняют механический привод внутрипочвенного фрезерователя 2. Рыхлящие пальцы 4, выступающие вперед по ходу движения устройства относительно образующей режущих кромок почвенных фрез 7, производят предварительное разуплотнение почвы перед ее фрезерованием. Затем внутрипочвенный фрезерователь 2 фрезами 7 производит ... 2264075 Рулонный пресс-подборщик лубяных культур ... массу и препятствуют наматыванию стеблей на вращающиеся детали транспортера и привода. На выходе из транспортера 12 к щиткам 21 закреплены шарнирно козырьки 22 (на фиг. 4 показан один козырек 22), которые нависают над приемными ремнями 5 прессовальной камеры 2 и препятствуют просыпанию стеблей между подбирающим аппаратом 1 и ремнями 5. Козырьки 22 поддерживаются стойками 23. Форма козырьков 22 с нижней их стороны подобрана такой, чтобы обеспечивался одинаково минимальный зазор между козырьками 22 и ремнями 5 при копировании подбирающим аппаратом 1 почвы.Привод транспортера 12 и подбирающего барабана 11 осуществляется через вал 24, от него же через цепную передачу 25 и редуктор 26 ... |
Еще из этого раздела: 2489835 Гнездовой высевающий аппарат для посева проросших семян овощных культур 2180475 Устройство для поштучной подачи предметов, в частности семян сельскохозяйственных культур 2407282 Способ выращивания корнесобственных саженцев винограда и машина для его осуществления 2075933 Композиция для иммунизации растений от различных фитопатогенов 2086081 Рабочий орган культиватора 2057432 Биологический состав кузнецова для подсочки деревьев, в том числе каучуконосов (варианты), и способ его приготовления 2462016 Устройство для протравливания семян 2235464 Гербицидно-действующее средство 2259707 Способ озеленения территорий многолетними декоративными древесными растениями 2067832 Способ борьбы с грибковыми инфекциями растений |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||


 2073512, опубл. 1997]; «клозантел» (синонимы: клозантин, клозантекс, сантел, фасковерм, роленол) [Веселова Т.П., Архипов И.А., Дорошина М.В. «Эффективность клозантела при фасциолезе овец», Бюллетень Всесоюзного института гельминтологии им. К.И.Скрябина 1986. Т.42. 27-28]; производные авермектина [Алексеев М.А., Рославцева С.А. «Развитие резистентности к авермектинам A1 и A2 на примере комнатной мухи Musca domestica L. (Diptera: Muscidae)», Агрохимия. - 2006. -
2073512, опубл. 1997]; «клозантел» (синонимы: клозантин, клозантекс, сантел, фасковерм, роленол) [Веселова Т.П., Архипов И.А., Дорошина М.В. «Эффективность клозантела при фасциолезе овец», Бюллетень Всесоюзного института гельминтологии им. К.И.Скрябина 1986. Т.42. 27-28]; производные авермектина [Алексеев М.А., Рославцева С.А. «Развитие резистентности к авермектинам A1 и A2 на примере комнатной мухи Musca domestica L. (Diptera: Muscidae)», Агрохимия. - 2006. - 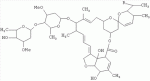
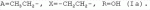
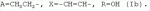
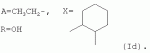

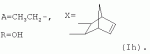

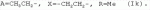
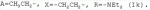
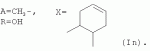
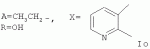
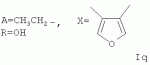
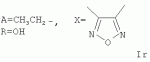
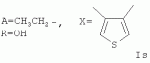
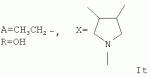
 ,
,  ,
,  ,
, 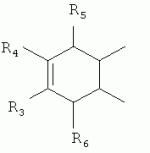 ,
,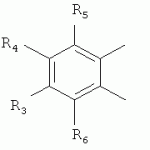 ,
, 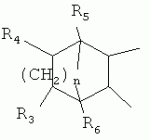 ,
, 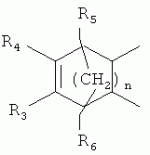 ,где R3, R4, R5 , R6 - Н, Alk, Ph или Наl;n=1-5; или Х представляет собой гетероциклический фрагмент.
,где R3, R4, R5 , R6 - Н, Alk, Ph или Наl;n=1-5; или Х представляет собой гетероциклический фрагмент.