Сложноэфирное соединение и его применениеПатент на изобретение №: 2449986 Автор: МОРИ Тацуя (JP) Патентообладатель: СУМИТОМО КЕМИКАЛ КОМПАНИ, ЛИМИТЕД (JP) Дата публикации: 10 Апреля, 2011 Начало действия патента: 27 Февраля, 2008 Адрес для переписки: 129090, Москва, ул. Б. Спасская, 25, стр.3, ООО "Юридическая фирма Городисский и Партнеры", Е.Е.Назиной Изобретение относится к сложноэфирному соединению, представленному формулой Настоящее изобретение относится к сложноэфирному соединению и его применению. В ЕР 0926129 А1 раскрывается определенный вид тетрафторбензильных сложноэфирных соединений. Целью настоящего изобретения является обеспечение соединения, имеющего превосходную эффективность в борьбе с вредителями. Авторы настоящего изобретения провели обширные исследования с целью выявления соединения, имеющего превосходную эффективность в борьбе с вредителями, и в результате обнаружили, что соединение, представленное формулой (1), приведенной ниже, имеет превосходную эффективность в борьбе с вредителями, что, таким образом, привело к настоящему изобретению. Настоящим изобретением обеспечивается 1) сложноэфирное соединение, представленное формулой (1) где R представляет С1-С 4 алкильную группу или С3-С4 алкенильную группу и А представляет одинарную связь или атом кислорода (далее именуемое настоящим соединением); 2) сложноэфирное соединение в соответствии с вышеприведенной формулой 1, где А представляет одинарную связь; 3) сложноэфирное соединение в соответствии с вышеприведенной формулой 1, где А представляет атом кислорода; 4) агент для борьбы с вредителями, включающий сложноэфирное соединение, представленное формулой (1), в качестве активного ингредиента; 5) способ борьбы с вредителями, включающий нанесение эффективного количества сложноэфирного соединения, представленного формулой (1), на вредителей или место, в котором вредители обитают, и 6) применение сложноэфирного соединения, представленного формулой (1), для борьбы с вредителями. Поскольку настоящее соединение имеет превосходную эффективность в борьбе с вредителями, оно полезно в качестве активного ингредиента агента для борьбы с вредителями. У настоящего соединения имеются изомеры, обусловленные наличием двух асимметрических атомов углерода, присутствующих в циклопропановом кольце, и изомеры, обусловленные наличием двойной связи, и каждый из них и смесь этих изомеров, имеющая произвольное соотношение, включены в настоящее изобретение. В настоящем изобретении примеры С 1-С4 алкильной группы включают метильную группу, этильную группу, пропильную группу и т.п., а примеры С3 -С4 алкенильной группы включают аллильную группу. Примеры настоящего соединения включают следующие соединения: соединение, представленное формулой (1), в котором абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией; соединение, представленное формулой (1), в котором относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), в котором относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является цис-конфигурацией; соединение, представленное формулой (1), в котором относительная конфигурация двойной связи, присутствующей при заместителе в положении 3 циклопропанового кольца, является Z-конфигурацией; соединение, представленное формулой (1), в котором абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), в котором абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является цис-конфигурацией; соединение, представленное формулой (1), в котором абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией, относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; и относительная конфигурация двойной связи, присутствующей при заместителе в положении 3 циклопропанового кольца, является Z-конфигурацией; соединение, представленное формулой (1), в котором абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией, относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является цис-конфигурацией; и относительная конфигурация двойной связи, присутствующей при заместителе в положении 3 циклопропанового кольца, является Z-конфигурацией; соединение, представленное формулой (1), обогащенное соединением, в котором абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), содержащее не менее 80% соединения, в котором абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), содержащее не менее 90% соединения, в котором абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), в котором R представляет С1-С4 алкильную группу; соединение, представленное формулой (1), в котором R представляет С3-С4 алкенильную группу; соединение, представленное формулой (1), в котором R представляет метильную или аллильную группу; соединение, представленное формулой (1), в котором А представляет одинарную связь; соединение, представленное формулой (1), в котором А представляет атом кислорода; соединение, представленное формулой (1), в котором R представляет С1-С4 алкильную группу и А представляет одинарную связь; соединение, представленное формулой (1), в котором R представляет С1-С4 алкильную группу, А представляет одинарную связь и абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией; соединение, представленное формулой (1), в котором R представляет С1-С4 алкильную группу, А представляет одинарную связь и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), в котором R представляет С1-С4 алкильную группу, А представляет одинарную связь и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является цис-конфигурацией; соединение, представленное формулой (1), в котором R представляет С1 -С4 алкильную группу, А представляет одинарную связь и относительная конфигурация двойной связи, присутствующей при заместителе в положении 3 циклопропанового кольца, является Z-конфигурацией; соединение, представленное формулой (1), в котором R представляет С1-С4 алкильную группу, А представляет одинарную связь и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), в котором R представляет С1-С4 алкильную группу, А представляет одинарную связь, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является цис-конфигурацией; соединение, представленное формулой (1), в котором R представляет С1-С4 алкильную группу, А представляет одинарную связь, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией, относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией и относительная конфигурация двойной связи, присутствующей при заместителе в положении 3 циклопропанового кольца, является Z-конфигурацией; соединение, представленное формулой (1), в котором R представляет С1 -С4 алкильную группу, А представляет одинарную связь, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией, относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является цис-конфигурацией и относительная конфигурация двойной связи, присутствующей при заместителе в положении 3 циклопропанового кольца, является Z-конфигурацией; соединение, представленное формулой (1), обогащенное соединением, в котором R представляет С1-С4 алкильную группу, А представляет одинарную связь, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), содержащее не менее 80% соединения, в котором R представляет С1-С4 алкильную группу, А представляет одинарную связь, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), содержащее не менее 90% соединения, в котором R представляет С1-С4 алкильную группу, А представляет одинарную связь, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), в котором R представляет С3-С4 алкенильную группу и А представляет одинарную связь; соединение, представленное формулой (1), в котором R представляет С3-С4 алкенильную группу, А представляет одинарную связь и абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией; соединение, представленное формулой (1), в котором R представляет С3-С4 алкенильную группу, А представляет одинарную связь и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), в котором R представляет С3-С4 алкенильную группу, А представляет одинарную связь и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является цис-конфигурацией; соединение, представленное формулой (1), в котором R представляет С3-С4 алкенильную группу, А представляет одинарную связь и относительная конфигурация двойной связи, присутствующей при заместителе в положении 3 циклопропанового кольца, является Z-конфигурацией; соединение, представленное формулой (1), в котором R представляет С3-С4 алкенильную группу, А представляет одинарную связь, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), в котором R представляет С3-С4 алкенильную группу, А представляет одинарную связь, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является цис-конфигурацией; соединение, представленное формулой (1), в котором R представляет С3-С4 алкенильную группу, А представляет одинарную связь, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией, относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией и относительная конфигурация двойной связи, присутствующей при заместителе в положении 3 циклопропанового кольца, является Z-конфигурацией; соединение, представленное формулой (1), в котором R представляет С3 -С4 алкенильную группу, А представляет одинарную связь, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией, относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является цис-конфигурацией и относительная конфигурация двойной связи, присутствующей при заместителе в положении 3 циклопропанового кольца, является Z-конфигурацией; соединение, представленное формулой (1), обогащенное соединением, в котором R представляет С3-С4 алкенильную группу, А представляет одинарную связь, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), содержащее не менее 80% соединения, в котором R представляет С3-С4 алкенильную группу, А представляет одинарную связь, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), содержащее не менее 90% соединения, в котором R представляет С3-С4 алкенильную группу, А представляет одинарную связь, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), в котором R представляет С1-С4 алкильную группу и А представляет атом кислорода; соединение, представленное формулой (1), в котором R представляет С1-С4 алкильную группу, А представляет атом кислорода и абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией; соединение, представленное формулой (1), в котором R представляет С1-С4 алкильную группу, А представляет атом кислорода и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), в котором R представляет С1-С4 алкильную группу, А представляет атом кислорода и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является цис-конфигурацией; соединение, представленное формулой (1), в котором R представляет С1-С4 алкильную группу, А представляет атом кислорода и относительная конфигурация двойной связи, присутствующей при заместителе в положении 3 циклопропанового кольца, является Z-конфигурацией; соединение, представленное формулой (1), в котором R представляет С1-С4 алкильную группу, А представляет атом кислорода, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), в котором R представляет С1-С4 алкильную группу, А представляет атом кислорода, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), в котором R представляет С1-С4 алкильную группу, А представляет атом кислорода, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией, относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией и относительная конфигурация двойной связи, присутствующей при заместителе в положении 3 циклопропанового кольца, является Z-конфигурацией; соединение, представленное формулой (1), в котором R представляет С1 -С4 алкильную группу, А представляет атом кислорода, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией, относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является цис-конфигурацией и относительная конфигурация двойной связи, присутствующей при заместителе в положении 3 циклопропанового кольца, является Z-конфигурацией; соединение, представленное формулой (1), обогащенное соединением, в котором R представляет С1-С4 алкильную группу, А представляет атом кислорода, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), содержащее не менее 80% соединения, в котором R представляет С1-С4 алкильную группу, А представляет атом кислорода, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), содержащее не менее 90% соединения, в котором R представляет С1-С4 алкильную группу, А представляет атом кислорода, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), в котором R представляет метильную группу и А представляет одинарную связь; соединение, представленное формулой (1), в котором R представляет метильную группу, А представляет одинарную связь и абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией; соединение, представленное формулой (1), в котором R представляет метильную группу, А представляет одинарную связь и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), в котором R представляет метильную группу, А представляет одинарную связь и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является цис-конфигурацией; соединение, представленное формулой (1), в котором R представляет метильную группу, А представляет одинарную связь и относительная конфигурация двойной связи, присутствующей при заместителе в положении 3 циклопропанового кольца, является Z-конфигурацией; соединение, представленное формулой (1), в котором R представляет метильную группу, А представляет одинарную связь, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), в котором R представляет метильную группу, А представляет одинарную связь, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является цис-конфигурацией; соединение, представленное формулой (1), в котором R представляет метильную группу, А представляет одинарную связь, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией, относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией и относительная конфигурация двойной связи, присутствующей при заместителе в положении 3 циклопропанового кольца, является Z-конфигурацией; соединение, представленное формулой (1), в котором R представляет метильную группу, А представляет одинарную связь, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией, относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является цис-конфигурацией и относительная конфигурация двойной связи, присутствующей при заместителе в положении 3 циклопропанового кольца, является Z-конфигурацией; соединение, представленное формулой (1), обогащенное соединением, в котором R представляет метильную группу, А представляет одинарную связь, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), содержащее не менее 80% соединения, в котором R представляет метильную группу, А представляет одинарную связь, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), содержащее не менее 90% соединения, в котором R представляет метильную группу, А представляет одинарную связь, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), в котором R представляет аллильную группу и А представляет одинарную связь; соединение, представленное формулой (1), в котором R представляет аллильную группу, А представляет одинарную связь и абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией; соединение, представленное формулой (1), в котором R представляет аллильную группу, А представляет одинарную связь и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), в котором R представляет аллильную группу, А представляет одинарную связь и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является цис-конфигурацией; соединение, представленное формулой (1), в котором R представляет аллильную группу, А представляет одинарную связь и относительная конфигурация двойной связи, присутствующей при заместителе в положении 3 циклопропанового кольца, является Z-конфигурацией; соединение, представленное формулой (1), в котором R представляет аллильную группу, А представляет одинарную связь, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), в котором R представляет аллильную группу, А представляет одинарную связь, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является цис-конфигурацией; соединение, представленное формулой (1), в котором R представляет аллильную группу, А представляет одинарную связь, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией, относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией и относительная конфигурация двойной связи, присутствующей при заместителе в положении 3 циклопропанового кольца, является Z-конфигурацией; соединение, представленное формулой (1), в котором R представляет аллильную группу, А представляет одинарную связь, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией, относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является цис-конфигурацией и относительная конфигурация двойной связи, присутствующей при заместителе в положении 3 циклопропанового кольца, является Z-конфигурацией; соединение, представленное формулой (1), обогащенное соединением, в котором R представляет аллильную группу, А представляет одинарную связь, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), содержащее не менее 80% соединения, в котором R представляет аллильную группу, А представляет одинарную связь, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), содержащее не менее 90% соединения, в котором R представляет аллильную группу, А представляет одинарную связь, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), в котором R представляет метильную группу и А представляет атом кислорода; соединение, представленное формулой (1), в котором R представляет метильную группу, А представляет атом кислорода и абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией; соединение, представленное формулой (1), в котором R представляет метильную группу, А представляет атом кислорода и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), в котором R представляет метильную группу, А представляет атом кислорода и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является цис-конфигурацией; соединение, представленное формулой (1), в котором R представляет метильную группу, А представляет атом кислорода и относительная конфигурация двойной связи, присутствующей при заместителе в положении 3 циклопропанового кольца, является Z-конфигурацией; соединение, представленное формулой (1), в котором R представляет метильную группу, А представляет атом кислорода, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), в котором R представляет метильную группу, А представляет атом кислорода, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является цис-конфигурацией; соединение, представленное формулой (1), в котором R представляет метильную группу, А представляет атом кислорода, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией, относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией и относительная конфигурация двойной связи, присутствующей при заместителе в положении 3 циклопропанового кольца, является Z-конфигурацией; соединение, представленное формулой (1), в котором R представляет метильную группу, А представляет атом кислорода, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией, относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является цис-конфигурацией и относительная конфигурация двойной связи, присутствующей при заместителе в положении 3 циклопропанового кольца, является Z-конфигурацией; соединение, представленное формулой (1), обогащенное соединением, в котором R представляет метильную группу, А представляет атом кислорода, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией; соединение, представленное формулой (1), содержащее не менее 80% соединения, в котором R представляет метильную группу, А представляет атом кислорода, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией, и соединение, представленное формулой (1), содержащее не менее 90% соединения, в котором R представляет метильную группу, А представляет атом кислорода, абсолютная конфигурация положения 1 циклопропанового кольца является R-конфигурацией и относительная конфигурация заместителя в положении 1 циклопропанового кольца и заместителя в положении 3 циклопропанового кольца является транс-конфигурацией. Настоящее соединение может быть получено, например, следующим способом. Способ, который включает реакцию спиртового соединения, представленного формулой (2) где R представляет С1-С 4 алкильную группу или С3-С4 алкенильную группу и А представляет одинарную связь или атом кислорода, с карбоновой кислотой, представленной формулой (3) или ее реакционноспособным производным (например, галогенангидридом, ангидридом кислоты и т.д.). Обычно данную реакцию проводят в растворителе в присутствии конденсирующего агента или основания. Примеры конденсирующего агента включают дициклогексилкарбодиимид и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида. Примеры основания включают органические основания, такие как триэтиламин, пиридин, N,N-диэтиланилин, 4-диметиламинопиридин и диизопропилэтиламин. Примеры растворителя включают углеводороды, такие как бензол, толуол и гексан, простые эфиры, такие как диэтиловый эфир и тетрагидрофуран, и галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и хлорбензол. Продолжительность реакции обычно находится в интервале от 5 минут до 72 часов. Температура реакции обычно находится в интервале от -20°С до 100°С (при условии, что температура кипения используемого растворителя ниже 100°С, от -20°С до температуры кипения растворителя), предпочтительно в интервале от -5°С до 100°С (при условии, что температура кипения используемого растворителя ниже 100°С, от -5°С до температуры кипения растворителя). В реакции используемое мольное соотношение спиртового соединения, представленного формулой (2), и карбоновой кислоты, представленной формулой (3), или ее реакционноспособного производного может быть соответствующим образом подобрано, но реакцию предпочтительно проводят при эквимолярном соотношении или при соотношении, близком к таковому. Обычно конденсирующий агент или основание могут быть использованы в соответствующем соотношении от 1 моль до избыточного количества, предпочтительно от 1 моль до 5 моль по отношению к 1 моль спиртового соединения, представленного формулой (2). Конденсирующий агент или основание могут быть подходящим образом выбраны в зависимости от вида конкретной карбоновой кислоты, представленной формулой (3), или ее реакционноспособного производного (например, соответствующего хлорангидрида кислоты, бромангидрида кислоты, ангидрида кислоты и т.д.) кислоты, представленной формулой (3). После завершения реакции реакционную смесь подвергают общепринятой процедуре заключительной обработки, например фильтрованию реакционной смеси с последующим концентрированием полученного фильтрата или выливанию реакционной смеси в воду с последующей экстракцией органическим растворителем и концентрированием полученного экстракта для выделения настоящего соединения. Полученное настоящее соединение может быть очищено общепринятым методом, таким как хроматография или перегонка. Спиртовое соединение, представленное формулой (2), является коммерчески доступным продуктом или соединением, описанным в ЕР 0926129 А1 и патенте US 4405640, и может быть приобретено в качестве коммерчески доступного продукта или может быть получено способом, описанным в указанных публикациях. Карбоновая кислота, представленная формулой (3), является соединением, описанным, например, в Agr. Biol. Chem., 34, 1119 (1970), и может быть получено способом, описанным там. Примеры вредителей, в отношении которых настоящее соединение эффективно, включают артроподы, такие как насекомые и черви, особенно, например, следующих вредителей. Бабочки (Lepidoptera): огневки (Pyralidae), такие как Chilosuppressalis (рисовый ствольный сверлильщик), Cnaphalocrocis medinalis (рисовая огневка), Plodia interpunctella (индийская мучная моль) и т.п.; ночницы (Noctuidae), такие как Spodoptera litura (личинка азиатской хлопковой совки), Pseudaletia separate (личинка рисовой совки), Mamestra brassicae (личинка капустной совки) и т.п.; белянки (Pieridae), такие как Pieris rapae (личинка обычной капустной белянки) и т.п.; листовертки (Tortricidae), такие как Adoxophyes orana и т.п.; садовые моли (Carposinidae); кружковые моли (Lyonetiidae); волнянки (Lymantriidae); металловидки (Plusiinae); восклицательные совки (Agrotis ssp.), такие как Agrotis segetum (озимая совка), Agrotis ipsilon (черная озимая совка) и т.п.; хлопковые совки (Helicoverpa spp.); щетинковые совки (Heliothis spp.); Plutella xylostella (капустная моль); Parnara guttata (рисовая толстоголовка); Tinea pellionella (шубная моль); Tineola bisselliell (платяная моль) и т.п.; двукрылые (Diptera): комары (Calicidae), такие как Culex pipiens pallens (комар обыкновенный), Culex tritaeniorhynchus и т.п.; москиты (Aedes spp.), такие как Aedes aegypti, Aedes albopictus и т.п.; малярийные комары (Anopheles spp.), такие как Anopheles sinensis и т.п.; комары-звонцы (Chironomidae); мухи настоящие (Muscidae), такие как Musca domestica (муха комнатная), Muscina stabulans (муха домовая), Fannia canicularis (малая домовая муха) и т.п.; мясные мухи (Calliphordiae); серые мясные мухи (Sarcophagidae); мухи цветочные (Anthomyiidae), такие как Hylemya platura (личинка кукурузной мухи), Delia antique (личинка луковой мухи) и т.п.; мухи-пестрокрылки (Tephritidae); Drosophilidae (дрозофилиды); бабочницы (Psychodidae); мухи-горбатки (Phoridae); черные мошки (Simuliidae); слепни (Tabanidae); жигалки осенние (Stomoxyidae); мокрецы (Ceratopogonidae) и т.п.; таракановые (Dictyoptera): Blattella germanica (прусский таракан), Periplaneta fuliginosa (дымчато-коричневый таракан), Periplaneta americana (американский таракан), Periplaneta brunnea (коричневый таракан), Blatta orientalis (азиатский таракан) и т.п. Перепончатокрылые (насекомые): Formicidae (муравьи); Vespidae (шершни); Bethylidae (осы); пилильщики настоящие (Tenthredinidae), такие как Athalia rosae japonensis (капустный пилильщик) и т.п.; блохи (Aphaniptera): Ctenocephalides canis (собачьи блохи), Ctenocephalides felis (кошачьи блохи), Pulex irritans (блохи человека) и т.п.; вши (Anoplura): Pediculus humanus, Phthirus pubis, Pediculus humanus humanus , Pediculus humanus corporis и т.п. термиты (Isoptera): Reticulitermes speratus, Coptotermes formosanus и т.п. Полужесткокрылые (Hemiptera): Delphacidae (свинушки), такие как Laodelphax striatellus (темная цикадка), Nilaparvata lugens (коричневая рисовая цикадка), Sogatella furcifera (белоспинная рисовая цикадка) и т.п.; Deltocephalidae (цикады), такие как Nephotettix cincticeps (зеленая рисовая цикада), Nephotettix virescens (зеленая рисовая цикадка) и т.п.; тли (Aphididae); клопы (Pentatomidae); белокрылки (Aleyrodidae); Coccidae (щитовки); Tingidae (кружевницы); Psyliidae (безволоски) и т.п.; жуки (Coleoptera): Attagenus japonicus; Anthrenus verbasci; Diabrotica spp. (кукурузный корневой жук), такие как Diabrotica virgifera (западный кукурузный корневой жук), Diabrotica undecimpunctatahowardi (южный кукурузный корневой жук) и т.п.; скарабеи (Scarabaeidae), такие как Anomala cuprea (медный хрущ), Anomala rufocuprea (соевый жук) и т.п.; долгоносики (Curculionidae), такие как Sitophilus zeamais (кукурузный долгоносик), Lissorhoptrus oryzophilus (рисовый водяной долгоносик), Anthonomus gradis grandis (хлопковый долгоносик), Callosobruchuys chienensis (китайская зерновка) и т.п.; Tenebrionidae (чернотелки), такие как Tenebrio molitor (желтый мучной червь), Tribolium castaneum (малый мучной хрущак) и т.п.; Chrysomelidae (листоеды), такие как Oulema oryzae (рисовая пьявица), Phyllotreta striolata (выемчатая полосатая блошка), Aulacophora femoralis (тыквенный листоед) и т.п.; точильщики (Anobiidae); коровки (Epilachna spp.), такие как Epilachna vigintioctopunctata (двадцативосьмипятнистая картофельная божья коровка) и т.п.; Lyctidae (древогрызы); Bostrychidae (капюшонники); Cerambycidae (усачи); Paederus fuscipes (жук-синекрыл) и т.п.; трипсы (Thysanoptera): Thrips palmi, Frankliniella occidentalis , Thrips hawaiiensis (цветочные трипсы) и т.п.; прямокрылые (Orthoptera): Gryllotalpa fossor Scudder, Acrididae (кузнечики) и т.п.; клещи (Acarina): Dermanyssidae, такие как Dermatophagoides farinae, Dermatophagoides ptrenyssnus и т.п.; Acaridae, такие как Tyrophagus putrescentiae (зерновые клещи), Aleuroglyphus ovatus (темноногий клещ) и т.п.; Glycyphagidae, такие как Glycyphagidae privates, Glycyphagidae domesticus , Glycyphagus destructor (волосатый обыкновенный клещ) и т.п.; хищные клещи (Cheyletidae), такие как Cheyletus malaccensis , Cheyletus malaccesis и т.п.; прозрачные клещи (Tarsonemidae); Chortoglyphidae; паукообразные (Haplochthoniidae); паутинные клещи (Tetranychidae), такие как Tetranychus urticae (обыкновенный паутинный клещ), Tetranychus kanzawai (клещ Каназава), Panonychus citri (красный цитрусовый клещ), Panonychus ulmi (красный плодовый клещ) и т.п.; твердые клещи (Ixodidae), такие как Haemaphysalis longicornis и т.п. Агент для борьбы с вредителями в соответствии с настоящим изобретением может быть представлен в виде настоящего соединения как такового или обычно он является составом, включающим настоящее соединение и инертный носитель. Примеры составов включают масляные растворы, эмульгируемые концентраты, смачиваемые порошки, текучие составы (например, водные суспензии, водные эмульсии), порошки, гранулы, аэрозоли, составы, возгоняющиеся при нагревании (например, инсектицидные спирали, инсектицидные пластины для электрофумигаторов, летучие составы с поглощающим фитилем для нагревания), термофумиганты (например, фумиганты самовозгорающегося типа, фумиганты, использующие химическую реакцию, фумиганты из пористой керамической пластины и т.п.), составы, возгоняющиеся без нагревания (например, смоляные летучие составы, летучие составы из импрегнированной бумаги), дымовые составы (например, туманообразователи), составы сверхнизкого объема (ULV) и ядовитые приманки. Примеры способов получения составов включают следующие способы. [1] Способ смешивания настоящего соединения с твердым носителем, жидким носителем, газообразным носителем, приманкой или т.п. и, при необходимости, с добавлением поверхностно-активного вещества и других вспомогательных веществ для получения состава. [2] Способ импрегнирования твердого носителя определенной формы, не содержащего активного ингредиента, настоящим соединением. [3] Способ смешивания настоящего соединения с порошкообразным твердым носителем и, необязательно, с добавлением поверхностно-активного вещества и других вспомогательных веществ для получения состава с последующим формованием полученной смеси. Указанные составы содержат настоящее соединение в массовом соотношении обычно от 0,001 до 95% в зависимости от типа состава. Примеры носителя, используемого для приготовления состава, включают твердые носители {глины (например, каолин, диатомовую землю, синтетический водный диоксид кремния, бентонит, глину Фубасами и кислую глину), тальки, керамики, другие неорганические материалы (например, серицит, кварц, серу, активированный уголь, карбонат кальция, гидратированный кремнезем и монтмориллонит), химические удобрения (например, сульфат аммония, фосфат аммония, нитрат аммония, мочевину и хлорид аммония) и т.п.}; жидкие носители {воду, спирты (например, метанол и этанол), кетоны (например, ацетон и метилэтилкетон), ароматические углеводороды (например, бензол, толуол, ксилол, этилбензол, метилнафталин и фенилксилилэтан), алифатические углеводороды (например, гексан, циклогексан, керосин и газойль), сложные эфиры (например, этилацетат и бутилацетат), нитрилы (например, ацетонитрил и изобутиронитрил), простые эфиры (например, диизопропиловый эфир и диоксан), амиды кислот (например, N,N-диметилформамид и N,N-диметилацетамид), галогенированные углеводороды (дихлорметан, трихлорэтан и тетрахлоруглерод), диметилсульфоксид, растительные масла (например, соевое масло и хлопковое масло) и т.п.} и газообразные носители {флон-газ, газообразный бутан, сжиженный попутный газ (LPG), диметиловый эфир, газообразный диоксид углерода и т.п.}. Примеры поверхностно-активного вещества включают алкилсульфатные сложные эфиры, алкилсульфонатные соли, алкиларилсульфонатные соли, алкилариловые простые эфиры, полиоксиэтилированные алкилариловые простые эфиры, простые эфиры полиэтиленгликоля, сложные эфиры многоатомных спиртов и производные сахаров со спиртовыми группами. Примеры других вспомогательных веществ для получения состава включают связующие, диспергаторы и стабилизаторы, например казеин, желатин, полисахариды (например, крахмал, гуммиарабик, производные целлюлозы и аргиновой кислоты), производные лигнина, бентонит, синтетические водорастворимые полимеры (например, поливиниловый спирт и поливинилпирролидон), полиакриловую кислоту, BHT (2,6-ди-трет-бутил-4-метилфенол) и ВНА (смесь 2-трет-бутил-4-метоксифенола и 3-трет-бутил-4-метоксифенола). Примеры твердого носителя для инсектицидной спирали включают смесь растительного порошка, такого как древесные опилки, и Pyrethrum marc и т.п., и связующего, такого как порошок Табу (порошок Machilus thunbergii), крахмал, глютен и т.п. Примеры твердого носителя определенной формы для получения инсектицидных пластин для электрофумигатора включают хлопчатую корпию, спрессованную в пластину, и фибрилл из смеси хлопчатой корпии и пульпы, спрессованный в пластину. Примеры твердого носителя для фумиганта самовозгорающегося типа включают горючий тепловыделяющий агент, такой как нитрат, нитрит, соль гуанидина, хлорат калия, нитроцеллюлоза, этилцеллюлоза, древесные опилки и т.п., агенты, стимулирующие термическое разложение, такие как соль щелочных металлов, соль щелочноземельных металлов, бихроматная соль, хроматная соль и т.п., агенты, выделяющие кислород, такие как нитрат калия и т.п., агеты, способствующие горению, такие как меламин, пшеничный крахмал и т.п., наполнители, такие как диатомовая земля, и связующие, такие как синтетическая паста и т.п. Примеры твердого носителя для фумиганта, использующего химическую реакцию, включают тепловыделяющие агенты, такие как сульфид щелочного металла, полисульфид, гидросульфид, оксид кальция и т.п., каталитические агенты, такие как углеродистое соединение, карбид железа, активированная глина и т.п., органические вспенивающие агенты, такие как азодикарбонамид, бензолсульфонилгидразид, динитропентаметилентетрамин, полистирол, полиуретан и т.п., и наполнители, такие как куски натурального волокна, куски синтетического волокна и т.п. Примеры твердого носителя для состава, возгоняющегося без нагревания, включают термопластичную смолу и бумагу (писчую бумагу, папиросную бумагу и т.д.). Примеры материала основы для отравленных приманок включают ингредиенты приманки, такие как пищевой порошок, растительное масло, сахар, кристаллическая целлюлоза и т.п., антиоксиданты, такие как дибутилгидрокситолуол, нордигидрогуаруксусная кислота и т.п., консерванты, такие как дегидроуксусная кислота и т.п., агенты, предотвращающие случайное употребление в пищу детьми или животными, такие как красный бумажный порошок, и аттрактанты для вредителей, такие как сырная отдушка, луковая отдушка, масло земляного ореха и т.п. Способ борьбы с вредителями в соответствии с настоящим изобретением обычно реализуют, нанося эффективное количество настоящего соединения в форме агента для борьбы с вредителями на вредителей или место, в котором вредители обитают. Примеры способа нанесения агента для борьбы с вредителями в соответствии с настоящим изобретением включают следующие способы, и эти способы могут быть подходящим образом выбраны в зависимости от конкретной формы, конкретного места применения агента для борьбы с вредителями в соответствии с настоящим изобретением и т.п. [1] Способ обработки вредителей или места, в котором вредители обитают, агентом для борьбы с вредителями в соответствии с настоящим изобретением как таковым. [2] Способ разбавления агента для борьбы с вредителями в соответствии с настоящим изобретением растворителем, таким как вода и т.п., а затем распыление данного разбавленного раствора на вредителей или место, в котором вредители обитают. В данном случае агент для борьбы с вредителями в соответствии с настоящим изобретением, который обычно представлен в таком виде, как эмульгируемые концентраты, смачиваемые порошки, текучие формы, микрокапсулы и т.п., разбавляют до концентрации от 0,1 до 10000 ч./млн. [3] Способ нагревания агента для борьбы с вредителями в соответствии с настоящим изобретением в месте, в котором вредители обитают, для высвобождения активного ингредиента в летучей форме. В данном случае применяемое количество и применяемая концентрация настоящего соединения могут быть подходящим образом определены в зависимости от формы агента для борьбы с вредителями в соответствии с настоящим изобретением, времени применения, места применения, способа применения, вида вредителей, обстоятельств поражения и т.п. Агент для борьбы с вредителями в соответствии с настоящим изобретением может быть смешан или может применяться с другими инсектицидами, нематоцидами, агентами для борьбы с почвенными вредителями, фунгицидами, гербицидами, регуляторами роста растений, репеллентами, синергетиками, удобрениями или модификаторами почвы. Примеры активного ингредиента такого инсектицида и акарицида включают фосфорорганические соединения, такие как фенитротион, фентион, диазинон, хлорпирифос, ацефат, метидатион, дисульфотон, DDVP, сульпрофос, цианофос, диоксабензофос, диметоато, фентоато, малатион, трихлорфон, азинфос-метил, монокротофос, этион и т.п.; карбаматные соединения, такие как ВРМС, бенфуракарб, пропоксур, карбосульфан, карбарил, метомил, этиофенкарб, алдикарб, оксамил, фенотиокарб и т.п.; пиретроидные соединения, такие как этофенпрокс, фенвалерат, эсфенвалерат, фенпропатрин, циперметрин, перметрин, цигалотрин, дельтаметрин, циклопротрин, фульвалинат, бифентрин 2-метил-2-(4-бромдифторметоксифенил)пропил 3-феноксибензиловый эфир, тралометрил, силафлуофен, d-фенотрин, цифенотрин, d-ресметрин, акринатрин, цифлутрин, тефлутрин, трансфлутрин, тетраметрин, аллетрин, d-фураметрин, праллетрин, эмпентрин, 5-(2-пропинил)фурфурил 2,2,3,3-тетраметилциклопропанкарбоксилат и т.п.; нитроимидазолидиновые производные; N-цианоамидиновые производные, такие как ацетамиприд и т.п.; хлорированные углеводородные соединения, такие как эндосульфан, соединения бензоилфенилмочевины, такие как хлорфлуазурон, тефлубензурон, флуфеноксурон и т.п.; фенилпиразольные соединения; метоксадиазон; бромпропилат; тетрадифон; хинометионат; пиридабен; фенпироксимат; диафентиурон; тебуфенпирад; полинактиновый комплекс [тетранактин, динактин, тринактин]; пиримидифен; мелбемектин; абамектин; ивермектин и азадирахтин. Примеры репеллента включают 3,4-карандиол, N,N-диэтил-м-толуамид, 1-метилпропил 2-(2-гидроксиэтил)-1-пиперидинкарбоксилат, п-ментан-3,8-диол, растительные эфирные масла, такие как масло иссопа, и т.п. Примеры синергетиков включают бис-2,3,3,3-тетрахлорпропиловый эфир (S-421), N-(2-этилгексил)бицикло[2.2.1]гепт-5-ен-2,3-дикарбоксимид (MGK-264) и Далее настоящее изобретение будет дополнительно пояснено более подробно примерами получения, примерами составов и примерами исследований, но настоящее изобретение не ограничивается данными примерами. Сначала будут приведены примеры получения в соответствии с настоящим изобретением. Пример получения 1 В атмосфере азота 0,59 г N,N-дициклогексилкарбодиимида добавляют к смеси 0,55 г 4-метил-2,3,5,6-тетрафторбензилового спирта, 0,51 г (1R)-транс-3-(2-циано-1-пропенил)-2,2-диметилциклопропанкарбоновой кислоты, 0,10 г 4-диметиламинопиридина и 7 мл безводного дихлорметана и смесь перемешивают 3 часа при комнатной температуре. Затем реакционную смесь фильтруют и фильтрат концентрируют при пониженном давлении. Полученный остаток подвергают колоночной хроматографии на силикагеле, получают 0,72 г 4-метил-2,3,5,6-тетрафторбензил(1R)-транс-3-(2-циано-1-пропенил)-2,2-диметилциклопропанкарбоксилата, представленного следующей формулой: (соотношение изомеров по двойной связи: Z/E = около 2/1) (далее именуется настоящим соединением (1)). 1H-ЯМР (CDCl3, TMS), Пример получения 2 В атмосфере азота 0,49 г N,N-дициклогексилкарбодиимида добавляют к смеси 0,50 г 4-метокси-2,3,5,6-тетрафтормензилового спирта, 0,43 г (1R)-транс-3-(2-циано-1-пропенил)-2,2-диметилциклопропанкарбоновой кислоты, 0,087 г 4-диметиламинопиридина и 7 мл безводного дихлорметана и смесь перемешивают 3 часа при комнатной температуре. Затем реакционную смесь фильтруют и фильтрат концентрируют при пониженном давлении. Полученный остаток подвергают колоночной хроматографии на силикагеле, получают 0,62 г 4-метокси-2,3,5,6-тетрафторбензил(1R)-транс-3-(2-циано-1-пропенил)-2,2-диметилциклопропанкарбоксилата, представленного следующей формулой: (соотношение изомеров по двойной связи: Z/E = около 2/1) (далее именуется настоящим соединением (2)). 1H-ЯМР (CDCl3, TMS), Пример получения 3 В атмосфере азота 0,23 г гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида добавляют к смеси 0,20 г 4-аллил-2,3,5,6-тетрафторбензилового спирта, 0,16 г (1R)-транс-3-(2-циано-1-пропенил)-2,2-диметилциклопропанкарбоновой кислоты, 0,05 г 4-диметиламинопиридина и 4 мл безводного хлороформа и смесь перемешивают 3 часа при комнатной температуре. Затем реакционную смесь выливают в ледяную воду с последующей двукратной экстракцией этилацетатом. Этилацетатные слои объединяют, промывают водным насыщенным раствором хлорида натрия, осушают безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток подвергают колоночной хроматографии на силикагеле, получают 0,32 г 4-аллил-2,3,5,6-тетрафторбензил (1R)-транс-3-(2-циано-1-пропенил)-2,2-диметилциклопропанкарбоксилата, представленного следующей формулой: (соотношение изомеров по двойной связи: Z/E = около 2/1) (далее именуется настоящим соединением (3)). 1H-ЯМР (CDCl3, TMS), Далее приведены примеры составов. Все части являются массовыми. Пример состава 1 Каждые 20 частей настоящих соединений (1)-(3) растворяют в 65 частях ксилола, добавляют 15 частей Sorpol 3005X (зарегистрированное торговое наименование Toho Chemical Industry Co., LTD), и полученную смесь перемешивают и тщательно смешивают, получают эмульгируемый концентрат. Пример состава 2 К каждым 40 частям настоящих соединений (1)-(3) добавляют 5 частей Sorpol 3005X и полученную смесь тщательно перемешивают. К смеси добавляют 32 части CARPLEX #80 (синтетический водный диоксид кремния, зарегистрированное торговое наименование Shionogi & Co., Ltd.) и 23 части диатомовой земли (300 меш). Полученную смесь перемешивают и смешивают в жидкостном миксере с получением смачиваемого порошка. Пример состава 3 Каждые 1,5 части настоящих соединений (1)-(3), 1 часть TOKUSIL GUN (синтетический водный диоксид кремния производства Tokuyama Corp.), 2 части REAX 85A (лигнинсульфонат натрия производства Westvaco chemicals), 30 частей Bentonite FUJI (бентонит производства HOJUN Co., Ltd.) и 65,5 частей глины SHOKOZAN A (каолиновая глина производства Shokozan Kogyosho Co.) размалывают и тщательно смешивают. К смеси добавляют воду и смесь тшательно замешивают, гранулируют в экструзионном грануляторе и сушат, получая 1,5% гранулы. Пример состава 4 Смешивают каждые 10 частей настоящих соединений (1)-(3), 10 частей фенилксилилэтана и 0,5 части SUMIDUR L-75 (толилендиизоцианат производства Sumika Bayer Urethane Co., Ltd.). Полученную смесь добавляют к 20 частям 10% водного раствора гуммиарабика с последующим перемешиванием в гомогенизационном миксере, получают эмульсию со средним диаметром частиц 20 мкм. К эмульсии добавляют 2 части этиленгликоля и смесь далее перемешивают 24 часа на нагревательной бане при 60°С, получая микроинкапсулированную суспензию. Отдельно 0,2 части ксантановой смолы и 1,0 часть VEEGUM R (силикат алюминия-магния производства Sanyo Chemical Industries, Ltd.) диспергируют в 56,3 частях воды, очищенной ионным обменом, получая раствор загустителя. Затем 42,5 части микроинкапсулированной суспензии и 57,5 частей раствора загустителя смешивают, получая микроинкапсулированный состав. Пример состава 5 Смешивают каждые 10 частей настоящих соединений (1)-(3) и 10 частей фенилксилилэтана, смесь добавляют к 20 частям 10% водного раствора полиэтиленгликоля с последующим перемешиванием в гомогенизационном миксере, получают эмульсию со средним диаметром частиц 3 мкм. Отдельно 0,2 части ксантановой смолы и 1,0 часть VEEGUM R (силикат алюминия-магния производства Sanyo Chemical Industries, Ltd.) диспергируют в 58,8 частях воды, очищенной ионным обменом, получая раствор загустителя. Затем 40 частей эмульсии и 60 частей раствора загустителя смешивают, получая текучий состав. Пример состава 6 К каждым 5 частям настоящих соединений (1)-(3) добавляют 3 части CARPLEX #80 (тонкодисперсный порошок синтетического водного диоксида кремния, зарегистрированное торговое наименование Shionogi & Co., Ltd.), 0,3 части РАР (смесь моноизопропилфосфата и диизопропилфосфата) и 91,7 частей талька (300 меш) и смесь перемешивают и смешивают в жидкостном миксере с получением пылевидного порошка. Пример состава 7 Каждые 0,1 части настоящих соединений (1)-(3) растворяют в 10 частях дихлорметана и раствор смешивают с 89,9 части дезодорированного керосина, получают масляный раствор. Пример состава 8 Каждые 1 часть настоящих соединений (1)-(3), 5 частей дихлорметана и 34 части дезодорированного керосина смешивают до растворения и помещают в аэрозольный контейнер. После установки клапанной части через клапанную часть под давлением вводят 60 частей пропеллента (сжиженного попутного газа), получают масляный аэрозоль. Пример состава 9 Раствор, полученный смешиванием до растворения каждых 0,6 частей настоящих соединений (1)-(3), 5 частей ксилола, 3,4 части дезодорированного керосина, 1 части ATMOS 300 (эмульгатор, зарегистрированное торговое наименование Atlas Chemical Co.) и 50 частей воды, помещают в аэрозольный контейнер и через клапанную часть под давлением вводят 40 частей пропеллента (сжиженного попутного газа), получают водный аэрозоль. Пример состава 10 Каждые 0,3 г настоящих соединений (1)-(3) растворяют в 20 мл ацетона и 99,7 г материала носителя для спирали (полученного смешиванием порошка Табу, Pyrethrum marc и древесных опилок в соотношении 4:3:3) смешивают до однородности и перемешивают, добавляют туда 100 мл воды и смесь тшательно замешивают, формуют и сушат, получая инсектицидную спираль. Пример состава 11 К каждым 0,8 г настоящих соединений (1)-(3) добавляют ацетон и 0,4 г пиперонилбутоксида до их растворения и общий объем доводят до 10 мл. Материал носителя для инсектицидных пластин для электрофумигатора (фибриллы из смеси хлопчатой корпии и пульпы, спрессованные в форме пластины) размером 2,5×1,5 см толщиной 0,3 см однородно импрегнируют 0,5 мл данного раствора, получают инсектицидную пластину для электрофумигатора. Пример состава 12 Каждые 3 части настоящих соединений (1)-(3) растворяют в 97 частях дезодорированного керосина с получением раствора, который помещают в контейнер, изготовленный из поливинилхлорида, и устанавливают поглощающий фитиль (полученный отверждением неорганического порошка со связующим и прокаливанием смеси), имеющий верхнюю часть, которая может быть нагрета нагревателем, получают устройство, применяемое в электрофумигаторных устройствах с поглощающим фитилем. Пример состава 13 Каждые 100 мг настоящих соединений (1)-(3) растворяют в подходящем объеме ацетона и раствором импрегнируют пористую керамическую пластину размером 4,0×4,0 см толщиной 1,2 см, получают термофумигант. Пример состава 14 Каждые 100 мкг настоящих соединений (1)-(3) растворяют в подходящем объеме ацетона, раствор равномерно наносят на фильтр размером 2×2 см толщиной 0,3 мм и ацетон высушивают на воздухе, получают летучий агент для применения при комнатной температуре. Далее примеры исследований показывают, что настоящие соединения эффективны в качестве активного ингредиента агента для борьбы с вредителями. Пример исследования 1 Каждые 0,025 части настоящих соединений (1)-(3), полученные в приведенных выше примерах получения, растворяют в 10 частях дихлорметана и раствор смешивают с 89,975 частями дезодорированного керосина с получением 0,025% масляного раствора. Взрослых домовых мух (5 самцов и 5 самок, всего 10 особей) выпускают в кубическую камеру со сторонами 70 см и через небольшое окно на боковой грани камеры с помощью распылительного пистолета под давлением 8,8×104 Па в камеру распыляют 0,7 мл 0,025% масляного раствора настоящего соединения, приготовленного выше. Через две минуты после распыления подсчитывают число упавших домовых мух (повторяют дважды). Дополнительно в тех же условиях повторяют исследование, используя вместо настоящих соединений (1)-(3) 4-метил-2,3,5,6-тетрафторбензил (1R)-транс-3-(2-метил-1-пропенил)-2,2-диметилциклопропанкарбоксилат, представленный следующей формулой: (соединение, раскрытое в ЕР 0926129А1, далее именуемое сравнительным соединением (1)), 4-метокси-2,3,5,6-тетрафторбензил (1R)-транс-3-(2-метил-1-пропенил)-2,2-диметилциклопропанкарбоксилат, представленный следующей формулой: (соединение, раскрытое в US 4405640, далее именуемое Сравнительным соединением (2)), и 4-аллил-2,3,5,6-тетрафторбензил (1R)-транс-3-(2-метил-1-пропенил)-2,2-диметилциклопропанкарбоксилат, представленный следующей формулой: (соединение, раскрытое в US 4405640, далее именуемое сравнительным соединением (3)) в качестве контроля. Результаты представлены в таблице 1. Исследуемое соединение Число упавших домовых мухНастоящее соединение (1)10 Настоящее соединение (2)10 Настоящее соединение (3)9 Сравнительное соединение (1)0 Сравнительное соединение (2)0 Сравнительное соединение (3)0 Пример исследования 2 Каждые 0,00625 части настоящих соединений (1)-(3), полученных в приведенных выше примерах получения, растворяют в 10 частях дихлорметана и раствор смешивают с 89,99375 частями дезодорированного керосина с получением 0,00625% масляного раствора. Десять самок обыкновенного москита (Culex pipens pallens) выпускают в кубическую камеру со сторонами 70 см и через небольшое окно на боковой грани камеры с помощью распылительного пистолета под давлением 8,8×104 Па в камеру распыляют 0,7 мл 0,00625% масляного раствора настоящего соединения, приготовленного выше. Через десять минут после распыления самок обыкновенного москита переводят в чистый стакан (диаметр дна 8,2 см) с хлопковым войлоком, содержащим 0,5% водного раствора сахара, и оставляют на сутки. Через 24 часа подсчитывают число мертвых москитов и вычисляют смертность (повторяют дважды). Дополнительно в тех же условиях повторяют исследование, используя вместо настоящих соединений (1)-(3) 4-метоксиметил-2,3,5,6-тетрафторбензил (1R)-транс-3-(2-циано-1-пропенил)-2,2-диметилциклопропанкарбоксилат (соотношение изомеров по двойной связи E/Z приблизительно 2/1; соединение, описанное в US 6908945B2, далее именуемое сравнительным соединением (4)) в качестве контроля. Результаты представлены в таблице 2. Исследуемое соединение Смертность (%) Настоящее соединение (1)95 Настоящее соединение (2)100 Настоящее соединение (3)70 Сравнительное соединение (4)16Промышленная применимость Поскольку настоящее соединение обладает превосходной эффективностью в борьбе с вредителями, оно полезно в качестве активного ингредиента агента для борьбы с вредителями. Формула изобретения1. Сложноэфирное соединение, представленное формулой (1) 2. Сложноэфирное соединение по п.1, где А представляет одинарную связь. 3. Сложноэфирное соединение по п.1, где А представляет атом кислорода. 4. Агент для борьбы с насекомыми-вредителями, включающий сложноэфирное соединение, представленное формулой (1), в качестве активного ингредиента. 5. Способ борьбы с насекомыми-вредителями, включающий нанесение эффективного количества сложноэфирного соединения, представленного формулой (1), на насекомых-вредителей или место, в котором насекомые-вредители обитают. 6. Применение сложноэфирного соединения, представленного формулой (1), для борьбы с насекомыми-вредителями. Популярные патенты: 2005344 Способ облучения живых организмов или растений ... для интенсификации производства сельскохозяйственной продукции. Осуществление предлагаемого способа подтверждает эффект воздействия лазерного излучения на живой организм, результатом которого является стимуляция энергетических процессов углеводного обмена, а также восстановления функций опорнодвигательного аппарата больных живых организмов. В результате подтверждается обоснованность применения когерентного лазерного излучения для создания эффективных сельскохозяйственных технологий, а также использование современных промышленных технологий. (56) Бурилков В. К. , Крочик Г. М. Биологическое действие лазерного излучения, Кишинев, Штиинца, 1989 г. ФОРМУЛА ИЗОБРЕТЕНИЯ СПОСОБ ... 2272399 Зерноуборочный комбайн ... периметрам молотильных барабанов и непрерывный вымолот зерна на всем пути ее прохождения через молотильное устройство, улучшить условия выделения зерна и его прохождения через деки за счет центробежных сил, создаваемых при их вращении, что в итоге дает возможность существенно повысить эффективность вымолота зерна и снизить его потери.Выполнение молотильных барабанов в виде открытых с переднего и закрытых с заднего торца труб, установка в передних частях их внутренних полостей турбокомпрессоров с воздухозаборниками, а в боковых стенках - сопловых устройств позволяет создать в молотильном устройстве радиальные и осевые воздушные потоки, которые смещают обмолачиваемую массу к периметрам ... 2216903 Устройство для отделения плодов от ветвей ... срезанных ветвей и разделять урожай на фракции. Наиболее близким по технической сущности и достигаемому положительному эффекту (прототипом) является устройство для отделения плодов от ветвей, преимущественно облепихи, содержащее раму с опорными колесами и установленные на раме активационную камеру, в которой размещены барабаны с пружинными пальцами, возбудители колебаний, механизм привода, ленточный транспортер для улавливания плодов, вентилятор и приемные емкости, (см. описание к а.с. 309677, заявл. 19.05.70, по кл. А 01 D 46/00). Данное устройство также не позволяет убирать урожай со срезанных ветвей и осуществлять разделение вороха на фракции. Задача настоящего изобретения состоит ... 2121263 Способ лесоводственной оценки технологического комплекса машин ... предлагаемого способа позволяет с большей точностью и надежностью оценить технологию для разработки лесосек в конкретных природных условиях, при отрицательной оценке внести необходимые коррективы и осуществить подбор необходимых машин для проведения рубок в соответствии с предъявляемыми требованиями. Источники информации 1. Указания по освидетельствованию мест рубок, подсочки (осмолоподсочки) насаждений и заготовки второстепенных лесных материалов. - М.: ЦБНТИ Гослесхоза СССР, 1984, с. 39. 2. Правила рубок главного пользования в равнинных лесах европейской части Российской Федерации. - М.: 1994, 32 С. (Утверждены приказом ФС ЛХ России от 31 августа 1993 г. N 226). 3. ... 2472951 Машина (варианты) ... Поэтому к технико-экономической эффективности можно отнести: - упрощение конструкции и эксплуатации двигателя, трансмиссии ходовой системы, механизмов поворота, торможения, регулирования мощности, нагрузки, скорости, - ручной, можно электро и пневмопривод, а привод силами людей полезно для них и машин, - регулирование хода поршня, степени сжатия, числа цилиндров, режимов их пуска и работы без коленчатого и куличкового валов, шатунов, потерь энергии на трение, /ресурса/. - пакетируемость цилиндров, изменение мощности и производительности, - унифицируемость цилиндров двигателей различной мощности, компактность и агрегатируемость машинами любой навески. Вариатор с двумя ... |
Еще из этого раздела: 2482660 Способ выращивания рапса ярового на семена 2303347 Способ ведения виноградных кустов 2054872 Гербицидная композиция и способ борьбы с сорняками 2470922 Сокристаллы 2406293 Способ определения содержания водорастворимых углеводов и крахмала из одной навески 2429594 Палец штампосварной для режущего аппарата (варианты) и способ его изготовления 2267924 Способ стимулирования роста растений 2067832 Способ борьбы с грибковыми инфекциями растений 2140137 Универсальный способ получения проросших семян сельскохозяйственных культур 2265314 Устройство системы зашторивания теплиц с регулируемым ходом |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
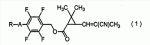 которое может найти применение для борьбы с насекомыми-вредителями. В формуле (1) R представляет C1-C4 алкильную группу или С3-С4 алкенильную группу и А представляет одинарную связь или атом кислорода. Изобретение относится также к агенту для борьбы с насекомыми-вредителями, способу борьбы с насекомыми-вредителями и применению соединения формулы (1) для борьбы с насекомыми-вредителями. 4 н. и 2 з.п. ф-лы, 2 табл., 19 пр.
которое может найти применение для борьбы с насекомыми-вредителями. В формуле (1) R представляет C1-C4 алкильную группу или С3-С4 алкенильную группу и А представляет одинарную связь или атом кислорода. Изобретение относится также к агенту для борьбы с насекомыми-вредителями, способу борьбы с насекомыми-вредителями и применению соединения формулы (1) для борьбы с насекомыми-вредителями. 4 н. и 2 з.п. ф-лы, 2 табл., 19 пр.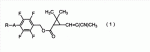
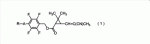


 -ВНС, 1,1-бис(хлорфенил)-2,2,2-трихлорэтанол и т.п.;
-ВНС, 1,1-бис(хлорфенил)-2,2,2-трихлорэтанол и т.п.; -[2-(2-бутоксиэтокси)этокси]-4,5-метилендиокси-2-пропилтолуол(пиперонилбутоксид).
-[2-(2-бутоксиэтокси)этокси]-4,5-метилендиокси-2-пропилтолуол(пиперонилбутоксид).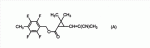
 (м.д.): 1,21 (с, 3H, Z+E изомеры), 1,32 (с, 3H, Z+E изомеры), 1,71 (т, 1H, Z+E изомеры), 1,95 (с, 3H, Z+E изомеры), 2,19 (м, 1/3H, E изомер), 2,29 (с, 3H, Z+E изомеры), 2,45 (м, 2/3H, Z изомер), 5,24 (с, 2H, Z+E изомеры), 5,78 (д, 2/3H, Z изомер), 6,00 (д, 1/3H, E изомер).
(м.д.): 1,21 (с, 3H, Z+E изомеры), 1,32 (с, 3H, Z+E изомеры), 1,71 (т, 1H, Z+E изомеры), 1,95 (с, 3H, Z+E изомеры), 2,19 (м, 1/3H, E изомер), 2,29 (с, 3H, Z+E изомеры), 2,45 (м, 2/3H, Z изомер), 5,24 (с, 2H, Z+E изомеры), 5,78 (д, 2/3H, Z изомер), 6,00 (д, 1/3H, E изомер).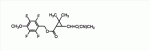
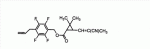
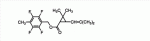
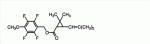
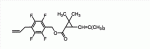
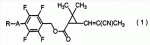 ,где R представляет C1-C4 алкильную группу или С3-С4 алкенильную группу и А представляет одинарную связь или атом кислорода.
,где R представляет C1-C4 алкильную группу или С3-С4 алкенильную группу и А представляет одинарную связь или атом кислорода.