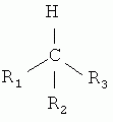
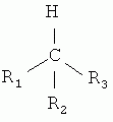
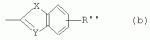Способ защиты материалов от микробного разрушенияПатент на изобретение №: 2442327 Автор: Эль-Регистан Галина Ивановна (RU), Николаев Юрий Александрович (RU), Калинин Михаил Владимирович (RU), Гальченко Валерий Фёдорович (RU), Борзенков Игорь Анатольевич (RU), Козлова Алла Николаевна (RU), Гернет Марина Васильевна (RU), Шаненко Елена Феликсовна (RU), Воронина Надежда Александровна (RU), Кочеткова Алла Алексеевна (RU), Мулюкин Андрей Львович (RU), Шатилова Татьяна Ивановна (RU) Патентообладатель: Общество с ограниченной ответственностью "ИНМИОЛ" (RU) Дата публикации: 27 Апреля, 2011 Начало действия патента: 17 Марта, 2009 Адрес для переписки: 344064, г.Ростов-на-Дону, ул. Шеболдаева, 54, ООО "ИНМИОЛ" Изобретение относится к способам защиты материалов от микробного разрушения путем обработки защищаемого материала веществом с антимикробной активностью. Способ заключается в том, что в качестве вещества с антимикробной активностью используют алкилоксифенильное производное метана общей формулы: где R1 выбран из водорода, алкила C1-C21, алкилоксифенила, R2 выбран из водорода, оксифенила, алкилоксифенила, диалкилоксифенила, R3 выбран из алкилоксифенила, диоксифенила, диалкилоксифенила, при этом в алкилоксифениле и диалкилоксифениле алкил выбран из C2-C20, при этом концентрации вещества с антимикробной активностью составляют 0.002-0.5% мас. Способ обеспечивает расширение ассортимента веществ для антимикробной защиты, обладающих пролонгированным действием и повышенной надежностью защиты. 8 пр., 4 табл. Изобретение относится к способам подавления роста микроорганизмов и может быть использовано для защиты органических и неорганических материалов от биоповреждений, а также в медицине, ветеринарии, микробиологической и медицинской промышленности. Известен способ защиты материалов, например смазочно-охлаждающей жидкости на водной или неводной основе, когда в нее вводят композицию соединений, подавляющих рост анаэробов, которая содержит Недостатком указанного способа являются применение антимикробных композиций, подавляющих только микроорганизмы одного типа, например анаэробы, и не активных против других организмов, например аэробов, а также ингибирование развития только вегетативных клеток, но не покоящихся форм, таких как споры. Известен способ защиты материалов, например технического масла, от воздействия микромицетов, предусматривающий введение в техническое масло эфирного масла цитраль (3,7-диметилоктадиен-2,6-аль-1) в количестве 0,5-1,0% (RU 2074250, 27.02.1992). Известен способ борьбы с бактериями и загрязняющими (контаминирующими) организмами, включающий нанесение на указанные бактерии и загрязняющие организмы или места их обитания эффективного количества антибактериального активного ингредиента, соответствующего формуле (а): где n=1 или 2; R1 - водород; R представляет (а) фенил; фенил, замещенный 1 или 2 заместителями, независимо выбранными из галогена, C1-12-алкила, тригалометила, C1-5-алкокси, C1-4-алкилкарбонил или нитро; тиенил, когда n
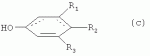
где Х - кислород или сера, Y - азот или СН; R'' - водород или C1-4-алкил (RU 2143805, 10.01.2000). Недостатком указанного способа является то, что биоциды указанной формулы, применяемые для защиты материалов, обладают токсическим действием и являются экологически опасными веществами. Известно также использование антимикробных белков и пептидов для защиты объектов от микробного разрушения. Например, известно применение белкового компонента, выделенного из растительного хроматина после разложения последнего, в качестве антимикробного агента. Указанный белковый компонент имеет кажущуюся молекулярную массу в интервале от 10 до 20 кДа (RU 2303357, 27.07.2007). Однако данное вещество может быть разрушено микроорганизмами, что сокращает срок его защитного действия. К общему недостатку используемых способов защиты материалов от биоповреждений следует отнести развитие процесса автолиза микроорганизмов, ингибированных биоцидами, вследствие чего в среду попадают органические вещества, облегчающие последующее развитие микроорганизмов второй волны контаминации. Тем самым срок защитного действия биоцидов сокращается. Наиболее близким к предложенному изобретению является способ защиты материалов от микробиологического и окислительного разрушения, согласно которому навеску вещества фенольного ряда вносят в защищаемый материал, при этом используют вещество общей формулы (с):
где R1=H; НО или алкил C 2-C21; R2=H; ОН; (CH 2)nOH, где n=2-6; CH2 COOR4(R4=Н или алкил C1-C 20); алкил С6-C21 или CH2 COR5 [R5=СО(СН2 )nCH3, где n=0-19 или NН(СНz2 )nCH3, где n=0-19] R 3=Н или алкил С2-С21, причем R1, R2 и R3 одновременно не могут быть водородами (RU 2086610, 10.08.1993). Антимикробные вещества в известном способе обладают широким спектром действия и пролонгированным характером защиты. Однако недостатком известного технического решения, принятого за прототип, является высокая гидрофобность большинства соединений общей формулы, что существенно ограничивает сферу их применения. Кроме того, в патенте описано применение для защиты материалов лишь ограниченного спектра экологически безопасных веществ, не приведены примеры пролонгированного антимикробного действия и предотвращения автолиза клеток ингибированных микроорганизмов. Задачей настоящего изобретения являются расширение ассортимента экологически безопасных веществ, которые могут быть использованы для антимикробной защиты материалов разной природы и обладают пролонгированным действием, а также повышение надежности защиты. Поставленная задача решается описываемым способом защиты материалов от микробного разрушения путем обработки защищаемого материала веществом с антимикробной активностью, при этом в качестве вещества с антимикробной активностью используют алкилоксифенильное производное метана общей формулы: где R1 выбран из водорода, алкила C1-C21, алкилоксифенила, R2 выбран из водорода, оксифенила, алкилоксифенила, диалкилоксифенила, R3 выбран из алкилоксифенила, диоксифенила, диалкилоксифенила, при этом в алкилоксифениле и диалкилоксифениле алкил выбран из С2-С20, при этом концентрации вещества с антимикробной активностью составляют 0.002-0.5% мас. Нами установлено, что указанные выше вещества обладают антимикробной активностью против вегетативных и покоящихся клеток широкого спектра микроорганизмов: бактерий, архей, грибов, дрожжей. Они предотвращают их автолиз и вторичную волну контаминации, что обеспечивает пролонгированный эффект и отсутствие привыкания. Основная биологическая активность соединений заключается в индукции перехода вегетативных клеток микроорганизмов в состояние анабиоза и поддержании этого состояния, что выражается в ингибировании прорастания покоящихся форм и роста микроорганизмов. Кроме того, заявленные производные метана являются низкотоксичными соединениями. По молекулярному механизму действия используемые производные метана являются модификаторами мембран и биополимеров клетки, что обусловливает потерю клеткой метаболитической активности, способности к пролиферации и ее гибель без последующего автолиза. Используемые производные метана можно получить известными методами синтеза, или выделить из природных источников. Максимальный эффект защиты материалов от микробного разрушения достигается путем введения заявленных веществ в концентрации от 20 до 5000 мг/л в зависимости от таксономической группы микроорганизмов (эубактерии, археи, грибы) и физиологической группы (гетеротрофы, автотрофы, углеводородокисляющие, сульфатредуцирующие и др.). Заявленные вещества при разбавлении до концентраций ниже 10 мг/л не оказывают угнетающего действия на развитие микроорганизмов. Антимикробную активность веществ изучают методами турбидиметрического определения роста микроорганизмов в селективных питательных жидких средах при измерении оптической плотности (ОП) микробной суспензии на фотоэлектроколориметре ФЭК-56, фильтр Испытуемые вещества вносят в виде раствора в воде, или в этиловом спирте (96%-ный ректификат), или в специальном растворителе, состоящем из ацетона, содержащего 10% детергента Твин-80, в количестве 0,5-1% об/об. В контрольные варианты вносят равные количества компонентов растворителей. Концентрации вносимых веществ в среде роста от максимальной - 5000 мг/л (0.5% мас.), уменьшаются дробно до минимальной концентрации 1,0 мг/л (0.0001% мас.). Антимикробную активность оценивают по величине минимальных рост-ингибирующих концентраций (МИК), выраженных в мг/л. В таблице 1 приведены конкретные вещества, соответствующие общей формуле, указанной выше, которые опробованы нами для защиты материалов от микроорганизмов, указанных в таблице 2. Таблица 1. Вещества, обладающие антимикробной активностью.  Вещества, спецификация радикалов R1, R2, R3 .1 Алкил, алкилоксифенилметаны, где R1-Н или алкил С2-С21, R 2-H; R3 - алкилоксифенил с длиной алкильного радикала С2-С21. 2Триалкилоксифенилметаны, где R1, R2 и R3 - алкилоксифенилы с длиной алкильного радикала C2-C21. 3 Алкилоксифенилметан, где R1-С5Н11 , R2 - Н; R3 - диоксифенил. 4 Алкилоксифенилметан, где R1, R2 - Н, R 3 - диалкилоксифенил. 5Диалкилоксифенилметан, где R1 - Н, R2, R3 - диалкилоксифенил. Вещества, спецификация радикалов R1, R2, R3 .1 Алкил, алкилоксифенилметаны, где R1-Н или алкил С2-С21, R 2-H; R3 - алкилоксифенил с длиной алкильного радикала С2-С21. 2Триалкилоксифенилметаны, где R1, R2 и R3 - алкилоксифенилы с длиной алкильного радикала C2-C21. 3 Алкилоксифенилметан, где R1-С5Н11 , R2 - Н; R3 - диоксифенил. 4 Алкилоксифенилметан, где R1, R2 - Н, R 3 - диалкилоксифенил. 5Диалкилоксифенилметан, где R1 - Н, R2, R3 - диалкилоксифенил. Сущность изобретения поясняется примерами. Пример 1. В ряд пробирок, содержащих специальные питательные среды для роста культур микроорганизмов (табл.2), вносят вещество 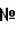 3 (табл.1) для этих культур Штамм микроорганизма МИК, мг/л Methanosarcina acetovorans 20Bacillus subtilis20 Micrococius luteus20 Staphylococcus aureus20 Streptococcus faecalis 20 Lactococcus lactis 20Staphylococcus aureus25 Streptomyces coelicolor 30 Halobacterium halobium 30Lactobacillus acidophilus50 Salmonella minnesota65 Pseudomonas 65 Mycobacterium smegmatis 70Saccharomyces cerevisiae300 Candida utilis 300 Aspergillus niger 300Penicillium brevi-300 3 (табл.1) для этих культур Штамм микроорганизма МИК, мг/л Methanosarcina acetovorans 20Bacillus subtilis20 Micrococius luteus20 Staphylococcus aureus20 Streptococcus faecalis 20 Lactococcus lactis 20Staphylococcus aureus25 Streptomyces coelicolor 30 Halobacterium halobium 30Lactobacillus acidophilus50 Salmonella minnesota65 Pseudomonas 65 Mycobacterium smegmatis 70Saccharomyces cerevisiae300 Candida utilis 300 Aspergillus niger 300Penicillium brevi-300 Приведенный пример показывает, что алкилоксифенилметан (вещество Пример 2. Питательную среду инокулируют смесью микроорганизмов, В. subtilis, P. fluorescens S. cerevisiae. Затем по методу, описанному в примере 1, в питательную среду вносят препарат Данный пример показывает, что у микроорганизмов не происходит развития адаптационных реакций в отношении биоцидных веществ общей формулы и поэтому ростподавляющее действие испытанных веществ сохраняется в течение не менее 12 месяцев. Пример 3. В пробирки с питательными средами вносят культуры микроорганизмов (Saccharomyces cerevisiae, Micrococcus luteus, Thioalkalivibrio versutus, Staphylococcus aureus, Mycobacterium smegmatis) и инкубируют в течение 1-3 сут до достижения стационарной фазы, после чего добавляют вещество Данный пример доказывает, что применение веществ Пример 4. Растения ячменя в стадии кущения были обработаны веществом 1 (табл.1) в концентрации 230-350 мг/л. На опытных и контрольных участках применялась одинаковая технология обработки почвы и внесения удобрений. На опытном участке растения, обработанные веществом 1, не поражались фитопатогенными грибами и бактериями, в отличие от необработанных растений контрольного участка. При этом зерно было лучшего качества за счет отсутствия поражения фитопатогенными грибами. Для яблонь при обработке на стадии образования завязей был получен аналогичный результат (яблоки не поражались паршой). Данный пример показывает, что препараты на основе вещества 1 являются не только эффективными, но и экологически безопасными. Они могут эффективно применяться для защиты сельскохозяйственных растений от фитопатогенных микроорганизмов. Пример 5. Культуры углеводородокисляющих бактерий Rhodococcus erytropolis и R. maris вносили в пробирки с 10 мл среды Раймонда с 2% нефти до концентрации 3×108 кл/мл. В пробирки вносили вещество 1 (табл.1) до концентрации 0.005-0.5%. В контрольном варианте биоцид не был добавлен. Пробирки культивировали при 27°С в течение 14 суток. Выводы о наличии роста и развития культур делали на основании помутнения среды роста, образования эмульсии вода-нефть и микроскопического исследования образцов. Культуры углеводородородокисляющих бактерий выращивали, как описано выше, и добавляли (в количестве 10%) к культурам сульфатвосстанавливающих бактерий, которые затем выращивали на среде Видделя с лактатом в пробирках Балча в течение 2 недель. При засеве вносили вещество Результаты анализа развития культур углеводородокисляющих и сульфатвосстанавливающих бактерий в присутствии нефти представлены в табл.4. Данный пример показывает, что биоциды общей формулы эффективно подавляют развитие углеводородокисляющих и сульфатредуцирующих бактерий, участвующих в разложении нефти и нефтепродуктов, и могут быть использованы для предотвращения их биокоррозии в концентрациях 0.1-0.5%. Таблица 4 Влияние различных концентраций вещества 1 на рост и развитие углеводородокисляюших бактерий R. erytropolis и R. maris. Концентрация вещества 1, % Титр клеток углеводородокисляющих бактерий Активность сульфатредуцирующих бактерий 0109 100 0.005 109100 0.01 10740 0.05 10610 0.1 Менее 105 00.5 Менее 105 0Пример 6. Влияние препарата вещества 1 на коррозию стали оценивали по методу определения защитной способности ингибиторов коррозии металлов в водонефтяных средах (ГОСТ 9.506-87) с использованием образцов стали Ст3. Содержание вещества 1 составляло 0.005%, 0.01%, 0.05%, 0.1%, 0.5% (мас.). Эффективными оказались концентрации от 0.05% и выше. При содержании вещества 1 от 0.1% до 0.5% (мас.) снижение скорости коррозии составило 65-75%. Аналогичные результаты получены для веществ Полученные данные свидетельствуют, что вещества общей формулы в концентрациях 0.05-0.5% (мас.) являются ингибиторами коррозии металлов в условиях работы нефтеперерабатывающего оборудования. Пример 7. Определение силы биоцидного действия. Культуры бактерий Staphylococcus aureus и Mycobacterium smegmatis выращивали на среде LB состава (г/л): пептон 10, дрожжевой экстракт - 5, NaCl - 5, рН 7.0-7.5, при температуре 30°С. Для выращивания М. smegmatis в среду добавляли детергент Твин-80 (0.01%) для диспергирования агрегатов клеток до единичных клеток. Для определения силы антимикробной активности испытуемых веществ в пробирки объемом 20 мл вносили по 5 мл среды, внося испытуемый препарат вместе с инокулятом (2% культуры стационарной фазы роста). Начальная концентрация клеток - 50-100 млн/мл. В качестве антимикробного агента вносили препарат Данный пример показывает, что растворы вещества Пример 8. Водные растворы вещества Аналогичные данные по подавлению активности протеолитических грибов с применением вещества Данный пример показывает, что вещество Формула изобретенияСпособ защиты материалов от микробного разрушения путем обработки защищаемого материала веществом с антимикробной активностью, отличающийся тем, что в качестве вещества с антимикробной активностью используют алкилоксифенильное производное метана общей формулы Популярные патенты: 2095957 Устройство для транспортирования подстилочного навоза ... транспортирования и разгрузки свежего навоза. Свежий навоз и прежде всего подстилочный, обладая высокой связанностью и липкостью, замажет транспортирующие планки и цепь, и выгрузка будет ненадежной и малопроизводительной, а при высокой влажности навоза и невозможной. Таким же недостатком обладают и саморазгружающиеся транспортные устройства в виде мобильных кормораздатчиков, таких как КТУ 10 и др. где кормовая масса разгружается тоже транспортерами, установленными на дне кузова, и эти транспортеры не способны перемещать связанную массу подстилочного навоза. Вот эти свойства снежного навоза и вынудили при бесподстилочном содержании животных убирать навоз и транспортировать его ... 2264065 Способ возделывания сельскохозяйственных культур на корм ... см. В этой фазе уборки также имела преимущество горохозлаковая смесь.В дальнейшем доля донника в урожае возрастала, а гороха снижалась. Обусловлено это остановкой в росте злакового компонента, что благоприятствовало лучшему освещению донника и созданию более благоприятных условий для роста его растений. Кроме того, к этому времени, опять же в силу биологических особенностей, у донника наблюдается интенсивный прирост надземной биомассы. Горох, наоборот, вступал в фазу налива и созревания зерна, что сопровождалось усыханием растений и опаданием листьев. Тем не менее, при всех способах возделывания самая высокая урожайность абсолютно сухого вещества наблюдается в фазе тестообразного ... 2076603 Способ повышения урожайности сельскохозяйственных культур ... раствор биопрепарата разливают в кюветы и замораживают при температуре -20oС. Затем кюветы устанавливают в камеру лиофильной сушилки и замороженный биопрепарат высушивают в вакууме. Высушенный препарат представляет собой порошок светло-серого или темно-серого цвета. Пример 1. Оценку фунгицидной активности препарата проводили на чистых культурах фитопатогенных грибов согласно методическим рекомендациям по определению фунгицидной активности новых соединений (5). Для опытов использовали 2%-ную картофельно-агаризованную среду. В охлажденную до 50oС среду добавляли 1%-ный раствор препарата до конечной концентрации 0,003% Затем сразу разливали в чашки Петри с диаметром 10 см и оставляли ... 2054872 Гербицидная композиция и способ борьбы с сорняками ... аминосульфонил] N,N-диметил-3-пиридинкарбоксамида (II) на Echinochloa Crus-Galli. Эксперимент проводится с посевом семян Echinochloa Crus-Galli. В табл. 1 представлены средние данные двух испытаний в теплице. Показанные в табл. 1 результаты показывают отличную и даже неожиданную степень синергии, полученную с предлагаемой смесью. П р и м е р 2. Опыт, показывающий природу биологического синергического эффекта смеси октаноата бромоксинила (I) с 2-[[(4,6-диметоксипиримидин-2-ил)аминок-арбонил]аминосульфонил] N,N-диметил-3-пиридинкарбоксамидом (II) на Lolium multiflorum. Эксперимент проводится с посевом семян Lolium multiflorum. В табл. 2 представлены ... 2027341 Бункер для сыпучих материалов ... вместе с потоком воздуха переносится в шламосборник 7, где взвесь связывается водой, а освободившийся от нее воздух выходит за пределы шламосборника в атмосферу. В процессе движения потока взвеси по пневмопроводу 4 при прохождении им струйных аппаратов 43, форкамерами для которых является незаполненная зернопродуктами часть пространства под перегородками 48, происходит подсос легкой взвеси, выделяемой из зернопродуктов в процессе их перемещения по секциям отсеков. Перелопачивание при помощи шнекового подъемника 5 может осуществляться как при открытых выпускных окнах В и С, так и при закрытых: как при нагнетании воздуха в бункер, так и без нагнетания. Перелопачивание ... |
Еще из этого раздела: 2108013 Рабочий орган культиватора 2120752 Способ консервирования ксеногенных клеток печени 2414114 Зерноуборочный комбайн 2182420 Устройство для перерезания стволов деревьев 2066320 Производные тиазола, способ их получения и способ борьбы с грибками 2272399 Зерноуборочный комбайн 2420940 Энергосберегающий способ обеззараживания семян люпина от антракноза 2189742 Способ обработки инкубационных яиц 2312500 Способ защиты смородины от вредителей и болезней 2163758 Способ и устройство контроля количества меда в улье |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
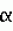 -три-1-(п-нитрофенол)-2-аминопропандиол-1,3 и органический сульфонат (Патент ГДР
-три-1-(п-нитрофенол)-2-аминопропандиол-1,3 и органический сульфонат (Патент ГДР 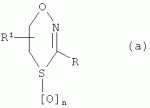
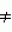 2, фуранил; или R представляет собой радикал формулы (b):
2, фуранил; или R представляет собой радикал формулы (b):