Штамм бактерий bacillus licheniformis (его варианты), обладающий бактерицидной и фунгицидной активностью, и препарат на основе этого штаммаПатент на изобретение №: 2440413 Автор: Леляк Анастасия Александровна (RU), Леляк Александр Иванович (RU) Патентообладатель: Леляк Александр Иванович (RU) Дата публикации: 20 Января, 2012 Начало действия патента: 16 Августа, 2010 Адрес для переписки: 630559, Новосибирская обл., Новосибирский р-н, р.п. Кольцово, а/я 247, А.И. Леляку Изобретение относится штамму микроорганизма, обеспечивающему восстановление микробиоценоза почвы и желудочно-кишечного тракта (ЖКТ) животных, обладающего антибактериальной и фунгицидной активностью, и к препаративной форме на их основе и может быть использовано в биотехнологии, ветеринарной медицине и защите растений. Штаммы Bacillus licheniformis IC-831-1-2, Bacillus licheniformis IC-832-1-2, Bacillus licheniformis IC-833-1-2, Bacillus licheniformis IC-834-1-2 получены методом направленной селекции и депонированы во Всероссийской Коллекции Промышленных Микроорганизмов ФГУП ГосНИИГенетика под регистрационными номерами ВКПМ соответственно: В-10561, В-10562, В-10563 и В-10564. Препарат характеризуется содержанием наполнителя с биомассой бактерий в споровой форме Bacillus licheniformis ВКПМ В-10561, или ВКПМ В-10562, или ВКПМ В-10563, или ВКПМ В-10564, или их смесь с титром каждого штамма бактерий не менее 1·10 3 КОЕ/г или 1·103 КОЕ/мл. В качестве наполнителя он содержит воду или порошкообразный сорбент. Изобретение позволяет повысить эффективность восстановления микробиоценоза почвы, ЖКТ животных и расширить спектр антибактериальной и фунгицидной активности. 5 н. и 4 з.п. ф-лы, 9 табл. Изобретение относится к штамму микроорганизма, обеспечивающему восстановление микробиоценоза почвы и желудочно-кишечного тракта (ЖКТ) животных, обладающему антибактериальной и фунгицидной активностью, и к препаративной форме на его основе и может быть использовано в биотехнологии, ветеринарной медицине и защите растений для получения препаратов против бактериальных и грибных инфекций животных и растений, а также для использования в качестве микробиологических удобрений и пробиотиков для восстановления микробиоценоза ЖКТ животных. Зарегистрированные и внесенные в Список Госхимкомиссии Минсельхоза РФ бактериальные фунгициды не предназначены для применения на ягодных культурах - малине и черной смородине. Так, препарат Интеграл (жидкость на основе штамма 24Д Bacillus subtilis) зарегистрирован для применения против болезней зерновых культур (пшеница, ячмень яровой), овощных культур (картофеля, томатов и огурцов). Из ягодных культур препарат разрешен для борьбы с антракнозом черной смородины. Препарат Фитоспорин-М (порошок на основе штамма 24Д Bacillus subtilis) зарегистрирован для применения против болезней зерновых культур (пшеница, ячмень), бобовых (горох), овощных культур (картофель, капуста, томаты, огурцы), (патент РФ Препарат Бактофит (смачивающийся порошок на основе штамма ИПМ 215 Bacillus subtilis) предназначен для защиты от болезней овощных и цветочных культур, выращиваемых в открытом и защищенном грунте, а также черной смородины от мучнистой росы. Среди микробиологических удобрений аналогом заявляемого препарата является препарат Бактофосфин, основу которого составляют почвенные микроорганизмы Bacillus mucilaginosus, предназначенный для обогащения почвы усвояемыми растениями формами фосфора, а также восстановления ее плодородия, повышения всхожести и урожайности многих видов сельскохозяйственных культур в открытом и защищенном грунте. Авторами данного удобрения не приводятся конкретные данные по влиянию на показательные для плодородных почв группы микроорганизмов, а также влияния на урожайность культур. Микробиологическое удобрение Байкал Эм-1 содержит консорциум представителей различных групп микроорганизмов, в том числе грибов, которые, развиваясь в почве при внесении как симбиотическое сообщество, призваны увеличить численность почвенной микрофлоры и, соответственно, плодородие и урожайность. Однако выше приведенные препараты обладают узким спектром действия. Известен ряд штаммов бактерий рода Bacillus, являющихся антагонистами различных возбудителей болезней сельскохозяйственных культур. Штамм Bacillus subtilis В-116 оказывает антагонистическое действие на грибы Pythium и Rhysoctonia. Штамм бактерий Bacillus subtilis ВНИИСХМ N128 используется для получения препарата против грибковых заболеваний хлопчатника (Авторское свидетельство СССР Однако эти штаммы оказывают ограниченное действие, направленное на отдельных грибковых возбудителей болезней различных сельскохозяйственных культур. Известен штамм бактерий Bacillus subtilis ВНИИСХМ N131, используемый для получения препарата против возбудителей гнилей яблок и винограда при хранении (Авторское свидетельство СССР Однако данный штамм также оказывает ограниченное действие, направленное на отдельных грибных возбудителей болезней сельскохозяйственных культур. Наиболее близким аналогом (прототипом) является штамм бактерий Bacillus subtilis ВКПМ В 7036, предназначенный для получения препарата против грибных болезней растений (Патент РФ Наиболее близким аналогом (прототипом) препаративной формы является препарат Фитоп, полученный на основе выше указанного штамма Bacillus subtilis ВКПМ В 7036 при следующем соотношении компонентов, мас.% (Патент РФ Однако штамм-прототип и препарат на его основе обладают недостаточно широким спектром антагонистической активности, а также не исследовался на способность восстановления микробиоценоза ЖКТ животных. Техническим результатом заявляемых технических решений является обеспечение восстановления микробиоценоза почвы, ЖКТ животных и расширение спектра антибактериальной и фунгицидной активности. Указанный технический результат достигается путем получения методом направленной селекции четырех вариантов бактериальных штаммов Bacillus licheniformis: IC-831-1-2, IC-832-1-2, IC-833-1-2 и IC-834-1-2, обеспечивающих восстановление микробиоценоза почвы и желудочно-кишечного тракта животных, обладающих бактерицидной и фунгицидной активностью и депонированых от 18.03.2010 г. во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) ФГУП ГосНИИГенетика соответственно под Указанный технический результат достигается также тем, что в препарате, характеризующемся тем, что он содержит наполнитель с биомассой бактерий в споровой форме Bacillus licheniformis IC-831-1-2, или IC-832-1-2, или IC-833-1-2, или IC-834-1-2, или их смесь с титром каждого штамма бактерий не менее 1·103 КОЕ/г или 1·103 КОЕ/мл. В качестве наполнителя он содержит воду или порошкообразный сорбент. В качестве порошкообразного сорбента он содержит цеолит, или полисахарид, или моносахарид, или дисахарид, или смесь полисахарида с моносахаридом или полисахаридом в соотношении от 1:100 до 1:10. В качестве полисахарида он содержит крахмал, в качестве моносахарида - глюкозу, в качестве дисахарида - сахарозу. Исходные клоны для получения заявляемых штаммов были выделены из здоровых животных в экологически чистом районе Новосибирской области (Завьяловский бор): - штамм Bacillus licheniformis: IC-831-1-2 выделен из фекалий гуся, - штамм Bacillus licheniformis IC-832-1-2 выделен из фекалий коровы, - штамм Bacillus licheniformis IC-833-1-2 выделен из фекалий гуся, - штамм Bacillus licheniformis IC-834-1-2 выделен из фекалий курицы. Исходные клоны подвергались селекции на подавление бактериального и грибного роста. С лучшими клонами проводили эксперименты по подавлению роста: энтеробактерий, грамположительных кокков, неферментируюших бактерий, грибов рода Candida, возбудителей фузариоза растений, пурпуровой пятнистости малины, септориоза малины. Иммобилизация спор бактерий на крахмале обеспечивает им дополнительную механическую защиту, предотвращает агрегирование спор и обеспечивает более равномерное их распределение в массе наполнителя. При применении препарата крахмал способствует ускорению прорастания спор бактерий, что повышает эффективность его действия. Пудра на основе сахарозы (сахара) или глюкозы является не только сорбентом - наполнителем, но и оказывает на препарат стабилизирующий и консервирующий эффект, создает более мягкие условия для хранения спор бактерий. Кроме того, использование заявляемых компонентов препарата значительно упрощает технологию его получения как на этапах культивирования (в технологии отсутствует использование дорогих ферментов, не требуется очистка и концентрирование препарата), так и на этапах получения его готовой формы (удаление и перераспределение влаги совмещено с получением готовой формы препарата). Культурально-морфологические и биохимические свойства штаммов Bacillus licheniformis IC-831-1-2, IC-832-1-2, IC-833-1-2 и IC-834-1-2. Штаммы относятся к грамположительным факультативно анаэробным палочковидным бактериям. При росте на мясо-пептонном агаре дают морщинистую форму колоний с обильным образованием слизи и выделением розовато-красного пигмента в верхний слой среды под колонией. Колонии кремово-розовые. Клетки палочковидные, эндоспоры овальные, расположены центрально или парацентрально, не раздувают клетку при спорообразовании. Длина клетки (1,09-1,96) мкм, ширина (0,36-0,97) мкм. Капсулу не образуют, выделяют большое количество слизи. По Граму окрашиваются положительно. Штаммы являются термофильными, размножаются при (35-65)°С, оптимальный рост при температуре (37-40)°С. Через 48 часов роста при 40°С на мясо-пептонном агаре культуры имеют непрозрачные колонии неоднородной консистенции, со слизистыми включениями и волнистым краем, вросшие в поверхность агаровой пластинки. pH среды: минимальная 5,7; максимальная 8,0; оптимальная 6,5-7,0. Штаммы размножаются при 40°С на мясо-пептонном агаре и мясо-пептонном бульоне. Биохимические свойства штаммов. Они не растут в анаэробных условиях, не образуют ацетилметилкарбинол из глюкозы в реакции Фогес-Проскауэра, ферментируют с образованием кислоты глюкозу, маннозу, фруктозу, рибозу, ликсозу, целлобиозу, трегалозу, мальтозу, туранозу. Гидролизуют крахмал, мочевину и эскулин. Не обладают лецитиназной активностью. Обладают каталазной активностью. Толерантны к концентрациям хлорида натрия в питательной среде в диапазоне (1-9) %. Штаммы не являются зоопатогенными и фитопатогенными. Штаммы продуцируют биологически активные метаболиты, в том числе антибиотики и ферменты широкого спектра действия, подавляющие рост патогенной и условно-патогенной бактериальной и грибной микрофлоры. При длительном хранении штаммов споровую массу лиофильно высушивают. Для массового размножения бактерий используют мясо-пептонный бульон, культивирование проводят при температуре 40°С. Пример 1. Исследование непатогенности штаммов Bacillus licheniformis IC-831-1-2, IC-832-1-2, IC-833-1-2 и IC-834-1-2. Исследование проведено в лаборатории биотехнологического контроля НПФ «Исследовательский центр». Патогенность каждого микроорганизма оценивали по выживаемости инфицированных животных, их внешнему виду и поведению, высеваемости бактерий из крови и органов в различные сроки после заражения, а также макроскопической картине внутренних органов при вскрытии животных в конце срока наблюдения. В работе использованы лабораторные животные двух видов: нелинейные белые мыши массой (18-20) г в количестве 40 особей обоего пола и крысы породы Вистар массой (180-200) г в количестве 40 особей обоего пола. Из животных формировали опытную и контрольную группу по 20 особей в каждой. Для выявления проникновения бактерий в органы экспериментальных животных животным из опытных групп на протяжении 60 суток перорально вводили суточную культуральную жидкость бактерий, полученную путем культивирования исследуемого штамма на мясо-пептонном бульоне. Животных из опытных и контрольных групп забивали по следующей схеме: 1. день 5 - по 4 особи из каждой группы (контрольной и опытной); 2. день 15 - по 4 особи из каждой группы (контрольной и опытной); 3. день 30 - по 4 особи из каждой группы (контрольной и опытной); 4. день 45 - по 4 особи из каждой группы (контрольной и опытной); 5. день 60 - по 4 особи из каждой группы (контрольной и опытной). После проведения вскрытия посевы из органов (сердце, легкое, печень, селезенка) и крови производили на мясо-пептонный и кровяной агары в чашки Петри методом отпечатков. Посевы инкубировали в термостате при температуре (37±1)°С в течение 24 часов. Результаты учитывали по наличию/отсутствию колоний на поверхности питательной среды в чашке Петри. В результате проведенных исследований установлено нижеследующее. В течение опыта не зарегистрировано гибели животных. Не отмечено каких-либо изменений в их внешнем виде и поведении. При макроскопической оценке внутренних органов во все периоды проведения вскрытий патологических изменений не обнаружено. Микробиологический анализ показал, что внутренние органы и кровь были стерильными в опытном и контрольном вариантах во все периоды проведения исследований. На основании отсутствия гибели животных и каких-либо изменений в их внешнем виде и общем поведении, на протяжении 60-дневного наблюдения, отрицательных результатов микробиологического анализа сердца, легких, печени, селезенки и крови сделан вывод, что штаммы Bacillus licheniformis IC-831-1-2, IC-832-1-2, IC-833-1-2 и IC-834-1-2 являются непатогенными. Пример 2. Исследование антагонистической активности штаммов Bacillus licheniformis IC-831-1-2, IC-832-1-2, IC-833-1-2 и IC-834-1-2 Полученные путем селекции штаммы Bacillus licheniformis IC-831-1-2, IC-832-1-2, IC-833-1-2 и IC-834-1-2 характеризуются высокой антагонистической активностью в отношении патогенных и условно патогенных микроорганизмов. Антагонистическую активность в отношении тест-культур проверяли методом отсроченного антагонизма. В качестве тест-штаммов использовали Staphylococcus aureus, Candida albicans, Klebsiella pneumonia, Shigella flexneri, Shigella sonnei, Yersinia pseudotuberculosis, Serratia marcescens, Escherichia coli, Enterococcus spp. Используемые тест-штаммы удовлетворяли следующим требованиям: находились в S-форме, имели типичные морфологические и ферментативные свойства. Исследование антагонистической активности заявляемых штаммов Bacillus licheniformis производили на мясо-пептонном агаре. Рецептура мясо-пептонного агара на 1 дм 3: 1. пептон мясной ферментативный - 10,0 г; 2. дрожжевой экстракт - 5,0 г; 3. хлорид натрия - 5,0 г; 4. агар микробиологический - 15,0 г; 5. дистиллированная вода - до общего объема 1 дм3. После смешивания компонентов среду разогревали до полного растворения агара и фильтровали через ватно-марлевый фильтр в колбы вместимостью 500 см3 по 300 см3. Колбы со средой закрывали ватно-марлевыми пробками, оборачивали горловину пергаментом и стерилизовали в автоклаве при давлении 0,15 МПа в течение 40 мин. После остывания до температуры (45±1)°С среду разливали по стерильным чашкам Петри. Для контроля стерильности чашки с подсушенной средой помещали в термостат при температуре (37±1)°С на (24±2) часа. Нестерильные чашки отбраковывали. Культуры патогенных микроорганизмов, указанные выше, выращивали на чашках Петри в течение (18±2) часов на мясо-пептонном агаре. В стерильные пробирки приливали по 1 мл физиологического раствора и готовили суспензии тест-штаммов с концентрацией микробных клеток (5,0±1,0)×108 КОЕ/см3. Для проведения испытания от каждой серии препарата отбирали 3 пробы по 1 г. Далее 0,5 г препарата разводили в 0,5 см3 . Полученную взвесь высевали методом штрихов с помощью микробиологической петли по диаметру чашки Петри с мясо-пептонным агаром. Посевы инкубировали в термостате при температуре (37±1)°С в течение (48±2) часов. Затем к выросшей в виде штриха культуре подсевали с помощью микробиологической петли суспензию патогенов методом перпендикулярных штрихов. Учет результатов проводили через 8 часов инкубирования при (37±1)°С по величине зон угнетения роста тест-штаммов. Контролем роста культур патогенов служил их параллельный высев на чашки Петри с той же плотной средой (мясо-пептонным агаром), но без исследуемой ассоциации антагониста. В результате проведенных исследований установлено, что штамм Bacillus licheniformis IC-831-1-2 характеризуется следующими показателями зон задержки роста (мм) тест-штаммов патогенов (таблица 1). Таблица 1. Характеристика штамма B. licheniformis IC-831-1-2 по показателям зон задержки роста тест-штаммов патогенов Наименование тест-штамма Размер зоны (мм) Staphylococcus aureus штамм IC-1161-4-1 10Staphylococcus aureus штамм IC-1189-4-1 12Staphylococcus aureus IC-1126-4-1 13Staphylococcus aureus IC-1142-4-1 15Staphylococcus aureus IC-1192-4-1 12Staphylococcus aureus IC-1200-4-1 8Staphylococcus aureus IC-1246-4-1 10Staphylococcus aureus IC-1120-4-1 12Staphylococcus aureus IC-1128-4-1 12Staphylococcus aureus IC-1257-4-1 12Staphylococcus aureus IC-1249-4-1 13Staphylococcus aureus IC-1233-4-1 20Staphylococcus aureus IC-1149-4-1 15Staphylococcus aureus IC-1241-4-1 30Staphylococcus aureus IC-1251-4-1 23Staphylococcus aureus IC-1226-4-1 20Staphylococcus aureus IC-1230-4-1 12Staphylococcus aureus IC-1140-4-1 22Staphylococcus aureus IC-1222-4-1 15Staphylococcus aureus IC-1165-4-1 18Staphylococcus aureus IC-1205-4-1 17Staphylococcus haemoliticus IC-1256-4-2 20Staphylococcus aureus IC-1232-4-1 14Staphylococcus aureus IC-1167-4-1 12Staphylococcus aureus IC-1131-4-1 7Staphylococcus aureus IC-1259-4-1 7Staphylococcus aureus IC-1243-4-1 7Staphylococcus aureus IC-1274-4-1 30Staphylococcus aureus IC-1231-4-1 12Staphylococcus aureus IC-1233-4-1 15Staphylococcus aureus IC-1234-4-1 10Staphylococcus haemoliticus IC-1258-4-2 8Candida albicans штамм IC-1124-9-1 10Candida albicans штамм IC-1172-9-1 10Candida albicans штамм IC-1152-9-1 12Candida albicans штамм IC-1155-9-1 11Candida albicans штамм IC-1143-9-1 10Candida albicans штамм IC-1141-9-1 13Candida albicans штамм IC-1134-9-1 30 Продолжение таблицы 1 Candida albicans IC-53-9-1 12Candida albicans IC-1147-9-1 10Candida albicans IC-1150-9-1 11Candida albicans IC-1203-9-1 11Candida albicans IC-1195-9-1 10Candida krusei IC-1244-9-2 15Candida albicans IC-1144-9-1 15Candida albicans IC-1132-9-1 10Candida albicans IC-1130-9-1 20Candida albicans IC-1156-9-1 30Candida albicans IC-1122-9-1 30Candida albicans IC-26-9-1 10Candida albicans IC-1150-9-1 30Candida albicans IC-55-9-1 11Candida albicans IC-1119-9-1 9Candida albicans IC-1240-9-1 10Candida albicans IC-1166-9-1 10Candida albicans IC-1137-9-1 14Candida albicans IC-1186-9-1 10Klebsiella pneumonia штамм IC-27-10-1 6Shigella flexneri IC-815-14-2 7Shigella sonnei IC-47-14-1 5Yersinia pseudotuberculosis штамм IC-45- Продолжение таблицы 1 Candida albicans IC-53-9-1 12Candida albicans IC-1147-9-1 10Candida albicans IC-1150-9-1 11Candida albicans IC-1203-9-1 11Candida albicans IC-1195-9-1 10Candida krusei IC-1244-9-2 15Candida albicans IC-1144-9-1 15Candida albicans IC-1132-9-1 10Candida albicans IC-1130-9-1 20Candida albicans IC-1156-9-1 30Candida albicans IC-1122-9-1 30Candida albicans IC-26-9-1 10Candida albicans IC-1150-9-1 30Candida albicans IC-55-9-1 11Candida albicans IC-1119-9-1 9Candida albicans IC-1240-9-1 10Candida albicans IC-1166-9-1 10Candida albicans IC-1137-9-1 14Candida albicans IC-1186-9-1 10Klebsiella pneumonia штамм IC-27-10-1 6Shigella flexneri IC-815-14-2 7Shigella sonnei IC-47-14-1 5Yersinia pseudotuberculosis штамм IC-45-  13-1 8 Serratia marcescens IC-1170-17 12Escherichia coli IC-1184-5-1 10Escherichia coli IC-1273-5-1 8Escherichia coli IC-1429-5-1 3Escherichia coli IC-1427-5-1 30Escherichia coli IC-1151-5-1 7Enterococcus spp. IC-1236-16 15Enterococcus faecium IC-1253-16-1 30Enterococcus spp. IC-1163-16 15Enterococcus spp. IC-1164-16 30Enterococcus spp. IC-1423-16 10Enterococcus spp. IC-1168-16 10Enterococcus spp. IC-1175-16 12 13-1 8 Serratia marcescens IC-1170-17 12Escherichia coli IC-1184-5-1 10Escherichia coli IC-1273-5-1 8Escherichia coli IC-1429-5-1 3Escherichia coli IC-1427-5-1 30Escherichia coli IC-1151-5-1 7Enterococcus spp. IC-1236-16 15Enterococcus faecium IC-1253-16-1 30Enterococcus spp. IC-1163-16 15Enterococcus spp. IC-1164-16 30Enterococcus spp. IC-1423-16 10Enterococcus spp. IC-1168-16 10Enterococcus spp. IC-1175-16 12Штамм В. licheniformis IC-832-1-4 характеризуется следующими показателями зон (мм) задержки роста тест-штаммов патогенов (таблица 2). Таблица 2. Характеристика штамма B. licheniformis IC-832-1-2 по показателям зон задержки роста тест-штаммов патогенов Наименование тест-штамма Размер зоны (мм) Candida albicans штамм IC-1124-9-1 30Candida albicans штамм IC-1172-9-1 30Candida albicans штамм IC-53-9-1 30Candida albicans штамм IC-1147-9-1 30Candida albicans штамм IC-1150-9-1 30Candida albicans штамм IC-1203-9-1 20Candida albicans штамм IC-1136-9-1 30Candida albicans штамм IC-1195-9-1 20Candida krusei штамм IC-1244-9-2 18Candida albicans штамм IC-1144-9-1 20Candida albicans штамм IC-1132-9-1 8Candida albicans штамм IC-1130-9-1 15Candida albicans штамм IC-1156-9-1 30Candida albicans штамм IC-1122-9-1 30Candida albicans штамм IC-26-9-1 8Candida albicans штамм IC-1150-9-1 30Candida albicans штамм IC-55-9-1 10Candida albicans штамм IC-1119-9-1 15Candida albicans штамм IC-1155-9-1 30Candida albicans штамм IC-1186-9-1 10Candida albicans штамм IC-1143-9-1 30Candida albicans штамм IC-1141-9-1 30Candida albicans штамм IC-1134-9-1 30Pseudomonas aeruginosa штамм IC-1210-7-1 12Shigella flexneri штамм IC-815-14-2 7Yersinia pseudotuberculosis штамм IC-45-13-1 5Escherichia coli штамм IC-1427-5-1 30Enterococcus faecium штамм IC 1253-16-1 30Enterococcus spp. штамм IC-1164-16 30Enterococcus spp. штамм IC-1236-16 0Staphylococcus aureus штамм IC-1126-4-1 24Staphylococcus aureus штамм IC-1161-4-1 8Staphylococcus aureus штамм IC-1189-4-1 16Staphylococcus aureus штамм IC-1142-4-1 25Staphylococcus aureus штамм IC-1192-4-1 23Staphylococcus aureus штамм IC-1200-4-1 20Staphylococcus aureus штамм IC-1246-4-1 20Staphylococcus aureus штамм IC-1120-4-1 22Staphylococcus aureus штамм IC-1128-4-1 24Staphylococcus aureus штамм IC-1257-4-1 20Staphylococcus aureus штамм IC-1149-4-1 12 Продолжение табл.2Staphylococcus aureus штамм IC-1251-4-1 10Staphylococcus aureus штамм IC-1226-4-1 16Staphylococcus aureus штамм IC-1140-4-1 11Staphylococcus aureus штамм IC-1165-4-1 15Staphylococcus aureus штамм IC-1205-4-1 12Staphylococcus haemoliticus штамм IC-1256-4-2 15Staphylococcus aureus штамм IC-1241-4-1 30Staphylococcus aureus штамм IC-1230-4-1 10Staphylococcus aureus штамм IC-1232-4-1 11Staphylococcus aureus штамм IC-1167-4-1 30 Продолжение табл.2Staphylococcus aureus штамм IC-1251-4-1 10Staphylococcus aureus штамм IC-1226-4-1 16Staphylococcus aureus штамм IC-1140-4-1 11Staphylococcus aureus штамм IC-1165-4-1 15Staphylococcus aureus штамм IC-1205-4-1 12Staphylococcus haemoliticus штамм IC-1256-4-2 15Staphylococcus aureus штамм IC-1241-4-1 30Staphylococcus aureus штамм IC-1230-4-1 10Staphylococcus aureus штамм IC-1232-4-1 11Staphylococcus aureus штамм IC-1167-4-1 30Штамм B. licheniformis IC-833-1-2 характеризуется следующими показателями зон задержки роста (мм) тест-штаммов патогенов (таблица 3). Таблица 3. Характеристика штамма B. licheniformis IC-833-1-2 по показателям зон задержки роста тест-штаммов патогенов Наименование тест-штамма Размер зоны (мм) Candida albicans штамм IC-1124-9-1 30Candida albicans штамм IC-1172-9-1 30Candida albicans штамм IC-1143-9-1 30Candida albicans штамм IC-53-9-1 30Candida albicans штамм IC-1147-9-1 30Candida albicans штамм IC-1150-9-1 30Candida albicans штамм IC-1203-9-1 30Candida albicans штамм IC-1195-9-1 8Candida krusei штамм IC-1244-9-2 6Candida albicans штамм IC-1144-9-1 10Candida albicans штамм IC-1132-9-1 10Candida albicans штамм IC-1130-9-1 20Candida albicans штамм IC-1156-9-1 30Candida albicans штамм IC-1133-9-1 8Candida albicans штамм IC-1122-9-1 30Candida albicans штамм IC-26-9-1 10Candida albicans штамм IC-1150-9-1 30Candida albicans штамм IC-55-9-1 30Candida albicans штамм IC-1119-9-1 30Candida albicans штамм IC-1139-9-1 30Candida albicans штамм IC-1141-9-1 30Candida albicans штамм IC-1240-9-1 10Candida albicans штамм IC-1152-9-1 30Candida albicans штамм IC-1155-9-1 30Klebsiella pneumonia штамм IC-43-10-1 6 Продолжение табл.3Klebsiella pneumonia штамм IC-31-10-1 9Shigella flexneri штамм IC-815-14-2 12Shigella sonnei штамм IC-1216-14-1 30Serratia marcescens штамм IC-817-17-1 30Yersinia pseudotuberculosis штамм IC-45-13-1 30Staphylococcus aureus штамм IC-25-4-1 7Staphylococcus aureus штамм IC-1161-4-1 26Staphylococcus aureus штамм IC-1189-4-1 15Staphylococcus aureus штамм IC-1126-4-1 18Staphylococcus aureus штамм IC-1142-4-1 16Staphylococcus aureus штамм IC-1192-4-1 20Staphylococcus aureus штамм IC-1200-4-1 20Staphylococcus aureus штамм IC-1246-4-1 16Staphylococcus aureus штамм IC-1233-4-1 30Staphylococcus aureus штамм IC-1120-4-1 15Staphylococcus aureus штамм IC-1140-4-1 18Staphylococcus aureus штамм IC-1241-4-1 30Staphylococcus aureus штамм IC-1232-4-1 20Staphylococcus aureus штамм IC-1167-4-1 30Staphylococcus aureus штамм IC-1274-4-1 30Staphylococcus aureus штамм IC-1231-4-1 7Staphylococcus aureus штамм IC-1234-4-1 8Staphylococcus haemoliticus штамм IC-1258-4-2 5Staphylococcus aureus штамм IС-1230-4-1 12Staphylococcus aureus штамм IC-1222-4-1 10Staphylococcus aureus штамм IC-1165-4-1 20Staphylococcus aureus штамм IC-1205-4-1 24Staphylococcus haemoliticus штамм IC-1256-4-2 9Staphylococcus aureus штамм IC-1128-4-1 17Staphylococcus aureus штамм IC-1251-4-1 18Staphylococcus aureus штамм IC-1226-4-1 20Staphylococcus aureus штамм IC-1249-4-1 20Staphylococcus aureus штамм IC-1257-4-1 16Escherichia coli штамм IC-1153-5-1 8Escherichia coli штамм IC-34-5-1 5Escherichia coli штамм IC-1148-5-1 7Escherichia coli штамм IC-36-5-1 6Escherichia coli штамм IC-1427-5-1 20Escherichia coli штамм IC-1151-5-1 6Enterococcus spp. штамм IC-1236-16 16Enterococcus faecium штамм IC 1253-16-1 30Enterococcus spp. штамм IC-1164-16 30Enterococcus spp. штамм IC-1423-16 8Enterococcus spp. штамм IC-1168-16 8Enterococcus spp. штамм IC-1175-16 10 Продолжение табл.3Klebsiella pneumonia штамм IC-31-10-1 9Shigella flexneri штамм IC-815-14-2 12Shigella sonnei штамм IC-1216-14-1 30Serratia marcescens штамм IC-817-17-1 30Yersinia pseudotuberculosis штамм IC-45-13-1 30Staphylococcus aureus штамм IC-25-4-1 7Staphylococcus aureus штамм IC-1161-4-1 26Staphylococcus aureus штамм IC-1189-4-1 15Staphylococcus aureus штамм IC-1126-4-1 18Staphylococcus aureus штамм IC-1142-4-1 16Staphylococcus aureus штамм IC-1192-4-1 20Staphylococcus aureus штамм IC-1200-4-1 20Staphylococcus aureus штамм IC-1246-4-1 16Staphylococcus aureus штамм IC-1233-4-1 30Staphylococcus aureus штамм IC-1120-4-1 15Staphylococcus aureus штамм IC-1140-4-1 18Staphylococcus aureus штамм IC-1241-4-1 30Staphylococcus aureus штамм IC-1232-4-1 20Staphylococcus aureus штамм IC-1167-4-1 30Staphylococcus aureus штамм IC-1274-4-1 30Staphylococcus aureus штамм IC-1231-4-1 7Staphylococcus aureus штамм IC-1234-4-1 8Staphylococcus haemoliticus штамм IC-1258-4-2 5Staphylococcus aureus штамм IС-1230-4-1 12Staphylococcus aureus штамм IC-1222-4-1 10Staphylococcus aureus штамм IC-1165-4-1 20Staphylococcus aureus штамм IC-1205-4-1 24Staphylococcus haemoliticus штамм IC-1256-4-2 9Staphylococcus aureus штамм IC-1128-4-1 17Staphylococcus aureus штамм IC-1251-4-1 18Staphylococcus aureus штамм IC-1226-4-1 20Staphylococcus aureus штамм IC-1249-4-1 20Staphylococcus aureus штамм IC-1257-4-1 16Escherichia coli штамм IC-1153-5-1 8Escherichia coli штамм IC-34-5-1 5Escherichia coli штамм IC-1148-5-1 7Escherichia coli штамм IC-36-5-1 6Escherichia coli штамм IC-1427-5-1 20Escherichia coli штамм IC-1151-5-1 6Enterococcus spp. штамм IC-1236-16 16Enterococcus faecium штамм IC 1253-16-1 30Enterococcus spp. штамм IC-1164-16 30Enterococcus spp. штамм IC-1423-16 8Enterococcus spp. штамм IC-1168-16 8Enterococcus spp. штамм IC-1175-16 10Штамм B. licheniformis IC-834-1-2 характеризуется следующими показателями зон задержки роста (мм) тест-штаммов патогенов (таблица 4). Таблица 4. Характеристика штамма B. licheniformis IC-834-1-2 по показателям зон задержки роста тест-штаммов патогенов Наименование тест-штамма Размер зоны (мм) Staphylococcus aureus штамм IC-1161-4-1 14Candida albicans штамм IC-1124-9-1 18Candida albicans штамм IC-1172-9-1 9Candida albicans штамм IC-1152-9-1 12Candida albicans штамм IC-1155-9-1 14Candida albicans штамм IC-1143-9-1 12Candida albicans штамм IC-1141-9-1 15Candida albicans штамм IC-1134-9-1 30Escherichia coli штамм IC-1250-5-1 5Shigella flexneri штамм IC-815-14-2 9Candida albicans штамм IC-53-9-1 12Candida albicans штамм IC-1147-9-1 30Candida albicans штамм IC-1150-9-1 30Candida albicans штамм IC-1203-9-1 15Salmonella enteritidis штамм IC-1159-6-1 5Candida albicans штамм IC-1136-9-1 7Candida albicans штамм IC-1195-9-1 10Candida krusei штамм IC-1244-9-2 14Candida albicans штамм IC-1144-9-1 15Candida albicans штамм IC-1132-9-1 12Candida albicans штамм IC-1130-9-1 13Candida albicans штамм IC-1156-9-1 30Candida albicans штамм IC-1122-9-1 30Candida albicans штамм IC-1150-9-1 30Candida albicans штамм IC-55-9-1 30Candida albicans штамм IC-1119-9-1 30Staphylococcus aureus штамм IC-1189-4-1 20Serratia marcescens штамм IC-817-17-1 16Yersinia pseudotuberculosis штамм IC-45-13-1 16Staphylococcus aureus штамм IC-1126-4-1 17Staphylococcus aureus штамм IC-1142-4-1 17Staphylococcus aureus штамм IC-1192-4-1 15Staphylococcus aureus штамм IC-1200-4-1 15Staphylococcus aureus штамм IC-1246-4-1 15Staphylococcus aureus штамм IC-1120-4-1 16Staphylococcus aureus штамм IC-1128-4-1 16Staphylococcus aureus штамм IC-1257-4-1 15Escherichia штамм coli IC-1153-5-1 10 Продолжение табл.4Escherichia штамм coli IC-1184-5-1 5Escherichia штамм coli IC-1273-5-1 5Escherichia coli штамм IC-1193-5-1 5Escherichia coli штамм IC-1116-5-1 5Escherichia coli штамм IC-1424-5-1 5Escherichia coli штамм IC-1238-5-1 5Escherichia coli штамм IC-36-5-1 7Enterococcus spp. штамм IC-1163-16 8Staphylococcus aureus штамм IC-1249-4-1 19Enterococcus spp. штамм IC-1236-16 10Staphylococcus aureus штамм IC-1233-4-1 10Staphylococcus aureus штамм IC-1149-4-1 8Escherichia coli штамм IC-1430-5-1 7Staphylococcus aureus штамм IC-1251-4-1 10Staphylococcus aureus штамм IC-1226-4-1 10Escherichia coli штамм IC-1427-5-1 30Enterococcus faecium штамм IC 1253-16-1 10Staphylococcus aureus штамм IC-1140-4-1 20Staphylococcus aureus штамм IC-1222-4-1 18Staphylococcus aureus штамм IC-1165-4-1 20Staphylococcus aureus штамм IC-1205-4-1 18Staphylococcus aureus штамм IC-1256-4-2 20Candida albicans штамм IC-1133-9-1 8Staphylococcus aureus штамм IC-1241-4-1 10Staphylococcus aureus штамм IC-1230-4-1 30Enterococcus spp. штамм IC-1164-16 30Staphylococcus aureus штамм IC-1232-4-1 20Staphylococcus aureus штамм IC-1167-4-1 22Staphylococcus aureus штамм IC-1131-4-1 10Staphylococcus aureus штамм IC-1259-4-1 10Staphylococcus aureus штамм IC-1243-4-1 10Staphylococcus aureus штамм IC-1179-4-1 9Staphylococcus aureus штамм IC-1125-4-1 8Staphylococcus aureus штамм IC-1274-4-1 30Staphylococcus aureus штамм IC-1231-4-1 20Candida albicans штамм IC-1154-9-1 22Staphylococcus aureus штамм IC-1229-4-1 8Candida albicans штамм IC-1202-9-1 6Staphylococcus aureus штамм IC-1233-4-1 8Staphylococcus aureus штамм IC-1234-4-1 10Staphylococcus aureus штамм IC-1258-4-2 8Enterococcus app. штамм IC-1423-16 10Enterococcus spp. штамм IC-1168-16 10Enterococcus spp. штамм IC-1175-16 12 Продолжение табл.4Escherichia штамм coli IC-1184-5-1 5Escherichia штамм coli IC-1273-5-1 5Escherichia coli штамм IC-1193-5-1 5Escherichia coli штамм IC-1116-5-1 5Escherichia coli штамм IC-1424-5-1 5Escherichia coli штамм IC-1238-5-1 5Escherichia coli штамм IC-36-5-1 7Enterococcus spp. штамм IC-1163-16 8Staphylococcus aureus штамм IC-1249-4-1 19Enterococcus spp. штамм IC-1236-16 10Staphylococcus aureus штамм IC-1233-4-1 10Staphylococcus aureus штамм IC-1149-4-1 8Escherichia coli штамм IC-1430-5-1 7Staphylococcus aureus штамм IC-1251-4-1 10Staphylococcus aureus штамм IC-1226-4-1 10Escherichia coli штамм IC-1427-5-1 30Enterococcus faecium штамм IC 1253-16-1 10Staphylococcus aureus штамм IC-1140-4-1 20Staphylococcus aureus штамм IC-1222-4-1 18Staphylococcus aureus штамм IC-1165-4-1 20Staphylococcus aureus штамм IC-1205-4-1 18Staphylococcus aureus штамм IC-1256-4-2 20Candida albicans штамм IC-1133-9-1 8Staphylococcus aureus штамм IC-1241-4-1 10Staphylococcus aureus штамм IC-1230-4-1 30Enterococcus spp. штамм IC-1164-16 30Staphylococcus aureus штамм IC-1232-4-1 20Staphylococcus aureus штамм IC-1167-4-1 22Staphylococcus aureus штамм IC-1131-4-1 10Staphylococcus aureus штамм IC-1259-4-1 10Staphylococcus aureus штамм IC-1243-4-1 10Staphylococcus aureus штамм IC-1179-4-1 9Staphylococcus aureus штамм IC-1125-4-1 8Staphylococcus aureus штамм IC-1274-4-1 30Staphylococcus aureus штамм IC-1231-4-1 20Candida albicans штамм IC-1154-9-1 22Staphylococcus aureus штамм IC-1229-4-1 8Candida albicans штамм IC-1202-9-1 6Staphylococcus aureus штамм IC-1233-4-1 8Staphylococcus aureus штамм IC-1234-4-1 10Staphylococcus aureus штамм IC-1258-4-2 8Enterococcus app. штамм IC-1423-16 10Enterococcus spp. штамм IC-1168-16 10Enterococcus spp. штамм IC-1175-16 12Таким образом, исследуемые штаммы бактерий проявляют антагонистическую активность в отношении широкого спектра патогенных и условно патогенных микроорганизмов. Пример 3. Методика культивирования бактерий Bacillus licheniformis для получения микробной биомассы Для получения биомассы спор бактерий штаммы Bacillus licheniformis IC-831-1-2, IC-832-1-2, IC-833-1-2 и IC-834-1-2 культивировали на жидкой питательной среде следующего состава: 1. пептон мясной ферментативный - 10,0 г; 2. дрожжевой экстракт - 5,0 г; 3. хлорид натрия - 5,0 г; 4. дистиллированная вода - до общего объема 1 дм3. pH (7,2±0,2). На 1 дм3 ферментационной питательной среды требуется 10 см3 соответствующего штамма Bacillus licheniformis с титром 108 КОЕ/см3. Процесс выращивания биомассы осуществляли в ферментере в течение (48±2) часов. При указанном способе культивирования получали титр спор не выше (5-10)×1010 КОЕ/см3. Пример 4. Получение готовой формы препарата на основе бактерий штаммов B. licheniformis IC-831-1-2, IC-832-1-2, IC-833-1-2 и IC-834-1-2 Вначале готовят смесь собранной и проверенной по показателям качества сырой биомассы с наполнителем. В качестве наполнителя может быть использована вода (для обработки растений методом распыления) с титром спор не менее 1·103 КОЕ/мл или порошкообразный сорбент, например цеолит. В качестве сорбента используют также сахарную пудру и крахмал в соотношении биомасса, пудра и крахмал 1:5:5, тщательно перемешивают. В процессе перемешивания происходит иммобилизация спор бактерий на частицы крахмала. Далее в полученную смесь вводят сахарную или глюкозную пудру из расчета 1 часть смеси на 10 частей пудры. В результате получают концентрат препарата с титром спор не менее 1×10 10 КОЕ/г. Далее его смешивают с сахарной или глюкозной пудрой и крахмалом в такой пропорции, чтобы получить готовый препарат с титром спор не менее 1·103-10 6 КОЕ/г. Остаточная влажность препарата составляет не более 5%. Пример 5. Составы препаратов 5.1. Состав 1. Водный раствор биомассы спор бактерий Bacillus licheniformis IC-831-1-2 с титром спор не менее 1·103 КОЕ/мл. Данный раствор хранят в темном месте не более 1-2 суток. 5.2. Состав 2. Смесь биомассы спор бактерий Bacillus licheniformis IC-831-1-2 с цеолитом с титром спор не менее 1·106 КОЕ/г. 5.3. Состав 3. Смесь биомассы спор бактерий Bacillus licheniformis IC-831-1-2 с титром спор не менее 1·106 КОЕ/г со смесью крахмала и пудры на основе сахарозы в соотношении 1:100. 5.4. Состав 4. Смесь биомассы спор бактерий Bacillus licheniformis IC-832-1-2 с титром спор не менее 1·106 КОЕ/г со смесью крахмала и пудры на основе сахарозы в соотношении 1:10. 5.5. Состав 5. Смесь биомассы спор бактерий Bacillus licheniformis IC-833-1-2 с титром спор не менее 1·106 КОЕ/г со смесью крахмала и пудры на основе сахарозы в соотношении 1:50. 5.6. Состав 6. Смесь биомассы спор бактерий Bacillus licheniformis IC-834-1-2 с титром спор не менее 1·106 КОЕ/г со смесью крахмала и пудры на основе сахарозы в соотношении 1:10. 5.7. Состав 7. Смесь биомассы спор бактерий Bacillus licheniformis IC-831-1-2, IC-832-1-2, IC-833-1-2, IC-834-1-2 в соотношении 1:1:1:1 с титром спор каждого вида бактерий не менее 1·103 КОЕ/г со смесью крахмала и пудры на основе глюкозы в соотношении 1:20. Пример 6. Данные по хранению сухой формы препарата на основе штаммов B. licheniformis IC-831-1-2, IC-832-1-2, IC-833-1-2 и IC-834-1-2 Для установления срока годности и условий хранения препарата проведены соответствующие исследования. В течение 48 месяцев хранения сухой формы препарата при температуре (30±0,5)°С титр и антагонистическая активность препарата не изменились, что подтверждает высокую термостабильность препаратов в споровой форме, обеспечивающую значительное упрощение технологии их применения в ветеринарной медицине и растениеводстве. Пример 7. Данные по ингибирующей активности штаммов Bacillus licheniformis IC-831-1-2, IC-832-1-2, IC-833-1-2 и IC-834-1-2 в отношении фитопатогенов. Для испытания штаммов Bacillus licheniformis IC-831-1-2, IC-832-1-2, IC-833-1-2 и IC-834-1-2 в отношении способности ингибировать фитопатогенов использовали метод агаровых блоков. Суспензию препарата с титром 1×10 6 КОЕ/см3 вносили в мясо-пептонный агар, остуженный до температуры (36±1)°С. Для выращивания фитопатогенов использовали: - среду Чапека для Didymella applanata; картофельно-глюкозный агар для Fusarium oxysporum, Botrytis cinerea, Alterneria alternaya, Fusarium moniliformes, Fusarium sporotrichiella, Rhizoctonia solani. Инокулированную исследуемым штаммом среду разливали в чашки Петри и на застывшую поверхность, в центр помещали блок диаметром 10 мм, вырезанный из колонии фитопатогена. Учет результатов проводили с периодичностью 1 раз в 3 дня. Активность штамма учитывали по изменению диаметра колонии гриба в сравнении с контролем (среда без внесения штамма). На основании полученных данных определяли ингибирующую активность, которую рассчитывали по формуле
где Дк - диаметр колонии в контрольном варианте, До - диаметр колонии в опытном варианте. В результате исследований установлены следующие показатели ингибирующей активности штамма Bacillus licheniformis IC-831-1-2 на 7-е сутки: - в отношении Didymella applanata - 12,7%; - в отношении Fusarium moniliformes - 62%; - в отношении Fusarium oxysporum - 70%; - в отношении Fusarium sporotrichiella - 19,2%; - в отношении Alterneria alternata - 10,5%. В результате исследований установлены следующие показатели ингибирующей активности штаммов Bacillus licheniformis IC-832-1-2 на 7-е сутки: - в отношении Didymella applanata - 17,2%; - в отношении Botrytis cinerea - 21%; - в отношении Fusarium moniliformes - 43%; - в отношении Fusarium sporotrichiella - 17,2%; - в отношении Alterneria alternata - 38,7%. В результате исследований установлены следующие показатели ингибирующей активности штамма Bacillus licheniformis IC-833-1-2 на 7-е сутки: - в отношении Botrytis cinerea - 38%; - в отношении Fusarium oxysporum - 62%; - в отношении Fusarium moniliformes - 12%; - в отношении Alterneria alternata - 42%. В результате исследований установлены следующие показатели ингибирующей активности штамма Bacillus licheniformis IC-834-1-2 на 7-е сутки: - в отношении Didymella applanata - 67%; - в отношении Botrytis cinerea - 67%; - в отношении Fusarium moniliformes - 44%; - в отношении Fusarium oxysporum - 67%; - в отношении Fusarium sporotrichiella - 36%; - в отношении Alterneria alternata - 11%. Таким образом, заявляемые штаммы Bacillus licheniformis проявляют антагонистическую активность по отношению к выше перечисленным грибным фитопатогенам. Пример 8. Данные полевых испытаний по изучению влияния препаратов на основе штаммов Bacillus licheniformis IC-831-1-2, IC-832-1-2, IC-833-1-2 и IC-834-1-2 на пораженность малины пурпуровой пятнистостью и смородины септориозом Для испытания штаммов Bacillus licheniformis IC-831-1-2, IC-832-1-2, IC-833-1-2 и IC-834-1-2 с целью определения наличия фунгицидной активности в отношении болезней малины и смородины в открытом грунте использовали промышленные посадки малины сорта Зоренька Алтая и смородины сорта Софья. В качестве химического эталона использовали препарат Топаз в концентрации 0,1%. Обработку проводили суспензией препаратов с титром 106 спор/мл. Обработку посадок проводили в июле и июне. Сроки обработки определялись при появлении первых симптомов болезней. Схема полевого опыта: - штамм Bacillus licheniformis IC-831-1-2; - штамм Bacillus licheniformis IC-832-1-2; - штамм Bacillus licheniformis IC-833-1-2; - штамм Bacillus licheniformis IC-834-1-2; - Топаз 0,1%; - контроль. Повторность опыта четырехкратная, площадь делянки 10 м2, расход рабочей жидкости - 4 дм3 на вариант. Размещение делянок рандомизированное. Схемы на малине и смородине аналогичны. Поражение листьев смородины септориозом учитывали по следующей шкале: 0 - баллов - здоровые листья; 1 балл - слабое развитие заболевания (занято пятнами от 0 до 10% поверхности листовой пластинки); 2 балла - средние развитие заболевания (занято пятнами от 11 до 25% поверхности листовой пластинки); 3 балла - сильное развитие заболевания (занято пятнами от 26 до 50% поверхности листовой пластинки); 4 балла - очень сильное развитие заболевания (занято пятнами более 50% поверхности листовой пластинки). Степень повреждения побегов малины оценивали по специальной 4-балльной шкале для пурпуровой пятнистости малины: 0 баллов - здоровый стебель; 1 балл - поверхность пораженного участка гладкая, возможны утолщения коры, участок расположен по одну сторону стебля; 2 балла - поверхность пораженного участка гладкая, возможны трещины коры, участок расположен по обе стороны стебля; 3 балла - поверхность пораженного участка деформирована, участок расположен по обе стороны стебля; 4 балла - поверхность пораженного участка деформирована, участок окольцовывает стебель. Развитие болезни определяли по следующей формуле:
где R - индекс развития болезни, %; a - количество растений соответствующего балла, шт.; b - балл шкалы; N - общее количество растений, шт.; K - высший балл используемой шкалы. Распространенность рассчитывали по формуле
R - индекс распространенности болезни, %; а - количество растений в контроле, шт.; b - количество растений в опыте, шт. Биологическую эффективность биопрепаратов определяли по формуле
где a - показатель средней пораженности в контроле, %; b - показатель средней пораженности на обработанном участке, %. Результаты полевых опытов представлены в таблицах. Таблица 5. Влияние заявляемых препаратов на основе штаммов Bacillus licheniformis на поражение малины пурпуровой пятнистостью. ВариантРаспространенность, %Развитие, % Биологическая эффективность, %Контроль 75,0 25,0- Штамм B. lich. IC 831-1-234,1 8,5 66,0Штамм B. lich. IC-832-1-2 43,210,8 56,8Штамм B. lich. IC 833-1-2 40,812,0 61,4Штамм B. lich. IC 834-1-2 37,59,0 62,7Топаз 0,1%38,6 10,856,8 НСР05 4,0 4,0  Таблица 6. Влияние заявляемых препаратов на основе штаммов Bacillus licheniformis на поражение малины пурпуровой пятнистостью. ВариантРаспространенность, %Развитие, % Биологическая эффективность, %Контроль 95,0 35,0- Штамм B. lich. IC 831-1-232,5 8,1 76,9Штамм B. lich. IC-832-1-2 35,015,6 55,4Штамм B. lich. IC 833-1-2 37,013,0 59,5Штамм B. lich. 1С 834-1-2 44,011,2 75,9Топаз 0,1%50,0 12,564,3 НСР05 Таблица 6. Влияние заявляемых препаратов на основе штаммов Bacillus licheniformis на поражение малины пурпуровой пятнистостью. ВариантРаспространенность, %Развитие, % Биологическая эффективность, %Контроль 95,0 35,0- Штамм B. lich. IC 831-1-232,5 8,1 76,9Штамм B. lich. IC-832-1-2 35,015,6 55,4Штамм B. lich. IC 833-1-2 37,013,0 59,5Штамм B. lich. 1С 834-1-2 44,011,2 75,9Топаз 0,1%50,0 12,564,3 НСР05  7,0 7,0  Таблица 7. Влияние заявляемых препаратов на основе штаммов Bacillus licheniformis на поражение смородины септориозом. Вариант Биологическая эффективность, % Сроки учетов 27 июня4 июля 11 июля B. licheniformis IC 831-1-280,6 61,3 54,8 B. stearothermophilus IC-832-1-482,3 59,7 54,8В. stearothermophilus IC 833-1-479,5 52,0 59,1В. stearothermophilus IC 834-1-476,6 65,0 53,1Топаз 0,1%64,5 56,556,5 Примечание 1. (*) - биологическая эффективность рассчитана по проросту развития болезни. Примечание 2. Системный фунгицидный и инсектицидный препарат Топаз эффективно лечит ягодные кустарники и огурцы от мучнистой росы, а цветочные растения от ржавчины. Он действует в течение 10 дней и не смывается дождем. Таблица 7. Влияние заявляемых препаратов на основе штаммов Bacillus licheniformis на поражение смородины септориозом. Вариант Биологическая эффективность, % Сроки учетов 27 июня4 июля 11 июля B. licheniformis IC 831-1-280,6 61,3 54,8 B. stearothermophilus IC-832-1-482,3 59,7 54,8В. stearothermophilus IC 833-1-479,5 52,0 59,1В. stearothermophilus IC 834-1-476,6 65,0 53,1Топаз 0,1%64,5 56,556,5 Примечание 1. (*) - биологическая эффективность рассчитана по проросту развития болезни. Примечание 2. Системный фунгицидный и инсектицидный препарат Топаз эффективно лечит ягодные кустарники и огурцы от мучнистой росы, а цветочные растения от ржавчины. Он действует в течение 10 дней и не смывается дождем. Таким образом, обработка насаждений малины препаратами на основе штамма В. licheniformis IC 831-1-2 в полевом опыте снижала: развитие болезни почти в 3 раза, распространенность - больше чем в 2 раза. Прибавка урожайности составила 0,3 т/га. Обработка насаждений смородины штаммом В. licheniformis IC 831-1-2 в полевом опыте снижала развитие болезни в 2,2 раза. Биологическая эффективность составила (54,8-80,6) % в зависимости от срока проведения учета. Обработка насаждений малины препаратом на основе штамма В. stearothermophilus IC 832-1-4 в полевом опыте снижала: развитие болезни почти в 3 раза, распространенность - больше чем в 2 раза. Прибавка урожайности составила 0,3 т/га. Обработка насаждений смородины штаммом В. stearothermophilus IC 832-1-4 в полевом опыте снижала развитие болезни в 2,2 раза. Биологическая эффективность составила (54,8-82,3) % в зависимости от срока проведения учета. Обработка насаждений малины препаратом на основе штамма В. stearothermophilus IC 833-1-4 в полевом опыте снижала: развитие болезни почти в 3 раза, распространенность - больше чем в 2 раза. Прибавка урожайности составила 0,3 т/га. Обработка насаждений смородины штаммом В. stearothermophilus IC 833-1-4 в полевом опыте снижала развитие болезни в 2,2 раза. Биологическая эффективность составила (52,0-79,5) % в зависимости от срока проведения учета. Обработка насаждений малины препаратом на основе штамма В. stearothermophilus IC 834-1-4 в полевом опыте снижала: развитие болезни почти в 3 раза, распространенность - больше чем в 2 раза. Прибавка урожайности составила 0,3 т/га. Обработка насаждений смородины штаммом В. stearothermophilus IC 834-1-4 в полевом опыте снижала развитие болезни в 2,2 раза. Биологическая эффективность составила (53,1-76,6) % в зависимости от срока проведения учета. Пример 9. Исследования заявляемого препарата в виде микробиологического удобрения Ниже в таблице 8 приведены исследования заявляемых препаратов в виде микробиологического удобрения на сорте яровой пшеницы Баганская - 95. Семена обрабатывались на протравочной машине ПС-10, с нормой расхода рабочего раствора 10 л на тонну семян. Расход препаратов составил 10 мл на тонну. Титр препарата - 1×108 КОЕ/мл. Подкормка проводилась путем опрыскивания штанговым опрыскивателем с расходом рабочей жидкости 50 л/га (расход препаратов - 10 мл/га). В результате проведения полевых испытаний препарата Фитоп и экспериментального препарата на основе штамма В. stearothermophilus IC-834-1-4 установлено увеличение содержания групп микроорганизмов - индикаторов почвенного плодородия: обогащение микробного ценоза почвы микроорганизмами различных эколого-трофических групп (общее микробное число), увеличение количества спорообразующих бактерий рода Bacillus, содержание которых является важным показателем благоприятного трофического режима почвы при внесении бактериального препарата и обеспеченности ее элементами минерального питания и характерно для почв с интенсивными процессами нитрификации. Увеличилось количество истинных денитрификаторов и аммонифицирующих микроорганизмов, а также количество автохтонной микрофлоры, которая осуществляет деструкцию гумусовых соединений. Индекс гумификации к моменту уборки урожая достоверно увеличился в варианте с внесением Фитопа на 19,5% и в варианте с внесением препарата на основе штамма В. stearothermophilus IC-834-1-4 на 16,6% по сравнению с контролем. Таким образом, препарат на основе штамма В. stearothermophilus IC-834-1-4 не только положительно влияет на динамику изменения численного состава почвенных микроорганизмов, но и является более эффективным по сравнению со своим аналогом - препаратом Фитоп на основе штамма В. subtilis ВКПМ В-7036. Таблица 8. Исследование препаратов в виде микробиологического удобрения. Вариант опыта Показательная группа почвенной микрофлоры, КОЕ/г Отклонение от контроля 1Общее микробное число Вариант опыта Показательная группа почвенной микрофлоры, КОЕ/г Отклонение от контроля 1Общее микробное число  1.1Контроль 98,2×105 1.1Контроль 98,2×105  1.2Обработка семян штаммом163×10 564,8 1.2Обработка семян штаммом163×10 564,8  Bacillus stearothermophilus Bacillus stearothermophilus    IC-834-1-4 IC-834-1-4   1.3Обработка семян препаратом132,1×10 533,9 1.3Обработка семян препаратом132,1×10 533,9  Фитоп Фитоп   1.4Контроль 40,13×105 1.4Контроль 40,13×105  1.5Подкормка вегетирующих 86×105 45,87 1.5Подкормка вегетирующих 86×105 45,87  растений штаммом В. растений штаммом В.   stearothermophilus stearothermophilus    IC-834-1-4 IC-834-1-4   1.6Подкормка вегетирующих 32,07×105 8,06 1.6Подкормка вегетирующих 32,07×105 8,06  растений препаратом Фитоп растений препаратом Фитоп  2Бактерии рода Bacillus 2Бактерии рода Bacillus   2.1Контроль 11,3×104 2.1Контроль 11,3×104  2.2Обработка семян штаммом17,7×10 46,4 2.2Обработка семян штаммом17,7×10 46,4  Bacillus stearothermophilus Bacillus stearothermophilus    IC-834-1-4 IC-834-1-4   2.3Обработка семян препаратом12,5×10 41,2 2.3Обработка семян препаратом12,5×10 41,2  Фитоп Фитоп   2.4Контроль 13,5×104 2.4Контроль 13,5×104  2.5Подкормка вегетирующих 23,1×104 9,6 2.5Подкормка вегетирующих 23,1×104 9,6  растений штаммом В. растений штаммом В.   stearothermophilus stearothermophilus    IC-834-1-4 IC-834-1-4   2.6Подкормка вегетирующих 15,1×104 1,6 2.6Подкормка вегетирующих 15,1×104 1,6  растений препаратом Фитоп растений препаратом Фитоп  2.7контроль 14,3×104 2.7контроль 14,3×104  2.8Обработка семян и подкормка21,3×10 47 2.8Обработка семян и подкормка21,3×10 47  вегетирующих растений вегетирующих растений   штаммом В. stearothermophilus штаммом В. stearothermophilus    IC-834-1-4 IC-834-1-4   2.9Обработка семян и подкормка16,7×10 42,4 2.9Обработка семян и подкормка16,7×10 42,4  вегетирующих растений вегетирующих растений   препаратом Фитоп препаратом Фитоп  3Истинные денитрификаторы 3Истинные денитрификаторы   3.1Контроль 33,5×105 3.1Контроль 33,5×105  3.2Обработка семян штаммом 3.2Обработка семян штаммом   Bacillus stearothermophilus Bacillus stearothermophilus    IC-834-1-4 55,2×105 21,7 3.3 Обработка семян препаратом IC-834-1-4 55,2×105 21,7 3.3 Обработка семян препаратом    Фитоп 34,9×105 1,43.4 Контроль 36,6×105 Фитоп 34,9×105 1,43.4 Контроль 36,6×105  3.5Обработка семян и подкормка 3.5Обработка семян и подкормка   вегетирующих растений вегетирующих растений   штаммом В. stearothermophilus штаммом В. stearothermophilus    IC-834-1-4 58,1×105 21,5 3.6 Обработка семян и подкормка 27,3×105 9,3 IC-834-1-4 58,1×105 21,5 3.6 Обработка семян и подкормка 27,3×105 9,3 вегетирующих растений вегетирующих растений   препаратом Фитоп препаратом Фитоп  4 Азотфиксирующие (аммонифицирующих) микроорганизмы 4.1 Контроль37,5×10 5 4 Азотфиксирующие (аммонифицирующих) микроорганизмы 4.1 Контроль37,5×10 5 4.2Обработка семян штаммом 4.2Обработка семян штаммом   Bacillus stearothermophilus Bacillus stearothermophilus    IC-834-1-4 33,6×105 IC-834-1-4 33,6×105  4.3Обработка семян препаратом 4.3Обработка семян препаратом   Фитоп 56,7×105 19,25 Автохтонная микрофлора Фитоп 56,7×105 19,25 Автохтонная микрофлора   5.1Контроль 3,8×104 5.1Контроль 3,8×104  5.2Обработка семян штаммом 5.2Обработка семян штаммом   Bacillus stearothermophilus Bacillus stearothermophilus    IC-834-1-4 2,3×104 -1,5 5.3 Обработка семян препаратом IC-834-1-4 2,3×104 -1,5 5.3 Обработка семян препаратом    Фитоп 6,3×104 2,55.4 Контроль 0,9×104 Фитоп 6,3×104 2,55.4 Контроль 0,9×104  5.5Подкормка вегетирующих 0,5×104 5.5Подкормка вегетирующих 0,5×104   растений штаммом В. растений штаммом В.   stearothermophilus stearothermophilus    IC-834-1-4 IC-834-1-4   5.6Подкормка вегетирующих 5.6Подкормка вегетирующих    растений препаратом Фитоп2,3×10 41,4 5.7 Контроль3,9×10 4 растений препаратом Фитоп2,3×10 41,4 5.7 Контроль3,9×10 4 5.8Обработка семян и подкормка 5.8Обработка семян и подкормка   вегетирующих растений вегетирующих растений   препаратом Фитоп0,8×10 4-3,1 5.9 Обработка семян и подкормка препаратом Фитоп0,8×10 4-3,1 5.9 Обработка семян и подкормка    вегетирующих растений вегетирующих растений   штаммом В. stearothermophilus штаммом В. stearothermophilus    IC-834-1-4 5,4×104 1,5 IC-834-1-4 5,4×104 1,5 Пример 10. Данные по восстановлению микрофлоры желудочно-кишечного тракта животных с использованием заявляемого препарата Исследования связаны с определением динамики изменения количественного состава показательных групп кишечной микрофлоры в течение всего периода выведения штаммов из организма животных. Материалом для работы служили: 1. Здоровые беспородные мыши обоего пола из питомника ФГУН ГНЦ ВБ «Вектор». Животных содержали при температуре (25±1)°С и 12-часовом освещении. В качестве корма использовали гранулы для кормления лабораторных мышей и крыс. Животных распределяли по следующим группам: - группа 1 - контроль; - группа 2 - опыт, серийно производящийся препарат Ветом 3 (действующее начало - штамм Bacillus subtilis ВКПМ В 7048); - группа 3 - опыт, экспериментальная модель препарата Ветом 13.1 (действующее начало - штамм Bacillus stearothermophilus IC 831-1-4); - группа 4 - опыт, экспериментальная модель препарата Ветом 14.1 (действующее начало - штамм Bacillus stearothermophilus IC 832-1-4); - группа 5 - опыт, экспериментальная модель препарата Ветом 15.1 (действующее начало - штамм Bacillus stearothermophilus IC 833-1-4); - группа 6 - опыт, экспериментальная модель препарата Ветом 16.1 (действующее начало - штамм Bacillus stearothermophilus IC 834-1-4). Каждая группа содержала по 5 животных. 2. В экспериментах использовались препараты в виде культуральной жидкости используемых штаммов титром не менее 1×108 KOE/мл. Препараты экспериментальным животным выпаивали по следующей схеме: - 0 день - вода; - 1 - 10 день - соответствующие вариантам опыта препараты, разведенные водопроводной водой до расчетного титра не менее 1х106 КОЕ/мл. Поилки с препаратами меняли ежедневно. - 11 - 50 день - вода. 1. Для количественного учета динамики выделения штаммов использовали метод последовательного разведения фекалий животных с последующим высевом 100 мкл предварительно прогретой при 100°С в течение 10 минут суспензии из каждого разведения на мясо-пептонный агар в чашки Петри. Таблица 9. Данные по восстановлению микрофлоры ЖКТ животных Дата, штамм E. coliEnterococcus Lactobacillus Патогенные, в том числе протей Bifidobacterium 12 45 67 0 деньКонтроль 7×104 1×104 3×106 103 108 7048 2,8×105 1×104 5,3×107 10310 8IC-831-1-4 5×105 1×104 7×106 103 108 IC-832-1-4 2×105 1×104 7×106 10310 8IC-833-1-4 1×105 1×104 1×106 103 108 IC-834-1-4 3×105 1×104 2,2×106 10310 8 10 деньКонтроль 5×105 1,1×10 43,4×10 7104 108 7048 2,2×107 1×105 3×107 10310 8IC-831-1-4 2,7×106 3×105 3,8×10 6103 108 IC-832-1-4 2×107 2×106 5×107 103 108 IC-833-1-4 2,6×108 1×105 2,2×108 10310 9IC-834-1-4 1,8×107 3,7×10 62×10 7103 109 20 деньКонтроль 1×105 1×104 1×105 104 108 7048 4×107 1×104 1×106 10410 9IC-831-1-4 1×107 1,2×10 73×10 8102 109 IC-832-1-4 1×107 1×106 6×108 103 109 IC-833-1-4 2×108 5×107 1×108 10210 9IC-834-1-4 2×108 1×107 1×109 102 109 30 день Контроль3×10 41,2×10 41,0×10 6104 107 7048 7,7×107 5×107 1,5×108 10410 9 IC-831-1-45×10 74,6×10 72,6×10 8102 109 IC-832-1-4 3,6×108 5,1×10 73,9×10 9102 1010 IC-833-1-4 5×108 8×108 6×108 102 1010 IC-834-1-4 2,0×108 4,6×10 82,0×10 9102 1010 40 деньКонтроль 1,0×105 6×104 3×105 104 108 7048 2,1×107 3×107 1×107 10410 9IC-831-1-4 7,5×107 2×107 1,3×10 9102 109 IC-832-1-4 9,5×109 1×108 2×1010 102 1010 IC-833-1-4 6,3×108 3×109 6,2×10 9102 1010 IC-834-1-4 1×109 1×109 5×109 102 1010 50 день Контроль 2×105 2,4×104 6×106 10410 8 70486×10 72,0×10 72×10 8104 109 IC-831-1-4 1×108 2×108 1,5×10 9102 109 IC-832-1-4 1,4×109 1,0×10 83×10 1010 21010 IC-833-1-4 2,0×108 3,9×10 101,0×10 100 1011 IC-834-1-41×10 93×10 92,3×10 100 1011 2. Для количественного учета динамики изменения кишечной микрофлоры ежедневно производили высевы из фекалий мышей всех опытных групп по стандартной схеме обследования на дисбактериоз, включающей: - определение бактерий группы кишечной палочки (БГКП) с нормальной ферментативной активностью на среде Эндо и среде Левина; - энтерококков на полимиксиновом агаре; - лактобактерий на среде Бликфельдта; - условно-патогенных микроорганизмов на среде Плоскирева и желточно-солевом агаре; - бифидобактерий на тиогликолевой среде. В таблице 9 приведены данные по восстановлению микрофлоры желудочно-кишечного тракта животных. Анализ таблицы 9 показывает высокую эффективность восстановления кишечной микрофлоры животных по сравнению с контролем и коммерческим препаратом-пробиотиком Ветом 3 (штамм В. subtilis ВКПМ В 7048). Показания к применению (рекомендательные). Препараты на основе штаммов Bacillus stearothermophilus IC-831-1-4, IC-833-1-4, IC-834-1-4 рекомендуется использовать для профилактики и лечения дисбактериозов сельскохозяйственных и диких птиц, в том числе кур, уток, гусей, индеек, цесарок и других, повышения естественной резистентности организма птиц, устранения иммунодефицитных состояний, вызванных инфекционными (вирусы, бактерии, простейшие, внутриклеточные) и неинфекционными (некачественные корма, скученное содержание, стресс вследствие несоблюдения температурных режимов содержания) факторами, увеличения сохранности поголовья, увеличение яйценоскости, получения дополнительных привесов бройлеров, снижения конверсии кормов, уменьшения времени выращивания птицы. Профилактики и лечения дисбактериозов всех видов продуктивных сельскохозяйственных животных, лечения инфекционных заболеваний бактериальной и протозойной этиологии, профилактики вирусных заболеваний и иммунодефицитных состояний, повышения сохранности молодняка в ранние периоды развития, повышения продуктивности, получения дополнительных привесов. Препараты на основе штаммов Bacillus stearothermophilus IC-832-1-4 рекомендуется использовать для профилактики и лечения дисбактериозов крупного рогатого скота, лечения инфекционных заболеваний бактериальной и протозойной этиологии, профилактики вирусных заболеваний и иммунодефицитных (первичных и вторичных) состояний, повышения сохранности молодняка КРС в ранние периоды развития, повышения продуктивности молочного животноводства, получения дополнительных привесов молодняка мясного животноводства, улучшения качества и сортности молока и мяса, продления фертильности маточного поголовья. Формула изобретения1. Штамм бактерий Bacillus licheniformis IC-831-1-2, обладающий бактерицидной и фунгицидной активностью и депонированный во Всероссийской Коллекции Промышленных Микроорганизмов ФГУП ГосНИИГенетика под регистрационным номером ВКПМ В-10561. 2. Штамм бактерий Bacillus licheniformis IC-832-1-2, обладающий бактерицидной и фунгицидной активностью и депонированный во Всероссийской Коллекции Промышленных Микроорганизмов ФГУП ГосНИИГенетика под регистрационным номером ВКПМ В-10562. 3. Штамм бактерий Bacillus licheniformis IC-833-1-2, обладающий бактерицидной и фунгицидной активностью и депонированный во Всероссийской Коллекции Промышленных Микроорганизмов ФГУП ГосНИИГенетика под регистрационным номером ВКПМ В-10563. 4. Штамм бактерий Bacillus licheniformis IC-834-1-2, обладающий бактерицидной и фунгицидной активностью и депонированный во Всероссийской Коллекции Промышленных Микроорганизмов ФГУП ГосНИИГенетика под регистрационным номером ВКПМ В-10564. 5. Препарат, обладающий бактерицидной и фунгицидной активностью, характеризующийся содержанием наполнителя с биомассой бактерий в споровой форме Bacillus licheniformis ВКПМ В-10561, или ВКПМ В-10562, или ВКПМ В-10563, или ВКПМ В-10564, или их смесь с титром каждого штамма бактерий не менее 1·103 КОЕ/г или 1·103 КОЕ/мл. 6. Препарат по п.5, отличающийся тем, что в качестве наполнителя он содержит воду. 7. Препарат по п.5, отличающийся тем, что в качестве наполнителя он содержит порошкообразный сорбент. 8. Препарат по п.7, отличающийся тем, что в качестве порошкообразного сорбента он содержит цеолит, или полисахарид, или моносахарид, или дисахарид, или смесь полисахарида с моносахаридом или полисахаридом в соотношении от 1:100 до 1:10. 9. Препарат по п.8, отличающийся тем, что в качестве полисахарида он содержит крахмал, в качестве моносахарида - глюкозу, в качестве дисахарида - сахарозу. Популярные патенты: 2060650 Дозатор концентрированных кормов ... управления 10 сравнивается с напряжением на входе блока 10, которое соответствует массе выдаваемой порции корма. При наступлении равенства этих напряжений на выходе из компаратора образуется нулевой сигнал, который подается в блок 10. После этого из блока 10 подается команда на отключение привода 3 и включение электромагнита, который через ось поворачивает вал 11 в плоскости, перпендикулярной плоскости поворота крестовины, и корм высыпается из емкости 12 в кормушку. Спиральные пружины 8 возвращают крестовину в исходное положение, а блок 10 подает сигнал на отключение электромагнита. При этом спиральная пружина механизма возврата устанавливает вал 11 с емкостью 12 также в исходное ... 2102853 Питательное устройство для растений ... (фиг. 7 - 8). В качестве газовой фазы может быть использован не только воздух, но и другие газы, например, гелий, аргон, аммиак, диоксид углерода, в зависимости от применяемого водорастворимого вещества, образующего твердую фазу 1. Газовая фаза, примыкающая к твердой фазе 1, в рабочем состоянии питательного устройства обычно содержит молекулы водяного пара. Последние поступают внутрь корпуса 2 из окружающей среды - атмосферного воздуха (фиг. 6 - 10), воды (фиг. 1), влажной почвы (фиг. 2 - 4, 11, 12) или из внутреннего источника (фиг. 12). Присутствие молекул водяного пара в газовой фазе необходимо для реализации принципа действия питательного устройства - образования раствора ... 2469534 Перезаряжаемая электронная ловушка для животных с перегородкой, механическим переключателем в конфигурации с множеством поражающих пластин ... ловушка, имеющая три пластины, как описано в патенте US 7219466.Подобно ловушке с двумя пластинами ловушка с тремя пластинами также основана на том, что уничтожаемое животное одновременно физически соприкасается, по меньшей мере, с двумя пластинами и при обнаружении животного по значению электрического сопротивления осуществляется активизация электродов. В результате, как только мышь поражается электрическим током и остается в контакте с пластинами, ловушка должна быть очищена прежде, чем она будет возвращена в исходное состояние. СУЩНОСТЬ ИЗОБРЕТЕНИЯЗадачей настоящего изобретения является создание электронной ловушки для животных, имеющей множество электродов, разнесенных один ... 2440708 Комбинированное устройство для ротационного внутрипочвенного рыхления ... щелереза, расположенных вертикально симметрично вдоль хода движения устройства, механически связанных с общим приводом и расположенным под приводом внутрипочвенным фрезерователем, снабжено рампой, установленной по ходу движения устройства за валом фрезерователя параллельно ему и соединенной с диском щелереза. Рампа снабжена рыхлящими пальцами, ориентированными вперед по ходу движения устройства и расположенными на рампе в промежутках между почвенными фрезами. Рыхлящий палец снабжен подшипником, на который опирается вала фрезерователя. Рыхлящий палец выступает вперед по ходу движения устройства относительно цилиндрической поверхности, образованной режущими кромками почвенных фрез ... 2229213 Способ регулирования роста зерновых культур ... опыты проводили на опытном поле Рязанской ГСХА (учхоз “Стенькино”) на яровом ячмене сорта “Криничный”. Площадь опытной делянки 150 кв.м., площадь учетной делянки 70 кв.м.Семена обрабатывали методом полусухого протравливания в день посева следующими препаратами: препаратом СИЛК (эталон), норма расхода препарата - 50 мл/т, расход рабочего раствора 10 л/т и препаратом Лариксин при норме расхода 100 и 250 мл/т, расход рабочего раствора 10 л/т. Контрольные семена обрабатывали водой.Вегетирующие растения опрыскивали двукратно в фазу начала выхода в трубку и в фазу появления флагового листа. Препарат Силк использовали для опрыскивания ярового ячменя при норме расхода 30 мл/га, а ... |
Еще из этого раздела: 2485755 Способ выращивания посадочного материала 2444769 Жидкостный резервуар, устройство наблюдения для наблюдения под поверхностью жидкости и оптическая пленка 2272840 Способ молекулярного маркирования пола хмеля обыкновенного (humulus lupulus l) 2402189 Роликовая сортировальная машина 2121252 Агротранспортная система 2197796 Рабочий орган ручного почвообрабатывающего орудия 2456799 Ловушка для поимки животных, обитающих в земле 2048055 Устройство для отрезания и погрузки сенажа и силоса 2121258 Устройство для вентилирования зерна или другого сыпучего материала (варианты) 2493697 Технологическая линия для подготовки к скармливанию пророщенного зерна |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
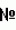 2129375, МПК A01N 63/00, C12N 1/20, опубл. 27.04.1999 г.).
2129375, МПК A01N 63/00, C12N 1/20, опубл. 27.04.1999 г.).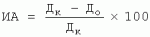 ,
,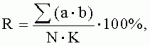
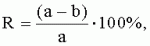 где
где