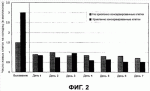
Способ получения сэндвичной культуры изолированных клеток печениПатент на изобретение №: 2432395 Автор: АРСЕНИЕВ Любомир (DE), АЛЕКСАНДРОВА Крассимира (DE), БАРТХОЛЬД Марк (DE), КАФЕРТ-КАСТИНГ Забине (DE), ЛАУБЕ Бритта (DE) Патентообладатель: ЦИТОНЕТ ГМБХ УНД КО. КГ (DE) Дата публикации: 10 Января, 2010 Начало действия патента: 3 Ноября, 2006 Адрес для переписки: 129090, Москва, ул. Б.Спасская, 25, стр.3, ООО "Юридическая фирма Городисский и Партнеры", пат.пов. Е.Е.Назиной Изображения    Изобретение относится к области биотехнологии, конкретно к способу получения сэндвичной культуры клеток печени, и может быть использовано в медицине. Способ предусматривает стадии: (а) подготовки матрицы, (b) подготовки изолированных клеток печени, (с) высевания клеток печени на матрицу с плотностью от 2 до 4×10 3 мм-2, (d) оставления в покое покрытой клетками матрицы в течение 10-180 минут, так что клетки могут прилипать к матрице, (е) смывания не прилипших клеток с покрытой клетками матрицы, (f) оставления в покое покрытой клетками матрицы в течение максимально 180 минут, и (g) замораживания покрытой клетками матрицы в среде замораживания, (h) хранения замороженной, покрытой клетками матрицы, (i) размораживания замороженной, покрытой клетками матрицы, (j) смывания не прилипших клеток с покрытой клетками матрицы, (k) покрывания размороженной, покрытой клетками матрицы слоем второй матрицы, и (1) рекультивирования заделанных между матрицами клеток. Изобретение позволяет повысить процент жизнеспособных гепатоцитов в сэндвичных культурах. 11 з.п. ф-лы, 4 ил., 1 табл. Область техники, к которой относится изобретение Данное изобретение относится к технической области криогенной консервации и, в частности, к способам подготовки клеток печени для криогенной консервации, способам криогенной консервации изолированных клеток печени и к способам получения сэндвичной культуры криогенно консервированных изолированных клеток печени. Уровень техники Изолированные из тканевого соединения клетки печени, а именно гепатоциты, используются прежде всего в виде культур первичных клеток для тестирования физиологического действия возможных лекарственных средств. Прежде всего свежепрепарированные первичные гепатоциты человека представляют «золотой стандарт» для in vitro определения в тестируемых рядах в пробирках возможных действующих веществ или для исследования метаболизма биологически активных веществ или индукции ферментов. К сожалению, свежеизолированные гепатоциты человека имеются в распоряжении не регулярно и не в любое время. Поэтому существует потребность в способах, с помощью которых изолированные гепатоциты можно хранить определенное время. При этом физиологическая функция клеток, т.е. прежде всего их метаболическая, соответственно, ферментативная способность, должны по возможности полностью сохраняться. Как известно, гепатоциты хранятся в криогенно консервированном виде. Как правило, гепатоциты подвергаются криогенной консервации в суспензии. Суспензия содержит наряду с гепатоцитами еще среду замораживания, которая должна предотвращать повреждение клеток за счет замораживания и размораживания. Для хранения суспензию замораживают в большинстве случаев до температур ниже -80°С. Для применения после хранения замороженную суспензию клеток размораживают, и клетки переносят на пластинки для культуры или в сосуды для культуры. Для рекультивирования образованных клеток сосуды для культуры, как правило, покрывают матричным материалом, к которому могут прилипать клетки. Успешное прилипание является существенным для рекультивирования и последующих исследований. Однако в большинстве случаев можно получать и рекультивировать лишь небольшую долю первоначально замороженных в живом состоянии клеток. Недостаток этого способа состоит прежде всего в том, что нельзя прогнозировать, будут ли и в каком количестве размороженные клетки из суспензии прилипать к пластинке для культуры. Доля прилипающих клеток в порции зависит от отдельной порции. Регулярно прилипает в достаточной степени к пластинке для культуры лишь небольшое число размороженных после криогенной консервации клеток порции. Другой известный способ криогенной консервации состоит в том, что свежеизолированные клетки вносят в сосуды для культуры для последующего замораживания внесенных клеток вместе с сосудами для культуры. В данном случае сосуды для культуры также покрывают перед внесением клеток матрицей, к которой могут прилипать клетки. Как известно, используют предпочтительно коллагеновые гели. В одном известном способе гепатоциты высевают на покрытые коллагеном типа I пластинки и оставляют на коллагеновой матрице в течение примерно 4 часов для прилипания. Возникающую монослойную культуру клеток затем культивируют в течение примерно 20 часов. Затем смывают не прилипшие клетки. Еще после 6 часов культуру покрывают средой замораживания, охлаждают до -70°С и хранят (Watts und Grant, 1998; Human & Experimental Toxicology 15:30-37). Для последующего применения монослойные культуры размораживают и рекультивируют. Однако размороженные культуры имеют большую долю не прилипших и не живых клеток, а также обломков клеток. Хотя обычно большие части матрицы покрываются клетками, однако конфлюэнтный, сплошной клеточный комплекс не возникает. В другом известном способе гепатоциты замораживают в сэндвичной конфигурации, т.е. в системе с двойным гелем. Для этого сначала высевают суспензию гепатоцитов на покрытые коллагеновым гелем пластинки для культуры. После 24 часов культивирования клеток наливают второй слой коллагенового геля на высеянные клетки. Затем полученную сэндвичную культуру замораживают в среде замораживания до температуры -70°С и хранят (Koebe et al., 1990; Cryobiology 27:576-584). За счет иммобилизации клеток печени на матрице или между двумя матрицами перед замораживанием, клетки механически стабилизируются, и тем самым повышается степень выживания. За счет того, что клетки могут прилипать в свежеизолированном, высоковитальном состоянии, значительно повышается коэффициент прилипания по сравнению с прилипанием замороженных в суспензии и размороженных после криогенной консервации клеток. Несмотря на это в данном случае после размораживания также образуются большие доли не прилипших, соответственно, не живых клеток. Идеальное состояние сплошной культуры живых гепатоцитов не достигается. Кроме того, замороженные в суспензии клетки, как правило, в течение нескольких часов после размораживания теряют свою метаболическую способность. В этом случае они непригодны для большого числа проводимых в пробирках тестов. Кроме того, изолированные из органов человека клетки являются в большинстве случаев менее устойчивыми, чем извлеченные из животных моделей клетки. Это объясняется, прежде всего, тем, что человеческие клетки из донорских органов можно получать при менее благоприятных условиях, чем клетки из животных, которые в большинстве случаев специально выращиваются для этого, а затем усыпляются (например, крысы, мыши или свиньи). Поэтому человеческие клетки требуют значительно более щадящих условий культивирования. До настоящего времени не известен ни один способ, с помощью которого можно успешно подвергать криогенной консервации гепатоциты человека, для того чтобы затем можно было в течение длительного времени проводить изучения в пробирке. Поэтому существует потребность в улучшенных способах криогенной консервации клеток печени, которые обеспечивают возможность щадящей криогенной консервации, то есть, прежде всего, щадящего размораживания с высоким коэффициентом выживания. Улучшенный способ криогенной консервации должен быть пригодным, прежде всего, для успешной криогенной консервации изолированных гепатоцитов человека. При этом должна обеспечиваться возможность рекультивирования большой доли размороженных клеток, по возможности в виде конфлюэнтного единичного слоя (сплошного монослоя) на матрице для культивирования. Кроме того, способ должен быть пригодным для получения улучшенных сэндвичных культур изолированных клеток печени, которые содержат большую долю живых клеток. Кроме того, необходимо обеспечить, чтобы размороженные после криогенной консервации, рекультивированные клетки по возможности сохраняли в течение длительного времени свою метаболическую, соответственно, ферментативную способность, так чтобы их можно было использовать для большого числа тестирований в пробирке. Сущность изобретения Положенный в основу данного изобретения технический результат состоит в создании улучшенного способа криогенной консервации изолированных клеток печени, в частности клеток печени человека, так что криогенно консервированные клетки печени можно затем рекультивировать в виде улучшенной сэндвичной культуры. Положенная в основу изобретения техническая задача решена с помощью способа, согласно пункту 1 формулы изобретения, в частности способа препарирования клеток печени для криогенной консервации, который содержит следующие стадии: На стадии (а) подготавливают матрицу, в частности коллагеновую матрицу, предпочтительно коллагеновый гель. Матрица предпочтительно находится в сосуде для культуры, например пластинке с 6 колодцами. Сосуд для культуры предпочтительно покрывают матричным материалом. На стадии (b) подготавливают изолированные клетки печени, в частности изолируют из ткани. На следующей стадии (с) изолированные клетки печени высевают на матрицу. При этом плотность клеток печени на матрице составляет от 2 до 4×103 клеток на квадратный миллиметр поверхности матрицы. Предпочтительная плотность клеток составляет от 2,6 до 3,2×103 мм-2. То есть, при сосуде для культуры с основной площадью 9,6 см2, например, площадью дна одного колодца в пластине с 6 колодцами, число высеянных клеток составляет для каждого колодца от 2,5 до 3×106. На следующей, предпочтительно непосредственно примыкающей стадии (d) клетки оставляют в покое на матрице (фаза покоя, фаза прилипания). Для этого покрытую клетками матрицу оставляют в покое в течение 10-180 минут, предпочтительно 30-90 минут, особенно предпочтительно в течение 1 часа, так что высеянные на матрицу клетки могут прилипать к матрице. Выдерживание в покое осуществляют предпочтительно в шкафу для культуры (инкубаторе), в частности, в стандартных условиях при температуре 37°С, содержании СО2 5% и относительной влажности 95%. Успешное прилипание можно дополнительно контролировать с помощью микроскопа. После выдерживания в покое на стадии (d) на стадии (е) не прилипшие к матрице клетки смывают, в частности, осторожно с покрытой клетками матрицы (стадия промывки). Смывание происходит предпочтительно за счет того, что на покрытую клетками матрицу наносят слой культуральной среды, а затем откачивают жидкий остаток из культуральной среды и не прилипших клеток. Эту стадию предпочтительно повторяют, по меньшей мере, один раз. В следующей стадии (f) снова оставляют в покое промытую, покрытую клетками матрицу (вторая фаза покоя). Выдерживание в покое происходит в течение максимально 180 минут, в частности 30-180 минут, особенно предпочтительно в течение около 1 часа. Выдерживание в покое осуществляют предпочтительно в шкафу для культуры, в частности, в стандартных условиях при температуре 37°С, содержании СО2 5% и относительной влажности 95%. После второй фазы покоя покрытую клетками матрицу замораживают на стадии (g) в среде замораживания (стадия замораживания). Перед замораживанием и после второй фазы покоя покрытую клетками матрицу предпочтительно снова промывают, прежде всего, для удаления оставшихся не прилипших клеток (стадия промывания). Эта стадия предпочтительно соответствует стадии (е). Таким образом, способ, согласно изобретению, предусматривает высевание изолированных клеток печени с определенной плотностью на матрицу и замораживания в среде замораживания клеток после определенной последовательности фаз покоя и смывания не прилипших клеток. Таким образом, замораживают покрытую клетками матрицу, в частности коллагеновую матрицу, на которой прилипли клетки и находятся, в частности, в одном слое. За счет мер, согласно изобретению, неожиданным образом получается культура невридимых клеток, которую можно особенно хорошо замораживать, то есть криогенно консервировать. При этом обнаруживается, что препарированные, согласно изобретению, и криогенно консервированные культуры после размораживания являются особенно живучими (витальными) и имеют большое число прилипших на матрице клеток. При этом размороженные клетки можно предпочтительно рекультивировать в сплошном монослое. Способ согласно изобретению является неожиданным образом особенно щадящим для клеток и поэтому пригоден также для менее прочных клеток, таких как изолированные из органов человека гепатоциты. Прежде всего, проявляется, что препарированные согласно изобретению и подвергнутые криогенной консервации клетки, если они после размораживания покрываются слоем второй матрицы, сохраняют в течение нескольких дней, в частности более 3 дней, свою полную метаболическую активность, соответственно метаболическую способность. В одном предпочтительном варианте выполнения способа согласно изобретению замораживание происходит на стадии (g) со средой замораживания, которую добавляют в количестве около 0,5 мл на 1 мм2 основной поверхности сосуда для культуры. Для этого покрытую клетками матрицу покрывают слоем среды замораживания. Среда замораживания предпочтительно содержит 10% фетальной телячьей сыворотки (FCS), а также 10% диметилсульфоксида (DMSO). В особенно предпочтительном варианте выполнения на стадии (g) после добавления среды замораживания выполняют контролируемое охлаждение, т.е. замораживание, предпочтительно до температуры -80°С или ниже. Для охлаждения предпочтительно используют скорости охлаждения от -0,5 до -20°С в минуту. При этом в одном варианте выполнения компенсируют фазовый переход; это осуществляется предпочтительно за счет кратковременного нагревания со скоростью нагревания предпочтительно от +1 до +3°С в минуту. После препарирования согласно изобретению и замораживания изолированных клеток печени на матрице покрытую клетками матрицу хранят в замороженном состоянии в рамках криогенной консервации. При хранении температура предпочтительно составляет -80°С или ниже, особенно предпочтительно -150°С или ниже. Хранение осуществляется целесообразно в холодильном шкафу или в паровой фазе жидкого воздуха, соответственно жидкого азота. Естественно, для температурного хранения клеток пригодны также все другие известные способы. Специалист может выбирать способ хранения в соответствии с областью применения и в соответствии с целесообразностью. Данное изобретение относится также к способу криогенной консервации изолированных клеток печени, который содержит указанные выше стадии (а)-(g), при этом в дополнительной стадии (h) замороженную, покрытую клетками матрицу хранят в течение неопределенного времени, которые выбирают в зависимости от области и цели применения. В следующей дополнительной стадии (i) в зависимости от области и цели применения предпочтительно непосредственно перед применением или в другой подходящий момент времени снова размораживают замороженную, покрытую клетками матрицу. Это происходит предпочтительно посредством нанесения на замороженную, покрытую клетками матрицу слоя теплой культуральной среды. Замороженная, покрытая клетками матрица предпочтительно находится в сосуде для культуры, например пластинке с 6 колодцами. Сосуд для культуры предпочтительно извлекают из холодильного шкафа, соответственно из бака с жидким азотом, и, в частности, непосредственно после этого инкубируют в течение примерно 5 минут в холодильнике в стандартных условиях (37°С, 5% СО2, относительной влажности 95%). Затем на покрытую клетками матрицу предпочтительно из пипетки подают среду размораживания (среду 1), предпочтительно медленно и по каплям. На площадь около 9,6 см2 (пластинка с 6 колодцами) подают примерно 1 мл среды 1. Температура среды предпочтительно составляет около 37°С. Процесс повторяют для каждого сосуда с клеточной культурой. Обычно используют максимально три пластинки с 6 колодцами, так что максимально в 18 колодцах покрытую клетками матрицу покрывают слоем теплой среды. Затем предпочтительно каждый сосуд с клеточной культурой, соответственно колодец, покрывают слоем одинакового количества среды 1 (1 мл на 9,6 см2) аналогичным образом, предпочтительно медленно и по каплям. В одном предпочтительном варианте выполнения среда 1 является содержащей сыворотку средой размораживания, которая содержит предпочтительно 10% фетальной телячьей сыворотки (FCS). В дополнительной стадии (j) прежде всего не прилипшие клетки или отставшие, не живые клетки смывают с покрытой клетками матрицы, так что получают свободную от не прилипших клеток матрицу. Для этого сначала по возможности полностью откачивают полученный за счет добавления на стадии (i) среды 1 остаток над покрытой клетками матрицей. Остаток содержит по существу размороженные, не живые и не прилипшие клетки. В особенно предпочтительном варианте выполнения после этого на откачанную, покрытую клетками матрицу подают другую среду, т.е. среду 2, предпочтительно по каплям. Среда 2 имеет предпочтительно температуру 37°С. При добавлении среды 2 предпочтительно выбирают указанный в стадии (i) двухступенчатый процесс; сначала распределяют во все соответствующие сосуды для культуры первую половину среды, а затем соответственно вторую половину. Добавляемые количества среды 2 соответствуют количествам среды 1 в стадии (i). Среда 2 предпочтительно имеет отличающийся от среды размораживания (среды 1) состав. Среда 2 предпочтительно содержит сыворотку и предпочтительно содержит 10% CFS. В особенно предпочтительном варианте выполнения покрытые слоем среды 2 покрытые клетками матрицы после этого инкубируют в течение около 30 минут в шкафу для культуры при стандартных условиях (фаза покоя, инкубация). Для удаления не прилипших и не живых клеток после этого по возможности полностью откачивают остаток над покрытой клетками матрицей из сосуда для культуры. За счет этого получают по существу свободную от не прилипших и не живых клеток, покрытую клетками матрицу. В дополнительной стадии (k) размороженную, обмытую, покрытую клетками матрицу покрывают слоем второй матрицы, предпочтительно коллагеновой матрицы, особенно предпочтительно коллагеновым гелем, соответственно заливают слоем геля. Предпочтительно залитый гель предпочтительно затвердевает в течение от нескольких минут до 1 часа. В предпочтительном варианте выполнения состав первой, нижней матрицы и нанесенной после размораживания второй, верхней матрицы, по существу, одинаков, предпочтительно идентичен. Вторую, верхнюю матрицу предпочтительно наливают на прилипший на нижнюю матрицу монослой прилипших клеток печени. Таким образом, согласно изобретению получают сэндвичную культуру, в которой изолированные клетки печени заделаны между двумя матрицами, в частности двумя коллагеновыми матрицами. В заключительной стадии (l) заделанные между матрицами клетки рекультивируют и в зависимости от области и цели применения тотчас или после целесообразно выбранного времени культивирования применяют по назначению, т.е. предпочтительно для тестирования в пробирках. Препарированные согласно изобретению и подвергнутые криогенной консервации, размороженные и рекультивированные изолированные клетки печени имеют особенно высокий коэффициент живучести. Они проявляют особенно долго после размораживания свою метаболическую способность. С помощью способа согласно изобретению можно предпочтительно подвергать криогенной консервации и успешно размораживать прежде всего изолированные из органов человека менее стойкие гепатоциты, так что их можно затем в течение длительного времени применять в соответствующих тестах в пробирках. Неожиданным образом получена клеточная культура, в которой клетки можно рекультивировать, по существу, в виде конфлюэнтного монослоя и в которой доля не живых, соответственно не прилипших клеток является очень небольшой. Изобретение относится также к способу получения сэндвичной культуры криогенно консервированных изолированных клеток печени, при этом выполняют, по меньшей мере, стадии (а)-(l) способов согласно изобретению и получают сэндвичную культуру из заключенных между верхней и нижней матрицей клеток. Наконец, предметом данного изобретения является также способ получения сэндвичной культуры изолированных клеток печени, при этом сначала приготавливают печеночную ткань животного или человеческого организма, а затем изолируют клетки печени из ткани и выполняют, по меньшей мере, стадии (а)-(l) способов согласно изобретению. Специалист может выбирать в зависимости от области и цели применения известные способы изоляции клеток печени из тканей. Наконец, данное изобретение относится также к сэндвичной культуре, которую можно получать и которую предпочтительно получают с помощью указанных выше способов. Сэндвичная культура согласно изобретению имеет все указанные выше преимущества и представляет по сравнению с уровнем техники улучшенную культуру изолированных клеток печени. Примеры выполнения Ниже приводится подробное пояснение изобретения с помощью примеров и чертежей. Примеры следует понимать ни как имеющие ограничительный характер, а как иллюстрацию положенной в основу данного изобретения изобретательской идеи и преимуществ изобретения на основе конкретных примеров. На чертежах изображено: фиг.1 - микроскопические фотографии культивированных гепатоцитов (масштаб с увеличением примерно в 150 раз), при этом на фиг.1А показаны свежеизолированные гепатоциты человека, а на фиг.1В - подвергнутые криогенной консервации гепатоциты человека; фиг.2 - число живых гепатоцитов в зависимости от длительности культивирования; фиг.3 - образование 6 Пример 1. Препарирование гепатоцитов человека для криогенной консервации 1.1 Изоляция гепатоцитов человека Гепатоциты из человеческих доноров изолируют известным образом из хирургически удаляемых частей ткани, которые удаляются с согласия донора. Для этого ткань подвергают перфузии, при этом гепатоциты выделяются из совокупности тканей и их можно получать из перфузионного раствора. Жизнеспособность получаемых гепатоцитов определяют с помощью теста окраски трипановым синим. Для дальнейших экспериментов применяют лишь препараты клеток, которые имеют выход окраски трипановым синим более 70%. 1.2 Подготовка матрицы В последующих экспериментах применяют сосуды для культуры в виде пластинок с несколькими колодцами, а именно пластинки с 6 колодцами (тип 657 160, фирмы Greiner Bio-One). Пластинки покрывают слоем природного коллагенового геля, который изолируют предпочтительно из хвостов крыс. В качестве альтернативного решения применяют предварительно покрытые слоем коллагена тип 1 пластинки с несколькими колодцами, а именно пластинки с 6 колодцами (тип 657 950 CELLCOAT, фирмы Greiner Bio-One). Пластинки с 6 колодцами имеют площадь дна 9,6 см2 каждого колодца. 1.3 Высевание клеток Изолированные гепатоциты высевают на пластинки с несколькими колодцами. Для этого изготавливают суспензию изолированных гепатоцитов, которая содержит от 2,5 до 3 миллионов живых гепатоцитов в 2 мл суспензии. В каждый колодец пластинки с 6 колодцами вносят с помощью пипетки 2 мл этой клеточной суспензии. Таким образом, плотность клеток составляет от 2600 до 3200 живых гепатоцитов на 1 мм2 поверхности сосуда для культуры. После высевания пластинки оставляют в течение около 1 часа. Для этого пластинки помещают в шкаф для культуры, где поддерживаются стандартные условия (37°С, 5% СО2, относительная влажность воздуха 95%). Фаза покоя обеспечивает прилипание клеток из суспензии на коллагеновый гель. Успешное прилипание можно оценивать посредством контроля с помощью микроскопа. После фазы прилипания/покоя откачивают остаток клеточной суспензии, который имеет, по существу, не прилипшие клетки. 1.4 Замораживание покрытой клетками матрицы После откачивания остатка добавляют примерно 1 мл теплой среды 1 с температурой 37°С в каждый колодец. Затем оставляют снова в покое клетки в течение примерно 1 часа в инкубаторе при стандартных условиях. После этого тщательно откачивают остаток, который, по существу, содержит не прилипшие клетки. Среда 1 является производной от стандартной среды клеточной культуры для гепатоцитов и содержит 10% фетальной телячьей сыворотки (FCS). Для замораживания в каждый колодец добавляют 0,5 мл среды замораживания. Добавление среды замораживания осуществляют быстро. После добавления среды замораживания пластинки тотчас ставят в предварительно охлажденную до 0°С холодильную машину и запускают программу замораживания. Среда замораживания основана, по существу, на среде 1 и содержит 10% фетальной телячьей сыворотки (FCS) и 10% диметилсульфоксида (DMSO). Программа замораживания предусматривает компенсацию фазового перехода и достижение целевой температуры -100°С. Затем пластинки с замороженной клеточной культурой хранят при температуре -151°С в холодильному шкафу, соответственно в газовой фазе в баке с азотом. Пример 2. Размораживание криогенно консервированных гепатоцитов Замороженные согласно примеру 1 и хранимые при температуре -151°С культуры гепатоцитов размораживают и рекультивируют для дальнейшего применения в тестах в пробирках после хранения в течение до 4 недель. Для размораживания криогенно консервированных культур гепатоцитов пластинки с 6 колодцами сначала помещают непосредственно после извлечения из холодильного шкафа, соответственно бака с азотом на 5 минут в шкаф для культуры, который имеет стандартные условия (смотри пример 1). Затем добавляют в каждый колодец медленно и по каплям предварительно подогретую до 37°С среду 1 (смотри пример 1). Этот процесс повторяют для максимально трех одновременно размораживаемых пластинок с 6 колодцами, т.е. для максимально 18 колодцев. Затем процесс повторяют, при этом снова медленно добавляют в каждый колодец по 1 мл среды 1. После этого остаток откачивают с помощью пипетки Пастера. Остаток содержит, по существу, размороженные не живые и не прилипшие клетки. Для дальнейшего промывания добавляют аналогичным образом в каждый колодец два раза по 1 мл теплой среды 2 с температурой 37°С. При этом среду 2 добавляют указанным выше для среды 1 способом двумя заходами по 1 мл в каждый колодец. После этого пластины инкубируют примерно в течение 30 минут в шкафу для культуры при стандартных условиях. После инкубации весь остаток, который содержит другие не живые и не прилипшие клетки, откачивают с помощью пипетки Пастера. Полученный таким образом монослой из прилипших гепатоцитов покрывают другим слоем коллагенового клея для получения сэндвичной конфигурации. Коллагеновый гель затвердевает после наливания в течение примерно 30 минут. Он имеет состав, который, по существу, соответствует составу нижнего коллагенового геля, который находился в сосудах для культуры. Среда 2 является стандартной средой для длительного культивирования гепатоцитов и содержит 10% фетальной телячьей сыворотки (FCS). Дальнейшее рекультивирование полученной сэндвичной культуры осуществляют в среде 2, которую примерно каждые 24 часа заменяют свежей средой. Пример 3. Определение числа жизнеспособных клеток Число жизнеспособных (живых) клеток в культурах свежеизолированных гепатоцитов, а также криогенно консервированных согласно изобретению гепатоцитов определяют посредством подсчета морфологически невредимых клеток. При этом подсчет проводят на фотографиях сравнительных поверхностей величиной 0,259 мм2. Из числа обнаруженных на сравнительной поверхности невредимых клеток делают вывод о числе невредимых клеток во всем сосуде для культуры (для применяемых пластинок с 6 колодцами с площадью 9,6 см2 каждого колодца получают коэффициент коррекции 3700). Перед замораживанием и в различные моменты времени после размораживания после криогенной консервации фотографически документируют морфологию рекультивированных гепатоцитов и сравнивают с культурами свежеизолированных и культивированных гепатоцитов. Результаты: На фиг.1 показана морфология свежеизолированных и высеянных на слой коллагенового геля человеческих гепатоцитов (фиг.1А), а также морфология подвергнутых криогенной консервации, размороженных и в течение 7 дней рекультивированных изолированных человеческих гепатоцитов (фиг.1В). Рекультивированные подвергнутые криогенной консервации клетки можно морфологически едва отличить от свежеизолированных клеток. Доля живых клеток в культуре лишь немного уменьшилась по сравнению с долей живых клеток в культурах свежеизолированных гепатоцитов. На фиг.2 показано число живых (витальных) человеческих гепатоцитов в зависимости от длительности рекультивирования после размораживания гепатоцитов. Сравнительная кривая показывает число живых человеческих гепатоцитов при культивировании свежеизолированных клеток в тот же период времени. Первоначально были высеяны для криогенной консервации 3 миллиона клеток, для свежего препарирования - 1,5 миллионов клеток. Было установлено, что размороженные рекультивированные человеческие гепатоциты растут конфлюэнтно, и что число живых прилипших клеток не существенно отличается от числа живых клеток в сравнимых свежих культурах. При этом следует отметить, что после длительного времени культивирования число живых клеток остается почти постоянным в подвергнутых криогенной консервации размороженных препаратах. Пример 4. Ферментная активность криогенно консервированных гепатоцитов Хорошим маркером для метаболической, соответственно ферментной способности клеток печени является способность индуцирования ферментативного гидроксилирования тестостерона. В невредимых клетках печени происходит основной обмен «базального уровня» этой реакции, при этом образуется гидрокситестостерон (ОНТ). Скорость образования можно увеличивать при невредимых клетках за счет ферментной индукции. Поэтому доказательство образования ОНТ в культивированных гепатоцитах позволяет делать выводы о ферментативной способности и физиологической функции культивированных гепатоцитов. Анализ и квантификация региоселективного, соответственно стереоселективного гидроксилирования тестостерона осуществлялись само по себе известным методом, опубликованным, например, в статье Friedrich et al., 2003 (J.Chromatogr. B. 784:49-61). Для этого исследования были разморожены криогенно консервированные согласно изобретению человеческие гепатоциты и рекультивированы в течение двух дней, а затем инкубированы еще в течение 24 часов в рифампицине. Рифампицин индуцирует гидроксилирование тестостерона в позициях 6 Для контроля свежеизолированные культуры также инкубировали в течение 24 часов в рифампицине, после их культивирования в течение двух дней. Условия культивирования были выбраны аналогично условиям способов, согласно изобретению. Наряду со способностью индуцирования ферментов определяли основной обмен тестостерона в подвергнутых криогенной консервации и рекультивированных клетках, а также в свежепрепарированных и культивированных клетках. Результаты: Криогенно консервированные, согласно изобретению, рекультивированные гепатоциты и свежепрепарированные культивированные гепатоциты показали сравнимую способность ферментной индукции. Средние величины для индукции гидроксилирования тестостерона приведены в следующей таблице:  Криогенно консервированные, рекультивированные гепатоциты (согласно изобретению) Свежеизолированные гепатоциты (сравнительный пример) 6 Криогенно консервированные, рекультивированные гепатоциты (согласно изобретению) Свежеизолированные гепатоциты (сравнительный пример) 6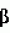 -гидроксилирование в 2,8 разав 2,3 раза16 -гидроксилирование в 2,8 разав 2,3 раза16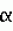 -гидроксилирование в 2,4 разав 1,6 раза2 -гидроксилирование в 2,4 разав 1,6 раза2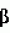 -гидроксилирование в 2,3 разав 2,4 раза -гидроксилирование в 2,3 разав 2,4 разаКак и ожидалось, рифампицин не мог индуцировать образование 6 На фиг.3 показана абсолютная концентрация образованного гидрокситестостерона (в качестве примера показана концентрация для 6 Из опыта обращения с криогенно консервированными в суспензии клетками печени следует, что криогенная консервация сильно уменьшает основной обмен при гидроксилировании тестостерона по сравнению со свежепрепарированными гепатоцитами. Как и ожидалось, в криогенно консервированных в монослое клетках печени также уменьшалась основная активность рекультивированных гепатоцитов по сравнению со свежей культурой. Однако она все еще хорошо обнаруживалась 24 и 72 часа после размораживания. В частности, было установлено, что криогенно консервированные гепатоциты 72 часа после размораживания и после предшествующей инкубации в течение 24 часов рифампицином проявляют явную способность к индукции гидроксилирования тестостерона. Полученная в течение, по меньшей мере, трех дней основная активность вместе с неуменьшающейся способностью к индукции являются существенным доказательством того, что криогенно консервированные согласно изобретению человеческие гепатоциты можно успешно применять для большого числа тестов в пробирке. Формула изобретения1. Способ получения сэндвичной культуры изолированных клеток печени, содержащий стадии (а)-(1):(a) подготовки матрицы, (b) подготовки изолированных клеток печени,(c) высевания клеток печени на матрицу с плотностью от 2 до 4×10 3 мм-2,(d) оставления в покое покрытой клетками матрицы в течение 10-180 мин, так что клетки могут прилипать к матрице,(e) смывания неприлипших клеток с покрытой клетками матрицы,(f) оставления в покое покрытой клетками матрицы в течение максимально 180 мин, и(g) замораживания покрытой клетками матрицы в среде замораживания,(h) хранения замороженной покрытой клетками матрицы,(i) размораживания замороженной покрытой клетками матрицы, (j) смывания неприлипших клеток с покрытой клетками матрицы, (k) покрывания размороженной покрытой клетками матрицы слоем второй матрицы и(1) рекультивирования заделанных между матрицами клеток. 2. Способ по п.1, при этом матрица является коллагеновой матрицей. 3. Способ по п.1, при этом оставление в покое в стадии (d) происходит в течение 30-90 мин. 4. Способ по п.1, при этом в стадии (е) покрывают слоем культуральной среды, а затем откачивают жидкий остаток над покрытой клетками матрицей. 5. Способ по п.1, при этом оставление в покое в стадии (f) происходит в течение 30-180 мин. 6. Способ по п.1, при этом в стадии (g) добавляют среду замораживания в количестве 0,5 мкл/мм-2. 7. Способ по п.6, при этом среда замораживания содержит фетальную телячью сыворотку (FCS) и DMSO. 8. Способ по п.1, при этом в стадии (g) замораживание происходит за счет покрытия покрытой клетками матрицы слоем среды замораживания и контролируемого охлаждения до -80°С или ниже со скоростью охлаждения от 0,5 до 20°С мин-1 , при необходимости с компенсацией фазового перехода. 9. Способ по п.1, при этом хранение в стадии (h) происходит при температуре -150°С. 10. Способ по п.1, при этом в стадии (i) покрытую клетками матрицу покрывают слоем теплой культуральной среды. 11. Способ по п.1, при этом в стадии (j) покрытую клетками матрицу покрывают слоем теплой культуральной среды, а затем откачивают жидкий остаток над покрытой клетками матрицей. 12. Способ по п.1, при этом стадия (а) содержит стадии: (а1) подготовки ткани печени из животного или человеческого организма и(а2) изолирования клеток печени из ткани. Популярные патенты: 2261588 Способ электростимуляции жизнедеятельности растений ... не генетически измененные сельскохозяйственные посевные материалы.Данный способ позволит исключить внесение химических удобрений, различных ядохимикатов, так как возникающие токи позволят разлагать ряд трудноусвояемых для растений веществ, а следовательно, позволят растению легче усваивать эти вещества.При этом подбирать токи для определенных растений необходимо опытным путем, так как электропроводность даже для одной и той же почвы в зависимости от ее сиюминутного состояния может изменяться в миллионы раз (3, стр.71), а так же с учетом особенностей питания данного растения и большей важности для него тех или иных микро- и макроэлементов [7, стр.85].Влияние электростимуляции ... 2298909 Устройство для сбора семян ... под воздействием "теребления" и ударного воздействия обмолачивающих элементов 11, отделяются и транспортируются восходящим воздушным потоком по трубопроводу 6 через осадочную камеру 7 в накопитель семян 8.Семена, оставшиеся на растениях после прохода по полю устройства для сбора семян, дозревают. Уборка их проводится при последующих проходах устройства для сбора семян по полю. В результате семена собирают по мере их созревания.В зависимости от вида злаковой травы и степени ее созревания перед заездом на убираемое поле количество обмолачивающих элементов 11 в пространстве 10 приемной камеры 1 может меняться с целью изменения интенсивности обмолачивающего воздействия ... 2039429 Линия производства молочных продуктов ... для одновременной мойки посуды (тары), кассет и туннельный стерилизатор связаны друг с другом и образуют участок приемки и обработки тары, размещенный параллельно участкам приемки и переработки молока, розлива и хранения готовой продукции, которые связаны друг с другом последовательно. Участок приемки и переработки молока содержит устройство 7 для опорожнения фляг 8. Во время опорожнения фляг на горловину устанавливают специальную крышку 9 с трубопроводами 10 и 11 соответственно для подвода воздуха и отвода молока. Сжатый воздух подают при помощи компрессора 12. Молоко поступает непосредственно на заполнение аппаратов 13 для производства жидких молочных продуктов. Магистральный ... 2162635 Устройство для аэрозольного распыления (варианты) ... - 20 см; высота - 45 см), содержащий 10 тараканов, поместили в центр концентрических окружностей, а на верх цилиндра поместили покрытие с отверстием 5 см в диаметре в центре. Через отверстие в течение 6 секунд производили распыление и сразу после этого цилиндр вынули. Обследовали состояние насекомых и измерили то расстояние, на которое смогло проползти каждое насекомое от центра концентрических окружностей (см. фиг. 14). Получали значения MD50 (расстояние от центра до позиции, где 50% насекомых были обездвижены) и MD95 (расстояние от центра до позиции, где 95% насекомых были обездвижены). Далее обездвиженных насекомых переместили в отдельный контейнер и продолжали наблюдение, ... 2233582 Устройство для охлаждения молока ... соединений вакуумных трубопроводов не обеспечивают требуемой герметичности, поэтому неизбежное натекание воздуха в молочный контур на участках уже сформировавшегося потока приводит к нарушению его сплошности и, соответственно, ухудшению условий теплоотдачи в каналах теплообменника.Кроме того, предложенные в устройстве конструкции теплообменников зависят от их производительности, что затрудняет унификацию устройства в целом. Помимо этого необходимость обеспечения высокой соосности составных каналов в контурах со стороны соприкасающихся блоков и теплообменных поверхностей приводит к увеличению трудоемкости их изготовления.При этом наличие резиновых вакуумных уплотнений между ... |
Еще из этого раздела: 2189708 Машина для формирования гребней 2054235 Лесопосадочная машина 2218755 Способ длительного клонирования пайзы (echinochloa frumentacea link) 2073513 Способ профилактики технологических стрессов молодняка крупного рогатого скота 2287923 Роторный энергосберегающий мостовой агрегат для сельскохозяйственных работ 2403705 Способ автоматического управления температурно-световым режимом в теплице 2092004 Композиционный состав для обработки растений и их органов 2282965 Разбрасыватель минеральных удобрений 2141756 Способ многоуровневого культивирования растений и устройство для его осуществления 2108700 Способ оценки горных сенокосов и пастбищ |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||