Жидкие бактериальные инокулянты с повышенным сроком годности и повышенной стабильностью на семенахПатент на изобретение №: 2428467 Автор: ПИРС Джереми Дэвид (GB), КАРПЕНТЕР Мэри Энн (GB) Патентообладатель: БЕКЕР АНДЕРВУД ИНК. (US) Дата публикации: 27 Января, 2009 Начало действия патента: 14 Ноября, 2005 Адрес для переписки: 129090, Москва, ул. Б.Спасская, 25, стр.3, ООО "Юридическая фирма Городисский и Партнеры", пат.пов. Е.Е.Назиной Изображения 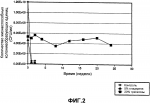 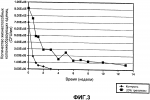  Изобретение относится к биотехнологии, в частности к способу получения инокулянта, содержащего десикант, и к способу обработки семян, полученным инокулянтом. Способ получения препарата частично обезвоженного жидкого инокулянта бактерий включает: получение жидкого инокулянта бактерий, выращенных по существу до стационарной фазы, где бактерии представляют собой бактерии одного или нескольких родов из Rhizobium, Bradyrhizobium, Pseudomonas и Serratia; и добавление в количестве, достаточном для частичного обезвоживания жидкого инокулянта бактерий, обезвоживающей добавки, включающей десикант, к жидкому инокулянту бактерий для получения препарата частично обезвоженного жидкого инокулянта бактерий, где десикант представляет собой одно или несколько соединений, выбранных из трегалозы, сахарозы, глицерина, триэтиленгликоля и маннита, в количестве от примерно 5% до примерно 50% (мас./об.) препарата частично обезвоженного жидкого инокулянта бактерий. Последующее нанесение полученного препарата частично обезвоженного инокулянта бактерий на сухой носитель позволит получить сухой сыпучий препарат инокулянта бактерий. Изобретение позволяет повысить выживание и стабильность бактерий в инокулянтах в упаковке и на семенах. 3 н. и 20 з.п. ф-лы, 8 ил., 5 табл. Область техники, к которой относится изобретение Изобретение относится к жидким инокулянтам. В частности, изобретение относится к способу повышения выживаемости и стабильности бактерий жидких инокулянтов в упаковке и при нанесении на семена. Уровень техники Известно, что различные микроорганизмы обладают полезным действием на растения. Эти микроорганизмы включают бактерии родов Rhizobium (включая Bradyrhizobium), Pseudomonas, Serratia, Bacillus (включая Paenibacillus), Pasteuria, Azotobacter, Enterobacter, Azospirillum, Methylobacterium, Cyanobacteria (сине-зеленые водоросли) и микоризные грибы. Такие микроорганизмы могут доставляться к растению посредством использования композиций инокулянтов. Способ получения композиций инокулянтов включает стадию ферментирования микроорганизмов, обычно в питательной среде. Композиции инокулянтов могут наноситься прямо на семена растений или вноситься в борозду непосредственно перед посадкой семян. Инокуляция семян или почвы полезными микроорганизмами для повышения урожая введена в практику много лет назад. Однако зачастую наблюдались изменчивые и не согласующиеся между собой результаты, возможно, вследствие потери жизнеспособности бактерий или возможного изменения дозировки, обусловленной изменениями жизнеспособности инокулянтов. При применении инокулянта во время посева, независимо вносится ли он в борозду или наносится на семена, у микроорганизмов инокулянта нет времени для адаптации к новой окружающей среде. В результате, микроорганизмы инокулянта могут иметь низкий показатель выживаемости. В настоящее время для повышения жизнеспособности микроорганизмов в инокулянте при нанесении инокулянта на семена или во время их посадки в инокулянт добавляются вспомогательные компоненты, продлевающие срок выживаемости бактерий (экстендеры), на основе сахаров или полимеров. Поскольку экстендеры добавляются после расфасовки инокулянта, они не влияют на выживаемость или стабильность инокулянта в упаковке. Кроме того, добавление экстендеров во время нанесения инокулянта на семена или во время посадки является трудоемким процессом и обычно должно выполняться конечными потребителями инокулянтов (например, фермерами) в неконтролируемой окружающей среде (например, в сарае или на сельскохозяйственном поле). Поэтому велика вероятность того, что экстендеры будут применены неправильно. Для устранения проблем, связанных с добавлением экстендеров после приготовления инокулянта, добавление экстендеров осуществлялось в питательную среду перед стадией ферментации процесса получения жидкого инокулянта. Однако добавление экстендеров в оптимальном количестве перед ферментацией для повышения выживаемости микроорганизмов на семенах ингибирует их рост. Таким образом, существует потребность в способе повышения выживаемости и стабильности микроорганизмов (например, бактерий) жидкого инокулянта в процессе хранения и повышения выживаемости и стабильности микроорганизмов жидкого инокулянта при нанесении его на семена. Сущность изобретения Одним вариантом осуществления настоящего изобретения является собой способ получения жидкого препарата инокулянта, содержащего десикант. Способ включает получение жидкого инокулянта бактерий, выращенных по существу до стационарной фазы. В полученный жидкий инокулянт добавляется компонент для осушительной (обезвоживающей) обработки, включающий в себя десикант, с получением препарата частично обезвоженного инокулянта. В другом варианте осуществления настоящего изобретения препарат частично осушенного инокулянта подвергается расфасовке и хранится. В еще одном варианте осуществления настоящего изобретения частично осушенный инокулянт наносится на семена. Краткое описание фигур Фиг. 1 представляет графическое изображение выживаемости Bradyrhizobium japonicum («B. japonicum») в жидком бульоне, которая является функцией времени и температуры, представленные графики построены по результатам нескольких вариантов осуществления настоящего изобретения. Фиг. 2 представляет графическое изображение выживаемости B. japonicum в жидком бульоне, которая является функцией времени и температуры, представленные графики построены по результатам нескольких вариантов осуществления настоящего изобретения. Фиг.3 представляет графическое изображение выживаемости В. japonicum на семенах, которая является функцией времени и температуры, представленные графики построены по результатам нескольких вариантов осуществления настоящего изобретения. Фиг.4 представляет диаграмму выживаемости В. japonicum в жидком бульоне в зависимости от типа и количества десиканта, представленная диаграмма построена по результатам нескольких вариантов осуществления настоящего изобретения. Фиг.5 представляет диаграмму выживаемости В. japonicum в жидком бульоне в зависимости от типа и количества десиканта, представленная диаграмма построена по результатам нескольких вариантов осуществления настоящего изобретения. Фиг.6 представляет диаграмму выживаемости В. japonicum на семенах в зависимости от типа и количества десиканта, представленная диаграмма построена по результатам нескольких вариантов осуществления настоящего изобретения. Фиг.7 представляет диаграмму выживаемости Pseudomonas fluorescens («P. fluorescent») в жидком бульоне в зависимости от типа и количества десиканта, представленная диаграмма построена по результатам нескольких вариантов осуществления настоящего изобретения. Фиг.8 представляет диаграмму выживаемости S. proteamaculans («S. proteamaculans») в жидком бульоне в зависимости от типа и количества десиканта, представленная диаграмма построена по результатам нескольких вариантов осуществления настоящего изобретения. Подробное описание изобретения Предоставлен способ получения жидкого инокулянта бактерий. Способ включает добавление десиканта в жидкий инокулянт после того, как бактерии выращены по существу до стационарной фазы. Добавление десиканта к инокулянту приводит к получению препарата частично обезвоженного инокулянта. Способ может обеспечивать повышенную стабильность бактерий, когда препарат частично осушенного инокулянта находится «в упаковке» (т.е. помещен в упаковку) и когда препарат частично осушенного инокулянта нанесен на семена. Повышенная стабильность может приводить к повышенной выживаемости бактерий как в упаковке, так и на семенах. Бактерии вводятся в жидкую питательную среду для получения бактериальной культуры. В жидкую питательную среду могут вводиться различные бактерии, включая, но без ограничения, Rhizobium (в том числе Bradyrhizobium), Pseudomonas, Serratia, Bacillus (в том числе Paenibacillus), Pasteuria, Azotobacter, Enterobacter, Azospirillum, Methylobacterium, Cyanobacteria (сине-зеленые водоросли). Для получения бактериальной культуры в жидкую питательную среды могут вводиться и другие микроорганизмы (например, микоризные грибы). Предпочтительные штаммы Rhizobium и Bradyrhizobium включают Bradyrhizobium japonicum, Rhizobium meliloti, Rhizobium leguminosarum biovar trifolii, Rhizobium leguminosarum biovar viceae и Rhizobium leguminosarum biovar phaseoli. Эти бактерии способны образовывать клубеньки на корнях бобовых растений. Хотя приведенное далее описание относится, главным образом, к композициям инокулянта Rhizobium, будет понятно, что аналогичные принципы применяются и при использовании других микроорганизмов. Жидкая питательная среда, в которую вводятся бактерии, может представлять собой любую известную в данной области техники жидкую питательную среду, совместимую с выбранными бактериями. Например, YMB представляет собой среду, обычно используемую для Rhizobium. Состав YMB представлен в таблице 1. Таблица 1Характеристические свойства YMB Дрожжевой экстракт 0,50 г/л Маннит 10,0 г/л К2НРО4 0,50 г/л MgSO4 7H2O 0,2 г/лNaCl 0,1 г/л Вода 1 лрН 6,8 7H2O 0,2 г/лNaCl 0,1 г/л Вода 1 лрН 6,8 После добавления бактерий в жидкую питательную среду бактериальная культура инкубируется (или ферментируется) для предоставления бактериям возможности роста до «по существу стационарной фазы». Значение термина «по существу стационарная фаза» включает период роста культуры от поздней «логарифмической фазы» до «стационарной фазы». Термин «логарифмическая фаза» означает фазу, которая имеет место после лаг-фазы в начале ферментации и представляет собой фазу, на которой обычно питательные вещества являются неограниченными и наблюдается экспоненциальный рост бактерий. Термин «стационарная фаза» означает фазу, которая имеет место после логарифмической фазы и представляет собой фазу, на которой рост бактерии по существу прекращается. Стационарная фаза обычно достигается, когда жидкая питательная среда по существу полностью расходуется. В данном описании среда, содержащая бактерии, которые инкубируются по существу до стационарной фазы, называется «жидким инокулянтом». Обычно период инкубирования бактерий может составлять от 115 дней. Точнее, инкубационный период может составлять от 2 до 7 дней. В течение инкубационного периода жидкая питательная среда и бактерии могут аэрироваться и выдерживаться при температуре, подходящей для их роста. Аэрация может осуществляться с использованием инкубатора со встряхиванием, ферментационного реактора и других аналогичных устройств. Конкретные условия инкубации зависят от типа бактерий и типа используемой жидкой питательной среды. Например, B. japonicum может инкубироваться в питательной среде в инкубаторе со встряхиванием в течение примерно от 1 до 10 дней при температурах в интервале от примерно 20°С до примерно 35°С. Предпочтительно, B. japonicum инкубируется в течение примерно от 2 до 7 дней при температуре примерно 28°С для обеспечения возможности роста бактерий. Количество бактерий в продолжении по существу стационарной фазы изменяется в зависимости от вида бактерий. Например, для Rhizobium бактерий общее количество бактерий в жидком инокулянте составляет от примерно 1 × 109/мл до примерно 1 × 10 11/мл. Точнее, данный жидкий инокулянт включает примерно 1 × 1010/мл бактерий. Указанные количества являются примерными количествами, и подразумевается, что и эти другие количества также входят в область настоящего изобретения. После достижения по существу стационарной фазы (т.е. после того, как бактериям была предоставлена возможность роста с экспоненциальным коэффициентом скорости роста) в жидкий инокулянт вводится компонент обезвоживающей обработки, включающий десикант, для получения препарата частично обезвоженного инокулянта. Термин «компонент обезвоживающей обработки» означает смесь десиканта и разбавителя, обычно воды. Термин «десикант» означает вещество, которое при добавлении к воде снижает активность воды (определяемую как парциальное давление водных паров на поверхности вещества, деленное на давление насыщенного пара). Считается, что снижение водной активности до уровня менее 0,995 эффективно для повышения выживаемости бактерий препарата частично обезвоженного инокулянта, находящегося в упаковке. Считается, что снижение водной активности до уровня менее 0,990, предпочтительно менее примерно 0,980, эффективно для повышения выживаемости бактерий в препарата частично обезвоженного инокулянта, нанесенного на семена. Термин «десиканты», используемый в настоящем описании, может включать любое соединение или смесь соединений, которые могут классифицироваться как десиканты независимо от того, используется(ются) ли соединение или соединения в концентрациях, фактически обеспечивающих осушительное (обезвоживающее) действие на жидкий инокулянт, или нет. Примеры подходящих десикантов включают одно или несколько соединений, выбранных из трегалозы, сахарозы, глицерина и триэтиленгликоля. Другие подходящие десиканты включают, но без ограничения, невосстанавливающие сахара и спирты, относящиеся к группе сахаров (например, маннит). Количество десиканта, вводимое в жидкий инокулянт, обычно составляет от примерно 5% до примерно 50% (мас./об.) препарата частично обезвоженного инокулянта. Когда десикантом является трегалоза, концентрация десиканта в препарате частично обезвоженного инокулянта предпочтительно составляет от примерно 10% до примерно 40% (мас./об.). Более предпочтительно, концентрация трегалозы в препарате частично обезвоженного инокулянта находится в интервале от примерно 20% до примерно 30% (мас./об.). Компонент обезвоживающей обработки может включать смесь нескольких десикантов. На практике смеси могут представлять собой любое сочетание двух или большего количества десикантов, которые определены в описании. Например, компонент обезвоживающей обработки может включать смесь трегалозы и глицерина, смесь трегалозы и сахарозы или смеси сахарозы и триэтиленгликоля. Смесь трегалозы и глицерина может включать трегалозу в концентрациях от примерно 5% до примерно 40 (мас./об.) препарата частично обезвоженного инокулянта и глицерин в концентрациях от примерно 1% до примерно 10% (мас./об.) препарата частично обезвоженного инокулянта. Точнее, концентрации трегалозы и глицерина в смеси могут составлять примерно 20% и примерно 5% (мас./об.) препарата частично обезвоженного инокулянта соответственно. Десикант может добавляться в жидкий инокулянт в то время, когда жидкий инокулянт еще находится в емкости в процессе инкубации (например, в ферментационном реакторе или инкубаторе со встряхиванием). Альтернативно, десикант может добавляться в жидкий инокулянт в процессе расфасовки. В одном варианте осуществления настоящего изобретения достаточное количество десиканта присутствует в, по меньшей мере, препарате частично обезвоженного инокулянта, посредством чего (1) повышается стабильность и выживаемость бактерий на последующих стадиях, таких как расфасовка и хранение, и (2) повышается стабильность и выживаемость бактерий на последующих стадиях, таких как нанесение на семена препарата частично обезвоженного инокулянта. Препарат частично обезвоженного инокулянта может затем расфасовываться и отправляться на хранение. Упаковка может представлять собой любую стандартную упаковку, известную в данной области техники. Например, препарат частично обезвоженного инокулянта может расфасовываться в полиэтиленовые емкости. После расфасовки препарат частично обезвоженного инокулянта может оправляться на хранение. Условия хранения могут включать охлаждение до температур окружающей среды и ниже до приемлемой относительной влажности. Предпочтительно, условия хранения включают температуру ниже примерно 35°С и относительную влажность ниже примерно 80%. Препарат частично обезвоженного инокулянта может наноситься на различные семена. Например, препарат частично обезвоженного инокулянта может наноситься на семена бобовых растений. Бобовые растения образуют большую группу растений, включая экономически значимые овощные культуры, такие как соя, люцерна, арахис, горох, бобы и т.п. Бактерии препарата частично обезвоженного инокулянта могут заселять ризосферу и/или заражать корни растения, проникая в корешковые волоски, заселяя корни и образуя клубеньки. В результате такой симбиотической связи растения могут превращать газообразный азот в органические соединения азота посредством азотфиксации. Затем растения могут использовать эти органические соединения для роста. Количество бактерий на семени во время нанесения препарата частично обезвоженного инокулянта на семя изменяется. Число бактерий на семени через 10 недель после нанесения препарата частично обезвоженного инокулянта на семя также может изменяться, но считается, что число незначительно отклоняется от исходного количества. Другими словами, не должно быть значительного снижения количества бактерий на семени по времени. Например, если количество бактерий на семени при нанесении препарата частично обезвоженного инокулянта на семя составляет, по меньшей мере, 6 × 105, количество бактерий на семени спустя примерно 10 недель предпочтительно составляет 1 × 105. Предполагается, что для повышения стабильности и выживаемости бактерий в препарате частично обезвоженного инокулянта в упаковке и на семенах, перед нанесением частично обезвоженного инокулянта продукта на семена в препарат частично обезвоженного инокулянта может необязательно добавляться полимер. Полимер может добавляться перед стадией расфасовки или после стадией хранения. Полимер может включать поливинилпирролидон, полимеры алкилированного винилпирролидона, сополимеры винилпирролидона и винилацетата, сополимеры винилпирролидона и стирола, полимеры на основе поливинилового спирта и другие аналогичные полимеры. Концентрация полимера может составлять от примерно 1% до 25% (мас./об.) препарата частично обезвоженного инокулянта. Хотя добавление десиканта к жидкому инокулянту для получения препарата частично обезвоженного инокулянта после достижения бактериями по существу стационарной фазы повышает стабильность бактерий без необходимого добавления экстендера во время посева, применение экстендера не исключено. На практике область изобретения также включает также нанесение на семена экстендеров после нанесения на семена препарата частично обезвоженного инокулянта. Экстендер может добавляться во время посадки или во время нанесения препарата частично обезвоженного инокулянта на семена. Экстендеры могут включать любые традиционно применяемые экстендеры, например, полученные на основе сахаров, смол, карбоксиметилцеллюлозы и полимеров. Препарат частично обезвоженного инокулянта может наноситься на торф, глину и/или другие аналогичные сухие носители для получения сухого сыпучего (текучего) препарата инокулянта. Препарат частично обезвоженного инокулянта может наноситься распылением или другими известными способами. Далее изобретение будет проиллюстрировано с помощью примеров, которые, однако, не следует рассматривать как ограничивающие область настоящего изобретения. Пример 1. Оценка стабильности Bradyrhizobium japonicum в присутствии трегалозы и смеси глицерин/трегалоза. B. japonicum культурируют в виброинкубаторе во встряхиваемых колбах с питательной средой в течение 7 дней при температуре 28°С для получения 7-дневного ферментационного бульона. Во встряхиваемых колбах объемом 250 мл приготавливают четыре компонента обезвоживающей обработки (см. таблицу 2). Приготавливают по два образца каждого компонента обезвоживающей обработки, таким образом, подготавливают всего 8 встряхиваемых колб объемом 250 мл с компонентами обезвоживающей обработки. В каждую такую встряхиваемую колбу добавляют по 50 мл семидневного ферментационного бульона. Содержимому всех колб дают возможность достичь состояния равновесия в течение дополнительных 7 дней при 28°С. После достижения состояния равновесия одну колбу из каждой пары с одинаковыми компонентами обезвоживающей обработки статически инкубируют при 28°С. Вторую колбу из каждой пары с одинаковыми компонентами обезвоживающей обработки статически инкубируют при 35°С. Таблица 2Обезвоживающая обработка. Влияние трегалозы и глицерина на стабильность B. japonicum. Обработка Вода (г)Глицерин (г)Трегалоза (г) Символы на фигурах Контроль: 0% трегалозы, 0% глицерина 500 0 20% трегалозы30 0 20 20% трегалозы30 0 20 5% глицерина45 5 0 5% глицерина45 5 0 5% глицерина + 20% трегалозы 255 20 5% глицерина + 20% трегалозы 255 20 Из колб периодически отбирают пробные образцы и чашечным методом определяют общее количество жизнеспособных бактерий. Для чашечного определения количества жизнеспособных бактерий образцы сначала тщательно перемешивают и затем, используя калиброванную пипетку со стерильным наконечником, отбирают 1 мл образца и переносят его в опытную пробирку с 9 мл воды для обратного осмоса (RO), получая таким образом 10-1 разведение. Затем, используя 1000 мкл Rainin (калиброванный и установленный на 1000 мкл) и стерильные наконечники, из опытной пробирки 10-1 разведения отбирают 1000 мкл образца 10-1 разведения и переносят его в другую опытную пробирку, содержащую 9 мл RO воды, получая, таким образом, 10-2 разведение. Затем эти действия повторяют до 10-7 разведения, встряхивая опытные пробирки, содержащие разведения, и фламбируя их между каждым переносом. Используя 100 мкл Rainin (калиброванный и установленный на 30 мкл) и стерильные наконечники, из опытной пробирки с 10-1 разведением отбирают образец объемом 30 мкл и три капли по 10 мкл капли переносят на чашку с питательным агаром, которая служит в качестве чашки выявления загрязнения. Питательный агар представляет собой агар Oxoid. Указанные действия повторяют для других разведений с тем отличием, что для 10-5, 10-6 и 10 -7 разведений образцы помещают на стандартные чашки с питательной средой Congo Red Yeast Mannitol Agar («CRYMA» - см. таблицу 3). Таблица 3Состав питательной среды CRYMA-чашек Ингредиент Количество MgSО4 0,204 гNaCl 0,1 г K2HPO4 0,5 гДрожжевой экстракт (Difco) 0,4 гМанит 10,0 г Конго красный (0,25% раствор) 10 мл Агар (BBL)15 гЧашкам дают возможность высохнуть перед инвертированием и инкубируют их при 28о С в течение 5 дней. По истечении 5 дней число колоний подсчитывают под микроскопом малого увеличения. Общее количество вычисляют по формуле «среднее значение × разбавление × 100». Результаты определения выживаемости B. japonicum в жидком бульоне при 28°С, полученные при добавлении четырех различных компонентов обезвоживающей обработки, представлены на Фиг. 1. Результаты определения выживаемости бактерий B. japonicum в жидком бульоне при 35°С, полученные при добавлении четырех различных компонентов обезвоживающей обработки, представлены на Фиг. 2. Образец с добавлением 5% глицерина был испорчен в процессе испытания, и поэтому результат его испытания не представлен на Фиг. 2. Результаты, представленные на Фиг. 1, показывают, что при 28°С добавление 20% трегалозы и смеси 20% трегалозы/5% глицерина обеспечивает хорошую выживаемость бактерий в жидком бульоне. Количество бактерий в контрольном образце начинает снижаться в течение периода времени в интервале примерно от 12 недель до 16 недель от начала эксперимента. В отличие от контрольного образца, в образце с 20% трегалозы и в образце со смесью 20% трегалозы/5% глицерина количество бактерий сохраняется на относительно постоянном уровне в указанный период времени и даже по истечении указанного периода времени. Результаты, представленные на Фиг. 2, показывают, что при 35°С добавление 20% трегалозы обеспечивает хорошую выживаемость бактерий в жидком бульоне. Хотя количество бактерий в других образцах, включая контрольные образцы, значительно снижается в начале эксперимента, количество бактерий при добавлении 20% трегалозы остается относительно постоянным в течение всего эксперимента. По истечении 10 недель из контрольного образца и образца, содержащего 20% трегалозы, отбирают пробы и наносят на семена сои. Семена выдерживают при 22°С. Периодически отбирают пробы и определяют количество выживших B. japonicum. Количество выживших бактерий на семенах определяют следующим способом. Навеску семян сои массой 500 г помещают в чистый маркированный пластиковый пакет, который может герметично закрываться. Используя шприц объемом 2 мл или стерильные пипетки объемом 2 мл, отбирают 1,38 мл каждого образца и равномерно распределяют на поверхностях семян. Затем в пластиковый пакет, содержащий инокулированные семена, захватывают воздух окружающей среды. Сразу после этого пластиковый пакет герметично закрывают и встряхивают до тех пор, пока образец не покроет равномерно семена (приблизительно 30 секунд). Пластиковый пакет открывают и семена выдерживают в лабораторных условиях (21°С), защищая их от действия прямых солнечных лучей, до полного высыхания (приблизительно 10 минут). Используя сухой, протертый спиртом по всей длине шпатель в виде ложки, из пластикового мешочка произвольно отбирают 100 неповрежденных семян. Семена помещают в предварительно подготовленную бутыль со 100 мл разбавителя. Бутыль закрывают и сразу энергично встряхивают в течение приблизительно 1 минуты. Используя асептический способ, полученные в бутыли 100 мл суспензии последовательно разбавляют следующим образом: (1) сразу после встряхивания 100 мл суспензии из бутыли отбирают 1 мл суспензии бактерий в разбавителе и асептически переносят в первую пробирку с 9 мл RO воды, используемой в качестве разбавителя, получая, таким образом, 10-1 разведение; (2) суспензию 10-1 разведения встряхивают в течение 15 секунд; (3) сразу после встряхивания 1 мл суспензии 10 -1 разведения переносят в другую пробирку с 9 мл RO воды, используемой в качестве разбавителя, с получением 10-2 разведения; (4) после этого суспензию 10-2 разведения встряхивают; (5) стадии (3) и (4) повторяют, с получением 10 -3 и 10-4 разведения. После этого чашки с агаровой средой, на которых производится подсчет колоний, снабжают ярлыком с указанием разведения суспензии используемой пробирки, описанием композиции обработки и датой посева. Для каждого разведения подготавливают по две чашки. Перед отбором образцов из пробирок с разбавленными суспензиями и посевом их на чашки с агаровой средой суспензии встряхивают. Затем, используя стандартные методы асептического пипетирования, из каждой пробирки разведения отбирают образцы объемом 100 мкл и распределяют их, вносят в центр каждой чашки с агаровой средой. Используя стерильный распределитель, образцы равномерно распределяют на поверхностях чашек. После этого чашки инкубируют в течение 7 дней при 28°С. После инкубирования подсчитывают и записывают число колониеобразующих единиц (CFU) в каждой чашке. Затем для каждой чашки для определения количества CFU из расчета на каждую чашку (CFU/чашка) проводят следующие вычисления: [Среднее число колоний × [указанное в ярлыке разведение × 10(а) × 100(b) }/100(c)], где (а) представляет собой поправочное значение для 0,1 мл/чашка, (b) представляет собой поправочный коэффициент для 100 мл в исходной суспензии, помещенной в бутыли, и (с) представляет собой поправочный коэффициент для количества семян в исходном образце. Результаты определения выживаемости B. japonicum по истечении 10 недель представлены на Фиг. 3. Результаты показывают, что временной отрезок, в течение которого количество бактерий сохраняется на уровне свыше 1 × 105/семя, составляет для контрольного образца менее 1 недели, а для образца, содержащего 20% трегалозы, более 10 недель. Эти результаты показывают, что добавление трегалозы в концентрации 20% обеспечивает хорошее выживание бактерий при нанесении их на семена. Пример 2. Оптимизация количества смеси трегалоза/ахароза, необходимой для стабилизации B. japonicum Образцы препаратов приготавливают во встряхиваемых колбах в соответствии с методикой, описанной в примере 1. Компоненты, используемые для обезвоживающей обработки, для данного примера, представлены в таблице 4. Таблица 4Обезвоживающая обработка. Влияние трегалозы и сахарозы на стабильность B. japonicum ОбработкаВода (г) Трегалоза (г) Сахароза (г) Контрольный образец 500 05 % трегалозы45 5 010% трегалозы40 10 020% трегалозы30 20 030% трегалозы20 30 040% трегалозы10 40 05% сахарозы 45 05 10% сахарозы 400 1020% сахарозы30 0 2030% сахарозы20 0 30 Результаты определения выживаемости B. japonicum в жидком бульоне при 28°С с применением указанных добавок, представлены на Фиг. 4. Результаты определения выживаемости B. japonicum в жидком бульоне при 25°С с применением указанных добавок, представлены на Фиг. 5. Результаты, представленные на Фиг. 4, показывают, что при инкубировании при 28°С добавление галактозы в концентрациях в интервале от 10% до 30% (мас./об.) является оптимальными для выживаемости бактерий в жидком бульоне. Результаты, представленные на Фиг. 4, также показывают, что добавление сахарозы в концентрациях в интервале от 5% до 10% (мас./об.) благоприятно для выживаемости бактерий в жидком бульоне, но не в такой же степени, как добавление трегалозы. Кроме того, результаты, представленные на Фиг. 4, показывают, что бактерии могут выживать при обработке с добавлением трегалозы в концентрации 40%, демонстрируя, что бактерии обладают потенциалом выживать в препарате, который является ингибиторным для микроорганизмов. Результаты, представленные на Фиг.5, показывают, что при 35°С добавление трегалозы в концентрациях в интервале от 10% до 30% (мас./об.) является оптимальными для выживаемости бактерий в жидком бульоне. Результаты, представленные на Фиг.5, также показывают, что добавление сахарозы в концентрации 5% (мас./об.) благоприятно для выживаемости бактерий в жидком бульоне, но не в такой же степени, как добавление трегалозы. По истечении 10 недель образцы препаратов с компонентами, представленными в таблице 4, наносят на семена сои. Семена инкубируют при 22°С. Образцы инокулянта на семенах отбирают непосредственно после нанесения препарата, затем через 6 дней, через 2 недели и через 4 недели. В образцах определяют количество бактерий В. japonicum. Способ определения выживаемости бактерий на семенах описан выше в примере 1. Результаты определения выживаемости бактерий на семенах представлены на Фиг.6. Результаты, представленные на Фиг.6, показывают, что при 22°С добавление трегалозы в концентрациях в интервале от 20% до 30% (мас./об.) являются оптимальными для выживаемости бактерий при нанесении бактерий на семена. Пример 3. Определение стабильности Serratia Proteamaculans и Pseudomonas Fluorescens в препарате жидкого бульона Serratia Proteamaculans ("S. Proteamaculans") выращивают в стандартной микробиологической среде (триптический соевый бульон (Tryptic soya broth - "TBS") половинной концентрации) в течение 24 часов при 22°С для приготовления бактериального бульона. Приготавливают компоненты обезвоживающей обработки, представленные в таблице 5. В каждую колбу, содержащую указанный компонент, добавляют 50 мл бактериального бульона. Содержимому всех колб дают возможность достичь состояния равновесия в течение дополнительных 3 дней в виброинкубатора при 22°С. Затем колбы удаляют из виброинкубатора для статического инкубирования при 28°С. Из колб периодически отбирают образцы и количество бактерий оценивают, получая последовательные разведения и высевая их на агаровую среду со стриптическим соевым бульоном половинной концентрации - "TSA". Эти же действия выполняют для Pseudomonas fluorescens ("Р. fluorescens"). Таблица 5 Обезвоживающая обработка. Влияние добавления трегалозы, сахарозы и глицерина на стабильность S.Proteamaculaus и Р.fluorescens. Обработка Вода (г) Трегалоза (г)Сахароза (г)Глицерин (г) Контрольный образец50 00 010% глицерина 40 00 1020% глицерина30 0 020 30% глицерина 200 030 10% трегалозы 4010 0.0 20% трегалозы 3020 00 30% трегалозы 2030 00 10% сахарозы 400 100 20% сахарозы 300 200 30% сахарозы 200 300Результаты определения выживаемости P. fluorescens в жидкости при 28°С представлены на Фиг.7. Результаты показывают, что при 28°С добавление глицерина, трегалозы и сахарозы может улучшать выживаемость P. fluorescens. Результаты определения выживаемости S. proteamaculans в жидкости при 28°С представлены на Фиг.8. Результаты показывают, что при добавлении в инокулянт 30% трегалозы, 10% сахарозы и 30% сахарозы количество выживших бактерий превосходит количество выживших бактерий в контрольном образце в течение периода времени, составляющем до 4 недель. Эти данные показывают, что введение указанных добавок может повысить выживаемость S. proteamaculans. Квалифицированный специалист данной области техники будет представлять, что настоящее изобретение может осуществляться в различных альтернативных формах и конфигурациях. Приведенное выше подробное описание раскрытых вариантов осуществления изобретения представлено только с целью более четкого его разъяснения, и не подразумевает никаких ограничений. Формула изобретения1. Способ получения препарата частично обезвоженного жидкого инокулянта бактерий, где указанный способ включает:получение жидкого инокулянта бактерий, выращенных по существу до стационарной фазы, где бактерии представляют собой бактерии одного или нескольких родов из Rhizobium, Bradyrhizobium, Pseudomonas и Serratia; и добавление в количестве, достаточном для частичного обезвоживания жидкого инокулянта, бактерий, обезвоживающей добавки, включающей десикант, к жидкому инокулянту бактерий для получения препарата частично обезвоженного жидкого инокулянта бактерий, где десикант представляет собой одно или несколько соединений, выбранных из трегалозы, сахарозы, глицерина, триэтиленгликоля и маннита, в количестве от примерно 5 до примерно 50% (мас./об.) препарата частично обезвоженного жидкого инокулянта бактерий. 2. Способ по п.1, где бактерии представляют собой бактерии, выбранные из группы Bradyrhizobium japonicum, Serratia proteamaculans и Pseudomonas fluorescens. 3. Способ по п.1 или 2, где водная активность препарата частично обезвоженного жидкого инокулянта составляет менее чем примерно 0,990. 4. Способ по п.1, где водная активность препарата частично обезвоженного жидкого инокулянта составляет менее чем примерно 0,980. 5. Способ по п.1, где жидкий инокулянт получен введением бактерий в жидкую питательную среду с получением бактериальной культуры; и инкубированием бактериальной культуры для обеспечения возможности роста бактерий до по существу стационарной фазы с получением таким образом жидкого инокулянта. 6. Способ по п.5, где инкубирование бактериальной культуры проводится в течение от примерно 2 дней до примерно 7 дней. 7. Способ по п.1, где десикант включает смесь двух или более соединений, выбранных из трегалозы, сахарозы, глицерина, триэтиленгликоля и маннита. 8. Способ по п.1, где десикант включает трегалозу. 9. Способ по п.8, где количество трегалозы составляет от примерно 10 до примерно 40% (мас./об.) препарата частично обезвоженного жидкого инокулянта. 10. Способ по п.9, где количество трегалозы составляет от примерно 20 до примерно 30% (мас./об.) препарата частично обезвоженного жидкого инокулянта. 11. Способ по п.7, где десикант включает смесь трегалозы и глицерина. 12. Способ по п. 11, где количество трегалозы составляет от примерно 5 до примерно 40% (мас./об.) препарата частично обезвоженного жидкого инокулянта, и количество глицерина составляет от примерно 1 до примерно 10% (мас./об.) препарата частично обезвоженного жидкого инокулянта. 13. Способ по п.12, где количество трегалозы составляет примерно 20% (мас./об.) препарата частично обезвоженного жидкого инокулянта, и количество глицерина составляет примерно 5% (маc./об.) препарата частично обезвоженного жидкого инокулянта. 14. Способ по п.1, где способ дополнительно включает расфасовку препарата частично обезвоженного жидкого инокулянта. 15. Способ обработки семян, где способ включает: получение жидкого инокулянта бактерий, выращенных по существу до стационарной фазы, где бактерии представляют собой бактерии одного или нескольких родов из Rhizobium, Bradyrhizobium, Pseudomonas и Serratia;добавление обезвоживающей добавки, включающей десикант, к жидкому инокулянту бактерий для получения препарата частично обезвоженного инокулянта бактерий, где десикант представляет собой одно или несколько соединений, выбранных из трегалозы, сахарозы, глицерина, триэтиленгликоля и маннита, в количестве от примерно 5 до примерно 50% (мас./об.) препарата частично обезвоженного жидкого инокулянта бактерий; инанесение на семена препарата частично обезвоженного жидкого инокулянта. 16. Способ по п.15, где бактерии представляют собой бактерии рода Rhizobium. 17. Способ по п.15, где десикант включает трегалозу. 18. Способ по п.17, где количество трегалозы составляет от примерно 10 до примерно 40% (мас./об.) препарата частично обезвоженного жидкого инокулянта. 19. Способ по п.18, где количество трегалозы составляет от примерно 20 до примерно 30% (мас./об.) препарата частично обезвоженного жидкого инокулянта. 20. Способ по п.15 или 16, где семена включают семена бобового растения. 21. Способ по п.15 или 16, где число бактерий по истечении примерно 10 недель составляет более чем примерно 1×10 5 на семя. 22. Способ получения сухого сыпучего препарата инокулянта бактерий, где способ включает:получение жидкого инокулянта бактерий, выращенных по существу до стационарной фазы, где бактерии представляют собой бактерии одного или нескольких родов из Rhizobium, Bradyrhizobium, Pseudomonas и Serratia, добавление обезвоживающей добавки, включающей десикант, к жидкому инокулянту бактерий для получения препарата частично обезвоженного инокулянта бактерий, где десикант представляет собой одно или несколько соединений, выбранных из трегалозы, сахарозы, глицерина, триэтиленгликоля и маннита, в количестве от примерно 5 до примерно 50% (мас./об.) препарата частично обезвоженного жидкого инокулянта бактерий; инанесение препарата частично обезвоженного инокулянта бактерий на сухой носитель для получения сухого сыпучего препарата инокулянта бактерий. 23. Способ по п.22, где сухой носитель представляет собой торф. PD4A Изменение наименования, фамилии, имени, отчества патентообладателя (73) Патентообладатель(и): БЕКЕР-АНДЕРВУД, ИНК. (US) Дата внесения записи в Государственный реестр: 14.11.2012 Дата публикации: 10.12.2012 Популярные патенты: 2282959 Устройство для крепления навесного оборудования к транспортному средству ... а передние части выполнены Z-образной формы в плане и установлены симметрично относительно продольной оси транспортного средства крюками, направленными друг к другу или друг от друга. В проушинах дополнительной рамы и на нижних тягах трехточечного механизма навески может быть закреплено с возможностью качания дополнительное навесное оборудование в виде бульдозерного оборудования, содержащего отвал с жестко закрепленными к нему поперечной балкой и продольными штангами, закрепленными концами в проушинах дополнительной рамы. При этом к поперечной балке жестко закреплены продольные щеки, в которых установлена с возможностью продольного перемещения по направляющим поперечная ось, ... 2048055 Устройство для отрезания и погрузки сенажа и силоса ... вилами, несущего бруса, на котором закреплен механизм поворота с гидроцилиндром и телескопическими рычагами, механизма привода ножа и -образной направляющей рамки. Рычаги опираются на рамку с помощью роликов. Нож выполнен составным из двух частей: ведущей и ведомой, которые соединены между собой с возможностью поворота друг относительно друга при помощи шарниров, выполненных в виде цилиндрических шипов, расположенных на концах ведомой части ножа и помещенных в углубления в ведущей части ножа, а также прямоугольных выступов, входящих в ограничители поворота частей ножа. Торцовые поверхности ведущей и ведомой частей ножа, соприкасающиеся между собой, выполнены концентрично ... 2177226 Способ защиты растений от болезней, регулирования их роста и защитно-стимулирующий комплекс для его осуществления ... а вегетирующие растения обрабатывают при их высоте от 0,001 метра до цветения и позднее. В качестве прилипателей при протравливании семенного материала могут использоваться полимерные композиции, клей КМЦ и другие вещества с массовыми процентами не более 0,08. Поставленная цель в защитно-стимулирующем комплексе "Полиазофос-К" для защиты растений от болезней и регулировании их роста по славянской технологии, включающем аммофос, сернокислую медь, мочевину, аммиак или (и) углекислый натрий и воду, достигается тем, что сернокислая медь вводится в комплекс в качестве макроэлемента, то есть в массовых процентах, не превышающих 0,08, в таком же качестве в комплекс вводятся железо, ... 2447645 Аппарат для обмолота коробочек семян ... валки 4 установлены на пластинах 5) с возможностью свободного вращения в подшипниковом узле 7 с одинаковой угловой скоростью в одном направлении от ведущего вала 6. Ведущий вал 6 установлен к боковым дискам 20 и свободно вращается в подшипниковом узле 8 от шкива 11 ременной передачи на торце ведущего вала 6. Молотильные валки 4 в паре установлены относительно друг друга и выполнены с возможностью регулирования рабочего зазора в корпусе молотильного устройства аппарата болтами регулирования 9, в зависимости от применяемой культуры.Аппарат устанавливается к раме 18 и фиксируется болтовым соединением 19.Для дозирования подаваемых в обмолачиваемую зону семян льна, донника, мака, ... 2007901 Устройство для хранения овощей и фруктов ... шкафа 3. Воздуховод 10 выполнен в виде замкнутой полости, на стенках которой выполнены сквозные отверстия 11, обращенные во внутрь шкафа 3 на уровнях, соответствующих уровням секций, что позволяет поддерживать необходимый температурный режим во всем пространстве предлагаемого устройства. Датчик температуры закреплен внутри шкафа на задней его стенке. Указанное размещение датчика 12 связано с необходимостью отслеживать температурный режим внутри шкафа 3, а также с тем, чтобы избежать его повреждения в процессе загрузки шкафа 3 продукцией. Блок 13 питания размещен вне шкафа 3 и осуществляет питание устройства напряжением, не превышающим 42 Вт. На лицевой панели блока 13 питания ... |
Еще из этого раздела: 2262844 Способ повышения эффективности воспроизводства икры и численности осетрообразных рыб 2274986 Способ посева семян трав и кустарников для создания пастбищ на опустыненных землях и почвообрабатывающее орудие для его осуществления 2236787 Способ испытаний опрыскивателей и устройство для его осуществления 2279799 Балансир рыболовный 2049387 Инкубатор индивидуального пользования 2218756 Способ изготовления антипаразитарного ошейника 2250583 Агрегат дернинный комбинированный 2267924 Способ стимулирования роста растений 2388213 Способ измерения урожайности травяного покрова 2108700 Способ оценки горных сенокосов и пастбищ |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||