Способ получения трансгенных млекопитающих, которые продуцируют экзогенные белки в молоке, и трансгенные млекопитающие, полученные таким способомПатент на изобретение №: 2390562 Автор: МЕЛО Карлос Альберто (AR), БАРАНАО Лино (AR) Патентообладатель: СТЕРРЕНБЕЛД БАЙОТЕКНОЛОДЖИ НОРТ АМЕРИКА, ИНК. (US) Дата публикации: 10 Ноября, 2007 Начало действия патента: 29 Сентября, 2004 Адрес для переписки: 129090, Москва, ул. Б.Спасская, 25, стр.3, ООО "Юридическая фирма Городисский и Партнеры", пат.пов. Е.Е.Назиной, рег. 517 Изображения    Изобретение относится к области биотехнологии, животноводства и медицины. Предложено трансгенное животное из рода быков, которое продуцирует в своем молоке рекомбинантный гормон роста человека в среднем на месяц, по меньшей мере, 92 нг/мл. Раскрыт также способ получения такого трансгенного животного, который предусматривает клонирование генетической конструкции, кодирующей ген hGH и промотор бета-казеина, в экспрессирующем векторе. Далее проводят трансфекцию в фетальные соматические клетки крупного рогатого скота, обычно фибробласты, и ядерный перенос в энуклеированные ооциты крупного рогатого скота, с образованием, таким образом, трансгенных эмбрионов. Заявленное изобретение позволяет получать большие количества гормона роста человека. Изобретение может быть использовано в животноводстве и медицине. 6 н. и 37 з.п. ф-лы, 16 ил., 3 табл. УРОВЕНЬ ТЕХНИКИ Белковые факторы и гормоны, используемые в здравоохранении, в настоящее время получают в фармацевтической промышленности путем экстракции или - в последние десятилетия - с применением рекомбинантной технологии. Экспрессию генетических конструкций, содержащих требуемые гены, успешно осуществляли в бактериях, дрожжах или линиях клеток млекопитающих. Однако применение культур клеток млекопитающих для получения сложных белков, таких как белки, которые требуют правильного типа гликозилирования, включает в себя дорогостоящие способы. В последнее десятилетие все больше и больше использовали методику рекомбинантной ДНК для получения коммерчески важных биологических материалов. С этой целью клонированы последовательности ДНК, кодирующие множество важных с медицинской точки зрения белков человека. К ним относятся инсулин, активатор плазминогена, альфа-1-антитипсин и факторы коагуляции VIII и IX. В настоящее время даже при наличии новых методик на основе рекомбинантной ДНК указанные белки обычно очищают из крови и ткани дорогостоящим и требующим много времени способом, который может быть сопряжен с риском передачи инфекционных агентов, таких как агенты, вызывающие СПИД и гепатит. Хотя экспрессия последовательностей ДНК в бактериях для получения требуемого важного с медицинской точки зрения белка выглядит привлекательной, на практике бактерии часто оказываются неудовлетворительными в качестве хозяев, поскольку в бактериальной клетке чужеродные белки являются нестабильными и не могут подвергаться правильному процессингу. Признавая указанную проблему, предпринимали попытки экспрессировать клонированные гены в культуре ткани млекопитающих и в некоторых случаях получили пригодную методику. Однако периодическая ферментация клеток животных представляет собой дорогой и требующий определенных технических условий способ. Поэтому существует необходимость в высокопродуктивном дешевом способе получения биологических веществ, таких как правильно модифицированные эукариотические полипептиды. Отсутствие агентов, которые являются инфекционными для человека, может быть преимуществом такого способа. Возможность получения трансгенных в отношении требуемого гена животных, подобных крупному рогатому скоту, с целью получения большого количества белка человека в молоке представляет большой интерес для промышленности. Несколько групп исследователей сообщают в литературе о своих успехах в получении у трансгенных коров или коз сывороточного альбумина человека, альфа-антитрипсина и некоторых других примерах. Множество экспериментов было проведено ранее на мышах или крысах и при этом всегда предпочитали, чтобы трансгенная экспрессия была ограничена молочными железами, так как использовали промоторы бета-казеина или лактальбумина, которые отвечают только на факторы транскрипции молочной железы у самок в период лактации. Экспрессия гетерологичного белка исключительно в молоке подразумевает возможность избегать нежелательного влияния на здоровье животного-хозяина и обеспечивать простой способ очистки. В настоящее время внимание посвящено разработке нескольких систем для повышения выхода трансфекции или селекции клеток и выбору источника гомологичной эмбриональной соматической клетки для повышения жизнеспособности и состояния иммунитета клонированных животных. С другой стороны, существует огромный интерес в переносе ядер соматических клеток, главным образом чтобы сделать возможным размножение элитных домашних животных и конструирование трансгенных животных для сельскохозяйственных и биомедицинских целей. Коротко, перенос ядер (NT) заключается в удалении ядра из ооцита реципиента, с последующим переносом донорского ядра в перивителлиновое пространство в близком контакте с цитоплазмой реципиента и их слиянием. Развитие индуцируют искусственно путем химической или физической активации. Получение клонированного потомства посредством переноса ядра соматической клетки успешно достигнуто у овец (Campbell, К.H., et al., Nature 380:64-66 (1996), 1996; Wells, D.N., et al., Biol Reprod 57:385-393 (1997); Wilmut, I., et al., Nature 385:810-813 (1997)); коз (Baguisi, A., et al., Nat. Biotechnol. 17: 456-461 (1999)) и коров (Cibelli, J. В., et al., Science 280:1256-1258 (1998); Kato, Y., et al., Science 282:2095-2098 (1998); Wells, D. N., et al., Reprod Fertil Dev 10:369-378 (1998)). Существует несколько факторов, которые влияют на результаты NT, включая способы удаления ядер, слияния, активации и синхронизации клеточного цикла донора-реципиента. Высокие эффективности удаления ядер из ооцитов реципиентов достигнуты с использованием красителей, специфичных в отношении ДНК и используемых прижизненно для визуализации хроматина (Stice, S.L., и Keefer, С.L., Biol Reprod 48:715-719 (1993); Westhusin, M.E., et al., J Reprod Fertil 95:475-480 (1992)). Слияние донорской клетки с ооцитом реципиента зависит от точности совмещения клеток в импульсном поле, контакта донорской клетки c ооцитом реципиента и размера донорских клеток (Collas, P., et al., Anal. Biochem. 208:1-9 (1993)). Усовершенствована активация реконструированного в результате NT эмбриона, и показатели развития в бластоцисты эквивалентны показателям в случае оплодотворенных in vitro ооцитов (Liu, L., et al., Mol. Reprod. Dev. 49: 298-307 (1998)). Успешное развитие NT-эмбрионов осуществили при использовании зрелых ооцитов (Willadsen, S. M., Nature 320:63-65 (1986)), зигот (McGrath, J., and Solter, D., Dev. Biol. NY 4:37-55 (1985)) и эмбрионов на стадии дробления (Tsunoda, Y., et al., J. Reprod. Fertil. 96:275-281 (1992)) в качестве реципиентных цитопластов; однако это зависит от источника донорского ядра. Совместимость клеточного цикла между реципиентными цитопластами и донорскими клетками является одним из важных факторов, которые влияют на развитие NT-эмбрионов. Соответствующая синхронизация необходима для предотвращения плоидии реконструированного эмбриона. Митотический клеточный цикл имеет следующие последовательные фазы: интервал, предшествующий репликации (G1), фазу синтеза ДНК (S), интервал, предшествующий митозу (G2 ), и митоз (M). В течение одного клеточного цикла вся геномная ДНК реплицируется один раз перед митозом. Интерфазное донорское ядро, перенесенное в лишенный ядра зрелый ооцит (метафаза II), подвергается нескольким морфологическим изменениям. После слияния, но перед разрушением оболочки донорского ядра (NEBD), хромосомы конденсируются (PCC). Указанные изменения индуцируются активностью фактора, стимулирующего созревание/митоз/мейоз (MPF) и активируемой митогеном протеинкиназы (MAPK) (Collas, P., and Robl, J. M., Biol. Reprod. 45: 455-465 (1991)). Активности MPF и MAPK обнаружены во всех мейотических и митотических клетках и становятся наиболее высокими в метафазе, и в ооцитах млекопитающих указанные высокие уровни также индуцируют задержку в метафазе II. Снижение активности MPF и MAPK при оплодотворении или активации кальциевым ионофором является сигналом для завершения мейоза, выделения второго полярного тельца, деконденсации ядра сперматозоида и образования пронуклеуса. Прямое влияние NEBD и PCC на донорский хроматин зависит от клеточного цикла донорского ядра во время переноса. Диплоидные ядра G0/G1 подвергаются конденсации с образованием отдельных хроматид, а тетраплоидные ядра G2 подвергаются конденсации с образованием двойных хроматид. Однако ядра в S-фазе во время переноса имеют характерный «распыленный» вид; PCC вызывает большое повреждение ДНК. Поэтому правильная плоидность может быть получена в результате переноса ядер в G1 или G0 в ооциты в метафазе II во время активации или перед активацией. Второй способ заключается в переносе ядер в предварительно активированный ооцит в S-фазе, в данном случае можно использовать донорскую клетку в фазе G1, G 0 или S. Поскольку активности MPF и MAPK являются низкими, хроматин деконденсирует и подвергается репликации ДНК без PCC и NEBD. Третью схему синхронизации сообщали для мышей, у которых развитие живого потомства получали с использованием донорской клетки в G2 или метафазе и лишенного ядра ооцита в метафазе 2 (Cheong, H.Т., et al., Biol Reprod 48:958-963 (1993); Kwon, O.Y., and Kono, Т., Proc Natl Acad Sсi USA 93:13010-13013 (1996)). Сообщали об экструзии полярного тельца из реконструированного посредством NT эмбриона, с получением в результате одного диплоидного эмбриона и диплоидного полярного тельца (Kwon, O.Y., and Kono, T., Proc. Natl. Acad. Sci. USA 93: 13010-13013 (1996)). Однако нет сообщений об образовании полярных телец после NT в лишенные ядер ооциты MII у крупного рогатого скота, овец или свиней, что свидетельствует о различиях между видами в механизмах регулирования образования интактного веретена деления и экструзии полярных телец. Подтверждено, что стадии клеточного цикла донорской клетки и реципиента также имеют важное значение для перепрограммирования ядер донорских клеток. Увеличение периода между переносом донорских ядер и транскрипцией в зиготе может улучшать перепрограммирование ядра. По этой причине несколько авторов активировали ооцит через несколько часов после слияния (Сibelli, J. В., et al., Science 280:1256-1258 (1998); Wakayama, Т., et al., Nature 394:369-374 (1998); Wells, D. N. et al., Biol Reprod 60:996-1005 (1999)). В других сообщениях применяли последовательный перенос ядер (Stice, S.L., and Keefer, C. L., Biol. Reprod. 48: 715-719 (1993)). Неисследованный способ увеличения времени перепрограммирования донорского ядра состоит в переносе ядер перед метафазой II. После разрушения зародышевого пузырька (GVBD) все ядерные события регулируются посредством значительного увеличения в ооците цитозольных MPF и MAPS, которые предотвращают восстановление ядерной оболочки и вхождение в S-фазу вплоть до оплодотворения или активации. Поэтому созревающий ооцит может быть универсальным реципиентом для донорской клетки в метафазе или G2. Можно даже использовать клетки в G1 или G0 в качестве донорских клеток, если активация индуцирует S-фазу перед клеточным делением. Когда в качестве донорских клеток используют бластомеры в G2 или M, возможно перепрограммирование ядер (Cheong, H. Т., et al., Biol Reprod 48:958-963 (1993); Kwon, O. Y., и Kono, Т., Proc Natl Acad Sci USA 93:13010-13013 (1996); Liu, L., et al., Mol Reprod Dev 47:255-264 (1997)). Одним объяснением является то, что некоторые факторы вытесняются из хроматина в результате конденсации хромосом. Действительно, в случае ядерного переноса считалось, что NEBD и PCC являются морфологическими признаками перепрограммирования ядра. Кроме того, во время оплодотворения хроматин сперматозоида в высшей степени конденсирован, и его объем значительно меньше, чем объем ядер соматических клеток, и ооцит обладает способностью удалять ядерные белки сперматозоида. Хромосомы ооцита во время слияния спематозоид-ооцит также конденсированы. Возможно, конформация конденсированного хроматина может иметь некоторое биологическое значение. Следовательно, при имитации указанной ситуации посредством переноса метафазных ядер лишенный ядра метафазный реципиент может улучшать результат NT. Однако несколько исследователей использовали указанный подход для домашних животных и использовали бластомеры в качестве донорских клеток (Liu, L., et al., Mol. Reprod. Dev. 47: 255-264 (1997)). Одной из целей данного изобретения является характеристика и усовершенствование существующего способа переноса ядер соматических клеток для разработки надежного и экономичного способа получения генетически идентичных телят из донорских клеток взрослого организма. СУЩНОСТЬ ИЗОБРЕТЕНИЯ Изобретение относится к трансгенному млекопитающему, отличному от человека, отличающемуся продукцией неожиданно высоких уровней рекомбинантного гормона роста в молоке. Рекомбинантным гормоном роста может быть гормон роста человека, но без ограничения указанным. Трансгенным млекопитающим, отличным от человека, может быть, без ограничения, животное, относящееся к виду крупного рогатого скота. Изобретение, кроме того, относится к плазмиде, которая обеспечивает экспрессию представляющего интерес белка в клетках млекопитающих, в которой экспрессия регулируется промотором бета-казеина. Представляющим интерес белком может быть, без ограничения, гормон роста человека. Изобретение также относится к различным способам получения трансгенного млекопитающего, отличного от человека, которое продуцирует рекомбинантный гормон роста в молоке. Рекомбинантным гормоном роста может быть гормон роста человека, но без ограничения указанным. Трансгенным млекопитающим, отличным от человека, может быть, без ограничения, животное, относящееся к виду крупного рогатого скота. Изобретение также относится к способу получения представляющего интерес белка, включающему в себя получение трансгенного млекопитающего, отличного от человека, которое продуцирует указанный белок в молоке, получение указанного молока от трансгенного млекопитающего, отличного от человека, и очистку указанного представляющего интерес белка из молока. Представляющим интерес белком может быть гормон роста человека, но без ограничения указанным. Трансгенным млекопитающим, отличным от человека, может быть, без ограничения, животное, относящееся к виду крупного рогатого скота. Изобретение также относится к способу получения и очистки рекомбинантного гормона роста из молока трансгенного животного. Рекомбинантным гормоном роста может быть гормон роста человека, но без ограничения указанным. Трансгенным млекопитающим может быть, без ограничения, животное, относящееся к виду крупного рогатого скота. КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ На фиг. 1A-1B показан суточный объем молока, собранного от трансгенной коровы, полученной слиянием лишенного ядра ооцита и фибробласта, предварительно трансфицированного плазмидой, содержащей ген, который кодирует гормон роста человека (hGH), и промотор, который управляет его экспрессией в клетках молочной железы. На фиг. 2A-2C показан подсчет бактерий, обнаруженных в молоке, собранном от той же самой трансгенной коровы. На фиг. 3A-3B показана биологическая активность hGH, находящегося в молоке той же самой трансгенной коровы. На фиг. 4A показана суточная масса hGH, продуцируемого в молоке той же самой трансгенной коровы. Указанная величина и суточный объем молока, собранного от трансгенной коровы, вместе изображены графически на фиг. 4B. На фиг. 5A показана концентрация hGH и инсулиноподобного фактора роста-1 (IGF-1) в сыворотке той же самой трансгенной коровы и суточная масса hGH, продуцируемого в молоке той же самой трансгенной коровы. Концентрация hGH в сыворотке трансгенной коровы и суточная масса hGH, продуцируемого в молоке трансгенной коровы, вместе изображены графически на фиг. 5B. На фиг. 5C вместе графически изображены временные профили концентраций hGH и IGF-1 в сыворотке трансгенной коровы. На фиг. 6A и 6B показана сывороточная концентрация hGH и инсулиноподобного фактора роста-1 (IGF-1) у двух трансгенных телят, полученных путем субклонирования коровы, которая является трансгенной по продукции hGH в молоке. На фиг. 6C и 6D вместе графически изображены временные профили сывороточных концентраций hGH и IGF-1 для каждого из указанных трансгенных телят. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ Изобретение относится к трансгенному млекопитающему, отличному от человека, отличающемуся продукцией неожиданно высоких уровней рекомбинантного гормона роста в молоке. Указанным млекопитающим может быть, без ограничения, животное, относящееся к виду крупного рогатого скота. Другими видами трансгенных млекопитающих могут быть, без ограничения, вид свиней, вид овец, вид коз или вид грызунов. Рекомбинантным гормоном роста может быть, без ограничения, гормон роста человека. Указанная молекула, также известная как соматотропин, представляет собой белок, состоящий из 191 аминокислоты, с молекулярной массой примерно 22 кД. Он имеет важное значение для линейного роста, и его применения хорошо известны. Изобретение также относится к трансгенному млекопитающему, отличающемуся тем, что рекомбинантный гормон роста, продуцируемый в его молоке, осуществляет самостимуляцию молочных желез животного к продуцированию большего количества молока, содержащего указанный гормон. Изобретение также относится к плазмиде, содержащей ген, кодирующий представляющий интерес белок, оперативно связанный с промотором бета-казеина и геном В следующем варианте плазмида дополнительно содержит ген резистентности к неомицину для селекции клеток, резистентных к генетицину. Примером такой плазмиды является плазмида pRNeo. В следующем варианте плазмида содержит ген, кодирующий зеленый флуоресцирующий белок, такой как GFP, который находится под контролем промотора цитомегаловируса (CMV). Примером такой плазмиды является плазмида pRNeoGreen. Изобретение, кроме того, относится к плазмиде, такой как описанные выше плазмиды, которая была линеаризована посредством рестрикционного расщепления. В частности, используют фермент рестрикции ApaLI и вырезают ген Проводится процедура депонирования указанных выше плазмид по условиям Будапештского договора. Наименование и адрес депозитария DSMZ-Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH, Mascheroder Weg 1b, 38124 Braunschweig, Germany. Соответствующие номера доступа будут представлены со временем. Изобретение, кроме того, относится к плазмиде, сконструированной на основе плазмиды, содержащей ген резистентности Neo, в которую встраивали модифицированную более короткую область бета-казеина выше области, кодирующей hGH, такой как pVE Изобретение, кроме того, относится к способу трансфекции генетических конструкций с использованием комбинации катионных липидов для применения в липосомах. Также описаны способы селекции клеток, резистентных к неомицину, в соответствующих средах, которые представляют собой способы селекции трансгенных клеток с зеленой флуоресценцией. Указанные клетки осторожно собирали так, чтобы избежать повреждения клеток. Изобретение также относится к способу переноса ядер клеток, задержанных в G0, или в других периодах клеточного цикла в лишенные ядер ооциты коров. Изобретение относится к способу переноса трансгенного эмбриона в стимулированную гормонами матку коровы. Описан способ определения параметров здоровья животного согласно изобретению. Анализы осуществляют, используя как сыворотку, так и молоко животного, чтобы определить такие параметры. Изобретение, кроме того, относится к способу получения трансгенного млекопитающего, отличного от человека, включающему в себя получение гена, который кодирует гормон роста, клонирование гена в плазмиде, при этом ген оперативно связывают с промотором, который будет управлять экспрессией гена в клетках млекопитающего, получая в результате экспрессирующую плазмиду, трансфекцию соматических клеток экспрессирующей плазмидой, для того чтобы включить плазмиду в геном клеток, с получением в результате трансгенных соматических клеток, удаление ядра из зрелого ооцита, с получением энуклеированного ооцита, слияние трансгенной соматической клетки с энуклеированным ооцитом, с получением в результате одноклеточного эмбриона, имплантацию эмбриона в матку готового к оплодотворению млекопитающего и мониторинг беременности вплоть до рождения трансгенного млекопитающего. Изобретение, кроме того, относится к способу получения трансгенного млекопитающего, отличного от человека, включающему в себя извлечение соматических клеток из организма самки млекопитающего, которая является трансгенной по продукции рекомбинантного гормона роста в молоке, необязательно фибробластов, удаление ядра из зрелого ооцита, с получением в результате энуклеированного ооцита, слияние одной трансгенной соматической клетки с энуклеированным ооцитом, с получением одноклеточного эмбриона, имплантацию эмбриона в матку готового к оплодотворению млекопитающего и мониторинг беременности вплоть до рождения трансгенного млекопитающего. Изобретение, кроме того, относится к способу получения трансгенного млекопитающего, отличного от человека, включающему в себя суперовуляцию самки млекопитающего, отличного от человека, которая является трансгенной по продукции рекомбинантного гормона роста в молоке, искусственное оплодотворение млекопитающего спермой, полученной от самца нетрансгенного млекопитающего, отличного от человека, чтобы получить эмбрионы, сбор эмбрионов, имплантацию эмбрионов в матку готового к оплодотворению млекопитающего и мониторинг беременности вплоть до рождения трансгенного млекопитающего. Изобретение, кроме того, относится к способу получения трансгенного млекопитающего, отличного от человека, включающему в себя суперовуляцию самки млекопитающего, отличного от человека, которая является трансгенной по продукции рекомбинантного гормона роста в молоке, искусственное оплодотворение млекопитающего спермой, полученной от самца млекопитающего, отличного от человека, который является трансгенным по продукции указанного рекомбинантного гормона роста, чтобы получить эмбрионы, сбор эмбрионов, имплантацию эмбрионов в матку готового к оплодотворению млекопитающего и мониторинг беременности вплоть до рождения трансгенного млекопитающего. Изобретение, кроме того, относится к способу получения трансгенного млекопитающего, отличного от человека, включающему в себя суперовуляцию самки нетрансгенного млекопитающего, отличного от человека, искусственное оплодотворение млекопитающего спермой, полученной от самца млекопитающего, отличного от человека, который является трансгенным по продукции рекомбинантного гормона роста, чтобы получить эмбрионы, сбор эмбрионов, имплантацию эмбрионов в матку готового к оплодотворению млекопитающего и мониторинг беременности вплоть до рождения трансгенного млекопитающего. Рекомбинантным гормоном роста может быть, без ограничения, гормон роста человека. Трансгенным млекопитающим, отличным от человека, может быть, без ограничения, животное, относящееся к виду крупного рогатого скота. Изобретение, кроме того, относится к способу получения белка, включающему в себя получение трансгенного млекопитающего, отличного от человека, которое продуцирует неожиданно высокие уровни представляющего интерес белка в молоке, получение молока от трансгенного млекопитающего, отличного от человека, и очистку представляющего интерес белка из молока. Изобретение также относится к способу получения представляющего интерес белка у трансгенного млекопитающего, отличного от человека, полученного способом, включающим в себя получение гена, который кодирует указанный представляющий интерес белок, клонирование гена в плазмиде, при этом ген оперативно связывают с промотором, который будет управлять экспрессией гена в клетках млекопитающего, получая в результате экспрессирующую плазмиду, трансфекцию соматических клеток, необязательно фибробластов, плазмидой, для того чтобы включить плазмиду в геном указанных соматических клеток, получая трансгенные соматические клетки, удаление ядра из зрелого ооцита, с получением энуклеированного ооцита, слияние одной трансгенной соматической клетки с энуклеированным ооцитом, с получением одноклеточного эмбриона, имплантацию эмбриона в матку готового к оплодотворению млекопитающего и мониторинг беременности вплоть до рождения трансгенного млекопитающего. Изобретение, кроме того, также относится к способу получения представляющего интерес белка у трансгенного млекопитающего, отличного от человека, полученного способом, включающим в себя извлечение соматических клеток из организма самки млекопитающего, которая является трансгенной по продукции указанного представляющего интерес белка в молоке, необязательно фибробластов, удаление ядра из зрелого ооцита, с получением энуклеированного ооцита, слияние одой трансгенной соматической клетки с энуклеированным ооцитом, с получением одноклеточного эмбриона, имплантацию эмбриона в матку готового к оплодотворению млекопитающего и мониторинг беременности вплоть до рождения трансгенного млекопитающего. Изобретение также относится к способу получения представляющего интерес белка у трансгенного млекопитающего, отличного от человека, полученного способом, включающим в себя суперовуляцию самки млекопитающего, отличного от человека, которая является трансгенной по продукции указанного представляющего интерес белка в молоке, искусственное оплодотворение млекопитающего спермой, полученной от самца нетрансгенного млекопитающего, отличного от человека, чтобы получить эмбрионы, сбор эмбрионов, имплантацию эмбрионов в матку готового к оплодотворению млекопитающего и мониторинг беременности вплоть до рождения трансгенного млекопитающего. Изобретение также относится к способу получения представляющего интерес белка у трансгенного млекопитающего, отличного от человека, полученного способом, включающим в себя суперовуляцию самки млекопитающего, отличного от человека, которая является трансгенной по продукции указанного представляющего интерес белка в молоке, искусственное оплодотворение млекопитающего спермой, полученной от самца млекопитающего, отличного от человека, который является трансгенным по продукции указанного представляющего интерес белка, чтобы получить эмбрионы, сбор эмбрионов, имплантацию эмбрионов в матку готового к оплодотворению млекопитающего и мониторинг беременности вплоть до рождения трансгенного млекопитающего. Изобретение также относится к способу получения представляющего интерес белка у трансгенного млекопитающего, отличного от человека, полученного способом, включающим в себя суперовуляцию самки нетрансгенного млекопитающего, отличного от человека, искусственное оплодотворение млекопитающего спермой, полученной от самца млекопитающего, отличного от человека, который является трансгенным по продукции указанного представляющего интерес белка, чтобы получить эмбрионы, сбор эмбрионов, имплантацию эмбрионов в матку готового к оплодотворению млекопитающего и мониторинг беременности вплоть до рождения трансгенного млекопитающего. Трансгенными млекопитающими, характеризующимися продукцией неожиданно высоких уровней представляющего интерес белка в их молоке, могут быть, без ограничения, животные вида крупного рогатого скота. Другими видами трансгенных млекопитающих могут быть, без ограничения, вид свиней, вид овец, вид коз или вид грызунов. Представляющим интерес белком, без ограничения, может быть гормон роста человека. Изобретение, кроме того, относится к трансгенному млекопитающему, отличному от человека, относящемуся к виду крупного рогатого скота, который продуцирует рекомбинантный гормон роста человека в молоке, геном которого содержит интегрированную плазмиду, при этом указанная плазмида содержит ген гормона роста человека и промотор бета-казеина, который управляет экспрессией указанного гена в клетках молочной железы млекопитающего. Изобретение, кроме того, относится к трансгенному млекопитающему, которое продуцирует неожиданно высокие уровни hGH, однако не наблюдается физического роста, ожидаемого при таком высоком уровне продукции hGH. Так как трансгенный крупный рогатый скот подвергается влиянию присутствия гормона роста человека, можно предполагать, что животные могли бы расти со скоростью, превышающей скорости роста нетрансгенных животных, и страдать в результате от таких состояний как сахарный диабет, гипертония, повышенный риск сердечно-сосудистого заболевания и укрупнение органов тела, включая печень, селезенку, почки и сердце. Такие высокие уровни hGH теоретически должны делать животное нежизнеспособным. Однако дело обстоит не так. Млекопитающее, такое как корова, с опасно высокими уровнями чужеродного гормона в крови, но которая имеет прекрасное здоровье и имеет превосходную производительность рекомбинантного белка, составляет неожиданный изобретательский вклад. Рекомбинантный гормон роста человека согласно изобретению продуцируется на неожиданно высоких уровнях. Уровень продуцируемого гормона роста человека составляет примерно более 1,0 г/л молока. Уровень hGH может быть более примерно 2,0 г/л молока. Уровень продуцируемого hGH также может примерно превышать 3,0 г/л молока. В другом варианте продуцируемый уровень hGH может составлять примерно более 4,0 г/л молока. В еще одном варианте уровень продуцируемого hGH может составлять примерно более 5,0 г/л молока. В следующем варианте уровень продуцируемого hGH может составлять примерно более 6,0 г/л молока. В следующем варианте уровень продуцируемого hGH составляет примерно от 1,0 г/л молока до 7,0 г/л молока. В следующем варианте уровень продуцируемого hGH составляет примерно от 2,0 г/л молока до 6,0 г/л молока. В другом варианте уровень продуцируемого hGH составляет примерно от 2,0 до 5,0 г/л молока. Кроме того, изобретение относится к способу очистки рекомбинантного гормона роста из молока трансгенного млекопитающего, а также к анализам указанного гормона. Способы очистки могут включать в себя стадии хроматографии и концентрирования. Можно использовать различные типы хроматографии, и они включают в себя ионообменную хроматографию, обращенно-фазовую хроматографию, молекулярную эксклюзионную хроматографию или аффинную хроматографию. Ионообменная хроматография может представлять собой анионообменную хроматографию. Аффинная хроматография может представлять собой иммуноаффинную хроматографию. Кроме того, могут быть осуществлены многократные стадии хроматографии. Изобретение, кроме того, относится к способу очистки рекомбинантного гормона роста из молока трансгенного млекопитающего, отличного от человека, которое продуцирует рекомбинантный гормон роста, включающему в себя осветление молока трансгенного млекопитающего, отличного от человека, с получением осветленного молока и осуществление хроматографии осветленного молока, с получением в результате очищенного рекомбинантного гормона роста. Изобретение, кроме того, относится к способу очистки рекомбинантного гормона роста из молока трансгенного млекопитающего, отличного от человека, которое продуцирует рекомбинантный гормон роста, включающему в себя осветление молока трансгенного млекопитающего, отличного от человека, с получением осветленного молока, осуществление хроматографии осветленного молока посредством анионообменной хроматографии с использованием увеличенного слоя, с получением материала, подвергнутого анионообменной хроматографии, осуществление обращенно-фазовой хроматографии материала, подвергнутого анионообменной хроматографии, с получением материала, подвергнутого обращенно-фазовой хроматографии, осуществление анионообменной хроматографии материала, подвергнутого обращенно-фазовой хроматографии, с получением материала, подвергнутого анионообменной хроматографии, осуществление молекулярной эксклюзионной хроматографии материала, подвергнутого анионообменной хроматографии, с получением материала, подвергнутого молекулярной эксклюзионной хроматографии, концентрирование материала, подвергнутого молекулярной эксклюзионной хроматографии, с получением концентрированного материала и осуществление молекулярной эксклюзионной хроматографии концентрированного материала, с получением очищенного рекомбинантного гормона роста. Изобретение также относится к способу очистки рекомбинантного гормона роста из молока трансгенного млекопитающего, отличного от человека, которое продуцирует рекомбинантный гормон роста, включающему в себя осветление молока, полученного от трансгенного млекопитающего, с получением осветленного молока, осуществление иммуноаффинной хроматографии осветленного молока с получением материала, подвергнутого иммуноаффинной хроматографии, осуществление обращенно-фазовой хроматографии материала, подвергнутого иммуноаффинной хроматографии, с получением материала, подвергнутого обращенно-фазовой хроматографии, осуществление анионообменной хроматографии материала, подвергнутого обращенно-фазовой хроматографии, с получением материала, подвергнутого анионообменной хроматографии, осуществление молекулярной эксклюзионной хроматографии материала, подвергнутого анионообменной хроматографии, с получением материала, подвергнутого молекулярной эксклюзионной хроматографии, осуществление концентрирования материала, подвергнутого молекулярной эксклюзионной хроматографии, с получением концентрированного материала и осуществление молекулярной эксклюзионной хроматографии концентрированного материала с получением очищенного рекомбинантного гормона роста. Рекомбинантным гормоном роста в описанных выше способах очистки без ограничения может быть гормон роста человека. Трансгенным млекопитающим без ограничения может быть млекопитающее вида крупного рогатого скота. Следующие примеры являются иллюстративными, но не ограничивающими способ и композиции согласно настоящему изобретению. Другие подходящие модификации и адаптации множества условий и параметров, обычно встречающихся при ферментативном получении химических веществ и в способах очистки белка, которые очевидны для специалистов в данной области, составляют сущность изобретения и входят в объем изобретения. ПРИМЕР 1 Конструирование экспрессирующих плазмид Авторы создали конструкцию, несущую большую часть промотора гена бычьего бета-казеина, включая короткий фрагмент 5'-некодирующей области гена бета-казеина, слитую с кодирующей последовательностью гена гормона роста человека. Область бета-казеина, используемую в различных конструкциях, уменьшали от 3,8 т.п.н. до примерно 1,3 т.п.н. Ген hGH охватывает примерно от 2 до 2,2 т.п.н., в зависимости от того, включен ли внутренний сигнал полиA. Экспрессирующую кассету размещали в полилинкере обычного вектора для клонирования типа pUC или pBS. Указанный промотор обеспечивает тканеспецифическую и регулируемую в развитии экспрессию генов под его контролем, подобных бета-казеину, и в данном случае гетерологичного hGH. Наиболее типичной плазмидой является pR Другие описанные конструкции главным образом получают из исходной плазмиды, которая указана так, чтобы улучшить селекцию трансфицированных клеток или повысить эффективность интеграции ДНК в геном бычьей клетки. В начальный период осуществляли котрансфекцию плазмидой, содержащей ген резистентности к генетицину, способствуя селекции, но затем использовали другие конструкции, несущие ген NPT резистентности к неомицину в том же самом векторе, содержащем кассету экспрессии hGH. Примером такой плазмиды является плазмида pRNeo. Получали другую плазмиду для конститутивной экспрессии зеленого флуоресцирующего белка, которая содержит промотор CMV, энхансер растительного происхождения (альфа-альфа) и ген зеленого флуоресцирующего белка из медузы A. victoria. Примером такой плазмиды является плазмида pRNeoGreen. Кроме этого, создавали другую плазмиду. Плазмиду конструировали на основе плазмиды, содержащей ген резистентности Neo, в которую встраивали область модифицированного более короткого промотора бета-казеина выше области, кодирующей hGH. Данная плазмида представляет собой плазмиду pVE Создавали другие конструкции, в которых область Конструкции анализировали, используя ферменты рестрикции и секвенирование ДНК, и их способность вызывать экспрессию hGH предварительно тестировали в линии клеток молочной железы, используя узнавание флуоресцирующим антителом. Получение плазмиды pVE Получение pVE Целью данной конструкции является получение минимального удлинения области промотора бета-казеина для управления специфично регулируемой транскрипцией гена hGH, слитого непосредственно далее вместе с его полиA сигналом, в организме хозяина. Применение pVEX в качестве исходного вектора делает возможным использование гена резистентности к неомицину, регулируемого промотором tk, уже присутствующим в данной плазмиде. Ранний промотор SV40, содержащий 554 п.н., удаляли посредством рестрикции ферментами StuI и NdeI, и последний сайт заполняли, используя фермент Кленова и самолигирование полученного в результате вектора. Короткий промотор бета-казеина получали после ПЦР-амплификации фрагмента длиной 1,3 т.п.н. из области промотора исходного гена длиной 3,8 т.п.н., используя следующие олигонуклеотиды в качестве праймеров: PB1 5'TCTACTCGAGGATCATCTATCTGTCCCAAAG (SEQ ID NO:1) и PB2 5'CTAGGATCCAATGATCTGATTTTGTGG (SEQ ID NO:2). Данный фрагмент содержит 1230 п.н. канонического промотора плюс 49 п.н. первого некодирующего экзона гена бета-казеина. Фрагмент гена hGH получали способом ПЦР на исходном бычьем геномном клоне hGH, используя следующие олигонуклеотиды в качестве праймеров: PB4 5'CTAGGATCCATGGCTACAGGTAAGCGCC (SEQ ID NO: 3) и GHTE 5'ATGCTGTGTCTGGACGTCCT (SEQ ID NO: 4) Концы фрагмента промотора бета-казеина затупляли ферментом Кленова, и фрагмент встраивали в заполняемый сайт BamHI в pVEX. После селекции рекомбинантных клонов авторы выбрали определенное направление, подходящее для использования уникального сайта HindIII, расположенного ниже в pVEX, чтобы встроить область, кодирующую hGH. С этой целью концы фрагмента hGH также затупляли и также заполняли HindIII-сайт плазмиды. Отбирали клоны, которые содержат промотор бета-казеина и hGH, правильно слитые, чтобы экспрессировать hGH только под контролем данного промотора. Размер данной плазмиды составляет примерно 8,5 т.п.н. Трансфекция соматических клеток Затем плазмиды pR Трансфицированные клетки подвергали селекции, добавляя к культуре генетицин. После периода, составляющего от 2 до 8 недель, клетки, которые были резистентны к генетицину, подходили для использования в качестве донорских клеток, чтобы получить трансгенные клоны. Подвергнутые селекции трансфицированные клетки анализировали в ПЦР в отношении содержания экспрессирующей кассеты, чтобы гарантировать соответствующий перенос ядер для создания трансгенных эмбрионов. ПРИМЕР 2 Удаление ядер из ооцитов и перенос метафазных ядер в зрелые энуклеированные ооциты Сбор и созревание in vitro ооцитов коров Ооциты коров посредством аспирации извлекали из яичников, полученных со скотобойни, и они созревали в TCM-199 + 5% FCS при 39°C в течение 24 час. Среду для созревания уравновешивали CO 2 в течение по меньшей мере 2 часов перед использованием. Зрелые ооциты лишали оболочки путем встряхивания в течение 2 минут в теплом TL-HEPES с 1 мг/мл гиалуронидазы из семенников быка. Перенос ядер с использованием клеток cumulus Удаление ядер Из ооцитов механически удаляли ядра, используя гидравлические микроманипуляторы Narishige и микроскопию Nikon Diaphot. Удаление ядер осуществляли с использованием конусообразных и заостренных пипеток на 20 мкм. Ооциты предварительно красили 5 мкг/мл красителя бисбензимида (Hoechst 33342, Sigma Сhemical Co., St. Louis, MO, USA) в течение 20 минут. Содержимое ядер из метафаз удаляли при визуализации окрашенных хромосом в ультрафиолетовом свете. Метафазные хромосомы оценивали после аспирации внутри пипетки. Трансгенную соматическую клетку переносили в перивителлиновое пространство и располагали вплотную к энуклеированному ооциту. Слияние Трансгенную соматическую клетку и энуклеированный ооцит выравнивали вручную в камере для слияния, так чтобы сливаемые мембраны были параллельны электродам. Это осуществляли, используя стеклянную пипетку для манипулирования эмбрионами. Слияние электрическим способом Слияние осуществляли, используя один электрический импульс 180 вольт/см в течение 15 мксек (манипулятор клеток BTX Electro 200 BTX Inc., San Diego, Ca, USA), и контролировали, наблюдая в оптимизаторе-анализаторе графических импульсов BTX. Камера для импульсного воздействия на эмбрионы состояла из двух электродов из стальной проволоки 0,5 мм, вмонтированных на расстоянии 0,5 мм от предметного стекла микроскопа. Предполагаемые зиготы контролировали в отношении слияния, лизиса и фрагментации. Оценка способности к развитию Зиготы оценивали через 48 часов после оплодотворения в отношении дробления и через 7-9 дней - в отношении развития морулы или бластоцист. ПРИМЕР 3 Культура клеток и эмбрионов Различные донорские клетки, системы культивирования и обработки реципиентных ооцитов тестировали в эксперименте, целью которого являлось упрощение способов и повышение степени выживаемости эмбрионов в программе клонирования крупного рогатого скота. Применяли три системы культивирования реконструированных эмбрионов в случае использования фибробластов взрослого организма в качестве донорских клеток: TCM-199 + 5% FCS, Menezo + 5% FCS (в обоих случаях с использованием клеток VERO в виде совместной культуры) и SOF без совместного культивирования, но при более низкой концентрации O2. Среду SOF также использовали для культивирования реконструированных эмбрионов в том случае, когда донорская клетка представляла собой генетически и негенетически модифицированный фетальный фибробласт. Наконец, в том случае, когда в качестве донорских клеток использовали генетически модифицированные фетальные фибробласты, реципиентные ооциты предварительно обрабатывали росковитином (R), чтобы приостановить мейоз и оптимизировать удобство использования реципиента. Ооциты аспирировали из яичников, полученных со скотобойни, и они созревали в TCM-199 + 5% FCS при 39°C в течение 24 часов. В случае группы, обработанной R, перед созреванием ооциты инкубировали с 25 мкМ R в TCM-199 + 5% FCS в течение 24 часов при 39°C. Зрелые ооциты лишали оболочки путем встряхивания в течение 3 минут в TL HEPES с 1 мг/мл гиалуронидазы из семенников быка. Определяли метафазы и из ооцитов удаляли ядра при визуализации с использованием Hoechst 33342 (5 мкг/мл) в УФ-свете (<6 секунд). Фибробласты взрослого организма от быка ангусской породы и фетальные фибробласты из 45-дневного плода женского пола породы Джерси использовали в качестве донорских клеток. Трансфекцию конструкциями, содержащими ген резистентности, осуществляли с использованием липосом. После селекции генетицином в течение 10-15 дней донорские клетки в стадии G0/G1 сливали с энуклеированными ооцитами с помощью электрического импульса. Через 3 часа индуцировали активацию посредством инкубации в TL-HEPES с 5 мкМ иономицина в течение 4 мин и 2 мм 6-DMAP в течение 3 часов. Затем ооциты промывали TL-HEPES и культивировали либо в TCM-199 + 5% FCS + 10 г/л альбумина, или в Menezo + 2% FCS, совместно с клетками VERO, либо в среде SOF и атмосфере 5% CO2 + 5% O 2 + 90% N2. Обычно две бластоцисты переносили нехирургически корове-реципиенту и определяли беременность на 30-35 день методом ультрасонографии. Дробление (48 часов), развитие до бластоцист (7-9 дни) регистрировали и анализировали, используя критерий Хи-квадрат. Показатели дробления и развития до бластоцист были выше в случае культивирования эмбрионов в SOF. Однако не обнаружено различий в доле случаев беременности, связанных с разными условиями культивирования или источником донорских клеток. Остановка мейотического созревания на 24 часа не ставила под угрозу способность реципиентных ооцитов к развитию. Поэтому обработка росковитином может быть использована для повышения пригодности ооцитов для способов NT. См. таблицу 1 ниже. Проценты в колонках с разными верхними индексами отличались (P<0,05). Коровам, подвергнутым имплантации, обеспечивали возможность для нормального протекания беременности вплоть до естественных родов. При соответствующих условиях возможно использование хирургического способа (кесарево сечение) для родоразрешения. Новорожденных кормят богатым Ig молозивом в течение первых 48 часов и затем используют синтетические, позже - природные корма (все корма не содержат соединений животного происхождения). ПРИМЕР 4 Тестирование трансгенных телят и продуцируемого рекомбинантного белка В настоящем примере авторы представляют полное описание тестов, выполненных на конкретном трансгенном теленке, которого получали в результате способа, описанного в примерах 1-3, и тестирование продуцируемого им рекомбинантного белка. Тем не менее, должно быть понятно, что такой же набор анализов осуществляют в случае животных, которые родились вследствие применения других способов получения трансгенных телят, таких как способы, которые будут описаны в примерах 5 и 6 ниже. С помощью ПЦР-реакций, выполненных на ДНК, очищенной из лейкоцитов телят, с использованием ДНК от нетрансгенных телят породы Джерси в качестве негативного контроля подтверждено, что промотор бета-казеина коров и ген, кодирующий hGH, включены в геном клеток трансгенного теленка. Они могут быть выявлены вместе в виде уникального фрагмента ДНК, отличающегося от гомологичного гена бета-казеина животного. С использованием автоматического секвенатора Pharmacia подтверждено, что встроенная последовательность гена соответствует на 100% гену, кодирующему hGH. Она содержит интроны, сигнал секреции и терминатор. Промотор бета-казеина коров, который регулирует экспрессию того же самого гена hGH у теленка, также секвенировали. Все указанные элементы точно совпадали с теоретически ожидаемой последовательностью из генетической конструкции, используемой для трансформации клеток, из которых создавали клоны. Зная о точности генетической фазы эксперимента, авторы перешли к доказательству того, что продуцируемый рекомбинантный белок является предполагаемым белком и совпадает по каждой из его физических и химических характеристик с природным hGH. Для этой цели авторам было необходимо получить молоко от телочки, так как промотор бета-казеина обеспечивает экспрессию рекомбинантного белка только в молочных железах, когда животное находится в возрасте продуцирования молока. Затем трансгенную телочку индуцировали к продуцированию молока, когда она достигала десятимесячного возраста. К этому времени телочка весила 240 кг (примерно 530 фунтов). Первая фаза указанной обработки заключалась в комбинированном введении подкожным путем эстрогенов (бензоат эстрадиола, хистерен, Instituto Rosenbusch) и прогестагенов (ацетат медроксипрогестерона, пронал, Aton), включающем в себя 5 последовательных применений каждого лекарственного средства в дозе 0,1 мг/кг и 0,25 мг/кг, соответственно, каждые 48 часов (т.е. в 1, 3, 5, 7 и 9 дни, полагая, что обработка начинается в 1 день). Вторая фаза включала в себя введение подкожным путем дексаметазона (декадрон, Sidus) и окситоцина (орастин, Hoechst Marion Rousseb); при этом общее количество первого средства, составляющее 20 мг, инъецировали в течение периода, включающего 18-20 дни (треть указанной общей массы каждый день), и 3 применения 50 МЕд последнего средства в 21-23 дни. Приведенная выше информация суммирована в таблице 2: Как ожидалось, корова начинала давать молозиво через день после окончания обработки, и затем постепенно продуцируемая жидкость по качеству превращалась в молоко. Собранную жидкость соответствующим образом хранили и тщательно анализировали. Осуществляли несколько тестов, результаты которых показаны на фиг. 1-4, используя молозиво и молоко (для простоты и молозиво, и молоко в дальнейшем будут называться «молоко», за исключением случаев, когда их необходимо различать). Сначала измеряли объем собранного молока. Начальная удойность (первые пять дней лактации) составляла 1650 мл/день. В течение первого месяца продуцирования осуществляли два ручных доения в день, одно утром и одно вечером (можно было отметить вклад каждого вымени в конечный объем); тогда как со второго месяца, поскольку производство молока начинало увеличиваться, проводили три доения в день (утром, в полдень и вечером). Суточные объемы взрастали более или менее непрерывно до достижения около 10000 мл через три месяца после первого доения. Подробную информацию по этой теме (фиг.1A) можно видеть на кривой суточных объемов молока, указанных по датам (фиг.1B). Параллельно с измерениями объема молока проводили микробиологические анализы молока, результаты которых (фиг.2A) видны на соответствующих графиках КОЕ (колониеобразующие единицы) в зависимости от даты и на фиг. 2B-2C. Биологическую активность (hGH) также оценивали в анализе биологической активности in vitro в культуре клеток NB2 (фиг.3A-3B). Подтверждено, что биологическая активность рекомбинантного hGH, продуцируемого в молоке телки, в пределах ошибки способа имеет нормальные значения для природного hGH человека. Кроме того, полученное молоко исследовали с помощью Вестерн-блотинга, на котором выявили основную полосу, соответствующую интактному hGH. Также выявлены дополнительные минорные полосы, соответствующие расщепленным вариантам и агрегатам, как ожидалось в таких системах продуцирования. На основании информации, относящейся к биологической активности и суточным объемам, можно рассчитать суточную продукцию hGH, используя уравнение 1, в котором mhGH означает массу hGH, полученного за сутки, в миллиграммах; BA - биологическую активность в международных единицах; SA - удельную активность hGH (3 МЕд/мг) и V - суточный объем собранного молока. Данные показаны на фиг.4A. График суточной массы hGH показан на фиг.4B. Чтобы установить визуальную корреляцию между суточной массой hGH и суточным объемом молока, на графике на фиг.4B также откладывали последний показатель.
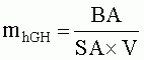 (Уравнение 1) (Уравнение 1)Как можно видеть на основании указанной информации, суточная масса hGH в молоке и суточный объем молока имеют тенденцию увеличиваться по мере развития коровы (хотя первое в большей степени), что составляет тенденцию к повышению продуктивности в отношении рекомбинантного гормона (грамм hGH на литр молока). Можно отметить, что данная продуктивность изменяется от 2 г hGH на литр (первое доение), когда продуктом является молозиво, до среднего количества 5 г hGH на литр молока, начиная со второго месяца лактации. Таким образом, получали неожиданно высокий выход гормона роста человека в виде продуктивности, увеличивающейся более или менее непрерывно по мере качественного превращения жидкости из молозива в молоко. Хотя в настоящее время масса продуцируемого hGH в сутки является действительно выдающейся, следует отметить, что так как корова еще не совсем выросла, тенденция повышения массы рекомбинантного белка, продуцируемого в сутки, должна продолжаться в будущем вплоть до достижения максимума. Параллельно тестам, осуществляемым на молоке, выполняли другой набор анализов на сыворотке коровы, результаты которых показаны на фиг.5A-5C. Сначала осуществляли измерения концентрации hGH в сыворотке коровы. Результаты (фиг.5A) изображены на графике вместе с суточной массой hGH в молоке, чтобы иметь возможность сравнить обе величины (фиг.5B). Справочные пределы GH в сыворотке (у людей) составляют 0,06-5 нг/мл. Предполагая наличие у крупного рогатого скота гипотетически сходного диапазона, можно отметить, что за исключением начала, вся кривая hGH в сыворотке трансгенной коровы, в зависимости от даты, лежит намного выше указанного предела. Несмотря на указанный факт, необходимо принять во внимание, что хотя hGH и соответствующий бычий гормон (bGH) очень сходны в отношении их аминокислотной последовательности и 3D-структуры, первый, хотя и полностью функциональный, не в полной мере активен у крупного рогатого скота. Поэтому чтобы оценить потенциальный риск для здоровья коровы указанных высоких уровней hGH в сыворотке, параллельно осуществляли измерения сывороточной концентрации IGF-1 (инсулиноподобного фактора роста 1, также известного как соматомедин C) (фиг.5A). Гормон роста осуществляет свои функции главным образом через IGF-1, который производится в печени. Поскольку IGF-1 опосредует многие эффекты гормона роста при делении клеток in vivo и его метаболические эффекты, то оценка IGF-1 является ценным диагностическим средством непрямой оценки предполагаемых расстройств, связанных с гормоном роста. Таким образом, IGF-1 представляет собой надежный индикатор биодоступного гормона роста. Результаты указанных анализов показаны на фиг.5C вместе с результатами, соответствующими hGH, чтобы получить возможность одновременной визуализации обеих величин. Кроме того, измеряли IGF-1 и hGH в сыворотке в группе нетрансгенных коров, чтобы иметь контрольную группу и, таким образом, получить сравнение с данными, соответствующими трансгенной корове. Средние значения измерений как белка в случае нетрансгенной группы, так и белка трансгенной коровы указаны в таблице 3 ниже. Таблица 3 Средние значения Средние значения  [IGF-1] в сыворотке[hGH] в сыворотке Нетрансгенные123,40 0,28 Трансгенные484,02 656,98 [IGF-1] в сыворотке[hGH] в сыворотке Нетрансгенные123,40 0,28 Трансгенные484,02 656,98 Стоит отметить, что средняя сывороточная концентрация hGH в нетрансгенной группе лежит в пределах предполагаемого диапазона, в то время как среднее значение для трансгенной коровы сильно превышает верхний предел указанного диапазона. Кроме этого, бесспорно, что средний уровень IGF-1 в сыворотке трансгенного животного безусловно выше, чем уровень, соответствующий нетрансгенным коровам, что составляет основное отличие. Поэтому хотя высокая концентрация hGH в сыворотке трансгенной коровы (которая, как известно, вызывает у человека расстройства с тяжелыми последствиями, такие как сахарный диабет, гипертония, повышенный риск сердечнососудистого заболевания и укрупнение органов тела, включая печень, селезенку, почки и сердце) теоретически должна делать животное нежизнеспособным, это, очевидно, не может представлять собой препятствия для его здоровья и самочувствия. Корова с опасно высокими уровнями чужеродного гормона в ее крови, но с прекрасным здоровьем и выдающейся продуктивностью рекомбинантного белка, представляет собой неожиданный и изобретательский вклад. Другой инновационный аспект настоящего изобретения заключается в том, что рекомбинантный hGH, который проникает в кровообращение, стимулирует молочную железу к продукции большего количества молока. Указанное действие достигается опосредованно, т.е. через действие IGF-1. Данная молекула увеличивает поток крови через молочную железу, обеспечивая ее важными предшественниками для синтеза молочного жира, белка и лактозы. Таким образом, IGF-1 действует, направляя питательные вещества через кровь к клеткам в вымени, где они способствуют выработке молока. Поэтому получают самостимулируемое животное, так как рекомбинантный hGH, продуцируемый в молоке трансгенной коровы, стимулирует продолжительное увеличение объема молока, даваемого животным, посредством стимуляции его молочной железы, с соответствующим выделением большего количества hGH в молоке животного. ПРИМЕР 5 Получение трансгенных телят путем субклонирования Брали пять образцов ткани из уха трансгенного теленка, используя иглу диметром 1,5 мм, конец которой был предварительно скошен для этой цели. Образцы отправляли в охлажденном виде в лабораторию в среде на основе PBS, содержащей антибиотики и противогрибковые средства. Затем образцы ткани инкубировали в течение 72 часов в среде MEM с 10% фетальной бычьей сывороткой антибиотиками при 39°C и в атмосфере 5% CO2. В конце образцы ткани удаляли и фибробластам на периферии планшета давали возможность расти вплоть до слияния слоя. После достижения указанного фибробласты инкубировали по меньшей мере в течение 5 дней без замены культуральной среды, чтобы достичь их синхронизации на стадии G0, которую оценивали с помощью визуализации в микроскопе. После обработки трипсином отдельные фибробласты сливали с энуклеированными ооцитами коров согласно примеру 2, и полученные таким образом эмбрионы культивировали в среде SOF и атмосфере 5% CO2 + 5% O2 + 90%N2 вплоть до стадии бластоцисты. После этого, как правило, два фибробласта переносили нехирургическим путем корове-реципиенту, и беременность определяли на 30-35 день методом ультрасонографии. Коровам, подвергнутым имплантации, обеспечивали нормальный ход беременности вплоть до естественных родов. При соответствующих условиях возможно использование хирургического способа (кесарева сечения) для родоразрешения. Новорожденных кормят богатым Ig молозивом в течение первых 48 часов и затем используют синтетические, позже - природные корма (все корма не содержат соединений животного происхождения). На фиг. 6A и 6B показаны измерения сывороточной концентрации hGH и IGF-1, выполненные в параллели для двух трансгенных животных, полученных субклонированием трансгенной коровы, и результаты указанных анализов изображены на фиг. 6C и 6D, соответственно, чтобы получить возможность одновременной визуализации обеих величин для каждого животного. Так как в настоящее время телята еще молодые, то значения как hGH, так и IGF-1 еще лежат в соответствующем диапазоне стандарта, но предполагается, что они будут повышены таким же образом, как у трансгенной коровы, от которой были получены два указанных клона. ПРИМЕР 6 Получение трансгенных телят путем искусственного оплодотворения трансгенной коровы В данном примере будет описан альтернативный способ получения трансгенного крупного рогатого скота. Данный способ включает в себя суперовуляцию трансгенной коровы с помощью гормональной обработки; искусственное оплодотворение указанной коровы; повторный сбор полученных таким образом эмбрионов; имплантацию указанных эмбрионов суррогатным коровам; и развитие беременности вплоть до рождения животных. Описание данного способа представлено ниже. Суперовуляция Утром в 1 день (т.е. день начала осуществления способа) 150 мкг простагландинов (D(+)-клорпростенол, арсапрост, Arsa) вводили трансгенной корове внутримышечно. Животное подвергали диете, давая 4 кг корма в сутки, содержащего примерно 15% белков (перед 1 днем животному давали 2 кг корма с таким же содержанием белков). Утром на 8 день устройство для CIDR (контролируемого внутреннего высвобождения лекарственного средства) прогестерона помещали внутривагинально. Кроме этого, вводили 50 мг прогестерона и эстрадиола внутримышечно. Количество корма, которым кормили животное, возрастало до 6 кг/день с таким же содержанием белков. Затем вводили две внутримышечные инъекции FSH и LH (PLUSET®, Calier) на 12, 13 и 14 день (одну утром, а другую вечером). На следующий день (15 день) обработку продолжали введением внутримышечным путем двух инъекций PLUSET® (одну утром, а другую вечером) и двух инъекций простагландинов по 150 мкг каждая (такая же схема введения). Утром на 16 день CIDR удаляли. Общее количество PLUSET®, введенного на протяжении фазы суперовуляции, составляло 350 МЕд. Оплодотворение Данная фаза включала в себя три последовательных введения (первое и второе - утром и вечером на 17 день, соответственно, и последнее - утром на 18 день) спермы от быка-донора породы Джерси, которую получали заранее и хранили в замороженном виде, чтобы сохранить жизнеспособность сперматозоидов. Сбор эмбрионов и их имплантация суррогатным коровам Сбор эмбрионов промыванием обоих рогов матки коровы с использованием 1 л DMPBS (Nutricell®) происходил утром на 26 день. Сразу после этого два эмбриона переносили нехирургическим способом корове-реципиенту, и беременность определяли на 30-35 день ультрасонографией. Коровам, подвергнутым имплантации, обеспечивали возможность для нормального протекания беременности вплоть до естественных родов. При соответствующих условиях возможно использование хирургического способа (кесарева сечения) для родоразрешения. Новорожденных кормят богатым Ig молозивом в течение первых 48 часов и затем используют синтетические, позже - природные корма (все корма не содержат соединений животного происхождения). Так как образование биологического потомства подчиняется закону Менделя, то половина животных, рожденных вследствие применения описанного выше способа, должна быть трансгенной, и из них половина должны быть мужского пола, а другая половина - женского пола. Поэтому существует высокая вероятность получения трансгенного самца (животное-основатель), сперма которого может быть использована для основания основного банка трансгенной спермы породы Джерси, используемой для оплодотворения суперовулированных трансгенных/нетрансгенных коров, чтобы размножить трансгенное стадо. ПРИМЕР 7 Очистка рекомбинантного hGH из молока В том случае, если проверенная примерная молекулярная масса, результаты Вестерн-блотинга и биологическая активность рекомбинантного hGH, продуцированного в молоке телят, оказываются соответствующими, осуществляют процесс полной очистки, поскольку при производстве биофармацевтического продукта обязательно, чтобы представляющий интерес белок был очищен до гомогенности, чтобы избежать присутствия возможных загрязнителей в указанном продукте. Указанный способ включает в себя стадии получения обезжиренного молока с помощью центрифугирования и разбавления надосадка, получаемого для того, чтобы достичь лучшей растворимости рекомбинантного hGH, который при соответствующих условиях, возможно, удерживается в мицеллах казеина (осветление); пропускание полученного раствора через колонку для анионообменной хроматографии с увеличенным слоем (альтернативой указанной стадии является применение иммуноаффинной колонки, см. пример 8 ниже); полученный в результате раствор подвергают стадии обращенно-фазовой ВЭЖХ (C4); затем фракции, обогащенные рекомбинантным hGH, подвергают анионообменной хроматографии. Очищенное вещество обессоливают, концентрируют и подвергают молекулярной эксклюзионной хроматографии. При этом осуществляют разделение по молекулярной массе, чтобы получить чистый рекомбинантный hGH. Способ очистки гормона роста человека (hGH) из молока включает в себя следующие стадии по порядку: (a) осветление, (b) анионообменную хроматографию с использованием расширенного слоя, (c) обращенно-фазовую хроматографию, (d) анионообменную хроматографию, (e) молекулярную эксклюзионную хроматографию (обессоливание), (f) концентрирование и (g) молекулярную эксклюзионную хроматографию. Осветление Свежее молоко смешивали с достаточным количеством твина 80, чтобы получить 0,5% раствор. После добавления твина 80 добавляли 2М трис-HCl до получения pH 7,3±0,1. Затем продукт гомогенизировали в течение 30 минут и затем центрифугировали при 14000 g, чтобы отделить жировой слой. Затем полученный в результате раствор разбавляли 0,5% твином 80 до получения проводимости, меньшей или равной 1500 мкСм/см. pH доводили до 7,3±0,1, используя 2М трис-HCl, и затем продукт фильтровали через мембрану с порами диаметром 0,8 мкм и соответствующим образом хранили. Анионообменная хроматография с использованием расширенного слоя Вещество, полученное на предыдущей стадии подвергают хроматографии, используя анионообменную матрицу, согласно следующим параметрам: 1. Оборудование: A. Колонка: 1) диаметр: 5 см; 2) высота слоя: 30 см (компактный слой); 3) матрица: a) Streamline Q XL (Amersham); b) объем: 600 мл. 2. Растворы и буферы: A. 0,5н NaOH; B. 20% этанол; C. Буфер A: 20 мм трис-HCl, pH 7,3; D. Буфер B: 500 мм трис-HCl, pH 7,3; E. Буфер C: 20 мм трис-HCl, 150 мм NaCl, pH 7,3; F. Буфер D: 20 мм трис-HCl, 500 мм NaCl, pH 7,3; 3. Материал, подвергаемый хроматографии: A. Осветленное молоко; B. Параметры образца: 1) объем: 25±5 л; 2) проводимость: <1500 мкСм/см; 3) pH: 7,3±0,1. Чтобы уравновесить колонку, через нее пропускали 1,5 объема колонки («об.кол.») (900 мл) очищенной воды со скоростью потока 115±5 см/час (нисходящий поток). Затем через нее последовательно пропускали следующие растворы или буферы в количествах, подробно указанных далее, со скоростью потока 230±30 см/час (восходящий поток): 3,0 об.кол. (1800 мл) 0,5н NaOH; 3,0 об.кол. (1800 мл) очищенной воды; 1,0 об.кол. (600 мл) буфера B и, наконец, 3,0 об.кол. (1800 мл) буфера A. После уравновешивания колонки наносили вещество для хроматографии. Указанное нанесение осуществляли при 12±3°C и скорости потока 230±30 см/час. Затем осуществляли элюирование со скоростью потока 115±15 см/час и при той же температуре. Во-первых, через колонку пропускали достаточное количество буфера A (восходящий поток), а во-вторых, пропускали растворы и буферы, подробно указанные далее, в следующем порядке (нисходящий поток): 1,5 об.кол. (900 мл) буфера A; 2,0 об.кол. (1200 мл) буфера C и, наконец, 2,0 об.кол. (1200 мл) буфера D. После окончания данной стадии через колонку последовательно пропускали следующие растворы и буферы в количествах, подробно указанных далее, чтобы ее очистить: 1,5 об.кол. (900 мл) очищенной воды; 1,5 об.кол. (900 мл) 0,5н NaOH; 2,0 об.кол. (1200 мл) очищенной воды; 1,0 об.кол. (600 мл) буфера B; 1,5 об.кол. (900 мл) очищенной воды и, наконец, 1,5 об.кол. (900 мл) 20% этанола. Отобранные содержащие hGH фракции анализировали в отношении суммарных белков (способом Бредфорда) и в отношении представляющего интерес белка (посредством РИА) и хранили при 2-8°C. Обращенно-фазовая хроматография Вещество, полученное в результате предыдущей стадии, подвергали хроматографии согласно следующим параметрам: 1. Оборудование: A. Колонка: 1) диаметр: 4 см; 2) высота слоя: 48 см; 3) матрица: a) BakerBond-бутил широкопористый (C4), с размером пор в 15 мкм, подготовленный для ЖХ-колонки (Baker); b) объем: 600 мл. 2. Растворы и буферы: A. Подвижная фаза 1 (MP1): 30 мм NaHCO3, pH 7,2: очищенная вода : ацетонитрил (35:55:10); B. Подвижная фаза 2(MP2): 30 мм NaHCO3, pH 7,2: очищенная вода : ацетонитрил (20:10:70); C. 50% метанол. 3. Вещество, подвергаемое хроматографии: A. Объединенные отобранные фракции, полученные в результате предыдущей стадии; B. Параметры образца: 1) объем: 30±15 л; 2) pH: 7,3±0,3. Чтобы уравновесить колонку, через нее пропускали следующие растворы или буферы в количествах, подробно указанных далее, со скоростью потока, меньшей или равной 478 см/час: 0,3 об.кол. (180 мл) 50% метанола; затем применяли градиент 50% метанол-MP2, начиная с соотношения 100:0 указанных растворов до достижения соотношения 0:100 указанных растворов в общем объеме 1,0 об.кол. (600 мл); после окончания градиента через колонку пропускали 1,0 об.кол. (600 мл) MP2; затем применяли градиент MP2-MP1, начиная с соотношения 100:0 указанных растворов вплоть до достижения соотношения 0:100 указанных растворов в общем объеме 1,0 об.кол. (600 мл), и, наконец, через колонку пропускали 2,0 об.кол. (1200 мл) MP1. После уравновешивания колонки подвергаемое хроматографии вещество фильтровали через мембрану с диаметром пор 0,45 мкм и затем сразу же наносили. Указанное нанесение осуществляли при 20±5°C и скорости потока, меньшей или равной 238 см/час. Затем осуществляли элюирование со скоростью 478±78 см/час при такой же температуре и затем пропускали растворы и буферы, подробно указанные далее, в следующем порядке: 1,0 об.кол. (600 мл) MP1; градиент MP1-MP2, начиная с соотношения 65:35 указанных растворов вплоть до достижения соотношения 45:55 указанных растворов в общем объеме 18,0 об.кол. (9000 мл); 1,0 об.кол. (600 мл) MP1-MP2 в соотношении 45:55, и, наконец, 2,0 об.кол. (1200 мл) MP2. После окончания данной стадии для очистки колонки применяли градиент MP2-50% метанол, начиная с соотношения 100:0 указанных растворов вплоть до достижения соотношения 0:100 указанных растворов в общем объеме 1,0 об.кол. (600 мл) и, наконец, через колонку пропускали 2,0 об.кол. (1200 мл) 50% метанола. Фракции, полученные в результате указанной хроматографии, анализировали в гомогенном 20% СДН-ПААГ и в отношении окисленного hGH, и, в зависимости от результатов, осуществляли отбор. Затем отобранные содержащие hGH фракции анализировали в отношении суммарных белков (способом Бредфорда) и хранили при 2-8°C. Анионообменная хроматография Вещество, полученное в результате предыдущей стадии, подвергали хроматографии, используя анионообменную матрицу, следующим образом: 1. Оборудование: A. Колонка: 1) диаметр: 5 см; 2) высота слоя: 25 см; 3) матрица: a) Source 30Q (Pharmacia); b) объем: 500 мл. 2. Растворы и буферы: A. 20% этанол; B. Раствор K: 0,5н NaOH, 3М NaCl; C. Раствор L: 50 мм трис, pH 7,50; D. Раствор M: 0,1н HCl, 3М NaCl; E. Подвижная фаза 3(MP3): раствор L:ацетонитрил (70:30); F. Подвижная фаза 4 (MP4): 50 мм трис, 0,1М NaCl, pH 7,50: ацетонитрил (70:30). 3. Вещество, подвергаемое хроматографии: A. Отобранные фракции, полученные в результате предыдущей стадии; B. Параметры образца: 1) объем: 4,5±1 л; 2) pH: 7,2±0,2. Чтобы уравновесить и дезинфицировать колонку, через нее последовательно пропускали следующие растворы или буферы в количествах, подробно указанных далее, со скоростью потока, меньшей или равной 183±20 см/час: 1,0 об.кол. (500 мл) очищенной воды; 1,0 об.кол. (500 мл) раствора K; 1,0 об.кол. (500 мл) раствора L и, наконец, 1,0 об.кол. (500 мл) MP3. После уравновешивания колонки наносили вещество, подвергаемое хроматографии. Указанное нанесение осуществляли при 20±5°C и со скоростью потока, меньшей или равной 183 см/час. Затем осуществляли элюирование со скоростью потока 183±20 см/час при такой же температуре и затем пропускали растворы и буферы, подробно указанные далее, в следующем порядке: 1,0 об.кол. (500 мл) MP3; градиент MP3-MP4, начиная с соотношения 15:85 указанных растворов вплоть до достижения соотношения 25:75 указанных растворов в общем объеме 5,0 об.кол. (2500 мл), и, наконец, через колонку пропускали 2,0 об.кол. (1000 мл) MP4. После окончания данной стадии через колонку последовательно пропускали следующие растворы или буферы в количествах, подробно указанных далее, чтобы ее очистить: градиент MP4-очищенная вода, начиная с соотношения 100:0 указанных растворов вплоть до достижения соотношения 0:100 указанных растворов в общем объеме 0,5 об.кол. (250 мл); 0,5 об.кол. (250 мл) очищенной воды; градиент очищенная вода-раствор K, начиная с соотношения 100:0 указанных растворов вплоть до достижения соотношения 0:100 указанных растворов в общем объеме 0,5 об.кол. (250 мл); 1,0 об.кол. (500 мл) раствора K; градиент раствор K-очищенная вода, начиная с соотношения 100:0 указанных растворов вплоть до достижения соотношения 0:100 указанных растворов в общем объеме 0,5 об.кол. (250 мл); 0,5 об.кол. (250 мл) очищенной воды; градиент очищенная вода-раствор M, начиная с соотношения 100:0 указанных растворов вплоть до достижения соотношения 0:100 указанных растворов в общем объеме 0,5 об.кол. (250 мл); 1,0 об.кол. (500 мл) раствора M; градиент раствор M-очищенная вода, начиная с соотношения 100:0 указанных растворов вплоть до достижения соотношения 0:100 указанных растворов в общем объеме 0,5 об.кол. (250 мл); 1,0 об.кол. (500 мл) очищенной воды; градиент очищенная вода-раствор L, начиная с соотношения 100:0 указанных растворов вплоть до достижения соотношения 0:100 указанных растворов в общем объеме 0,5 об.кол. (250 мл); 0,5 об.кол. (250 мл); 0,5 об.кол. (250 мл) раствора L; градиент раствор L-очищенная вода, начиная с соотношения 100:0 указанных растворов вплоть до достижения соотношения 0:100 указанных растворов в общем объеме 0,5 об.кол. (250 мл), и, наконец, 1,5 об.кол. (750 мл) очищенной воды. Отобранные содержащие hGH фракции анализировали в отношении суммарных белков (способом Бредфорда) и хранили при 2-8°C. Молекулярная эксклюзионная хроматография Вещество, полученное в результате предыдущей стадии, подвергали хроматографии, используя матрицу для молекулярной эксклюзионной хроматографии, следующим образом: 1. Оборудование: A. Колонка: 1) диаметр: 5 см; 2) высота слоя: 25 см; 3) матрица: a) Cellufine GH25 (Millipore); b) объем: 500 мл. 2. Растворы и буферы: A. 0,5н NaOH; B. 20% этанол; C. Буфер C: 150 мм NaH2PO4, pH 7,2; D. Буфер G: 320 мм глицин, 10 мм NaH2PO4 , 0,1% твин 80, pH 6,9. 3. Вещество, подвергаемое хроматографии: A. Отобранные фракции, полученные в результате предыдущей стадии; B. Параметры образца: 1) объем: 0,5±0,2 л; 2) pH: 7,5±0,5. Чтобы уравновесить и дезинфицировать колонку, через нее последовательно пропускали следующие растворы или буферы в количествах, подробно указанных далее, со скоростью потока, меньшей или равной 180 см/час: 1,0 об.кол. (500 мл) очищенной воды; 1,0 об.кол. (500 мл) 0,5н NaOH; 0,5 об.кол. (250 мл) очищенной воды; 0,5 об.кол. (250 мл) буфера C и, наконец, 2,0 об.кол. (1000 мл) буфера G. После уравновешивания колонки наносили вещество, подвергаемое хроматографии. Указанное нанесение осуществляли при 20±5°C и скорости потока 183±20 см/час. Затем осуществляли элюирование с такой же скоростью потока и при такой же температуре и через колонку пропускали 1,0 об.кол. (500 мл) буфера G столько раз, сколько было необходимо осуществить циклов. После окончания данной стадии через колонку последовательно пропускали следующие растворы или буферы в количествах, подробно указанных далее, чтобы ее очистить: 0,5 об.кол. (250 мл) очищенной воды; 1,0 об.кол. (500 мл) 0,5н NaOH; 0,5 об.кол. (250 мл) очищенной воды; 0,5 об.кол. (250 мл) буфера C; 0,5 об.кол. (250 мл) очищенной воды и, наконец, 1,5 об.кол. (750 мл) 20% этанола. Отобранные содержащие hGH фракции анализировали в отношении суммарных белков и хранили при 2-8°C. Концентрирование Фракции, полученные в результате предыдущего примера, концентрировали согласно условиям, описанным ниже: 1. Оборудование: A. Перистальтический насос: Watson Marlow - B. Трубки: Watson Marlow - C. Концентратор: Prep Scale Millipore - 2. Растворы и буферы: A. 0,28% додецилсульфат натрия (SDS); B. 0,06% тритон; C. 0,125н NaOH; D. Буфер G: 320 мм глицин, 10 мм NaH2PO4 , 0,1% твин 80, pH 6,9. 3. Обрабатываемое вещество: A. Отобранные фракции, полученные в результате предыдущего примера; B. Параметры образца: 1) объем: 1,0±0,5 л; 2) проводимость: 1200±100 мкСм/см; 3) pH: 6,9±0,1. Оборудование сначала очищали, дезинфицировали и уравновешивали и через оборудование пропускали растворы и буферы в следующей последовательности: 2 л 0,125н NaOH; 10 л очищенной воды и, наконец, 2 л буфера G. После этого оборудование было готово для использования для концентрирования отобранных фракций в соответствии с обычной методикой. Концентрирование осуществляли до достижения концентрации белка 15 мг/мл (оценивали способом по Бредфорду). Отобранные фракции фильтровали через мембрану с диаметром пор 0,22 мкм, анализировали в отношении суммарных белков (способом по Бредфорду) и хранили при 4°C. Проводимость и pH отобранных фракций составляли 1100-1300 мкСм/см и 6,9±0,1, соответственно. Молекулярная эксклюзионная хроматография Вещество, полученное в результате осуществления предыдущей стадии, подвергали хроматографии, используя матрицу для молекулярной эксклюзионной хроматографии, следующим образом: 1. Оборудование: A. Колонка: 1) диаметр: 5 см; 2) высота слоя: 92 см; 3) матрица: a) сефакрил S-200 высокого разрешения (Amersham Pharmacia); b) объем: 1800 мл. 2. Растворы и буферы: A. 0,5н NaOH; B. 20% этанол; C. Буфер H: 320 мм глицин, 2,2 мм NaH 2PO4, 1,8 мм Na2HPO4, pH 7,30. 3. Вещество, подвергаемое хроматографии: A. Фракции, отобранные в результате предыдущей стадии, концентрированные; B. Параметры образца: 1) объем: 40±20 мл; 2) проводимость: 1200±100 мкСм/см; 3) pH: 7,3±0,1. Чтобы уравновесить и дезинфицировать колонку, через нее последовательно пропускали следующие растворы или буферы в количествах, подробно указанных далее, со скоростью потока менее 46 см/час: 1,0 об.кол. (1800 мл) очищенной воды; 1,0 об.кол. (1800 мл) 0,5н NaOH и, наконец, 2,0 об.кол. (3600 мл) буфера H. После уравновешивания колонки наносили вещество, подвергаемое хроматографии. Указанное нанесение осуществляли при 20±5°C и скорости потока 46±15 см/час. Затем осуществляли элюирование при такой же скорости потока и температуре и через колонку пропускали 1,0 об.кол. (1800 мл) буфера H столько раз, сколько было необходимо осуществить циклов. После окончания данной стадии через колонку пропускали следующие растворы или буферы в количествах, подробно указанных далее, чтобы ее очистить: 1,0 об.кол. (1800 мл) очищенной воды и 1,5 об.кол. (2700 мл) 20% этанола. Фракции, содержащие очищенный hGH, асептически фильтровали через мембрану с диаметром пор 0,22 мкм в стерильные, апирогенные пластиковые флаконы, анализировали в отношении суммарных белков и хранили при -20°C. ПРИМЕР 8 Альтернативный способ очистки hGH из молока Вместо описанного ранее способа очистки можно использовать альтернативную схему, чтобы очистить рекомбинантный hGH, находящийся в молоке. Основное различие между способом, описанным в примере 7, и альтернативным способом, представленном в данном примере, заключается в том, что вторая стадия первого способа заключается в анионообменной хроматографии с использованием расширенного слоя, тогда как соответствующая стадия последнего включает в себя иммуноаффинную хроматографию. Стадии осветления в обоих способах также немного отличаются. Поскольку остальные части в обеих схемах очистки идентичны, ниже будут описаны только первые две стадии альтернативного способа. Осветление Свежее молоко смешивали с достаточным количеством твина 80, чтобы получить 0,5% раствор. После добавления твина 80 добавляли 1М трис, чтобы получить pH 7,3±0,3. Затем продукт гомогенизировали в течение 30 минут и затем центрифугировали при 14000 g, чтобы отделить жировой слой. Затем полученный в результате раствор разбавляли в 20 раз буфером S (50 мм трис-HCl, 500 мм NaCl, 0,5% твин 80, pH 7,3) и затем фильтровали через мембрану с диаметром пор 0,45 мкм и соответствующим образом хранили. Иммуноаффинная хроматография Материал, полученный в результате осуществления предыдущей стадии, подвергали хроматографии, используя матрицу для иммуноаффинного взаимодействия (Affigel 10 сложный эфир-агароза, производства BioRad с ковалентно связанными моноклональными антителами против GH производства Bio Sidus) согласно следующим параметрам: 1. Оборудование: A. Колонка: 1) диаметр: 30 см; 2) высота слоя: 15 см; 3) матрица: a) Affigel 10, сложный эфир-агароза (BioRad) с ковалентно связанными моноклональными антителами против GH (Bio Sidus); b) объем: 10 л; 2. Растворы и буферы: A. Буфер A: 50 мм трис-HCl, 500 мм NaCl, pH 7,2; B. Буфер B: 100 мм лимонная кислота, pH 3,0; C. Буфер C: 150 мм NaH2PO4, pH 7,2; D. Буфер D: 50 мм трис-HCl, 500 мм NaCl, 500 мм гуанидин-HCl, pH 7,2; E. Буфер E: 50 мм трис-HCl, 500 мм NaCl, pH 7,2, 0,2% азид натрия, 0,1 г/л гентамицина. 3. Материал, подвергаемый хроматографии: A. Осветленное молоко. B. Параметры образца: 1) объем: 30-50 л; 2) проводимость: 45±15 мСм/см; 3) pH: 7,3±0,3. Чтобы уравновесить и дезинфицировать колонку, если ее не использовали последние семь дней, через нее пропускали следующие растворы или буферы в количествах, подробно указанных далее, со скорость потока менее 51 см/час: 1,0 объем колонки («об. кол.») (10 л) буфера A; 2,0 об.кол. (20 л) буфера D; 2,0 об.кол. (20 л) буфера A; 1,0 об.кол. (10 л) буфера B; 2,0 об.кол. (20 л) буфера C и, наконец, 1,0 об.кол. (10 л) буфера A. С другой стороны, если колонку использовали последние семь дней, то через нее последовательно пропускали следующие растворы или буферы в количествах, подробно указанных далее, со скоростью потока менее 51 см/час: 1,0 об.кол. (10 л) буфера C и, наконец, 2.0 об.кол. (20 л) буфера A. После уравновешивания колонки наносили материал, подвергаемый хроматографии. Указанное нанесение осуществляли при 5±3°C и скорости потока менее 51 см/час. Затем осуществляли элюирование со скоростью потока 42±9 см/час и при такой же температуре и затем пропускали растворы и буферы, подробно указанные далее, в следующем порядке: 2,0 об.кол. (20 л) буфера A и 1,5 об.кол. (15 л) буфера B. После окончания данной стадии через колонку пропускали следующие растворы или буферы в количествах, подробно указанных далее, чтобы очистить колонку: 2,0 об.кол. (20 л) буфера D; 2,0 об.кол. (20 л) буфера A и, наконец, 2,0 об.кол. (20 л) буфера E. Отобранные содержащие hGH фракции анализировали в отношении суммарных белков (способ по Бредфорду) и в отношении представляющего интерес белка (с помощью РИА) и хранили при 4°C. ПРИМЕР 9 Контроль качества очищенного рекомбинантного hGH Две партии очищенного рекомбинантного hGH подвергали серии анализов, чтобы подтвердить, что продукт не отличается от природного hGH. Такие способы включали в себя анализы в ДСН/ПААГ, Вестерн-блота, биологической активности in vitro (клетки nb2) и in vivo (гипофизэктомированные крысы), картирование пептидов, определение полной аминокислотной последовательности, изоэлектрическое фокусирование (IEF) и обращенно-фазовую и эксклюзионную ВЭЖХ, но не ограничены указанным. Результаты, полученные во всех указанных анализах, были в точности такими же как для рекомбинантного, так и для природного hGH, что доказывает, что очищенный рекомбинантный hGH точно соответствует природному hGH, являясь, таким образом, подходящим для производства биофармацевтического продукта. На основании полного описания изобретения специалистам в данной области будет понятно, что то же самое можно осуществить в широком и эквивалентном диапазоне условий, состава и других параметров, не выходя за рамки объема изобретения или любого варианта его осуществления. Все патенты и публикации, цитированные в данном описании, полностью включены в данное описание в виде ссылки в полном объеме. Формула изобретения1. Трансгенное отличное от человека млекопитающее из рода быков, которое в своем молоке продуцирует рекомбинантный гормон роста человека, при этом в сыворотке указанного млекопитающего продуцируется в среднем на месяц по меньшей мере 92 нг/мл гормона роста. 2. Трансгенное отличное от человека млекопитающее по п.1, где указанный гормон роста человека продуцируется на уровне, примерно превышающем 1,0 г hGH/л молока. 3. Трансгенное отличное от человека млекопитающее по п.2, где указанный гормон роста человека продуцируется на уровне, примерно превышающем 2,0 г hGH/л молока. 4. Трансгенное отличное от человека млекопитающее по п.3, где указанный гормон роста человека продуцируется на уровне, примерно превышающем 3,0 г hGH/л молока. 5. Трансгенное отличное от человека млекопитающее по п.4, где указанный гормон роста человека продуцируется на уровне, примерно превышающем 4,0 г hGH/л молока. 6. Трансгенное отличное от человека млекопитающее по п.5, где указанный гормон роста человека продуцируется на уровне, примерно превышающем 5,0 г hGH/л молока. 7. Трансгенное отличное от человека млекопитающее по п.6, где указанный гормон роста человека продуцируется на уровне, примерно превышающем 6,0 г hGH/л молока. 8. Трансгенное отличное от человека млекопитающее по п.1, где продуцирование указанного рекомбинантного гормона роста человека указанным млекопитающим стимулирует указанное млекопитающее к продуцированию большего количества молока, содержащего указанный гормон роста. 9. Трансгенное отличное от человека млекопитающее по п.1, геном которого содержит интегрированную плазмиду, при этом указанная плазмида содержит ген гормона роста, оперативно связанный с промотором, который управляет экспрессией указанного гена в клетках молочной железы указанного млекопитающего. 10. Трансгенное отличное от человека млекопитающее по п.9, где промотором является промотор бета-казеина. 11. Трансгенное отличное от человека млекопитающее по п.10, где плазмида представляет собой плазмиду pRbhGH (DSM 16763). 12. Трансгенное отличное от человека млекопитающее по п.11, где указанная плазмида дополнительно содержит ген резистентности к неомицину. 13. Трансгенное отличное от человека млекопитающее из рода быков по п.12, где указанная плазмида, которая дополнительно содержит ген резистентности к неомицину, представляет собой плазмиду pRNeo (DSM 16764). 14. Трансгенное отличное от человека млекопитающее по п.9, где продуцирование указанного рекомбинантного гормона роста указанным млекопитающим стимулирует указанное млекопитающее к продуцированию большого количества молока, содержащего указанный гормон роста. 15. Трансгенное отличное от человека млекопитающее, относящееся к виду крупного рогатого скота, у которого в молоке продуцируется рекомбинантный гормон роста человека, и геном которого содержит интегрированную плазмиду, при этом указанная плазмида содержит ген гормона роста человека и промотор бета-казеина, который управляет экспрессией указанного гена в клетках молочной железы указанного млекопитающего, при этом в сыворотке указанного млекопитающего продуцируется в среднем на месяц по меньшей мере 92 нг/мл гормона роста. 16. Трансгенное отличное от человека млекопитающее по п.15, где указанная плазмида представляет собой плазмиду pRbhGH (DSM 16763). 17. Трансгенное отличное от человека млекопитающее по п.16, где указанная плазмида дополнительно содержит ген резистентности к неомицину. 18. Трансгенное отличное от человека млекопитающее по п.17, где указанная плазмида, которая дополнительно содержит ген резистентности к неомицину, представляет собой плазмиду pRNeo (DSM 16764). 19. Трансгенное отличное от человека млекопитающее по п.15, где указанную интегрированную плазмиду обнаруживают в соматических клетках и половых клетках указанного млекопитающего. 20. Трансгенное отличное от человека млекопитающее по п.15, где продуцирование рекомбинантного гормона роста человека указанным млекопитающим стимулирует указанное млекопитающее к продуцированию большего количества молока, содержащего указанный гормон. 21. Способ получения трансгенного отличного от человека млекопитающего из рода быков, включающего в себя а) клонирование гена, который кодирует гормон роста человека, в плазмиду, посредством чего указанный ген оперативно связывается с промотором, который будет направлять экспрессию указанного гена в клетках молочной железы, приводя к экспрессии плазмиды;b) трансфекцию бычьих соматических клеток указанной экспрессирующей плазмидой, так, чтобы указанная плазмида включалась в геном указанных клеток, что приводит к получению трансгенных соматических клеток; c) энуклеацию зрелого бычьего ооцита, что приводит к получению энуклеированного ооцита;d) слияние одной из указанных трансгенных соматических клеток с указанным энуклеированным ооцитом, что приводит к получению моноклеточного эмбриона;e) имплантацию указанного эмбриона в матку реципиентного млекопитающего, что приводит к наступлению беременности у млекопитающего; и f) мониторинг беременности вплоть до рождения трансгенного млекопитающего,при этом в сыворотке указанного трансгенного млекопитающего продуцируется в среднем на месяц по меньшей мере 92 нг/мл гормона роста человека. 22. Способ по п.21, где указанным промотором является промотор бета-казеина и где указанным гормоном роста является гормон роста человека. 23. Способ по п.22, где экспрессирующей плазмидой является плазмида pRbhGH (DSM 16763). 24. Способ по п.23, где указанная экспрессирующая плазмида дополнительно содержит ген резистентности к неомицину. 25. Способ по п.24, где указанной экспрессирующей плазмидой, которая дополнительно содержит ген резистентности к неомицину, является плазмида pRNeo (DSM 16764). 26. Способ по п.21, где указанное трансгенное млекопитающее является млекопитающим из рода быков, у которого в молоке продуцируется рекомбинантный гормон роста человека, и геном которого содержит интегрированную плазмиду, при этом указанная плазмида содержит ген гормона роста человека и промотор бета-казеина, который управляет экспрессией указанного гена в клетках молочной железы указанного млекопитающего. 27. Способ по п.26, где указанной плазмидой является плазмида pRbhGH (DSM 16763). 28. Способ по п.27, где указанная плазмида дополнительно содержит ген резистентности к неомицину. 29. Способ по п.28, где указанной плазмидой, которая дополнительно содержит ген резистентности к неомицину, является плазмида pRNeo. 30. Способ по п.21, где указанными соматическими клетками являются фибробласты. 31. Способ по п.21, где указанные трансгенные соматические клетки получают путем их выделения из организма самки, трансгенной по продукции указанного рекомбинатного гормона роста в ее молоке. 32. Способ по п.31, где указанными трансгенными соматическими клетками являются фибробласты. 33. Способ получения трансгенного отличного от человека млекопитающего из рода быков, включающий в себяa) суперовуляцию самки млекопитающего, отличного от человека, которая является трансгенной по продукции рекомбинантного гормона роста человека в ее молоке; b) искусственное оплодотворение указанного млекопитающего спермой, полученной от самца нетрансгенного млекопитающего, отличного от человека, с получением эмбрионов;c) сбор указанных эмбрионов;d) имплантацию указанных эмбрионов в матку млекопитающего, готового к оплодотворению;e) мониторинг беременности вплоть до рождения трансгенного млекопитающего, при этом в сыворотке указанного млекопитающего продуцируется в среднем на месяц по меньшей мере 92 нг/мл гормона роста человека. 34. Способ получения трансгенного отличного от человека млекопитающего из рода быков, включающий в себяa) суперовуляцию самки млекопитающего, отличного от человека, которая является трансгенной по продукции рекомбинантного гормона роста человека в ее молоке; b) искусственное оплодотворение указанного млекопитающего спермой, полученной от самца млекопитающего, отличного от человека, который является трансгенным по продукции указанного рекомбинантного гормона роста, с получением эмбрионов;c) сбор указанных эмбрионов;d) имплантацию указанных эмбрионов в матку млекопитающего, готового к оплодотворению;e) мониторинг беременности вплоть до рождения трансгенного млекопитающего, при этом в сыворотке указанного млекопитающего продуцируется в среднем на месяц по меньшей мере 92 нг/мл гормона роста человека. 35. Способ получения трансгенного отличного от человека млекопитающего из рода быков, включающий в себяa) суперовуляцию самки нетрансгенного млекопитающего, отличного от человека; b) искусственное оплодотворение указанного млекопитающего спермой, полученной от самца млекопитающего, отличного от человека, который является трансгенным по продукции указанного рекомбинантного гормона роста, с получением эмбрионов;c) сбор указанных эмбрионов;d) имплантацию указанных эмбрионов в матку млекопитающего, готового к оплодотворению;e) мониторинг беременности вплоть до рождения трансгенного млекопитающего, при этом в сыворотке указанного млекопитающего продуцируется в среднем на месяц по меньшей мере 92 нг/мл гормона роста человека. 36. Способ по любому из пп.21, 31, 33, 34 или 35, где указанное млекопитающее продуцирует гормон роста человека на уровне, превышающем приблизительно 1,0 г hGH/л молока. 37. Способ по п.36, где указанное млекопитающее продуцирует гормон роста человека на уровне, превышающем приблизительно 2,0 г hGH/л молока. 38. Способ по п.37, где указанное млекопитающее продуцирует гормон роста человека на уровне, превышающем приблизительно 3,0 г hGH/л молока. 39. Способ по п.38, где указанное млекопитающее продуцирует гормон роста человека на уровне, превышающем 4,0 г hGH/л молока. 40. Способ по п.39, где указанное млекопитающее продуцирует гормон роста человека на уровне, превышающем приблизительно 5,0 г hGH/л молока. 41. Способ по п.40, где указанное млекопитающее продуцирует гормон роста человека на уровне, превышающем приблизительно 6,0 г hGH/л молока. 42. Способ по любому из пп.21, 31, 33, 34 или 35, где продуцирование указанного рекомбинантного гормона роста указанным млекопитающим стимулирует указанное млекопитающее к продуцированию большего количества молока, содержащего указанный гормон роста. 43. Способ по любому из пп.21, 31, 33, 34 или 35, где ген, кодирующий указанный рекомбинантный гормон роста, оперативно связанный с промотором, который управляет экспрессией указанного гена в клетках молочной железы, находится в соматических клетках и зародышевых клетках указанного млекопитающего. MM4A Досрочное прекращение действия патента из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 30.09.2011 Дата публикации: 27.07.2012 Популярные патенты: 2295848 Способ дезинсекции и дезинфекции материалов зернового происхождения и устройство для его осуществления ... возможность существенного увеличения вводимой на постоянном токе энергии в плазму, предварительно возбужденную с помощью СВЧ волн. Соответственно, СВЧ источники в значительной степени освобождаются от функции поставщиков энергии в плазму и их мощность может быть существенно уменьшена.Таким образом, предлагаемые способ и устройство для обработки продуктов зернового происхождения обеспечивают повышение равномерности и производительности обработки зернового материала и его экономичности. Формула изобретения 1. Способ дезинсекции и дезинфекции материалов зернового происхождения, включающий формирование в разрядной камере рециркулирующего газового потока, подведение ... 2158069 Способ повышения урожайности сельскохозяйственных культур ... и извести в почву. Согласно современным представлениям основной показатель плодородия почвы - гумус образуется из поступающих в почву после отмирания высших и низших растений или их остатков, микроорганизмов и почвенных животных. Органические остатки подвергаются в почве сложным биохимическим процессам, в результате чего распадаются на промежуточные продукты разложения. Белки, например, расщепляются на пептиды и аминокислоты, жиры - на глицерин и жирные кислоты, углеводы - на моносахара и органические кислоты. То есть расщепление органических остатков имеет, в основном, кислотную направленность (Пейве Я.В., 1961). В дальнейшем часть промежуточных продуктов разложения ... 2130247 Замкнутый пневмосепаратор ... выхлопной диффузор посредством рециркуляционного канала сообщен с нижней частью пневмосепарирующего канала, канал частичного отвода запыленного воздуха, входной участок которого расположен у внутренней поверхности кожуха выхлопного диффузора в месте сопряжения со стенкой рециркуляционного канала, устройства вывода продуктов разделения, причем канал частичного отвода запыленного воздуха сообщен с отводом пневмосепарирующего канала, при этом его входной и выходной участки сообщены между собой окном, расположенным в смежной стенке пневмосепарирующего и рециркуляционного каналов. Выходной участок канала частичного отвода запыленного воздуха образован наружной поверхностью кожуха ... 2454055 Устройство для ротационного внутрипочвенного рыхления с механическим приводом ... внутреннего зацепления, ведущей, центрирующей и ведомой шестернями привода внутрипочвенного рыхлителя. Устройство снабжено промежуточной шестерней привода, которая установлена на диске щелереза с зацеплением с внутренней промежуточной шестерней привода кольцевого щелереза и ведомой шестерней привода внутрипочвенного рыхлителя. Кольцевой щелерез снабжен наружными режущими органами и расположенными между ними емкостями для приема грунта. Зубья и впадины зацепления ведущей, промежуточной внутреннего зацепления, промежуточной и ведомой шестерней привода внутрипочвенного рыхлителя выполнены попарно комплементарно поочередно слева и справа вдоль зацепления каждой шестерни. Ведущая, ... 2201663 Устройство для ориентированной посадки лука ... 19, расположенный радиально к его поверхности. Кроме того, на нижнем конце семяпровода 7 в задней части его по ходу движения устройства имеются две сквозные вертикальные прорези 20, расположенные по разные стороны от продольной плоскости семяпровода 7, необходимые для прохода лопастей 21 битера 8, причем расстояние между прорезями 20 не менее двух диаметров вешки луковицы. Вдавливание и фиксация луковиц в почве происходит с помощью битера 8, имеющего на рабочей поверхности эластичные лопасти 21, установленные в два ряда, свободные концы которых заходят в вертикальные прорези 20 семяпровода 7. Скорость вращения свободных концов эластичных лопастей 21 битера 8 равна поступательной ... |
Еще из этого раздела: 2399194 Способ и устройство контроля воздушного режима в корнеобитаемой среде 2464784 Защитный слой для растений и деревьев, его изготовление и его применение 2195644 Монитор для определения качества зерна 2216903 Устройство для отделения плодов от ветвей 2105446 Плоскорежущая лапа 2163071 Способ определения потенциальной соленостной толерантности водных беспозвоночных 2060624 Валкообразующий транспортер жатки-накопителя 2227965 Способ возделывания бахчевых культур и устройство для его осуществления 2261597 Способ борьбы с нематодами - возбудителями болезней сельскохозяйственных растений 2415560 Способ выращивания корнесобственных саженцев винограда |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
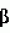 -лактамазы. Указанным представляющим интерес белком может быть, без ограничения, гормон роста человека. Указанной плазмидой может быть плазмида pR
-лактамазы. Указанным представляющим интерес белком может быть, без ограничения, гормон роста человека. Указанной плазмидой может быть плазмида pR

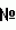 в каталоге 302S;
в каталоге 302S;