Способ идентификации сортов сои на основе микросателлитных (ssr) маркеровПатент на изобретение №: 2388828 Автор: Антонова Татьяна Сергеевна (RU), Рамазанова Светлана Алексеевна (RU), Гучетль Саида Заурбиевна (RU), Челюстникова Татьяна Аркадьевна (RU) Патентообладатель: Государственное научное учреждение Всероссийский научно-исследовательский институт масличных культур имени В.С. Пустовойта Российской академии сельскохозяйственных наук (RU) Дата публикации: 10 Мая, 2010 Начало действия патента: 28 Октября, 2008 Адрес для переписки: 350038, г.Краснодар, ул. Филатова, 17, ГНУ ВНИИМК Россельхозакадемии, патентная группа Изображения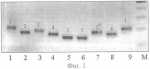 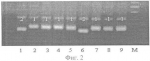 Отбирают пробу семян исследуемого генотипа. Отобранные семена проращивают, а затем из смеси органов растений каждого генотипа выделяют ДНК. Далее осуществляют отбор и синтез праймеров для полимеразной цепной реакции и проводят амплификацию ДНК по следующему набору микросателлитных локусов - SATT 1, SATT 2, SATT 5, SATT 9, SOYPR 1, SOYGY 2, SAT 1, SAT 36, SOYHSP 176 поочередно с каждым праймером при определенных температурах отжига. Продукты амплификации разделяют на фракции электрофорезом и проводят их визуализацию в лучах ультрафиолетового света. С помощью маркера определяют длину амплифицированных фрагментов ДНК сорта и выбирают присущий для сорта профиль (набор аллелей) по всем заявляемым локусам в качестве маркера для идентификации сорта. Заявляемый способ позволяет четко идентифицировать сорта сои. 3 з.п. ф-лы, 2 ил. Изобретение относится к сельскому хозяйству и может быть использовано в селекции и семеноводстве сои. Соя - важнейшая белково-масличная культура в России и мире. Ежегодно регистрируются новые улучшенные сорта. На современном этапе актуальной является задача идентификации и паспортизации уже существующих и новых сортов. Для сои характерно большое разнообразие морфологических признаков (высота растений, окраска венчика, бобов, семян и т.д.), которые выявляются визуально в фенотипе растений. С их помощью сорта сои проходят регистрацию и сертификацию. Такую ситуацию нельзя признать удовлетворительной, так как существуют сорта не отличимые по морфологическим признакам. Кроме того, существенным недостатком таких маркеров является зависимость их проявления от условий выращивания. При этом фенотипическое выражение признака уже может не соответствовать нужному генотипу, что приводит к некорректным выводам. В результате, заключение о принадлежности данной партии семян или посева к тому или иному сорту можно сделать лишь с определенной долей вероятности. К тому же, это требует дополнительных затрат времени и средств. Так как идентификация по морфологическим маркерам предполагает проведение полевых испытаний на отличимость. В настоящее время наиболее удобными для описания генотипов являются молекулярно-генетические маркеры (запасные белки, изоферменты и полиморфные фрагменты ДНК). Они не подвержены фенотипической изменчивости и, в большинстве случаев, имеют кодоминантное наследование. Однако полипептидный состав семян сортов сои отличается постоянством (Тарлаковская, Гаврилюк, 1990). Различия наблюдаются только между видами сои. К тому же гены, кодирующие белки, у большинства высших растений представляют незначительную часть генома и возможности белковых маркеров для идентификации сортов ограничены. Изоферментные маркеры более информативны. Например, украинскими учеными проведена работа по изучению изоферментных систем сои (Глазко, 2000). Они установили, что для четкой сортовой идентификации сортов сои достаточно выполнить анализ генотипов по 6 генетико-биохимическим системам и 14 локусам. Однако для полной идентификации генотипов этого недостаточно. Общепризнанно, что наиболее перспективными являются маркеры на основе полиморфных фрагментов ДНК. В настоящее время в генетико-селекционных исследованиях используются анализ длин фрагментов рестрикции (ПДРФ) ДНК и анализ полиморфизма длин фрагментов амплификации (ПДАФ) ДНК. ПДРФ не нашел пока широкого применения из-за сложности методик и необходимости применения радиоактивной метки. ПДАФ или иначе анализ продуктов полимеразной цепной реакции (ПЦР) находит все более широкое применение, так как является эффективным, быстрым и недорогим методом. А также позволяет практически решать проблемы, недоступные белковым маркерам, поскольку охватывает весь геном, включая структурные и неструктурные участки. Одним из методов, основанным на полиморфизме амплифицированных фрагментов ДНК, является RAPD-анализ. Известен «Способ маркирования селекционных достижений клевера лугового на основе RAPD-маркеров» (Патент РФ Недостатком этого способа является плохая воспроизводимость результатов и вытекающая отсюда невозможность точной идентификации сортов сои. Альтернативой RAPD-анализу является ПЦР с направленными праймерами, в частности SSR-PCR (амплификация простых повторяющихся последовательностей). Кодоминантность, возможность выявления значительного количества аллелей, стабильность воспроизводимых результатов и распределение микросателлитов по всему геному делают этот метод привлекательным для идентификации и паспортизации сортов, линий и гибридов растений. Микросателлитные маркеры позволяют дифференцировать биотипы, отличающиеся от исходных сортов или линий небольшим количеством генов, что не всегда заметно фенотипически. По данным многих авторов высокий уровень полиморфизма у сои удалось выявить только по микросателлитным локусам. Идентификация сортов сои проводилась американскими и канадскими авторами (Maughan P. Microsatellite and amplified sequence length polymorphism in cultivated and wild soybean / P. Maughan, M. Saghai- Maroof, G. Buss // Genom. - 1995. - V.38. - P.715-723; Rongwen J. The use of microsatellite DNA markers for soybean genotype identification / J. Rongwen, M.S. Akkaya, A.A. Bhagwat et al. // Theor. Appl. Genet. - 1995. - V. 90. - P.43-48) - прототип. Они использовали праймеры Satt I, Satt 2, Satt 5, Satt 9, Sat 1, Sat 36, Sat 43, а электрофорез проводили в акриламидном геле и для визуализации продуктов амплификации использовали радиоактивные метки. Недостатками известного способа, принятого нами за прототип, являются недостаточно широкий набор локусов, используемых для проведения анализа по идентификации сортов сои, а также канцерогенность используемого для электрофореза акриламидного геля, трудоемкость его приготовления, что снижает эффективность известного способа. Задача, решаемая заявляемым изобретением, состоит в повышении уровня идентификации сортов сои за счет увеличения числа используемых микросателлитных локусов, а также в повышении эффективности способа идентификации сортов сои за счет упрощения операции разделения продуктов амплификации и улучшения работы персонала при проведении анализа. Цель изобретения - расширение арсенала локусов, рекомендуемых для идентификации сортов сои, а также использование для электрофореза менее канцерогенного геля. Технический результат достигается тем, что в известном способе идентификации сортов сои на основе микросателлитных (SSR) маркеров, включающем отбор пробы семян исследуемого генотипа, их проращивание, выделение ДНК из смеси органов растений каждого генотипа отдельно стандартным методом, отбор и синтез праймеров для полимеразной цепной реакции, проведение амплификации ДНК поочередно каждым праймером, разделение продуктов амплификации на фракции методом электрофореза в разделяющем геле, визуализацию продуктов амплификации в лучах ультрафиолетового света, определение длин микросателлитных аллелей по каждому генотипу с помощью стандартного маркера, выбор присущих для каждого генотипа профилей в качестве его маркера, согласно изобретению амплификацию ДНК проводят по следующему набору микросателлитных локусов с использованием фланкирующих их праймеров: Микросателлитный локус Последовательность прямого и обратного праймеров SATT1 п AGT АСА TAG АТА ТТА AAG ТСТ оААА TGA TGA ACG TGA АТТ АТТ SATT2п ААТ ААТ GTG GAA ACT AAA TGG оТАА TGT GCC TAT CCT TGT СТТ SATT5п TAT CCT AGA GAA GAA СТА AAA AA оGTC GAT TAG GCT TGA AAT A SATT9п ATT ACT AGA GAA ATT AGT TTA оCTT ACT AGG GTA TTA ACC CTT SOYPR 1п CGA AGA GCT ACG TGC CAA ATT оGTT AGA AAA CTC CGC CCA CAC SOYGY 2п AAA ATT GAA AGT GTC АСА ССС С оTTA AAA TCG ATT AAT TGG CAT GA SAT1п CTG GTG GAC TAT TGA TAC GAC С оAAC TGC GAA GAT ACT ACC CTC С SAT 36п AAA GTC ATA ACT GGC ACT CCA AGT TT оGAA CAT AAC AAT AAT AAA TAT AGC TC SOYHSP176п TGT GGG CCA CAA AAC GTA TAG оCGT ACG TTC TAG СТА GTC TTCпричем обеспечивают температуру отжига праймера для микросателлитных локусов SATT 9-45°С, SATT 5 и SAT 1-55°С, а остальных шести: SATT 1, SATT 2, SOYPR 1, SOYGY 2, SAT 36, SOYHSP176 - 60°С, при этом выделение ДНК осуществляют из смеси всех органов не менее тридцати 5-дневных проростков, кроме их семядолей, каждого генотипа, пророщенных в рулонах фильтровальной бумаги, или из смеси фрагментов листьев не менее тридцати растений каждого генотипа, выращенных в поле, разделение продуктов амплификации методом электрофореза проводят в агарозном геле, окрашенном бромистым этидием. Сопоставительный анализ заявляемого технического решения с прототипом позволяет сделать вывод, что заявляемый способ идентификации сортов сои на основе микросателлитных (SSR) маркеров отличается от известного условиями осуществления действий, а именно используемыми веществами - праймерами. Таким образом, заявляемый способ соответствует критерию патентоспособности НОВИЗНА. Исследуя уровень техники в процессе проведения патентного поиска по всем видам сведений, общедоступных в печати, мы не выявили отличительного от прототипа признака, касающегося набора микросателлитных локусов и фланкирующих их праймеров при проведении амплификации ДНК. Заявляемый способ, включающий заявленную совокупность признаков, для специалиста в области селекции и семеноводства сои явным образом не следует из известного на сегодня существующего уровня техники. Заявляемая совокупность признаков была выявлена в результате проведенных нами многолетних исследований. Таким образом, можно сделать вывод о соответствии заявляемого технического решения критерию патентоспособности ИЗОБРЕТАТЕЛЬСКИЙ УРОВЕНЬ. Заявляемое техническое решение соответствует и критерию патентоспособности ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ, т.к. оно может быть использовано в сельском хозяйстве. И, кроме того, в ПРИМЕРЕ осуществления заявляемого способа представлены средства и методы, с помощью которых осуществлялось техническое решение в том виде, как оно охарактеризовано в независимом пункте формулы изобретения. Способ осуществляют следующим образом. Для идентификации сортов сои на основе микросателлитных (SSR) маркеров отбирают стандартным методом пробу семян исследуемого генотипа, проращивают отобранные семена и из смеси органов полученных проростков выделяют ДНК любым известным методом, осуществляют отбор и синтез праймеров по заявленным микросателлитным локусам для полимеразной цепной реакции (ПНР), по известной методике проводят амплификацию ДНК по выбранным микросателлитным локусам, полученные продукты амплификации разделяют на фракции методом электрофореза в разделяющем геле по стандартной методике, осуществляют визуализацию продуктов амплификации в лучах ультрафиолетового света, определяют длину амплифицированных фрагментов ДНК сорта с помощью стандартного маркера и выбирают присущий для сорта профиль (набор аллелей) по всем заявляемым локусам в качестве маркера для идентификации сорта, причем обеспечивают температуру отжига праймеров для микросателлитных локусов SATT 9 - 45°С, SATT 5 и SAT 1 - 55°С, а остальных шести праймеров SАТТ 1, SATT 2, SOYPR 1, SOYGY 2, SAT 36, SOYHSP 176 - 60°С. При этом выделение ДНК осуществляют из смеси всех органов не менее тридцати 5-дневных проростков, кроме их семядолей, каждого генотипа или из смеси фрагментов листьев не менее тридцати растений каждого генотипа, выращенных в поле, а разделение продуктов амплификации методом электрофореза проводят в агарозном геле, окрашенном бромистым этидием. На фиг.1 представлена фореграмма продуктов амплификации ДНК 9-и разных сортов сои по одному из локусов заявленного набора последних, с маркером; на фиг.2 - фореграмма продуктов апмлификации ДНК тех же 9-и сортов по другому локусу заявленного набора, с маркером. Пример осуществления способа Для идентификации сорта отбирали стандартным способом пробу, состоящую из 50 семян, проращивали их в рулонах фильтровальной бумаги в течение 5 суток при температуре +24°С. Выделение ДНК осуществляли стандартным методом. Из фрагментов примордиальных листьев иди корешков (смесь всех проростков) брали навеску массой 0,2 г и гомогенизировали в фарфоровой ступке с добавлением 0,9 мл лизирующего буфера (20 мМ Na EDTA; 0,1М трис-HCl, рН 8,5, 1,4 М NaCl, 20% СТАВ). Полученную массу переносили в чистую пластиковую пробирку, инкубировали при температуре 65°С в течение 60 мин, периодически перемешивая. Далее, добавляли 0,45 мл смеси хлороформа и изоамилового спирта (в соотношении 24:1 по объему) и полученную смесь перемешивали в течение 10 мин легким покачиванием, чтобы не нарушить целостность молекулы ДНК. Затем пробирки центрифугировали 5 мин при 10000 об/мин в микроцентрифуге MiniSpin plus (Германия). Верхнюю фракцию переносили в чистую пробирку. Процедуру повторяли дважды. Затем к полученному субнатанту добавляли 7 мкл раствора РНК-зы (10 мг/мл), перемешивали и инкубировали при 37°С в течение 60 мин. ДНК осаждали добавлением равного объема охлажденного до -20°С изопропилового спирта с последующим центрифугированием в течение 5 мин при 10000 об/мин. Осадок промывали дважды 80% этанолом, подсушивали при комнатной температуре 20 мин. Полученную ДНК растворяли в 100 мкл воды. Таким образом выделяли ДНК у всех анализируемых сортов. Затем проводили реакции амплификации поочередно со всеми заявленными праймерами. Полимеразную цепную реакцию (ПЦР) проводили на приборе "Терцик" (ДНК-технология, Россия) в 25 мкл реакционной смеси, содержащей: 67 мМ трис-HCl, рН 8,8; 16,6 мМ сульфата аммония; 2 мМ MgCl2 0,01% Tween 20; по 0,2 мМ дезоксирибонуклеозидфосфатов; по 10 пМ праймеров; 10 нг анализируемой ДНК и 1 ед. рекомбинантной термостабильной ДНК полимеразы. Термально-временной режим реакций: начальная денатурация при 96°С в течение 2 мин, затем 30 циклов: денатурация при 94°С - 30 сек, отжиг при 45-60°С (в зависимости от праймера) в течение 40 сек, элонгация при 70°С в течение 1 мин, финальная элонгация - 2 мин. Продукты амплификации разделяли на фракции известным методом электрофореза в окрашенном агарозном геле. Для этого использовали 2% агарозный гель на ТАЕ-буфере, содержащем 0,004 М трис-ацетата и 0,002 М ЭДТА. В качестве электродного буфера использовали 1 ТАЕ буфер. Для приготовления геля к 50 мл однократного ТАЕ-буфера добавляли 1 г агарозы, доводили смесь до кипения. Затем охлаждали колбу с горячим гелем под проточной водой до температуры 70°С, после этого добавляли 2 мкл 1% раствора бромистого этидия. Электрофорез проводили в камере для горизонтального электрофореза в течение 1,5 часа при силе тока 50 мА. Визуальное сравнение спектров анализируемых сортов проводили в ультрафиолетовых лучах. Для визуализации продуктов амплификации использовали трансиллюминатор и видеосистему с програмным обеспечением Gel Imager (ДНК-технология, Россия). Связанные с бромистым этидием фрагменты ДНК четко видны в лучах ультрафиолетового света. (фиг.1 и фиг.2). Фракции спектров отличаются по длине амплифицированных фрагментов ДНК. На фиг.1 представлена фореграмма продуктов амплификации ДНК девяти сортов сои по локусу SATT 9 с использованием фланкирующих его праймеров прямой последовательности: АТТ ACT AGA GAA ATT AGT ТТА и обратной последовательности: СТТ ACT AGG GTA ТТА АСС СТТ. На фиг.2 представлена фореграмма продуктов амплификации ДНК девяти сортов сои по локусу SOYPR 1 с использованием фланкирующих его праймеров прямой последовательности: ССА AGA GCT ACG TGC САА АТТ и обратной последовательности: GTT AGA AAA CTC CGC ССА САС. На чертежах дорожки 1-9 - фрагменты ДНК сортов сои: 1 - Лань, 2 - Лира, 3 - Фора, 4 - Валента, 5 - Дельта, 6 - Williams, 7 - РВБ, 8 - Aldana, 9 - К-4948, а также маркерная дорожка: М - маркер молекулярного веса 100bp DNA ladder. Фракции спектров отличаются по длине амплифицированных фрагментов ДНК. Формула изобретения1. Способ идентификации сортов сои на основе микросателлитных (SSR) маркеров, включающий отбор пробы семян каждого исследуемого генотипа, их проращивание, выделение ДНК из смеси органов растений каждого генотипа отдельно стандартным методом, отбор и синтез праймеров для полимеразной цепной реакции, проведение амплификации ДНК поочередно с каждым праймером, разделение продуктов амплификации на фракции методом электрофореза в разделяющем геле, визуализацию продуктов амплификации в лучах ультрафиолетового света, определение длин микросателлитных аллелей по каждому генотипу с помощью стандартного маркера, выбор присущих для каждого генотипа профилей в качестве его маркера, отличающийся тем, что амплификацию ДНК проводят по следующему набору микросателлитных локусов с использованием фланкирующих их праймеров: Микросателлитный локус Последовательность прямого и обратного праймеров SATT1 п AGT АСА TAG АТА ТТА AAG ТСТ оААА TGA TGA ACG TGA АТТ АТТ SATT2п ААТ ААТ GTG GAA ACT AAA TGG оТАА TGT GCC TAT CCT TGT СТТ SATT5п ТАТ CCT АСА GAA GAA СТА ААА АА оGTC GAT TAG GCT TGA ААТ А SATT9п АТТ ACT AGA GAA АТТ AGT ТТА оСТТ ACT AGG СТА ТТА АСС СТТ SOYPR1п CGA АСА GCT ACG TGC САА АТТ оGTT АСА GCT ACG TGC САА АТТ SOYGY 2п ААА АТТ GAA AGT GTC АСА ССС С о TTA AAA TCG ATT AAT TGG CAT GA SAT1п CTG GTG GAC TAT TGA TAC GAC С оAAC TGC GAA GAT ACT ACC CTC С SAT 36п AAA GTC ATA ACT GGC ACT CCA AGT TT оGAA CAT AAC AAT AAT AAA TAT AGC TC SOYHSP 176п TGT GGG CCA CAA AAC GTA TAG оCGT ACG TTC TAG СТА GTC TTCпричем, температура отжига праймера для микросателлитных локусов SATT 9-45°С, SATT 5 и SAT 1-55°С, а для остальных шести: SATT 1, SATT 2, SOYPR 1, SOYGY 2, SAT 36, SOYHSP 176-60°C. о TTA AAA TCG ATT AAT TGG CAT GA SAT1п CTG GTG GAC TAT TGA TAC GAC С оAAC TGC GAA GAT ACT ACC CTC С SAT 36п AAA GTC ATA ACT GGC ACT CCA AGT TT оGAA CAT AAC AAT AAT AAA TAT AGC TC SOYHSP 176п TGT GGG CCA CAA AAC GTA TAG оCGT ACG TTC TAG СТА GTC TTCпричем, температура отжига праймера для микросателлитных локусов SATT 9-45°С, SATT 5 и SAT 1-55°С, а для остальных шести: SATT 1, SATT 2, SOYPR 1, SOYGY 2, SAT 36, SOYHSP 176-60°C. 2. Способ по п.1, отличающийся тем, что выделение ДНК осуществляют из смеси всех органов не менее тридцати 5-дневных проростков, кроме их семядолей, каждого генотипа, пророщенных в рулонах фильтровальной бумаги. 3. Способ по п.1, отличающийся тем, что выделение ДНК осуществляют из смеси фрагментов листьев не менее 30-ти растений каждого генотипа, выращенных в поле. 4. Способ по п.1, отличающийся тем, что разделение продуктов амплификации методом электрофореза проводят в агарозном геле, окрашенном бромистым этидием. Популярные патенты: 2056743 Установка для выращивания пушных зверей ... проходящего сечения сопла. Поток холодного газа при температуре -20оС поступает в кожухотрубчатый теплообменник 3, где отдает свой холод раствору этиленгликоля, охлаждая его до температуры -15оС. Далее холодоноситель насосом 4 транспортируется к месту потребления холода помещения для выращивания пушных зверей 7. Здесь в воздухоохладителе 6 он контактирует с воздухом, который циркулирует в помещении, и охлаждает его до температуры +10 -5оС. Нагретый холодоноситель возвращается в теплообменник 3 для охлаждения. Воздух на входе в охладитель 6 частично подсасывается из атмосферы через заборную трубу 8. Избыток вентиляционного холодного воздуха уходит в окружающую срезу через выбросную ... 2288561 Устройство для предпосевной обработки семян растений ... семян и к неравномерности обработки семян.При большей величине длины l и ширины b электрода могут возникать электрические "пробои" между электродами, при этом в плазменной камере не удается создать плазменный разряд с необходимыми параметрами для обработки семян. Установка над транспортирующим механизмом электрода с возможностью его возвратно-поступательного перемещения относительно поверхности транспортирующего механизма позволяет оперативно изменять конфигурацию и параметры плазменного разряда в зависимости от различных видов обрабатываемых семян, с учетом их биологических и физических различий.Заявляемое устройство поясняется чертежами, где на фиг.1 показан один ... 2450501 Способ повышения плодородия почвы на склонах ... экскрементов материал, представляющий собой водопрочные, водоемкие, гидрофильные структуры глинисто-гумусный комплекс, улучшают ее водопроницаемость и тем самым позволяют поливным водам быстрее и на большую глубину проникать в почву: на 1 га культурно-поливных почв насчитывается до 15 млн. ходов дождевых червей. Последующее покрытие плодородным слоем почвы толщиной 15-35 см, в зависимости от вида выращиваемых культур, в совокупности с орошением и подачей воздуха в ячейки, обеспечивает дружные всходы и крепкую корневую систему, что значительно повышает урожайность.Таким образом, совокупность признаков заявляемого способа позволяет эффективно и недорого повысить плодородие почвы на ... 2421965 Способ возделывания зерновых колосовых культур ... S-аденозилметионин - донор метальных групп, участвует в процессах ферментативного метилирования, приводящих к образованию холина, адреналина и других биологически важных соединений. Непосредственный предшественник в биосинтезе метионина у некоторых растений и микроорганизмов - гомоцистеин (образуется из аспарагиновой кислоты). Недостаток метионина приводит к нарушению биосинтеза белков, замедлению роста и развития организма.Заявленный способ - использование метионина в качестве действующего вещества (для обработки семян из расчета 4-10 г действующего вещества на 1 тонну семян и посевов из расчета 4-10 г действующего вещества на 1 гектар посевов). Применение метионина позволяет ... 2272840 Способ молекулярного маркирования пола хмеля обыкновенного (humulus lupulus l) ... 45 мин в водяной бане при 60°С, переворачивая каждые 15 мин.2. Добавить 1 объем смеси хлороформ / изоамиловый спирт (24:1), перемешивать 10-15 мин, затем центрифугировать 10 мин при 10000 об/мин.3. К надосадочной жидкости, перенесенной в новую пробирку, добавить 0,7 объема изопропанола, центрифугировать 10 мин при 10000 об/мин.4. ДНК промыть в течение 30 мин в 500 мкл 76% этанола с 0,2М NaAc, затем 5 мин - в 100 мкл 70% этанола. Высушенную ДНК растворить в H2O mQ. Условия проведения ПЦРПолимеразная цепная реакция проводилась в амплификаторе Терцик МС2 (АО ДНК-технология, Москва). Реакционная смесь для ПЦР объемом 25 мкл включает: Taq-буфер (Силекс М) (70 мМ Трис-HCl, рН ... |
Еще из этого раздела: 2054872 Гербицидная композиция и способ борьбы с сорняками 2260943 Способ подращивания личинок осетровых рыб 2487516 Почвообрабатывающая машина 2127256 Замещенные простые оксимовые эфиры и фунгицидное, инсектицидное, арахноицидное средство 2067832 Способ борьбы с грибковыми инфекциями растений 2282959 Устройство для крепления навесного оборудования к транспортному средству 2227965 Способ возделывания бахчевых культур и устройство для его осуществления 2049387 Инкубатор индивидуального пользования 2462864 Устройство составления экономичного кормового рациона и экономичного кормления животных и птиц 2423807 Культиватор (варианты) и фреза для него |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
 2244416 по заявке
2244416 по заявке