Способ инкубации икры и выдерживания эмбрионов рыбПатент на изобретение №: 2308832 Автор: Михеев Владимир Петрович (RU), Михеева Ирина Васильевна (RU) Патентообладатель: Федеральное государственное унитарное предприятие "Всероссийский научно-исследовательский институт пресноводного рыбного хозяйства" ("ВНИИПРХ") (RU) Дата публикации: 27 Октября, 2007 Начало действия патента: 22 Декабря, 2005 Адрес для переписки: 141821, Московская обл., Дмитровский р-н, п. Рыбное, ФГУП "ВНИИПРХ", патентный отдел Изображения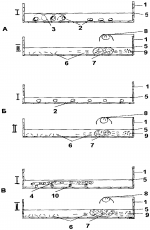 Изобретение относится к рыбоводству, предназначено для искусственного разведения рыб. Способ включает размещение и содержание икры в емкости с тонким слоем воды при соблюдении температурного и гидрохимического режима. Икру размещают в один слой, выдерживание эмбрионов, включая этап смешанного питания, проводят в той же емкости. Содержание икры и эмбрионов осуществляют в непроточной воде с периодическим покачиванием емкости и периодической сменой воды. На этапе перехода эмбрионов на смешанное питание в емкость помещают вегетирующие водные растения и проводят их круглосуточное освещение. Обеспечивается экономия водных ресурсов и снижение материальных затрат. 4 з.п. ф-лы, 1 ил. Изобретение относится к области рыбоводства и предназначено для искусственного разведения рыб преимущественно при мелкомасштабном производстве. Известны заводские способы инкубации икры и выдерживания эмбрионов рыб в проточной воде в специальных рыбоводных аппаратах, которые расположены в изолированных от внешних условий помещениях (инкубаторах, инкубационных цехах) летнего или зимнего типа. Известные способы инкубации подразделяются на два основных вида: инкубация мелкой неклейкой или обесклееннной икры, которая находится во взвешенном состоянии в токе воды, поступающей снизу (инкубационные аппараты Вейса, Чеза и др.) и инкубация крупной икры лососевых рыб и необесклеенной икры осетровых рыб, которая при инкубации находится в неподвижном состоянии (инкубационные аппараты Шустера, Коста, Вильямсона, Орава, лотковые и др.). Выдерживание свободных эмбрионов в известных способах проводят либо в бассейнах с проточной водой, либо в водоемах (Карпанин Д.П., Иванов А.П. Рыбоводство. - М.: Пищевая промышленность. - 1967. - С.56). В процессе инкубации икры и выдерживания свободных эмбрионов необходимо обеспечивать оптимальные условия их содержания: определенный уровень кислорода, температуры, гидрохимического режима и удаление продуктов обмена. Во всех существующих способах необходимые для инкубации условия осуществляются за счет непрерывной подачи воды, как правило, артезианской или водопроводной, что в свою очередь требует создания соответствующих гидротехнических сооружений. Это не всегда возможно при мелкомасштабном производстве рыбы в садках, на рыбоводных судах, частных декоративных бассейнах, малых прудовых и других хозяйствах. Наиболее близким способом того же назначения к заявленному изобретению по совокупности признаков является способ инкубации икры и выдерживания эмбрионов рыб, при котором икру размещают в лотках, скрепленных в лестничном порядке металлической рамой (лотковый инкубатор Садова-Коханской), в процессе инкубации икру содержат в тонком слое проточной воды, подаваемой сверху, а перед вылуплением свободных эмбрионов лотки с икрой помещают в бассейны с проточной водой (Привезенцев Ю.А., Власов В.А. Рыбоводство. - М.: Мир, 2004, 455 с., стр.106-107). Известный способ применяют для инкубации необесклеенной икры осетровых рыб. Икра приклеивается к лоткам и находится в состоянии неподвижности. Воду, поступающую из трубопровода, предварительно отстаивают для осаждения взвеси, освобождают от планктона и стерилизуют бактерицидной установкой. Вода самотеком проходит от верхнего лотка к нижнему, омывая на своем пути икринки, и отводится в канализацию. Перед вылуплением эмбрионов лотки с икрой помещают в бассейны с проточной водой, где в условиях постоянной проточности воды происходит появление свободных эмбрионов, их выдерживание на протяжении определенного времени, переход вначале на смешанное, а затем целиком на экзогенное питание. К причинам, препятствующим достижению указанного ниже технического результата при использовании известного способа, принятого за прототип, относится следующее. Известный способ применим только для клейкой (необесклеенной) икры и не может быть использован для неклейкой или обесклеенной икры рыб и других гидробионтов, т.к. в потоке воды икра может быть смыта из инкубационной емкости. Обеспечение необходимых условий для инкубации икры и выдерживания свободных эмбрионов, в том числе и на этапе смешанного питания, в известном способе осуществляется за счет постоянной проточности воды, что требует наличия специальной водопроводной системы. При этом водоисточник должен полностью отвечать рыбоводным требованиям к температурному, кислородному, гидрохимическому режимам. В связи с прямоточным водоснабжением необходимы значительные объемы водных ресурсов и дополнительная водоподготовка (нагрев, охлаждение воды, обогащение кислородом, корректировка отдельных показателей гидрохимического режима, стерилизация), что в условиях проточности требует специального оборудования и значительных материальных затрат. Это не всегда возможно при мелкомасштабном производстве рыбы в садках, рыбоводных судах, частных декоративных бассейнах, малых прудовых и других хозяйствах, в которых отсутствуют установки для заводского способа инкубации икры и выдерживания эмбрионов рыб классического типа. Настоящее изобретение направлено на расширение сферы применения способа, экономию водных ресурсов и снижение материальных затрат при одновременном обеспечении необходимых условий для инкубации икры и выдерживания эмбрионов рыб. Указанный технический результат достигается тем, что в способе инкубации икры и выдерживания эмбрионов рыб, включающем размещение и содержание икры в емкости с тонким слоем воды при соблюдении температурного и гидрохимического режима, особенность заключается в том, что икру размещают в один слой, выдерживание эмбрионов, включая этап смешанного питания, проводят в той же емкости, содержание икры и эмбрионов осуществляют в непроточной воде с периодическим покачиванием емкости и периодической сменой воды, а на этапе перехода эмбрионов на смешанное питание в емкость помещают вегетирующие водные растения и проводят их круглосуточное освещение. Икру предпочтительно размещать в емкости таким образом, чтобы площадь, приходящаяся на одну икринку, была не менее общей площади ее поверхности. Икру и эмбрионов желательно содержать в слое воды, толщина которого не превышает 30 мм, а над поверхностью икры составляет 5-10 мм. Покачивание емкости целесообразно осуществлять 1 раз в 3-5 часов. Смену воды в емкости предпочтительно осуществлять от одного до трех раз в сутки. Размещение икры рыб в емкости в один слой и содержание икры и эмбрионов в тонком слое непроточной воды позволяет обеспечить насыщение воды кислородом через ее поверхность путем абсорбции из атмосферы. Содержание в непроточной воде позволяет расширить сферу применения способа на икру неклейкую, обесклеенную, находящуюся в кладках, а также на яйца других гидробионтов. Для лучшего снабжения кислородом желательно, чтобы площадь емкости, приходящаяся на одну икринку, была не менее общей площади ее поверхности. При более плотном размещении икры возрастает опасность поражения ее сапролегниевыми грибами и усложняется процесс удаления из емкости мертвой и пораженной грибами икры, а при менее плотном - недостаточно эффективно используется площадь емкости. При абсорбции кислорода из атмосферы существенную роль играет площадь водной поверхности и толщина слоя воды. Чем больше поверхность воды по сравнению с ее общим объемом, тем быстрее кислород может поступать в воду. Поэтому желательно, чтобы общая толщина слоя воды не превышала 30 мм, а над поверхностью икры составляла 5-10 мм. При меньшей толщине слоя воды велика вероятность быстрого осушения икры в результате испарения воды, а при большей толщине абсорбированный кислород медленно диффундирует в толщу воды и ее насыщение кислородом будет недостаточным. Периодическое покачивание емкости в процессе инкубации и выдерживания гидробионтов проводится для ускоренного и более равномерного распределения абсорбированного из воздуха кислорода в слое воды, ликвидации застойных микрозон вокруг икры, а также отведения растворенных в воде продуктов метаболизма эмбрионов и обновления микросреды вокруг икринок. Экспериментально установлено, что покачивание емкости целесообразно осуществлять 1 раз в 2-5 часов в зависимости от вида инкубируемых объектов и стадии их развития. Периодическая смена воды в емкости необходима для поддержания нормальных для развития икры и эмбрионов гидрохимических условий и удаления поступающих в воду продуктов обмена. Смена воды в емкости на этапе инкубации и выдерживания свободных эмбрионов в обычном режиме достаточна не реже одного раза в сутки, т.к. в это время в воду поступают только растворенные продукты жизнедеятельности. При гибели икры, а также на этапе вылупления свободных эмбрионов происходит разрушение оболочек икры и в воду поступает содержимое икринок, а при переходе эмбрионов на смешанное питание в воду поступают оформленные продукты обмена эмбрионов и вносимого живого корма. В этих случаях смену воды в емкости желательно производить не реже двух - трех раз в сутки. Внесение в емкость вегетирующих водных растений на этапе перехода эмбрионов на смешанное питание приводит к дополнительному насыщению воды кислородом за счет фотосинтеза водных растений. Необходимость в дополнительном источнике кислорода за счет фотосинтеза водных растений обусловлена тем, что при внесении в емкость живого корма появляются помимо растворенных также и оформленные продукты обмена эмбрионов и кормовых беспозвоночных. При этом происходит усиление интенсивности микробиологических процессов и насыщение воды кислородом только за счет абсорбции из атмосферы становится недостаточным. Круглосуточное освещение водных растений, размещенных в емкости, усиливает фотосинтез, позволяет привлечь на свет кормовой зоопланктон в концентрации, необходимой для начала кормления эмбрионов, дает возможность увеличить продолжительность кормления в течение суток и способствует дополнительному подогреву воды для теплолюбивых объектов. Таким образом, заявляемый способ обеспечивает необходимые условия для осуществления инкубации икры и выдерживания эмбрионов рыб при одновременной экономии водных ресурсов и снижении материальных затрат на сооружение различных гидротехнических устройств для обеспечения проточности воды (систем водоподачи и водоотвода). В качестве инкубационных емкостей могут быть использованы лотки, кюветы и другие емкости, внутри которых можно располагать икру непосредственно на дне емкости, на сетчатых рамках, на субстрате и т.д. При этом значительно упрощается процесс поддержания нужного температурного режима водной среды, поскольку инкубационные емкости размещаются в помещениях с регулируемой температурой воздуха или в водоемах с нужным температурным режимом. При этом тонкий слой непроточной воды быстро приобретает необходимую температуру. Заявляемый способ может быть использован при разведении любых видов рыб и других водных организмов в мелкомасштабном хозяйстве. Таким образом, совокупность отличительных признаков обеспечивает достижение указанного технического результата. В результате проведения анализа уровня техники не обнаружены аналоги, характеризующиеся признаками, тождественными всем существенным признакам заявленного изобретения, а определение аналога-прототипа из выявленных аналогов позволяет выявить совокупность существенных по отношению к техническому результату отличительных признаков. Следовательно, заявленное изобретение соответствует условию В«новизнаВ». Дополнительный поиск других технических решений, относящихся к способам инкубации икры, показал, что изобретение не вытекает для специалиста явным образом из известного уровня техники, таким образом, заявленное изобретение соответствует условию В«изобретательский уровеньВ». На чертеже приведены схемы инкубации икры (I) и выдерживания свободных эмбрионов (II): А - судака, плотвы и стерляди (примеры 1-3); Б - карпа и линя (примеры 4, 5); В - окуня (пример 6). Сведения, подтверждающие возможность осуществления изобретения с получением указанного технического результата. Способ осуществляется следующим образом. Инкубационные емкости (1) в виде лотков, кювет, кристаллизаторов и др. устанавливают в любом помещении с регулируемым температурным режимом воздуха. Оплодотворенную икру рыб (2) размещают в один слой на дне емкости (1), либо на субстратах (3), в кладках (4), на сетчатых рамках и пр. желательно таким образом, чтобы площадь дна, приходящаяся на одну икринку, была не менее общей площади ее поверхности. Воду для залития инкубационных емкостей берут из ближайшего природного водоема, пригодного для жизни рыб и других гидробионтов, предварительно отстаивают, фильтруют через капроновое сито, удерживающее зоопланктон и крупный фитопланктон, выдерживают в помещении до приобретения температуры, необходимой для инкубации икры рыб. После этого воду заливают в емкости тонким слоем (5). Толщина слоя воды определяется исходя из размера инкубируемой икры и способа ее размещения в емкости. Вода должна полностью закрывать икринки, чтобы исключить возможность их осушения при испарении воды до очередной ее замены. Максимальный слой воды в емкости зависит от размеров приспособлений для размещения икры, конструкции емкости (например, неровности дна), горизонтальности ее размещения и других факторов, и должен быть как можно тоньше. Желательно, чтобы общая толщина слоя воды не превышала 30 мм, а над поверхностью икры составляла от 5 до 10 мм. В процессе инкубации икры и выдерживания эмбрионов емкости покачивают один раз в 2-5 часов, создавая слабое течение воды из одного конца емкости в другой и в обратном направлении. Делать это можно, например, путем однократного поднятия и опускания одного края емкости. Ежедневно не реже 1 раза в сутки основную часть воды из емкости сливают, избегая осушения икры и свободных эмбрионов, и заливают свежую воду из водоема, предварительно ее отстояв, прогрев до нужной температуры и освободив от планктона. В случае массовой гибели икры, в период вылупления свободных эмбрионов и после их перехода на смешанное питание смену воды в емкости осуществляют до трех раз в сутки. На протяжении всего времени инкубации проводят постоянные визуальные наблюдения за икрой и кладками яиц с использованием микроскопов, луп, других увеличительных приборов. При установлении начала разрушения оболочек икры при ее гибели или вылуплении эмбрионов дополнительно проводят смену воды до трех раз в сутки и удаляют из лотков оболочки икры. При обнаружении сапрофитных грибов на неоплодотворенной и погибшей икре предпринимают меры по ежедневному удалению пораженной сапролегнией икры. После завершения процесса вылупления всех эмбрионов из емкостей удаляют решетки, субстраты и другие приспособления для размещения икры. В этих же емкостях продолжают процесс выдерживания свободных эмбрионов. На этапе перехода эмбрионов на смешанное питание в емкость помещают вегетирующие водные растения (6) и проводят их круглосуточное освещение при помощи электролампы (7). Водные растения служат в качестве биогенератора кислорода. Для того чтобы вовремя начать обеспечивать свободных эмбрионов рыб кислородом за счет фотосинтеза водных растений и, в частности, точно определить начало смешанного питания, необходимо постоянно контролировать развитие свободных эмбрионов, учитывая особенности их поведения и развития в этот период. Формирование фитоценоза начинают незадолго до перехода свободных эмбрионов на смешанное питание. Для этого в емкостях размещают матрацы из водных растений и круглосуточно их освещают. В качестве фитоматрацев используют вегетирующие нитчатые водоросли, водные мхи, другие погруженные мелкие водные растения. При круглосуточном освещении их электролампой мощностью 40-60 Вт, находящейся на расстоянии 20-30 см от водной растительности, они энергично выделяют кислород. Нередко над скоплением растительности образуется пена из мелких пузырьков кислорода. За счет движения эмбрионов и личинок рыб и покачивания емкостей обогащенная кислородом вода распределяется по всей толще. Площадь, занимаемая водорослями, зависит от количества эмбрионов в емкости и должна составлять не менее 20 см2 на 1 тыс.шт. Важным моментом является процесс начала кормления свободных эмбрионов рыб. В период эндогенного питания свободные эмбрионы должны содержаться в воде, лишенной зоопланктона, который может дополнительно потреблять растворенный в воде кислород и служить источником эктопаразитов. Некоторые зоопланктеры могут нападать на эмбрионов и уничтожать их. В начале смешанного питания свободным эмбрионам дают только мелкий зоопланктон. Средних и крупных зоопланктеров из рациона изымают. Общая масса кормового зоопланктона не должна превышать 20-100 мг/л в зависимости от вида гидробионтов. При большем количестве происходит дополнительное расходование растворенного в воде кислорода, необходимого эмбрионам. При круглосуточном электрическом освещении емкости зоопланктеры (8) скапливаются в наиболее освещенной части емкости, обычно там, где расположены освещаемые водные растения, в небольшом объеме воды. Скопившийся под светом зоопланктон привлекает на кормление эмбрионов рыб (9). При этом общее количество живого корма в емкости может быть небольшим и поэтому безопасным для общего кислородного режима. Помимо этого круглосуточное освещение емкости может удлинять период кормления эмбрионов и личинок. При необходимости для теплолюбивых рыб с помощью освещения осуществляют дополнительное подогревание воды в емкости. Осуществление заявляемого способа проиллюстрировано примерами инкубации клейкой икры (судака, плотвы и стерляди), обесклеенной икры (карпа и линя), икры в слизистых кладках (окуня) и выдерживания свободных эмбрионов указанных рыб, включая период смешанного питания. Пример 1. Предлагаемым способом проведена инкубация клейкой икры и выдерживание свободных эмбрионов судака (на чертеже схема А, I - инкубация икры, II - выдерживание эмбрионов при переходе на смешанное питание). Икру судака завезли из теплого в более холодный регион (водоемы средней полосы), где не было еще благоприятных условий для нереста производителей судака в этот период. Основную часть икры инкубировали в водоеме внезаводским способом. Часть икры инкубировали предлагаемым способом. При этом в емкостях (1) разместили икру судака (2), приклеенную к субстрату в виде объемной мочалки из волокон липы (3), и залили тонким слоем непроточной воды (5). Воду брали из Пяловского водохранилища канала им. Москвы, предварительно процеживали через капроновое сито, чтобы удалить зоопланктон и крупный фитопланктон и прогрели в помещении до требуемой температуры (12-16°С). Судак имеет мелкую икру диметром не более 1,2 мм, площадь поверхности икринки составляет 6,15 мм2. За счет субстрата икра судака располагалась в разных слоях воды. На каждый квадратный сантиметр емкости размещали не более 16 икринок. Общий слой воды в емкости с учетом субстрата составлял 30 мм, слой воды над икринками, расположенными в самом верхнем горизонте, не превышал 5 мм. В период инкубации икры и на начальных этапах выдерживания свободных эмбрионов, когда эмбрионами выделялись растворенные продукты обмена, насыщение воды кислородом происходило только за счет абсорбции кислорода из воздуха. Покачивание емкости проводили 1 раз в 3 часа. Перед началом и в период смешанного питания, когда появились оформленные продукты обмена от эмбрионов рыб и живого зоопланктона, дополнительное насыщение воды кислородом стали осуществлять за счет фотосинтеза водных растений. На протяжении всего времени инкубации проводили постоянные визуальные наблюдения за икрой с помощью микроскопа. Для удаления продуктов обмена осуществляли замену воды в емкостях. Обычно воду меняли 1 раз в сутки. Два раза в сутки стали менять воду, когда началось разрушение оболочек мертвой (неоплодотворенной) икры и поступление содержимого погибших икринок в воду (у судака на 2-3 сутки при 26-39 градусо-днях). Три раза в сутки меняли воду в период вылупления из икры свободных эмбрионов судака (на седьмые - восьмые сутки при 98-113 градусо-днях). Удаление из емкостей мелкой мертвой икры, приклеенной к субстрату и находящейся внутри него, механическим способом проводить достаточно сложно. Поэтому для предупреждения развития сапролегниоза на погибшей икре сразу после размещения икры и затем через каждые 3 дня в емкость вносили препарат малахитовый зеленый, создавая нужную концентрацию лечебного раствора, выдерживая икру в нем требуемый период. Препарат подавлял развитие сапролегниевых грибов и был безопасен для икры судака. На 5-6 сутки (при 58-83 градусо-днях) началось движение эмбрионов внутри икринок. Вылупление свободных эмбрионов (6) из икры началось на седьмые и завершилось на восьмые сутки, то есть продолжалось на протяжении двух суток. После вылупления из икры всех свободных эмбрионов судака из емкостей удалили нерестовый субстрат и оболочки икры, обработка лечебными препаратами была прекращена. В природных условиях сразу после вылупления из икры свободные эмбрионы судака делают так называемую В«свечкуВ»: активно всплывают к поверхности воды водоема и затем пассивно погружаются. При этом происходит постепенный снос их вниз по течению реки. В емкостях личинки судака лишены такой возможности. Поэтому после периода активного движения на протяжении 10-15 сек они опускаются на дно и неподвижно там лежат примерно такое же время. На дне свободные эмбрионы могут находиться на боку, кверху брюхом и в нормальном для рыб положении. В этот период вопрос ликвидации застойных зон в емкости стоит менее остро по сравнению с предыдущим этапом развития эмбрионов, т.к. при ухудшении микроусловий свободные эмбрионы сами перемещаются на другое, более подходящее для них место. Поэтому покачивание емкости проводили не чаще одного раза в пять часов. Период мерцательного движения у свободных эмбрионов судака (В«свечкаВ») продолжался 7-8 дней. На 10-й-12-й день после вылупления эмбрионы стали плавать в толще воды в нормальном для рыб положении. При этом началось их смешанное питание одновременно за счет желточного мешка и внешней пищи. В конце периода эндогенного питания эмбрионов за 2-3 дня до перехода их на смешанное питание в емкости помещали водные растения (7) и круглосуточно освещали емкость в месте их расположения. Преимущественно использовали вегетирующие нитчатые водоросли, которые брали из природного водоема и размещали в емкости. Площадь, занимаемая водорослями, составляла 1/10-1/20 часть от площади емкости, а на каждую тысячу эмбрионов приходилось 10-20 см2 водной растительности. При круглосуточном освещении их электролампой (8) мощностью 60 Вт, находящейся на расстоянии 300 мм от водной растительности, они энергично выделяли кислород. В начале смешанного питания свободным эмбрионам давали только мелкий зоопланктон. Средних и крупных зоопланктеров из рациона изымали. Зоопланктон (9) вносили в емкость небольшими порциями, при этом он скапливался в освещенном пространстве в концентрации свыше 10-20 мг/л. На пищу в освещенное пространство емкости быстро собирались эмбрионы рыб. По мере выедания живого корма они вновь более или менее равномерно распределялись по емкости до очередного внесения корма. В этот период смену воды осуществляли три раза в сутки и не реже 1 раза в сутки убирали образующийся на дне емкостей осадок. На 14-16 сутки личинки судака целиком перешли на внешнее питание и их выпускали в природный водоем. Инкубация икры судака по предлагаемому способу продолжалась около 8 суток, примерно 100 градусо-дней. В водоеме, где вода была более прохладной, инкубация продолжалась более 12 суток. Вылупление эмбрионов в емкости произошло на протяжении двух суток, а в водоеме на специальном субстрате - 3 суток. Сокращенный период инкубации по предлагаемому способу уменьшил поражение икры судака сапролегнией по сравнению с открытым водоемом и увеличил выживаемость икры. Пример 2. Аналогично примеру 1 проводили инкубацию клейкой икры и выдерживание эмбрионов плотвы (на чертеже схема А, I - инкубация икры, II - выдерживание эмбрионов при переходе на смешанное питание). Для инкубации использовали лотки площадью 400 см2, установленные в помещении. Часть икры плотвы была приклеена ко дну лотка, часть - к капроновому субстрату. Плотность размещения икры в лотке была ниже, чем у судака: не более 3 шт./см2 . Это связано с тем, что икра этого вида рыб крупнее, диаметром до 3,2 мм и площадью общей поверхности более 32 мм 2. Общая толщина слоя воды составляла 30 мм, а над икринками, расположенными в самом верхнем горизонте, не превышала 5 мм. Отбор мертвой и пораженной сапролегнией икры проводили ежедневно механическим способом. Среднесуточную температуру поддерживали в пределах 16-20°С путем нагревания воздуха в помещении. В период инкубации смену воды в емкости осуществляли 1 раз/сутки, покачивание лотков проводили 1 раз в 5 часов. Остальные технологические операции были такими же, как и для судака в примере 1. При указанных температурных условиях период инкубации икры составил 6 суток, эндогенного питания свободных эмбрионов около 9 суток, смешанного питания более 3 суток. Основная гибель неоплодотворенной икры зафиксирована на 2-е сутки. При этом смену воды проводили два раза в сутки. Эмбрионы начали двигаться в икринках на 3-и сутки (при 50 градусо-днях). Вылупление свободных эмбрионов произошло на 5-6 сутки (85-105 градусо-дней). Выживаемость икры на субстрате оказалась выше, чем у приклеенной ко дну лотка, соответственно 75 и 15%. В природных условиях в отличие от судака свободные эмбрионы плотвы сразу начинают приклеиваться к любому субстрату в воде, который они при необходимости могут покидать и переплывать на другое место. В лотках свободные эмбрионы плотвы находились как в приклеенном состоянии, так и в не приклеенном на дне емкостей. На 4-е сутки после вылупления из икры (77 градусо-дней) у эмбрионов началось дыхание жабрами, на 6-е сутки (103 градусо-дня) - формирование плавательного пузыря. На 7-е сутки в лотки была помещена водная растительность, которую круглосуточно освещали. На 8-9-е сутки свободным эмбрионам стали давать мелкий зоопланктон. После перехода свободных эмбрионов на смешанное питание смену воды в емкости проводили три раза в сутки. Экзогенная пища в кишечниках появилась на 10-е сутки (166 градусо-дней). Одновременно у эмбрионов еще имелись остатки желточного мешка. В дальнейшем произошла полная резорбция желточного мешка, и эмбрионы целиком переключились на экзогенное питание, после чего их выпустили в водоем. Пример 3. Аналогично примеру 1 проводили инкубацию клейкой икры и выдерживание эмбрионов стерляди (на чертеже схема А, I - инкубация икры, II - выдерживание эмбрионов при переходе на смешанное питание). Диаметр икринок стерляди составлял 2 мм, площадь общей поверхности икринки в среднем составляла 12,6 мм2. На 1 см2 площади емкости размещали не более 8 икринок. Икру стерляди размещали в приклеенном состоянии ко дну емкости и к специальному субстрату в виде редкой мочалки из тонких капроновых нитей. Общий слой воды в емкостях составлял 30 мм, а над поверхностью икры - 10 мм. Смена воды в емкости в период инкубации проводилась 1 раз в сутки, в период повышенного отхода икры - 2 раза в сутки. Покачивание емкости проводили 1 раз в 2 часа. Мертвую икру отбирали механическим путем. Среднесуточная температура была в пределах 15-21°С. Остальные технологические операции проводили по примеру 1. При указанных температурных условиях период инкубации икры составил 7 суток, эндогенное питание свободных эмбрионов продолжалось около 8 суток, смешанное питание - более 3 суток. Гибель инкубируемой икры стерляди наблюдалась на вторые-третьи сутки, когда неоплодотворенная икра отмирала и покрывалась сапролегнией, и на шестые сутки - в период вылупления эмбрионов. В эти периоды чаще отбирали мертвую икру, смену воды проводили до 3-х раз в сутки. Вылупление из икры эмбрионов стерляди происходило на шестые сутки с начала инкубации. По окончании этого процесса из емкостей удаляли нерестовый субстрат и оболочки икринок. Вначале свободные эмбрионы стерляди, как и другие рыбы, дышат всей поверхностью тела. В состоянии покоя они лежат на дне емкости (обычно на боку) в течение примерно 6 сек, а затем перемещаются, извиваясь всем телом в течение 14 сек. На четвертые сутки после вылупления из икры эмбрионы начинают практически непрерывно двигаться, плавая в основном за счет изгибания тела. На 5-6 сутки (89-109 градусо-дней) эмбрионы начинают концентрироваться на одном месте на дне емкостей при непрерывном изгибании тела. На восьмые сутки (148 градусо-дней) эмбрионы покидают скопления, рассеиваются по емкости. На дне появляются меланиновые пробки, что указывает на начало смешанного питания. На 7-й день после вылупления эмбрионов в емкость помещали водную растительность, которую круглосуточно освещали, и при этом вносили небольшими порциями мелкий зоопланктон. Эмбрионы стерляди начинали питаться рачками при одновременном питании за счет желточного мешка. После того, как завершался процесс рассасывания желточного мешка, личинки стерляди переходили целиком на экзогенное питание и их перемещали из емкости для дальнейшего выращивания. Пример 4. Аналогично примеру 1 проводили инкубацию обесклеенной икры и выдерживание эмбрионов карпа (на чертеже схема Б, I - инкубация икры, II - выдерживание эмбрионов при переходе на смешанное питание). У карпа икра мелкая диаметром 1,5 мм и общей площадью поверхности икринки 7 мм 2, поэтому ее размещали на дне емкости из расчета не более 14 икринок на 1 см2. Толщина слоя воды в емкости составляла 20 мм, а над поверхностью икры 7 мм. Покачивание емкости проводили один раз в 3 часа, смену воды в емкости проводили в процессе инкубации один раз в сутки, а на этапе перехода на смешанное питание два раза в сутки. Поскольку при смене воды и покачивании емкости обесклеенная икра неравномерно распределялась по дну емкости, равномерное ее перераспределение осуществляли птичьим пером. Погибшую и пораженную сапролегнией икру отбирали с помощью груш, сифона или специальных небольших сачков. Все остальные технологические операции выполнялись аналогично примеру 1. Температура воды составляла 19-22°С. После вылупления свободные эмбрионы карпа лежат на дне емкости на боку (большой желточный мешок) или находятся в прикрепленном к стенкам состоянии. На четвертые сутки (78 градусо-дней) после вылупления свободные эмбрионы карпа занимают нормальное для взрослых рыб положение в пространстве благодаря наличию больших грудных плавников. Движение грудных плавников и тела синхронизировано, в момент движения эмбрион совершает резкое перемещение в пространстве, во время покоя опускается на дно. На 5-е сутки (99 градусо-дней) в плавательном пузыре появляется газ. У некоторых эмбрионов пузырьки газа появляются и в кишечнике. В этот период у эмбрионов начинается смешанное питание. Кормление проводили мелким зоопланктоном, предварительно поместив в емкость водную растительность. Смешанное питание свободных эмбрионов продолжалось более 3-х суток. Несъеденные и травмированные рачки накапливались на дне в виде осадка, который убирали из емкости один раз в сутки. В дальнейшем личинки карпа целиком перешли на экзогенное питание и их выпускали в водоем. Пример 5. Аналогично примеру 1 проводили инкубацию обесклеенной икры и выдерживание эмбрионов линя (на чертеже схема Б, I - инкубация икры, II - выдерживание эмбрионов при переходе на смешанное питание). Икра у линя мелкая диаметром 1,2 мм и площадью поверхности 4,5 мм2, поэтому ее размещали на дне емкости из расчета до 22 шт. обесклеенных икринок на 1 см 2. Толщина слоя воды составляла 20 мм, а над поверхностью икры - 5 мм. В процессе инкубации покачивание емкости проводили один раз в 5 часов, смену воды - один раз в сутки, а на этапе перехода на смешанное питание два раза в сутки. При температуре воды 21-22°С продолжительность инкубации икры составляла около 3 суток (около 70 градусо-дней). На 6-7 сутки началось смешанное питание эмбрионов, которое продолжалось несколько дней и завершилось полным переходом на экзогенное питание. У вылупившихся из икры свободных эмбрионов линя дыхание происходит поверхностью тела, рта и грудных плавников нет, глаза бесцветные. Эмбрионы в основном лежат на боку или на брюхе на дне емкости. Иногда переплывают с места на место, извиваясь всем телом. На 6 сутки (121 градусо-день) плавательный пузырь заполняется газом. К этому времени в емкость помещали водную растительность, начинали ее освещать и вносили мелких ракообразных. На 7 день (при 142 градусо-днях) начиналось смешанное питание эмбрионов линя, которое в дальнейшем становилось основным и личинок выпускали в водоем. Пример 6. Аналогично примеру 1 проводили инкубацию икры и выдерживание эмбрионов окуня (на чертеже схема В, I - инкубация икры, II - выдерживание эмбрионов при переходе на смешанное питание). Икра окуня (4), находящаяся в студенистых лентах, имеет диаметр до 3,5 мм, а площадь поверхности 38,6 мм2 . Поэтому ленты икры размещали на дне емкости на дополнительных подставках (10) при плотности из расчета не более 3-х икринок на 1 см2. Толщина слоя воды составляла 30 мм, а над поверхностью икры - 10 мм. В процессе инкубации покачивание емкости проводили один раз в 5 часов, смену воды - один раз в сутки, а на этапе перехода на смешанное питание два раза в сутки. Остальные операции проводили, как в примере 1. Инкубация икры проходила при температуре воды 10-12°С. Кладки икры окуня, взятые из природного водоема, характеризовались крайне малым количеством неоплодотворенной и погибшей икры. Поэтому каких-либо работ по профилактике сапролегниоза не проводилось. Вылупившиеся из икры свободные эмбрионы окуня имели длину 5 мм. Вначале, как и эмбрионы других рыб, они дышат всей поверхностью тела. В состоянии покоя свободные эмбрионы окуня лежат на дне емкости на боку, на спине, на брюхе. При температуре воды 15-17°С на шестые сутки после вылупления у свободных эмбрионов появилось жаберное дыхание, а на седьмые сутки жировая капля, обеспечивающая эндогенное питание, была сильно редуцирована. В это время начали перевод свободных эмбрионов на смешанное питание путем внесения мелкого зоопланктона. За день до этого в емкость поместили водоросли и начали их круглосуточное освещение. При завершении рассасывания жировой капли эмбрионы перешли полностью на внешнее питание и были выпущены в водоем. Таким образом, изложенные выше сведения свидетельствуют о том, что способ инкубации икры и выдерживания эмбрионов рыб по заявленному изобретению предназначен для искусственного разведения рыб преимущественно при мелкомасштабном производстве. Для заявленного способа в том виде, как он охарактеризован в независимом пункте изложенной формулы изобретения, подтверждена возможность его осуществления с помощью описанных в заявке средств и методов. Следовательно, заявленное изобретение соответствует условию "промышленная применимость". Формула изобретения1. Способ инкубации икры и выдерживания эмбрионов рыб, включающий размещение и содержание икры в емкости с тонким слоем воды при соблюдении температурного и гидрохимического режима, отличающийся тем, что икру размещают в один слой, выдерживание эмбрионов, включая этап смешанного питания, проводят в той же емкости, содержание икры и эмбрионов осуществляют в непроточной воде с периодическим покачиванием емкости и периодической сменой воды, а на этапе перехода эмбрионов на смешанное питание в емкость помещают вегетирующие водные растения и проводят их круглосуточное освещение. 2. Способ по п.1, отличающийся тем, что икру размещают в емкости таким образом, чтобы площадь, приходящаяся на одну икринку, была не менее общей площади ее поверхности. 3. Способ по п.1, отличающийся тем, что икру содержат в слое воды, толщина которого не превышает 30 мм, а над поверхностью икры составляет 5-10 мм. 4. Способ по п.1, отличающийся тем, что покачивание емкости осуществляют 1 раз в 2-5 ч. 5. Способ по п.1, отличающийся тем, что смену воды в емкости осуществляют от одного до трех раз в сутки. MM4A Досрочное прекращение действия патента из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 23.12.2008 Дата публикации: 10.05.2011 Популярные патенты: 2201069 Травяное покрытие на основе гибкого полотна ... в питательной смеси приведено в таблице 1. Затем подготовленную питательную смесь высыпают в одну из секций специального высевающего бункера. В другую секцию этого высевающего агрегата засыпают семена растений. На барабан, находящийся перед высевающим бункером, наматывают рулон текстильного полотна, например льноволокна. Край этого рулона закрепляют на другом ведущем барабане, играющем роль протяжного механизма. На третий барабан, находящийся над вторым, ведущим барабаном, наматывают другой рулон текстильного полотна, край которого также закрепляют на ведущем барабане. Затем включают привод высевающего бункера и ведущего барабана, при этом полотно, находящееся под высевающим ... 2189718 Пневматический высевающий аппарат ... По периметру первой накладки 13 выполнены сквозные вырезы длиной 1/4-1/3 расстояния между просасывающими отверстиями основания 10 и расположенными симметрично между просасывающими отверстиями основания. Первая накладка 13 крепится жестко на валу 9. Вторая накладка 15 на валу 9 сидит свободно, имеет равномерно распределенные по окружности присасывающие отверстия 16, располагающиеся против отверстий 14 первой накладки 13. Вторая накладка соединена с валом с помощью механизма смещения 20, 21, 18, 19. Крышка 23 имеет вакуумную камеру 8 и вспомогательную полость 24. Пневматический высевающий аппарат работает следующим образом. Крупные семена 6, расположенные в полости 3 семенной ... 2160520 Способ создания лакричных плантаций, предпочтительно солодки голой, на бросовых землях ... в последней декаде октября - первой декаде ноября. 3. Способ по п.1, отличающийся тем, что посев осуществляют сеялками с трехдисковыми сошниками без предварительной обработки почвы. MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 10.08.2001 Номер и год публикации бюллетеня: 11-2003 Извещение опубликовано: ... 2475020 Способ подбора лучших сортов опылителей для насаждений яблони ... это тем, что водорастворимые вещества пыльцы, при достаточном количестве, нейтрализуют ингибирующее действие флоризина пестиков и способствуют использованию его на рост пыльцевых трубок.Количественным показателем совместимости сортов при опылении является процент завязывания плодов опыленным сортом. При оценке сортов-опылителей лучшими опылителями считаются те сорта, которые обеспечили процент завязавшихся плодов выше, чем от свободного опыления (контроля), равный или близкий к нему. Сорта, обеспечивающие завязывание плодов ниже, чем лучшие опылители, но не менее чем 60% по отношению к контролю, выделяют в группу допустимых опылителей. Сорта, давшие процент завязывания плодов ... 2216908 Комбайн для уборки урожая с кустарников ... валы с криволинейными пальцами и горизонтальные цепные транспортеры, рабочие ветви каждого из которых размещены в активационной камере. Изобретение дает значительную экономию трудо- и энергозатрат и приводит к снижению себестоимости готовой продукции. 2 з. п. ф-лы, 2 ил. Изобретение относится к области сельского хозяйства, в частности к технике для уборки ягод, и может быть использовано для уборки урожая с ягодных кустарников, например, облепихи. Известна технология уборки урожая облепихи, по которой растения скашивают, с последующим отделением плодов от ветвей вручную в стационарных условиях (см. а.с. СССР 1644805, заявл. 20.04.89 г., кл. А 01 G 1/ 00). Удаление растений с ... |
Еще из этого раздела: 2027346 Лесозаготовительная машина 2267897 Высевающий аппарат 2238970 Штамм mycelia sterilia лх-1-продуцент комплекса биологически активных веществ, обладающих рострегуляторными свойствами 2100354 Макроциклический лактон, фармацевтическая композиция, обладающая антибиотической активностью, и инсектоакарицидная композиция 2285375 Способ обработки почвы и устройство для его осуществления 2414114 Зерноуборочный комбайн 2185045 Способ посева, устройство для его осуществления и семявысевающий аппарат конструкции ибрагимова 2456799 Ловушка для поимки животных, обитающих в земле 2420060 Способ генетической трансформации растений селекционно-ценных образцов клевера лугового 2236122 Устройство для содержания животных |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||