Способ генетической трансформации растений селекционно-ценных образцов клевера луговогоПатент на изобретение №: 2420060 Автор: Солодкая Любовь Андреевна (RU), Лапотышкина Людмила Ивановна (RU), Клименко Ирина Александровна (RU), Агафодорова Мария Николаевна (RU) Патентообладатель: Государственное научное учреждение "Всероссийский научно-исследовательский институт кормов имени В.Р. Вильямса" Российской академии сельскохозяйственных наук (RU) Дата публикации: 10 Июня, 2011 Начало действия патента: 18 Ноября, 2009 Адрес для переписки: 141055, Московская обл., г. Лобня, п/о Луговая, Научный городок, ГНУ ВИК Изображения    Образцы морфогенной ткани с побегами клевера лугового разрезают на части размером 3-5 мм, которые помещают на среду Гамборга В5 с 2 мг/л 6-бензиламинопурина. Верхнюю поверхность среза эксплантов инокулируют агробактерией. Кокультивирование осуществляют в течение 48 часов, после чего экспланты отмывают от остатка агробактерий на среде Гамборга В5 того же состава с добавлением 50 мг/л канамицина и 500 мг/л цефотаксима. Регенерацию растений с корнями производят на среде того же состава, но без цефотаксима при отсутствии проявления агробактериальной инфекции. Затем посредством ПЦР-анализа проверяют наличие встроенных генов и осуществляют контроль сохранения селекционно-ценных признаков исходных образцов. 5 ил., 1 табл. Изобретение относится к области сельского хозяйства и может быть использовано в селекции растений для направленного создания исходного селекционного материала клевера лугового с хозяйственно-ценными признаками методом генетической трансформации, а также в исследованиях по физиологии, фитопатологии и генетике растений. Известен способ регенерации растений клевера лугового при генетической трансформации [1], включающий культивирование трансформированной морфогенной культуры клевера на питательной среде Гамборга В5 с добавлением канамицина и цефотаксима, причем морфогенную культуру получают без образования дедифференцированной ткани путем культивирования гипокотиля на питательной среде Гамборга B5 с 4,0 мг/л 6-бензиламинопурина, 1,0 мг/л кинетина и 0,05 мг/л К недостаткам способа относится то, что он ограничен описанием особенностей регенерации растений при генетической трансформации. В литературе имеются сведения о способе генетической трансформации растений клевера лугового в культуре тканей in vitro [2], который включает инокулирование поверхности эксплантов, помещенных на среду Гамборга В5 без антибиотиков культурой агробактерий, кокультивирование в течение 48 часов, дальнейшее культивирование отмытых от агробактерий экс-плантов на среде Гамборга B5 с 50 мг/л канамицина в присутствии элиминирующего агробактерий антибиотика, регенерацию растений. Регенерацию трансформированных растений осуществляли из каллусных тканей, образующихся из черешков молодых листочков растений, выращенных в условиях теплицы. К недостаткам данного способа можно отнести следующее: 1) в экспериментах регенерацию трансформированных растений осуществляли из каллусных культур, что значительно увеличивает риск возникновения нежелательной сомаклональной изменчивости и, как следствие, возможное изменение селекционных признаков у исходного материала; 2) использование в экспериментах эксплантов с растений, выращиваемых в теплице, значительно увеличивает затраты на поддержание соответствующего режима выращивания в течение года и борьбу с вредителями и болезнями; 3) создание реципиентных систем на основе растений, не прошедших предварительный отбор на регенерационную способность (PC) неоправданно увеличивает число вариантов опыта за счет необходимости закладки параллельно вариантов контроля PC и субкультивирования их на протяжении всего процесса генетической трансформации. Цель изобретения - разработка способа генетической трансформации для направленного изменения по одному или нескольким целевым признакам растений клевера лугового селекционно-ценных образцов. В предлагаемом способе поставленная цель достигается тем, что генетическая трансформация включает инокулирование поверхности эксплантов, помещенных на среду Гамборга В5 без антибиотиков, культурой агробактерий, кокультивирование в течение 48 часов, дальнейшее культивирование отмытых от агробактерий эксплантов на среде Гамборга В5 с 50 мг/л канамицина в присутствии элиминирующего агробактерии антибиотика, регенерацию растений и ПЦР-анализ наличия встроенных генов. Инокуляцию осуществляют путем нанесения агробактерии шпателем на поверхность разреза частей размером 3-5 мм морфогенной ткани с побегами, помещенных на среду Гамборга В5 с 2 мг/л 6-бензиламинопурина, с последующей регенерацией растений in vitro методом прямой регенерации, без образования каллусной ткани, и ПЦР-анализа ДНК, выделенной из молодых асептических листочков и черешков растений-регенерантов in vitro, образовавших корни в присутствии селективного фактора канамицина в концентрации 50 мг/л, и контроля сохранения селекционно-ценных (кислотоустойчивость) признаков исходного образца. Способ осуществляется следующим образом. Морфогенные культуры с небольшими побегами, имеющие высокую PC, разрезали на части величиной 3-5 мм, помещали срезом вверх на агаризованную питательную среду Гамборга В 5 с 2 мг/л 6-бензиламнопурина (БАП) без цефотаксима и канамицина и инокулировали ночной культурой штаммов агробактерии, несущих различные генетические конструкции с маркерным (канамицинустойчивость) и целевыми генами. Инокулюм наносили шпателем только на поверхность срезов, исключая попадание его на поверхность среды. Через 5 дней инкубирования инокулированные экспланты трижды отмывали от агробактерии стерильной водой и помещали на агаризованную питательную среду Гамборга B5 того же состава, но с добавлением 500 мг/л цефотаксима и 50 мг/л канамицина. Субкультивирование на свежую среду проводили через каждые 3-4 недели, при этом клафоран добавляли в среду, постепенно снижая его концентрацию с 500 мг/л до 0 мг/л до полной элиминации агробактерии. Канамицин в концентрации 50 мг/л добавляли в продолжении всего процесса трансформации и поддержания in vitro коллекции трансформированных морфогенных культур и побегов. ДНК выделяли из молодых асептических листочков растений-регенерантов, образовавших in vitro корни в присутствии 50 мг/л канамицина, методом Эдвардса с предварительной проморозкой при -20°С. ПЦР анализ проводили с праймерами, изготовленными фирмой SYN-TOL. Пример 1. Генетическая трансформация растений клевера лугового сортообразца Ранний 2. Для генетической трансформации использовали генотипы клевера лугового с высокой PC, и показавшие высокую устойчивость к ионам алюминия при оценке in vitro, в вегетационном и полевом опытах. 20 морфогенных культур каждого генотипа с небольшими побегами, разрезанные на части величиной 3-5 мм, помещали срезом вверх на среду Гамборга B5 с 2 мг/л БАП и инокулировали ночной культурой агробактерии. В опытах использовали штамм Agrobacterium tumefaciens LGV 3850 и штамм A. rhizogenes A4, содержащие векторные плазмиды pK22ac и pK22rs с маркерным геном npt11 (гены ас-ар и rs-ap - гены синтеза дефензинов амаранта и редьки, повышающие устойчивость к корневым гнилям). Через 5 суток инокулированные морфогенные культуры трехкратно промывали стерильной дистиллированной водой. Излишек воды удаляли, промакивая морфогенные культуры между слоями стерильной фильтровальной бумаги, и затем помещали их на свежую агаризованную среду того же состава, но с добавлением 50 мг/л канамицина (селективного фактора для отбора клеточных культур клевера лугового с встроенными генами npt11) и 500 мг/л цефотаксима для подавления роста агробактерии. Канамицин добавляли в среды в продолжение всего процесса трансформации и поддержания in vitro коллекции трансформированных морфогенных культур клевера лугового. Субкультивирование на средах с цефотаксимом проводили каждые 3-4 недели, снижая постепенно его концентрацию до 0 мг/л до полной элиминации агробактерии. На фиг.1 представлен вид сверху на зеленые растения-регенеранты с корнями и без корней, на фиг.2 - то же, вид с обратной стороны, на фиг.3 хлорофиллдефектные побеги. Пример 2. ПЦР - анализ наличия встраиваемых генов. Подтверждение наличия генов nptII (маркерный), ас-ар (целевой) в полученных растениях определяли методом ПЦР. При этом очень важным моментом является то, что растения выращивались на среде Гамборга без добавления клафорана (пефотаксима), что исключало из анализа нетрансгенные растения, дающие положительный результат по ПЦР за счет остаточной контаминации агробактериями. В связи с тем, что в исследуемых растениях могут присутствовать собственные гены пептидных антибиотиков с последовательностями ДНК, гомологичными введенным трансгенам, для идентификации трансгенных растений методом ПЦР мы использовали праймеры, комплементарные промоторной области 35S вируса мозаики цветной капусты и концевому участку гена ас-ар. Были проанализированы растения из следующих вариантов опыта.  1 LGVac2 1 LGVac2 2 LGVac15П 2 LGVac15П 3 A4rsI 3 A4rsI  4 A4rs6 4 A4rs6 6 A4acI200 6 A4acI200 7 A4rs21 I 7 A4rs21 I  8 A4rs21 II 8 A4rs21 II  9 A4rs6 I 9 A4rs6 I  10 P8 - контроль, нетрансформированное растение. 10 P8 - контроль, нетрансформированное растение. Геномная ДНК для анализа была выделена из листовой ткани асептически выращенных растений методом Эдвардса с предварительной проморозкой при -20°С. Для ПЦР-анализа использовали праймеры, изготовленные фирмой SYNTOL. На фиг. 4 представлены результаты ПЦР-анализа растений клевера лугового с праймерами npt1/npt2 и плазмидой pK22rs (t отжига 50°С) лунки: 1 и 14-маркер молекулярной массы; 2-вода, 3-плазмида pK22rs, 4 - плазмида pK22rs+ДНК исходного образца (контроль-Р8), 5 - ДНК исходного образца P8; 6-13 - ДНК растений-трансформантов ( ПЦР-анализ с праймером npt1/npt2 при температуре отжига 50°С показал амплификацию всех тестируемых образцов, кроме На фиг.5 представлены результаты ПЦР-анализа с праймерами 35S/ac растений клевера лугового, трансформированных штаммом, содержащим вектор с геном ас (t отжига 52°С) лунки: 1 - маркер молекулярной массы, 2 - вода, 3 - плазмида pK22ac, 4 - pK22ac+ДНК исходного образца (контроль - Р8), 5 - ДНК исходного образца (Р8), 6-8 ДНК растений-трансформантов ( При ПЦР-анализе исследуемых образцов на наличие целевого гена дефензина амаранта (ас) установлено, что при использовании комбинации праймеров 35S/ac при температуре отжига 52°С наблюдали амплификацию образцов, трансформированных штаммом агробактерии с геном дефензина амаранта при отсутствии амплификации в контрольном нетрансгенном растении (фиг.5 - дорожки 6, 7, 8, образцы LGVac2; LGVac15П; A4acl 200). Таким образом, показано наличие встраиваемых генов в геноме изученных образцов клевера лугового. Пример 3. Кислотоустойчивость морфогенных культур клевера лугового на агаризованной питательной среде Гамборга В5 с 50 мг/л ионов алюминия. Все трансформированные морфогенные культуры клевера лугового сохраняли признак кислотоустойчивости на агаризованной питательной среде Гамборга В5 с 50 мг/л ионов алюминия после длительного (в течение более чем 56 пассажей) культивирования на среде с селективным фактором канамицином. Результаты представлены в таблице. Таблица Кислотоустойчивость трансгенных морфогенных культур клевера лугового Генотип Показатели устойчивости к 50 мг/л Al3+ Средняя масса, мг % Средняя длина, мм % побегов корней побегов корней исходныхтрансгенных исходных трансгенныхисходных трансгенных исходныхтрансгенных A4rsK711-2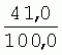 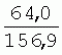 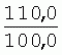 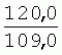 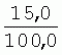 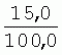  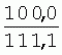 A4rs21 I A4rs21 I     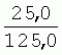  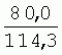 LGVac15П LGVac15П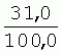 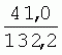  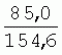    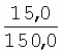 LGVac2 LGVac2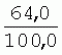 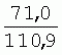  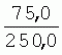 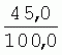 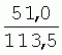   Изученные клоны 4-х генотипов клевера лугового сохранили признак устойчивости к Al3+ на уровне исходных форм, а клоны 3-х генотипов A4rs21 I, LGVac15П, LGVac2 даже существенно превышали их по массе образовавшихся корней 72,1; 54,6 и 125% соответственно. При этом длина корней была больше лишь у двух генотипов (LGVac15П и LGVac2). Существенное превышение массы морфогенной ткани отмечалось у клонов A4rs21 I (на 93,4%). Средняя масса побегов трансгенных клонов превышала таковую исходных образцов у 3-х генотипов A4rsK7 11-2, A4rs21 I и LGVac15П на 56,9; 38,5 и 32,2% соответственно. Таким образом, полученные данные, и в том числе, по способности к ризогенезу изученных клонов на селективной среде, свидетельствуют о сохранении признака кислотоустойчивости растениями-регенерантами в процессе генетической трансформации. Разработанный способ генетической трансформации растений селекционно-ценных образцов клевера лугового позволяет получать растения-регенеранты со встроенными генами - маркерным (канамицинустойчивость) и целевым (ген синтеза дефензина амаранта, повышающим устойчивость растений к корневым гнилям). Кроме того, использование при генетической трансформации способа прямой регенерации растений, исключающего возникновение сомаклональной изменчивости, позволяет 1) сохранять селекционно-ценные признаки исходного образца (кислотоустойчивость), 2) поддерживать в культуре in vitro более 50 пассажей трансгенные морфогенные культуры с высокой регенерационной способностью, 3) получать неограниченное количество трансгенных растений-регенерантов. Нанесение инокулюма только на поверхность среза облегчает последующие процедуры по элиминации агробактериальной инфекции морфогенной ткани. Использование для ПЦР-анализа ДНК, выделенной из листовой ткани асептических растений-регенерантов, образовавших корни на среде с 50 мг/л канамицина, позволяет выявлять трансгенные растения на более ранних этапах культивирования до высадки в почву. Источники информации 1. Солодкая Л.А., Агафодорова М.Н., Куренина Л.В., Лапотышкина Л.В. Способ регенерации растений клевера лугового при генетической рансформации. / Патент на изобретение RU 2. Michael L. Sullivan, Kenneth H. Quesenberry Red Clover (Trifolium pratense) // Methods in Molecular Biology, vol.343: Agrobacterium Protocols, 2/e, volume 1. Edited by: Kan wang, Humana Press Inc., Totowa, N1, p.369-383. Формула изобретенияСпособ генетической трансформации растений селекционно-ценных образцов клевера лугового, включающий инокулирование поверхности эксплантов, помещенных на среду Гамборга B5 без антибиотиков, культурой агробактерий, кокультивирование в течение 48 ч, дальнейшее культивирование отмытых от агробактерий эксплантов на среде Гамборга B5 с 50 мг/л канамицина в присутствии элиминирующего агробактерии антибиотика, регенерацию растений и ПЦР-анализ наличия встроенных генов, отличающийся тем, что инокуляцию осуществляют путем нанесения агробактерий шпателем на поверхность разреза частей размером 3-5 мм морфогенной ткани с побегами, помещенных на среду Гамборга В5 с 2 мг/л 6-бензиламинопурина, с последующей регенерацией растений in vitro методом прямой регенерации, без образования каллусной ткани, и ПЦР-анализа ДНК, выделенной из молодых асептических листочков растений-регенерантов in vitro, образовавших корни в присутствии селективного фактора канамицина в концентрации 50 мг/л, и контроля сохранения селекционно-ценных (кислотоустойчивость) признаков исходного образца. Популярные патенты: 2228024 Способ профилактики мастита у коров и устройство для его осуществления ... сложность конструкций и ограниченность их действий, что не позволяет повысить локальный иммунитет вымени животного, обеспечивающий профилактику мастита.Наиболее близким по функциональной и технической сущности является способ профилактики мастита у коров и устройство для его осуществления (см. патент РФ № 2173515, кл. А 01 J 7/04; А 61 Н 23/00, 2001 г.), где осуществляется воздействие низкочастотной ультразвуковой воздушной среды на поверхность вымени, сосков и основание сосков после обмывания или сдаивания в течение 1-10 мин 2-3 раза в неделю в зависимости от физиологического состояния вымени, а устройство содержит чашевидный корпус с излучателем низкочастотных ультразвуковых ... 2274986 Способ посева семян трав и кустарников для создания пастбищ на опустыненных землях и почвообрабатывающее орудие для его осуществления ... механизации технологического процесса заделки семян и поделки влагосборных углублений (лунок). Наиболее близким техническим средством решения проблемы посева семян трав и кустарников на опустыненных землях относится почвообрабатывающее орудие, содержащее балластную емкость с днищем, раму с продольными и поперечными брусьями и установленный под брусьями цилиндрический каток, снабженный локальными деформаторами почвы и растительного покрова, в котором оно снабжено установленным спереди катка и под балластной емкостью двухъярусным ножом, соединенным шарнирами и гидроприводом с продольными брусьями рамы, пневматическими опорными колесами, размещенными на брусьях рамы за катком, ... 2498561 Способ тандемного возделывания сельскохозяйственных культур для повышения производства пищевых зерновых культур ... таблиц и чертежей Таблица 1 показывает влияние времени посева на урожай зерна хлебопекарной пшеницы Triticum aestivum сорта Pusa-Gold и горчицы Brassica juncea сорта Agrani в зимнем раби сезоне культивирования в Нью Делхи, сезон 2006-2007.Таблица 2 показывает продолжительность посева культуры и уборки урожая в случае тандемного возделывания культуры соответственно с урожаем зерна, сезон 2006-07. Таблица 3 показывает влияние времени посева на урожай зерна пшеницы Triticum aestivum сорта Pusa-Gold в зимнем раби сезоне культивирования в Нью Делхи, сезон 2007-2008.Таблица 4 показывает продолжительность посева культуры и уборки урожая в случае тандемного возделывания культуры ... 2254705 Способ уплотнения и герметизации консервируемых кормов в рулонах ... По разметочным линиям площадки погрузчик подъезжает к платформе и опускает рулон на стояк (фиг.4) до касания с опорой 9. Благодаря разметочным линиям (не показаны) облегчается совмещение центра рулона с осью стояка, при этом допускается несовмещение до 0,1 диаметра рулона.На рулон надевают колпак 10, края его закручивают и герметично затягивают зажимом 25 (фиг.5). Затем открывают кран 14, из рулона вакуум-насосом 23 отсасывают воздух и под колпаком через 1,5...2 минуты создается разрежение около 0,8 кг/см2. За счет разницы давлений снаружи и внутри рулона на его поверхность действует удельное давление около 0,8 кг/см2. При диаметре рулона 1,5 м и длине 1,2 м общее давление на ... 2245614 Устройство для очистки вороха в зерноуборочном комбайне ... транспортную доску 1. Там он частично разделяется: в нижней части вороха - более тяжелые компоненты, а сверху - более легкие.При сходе в концевой зоне 2 с транспортной доски легкие примеси: измельченная солома, полова, обмолоченные колосья всасываются через входное окно 3 в аспирационный канал 4. Для поддержания постоянного воздушного потока в аспирационном канале 4 расположена осадочная камера 5, в этом месте канал расширяется, скорость уменьшается и примеси осаждаются в камере. При этом камера является аккумулятором разрежения. При накоплении примесей в камере клапан 7 автоматически открывается и примеси выгружаются на переднюю часть днища 6 копнителя. Пыль и очень легкие примеси ... |
Еще из этого раздела: 2488263 Система механической подачи недомолота для вторичного обмолота на возвратную доску 2172085 Способ управления групповым вождением машин 2197082 Установка для охлаждения молока с использованием естественного холода 2257713 Способ производства пестицида (варианты) 2440708 Комбинированное устройство для ротационного внутрипочвенного рыхления 2175833 Охладитель молока с аккумулятором холода 2422377 Биоцидный концентрат 2164741 Устройство для заготовки древесины 2090040 Машина для возделывания корнеклубневых культур 2019938 Рабочий орган почвообрабатывающей машины |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
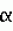 -нафтилуксусной кислоты с дальнейшей пересадкой эксплантов на свежую среду того же состава с 2,0 мг/л 6-бензиламинопурина, а эпикотильную часть проростков сохраняют путем культивирования на среде Гамборга B5 без гормонов или путем микроразмножения на среде того же состава с добавлением 2 мг/л 6-бензиламинопурина. Морфогенные культуры в процессе генетической трансформации сохраняют способность к регенерации растений и ризогенезу до 24-го пассажа и более на питательной среде Гамборга B5 с 50 мг/л канамицина. Полученные из гипокотильных эксплантов морфогенные культуры по генетическим и морфологическим признакам не отличаются от исходных генотипов.
-нафтилуксусной кислоты с дальнейшей пересадкой эксплантов на свежую среду того же состава с 2,0 мг/л 6-бензиламинопурина, а эпикотильную часть проростков сохраняют путем культивирования на среде Гамборга B5 без гормонов или путем микроразмножения на среде того же состава с добавлением 2 мг/л 6-бензиламинопурина. Морфогенные культуры в процессе генетической трансформации сохраняют способность к регенерации растений и ризогенезу до 24-го пассажа и более на питательной среде Гамборга B5 с 50 мг/л канамицина. Полученные из гипокотильных эксплантов морфогенные культуры по генетическим и морфологическим признакам не отличаются от исходных генотипов.