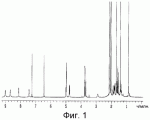
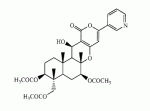
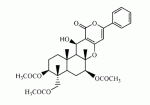
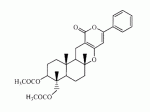
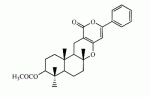
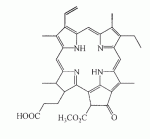
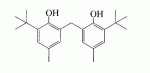
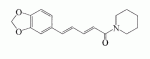
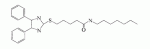
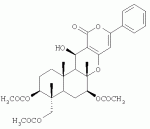
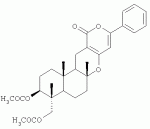
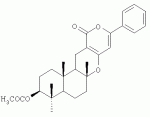
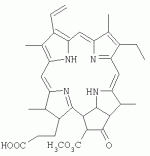
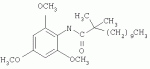
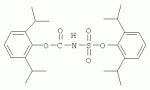
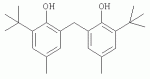
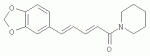
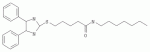
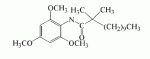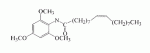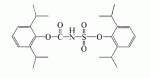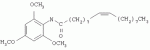Инсектицидные композиции, содержащие соединения, обладающие ингибирующей активностью против ацил соа: холестеринацилтрансферазы, или их соли в качестве эффективных ингредиентовПатент на изобретение №: 2305403 Автор: КИМ Янг-Коок (KR), ЛИ Хиун-Сун (KR), РХО Мун-Чуал (KR), КИМ Сунг-Ук (KR) Патентообладатель: КОРЕЯ РИСЕРЧ ИНСТИТЬЮТ ОФ БАЙОСАЙЕНС ЭНД БАЙОТЕКНОЛОДЖИ (KR) Дата публикации: 20 Января, 2006 Начало действия патента: 11 Декабря, 2003 Адрес для переписки: 129010, Москва, ул. Б.Спасская, 25, стр.3, ООО "Юридическая фирма Городисский и Партнеры", пат.пов. Е.Е.Назиной, рег. № 517 Изображения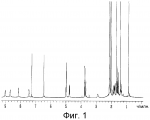 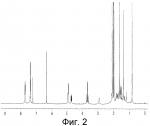 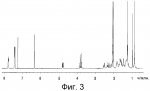 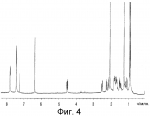 Описывается инсектицидная композиция, содержащая соединение, обладающее ингибирующим действием на ацил СоА, или его соли, где соединением является одно или более из группы, включающей соединения, представленные формулами 2-11 в качестве эффективного ингредиента. Соединения обладают инсектицидной активностью против личинок насекомых и могут применяться в качестве безопасных и эффективных инсектицидов. 1 з.п. ф-лы, 9 ил. Данное изобретение относится к применению некоторых соединений и их солей, обладающих ингибирующим действием на активность ацил СоА:холестеринацилтрансферазы (АСАТ), в качестве инсектицидов. Синтетические органические инсектициды широко применяются для повышения урожая сельскохозяйственных культур, уничтожая вредных насекомых, особенно в лесах. Однако продолжительное и неправильное применение таких инсектицидов в течение нескольких десятилетий привело к разрушению биологической защитной системы использования естественных врагов, аномальному размножению вредных насекомых или развитию сопротивляемости к инсектицидам, развитию токсичности в не целевых организмах, включая человека, загрязнению окружающей среды и так далее. Из-за побочных эффектов постепенно уменьшилось применение синтетических органических инсектицидов и, в частности, их применение в быту в 2004 году снизилось на 50% по сравнению с применением в 1993 году. Поэтому существует острая необходимость в разработке новых инсектицидов для улучшения урожайности сельскохозяйственных продуктов. Кроме того, мировой рынок биологических препаратов увеличился на более чем 5 триллионов корейских вон, и также ожидается увеличение рынка бытовых биологических инсектицидов до около 94 миллиардов корейских вон. Более того, с учетом развития биоинжиниринговых технологий, прогнозируется еще большее увеличение рынка инсектицидов. Инсектициды попадают в насекомых через ротовую полость, кожу и дыхальца. Когда инсектициды попадают на целевое насекомое, некоторые из них разлагаются и становятся нетоксичными, в то время как другие активируются, становятся более токсичными и аккумулируются в органах или выделяются из организма. При нанесении инсектицида на насекомое только часть применяемого инсектицида оказывает инсектицидное действие на мишень. Обычно, из-за существования нескольких факторов, препятствующих попаданию инсектицида на мишень в организме насекомого, только часть применяемого инсектицида достигает места воздействия и разрушает физиологические и биохимические функции насекомых, в конечном счете, убивая насекомое. Поэтому при применении или разработке инсектицидов в значительной степени учитываются места их воздействия, механизмы действия и метаболизм, влияющий на их эффективные концентрации в организме насекомого. Имеющиеся в настоящее время инсектициды классифицируют по образу действия на нервные яды, но которые влияют на трансмиссию нервных импульсов вдоль аксона, ингибиторы энергообразования, регуляторы роста насекомых и половые феромоны. Регуляторы роста насекомых подразделяются на ингибиторы ювенильных гормонов и ингибиторы синтеза хитина. Нервные яды убивают насекомых путем аномальной стимуляции, возбуждения или ингибирования нервной системы. Нейрон, минимальная единица, которая составляет нервную систему, обычно имеет одно длинное тонкое волокно, выступающее из тела клетки, называемое аксон. Через свой конец аксон вступает в контакт с дендритом или другим нейроном, образуя специализированную структуру, называемую В«синапсВ». Нервный импульс передается вдоль аксона. Когда нервный импульс достигает конца аксона, нейространсмиттер, ацетилхолин (далее обозначенный как В«AChВ») немедленно высвобождается из синаптических везикул в синапс между пресинаптической и постсинаптической мембранами. Высвобожденный ACh связывается со своим рецептором в постсинаптической мембране, стимулируя постсинаптический нейрон. Таким образом, нервный импульс передается от одного нейрона к другому нейрону. Сразу же после трансмиссии нервного импульса из пресинаптической мембраны в постсинаптическую мембрану ACh, высвобожденный из синаптической везикулы, гидролизуется ацетилхолинэстеразой (далее обозначенной как В«AChEВ»), которая выделяется из постсинаптической мембраны. AChE имеет два вида действия: образование сайта, ответственного за разрушение отрицательно заряженных ионов и сложных эфиров, и гидролиз ACh. Поэтому когда ACh аккумулируется в постсинаптической мембране в месте связывания с его рецептором после трансмиссии нервного импульса в постсинаптическую мембрану, могут возникать чрезмерные возбудимость и конвульсии. Поэтому ACh превращается в холин и уксусную кислоту под воздействием AChE. Холин передается в пресинаптическую мембрану для повторного использования и превращается в ACh в синаптических везикулах. В связи с этим, когда инсектициды, ингибирующие активность AChE в отношении разложения ACh, которые в основном являются фосфорорганическими соединениями и карбаматами, применяют для борьбы с насекомыми, ACh начинает аккумулироваться в синапсе, и трансмиссия нервных сигналов становится аномальной, тем самым, вызывая конвульсии, паралич и, в конечном счете, смерть. Известно, что инсектициды на основе фосфорорганических соединений и карбаматов ингибируют разложение ACh в основном воздействуя на активный сайт AChE. Эти химические соединения относительно быстро проникают в насекомое через кожу, присоединяясь к поверхности нервной системы, и вызывают сбой в системе трансмиссии нервных импульсов и, после определенного латентного периода, симптомы аномального поведения, избыточной нервной активности, тяжелые конвульсии и, в конечном счете, паралич и смерть. Регуляторы роста насекомых убивают насекомых путем вмешательства в синтез хитина и, следовательно, в образование кутикулы насекомого, и классифицируются на ингибиторы ювенильных гормонов и ингибиторы синтеза хитина. Обычно насекомые детоксифицируют абсорбированные инсектициды, переваривая их с помощью различных ферментов, связанных с окислением, восстановлением, гидролизом и подобным. Однако некоторые инсектициды получают еще большую токсичность при метаболизме. Это изменение называется "активацией", и инсектициды активируются, в основном, реакциями окисления. Насекомые имеют твердую внешнюю оболочку тела (экзоскелет) вместо кожи. В отличие от кожи позвоночных, экзоскелет насекомых имеет структурные функции, такие как поддержание формы тела, поддержка мускулов и твердость, и имеет различный химический состав. Экзоскелет (или кутикула) должен сбрасываться насекомым при росте. Таким образом, образование кутикулы является очень важным для роста насекомых. Экзоскелет насекомых (кожа) представляет собой многослойную структуру с тремя функциональными областями: кутикула, эпидермис и основная мембрана. Кутикула может быть разделена на два слоя: эпикутикула и прокутикула. Хитин, который отсутствует у позвоночных, является основным компонентом кутикулы. Синтез хитина является основной целью при осуществлении намерения убить насекомое и ингибируется особенно инсектицидами, ингибирующими сбрасывание оболочки насекомыми, что, в конечном счете, убивает насекомое. Прокутикула экзоскелета насекомого содержит большое количество хитина, который представляет собой линейный полимер N-ацетилглюкозаминовых единиц. В отличие от нервных ядов, при линьке ингибиторы попадают в насекомое через ротовую полость или рыльце, кутикула насекомого не образуется нормально, и, таким образом, блокируется линька насекомого. Ингибиторы линьки ингибируют биосинтез хитина во внутреннем слое эндокутикулы в прокутикуле, не влияя на образование эпикутикулы, состоящей из отвержденных белков. Хотя подробный механизм их действия не идентифицирован, известно, что ингибиторы линьки ингибируют фермент, связанный с биосинтезом хитина, который является основным компонентом прокутикулы, ингибируя полимеризацию UDP-N-ацетилглюкозамина. Половые феромоны также применяют для уничтожения насекомых. Обычно самцов насекомых ловят с применением привлекающих самцов феромонов, выделяемых самками насекомых, и, в конечном счете, убивают. Однако половые феромоны не являются эффективными на поле. Некоторые инсектициды действуют посредством физического удушения вредителей, покрывая их кожу эмульсией машинного масла. Однако современные инсектициды в основном влияют на нервную систему или ферменты, связанные с энергообразованием, которое является существенным для поддержания жизнедеятельности насекомого. В частности, были разработаны и применяются на практике инсектициды, воздействующие на функции, специфические для насекомых, например, ингибируют биосинтез образования хитина, образующего слой кутикулы, или блокируют образование ювенильных гормонов. Физиология насекомых описана многими исследователями. Недавние исследования были сфокусированы на ферментах или рецепторах, связанных с метаболизмом и на воздействие на них молекулярными биологическими методами. В результате таких исследований было обнаружено, что холестерин у насекомых требуется для образования мембраны плазмы и восков в кутикуле, а также для транспорта липидов в крови или лимфе. Холестерин может быть заменен 22-дегидрохолестерином или 7-дегидроэргостерином, и данные соединения, таким образом, называют "альтернативными соединениями". Однако альтернативные соединения не могут применяться для синтеза гормонов линьки у насекомых. Липидные компоненты у насекомых являются слабо гидрофильными, и поэтому тяжело переносятся между тканями через кровь или лимфу. Насекомые решают эту проблему с помощью транспортных белков. Фосфолипиды, холестерин, углеводороды, ювенильные гормоны и даже липидные материалы, получаемые из питания или проникающие через оболочку тела, переводятся в состояние связывания для переноса белков. В частности, ювенильные гормоны присутствуют в состоянии связывания для переноса или связывания белков в крови или лимфе. Связующие белки служат в качестве носителей для ювенильных гормонов, а также защищают ювенильные гормоны от атаки неспецифических эстераз. Однако специфические к ювенильным гормонам эстеразы могут разрушать ювенильные гормоны независимо от их связывания со связывающими белками. Поэтому титр ювенильного гормона в крови или лимфе определяется в соответствии с его количеством, выделяемым аллатумом тела, и активностью эстераз ювенильных гормонов. Аллатум тела, секретирующий ювенильные гормоны, демонстрирует периодическое действие во время развития личинки и воспроизводства на взрослых стадиях, и его высокая активность в секреции гормонов имеет тесное отношение к изменению его объема. При высокой активности клетки аллатума тела, секретирующие гормоны, развиваются при увеличении внутриклеточных органелл в цитозоле. В некоторых источниках описано, что ювенильные гормоны насекомых подавляют метаморфоз насекомых, и насекомые, таким образом, линяют при снижении титра ювенильного гормона. Многие исследователи изучили физиологию насекомых, особенно ферменты или рецепторы, связанные с метаболизмом, с применением методов молекулярной биологии. Однако транспорт гормонов и сохранение стерина изучались очень редко. Так как насекомые не способны синтезировать стерины, которые им необходимы как один из жизненно важных питательных элементов. Большинство насекомых используют стерины растений, превращая их в холестерин. Холестерин требуется для биосинтеза гормонов линьки, а также участвует в образовании мембраны плазмы вместе с фосфолипидами. С другой стороны, известно, что ингибиторы ацил СоА:холестеринацилтрансферазы оказывают влияние на профилактику и лечение гипертензии у человека. В частности, в настоящее время идет их разработка как терапевтических агентов для гипертензии, которые имеют новый механизм действия, связанный с механизмом приступов атеросклероза. Ацил СоА:холестеринацилтрансфераза, которая катализирует ацилирование холестерина, участвует в абсорбции холестерина в тонком кишечнике, синтез VLDL (липопротеинов очень низкой плотности) в печени, и аккумулирование холестерина в ацилированной форме в жировых тканях и стенках кровяных сосудов. Также известно, что ацил СоА:холестеринацилтрансфераза вовлечена в развитие атеросклероза и применяется с целью развития агентов для лечения гипертензии с новым образом действия. Репрезентативными примерами ингибиторов ацил СоА:холестеринацилтрансферазы являются химически синтезированная мочевина, амиды и фенолы. Среди них некоторые образцы лекарственных средств, прошедших тесты на активность in vivo, в настоящее время проходят предклинические исследования для применения в качестве терапевтических агентов для атеросклероза. Однако в настоящий момент нет отчетов относительно клинического применения ингибиторов ацил СоА:холестеринацилтрансферазы. Основываясь на том факте, что насекомым для роста и репродукции в основном требуются стерины, авторы данного изобретения обнаружили, что насекомые погибают, если ингибируется стерин-ацилирующий фермент, участвующий в хранении или транспорте стеринов, и разработали новые безопасные инсектициды, которые способны убивать насекомых посредством недавно идентифицированного механизма действия. Проводя исследования для данного изобретения, с учетом новой концепции ингибирующей мишени, стерин-ацилирующего фермента, который играет критическую роль в образовании стеринов для сохранения различных гормонов во время метаболизма стерина на стадии личинки насекомого, авторы данного изобретения обнаружили, выделили и очистили новые соединения с инсектицидным действием из природных источников, и определили их молекулярные структуры. С помощью системы исследований в соответствии с данным изобретением был проведен анализ того, оказывают ли выделенные соединения и другие синтетические органические соединения ингибирующее действие на активность ацил СоА:холестеринацилтрансферазы. Инсектицидные исследования, проводимые на двух личинках насекомых, позволили сделать открытие, что соединения, которые обладают ингибирующей активностью по отношению к указанному выше ферменту, могут убивать личинки. Поэтому объектом данного изобретения является применение соединений, обладающих ингибирующим действием на активность ацил СоА:холестеринацилтрансферазы, или их солей в качестве эффективных ингредиентов инсектицида. Указанные выше и другие объекты, характеристики и преимущества данного изобретения будут более понятны из представленного ниже подробного описания вместе с сопутствующими чертежами, в которых: на фигуре 1 представлен 1Н-ЯМР спектр пирипиропена А (формула 1) в соответствии с данным изобретением; на фигуре 2 представлен 1Н-ЯМР спектр фенилпиропена А (формула 2) в соответствии с данным изобретением; на фигуре 3 представлен 1Н-ЯМР спектр фенилпиропена В (формула 3) в соответствии с данным изобретением; на фигуре 4 представлен 1Н-ЯМР спектр фенилпиропена С (формула 4) в соответствии с данным изобретением; на фигуре 5 представлен 1Н-ЯМР спектр феофорбида А (формула 5) в соответствии с данным изобретением; на фигуре 6 представлен график, показывающий инсектицидное действие пирипиропена А в соответствии с данным изобретением против личинок Plutella xylostella L; на фигуре 7 представлен график, показывающий инсектицидное действие соединений формул 5-11 в соответствии с данным изобретением против личинок Plutella xylostella L; на фигуре 8 представлен график, показывающий влияние фенилпиропена А, В и С в соответствии с данным изобретением на потерю массы личинками Tenebrio molitor L, и на фигуре 9 представлена фотография, показывающая инсектицидную активность пирипиропена А, фенилпиропена А и С и феофорбида в соответствии с данным изобретением против личинок Tenebrio molitor L, где степень роста личинок сравнивают с контрольной группой. Для достижения указанной выше цели, данное изобретение представляет инсектицидную композицию, содержащую соединения, обладающие ингибирующим действием на ацил СоА:холестеринацилтрансферазу, или их соли, в качестве эффективных ингредиентов. Подробное описание данного изобретения представлено ниже. В данном изобретении представлена инсектицидная композиция, содержащая соединение, обладающее ингибирующей активностью против ацил СоА:холестеринацилтрансферазы, или его соли, в качестве эффективного ингредиента. В данном изобретении подробно представлена инсектицидная композиция, содержащая в качестве эффективного ингредиента соединение, выбранное из группы, включающей соединения, представленные формулами 1-11 ниже. [Формула 1] [Формула 2] [Формула 3] [Формула 4] [Формула 5] [Формула 6] [Формула 7] [Формула 8] [Формула 9] [Формула 10] [Формула 11] Соединения формул 1-11 могут быть получены химическим синтезом или экстракцией из растений или микроорганизмов. Среди соединений в соответствии с данным изобретением, соединения формул 1-4 получают способом, включающим культивирование Penicillium griseofulvum F1959, экстрагирование культивированных клеток этилацетатом и хроматографию полученного экстракта. Этилацетатный экстракт, полученный из Penicillium griseofulvum F1959, подвергают хроматографии с получением соединений формул 1-4. На стадии хроматографии, предпочтительно, применяют хроматографию на колонке с силикагелем с последующей высокоскоростной жидкостной хроматографией. Предпочтительно, при проведении хроматографии на колонке с силикагелем в качестве растворителя используют смесь хлороформа и метанола, а при проведении высокоскоростной жидкостной хроматографии в качестве растворителя используют смесь ацетонитрила и воды. Соединения формул 1-11 обладают ингибирующей активностью против ацил СоА:холестеринацилтрансферазы, и благодаря такому действию обладают инсектицидной активностью против личинок насекомых. В экспериментальных примерах, представленных ниже, основываясь на том факте, что насекомые в значительной степени нуждаются в стеринах для роста и в значительной степени используют стерин-ацилирующие ферменты, участвующие в поддержании и транспорте стеринов и активации и разрушении гормонов, оценивают соединения в соответствии с данным изобретением для определения их инсектицидного действия. Было обнаружено, что данные соединения обладают инсектицидной активностью, ингибируя ацил СоА:холестеринацилтрансферазу, которая участвует в сохранении и транспорте стеринов во время метаболизма стеринов. Соединения в соответствии с данным изобретением, которые обладают ингибирующей активностью против ацил СоА:холестеринацилтрансферазы, могут применяться для контроля вредных насекомых, включая вредных членистоногих (например, вредных насекомых и вредных клещей) и вредных нематод. Кроме того, соединения в соответствии с данным изобретением могут применяться для эффективного контроля вредных насекомых, имеющих повышенную сопротивляемость к обычным инсектицидам. В случае применения в качестве эффективных ингредиентов инсектицидной композиции соединения в соответствии с данным изобретением, без добавления других ингредиентов, могут применяться сами по себе или в виде их солей (приемлемые в сельском хозяйстве соли с неорганическими кислотами, такими как хлористоводородная кислота или серная кислота, или органическими кислотами, такими как п-толуолсульфоновая кислота). Однако соединения в соответствии с данным изобретением обычно смешивают с твердыми носителями, жидкими носителями, газообразными носителями или приманками, или их абсорбируют в основные материалы, например, пористые керамические пластины или нетканые волокна, к которым добавлены поверхностно-активные вещества, и, при необходимости, другие добавки, и затем из них получают различные формы, например, масляные спреи, эмульгируемые концентраты, смачиваемые порошки, текучие гранулы, дусты, аэрозоли, дымящие композиции, такие как туманы, испаряемые композиции, коптящие композиции, ядовитые приманки, и листовые или полимерные композиции для контроля клещей. Каждая из представленных выше композиций может содержать одно или более соединений в соответствии с данным изобретением в качестве эффективного ингредиента в количестве от 0,01 до 95% масс. Твердые носители, применяемые в композициях, могут включать тонкоизмельченные порошки или гранулы или глины (например, каолин, диатомовую землю, бентонит, фубасами и кислую глину), синтетический гидрированный оксид кремния, тальк, керамику, другие неорганические минералы (например, силикат, кварц, серу, активированный уголь, карбонат кальция и гидрированный диоксид кремния) и химические удобрения (например, сульфат аммония, фосфат аммония, нитрат аммония, мочевину и хлорид аммония). Жидкие носители могут включать воду, спирты (например, метанол, этанол и т.д.), кетоны (например, ацетон и метилэтилкетон), ароматические углеводороды (например, толуол, ксилол, этилбензол и метилнафталин), алифатические углеводороды (например, гексан, циклогексан, керосин и светлые нефтепродукты), сложные эфиры (например, этилацетат и бутилацетат), нитрилы (например, ацетонитрил и изобутиронитрил), простые эфиры (например, диизопропиловый эфир и диоксан), кислые амиды (например, N,N-диметилформамид и N,N-диметилацетамид), галогенированные углеводороды (например, дихлорметан, трихлорэтан и четыреххлористый углерод), диметилсульфоксид и растительные масла (например, соевое масло и хлопковое масло). Газообразные носители или пропелленты могут включать газ фреон, газ бутан, СНГ (сжиженный нефтяной газ), диметиловый эфир и газообразный диоксид углерода. Основные материалы для ядовитых приманок могут включать компоненты приманки (например, порошки злаков, растительные масла, сахариды и кристаллическую целлюлозу), антиоксиданты (например, дибутилгидрокситолуол и нордигидрогуайаретовая кислота), консерванты (например, дегидроуксусная кислота), агенты, предотвращающие случайное поедание детьми отравленных приманок (например, порошки красного перца) и аттрактанты (например, запах сыра и лука). Примеры поверхностно-активных веществ могут включать алкилсульфаты, алкилсульфонаты, алкиларилсульфонаты, простые алкилариловые эфиры и их полиоксиэтиленированные производные, простые полиэтиленгликолевые эфиры, сложные эфиры многовалентных спиртов и спиртовые производные сахаров. Примеры других вспомогательных агентов, таких как адгезивные агенты и диспергаторы, включают казеин; желатин; полисахариды, такие как крахмал, аравийская камедь, производные целлюлозы и альгиновой кислоты; производные лигнина; бентонит; сахариды; и синтетические растворимые в воде полимеры, такие как поливиниловый спирт, поливинилпирролидон и полиакриловые кислоты. Кроме того, в качестве вспомогательных агентов могут применяться стабилизаторы, включая РАР (фосфат изопропиловой кислоты), ВНТ (2,6-ди-трет-бутил-4-метилфенол), ВНА (смесь 2-трет-бутил-4-метоксифенола и 3-трет-бутил-4-метоксифенола), растительные масла, минеральные масла, поверхностно-активные вещества, жирные кислоты и сложные эфиры жирных кислот. В случае применения соединений в соответствии с данным изобретением в качестве сельскохозяйственных пестицидов, акарицидов или нематоцидов, их наносят в количестве обычно от 0,1 до 100 г на площадь 10 акров. Если композиции, такие как эмульгируемые концентраты, смачиваемые порошки или текучие гранулы применяют после разбавления водой, концентрация нанесения обычно составляет от 1 до 100000 ч/млн. Гранулы, дусты и подобные наносят без разбавления. Если соединения в соответствии с данным изобретением применяют в качестве пестицида, акарицида или нематоцида для предотвращения эпидемии, эмульгируемые концентраты, смачиваемые порошки, текучие гранулы и другие композиции применяют после разбавления водой до 0,1-500 ч/млн, но масляные спреи, аэрозоли, дымящие композиции, ядовитые приманки, противоакарицидные пластины и подобные применяют как таковые. Если соединения в соответствии с данным изобретением применяют в качестве пестицида или акарицида для контроля эктопаразитов у животных, например, сельскохозяйственного скота, такого как коровы и свиньи, и домашних животных, таких как кошки и собаки, соединения и их соли применяют в ветеринарии известными системными методами контроля паразитов, например, пероральным введением в виде таблеток, капсул, микстур, болюсов, корма и суппозиториев; парентеральным введением, например, инъекциями; или кожным введением, например, в виде распыления масляного или водного раствора, купанием или точечным нанесением; или известными несистемными методами с применением формованных изделий, таких как воротники или ушные метки (бирки). В таких случаях соединения в соответствии с данным изобретением применяют в количестве от 0,01 до 100 мг на кг тела животного. Соединения в соответствии с данным изобретением могут применяться в виде смеси или индивидуально, но одновременно с пестицидной композицией и способом в соответствии с данным изобретением могут применяться другие инсектициды, нематоциды, акарициды, репелленты, фунгициды, гербициды, регуляторы роста растений, синергисты, удобрения, агенты, улучшающие почву и/или корм для животных. ПРИМЕРЫ Более подробно данное изобретение объясняется в представленных ниже примерах и сопутствующих чертежах. Однако примеры представлены только с целью иллюстрации данного изобретения, и данное изобретение не ограничено примерами. Пример 1: Получение соединений, обладающих ингибиторным действием на ацил СоА:холестеринацилтрансферазу Получение соединений, обладающих ингибиторным действием на активность ацил СоА:холестеринацилтрансферазы (1) Penicillium griseofulvum F1959, используемую в данном изобретении, выделяют из почвы, собранной в Ульсан, Гуйонгсангбук-до, Корея, идентифицируют как В«Penicillium griseofulvumВ» посредством микологических исследований, и помещают в КСТС (Корейская коллекция типов культур) в KRIBB, Корея, и присваивают инвентарный номер КСТС 0387ВР. Используя замороженный штамм (10% глицерин, -80°С) выделенного гриба готовят культуру для посева инокулированием в 1-литровую колбу Эрленмейера с отражательной перегородкой, содержащую 100 мл среды для посева: 0,5% глюкозы, 0,2% экстракта дрожжей, 0,5% полипептона, 0,1% К2НРО 4, 0,05% MgSO4·7H 2O (стерилизованного после доведения рН до 5,8), с последующим инкубированием при энергичном перемешивании при температуре 29°С в течение 18 часов. 20 мл первой культуры инокулируют в 5 л колбу Эрленмейера с отражательной перегородкой, содержащую 1 л следующей культурной среды: 2% растворимого крахмала, 0,4% сойтона, 0,3% Pharmamedia, 0,1% К2НРО 4, 0,05% MgSO4·7H 2O, 0,3% CaCO3, 0,2% NaCl (стерилизованного после доведения рН до 5,8), и выращивают при энергичном перемешивании при температуре 29°С в течение 120 часов. (2) Ферментативный бульон культуры, полученный на стадии (1) выше, экстрагируют равным объемом этилацетата (EtOAc) при перемешивании. Образец экстрагированного этилацетатом образца концентрируют под давлением, получая маслянистый коричневый экстракт. Полученный экстракт подвергают хроматографии на колонке с силикагелем (хлороформ:метанол=99:1, 98:2, 97:3, 95:5, 90:10% об/об, 4 объема по сравнению с силикагелем). Фракции анализируют для определения распределения соединений с помощью тонкослойной хроматографии, фракции с одинаковыми соединениями объединяют и исследуют на ингибиторную активность против ацил СоА:холестеринацилтрансферазы. Фракции с ингибиторным действием собирают, элюируют смесью хлороформ/метанол (от 95:5 до 90:10% об/об) и элюаты концентрируют под давлением с получением желтовато-коричневого маслянистого экстракта. (3-1) Желтовато-коричневый экстракт подвергают высокоскоростной жидкостной хроматографии с получением активной фракции, содержащей соединение пирипиропена (формула 1). Высокоскоростную жидкостную хроматографию проводят на колонке OSD (20×250 мм), от YMC Company, имеющей детектор ультрафиолетового излучения, где соединение пирипиропена определяют при 322 нм. Соединение пирипиропена, а именно пирипиропен А (формула 1), элюируют из колонки OSD с использованием растворителя ацетонитрил:вода (45:55 по объему) со скоростью потока 8 мл/минута в течение 11 минут. Активную фракцию концентрируют под давлением и очищают еще раз, получая бесцветные кристаллы, пирипиропен А (формула 1). Выход соединения составляет 13 мг на ферментацию в 1 литре среды в течение 120 часов. (3-2) Также, активные фракции, содержащие соединения в соответствии с данным изобретением формул 2-4, получают, подвергая коричнево-желтый экстракт, полученный на стадии (2), высокоскоростной жидкостной хроматографии. Высокоскоростную жидкостную хроматографию проводят на колонке OSD (20×250 мм), от YMC Company, имеющей детектор ультрафиолетового излучения, где соединение пирипиропена определяют при 320 нм. Фенилпиропен А (формула 2), фенилпиропен В (формулы 3) и фенилпиропен С (формула 4) элюируют из колонки OSD с использованием растворителя ацетонитрил:вода (75:25 по объему) со скоростью потока 8 мл/минута в течение 15 минут, 26 минут и 49 минут соответственно. Каждую активную фракцию концентрируют под давлением и очищают еще раз, получая бесцветные аморфные кристаллы, фенилпиропен А (формула 2), фенилпиропен В (формулы 3) и фенилпиропен С (формула 4). Фенилпиропен А, В и С получают с выходом 2,9 мг, 3 мг и 3,1 мг соответственно на ферментацию в 1 литре среды в течение 120 часов. Определение молекулярных структур соединений в соответствии с данным изобретением, обладающих ингибиторным действием на метаболизм стерина у насекомых (1) Спектроскопия в видимом ультрафиолете Анализ в видимом ультрафиолете проводят для определения молекулярной структуры соединений, полученных хроматографией. Подробно полученные кристаллизованные соединения растворяют в 100% метаноле и анализируют для определения длины волн, соответствующих пикам абсорбции, с использованием спектрометра видимого ультрафиолета (Shimadzu Company, UV-265). В результате соединения демонстрируют максимальную абсорбцию при 232 и 322 нм в УФ-спектре, что показывает наличие в соединениях пиридина или фенильного кольца. (2) Инфракрасная спектроскопия Инфракрасную (ИК) спектроскопию проводят следующим образом. 2 мг каждого полученного кристаллизованного соединения растворяют в хлороформе, наносят на AgBr окно, сушат и анализируют на спектрометре BioRad FT/IR (BioRad Digilab Division, FTS-80). В результате соединения демонстрируют пики абсорбции около 3550 см-1, 1740 см -1 и 1702 см-1. ИК-спектр абсорбции указывает на наличие групп ОН, групп С=О, групп С=О соответственно в органических соединениях. (3) Масс-спектрометрия Для определения молекулярной массы соединений проводят масс-спектрометрию с высоким разрешением с использованием масс-спектрометра VGZAB-7070. В результате было найдено, что пирипиропен А (формула 1), фенилпиропен А (формула 2), фенилпиропен В (формула 3), фенилпиропен С (формула 4) и феофорбид А (формула 5) имеют молекулярную массу 583, 581, 508, 450 и 592, соответственно. (4) Анализ ЯМР ЯМР-анализ проводят для определения молекулярной структуры кристаллизованных соединений. 10 мг каждого кристаллизованного соединения полностью сушат, растворяют в CDCl 3, помещают в 5-мм ЯМР-трубку и анализируют с использованием ЯМР-спектрометра Varian Unity-500. 1Н-ЯМР-спектр получают при 500,13 МГц. Результаты представлены на фигурах 1-4. Молекулярные структуры соединений формул 1-4 определяют с применением тестов (1)-(4). Экспериментальный пример 1: Исследование активности соединений в соответствии с данным изобретением в отношении АСАТ Оценивают ингибиторную активность соединений в соответствии с данным изобретением против ацил СоА:холестеринацилтрансферазы (далее обозначенную как В«АСАТВ») с применением метода, разработанного Бречером, с незначительными изменениями (Brecher. P and C. Chen, Biochimica Biophysica Acat 617:458-471, 1980). Согласно данному методу активность в отношении АСАТ определяют с применением микросом печени в качестве источника АСАТ с субстратами холестерина и 14С-меченной олеоил-СоА. Радиоактивность продукта реакции сложного эфира холестерина оценивают как активность в отношении АСАТ. Подробно, получают реакционную смесь следующим образом. Холестерин и Triton WR-1339, растворенные в ацетоне, суспендируют в воде и после удаления ацетона в газообразном азоте добавляют калий-фосфатный буфер (рН 7,4, конечная концентрация: 0,4 М). Для стабилизации реакции ферментов к смеси добавляют сывороточный бычий альбумин до конечной концентрации 30 мкМ. Затем к смеси добавляют образец, растворенный в ДМСО. Полученную реакционную смесь предварительно инкубируют при температуре 37°С в течение 30 мин. Затем ферментную реакцию инициируют добавлением раствора [1-14C]-олеоил коэнзима А до конечной концентрации 0,04 мкКи. Через 30 мин инкубирования при температуре 37°С реакцию останавливают добавлением 1 мл раствора изопропанол-гептан. Затем к полученной реакционной смеси добавляют 0,6 мл н-гептана и 0,4 мл КВР буфера. Смесь хорошо перемешивают и дают отстояться при комнатной температуре в течение 2 минут. После разделения фаз 200 мкл надосадочной жидкости помещают в сцинтилляционную пробирку. После добавления в пробирку 4 мл сцинтилляционного коктейля (Lipoluma, Lumac Co.) количество синтезированного олеата холестерина измеряют на сцинтилляционном счетчике (Packard Delta-200). Ингибиторную активность против АСАТ рассчитывают согласно следующему уравнению 1: Ингибиторная активность (%)=[1-(Т-В/С-В)]×100, где Т: имп/мин в тестируемой реакционной смеси, которая содержит соединение в соответствии с данным изобретением вместе с источником фермента; С: имп/мин в контрольной реакционной смеси, которая не содержит соединение, но содержит источник фермента; и В: имп/мин в другой контрольной реакционной смеси, которая не содержит источник фермента, но содержит данное соединение. В результате пирпиропен А (формула 1) имеет значение IC 50 (IC50: концентрация соединения, необходимая для ингибирования 50% активности АСАТ) 35 нг/мл, значение IC50 рассчитано при 0,060 нМ, так как данное соединение имеет молекулярную массу 583. Фенилпиропен А (формула 2) имеет значение IC50 500 нг/мл, значение IC50 рассчитано при 86 нМ, так как данное соединение имеет молекулярную массу 581. Фенилпиропен В (формула 3) имеет значение IC 50 6,5 мкг/мл, значение IC50 рассчитано при 12,8 мкМ, так как данное соединение имеет молекулярную массу 508. Фенилпиропен С (формула 4) имеет значение IC 50 7,2 мкг/мл, значение IC50 рассчитано при 16,0 мкМ, так как данное соединение имеет молекулярную массу 450. Феофорбид А (формула 5) имеет значение IC 50 1,3 мкг/мл, значение IC50 рассчитано при 2,2 мкМ, так как данное соединение имеет молекулярную массу 592. Кроме того, при применении в концентрациях 20 мкг/мл и 100 мкг/мл соединения формул 6-11 демонстрируют активность против АСАТ 92,4% и 99,2%; 96,6% и 97,8%; 84,5% и 93,8%; 93,4% и 98,4%; 17,6% и 82,0%; и 84,8% и 89,6% соответственно. Экспериментальный пример 2: Исследование ингибиторной активности соединений в соответствии с данным изобретением против личинок Plutella xylostella L. Личинки Plutella xylostella L используют в качестве экспериментального насекомого в данном тесте, их получают от Insect Research Lab, Korean Research Institute of Bioscience and Biotechnology (KRIBB), Oun-dong, Yusong-ku, Taejon, Korea. После аккуратного взвешивания соответствующие количества соединений в соответствии с данным изобретением, обладающих ингибиторной активностью против АСАТ, растворяют в ацетоне, смешивают с девятью объемами 100 ч/млн исходного раствора Triton X-100 и периодически разбавляют, получая активные растворы соединений. Готовят питание для роста личинок P. xylostella L следующим образом: листья капусты одинакового роста разрезают на диски (3,0 см в диаметре), погружают в растворы активных соединений на 30 секунд и сушат под навесом в течение 60 минут. Каждый из пропитанных активным соединением дисков помещают в чашку Петри (55×20 мм) с диском фильтровальной бумаги. Затем 10 личинок второй возрастной стадии P. xylostella L помещают на каждый листовой диск с помощью мягкой щеточки, которая не повреждает личинки, и выращивают в инкубаторе (25±1°С, 40-45% относительная влажность, 16L:8D). Через 24 часа и 48 часов записывают показатели смертности. Контрольную группу не обрабатывают активными соединениями в соответствии с данным изобретением, но выращивают на листовых дисках, обработанных 10% смесью ацетона и девяти объемов 100 ч/млн исходного раствора Triton X-100. Такое биологическое исследование на листовых дисках проводят три раза и LC 50 (50% летальной концентрации) рассчитывают по методу Пробита, усовершенствованному Финнеем (1982). Как показано на фигуре 6, если личинки P. xylostella L обрабатывают от 0,001 до 1 мг пирипиропена А (формула 1), среди соединений в соответствии с данным изобретением, обладающих ингибиторной активностью против АСАТ, и инсектицидную активность соединения оценивают с интервалом 24 часа, пирипиропен А показывает постоянное инсектицидное действие в зависимости от дозы, по сравнению с контрольной группой. Как показано на фигуре 7, если личинок P. xylostella L обрабатывают 1 мг каждого соединения формул 5-11, и инсектицидную активность соединений оценивают с интервалом в 24 часа, соединения с высокой in vitro ингибиторной активностью против АСАТ демонстрируют сильное инсектицидное действие, в то время как соединения с относительно низкой ингибиторной активностью против АСАТ показывают слабое инсектицидное действие, по сравнению с каждой контрольной группой. Такие результаты показывают, что in vitro ингибиторная активность соединений против АСАТ коррелируется с их инсектицидным действием. Экспериментальный пример 3: Исследование ингибиторной активности соединений в соответствии с данным изобретением против личинок Tenebrio molitor L. Среди соединений в соответствии с данным изобретением с ингибиторной активностью против АСАТ, фенилпиропен А, В и С (2-4) тестируют на снижение массы у личинок насекомых. В данном тесте в качестве экспериментального насекомого используют личинки Tenebrio molitor L, которые получают из лаборатории по исследованию насекомых KRIBB, Корея. Здоровые личинки второй возрастной стадии (10-12 мм) Tenebrio molitor L отбирают в течение 24 часов перед проведением теста. Каждое из соединений формул 2-4 растворяют в 10% ацетоне до конечной концентрации 1 мг/мл и периодически разбавляют. 1 мл разбавленного раствора соединения смешивают с 1 г пшеничных отрубей, обычно используемых в качестве корма. Полученную смесь помещают в стеклянную чашку Петри (90×20 мм) и чашку Петри помещают в эксикатор на приблизительно 2 часа под давление для удаления органического растворителя. После взвешивания 10 наиболее подвижных личинок Tenebrio molitor L на каждый тест помещают в чашку Петри (87×15 мм) с фильтровальным бумажным диском, вместе со смесью соединения в соответствии с данным изобретением и пшеничных отрубей. Затем личинки выращивают при температуре 25±1°ри относительной влажности 40-45% при 16-часовом светлом/8-часовом темном цикле. Через 72 часа массу и питание личинок фиксируют каждые три дня. Это исследование проводят три раза и контрольную группу обрабатывают 10% ацетоном. Результаты представлены на фиг.8 и 9. Как показано на фиг.8, если личинки Tenebrio molitor L обрабатывают 1 мг фенилпиропена А, В или С (формулы 2-4), смешанным с 10 г пшеничных отрубей и массу личинок фиксируют на 3 и 7 день, соединения демонстрируют постоянное снижающее массу действие по сравнению с контрольными группами. Кроме того, когда Tenebrio molitor L обрабатывают 1 мг пирипиропена А (формула 1), фенилпиропена А и С (формулы 2 и 4) или феофорбида А (формула 5), где каждый из них смешан с 10 г пшеничных отрубей, оценивают ингибирующее рост действие соединения. Как показано на фиг.9, ингибирование роста личинок имеет место у всех личинок Tenebrio molitor L, обработанных данными соединениями. В частности, при обработке пирипиропеном А с высокой ингибиторной активностью против АСАТ, большинство насекомых Tenebrio molitor L погибает на стадии личинок и куколок, и некоторая их часть погибает от преждевременного образования куколок. Кроме того, при обработке другими соединениями, свыше 50% насекомых Tenebrio molitor L погибает на стадии личинок и куколок, а у выживших личинок наблюдается ингибирование роста, и количество выживших личинок значительно снижается. Более того, выжившие личинки менее подвижны по сравнению с контрольной группой. Эти результаты показывают, что соединения в соответствии с данным изобретением обладают ларвицидным действием через ингибирование роста личинок. Как описано выше, данное изобретение относится к инсектицидным композициям, содержащим соединения, обладающие ингибиторной активностью против АСАТ, или их соли в качестве эффективных ингредиентов. Соединения, обладающие ингибиторной активностью против АСАТ, оказывают превосходные инсектицидное действие, ингибируя метаболизм стерина у вредных насекомых. Поэтому соединения в соответствии с данным изобретением могут применяться в качестве безопасных и эффективных инсектицидов. Кроме того, некоторые из соединений, имеющих ингибиторную активность против АСАТ, могут быть легко получены из Penicillium griseofulvum F1959. Формула изобретения1. Инсектицидная композиция, содержащая соединение, обладающее ингибирующим действием на ацил СоА:холестеринацилтрансферазу, или его соли, где соединением является одно или более из группы, включающей соединения, представленные формулами 2-11 в качестве эффективного ингредиента: [Формула 2]
[Формула 3]
[Формула 4]
[Формула 5]
[Формула 6]
[Формула 7] [Формула 8]
[Формула 9]
[Формула 10]
[Формула 11] 2. Инсектицидная композиция по п.1, в которой соединения формул 2-4 получают способом, включающим: культивирование Penicillium griseofulvum F1959; экстрагирование культивированных клеток с этилацетатом и хроматографию полученного экстракта. Популярные патенты: 2229783 Способ посева семян трав и кустарников для создания пастбищ ... посева семян трав и кустарников для создания аридных пастбищ, включающий образование локальных углублений деформацией верхнего слоя почвы, высев семян и их заделку, отличающийся тем, что каждое локальное углубление имеет эвольвентные боковые поверхности, образованные перемещением плоскости по направляющей, в качестве которой использована циклоида, описываемая параметрическими уравнениями вида x=R(-Sin); у=R(1-Cos), где R - радиус качения окружности, точки которой образуют циклоиду; - угол поворота производящей окружности циклоиды, при этом величина угла отклонения касательной к кривой профиля локального углубления в точке его пересечения с горизонтом верхнего слоя ... 2464765 Сепарирующее устройство корнеклубнеуборочной машины ... Задачей предлагаемого изобретения является снижение повреждаемости картофеля при сепарации.Техническим результатом изобретения является создание равномерно-направленного потока корнеклубнеплодов на сепарирующем полотне, исключающего защемление клубней между боковыми стенками, обеспечивающего целостность картофеля.Поставленная задача и указанный технический результат достигаются тем, что сепарирующее устройство корнеклубнеуборочной машины, содержащее установленное на раме полотно просеивающего пруткового элеватора, снабжено упругими элементами ограничения контакта корнеклубнеплодов с рамой, выполненными в виде прутков овального сечения, которые расположены вдоль полотна ... 2250602 Широкозахватный колесный дождеватель ... на трубопроводе подвижно и связаны с ним через накопитель крутящего момента пружинного типа; накопитель крутящего момента выполнен в виде жестко соединенного с колесом упругого стержня, связанного с регулируемым по длине радиуса колеса и закрепленным на стойке трубопровода упором (SU, авторское свидетельство №1007612 А, М.кл.3 А 01 G 25/09. Дождевальная установка /А.В.Новоселов (СССР),- заявка №3312508/30-15; заявлено 06.07.1981; опубл. 30.03.1983, Бюл. №12 // Открытия. Изобретения. - 1983. - №12).К недостаткам данной дождевальной установки относятся сложность конструкции и низкая эксплуатационная надежность.Наиболее близким аналогом к заявленному объекту относится колесный ... 2139657 Инсектицидная композиция ... тетраметрин, пиперонилбутоксид и растворитель, согласно изобретению дополнительно содержит 0,0- диметил-0-(2,2-дихлорвинил) фосфат, 2,5 фурандион, дигидро-3- (тетрапропенил) и углеводородный пропеллент а в качестве растворителя углеводородный или спиртовый растворитель, при следующем соотношении компонентов, мас.%: 0,0-диметил-0-(2,2 дихлорвинил) фосфат - 0,05 - 1,00 тетраметрин - 0,01 -0,60 перметрин - 0,01-0,50 пиперонилбутоксид - 0,01-2,00 2,5 фурандион, дигидро-3-(тетрапропенил) - 0,01 - 0,50 углеводородный пропеллент - 20,00-60,00 растворитель - остальное Технический результат заявляемой инсектицидной композиции при ее использовании достигается благодаря комплексному ... 2264065 Способ возделывания сельскохозяйственных культур на корм ... озимую зерновую злаковую культуру. При этом нет проблем с получением всходов бобового компонента, а дружные и выровненные всходы злаковой культуры обеспечиваются оптимальным сроком посева в хорошо обработанную почву при междурядной культивации. Весной возобновляет вегетацию сначала злаковая культура, и только через 7-10 дней начинает отрастать донник. Поэтому в начальный период вегетации донник отстает в росте и не оказывает существенного влияния на величину и качество урожая смеси. После фазы колошения злаковая культура останавливается в росте и меньше потребляет из почвы элементов питания, а донник, в силу биологических особенностей, проходя фазы бутонизации и цветения, ... |
Еще из этого раздела: 2429594 Палец штампосварной для режущего аппарата (варианты) и способ его изготовления 2167648 Средство для защиты от укусов кровососущих насекомых (варианты) и способ его получения 2216908 Комбайн для уборки урожая с кустарников 2293463 Способ разработки лесосек 2233582 Устройство для охлаждения молока 2289908 Способ получения рассады стевии 2312500 Способ защиты смородины от вредителей и болезней 2400963 Передвижной перегрузчик для зерна сельскохозяйственных культур 2150193 Установка для бесфреонового охлаждения молока 2102853 Питательное устройство для растений |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||