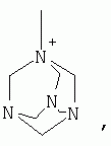
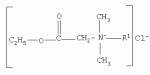
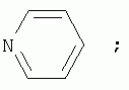
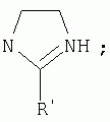
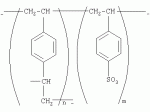
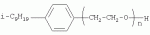
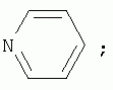
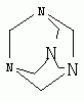
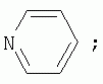
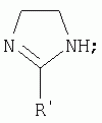
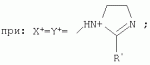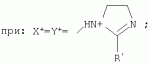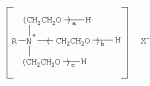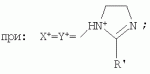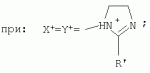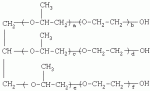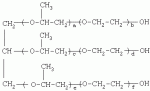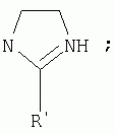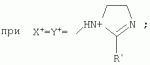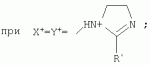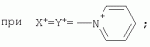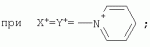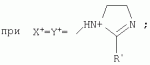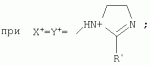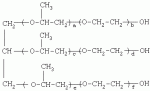{[1-(аммонио)-3,5,7-триазаадамантил]метилкарбонилоксиполи(алкиленокси)}пропан хлориды, обладающие бактерицидной и фунгицидной активностью, и способ их полученияПатент на изобретение №: 2288920 Автор: Фахретдинов Павел Сагитович (RU), Угрюмова Валентина Степановна (RU), Нуриев Ильдар Мухаматнурович (RU), Равилов Абдулхамит Зарипович (RU), Иванов Аркадий Васильевич (RU), Романов Геннадий Васильевич (RU), Фаткуллова Альбина Анварьевна (RU), Юсупова Галия Расыховна (RU), Камалов Булат Вагизович (RU), Чулков Алексей Константинович (RU) Патентообладатель: Всероссийский научный исследовательский ветеринарный институт (ВНИВИ) (RU), Институт органической и физической химии им. А.Е. Арбузова Казанского научного центра РАН (ИОФХ им. А.Е. Арбузова КазНЦ РАН) (RU) Дата публикации: 10 Декабря, 2006 Начало действия патента: 6 Июля, 2005 Адрес для переписки: 420088, г.Казань, ул. Арбузова, 8, ИОФХ им.А.Е.Арбузова, патентный отдел, А.А. Гурылевой Описываются {[1-(аммонио)-3,5,7-триазаадамантил]метилкарбонилоксиполи(алкиленокси)}пропан хлориды общей формулы: где: R' - алифатический ненасыщенный углеводородный радикал С17; a+c+e=49; b+d+f=9; R' - алифатический ненасыщенный углеводородный радикал С17; a+c+e=55; b+d+f=10; a+c+e=49; b+d+f=9; a+c+e=55; b+d+f=10; R' - алифатический ненасыщенный углеводородный радикал С17; а+с+е=49; b+d+f=0; R'-алифатический ненасыщенный углеводородный радикал C17; a+c+e=55; b+d+f=0; при: X+ =Y+=RNH2 +-; R - алифатический ненасыщенный углеводородный радикал C10-16; a+c+e=49; b+d+f=9; при: X+=Y+=RNH2 +-; R - алифатический углеводородный радикал С 10-16; a+c+e=55; b+d+f=10. Описывается также способ получения вышеуказанных соединений, которые обладают бактерицидной и фунгицидной активностью и могут быть использованы для борьбы с бактериальными и грибковыми поражениями в медицине, ветеринарии и сельском хозяйстве. 2 н. и 5 з.п. ф-лы, 2 табл. Изобретение относится к органической химии, а именно к синтезу неизвестных ранее {[1-(аммонио)-3,5,7-триазаадамантил]метилкарбонилоксиполи(алкиленокси)}пропан хлоридов, обладающих бактерицидной и фунгицидной активностью, которые могут быть использованы для борьбы с бактериальными и грибковыми поражениями в медицине, ветеринарии и сельском хозяйстве. Особенностью предлагаемого ряда соединений является одновременное наличие в их структуре {[1-(аммонио)-3,5,7-триазаадамантилового]} фрагмента, формулы: а также сложноэфирных и полиоксиалкиленовых группировок. Известны четвертичные аммониевые соединения, содержащие сложноэфирные группировки и представляющие собой N,N-диметил-N-алкил-N-[этилоксикарбонилметил]аммоний хлориды, формулы: [Shelton R.S., Van Campen M.J. et al. Quaternary Ammonium Salts as Germicides. II Acetoxy at Carbethoxy Derivates of Aliphatic Quaternary Ammonium Salts // j. Chem. Soc., 1946, v.68, №5, p.755-757]. Известны также четвертичные аммониевые соединения, включающие в структуру один или несколько полиоксиэтильных фрагментов. Такими, например, являются четвертичные аммониевые соединения с тремя полиоксиэтильными фрагментами, имеющие общую формулу: [Плетнев М.Ю. Косметико-гигиенические моющие средства. - М.: Химия, 1990, 272 с.; Kroke H. // Cosmet. Perfum. 1975. V.90. №11. Р.31-34.] Наиболее близкими по структуре к предлагаемым соединениям, содержащим одновременно сложноэфирные группировки и полиоксиэтиленовые фрагменты, являются N-[изононилфеноксиполи(этиленокси)карбонилметил]аммоний хлориды, общей формулы: где: R1=R2=СН 3; алкил фракции C7-C9; R 3=алкил фракции C7-C9, алкил фракции С10-C16, алкил фракции C15-C 18; n=3, 10. [Пат. 1531416 РФ. МПК С 07 С 87/30. Опубл. 1995.04.10. Фахретдинов П.С., Романов Г.В. и др. Способ получения ингибиторов коррозии углеродистых сталей в минерализованных сероводородсодержащих водных средах, проявляющих фунгистатическое, бактериостатическое и дезинфицирующее действие]. Технический результат настоящего изобретения - синтез новых {[1-(аммонио)-3,5,7-триазаадамантил]метилкарбонилоксиполи(алкиленокси)}пропан хлоридов, обладающих бактерицидной и фунгицидной активностью, и способ их получения. Предлагаются {[1-(аммонио)-3,5,7-триазаадамантил]метилкарбонил-оксиполи(алкиленокси)}пропан хлориды, содержащие одновременно сложноэфирные, полиоксиалкиленовые группировки и 1-(аммонио)-3,5,7-триазаадамантиловый фрагмент, общей формулы: где: R' = алифатический ненасыщенный углеводородный радикал, содержащий 17 атомов углерода; а+с+е = общая степень оксипропилирования, равная 49; b+d+f = общая степень оксиэтилирования, равная 9; R' = алифатический ненасыщенный углеводородный радикал, содержащий 17 атомов углерода; а+с+е = общая степень оксипропилирования, равная 55; b+d+f = общая степень оксиэтилирования, равная 10; а+с+е = общая степень оксипропилирования, равная 49; b+d+f = общая степень оксиэтилирования, равная 9; а+с+е = общая степень оксипропилирования, равная 55; b+d+f = общая степень оксиэтилирования, равная 10; R' = алифатический ненасыщенный углеводородный радикал, содержащий 17 атомов углерода; а+с+е = общая степень оксипропилирования, равная 49; b+d+f = общая степень оксиэтилирования, равная 0; R' = алифатический ненасыщенный углеводородный радикал, содержащий 17 атомов углерода; а+с+е = общая степень оксипропилирования, равная 55; b+d+f = общая степень оксиэтилирования, равная 0; при: Х+=Y+=RNH2 +-; R = алифатический углеводородный радикал, содержащий 10-16 атомов углерода; а+с+е = общая степень оксипропилирования, равная 49; b+d+f = общая степень оксиэтилирования, равная 9; при: Х+=Y+=RNH2 +-; R = алифатический углеводородный радикал, содержащий 10-16 атомов углерода; а+с+е = общая степень оксипропилирования, равная 55; b+d+f = общая степень оксиэтилирования, равная 10. Заявляемые {[1-(аммонио)-3,5,7-триазаадамантил]метилкарбонил-оксиполи(алкиленокси)}пропан хлориды являются новыми, не известными ранее соединениями, обладающими бактерицидной и фунгицидной активностью. Известен способ получения четвертичных аммониевых соединений, содержащих сложноэфирные и полиоксиэтиленовые группировки, например N-[изононилфеноксиполи(этиленокси)карбонилметил]аммоний хлоридов, общей формулы: где: R1=R2=СН 3, алкил фракции С7-С9; R 3 = алкил фракции C7-C9, алкил фракции С10-C16, алкил фракции C15-C 18; n=3, 10; путем взаимодействия монохлоруксусной кислоты со спиртовой компонентой, которой являются изононилфеноксиполиэтиленгликоли, общей формулы: где: n=3, 10; и последующей обработкой аминами, общей формулы: где: R1=R2=СН 3, алкил фракции C7-C9; R 3 = алкил фракции C7-C9, алкил фракции С10-C16, алкил фракции C15-C 18; [Патент 1531416 РФ. МПК С 07 С 87/30. Опубл. 1995.04.10.] (Прототип) Для заявляемых нами {[1-(аммонио)-3,5,7-триазаадамантил]метилкарбонилоксиполи(алкиленокси)}пропан хлоридов предлагается способ их получения путем взаимодействия 1,2,3-трис[гидроксиполи(алкиленокси)]пропанов, формулы: где: а+с+е = общая степень оксипропилирования, равная 49-55; b+d+f = общая степень оксиэтилирования, равная 9-10, с монохлоруксусной кислотой в присутствии кислотного катализатора, в среде кипящего растворителя, с азеотропным удалением образующейся воды и с последующей обработкой при нагревании в среде полярных растворителей полученного продукта реакции аминосоединениями, выбранными из ряда: первичных аминов, формулы: RNH 2, где: R - алифатический углеводородный радикал, содержащий 10-16 атомов углерода; пиридинов, формулы: алкилимидазолинов, формулы: где: R' = алифатический ненасыщенный углеводородный радикал, содержащий 17 атомов углерода; и/или 1,3,5,7-тетраазаадамантаном, формулы: в молярных соотношениях реагентов - гидроксильное производное пропана: монохлоруксусная кислота : аминосоединение : тетраазаадамантан = 1,0:3,0-3,2:0-2,1:1,0-2,1 соответственно. По предлагаемому способу в качестве кислотного катализатора используют Н+-форму катионообменной смолы КУ-2-8, которая представляет собой твердые, ограниченно набухающие высокомолекулярные полисульфокислоты сополимера стирола с дивинилбензолом, общей формулы: и выпускается в различных модификациях, отличающихся количеством дивинилбензола в сополимере. Например, марки катионита КУ-2-8 и КУ-2-10 содержат 8% и 10% дивинилбензола соответственно. [Салдадзе К.М., Пашков А.Б., Титов B.C. Ионообменные высокомолекулярные соединения. Под ред. Салдадзе К.М. Москва: Гос. научн.-техн. изд. хим. лит., 1960, с.112-114]. Катионобменная смола КУ-2-8 выпускается по ГОСТ 20298-74. В качестве органического растворителя для реакции взаимодействия гидроксильного производного пропана с монохлоруксусной кислотой используют ароматический углеводородный растворитель, например толуол, ксилол, нефрас А-120/200. Под условным обозначением Нефрас А-120/200 нефтехимической промышленностью выпускается сольвент нефтяной тяжелый по ТУ 38-101809-90, получаемый из продуктов каталитического риформинга и содержащий смесь ароматических углеводородов C8-C9 (ксилолы, пропилбензолы, метилэтилбензолы, мезитилен, псевдокумол и др.) Предлагаемый способ получения новых, не известных ранее {[1-(аммонио)-3,5,7-триазаадамантил]метилкарбонилоксиполи(алкиленокси)}пропан хлоридов имеет некоторое сходство со способом получения других рядов четвертичных аммониевых соединений, например N-[изононил-феноксиполи(этиленокси)карбонилметил]аммоний хлоридов [Пат. 1531416 РФ. Опубл. 1995.04.10.] Но и различия этих двух способов являются существенными. В известном способе в качестве спиртовой компоненты используют изононилфеноксиполиэтиленгликоли, общей формулы: а в качестве аминосоединений - длинноцепочечные алифатические третичные амины типа N,N,N-триалкиламинов фракции C7-С9, N,N-диметил-N-алкиламинов фракции С10-C16 или фракции C15-C 18. В предлагаемом способе в качестве спиртовой компоненты используют 1,2,3-трис[гидроксиполи(этиленокси)]пропаны, общей формулы: где: а+с+е = общая степень оксипропилирования, равная 49-55; b+d+f = общая степень оксиэтилирования, равная 9-10; а обработку продукта реакции гидроксильного производного пропана с монохлоруксусной кислотой ведут аминосоединениями, выбранными из ряда первичных аминов, формулы: RNH2 , где: R - алифатический углеводородный радикал, содержащий 10-16 атомов углерода; пиридинов, формулы: алкилимидазолинов, формулы: где: R' = алифатический ненасыщенный углеводородный радикал, содержащий 17 атомов углерода; и/или 1,3,5,7-тетраазаадамантаном, формулы: В предлагаемом способе используются молярные соотношения - реагентов - гидроксильное производное пропана : монохлоруксусная кислота : аминосоединение : тетраазаадамантан = 1,0:3,0-3,2:0-2,1:1,0-2,1 соответственно. В связи с вышеизложенным можно сделать заключение, что предлагаемый способ получения {[1-(аммонио)-3,5,7-триазаадамантил]метилкарбонилоксиполи(алкиленокси)}пропан хлоридов существенно отличается от существующих способов получения известных рядов четвертичных аммониевых соединений. Предлагаемый способ позволяет получить {[1-(аммонио)-3,5,7-триазаадамантил]метилкарбонилоксиполи(алкиленокси)}пропан хлориды, обладающие бактерицидной и фунгицидной активностью. Таким образом, заявляемые {[1-(аммонио)-3,5,7-триазаадамантил]метилкарбонилоксиполи(алкиленокси)}пропан хлориды являются новыми, и способ их получения является новым. Приводим конкретные примеры выполнения изобретения. Пример 1 {[1-(Аммонио)-3,5,7-триазаадамантил]метилкарбонилоксиполи(этиленокси)поли(2-метилэтиленокси)}-бис{2 |-(гексадеценил)мидазолинио]}метилкарбонилоксиполи(этиленокси)поли(2-метилэтиленокси)пропан трихлорид с общей степенью оксипропилирования, равной 49, и общей степенью оксиэтилирования, равной 9. Смесь 50,0 (1,5·10 -2 г-моля) 1,2,3-трис[гидроксиполи(этиленокси)поли(2 |-метилэтиленокси)]пропана с общей степенью оксипропилирования, равной 49, и общей степенью оксиэтилирования, равной 9; 4,3 г (4,5·10-2 г-моля) монохлоруксусной кислоты и 100 мл толуола, 1,5 г H+-формы катионообменной кислоты КУ-2-8 (в качестве кислотного катализатора) кипятят с ловушкой Дина-Старка и обратным холодильником до полного прекращения выделения воды и снижения кислотного числа реакционной массы до величин, меньших или равных 2 мг КОН/г. Величины кислотного числа в пробах определяют титрованием спиртовым раствором КОН. Время реакции 14 часов. Отфильтровывают реакционную массу от катализатора и в вакууме удаляют органический растворитель (толуол) и не вступившую в реакцию монохлоруксусную кислоту. Полученный продукт реакции смешивают с 8,8 г (3,0·10-2 г-моля) (2-гексадеценил)имидазолина и 2,1 г (1,5·10-2 г-моля) 1,3,5,7 - тетраазаадамантана в 70 мл изопропанола и 5 мл воды и нагревают при перемешивании и температуре 60-85°С в течение 10 часов. Контроль реакции ведут титрометрически, определяя содержание свободных аминов потенциометрическим титрованием спиртовым раствором соляной кислоты. Реакцию прекращают при остаточном содержании свободных аминов менее 0,2%. Растворитель удаляют в вакууме. Выход 63,6 г (99,0% от теор.) вязкой жидкости светло-желтого цвета. ИК-спектр: Пример 2 {[1-(Аммонио)-3,5,7-триазаадамантил]метилкарбонилоксиполи(этиленокси)поли(2-метилэтиленокси)}-бис{2 |-(гексадеценил)имидазолинио]}метилкарбонилоксиполи(этиленокси)поли(2-метилэтиленокси) пропан трихлорид с общей степенью оксипропилирования, равной 55, и общей степенью оксиэтилирования, равной 10. Получен аналогично примеру 1 из 75.0 г (2.0·10-2 г-моля) 1,2,3-трис[гидроксиполи(этиленокси)поли(2-метилэтиленокси)] пропана с общей степенью оксипропилирования, равной 55, и общей степенью оксиэтилирования, равной 10; 6.1 г (6.4·10-2 г-моля) монохлоруксусной кислоты; 150 мл ксилола; 3.8 г H +-формы катионообменной смолы КУ-2-8 (в качестве кислотного катализатора); 4 мл воды; этанола 100 мл; 3.1 г (2.2·10 -2 г-моля) 1,3,5,7-тетраазаадамантана и 12.4 г (4.2·10 -2 г-моля) (2-гексадеценил)имидазолина. Выход 93.5 г (99.5% от теор.) вязкой жидкости красного цвета. ИК-спектр: Пример 3 {[1-(Аммонио)-3,5,7-триазаадамантил]метилкарбонилоксиполи(этиленокси)поли(2-метилэтиленокси)}-бис[(пиридинио)метилкарбонилоксиполи(этиленокси)поли(2-метилэтиленокси)]пропан трихлорид с общей степенью оксипропилирования, равной 49, и общей степенью оксиэтилирования, равной 9. Получен аналогично примеру 1 из 65.0 г (2.0·10-2 г-моля) 1,2,3-трис [гидроксиполи(этиленокси)поли(2-метилэтиленокси)]пропана с общей степенью оксипропилирования, равной 49, и общей степенью оксиэтилирования, равной 9; 5.5 г (5.9·10-2 г-моля) монохлоруксусной кислоты; 130 мл ксилола; 2.0 г Н+-формы катионообменной смолы КУ-2-8 (в качестве кислотного катализатора); 6 мл воды; 90 мл изопропанола; 2.7 г (2.0·10-2 г-моля) 1,3,5,7-тетраазаадамантана и 3.0 г (3.9·10-2 г-моля) пиридина. Выход 74.7 г (99.8% от теор.) вязкой жидкости красного цвета. ИК-спектр: Пример 4 {[1-(Аммонио)-3,5,7-триазаадамантил]метилкарбонилоксиполи(этиленокси)поли(2-метилэтиленокси)}-бис[(пиридинио)метилкарбонилоксиполи(этиленокси)поли(2-метилэтиленокси)]пропан трихлорид с общей степенью оксипропилирования, равной 55, и общей степенью оксиэтилирования, равной 10. Получен аналогично примеру 1 из 68.0 г (1.8·10-2 г-моля) 1,2,3-трис[гидроксиполи(этиленокси)поли(2-метилэтиленокси)] пропана с общей степенью оксипропилирования, равной 55, и общей степенью оксиэтилирования, равной 10; 5.5 г (5.8·10 -2 г-моля) монохлоруксусной кислоты; 136 мл ксилола; 3.4 г H+-формы катионообменной смолы КУ-2-8 (в качестве кислотного катализатора); 4 мл воды; 92 мл изопропанола; 2.8 г (2.0·10-2 г-моля) 1,3,5,7-тетраазаадамантана и 3.0 г (3.8·10-2 г-моля) пиридина. Выход 77.2 г (99.6% от теор.) вязкой жидкости красного цвета. ИК-спектр: Пример 5 {[1-(Аммонио)-3,5,7-триазаадамантил]метилкарбонилоксиполи(2-метилэтиленокси)}-бис{[2'-(гексадеценил)имидазолинио]}метилкарбонилоксиполи(2-метилэтиленокси)пропан трихлорид с общей степенью оксипропилирования, равной 49. Получен аналогично примеру 1 из 72.0 г (2.5·10-2 г-моля) 1,2,3-трис[гидроксиполи(этиленокси)]пропана с общей степенью оксипропилирования, равной 49; 7.0 г (7.4·10 -2 г-моля) монохлоруксусной кислоты; 150 мл ксилола; 2.2 г Н+-формы катионообменной смолы КУ-2-8 (в качестве кислотного катализатора); 7 мл воды; 100 мл изопропанола; 3.4 г (2.5·10-2 г-моля) 1,3,5,7-тетраазаадамантана и 14.4 г (4.9·10-2 г-моля) (2-гексадеценил)имидазолина. Выход 95.5 г (99.7% от теор.) вязкой жидкости красного цвета. ИК-спектр: Пример 6 {[1-(Аммонио)-3,5,7-триазаадамантил]метилкарбонилоксиполи(2-метилэтиленокси)}-бис{[2'-(гексадеценил)имидазолинио]}метилкарбонилоксиполи(2-метилэтиленокси)пропан трихлорид с общей степенью оксипропилирования, равной 55. Получен аналогично примеру 1 из 74.0 г (2.3·10-2 г-моля) 1,2,3-трис[гидроксиполи(этиленокси)]пропана с общей степенью оксипропилирования, равной 55; 6.8 г (7.2·10 -2 г-моля) монохлоруксусной кислоты; 150 мл ксилола; 3.7 г Н+-формы катионообменной смолы КУ-2-8 (в качестве кислотного катализатора); 4 мл воды; 100 мл изопропанола; 3.5 г (2.5·10-2 г-моля) 1,3,5,7-тетраазаадамантана и 13.9 г (4.7·10-2 г-моля) (2-гексадеценил)имидазолина. Выход 95.6 г (99.4% от теор.) вязкой жидкости красного цвета. ИК-спектр: Пример 7 {[1-(Аммонио)-3,5,7-триазаадамантил]метилкарбонилоксиполи(этиленокси)поли(2-метилэтиленокси)}-бис[(алкиламмонио)метилкарбонилоксиполи(этиленокси)поли(2-метилэтиленокси)]пропан трихлориды фракции С10-C16 с общей степенью оксипропилирования, равной 49, и общей степенью оксиэтилирования, равной 9. Получен аналогично примеру 1 из 73.0 г (2.2·10 -2 г-моля) 1,2,3-трис[гидроксиполи(этиленокси)поли(2-метилэтиленокси)] пропана с общей степенью оксипропилирования, равной 49, и общей степенью оксиэтилирования, равной 9; 6.2 г (6.6·10-2 г-моля) монохлоруксусной кислоты; 150 мл ксилола; 2.2 г Н +-формы катионообменной смолы КУ-2-8 (в качестве кислотного катализатора); 6,6 мл воды; 99 мл изопропанола; 3.1 г (2.2·10 -2 г-моля) 1,3,5,7-тетраазаадамантана и 8.7 г (4.4·10 -2 г-моля) алкиламинов фракции C10-C16 . Выход 89.8 г (99.9% от теор.) вязкой жидкости красного цвета. ИК-спектр: Пример 8 {[1-(Аммонио)-3,5,7-триазаадамантил]метилкарбонилоксиполи(этиленокси)поли(2-метилэтиленокси)}-бис[(алкиламмонио)метилкарбонилоксиполи(этиленокси)поли(2-метилэтиленокси)]пропан трихлориды фракции С10-С16 с общей степенью оксипропилирования, равной 55, и общей степенью оксиэтилирования, равной 10. Получен аналогично примеру 1 из 76.0 г (2.0·10 -2 г-моля) 1,2,3-трис [гидроксиполи(этиленокси)поли(2-метилэтиленокси)] пропана с общей степенью оксипропилирования, равной 55, и общей степенью оксиэтилирования, равной 10; 6.2 г (6.5·10 -2 г-моля) монохлоруксусной кислоты; 152 мл ксилола; 3.8 г Н+-формы катионообменной смолы КУ-2-8 (в качестве кислотного катализатора); 4 мл воды; 100 мл изопропанола; 3.1 г (2.2·10-2 г-моля) 1,3,5,7-тетраазаадамантана и 6.2 г (3,5·10-2 г-моля) пиридина. Выход 93.4 г (91.7% от теор.) вязкой жидкости красного цвета. ИК-спектр: Определение бактерицидной активности соединений. Бактерицидную активность предлагаемых соединений изучали в отношении представителя грамположительной группы бактерий - золотистого стафилококка Staphylococcus aureus штамм Р-209 и грамотрицательной группы - кишечной палочки Escherichia coli штамм 7904 по общепринятой в бактериологии методике [Методы экспериментальной химиотерапии / Под. ред. Першина Г.Н. М.: Медицина, 1973, с.318-320; Ведьмина Е.А., Фурер Н.М. Руководство по микробиологии, клинике и эпидемиологии, клинике и эпидемиологии инфекционных болезней. М.: Медицина, 1964, с.608-610]. Пользуясь оптическим методом стандарта мутности готовили взвесь микроорганизмов в физиологическом растворе с бактериальной нагрузкой 500000 микробных тел в 1 мл. Бактериальную взвесь разливали в пробирки, содержащие определенные концентрации исследуемых веществ. Контрольные пробирки содержали такое же количество стерильного физиологического раствора. Экспозиция при этом составляла 0,5; 1,0; 1,5; 2,0 и 3,0 часа. По истечении срока экспозиции как опытные, так и контрольные материалы высевали на элективные питательные среды: Е.coli - на среду Эндо; St.aureus - на солевой агар. Инкубацию проводили в термостате при 37°С. Наблюдение за посевами вели в течение 7 суток. Бактерицидную активность предлагаемых соединений в отношении высокоустойчивых к дезинфектантам бактерий изучали на примере микобактерий туберкулеза Micobacterium bovis штамм 14 методом батистовых тестов. [Методы экспериментальной химиотерапии / Под ред. Першина Г.Н. М.: Медицина, 1973]. Стерильные батистовые тесты размером 1 см2 заражали взвесью культуры в концентрации 2 млрд.м.т./мл. Затем во флаконы с водным раствором исследуемых соединений вносили два батистовых теста. Экспозиция во всех случаях составляла 2 часа. По истечении срока экспозиции как опытные, так и контрольные материалы подвергались трехкратному отмыванию стерильной дистиллированной водой от испытуемого препарата путем центрифугирования при 5 тыс.об./мин в течение 30 минут. После чего проводили посев на среду Левенштейна - Йенсена. Инкубация проводилась в термостате при 37°С в течение одного месяца. Учет результатов вели по наличию или отсутствию роста колоний в опытных пробирках по сравнению с контрольными. Результаты испытаний приведены в таблице 1. В качестве эталона сравнения бактерицидной активности использовали структурный аналог - "Препарат Ф-761", представляющий собой N,N-диметил-N-алкил-N-[изононилфеноксиполи(этиленокси)карбонилметил]аммоний хлорид фракции C10-C16, формулы: где: R1=R2=СН 3; R3 - алифатический углеводородный радикал, содержащий 10-16 атомов углерода; n=10. [Патент 1531416 РФ. МКИ С 07 С 87/30. Фахретдинов П.С., Романов Г.В. и др. Способ получения ингибиторов коррозии углеродистых сталей в минерализованных сероводородсодержащих водных средах, проявляющих фунгистатическое, бактериостатическое и дезинфицирующее действие]. "Препарат Ф-761" наряду с тем, что является структурным аналогом предлагаемых в настоящем изобретении соединений, обладает теми же видами активности (антибактериальным и антигрибковым действием). Данные табл.1 свидетельствуют о бактерицидной активности заявляемых {[1-(аммонио)-3,5,7-триазаадамантил]метилкарбонилоксиполи(алкиленокси)}пропан хлоридов. Так, в отношении представителя группы грамположительных бактерий Staphylococcus aureus минимальные бактерицидные концентрации (МБЦК) для предлагаемых соединений составляют 0,25-2,0%, в то время как для структурного аналога - "Препарата Ф-761" (по пат. 1531416) МБЦК составляют 0,5% (при одинаковом времени экспозиции). В отношении представителя грамотрицательных бактерий - Eschrechia coli МБЦК заявляемых соединений составляют 0,5-1,0%, а МБЦК для структурного аналога составляет 1,0% при одинаковой экспозиции в 2 часа. Следует отметить высокую бактерицидную активность заявляемых соединений в отношении высокоустойчивых к дезинфектантам микобактерий туберкулеза Micobacterium bovis штамм 14, МБЦК которых составляет 0,063-1,0%, в то время как структурный аналог "Препарат Ф-761" в отношении M.bovis бактерицидной активностью не обладает. Полученные данные свидетельствуют, что {[1-(аммонио)-3,5,7-триазаадамантил]метилкарбонилоксиполи(алкиленокси)}пропан хлориды по бактерицидной активности превосходят структурный аналог "Препарат Ф-761" и могут быть использованы для профилактической и дезинфекционной обработки в очагах заражения возбудителей туберкулеза в ветеринарии и сельском хозяйстве. Определение фунгицидной активности. Фунгицидную активность предлагаемых соединений исследовали на примере возбудителя аскосфероза (болезни расплода пчел) - Ascosphaera apis, штамм ВГ-8. Испытания проводили по общепринятой в микробиологии методике серийных разведений [Методы экспериментальной химиотерапии / Под ред. Першина Г.Н. М.: Медицина, 1973, с.318-320; Ведьмина Е.А., Фурер Н.М. Руководство по микробиологии, клинике и эпидемиологии, клинике и эпидемиологии инфекционных болезней. М.: Медицина, 1964, с.608-610]. Для опытов использовали взвесь грибов с грибковой нагрузкой 200000 грибковых тел в 1 мл физиологического раствора. Грибковую взвесь разливали в пробирки, содержащие определенные концентрации исследуемых препаратов, в пропорции - 1 часть грибковой взвеси на 1 часть раствора препарата. В качестве эталона сравнения использовали структурный аналог N,N-диметил-N-алкил-N-[изононилфеноксиполи(этиленокси)карбонилметил]аммоний хлорид - "Препарат Ф-761", обладающий антибактериальным и антигрибковым действием (Патент РФ №1531416). В качестве контроля используют то же количество стерильного физиологического раствора. Экспозиции при этом составляют 5, 10, 30, 60 и 120 мин. После экспозиции проводят посев опытных и контрольных материалов на элективную питательную среду - сусло-агар. Инкубацию проводят в термостате при температуре 37°С, и наблюдение ведут в течение 14 суток. Результаты исследований фунгицидной активности предлагаемых соединений и эталона сравнения представлены в табл.2. Данные табл.2 свидетельствуют о фунгицидной активности заявляемых {[1-(аммонио)-3,5,7-триазаадамантил]метилкарбонилоксиполи(алкиленокси)}пропан хлоридов. Так, в отношении возбудителя аскосфероза (болезни расплода пчел) Ascosphaera apis, минимальные фунгицидные концентрации (МЦФК) этих препаратов составляют 0,25-2,0% при экспозиции 2 часа, в то время как структурный аналог "Препарат Ф-761" фунгицидной активностью не обладает. Предлагаемые соединения могут быть использованы в качестве антигрибковых средств в отношении возбудителя аскосфероза (болезни расплода пчел), например, в сельском хозяйстве на пасеках (омшанниках, ульях). Таким образом, заявляемые {[1-(аммонио)-3,5,7-триазаадамантил]метилкарбонилоксиполи(алкиленокси)}пропан хлориды являются новыми, и способ их получения также является новым. Представленные данные подтверждают бактерицидную и фунгицидную активность заявляемых соединений, которые могут быть использованы в качестве активной основы бактерицидных и фунгицидных средств в медицине, ветеринарии и сельском хозяйстве. Предлагаемый способ получения {[1-(аммонио)-3,5,7-триазаадамантил]метилкарбонилоксиполи(алкиленокси)}пропан хлоридов является несложным, не требующим особых условий и специального оборудования и может быть осуществлен практически на любом химическом производстве. Таблица 1.Результаты изучения бактерицидной активности препаратов. Соединенияпо примеру Экспозиция, чМинимальные бактерицидные концентрации, %St.aurerus E.coliM.bovis 12,0 0,250,50,125 22,0 0,250,50,125 32,0 1,00,51,0 42,0 1,00,51,0 52,0 0,250,50,125 62,0 0,250,50,125 72,0 2,01,00,063 82,0 2,01,00,063 Структурный аналог - "Препарат Ф-761"по пат. 15314162,00,5 1,0не активен Таблица 2.Результаты исследования фунгицидной активности.Соединения Экспозиция, чМинимальная фунгицидная концентрация, %1 23 120,5 22 0,532 2,04 22,05 20,5 620,5 72 1,082 1,0Структурный аналог "Препарат Ф-761" по пат. РФ №1531416 Не обладает фунгицидной активностьюФормула изобретения1. {[1-(Аммонио)-3,5,7-триазаадамантил]метилкарбонилоксиполи(алкиленокси)}пропан хлориды, общей формулы где R' = алифатический ненасыщенный углеводородный радикал, содержащий 17 атомов углерода; а+с+е=общая степень оксипропилирования, равная 49; b+d+f=общая степень оксиэтилирования, равная 9; R' = алифатический ненасыщенный углеводородный радикал, содержащий 17 атомов углерода; а+с+е=общая степень оксипропилирования, равная 55; b+d+f=общая степень оксиэтилирования, равная 10; а+с+е=общая степень оксипропилирования, равная 49; b+d+f=общая степень оксиэтилирования, равная 9; а+с+е=общая степень оксипропилирования, равная 55; b+d+f=общая степень оксиэтилирования, равная 10; R' = алифатический ненасыщенный углеводородный радикал, содержащий 17 атомов углерода; а+с+е=общая степень оксипропилирования, равная 49; b+d+f=общая степень оксиэтилирования, равная 0; R' = алифатический ненасыщенный углеводородный радикал, содержащий 17 атомов углерода; а+с+е=общая степень оксипропилирования, равная 55; b+d+f=общая степень оксиэтилирования, равная 0; при X+=Y +=RNH2 +-; R = алифатический углеводородный радикал, содержащий 10-16 атомов углерода; а+с+е=общая степень оксипропилирования, равная 49; b+d+f=общая степень оксиэтилирования, равная 9; при X+=Y +=RNH2 +-; R = алифатический углеводородный радикал, содержащий 10-16 атомов углерода; а+с+е=общая степень оксипропилирования, равная 55; b+d+f=общая степень оксиэтилирования, равная 10. 2. Соединения по п.1, обладающие бактерицидной и фунгицидной активностью. 3. Способ получения соединений по п.1, заключающийся во взаимодействии 1,2,3-трис[гидроксиполи(алкиленокси)]пропанов, общей формулы где а+с+е=общая степень оксипропилирования, равная 49-55; b+d+f=общая степень оксиэтилирования, равная 0-10; с монохлоруксусной кислотой в присутствии кислотного катализатора в среде кипящего органического растворителя, с азеотропным удалением образующейся воды и с последующей обработкой, в среде полярных растворителей при нагревании, полученного продукта реакции аминосоединениями, выбранными из ряда: первичных аминов, формулы RNH2, где R - алифатический углеводородный радикал, содержащий 10-16 атомов углерода, пиридинов, формулы алкилимидазолинов, формулы где: R' = алифатический ненасыщенный углеводородный радикал, содержащий 17 атомов углерода; и/или 1,3,5,7-тетраазаадамантаном, формулы: в молярных соотношениях реагентов - гидроксильное производное пропана : монохлоруксусная кислота : аминосоединение : тетраазаадамантан = 1:3,0-3,2:0-2,1:1,0-2,1 соответственно. 4. Способ по п.3, заключающийся в том, что в качестве кислотного катализатора используют Н+-форму катионообменной смолы КУ-2-8, взятую в количестве 3-5% от веса исходного гидроксильного производного пропана. 5. Способ по п.3, заключающийся в том, что в качестве органического растворителя используют ароматический углеводородный растворитель, например толуол, ксилол, нефрас А-120/200. 6. Способ по п.3, заключающийся в том, что при обработке продукта реакции гидроксильного производного пропана с монохлоруксусной кислотой аминосоединениями и/или 1,3,5,7-тетраазаадамантаном в качестве полярных растворителей используют смесь низкомолекулярного спирта, например этанола или изопропанола, с водой при объемных соотношениях спирт : вода=15-25:1,0. 7. Способ по п.3, заключающийся в том, что обработку аминосоединением и/или 1,3,5,7-тетраазаадамантаном продукта реакции гидроксильного производного пропана с монохлоруксусной кислотой ведут при температуре 60-85°С. MM4A - Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 07.07.2007 Извещение опубликовано: 20.02.2009 БИ: 05/2009 Популярные патенты: 2253239 Способ производства средства для обработки растений (варианты) ... стадии и по вегетации в фазе выхода в трубку при расходе препаратов по д.в, 0,5 мг/т и 0,5 мг/га соответственно. Относительная разница по сравнению с наиболее близким аналогом по всхожести составила от +3,8 до -4,1%, по энергии прорастания от +2 до -2,2%, по развитию фитопатогенов от +4,4 до -3,1%, по урожайности от +10,2 до -5,6%. Обработку огурцов осуществляли на предпосевной стадии и по вегетации в фазе цветения при расходе препаратов по д.в. 1 г/т и 10 мг/га соответственно, Относительная разница по сравнению с наиболее близким аналогом по всхожести составила от +7,8 до -2,4%, по энергии прорастания от +4,1 до -4,2%, по развитию фитопатогенов от +6,5 до -4,4%, по урожайности ... 2485083 Способ получения замещенных пиримидин-5-илкарбоновых кислот ... ... 2188534 Способ уборки льна-долгунца ... 17 с направляющими прутками 18. Перекрестный ремень 3 с направляющими прутками 18 образуют винтообразный канал. Копирующие колеса 19 размещены на кронштейне 20, закрепленном на раме 14. Гидроцилиндр 21 через шарнирные соединения одним концом связан с рамой 12, а противоположным концом соединен с рамой 14. Сница 22 служит для агрегатирования льноуборочной машины с трактором, а сница 23 предназначена для присоединения передвижной емкости ( тракторного прицепа) для сбора льновороха. Работает льноуборочная машина следующим образом. Перед началом работы подбирающий барабан 1 гидроцилиндром 21 переводится в рабочее положение, при котором копирующие колеса 19 опираются на почву. Затем ... 2264065 Способ возделывания сельскохозяйственных культур на корм ... 43,657,749,7 Известный (в смеси с горохом) 23,933,748,2 63,556,3 Предложенный (в смеси с донником) 20,930,546,9 63,259,5 При этом урожайность ячменно-гороховой и ячменно-донниковой смеси практически одинакова. Не отличались они и по качеству получаемого корма. В 1 кг сухого вещества ячменно-гороховой смеси содержалось 9,83 МДж обменной энергии и 10,68% сырого протеина, в ячменно-донниковой, соответственно, 9,83 и 10,68, а в одновидовом посеве ячменя - 9,63 и 9,41. Но по показателям биоэнергетической эффективности явное преимущество имел посев ячменя с донником, где на получение 1 ц сухой биомассы расходуется 190 МДж обменной энергии, и коэффициент энергетической ... 2192721 Орудие для обработки засоленных почв ... горизонте) слое и рыхление верхнего, корнеобитаемого слоя с растительными и корневыми остатками осуществляют следующим. Первым в технологической цепочке по ходу движения агрегата в работе принимает участие наклонная к горизонту лапа 2. Режущей кромкой лапы 2 подрезается грунт на глубине 0,50-0,65 м от поверхности поля. Лапой 2 грунт деформируется на большие комья и глыбы, образуя пустоты в зоне диаметром 0,15-0,30 м. При перемещении нижнего участка стойки 4 в подпахотном горизонте таким образом образуется дрена для сбора минерализованной воды, ее накопления и последующего отвода. Съемным лезвием 9 на фронтальной нижней части стойки 4 разрезается вертикальная щель в подпахотном ... |
Еще из этого раздела: 2137365 Способ отпугивания биологических существ 2043709 Система управления работой форсунки разбрызгивателя 2010519 Способ биологической борьбы с вредителями растений 2113779 Агромост 2185064 Вещество, обладающее пестицидной активностью, способ его получения, пестицидная композиция и способ контролирования вредителей 2172085 Способ управления групповым вождением машин 2195801 Картофелекопатель швыряльного типа 2426302 Всепогодная теплица 2460269 Малогабаритный картофелеуборочный комбайн 2420949 Способ оценки потенциальной урожайности семянок сафлора красильного |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||