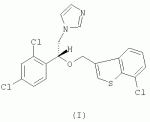
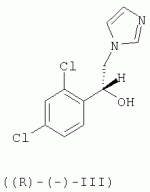
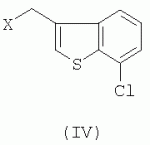
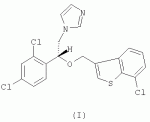
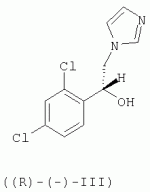
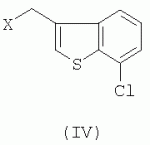
R-(-)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1h-имидазол и его соли, способ их получения, композиция, обладающая противогрибковым действиемПатент на изобретение №: 2276152 Автор: АНГЛАДА Луис (ES), ГУГЛЬЕТТА Антонио (ES), ПАЛАСИН Селия (ES), РАМЕНТОЛЬ Хорхе (ES), ФОГЕТ Рафаэль (ES) Патентообладатель: Феррер Интернасионал, С.А. (ES) Дата публикации: 10 Мая, 2006 Начало действия патента: 4 Февраля, 2003 Адрес для переписки: 127055, Москва, а/я 11, пат.пов. Н.К.Попеленскому Описывается R-(-)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазол формулы (I) и его соли, в частности его мононитрат, Область техники, к которой относится изобретение Настоящее изобретение относится к R-(-)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазолу(R-(-)-сертаконазолу) и его солям, способу его получения, к композициям, которые содержат упомянутое соединение, и к применению указанных композиций для лечения грибковых инфекций и борьбы с болезнями сельскохозяйственных культур. Уровень техники Рацемический 1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазол является известным соединением с названием сертаконазол (WHO, INN), которое используют в качестве противогрибкового агента для лечения заболеваний, вызванных грибами и дрожжами у человека и животных. Получение указанного соединения и его мононитрата описано в европейском патенте No 151477. Раскрытие изобретения Настоящее изобретение относится к R-(-)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазолу формулы I а также к его фармацевтически приемлемым аддитивным солям. R-(-)-энантиомер сертаконазола обладает активностью в отношении грибов и дрожжей, которая приблизительно в 2 раза выше по сравнению с рацемической смесью, (так как его сродство к мишени в 2 раза выше), как показано в таблице 1. Эти данные позволяют предположить, что введение R-(-)-сертаконазола в дозе, составляющей 1/2 дозы рацемического сертаконазола, таким образом позволит снизить риск побочных действий и обеспечит подавление неспецифической токсичности, связанной с нежелательной примесью S-(+)-энантиомера. Мононитрат является предпочтительной солью R-(-)-сертаконазола. Настоящее изобретение относится также к способу получения R-(-)-энантиомера сертаконазола и его фармацевтически приемлемых солей, причем способ включает взаимодействие R-(-)-1-(2,4-дихлорфенил)-2-имидазол-1-илэтанола формулы ((R)-(-)-III) с 3-галогенметил-7-хлорбензо[b]тиофеном формулы IV где Х означает галоген. Соединение можно выделить из реакционной смеси известными в данной области способами. При необходимости неочищенный продукт можно затем очистить известными в данной области способами, например кристаллизацией и/или хроматографией. Получение S-(+)-энантиомера сертаконазола можно проводить соответствующим способом с использованием S-(+)-1-(2,4-дихлорфенил)-2-имидазол-1-илэтанола вместо R-(-)-энантиомера. Необходимым условием для получения энантиомеров сертаконазола упомянутым выше способом является получение соответствующих энантиомеров промежуточного производного 1-(2,4-дихлорфенил)-2-имидазол-1-илэтанола (III). Два энантиомера 1-(2,4-дихлорфенил)-2-имидазол-1-илэтанола (III) можно получить путем разделения соответствующей рацемической смеси с использованием оптически активной кислоты, предпочтительно L-винной кислоты, D-винной кислоты, дибензоил-L-винной кислоты, дибензоил-D-винной кислоты или т.п., и с использованием метода, описанного в патенте Великобритании No 1244530 и в статье Lammerhofer M. and Lindner W., Chiralitiy, 6:261-269,1994.(R)-(-)-1-(2,4-Дихлорфенил)-2-имидазол-1-илэтанол получают также методом энантиоселективного восстановления 1-(2,4-дихлорфенил)-2-имидазол-1-илэтанона (II) с использованием (-)- Взаимодействие одного из энантиомеров промежуточного производного формулы (III) с 3-галогенметил-7-хлорбензо[b]тиофеном (IV) приводит к образованию соответствующего энантиомера сертаконазола в виде свободного основания. В качестве 3-галогенметил-7-хлорбензо[b]тиофена предпочтительными являются 3-хлорметил-7-хлорбензо[b]тиофен и 3-бромметил-7-хлорбензо[b]тиофен. Энантиомеры сертаконазола в виде свободного основания могут быть превращены в фармацевтически приемлемые соли известными в данной области способами. Предпочтительно получают мононитраты с помощью обработки азотной кислотой. Стадии получения энантиомеров сертаконазола представлены на следующей схеме. Кроме того, настоящее изобретение относится к фармацевтическим композициям, включающим (R)-(-)-сертаконазол и/или его соль, и к применению (R)-(-)-сертаконазола и/или его соли для лечения инфекций, вызванных грибами и дрожжами, у человека и животных, а также для борьбы с болезнями сельскохозяйственных культур, вызванными такими микроорганизмами. Соединения по настоящему изобретению, по выбору смешанные с фармацевтически приемлемыми носителями, можно вводить человеку или животным пероральным путем в форме таблеток, капсул, таблеток с покрытием, сиропов, растворов, порошков, гранул, эмульсий, гелей для перорального применения, паст для перорального применения, буккофарингеальных растворов, буккофарингеальных суспензий, буккофарингеальных гелей, буккофарингеальных паст и т.п.; инъекционным способом, ректальным способом и вагинально-внутриматочным способом в форме, подобной яйцеклетке, вагинальной таблетки, вагинальной капсулы, лечебного вагинального тампона, мази, крема, геля, пены, раствора, эмульсии, суспензии, пессария, лосьона и т.п., в суточной дозе от 50 до 400 мг; и местным способом в форме крема, лосьона, пасты, суспензии, мази, эмульсии, раствора, пены, шампуня, порошка, геля и т.п., в концентрации в диапазоне от 0,05 до 3%. Соединения по настоящему изобретению можно также по выбору смешивать с разбавителем или носителем и использовать для борьбы с болезнями сельскохозяйственных культур посредством нанесения на почву путем поливки, распыления, орошения, опыливания или в форме порошка, крема, пасты и т.п. при норме нанесения 0,05-10 кг на 1 гектар почвы. Осуществление изобретения Следующие примеры представлены для иллюстрации способов получения энантиомеров сертаконазола, их содержащих фармацевтических составов и их биологической активности в отношении различных микроорганизмов. Пример 1: R-(-)-1-(2,4-дихлорфенил)-2-имидазол-1-илэтанол В одногорлой колбе объемом 50 мл, снабженной капельной воронкой, охлаждающей баней, магнитной мешалкой и баллоном с азотом, смешивают 3,14 г (9,8 ммоль, 2,5 экв.) хлорида (-)-DIP и 9 мл безводного этилового эфира (молекулярные сита 4 å). К полученной смеси по каплям при комнатной температуре в атмосфере азота добавляют раствор 1 г (3,92 ммоль, 1 экв.) 1-(2,4-дихлорфенил)-2-имидазол-1-илэтанона в 10 мл безводного тетрагидрофурана (молекулярные сита 4 å). Смесь перемешивают в течение 24 ч при комнатной температуре в атмосфере азота. К смеси добавляют 0,4 мл метанола, перемешивают в течение 10 мин и растворители удаляют упариванием при пониженном давлении. К полученному неочищенному продукту добавляют 10 мл н-гексана и 10 мл воды. Смесь подкисляют добавлением 1,6 мл 6 М соляной кислоты. Две фазы разделяют и органический слой удаляют. Водную фазу нейтрализуют 3 М NaOH до значения рН 10-11 в присутствии 10 мл этилового эфира. Две фазы разделяют и органический слой промывают 10 мл этилового эфира. Два слоя эфира сушат над безводным сульфатом натрия и упаривают досуха при пониженном давлении, при этом получают 1,27 г неочищенного продукта, который кристаллизуют из смеси 5 мл смеси этанол/вода, 1:1 об./об., при этом получают 0,8 г (выход 80%) R-(-)-1-(2,4-дихлорфенил)-2-имидазол-1-илэтанола. Результаты анализа: ДСК: пик при 107,4°С ИК-спектр: соответствует указанной структуре 1H-13 С-ЯМР (ДМСО) спектр: соответствует указанной структуре [ Пример 2: R-(-)-1-(2,4-Дихлорфенил)-2-имидазол-1-илэтанол Раствор 5 г 1-(2,4-дихлорфенил)-2-имидазол-1-илэтанола в смеси ацетон/метанол (25 мл/20 мл) медленно добавляют к D-винной кислоте (3,21 г), растворенной в смеси ацетон/метанол (25 мл-10 мл) при комнатной температуре. После завершения добавления реагента реакционную смесь перемешивают в течение еще 30 мин при комантной температуре. Образующееся твердое вещество отфильтровывают и перекристаллизовывают из метанола. Выход составляет 1,85 г (37%), энанатиомерная чистота R-изомера >98%. Пример 3: (R)-(-)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазол В трехгорлой колбе объемом 100 мл, снабженной обратным холодильником, погружным термометром, капельной воронкой, охлаждающей баней и баллоном с азотом, смешивают 10 мл сухого N,N-диметилформамида (молекулярные сита 4 å) и 1,27 г (11,3 ммоль, 1,03 экв.) трет-бутоксида калия. К полученной смеси, охлажденной на водяной бане, по каплям добавляют раствор 2,83 г (11 ммоль) (R)-(-)-1-(2,4-дихлорфенил)-2-имидазол-1-илэтанола в 15 мл сухого N,N-диметилформамида. После завершения добавления смесь перемешивают в течение 45 мин и к раствору добавляют 2,93 г (11,2 ммоль, 1,02 экв.) 3-бромметил-7-хлорбензо[b]тиофена в 7 мл сухого N,N-диметилформамида. Реакционную смесь перемешивают в течение 4 ч при комнатной температуре. Растворитель удаляют отгонкой при пониженном давлении и остаток обрабатывают 50 мл хлористого метилена. Полученный раствор промывают 2 раза по 30 мл воды, сушат над безводным сульфатом натрия, фильтруют и упаривают досуха при пониженном давлении, при этом получают 4,62 г неочищенного продукта. Полученный неочищенный продукт очищают колоночной хроматографией на силикагеле с использованием в качестве элюента градиента хлористый метилен/метанол. Полученную смолу (2,0 г) кристаллизуют из этилового эфира (10 мл). Твердое вещество отфильтровывают и сушат, при этом получают 1,22 г (выход 25,1%) (R)-(-)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазола. Результаты анализа: ДСК: пик при 74,5°С ИК-спектр: соответствует указанной структуре 1H-13 С-ЯМР (ДМСО) спектр: соответствует указанной структуре [ Пример 4: (S)-(+)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазол В трехгорлой колбе объемом 100 мл, снабженной обратным холодильником, погружным термометром, капельной воронкой, охлаждающей баней и баллоном с азотом, смешивают 16 мл сухого N,N-диметилформамида (молекулярные сита 4 å) и 2,04 г (18,43 ммоль, 1,05 экв.) трет-бутоксида калия. К полученной смеси, охлажденной на водяной бане, по каплям добавляют раствор 4,44 г (17,2 ммоль) (S)-(+)-1-(2,4-дихлорфенил)-2-имидазол-1-илэтанола в 25 мл сухого N,N-диметилформамида. После завершения добавления смесь перемешивают в течение 45 мин и к раствору добавляют 4,61 г (17,62 ммоль, 1,02 экв.) 3-бромметил-7-хлорбензо[b]тиофена в 13 мл сухого N,N-диметилформамида. Реакционную смесь перемешивают в течение 4 ч при комнатной температуре. Растворитель удаляют отгонкой при пониженном давлении и остаток обрабатывают 80 мл хлористого метилена. Полученный раствор промывают 2 раза по 50 мл воды, сушат над безводным сульфатом натрия, фильтруют и упаривают досуха при пониженном давлении, при этом получают 7,30 г неочищенного продукта. Полученный неочищенный продукт очищают колоночной хроматографией на силикагеле с использованием в качестве элюента градиента хлористый метилен/метанол. Полученную смолу (3,78 г) кристаллизуют из этилового эфира (18 мл). Твердое вещество отфильтровывают и сушат, при этом получают 2,61 г (выход 34,5%) (S)-(+)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазола. Результаты анализа: ДСК: пик при 83,4°С ИК-спектр: соответствует указанной структуре 1H-13 С-ЯМР (ДМСО) спектр: соответствует указанной структуре [ Пример 5: Мононитрат (R)-(-)-сертаконазола (мононитрат (R)-(-)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазола) 880 мг(2,01 ммоль)(R)-(-)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазола растворяют в 5 мл 96% этанола. К раствору добавляют 1 мл воды и нагревают при температуре 35-37°С. К полученному раствору добавляют 0,23 мл 60% азотной кислоты (3 ммоль, 1,5 экв.). Затем добавляют 3 мл воды и охлаждают сначала до комнатной температуры, а затем при 10°С в течение 1 ч. Полученное твердое вещество отфильтровывают, промывают 2 раза по 4 мл воды и сушат в вакууме в течение 24 ч, при этом получают 0,9 г (выход 89%) мононитрата (R)-(-)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазола. Результаты анализа: ДСК: пик при 116,87°С ИК-спектр: соответствует указанной структуре 1 H-13С-ЯМР (ДМСО) спектр: соответствует указанной структуре [ Пример 6: Мононитрат (R)-(-)-сертаконазола (мононитрат R-(-)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазола В колбу объемом 500 мл, оборудованную механической мешалкой, загружают 15,72 г R-(-)-1-(2,4-дихлорфенил)-2-имидазол-1-илэтанола, 45 мл толуола, 1,05 г гидросульфата тетрабутиламмония и 24,5 г 18 н. водного NaOH. Смесь нагревают при 35-40°С и эту температуру поддерживают в течение еще 15 мин. Затем добавляют раствор 3-бромметил-7-хлорбензо[b]тиофена в 376 мл толуола в течение 30 мин. В реакционной смеси поддерживают температуру от 37 до 40°С в течение 2,5 ч и затем добавляют воду. Органический слой промывают водой. После концентрирования при пониженном давлении неочищенный продукт растворяют в 150 мл абсолютного этанола. Затем медленно добавляют смесь 9,1 г 60% HNO3 и 130 мл воды и после завершения добавления реагентов реакционную смесь охлаждают до 0°С. Полученное твердое вещество отфильтровывают, перекристаллизовывают из смеси ацетон/этанол и сушат. Выход составляет 24,5 г (80%). Пример 7: Мононитрат (S)-(+)-сертаконазола (мононитрат (S)-(+)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазола) 2,35 мг (5,37 ммоль)(S)-(+)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазола растворяют в 17 мл 96% этанола. К раствору добавляют 3 мл воды и нагревают при температуре 35-40°С. К полученному раствору добавляют 0,61 мл 60% азотной кислоты (8,06 ммоль, 1,5 экв.). Затем добавляют 13 мл воды и охлаждают сначала при комнатной температуре, а затем при 10°С в течение 1 ч. Полученное твердое вещество отфильтровывают, промывают 2 раза по 10 мл воды и сушат в вакууме в течение 24 ч, при этом получают 2,65 г (выход 98,5%) мононитрата (S)-(+)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазола. Результаты анализа: ДСК: пик при 168,91°С ИК-спектр: соответствует указанной структуре 1 H-13С-ЯМР (ДМСО) спектр: соответствует указанной структуре [ Пример 8: Состав 1% крема Состав на 100 г Мононитрат R-(-)-сертаконазола1,00 г Моно- и диглицериды пальмитиновой и стеариновой кислот6,00 г Кетостеариловый спирт, содержащий 20 моль этиленоксида 1,00 гДециловый эфир олеиновой кислоты 5,00 гМоноэтаноламин ундециленовой кислоты2,00 г Карбомер1,00 г Триэтаноламин0,60 г Метилпарабен0,15 гПропилпарабен 0,05 гДистиллированная вода до объема 100,00 гПример 9: Состав 1% геля Состав на 100 г Мононитрат R-(-)-сертаконазола1,00 г Пропиленгликоль 10,00 гКабомер 1,00 гТвин 20 0,10 гФеноксиэтанол 0,35 гДинатриевая соль ЭДТУ 0,15 гЛимонная кислота0,25 г 1 н. гидроксид натрия1,50 г Триэтаноламин1,55 г Дистиллированная вода до объема 100,00 гПример 10: Биологические данные Величины минимальной ингибирующей концентрации (МИК) определяют с использованием модифицированного метода микроразбавлений М27-А, рекомендованного Национальным комитетом по клиническим лабораторным стандартам, в среде RPMI-1640 (фирмы Sigma), дополненной глюкозой до концентрации 2% и доведенной до рН 7,0 с помощью 0,165 М буферного раствора, содержащего морфолин-пропансульфоновую кислоту (MOPS). Из исходных растворов соединений готовят серийные двухкратные разведения в модифицированной среде RPMI-1640. Величины МИК определяют по минимальной концентрации лекарственного средства, при которой наблюдается ингибирование роста на 50% по сравнению с ростом контрольного микроорганизма. Микробиологическая активность R-(-)-сертаконазола по сравнению с S-(+)-энантиомером, который значительно менее активен, и с рацемическим сертаконазолом представлена в виде среднегеометрических величин в таблице. Число штаммов, использованных в экспериментах, показано в скобках рядом с названием каждого микроорганизма. МИК (мкг/мл) нитрата сертаконазола и его энантиомеров МикроорганизмR-(-)-энантиомер РацематS-(+)энантиомер Candida spp (42) 0,1250,2563,217 Dermatophytes (17) 0,040,080,17 Filamentous fungi (11) 1,763,1116 Malassezia spp (11)0,64 1,3710,96Формула изобретения1. R-(-)-1-[2-(7-Хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазол формулы (I) или его фармацевтически приемлемые соли. 2. Мононитрат R-(-)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1H-имидазола. 3. Способ получения соединения по п.1 или 2, отличающийся тем, что проводят взаимодействие R-(-)-1-(2,4-дихлорфенил)-2-имидазол-1-илэтанола формулы ((R)-(-)-III) с 3-галогенметил-7-хлорбензо[b]тиофеном формулы (IV) где X означает галоген, и по выбору обрабатывают полученный R-(-)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазол солеобразующей кислотой. 4. Способ по п.3, отличающийся тем, что Х означает хлор или бром. 5. Способ по п.3 или 4, отличающийся тем, что соединением является мононитрат R-(-)-1 -[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлор-фенил)этил]-1Н-имидазола, а солеобразующей кислотой является азотная кислота. 6. Способ по п.3 или 4, отличающийся тем, что R-(-)-1-(2,4-дихлорфенил)-2-имидазол-1-илэтанол формулы ((R)-(-)-III) получают посредством энантиоселективного восстановления 1-(2,4-дихлорфенил)-2-имидазол-1-илэтанона с использованием (-)- 7. Способ по п.5, отличающийся тем, что R-(-)-1-(2,4-дихлорфенил)-2-имидазол-1-илэтанол формулы ((R)-(-)-III) получают посредством энантиоселективного восстановления 1-(2,4-дихлорфенил)-2-имидазол-1-илэтанона с использованием (-)- 8. Композиция, обладающая противогрибковым действием, содержащая R-(-)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлор-фенил)этил]-1Н-имидазол или его соль. 9. Композиция по п.8, в которой указанной солью является мононитрат. 10. Композиция по любому из п.8 или 9, которая является фармацевтической композицией. 11. Композиция по любому из п.8 или 9, которая является сельскохозяйственной композицией. 12. Применение R-(-)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазола или его соли в качестве активного ингредиента противогрибковой композиции. 13. Применение по п.12, в котором указанной солью является мононитрат. 14. Применение по любому из п.12 или 13, в котором указанная композиция используется для лечения грибковых инфекций у человека или животных. 15. Применение по любому из п.12 или 13, в котором указанная композиция используется для борьбы с болезнями сельскохозяйственных культур. Популярные патенты: 2394414 Соединительное устройство для сельскохозяйственной машины ... 14, установлена на заданном расстоянии от конца удлинительной части 10 в направлении от секции 2b балки 2. Контропора 13 имеет Т-образную форму и может быть вставлена в углубление 16 на одной стороне удлинительной части 10, как показано на фиг.3. Верхняя полка буквы Т образует с каждой стороны заплечики 15, которые упираются в стенки удлинительной части в углублении 16. Затем контропору приваривают пробочным швом в углублении 17 на других сторонах удлинительной части 10. В секции 2b балки 2 закреплено тело в виде цилиндра 18, предпочтительно с помощью сварки пробочным швом в углублении 19. На одной стороне 20 цилиндра 18, которая в собранном состоянии обращена к ... 2154940 Способ получения, содержания и хранения живого корма для биологических объектов птиц и рыб ... из расчета 10 инвазионных личинок нематоды на каждую гусеницу. После наполнения емкости для сбора конечного продукта - 75 гусеницами 3 возраста, ее устанавливают в холодильнике при тех же температурных условиях, что и паразитированные яйца. При получении гусениц четвертого возраста через 1 -2 суток после заселения контейнера - 1 отрождающиеся гусеницы 1 возраста поднимаются вверх, внедряются в искусственные хлопковые коробочки - 70 и питаются там в течение 20-25 суток, после чего емкость - 1 полностью заливают водой. Сконцентрированных на поверхности воды, покинувших гранулы гусениц откачивают с помощью вакуумного насоса 78 и смешивают с нематодной суспензией из расчета 10 ... 2464780 Способ, устройство и компьютерный программный продукт для управления группой молочного скота ... в течение всего дня. В преимущественном варианте воплощения настоящего изобретения устройство для кормления включает дозатор кормового продукта для отмеривания кормового продукта. В еще более предпочтительном варианте воплощения настоящего изобретения дозатор кормового продукта подходит для дозирования, по меньшей мере, двух типов кормового продукта или рационов. В частности, устройство включает смешивающее устройство для смешивания, по меньшей мере, двух типов кормового продукта, поскольку было установлено, что иногда скармливание смешанного кормового продукта оказывает положительное воздействие на надои молока. В одном конкретном варианте воплощения настоящего изобретения ... 2264082 Способ восстановления полей бурой водоросли ламинарии ... Предлагаемый способ восстановления полей ламинарии на неподвижном и подвижном галечном грунте может быть применен для восстановлены зарослей близкородственных к ламинарии японской видов, в частности, макроцистиса (Macrocystis sp.), костарии (Costaria costata), лессонии (Lessonia laminariaeoides), артротамнуса (Arthrotamnus bifidus), алярии (Alaria marginata), чельманиеллы (Kjellmaniella crassifolia) и многочисленных видов ламинарий (ламинария Гурьяновой - Laminaria gurjanovae, ламинария наклоненная - Laminaria inclinatorhiza, ламинария прижатая - Laminaria appressirhiza, ламинария цикориеподобная - Laminaria cichorioides).Пример №1.На участке прибрежья у м. Проходного (южное ... 2148319 Растительное средство для борьбы с пресноводными моллюсками ... abies (L.) (сем. Сосновые - Pinaceae) - в качестве средства для борьбы с пресноводными моллюсками - промежуточными хозяевами возбудителей трематодозов животных и рыб. Препараты ели европейской известны в медицине как потогонное, желчегонное, мочегонное, дезинфицирующее (обладая противомикробными и противогрибковыми свойствами) средства. Они используются для полосканий - при заболеваниях органов дыхания; применяют внутрь - при туберкулезе, склерозе сосудов, мочекаменной болезни, цинге, водянке, кожных сыпях; в виде мазей и присыпок - при фурункулезе, ранах и язвах; ванны - при радикулите. Применяются как напитки и настои с высоким содержанием витаминов C и K. В ветеринарии настой ... |
Еще из этого раздела: 2163071 Способ определения потенциальной соленостной толерантности водных беспозвоночных 2066320 Производные тиазола, способ их получения и способ борьбы с грибками 2389173 Способ выращивания земляники садовой 2475020 Способ подбора лучших сортов опылителей для насаждений яблони 2153256 Инсектицидное средство и способ борьбы с вредителями сельскохозяйственных культур 2450505 Порционное устройство для вытирания семян трав 2272399 Зерноуборочный комбайн 2053664 Медогонка 2407284 Акустический анализатор роевого состояния пчелосемей 2027757 Способ получения растений - регенерантов in vitro |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
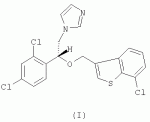 способ получения соединения формулы (I), композиция, обладающая противогрибковым действием, на основе соединения формулы (I) и применение соединения формулы (I) в качестве активного ингредиента противогрибковой композиции. Технический результат - соединение формулы (I) можно использовать в композициях для лечения грибковых инфекций у человека или животных и для борьбы с болезнями сельскохозяйственных культур. 5 н. и 10 з.п. ф-лы, 1 табл.
способ получения соединения формулы (I), композиция, обладающая противогрибковым действием, на основе соединения формулы (I) и применение соединения формулы (I) в качестве активного ингредиента противогрибковой композиции. Технический результат - соединение формулы (I) можно использовать в композициях для лечения грибковых инфекций у человека или животных и для борьбы с болезнями сельскохозяйственных культур. 5 н. и 10 з.п. ф-лы, 1 табл.