Штамм гриба duddingtonia flagrans, проявляющий свойства против галловых нематод растений и паразитических нематод животных и стимулирующий рост и развитие растенийПатент на изобретение №: 2253671 Автор: Теплякова Т.В. (RU), Репин В.Е. (RU), Рябчикова Е.И. (RU), Свириденко А.Н. (RU) Патентообладатель: Государственный научный центр вирусологии и биотехнологии "Вектор" (ГНЦ ВБ "Вектор") (RU) Дата публикации: 27 Ноября, 2004 Начало действия патента: 13 Мая, 2003 Адрес для переписки: 630559, Новосибирская обл., Новосибирский р-н, п. Кольцово, ГНЦ ВБ "Вектор", зав. патентным отделом Ю.Н. Мистюрину Изображения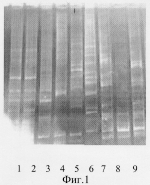  Изобретение относится к биотехнологии и представляет собой нематофаговый штамм гриба Duddingtonia flagrans, который может быть использован в качестве основы для получения биопрепаратов. Штамм Duddingtonia flagrans Т-89, зарегистрированный в Коллекции культур микроорганизмов ГНЦ ВБ “Вектор” под номером F-882, проявляющий свойства против галловых нематод растений и паразитических нематод животных и стимулирующий рост и развитие растений. Штамм обладает высокими показателями стимуляции роста, развития растений и проявлением нематофагового эффекта. 6 табл., 2 ил. Изобретение относится к микробиологической промышленности и представляет собой нематофаговый штамм гриба Duddingtonia flagrans, который может быть использован в качестве продуцента для получения биопрепаратов для борьбы с паразитическими нематодами растений и животных. Известны штаммы нематофаговых грибов: Arthrobotrys oligospora BKMF-2461D (Авторское свидетельство СССР, МПК С 12 N 1/14, №1264393, опубл. 1986), Arthrobotrys oligospora (патент США №4975105, МПК С 05 F 11/08, опубл. 1990), проявляющие высокий нематофаговый эффект. Препаративные формы для борьбы с галловыми нематодами получали на разных органических субстратах. Действующее начало - конидии и мицелий гриба. Однако такие штаммы характеризуются нестабильностью морфологических признаков нематофаговых свойств. Это проявляется в появлении секторов и пятен в колониях культур на агаризованных питательных средах. Цитокариологическим анализом обнаружены анастомозы между гифами, а также различие ядер по форме и величине в многоядерных базальных клетках конидиеносцев. Препарат на основе конидий может храниться не более 1 года. Известен другой аналог штамм Arthrobotrys oligospora 3062D (Авторское свидетельство СССР №1688818, МПК А 01 N 63/00, опубл. 1991), проявляющий по сравнению с вышеприведенным штаммом более высокий нематофаговый эффект и стабильность свойств. Действующим началом также являются конидии и мицелий. Данный штамм является основой разработанного биопрепарата “нематофагин-БЛ”, утвержденного в 1990 году Комиссией по микробиологическим средствам защиты ВАСХНИЛ, Союзсельхозхимией, и рекомендован для внедрения. “Нематофагин-БЛ” включен в список биопрепаратов, разрешенных к применению на территории России. Однако штаммы рода Arthrobotrys образуют в условиях поверхностной культуры конидии и мицелий, которые не приспособлены для длительного хранения, для применения против гельминтозов животных и нуждаются в дополнительных средствах для зашиты конидий от воздействия пищеварительных процессов животных [Прядко Э.И., Осипов П.П.Пленкообразующие вещества в качестве защиты конидий хищных грибов от воздействия пищеварительных процессов животных. Грибы-гифомицеты - регуляторы численности паразитических нематод. - Алма-Ата: Наука, 1990. - С.97-112], а при внесении в почву против фитопаразитических нематод необходимо длительное время (2-3 недели) для осуществления процесса адаптации и формирования хламидоспор и ловушек, которые обеспечивают хищным грибам существование в этой экологической нише. Более детальное изучение поведения нематофаговых грибов в условиях почвы позволило установить, что конидии не являются формой существования гриба в почве. При помощи прямого микроскопирования и метода мембранных камер установлено, что хищные грибы рода Arthrobotrys существуют в почве в виде хламидоспор. Часть конидий и мицелия, внесенной в почву, подвергается лизису, а часть клеток трансформируется в хламидоспоры. Они имеют мощную меланизированную оболочку, характеризуются повышенной активностью по отношению к нематодам, так как при прорастании сразу формируют улавливающие приспособления. Наиболее близким аналогом (прототипом) является штамм Duddmgtonia flagrans CI 3 DSM 6703 (Патент США №5643568, МПК А 01 N 63/00, опубл. 1997), обладающий нематофаговыми свойствами и используемый для борьбы с паразитирующими на животных нематодами. Однако данный штамм не исследовался на активность в отношении галловых нематод растений и не обладает свойством стимулировать рост растений, что сужает область его использования. Техническим результатом настоящего изобретения является получение нового штамма нематофагового гриба, обладающего высокой эффективностью в уничтожении галловых немагод растений, возбудителей гельминтозов животных, способностью сохранять жизнеспособность без потери свойств, как при прохождении через желудочно-кишечный тракт животных, так и в услових почвы, а также обладающего свойством стимулировать рост и развитие растений. Указанный результат достигается тем, что в качестве продуцента для получения биопрепаратов для борьбы с паразитическими нематодами растений и животных предлагается использовать штамм Duddingtonia flagrans T-89, зарегистрированный в коллекции культур микроорганизмов ГНЦ ВБ “Вектор” под номером F-S82 (справка о депонировании штамма прилагается). Заявляемый штамм характеризуется: - образованием в поверхностной культуре на различных твердых (агаризованных и сыпучих) средах спороношения преимущественно в виде хламидоспор, имеющих толстую оболочку; - хламидоспоры хранятся в сухом состоянии без потери исходных свойств гриба и жизнеспособности не менее двух лет, легко восстанавливаются даже после 10-летнего хранения при помещении культуры в суспензию нематод, которые стимулируют прорастание хламидоспор; - обладает высокой эффективностью по отношению к разным нематодам, проявляет длительность действия; сравнительная характеристика методом геномной дактилоскопии показала значительные различия данного штамма от прототипа. Штамм гриба Duddmgtonia flagrans T-89 выделен из почвы тепличного комбината “Кировец” г. Новосибирска в 1989 г. и депонирован в коллекции микроорганизмов НИИ коллекции культур микроорганизмов ГНЦ ВБ “Вектор” (пос. Кольцово, Новосибирская область) под номером F-882. Штамм имеет следующие культурально-морфологические и физиолого-биохимические признаки. На сусло-агаре и пептонно-кукурузном агаре образует колонии, имеющие пушистый мицелий коричневатого оттенка. На конидиеносцах образуются немногочисленные конидии, двухклеточные, прямые или слегка изогнутые. На вершине конидиеносцев образуется от 4 до 12 конидий, средний размер которых составляет 40×10 мкм. На мицелии обильно образуются круглые хламидоспоры, диаметр которых составляет от 25 до 55 мкм. Они имеют темно-коричневую окраску и толстую грубобородавчатую оболочку. В присутствии нематод гриб образует клейкие петли и их сплетения, участвующие в акте хищничества. Гриб усваивает различные источники углерода и азота. Хорошо растет на средах, содержащих сусло, мелассу, кукурузный экстракт. Оптимальная температура роста +(25-26)°С, нижний предел +(5-6)°С, верхний +(29-30)°С. Хранится штамм на агаризованной среде - пептонно-кукурузном агаре (ПКА) в пробирках при температуре +(4-5)°С в течение 2-х лет. Для длительного хранения могут быть использованы лиофилизация, криоконсервация, а также хранение в стерильной почве. Штамм F-882 маркерных признаков не имеет. Имеется характеристика ДНК штамма, полученная методом ПЦР-геномной дактилоскопии. Штаммы Duddingtonia flagrans широко применяются в различных странах (США, Дания, Аргентина и др.) в экспериментах на животных (лошади, овцы и др.) для борьбы с распространенными и опасными заболеваниями с.-х. и домашних животных - гельминтозами. В собственных экспериментах по исследованию заявляемого штамма на мышах токсичности не обнаружено. Имеется заключение Научно-исследовательского института медицины труда и экологии человека Российской академии медицинских наук (Сибирское отделение - Восточно-Сибирский научный центр), аккредитованного как испытательный центр в Системе сертификации ГОСТ Р (РОСС RU. 0001.510164) о не вирулентности, не токсичности, не токсигенности штамма. На фиг.1 приведена электрофореграмма RAPD-ПЦР анализ геномных ДНК грибов с праймером Ш-19. Штаммы: дорожка 1 - Phoma exigua 13, 2 - Phoma exigua 3; 3 - Pleurotus ostreatus A, 4 - Rhizoctonia solani var. faviata S, 5 - Rhizoctonia solani var. faviata SC, 6 - Rhizoctonia solani var. faviata P; 7 - Arthrobotrys sp. V-02, 8 - Duddingtonia flagrans T-89, 9 - Arthrobotrys oligospora BKMF-3062D. Характеризация штаммов грибов по методу ПП-ПЦР-геномной дактилоскопии Для изучения геномного полиморфизма особый интерес представляют гипервариабельные минисателлитные последовательности. Метод ПП-ПЦР-дактилоскопии (RAPD-PCR analysis) [Шагинян И.А., Гинцбург А.Л. ПЦР-генетическое типирование патогенных микроорганизмов // Генетика 1995, том 31, №5, с.600-610] с использованием произвольных праймеров длиной 6-20 нуклеотидов позволяет получать ряд ампликонов различной длины с молекулярными массами от 200 до 1500 пар нуклеотидов, при этом спектр ампликонов меняется для каждой комбинации праймер-ДНК-мишень, но характерен для каждой из комбинаций. При регистрации продуктов амплификации с помощью электрофореза в полиакриламидном или агарозном гелях каждый спектр разрешается в виде профилей амплификации, или дактилоскопии. Ниже приведен сравнительный анализ геномных ДНК гельминтофаговых грибов рода Arthrobotrys и Duddingtonia flagrans методом ПП-ПЦР-геномной дактилоскопии с применением произвольных праймеров. Геномные ДНК грибов выделяли из биомассы по методике Ahman и др. [Ahman J., Ek В., Rask L., Tunlid A. Sequence analysis and regulation of a gene encoding a cuticle-degrading serine protease from the nematophagouse fungus Arthrobotrys oligospora. // Microbiol. 1996. V.142, N7. P.1605-1616] с применением протеиназы К и с последующей очисткой ДНК фенолом и хлороформом. Качество ДНК оценивали методом электрофореза в 1%-ном агарозном геле ( Маниатис Р.А., Фрич Э., Сэмбрук Д. Методы генетической инженерии. Молекулярное клонирование. // М,: Мир, 1984. С.479). Полимеразную цепную реакцию с произвольными праймерами проводили следующим образом. Реакционная смесь (объем 25 мкл) содержала: 1.2 мкл смеси 2тМ дезокси-нуклеозидтрифосфатов, 2.5 мкл буфера MPCR (0.5M трис-НСl рН 8.8, 160тМ (NH4)2SO4 , 20mM MgCl2, 0,5тМ твин-20), 0.5 мкл Taq-полимеразы, 2.5 мкл 0.02М MgCl2, 1 мкл олигонуклеотидного праймера, 1 нг геномной ДНК. Условия амплификации (30 циклов): 94°С - 1 мин (этап денатурации); 42°С - 1 мин (этап отжига); 72°С - 1,5 мин (этап достройки цепи); 72°С - 8 мин (этап завершающего синтеза). Анализ продуктов амплификации проводили с помощью электрофореза в 4%-ном полиакриламидном геле с последующим окрашиванием бромистым этидием. Наиболее важным этапом при использовании ПЦР-дактилоскопии в генетическом типировании микроорганизмов является экспериментальный поиск и подбор праймера или их комбинации для наиболее эффективной дифференциации близкородственных представителей того или иного вида организмов. Для этой цели были испытаны несколько “случайных” праймеров длиной 10-20 нуклеотидов (таблица 1) на ДНК грибов Arthrobotrys oligospora (BKMF-3062D) и Duddingtonia flagrans T-89. В качестве отрицательных контролей были взяты ДНК микобактерии Mycobacterium bovis и ДНК бациллы Bacillus subtilis 652. Наиболее специфичными и информативными праймерами для дифференциации штаммов оказались олигонуклеотиды GDI8 и Ш-19, с которыми далее был проведен анализ вновь выделенных хромосомных ДНК грибов. Таблица 1Праймеры для проведения ПП-ПЦР-геномной дактилоскопии Наименование праймеровСостав праймеров Р295'-CCGGCCTTAC Ш-145'-AATCGGGCTG Ш-165'-GTGATCGCAG Ш-195'-AGTCAGCCAC GD15'-AGGACGAGCTCGCGGATATA GD135'-CTCGGCGGCCCGGGCAGAGAC GD185'-AGCCCGCGGGGCCGTCGTДля анализа помимо грибов рода Arthrobotrys (Arthrobotrys oligospora BKMF-3062D, Duddingtonia flagrans T-89 и Arthrobotrys sp. V-02) были взяты дополнительно еще 6 контрольных препаратов грибов других различных родов: Phoma exigua 3 и Phoma exigua 13; Rhizoctonia solani var. faviata S, Rhizoctonia solani var. faviata P и Rhizoctonia solani var. faviata SC; Pleurotus ostreatus А. После выделения хромосомных ДНК грибов провели их характеризацию методом ПП-ПЦР-генотипирования с использованием одного из подобранных праймеров Ш-19 (табл.1). Были получены следующие результаты (Фиг.1): все картины геномных фингерпринтов контрольных ДНК отличались от таковых для рода Arthrobotrys. Для грибов Arthrobotrys похожими были картины полос у штаммов Arthrobotrys oligospora BKMF-3062D и Arthrobotrys sp. V-02 (дорожки 7 и 9). Вероятно, они оба относятся к виду Arthrobotrys oligospora. Штамм Duddingtonia flagrans T-89 (дорожка 8) существенно отличался от них, в частности, на электрофореграмме в диапазоне длин от 400 до 1300 пар нуклеотидов (пн) полосы совершенно не совпадают с таковыми на дорожках 7 и 9, а в диапазоне 300-340 пн вместо двойных полос на дорожке 8 присутствует лишь одна, т.к. Duddingtonia flagrans T-89 является представителем другого рода грибов, на что указывают и данные морфологических исследований этого штамма. Пример 1. Сравнительный нематофаговый эффект Duddingtonia flagrans и Arthrobotrys oligospora BKMF-3062D в суспензии нематоды сапрозойной Panagrellus rediviras. (табл.2). Таблица 2.Нематофаговый эффект разных штаммов хищных грибов ВариантНематофаговый эффект в %1 сутки 2 сутки3 сутки4 сутки A. oligospora BKMF-3062D 9799100 100D flagrans F-882 738898 100Duddingtonia flagrans, как и Arthrobotrys oligospora проявляет хороший аттрактивный эффект, который обнаруживается по числу скопившихся нематод в блоках из культур грибов, выросших на пептонно-кукурузном агаре. Как и многие покоящиеся структуры, имеющие толстые оболочки, хламидоспоры Duddingtonia flagrans требуют для прорастания чуть больше времени, чем прототип, культура которого представлена конидиями и мицелием. Пример 2. Большое количество хламидоспор, требующих адаптации к почвенным условиям, позволяет осуществлять применение Duddingtonia flagrans F-882 не только за 2-3 недели до высадки рассады растений, поражаемых паразитическими нематодами, но и одновременно с растениями. В опыте, где биопрепарат на основе штамма D. flagrans F-882 был внесен в лунку вместе с рассадой огурца, наблюдалось его пролонгированное действие, что сказалось на галловых немагодах и на урожайности следующего оборота томата (табл.3). Таблица 3.Результаты производственного опыта по внесению биопрепарата на основе D. flagrans против галловых нематод ВариантУрожайность огурца Урожайность томата План ФактПлан Факт Центнер на 1 теплицу Центнер на 1 теплицуПрепарат на основе Duddingtonia flagrans F-882160 23030 34Пропаривание почвы (контроль) 232143 3026Пример 3. Скармливание в течение 7 суток зернового биопрепарата на основе штаммов D. flagrans F-882 в дозе 3 г в день в течение 7 суток лабораторной линии белых мышей, пораженных гельминтами (сифации, аспикулюрусы), показало, что гриб, проходя через пищеварительную систему животных, сохраняет свою жизнеспособность и нематофаговую эффективность. Экскременты опытных и контрольных линий помещали в чашки Петри на голодный агар (ГА) и осуществляли их прямое микроскопирование. Установлено наличие ловчих петель и хламидоспор гриба на экскрементах во всех пробах с хищным грибом, начиная с 2-х суток. Было также отмечено уменьшение колоний грибов рода Aspergillium, Penicillium и актиномицетов, как на поверхности агара, так и на самих экскрементах опытного варианта после употребления препарата в течение 3-х суток. После окончания опыта гельминтологический анализ показал полное отсутствие нематод в экскрементах мышей в опыте с грибом-нематофагом, в то время как в контрольном варианте их число в 1 г составляло в среднем 8 штук. Пример 4. Опыт поставлен с использованием фекалий лошадей, спонтанно инвазированных стронгилятами желудочно-кишечного тракта. Предварительные исследования методом овоскопии по Котельникову-Хренову показали высокую зараженность животных. Интенсивность инвазии составила 35-50 яиц в одной капле. Из этой пробы сделаны навески навоза массой 36 г. и 50 г. и равномерно распределены по чашкам Петри. В одну чашку с пробой фекалий массой 50 г. было добавлено 78 зерен ржи, на которой был выращен гриб Duddingtonia flagrans. Пробы были поставлены в термостат при температуре 26.7°С. Через 13 суток личинок нематод выделяли по методу Бермана-Орлова. Результаты представлены в табл.4. Таблица 4Влияние гриба D. flagrans на численность паразитических нематод лошадей Вариант Масса, г.Количество личинок стронгилят, экз.На 13 сутки В 1 г. фекалийКонгроль 36.0822.3 D. flagrans50.0 100.2Анализ полученных данных показал, что на 13 сутки после взятия проб в опытной пробе (D. flagrans) численность личинок паразитических нематод была в 11.5 раз меньше, чем в контрольной пробе. Пример 5. Данные о заявляемом штамме, обеспечивающем стимулирование роста и развития растений. Испытания гриба Duddingtonia flagrans в опытах на разных культурах позволили установить стимулирующий эффект на рост и развитие растений. Это отмечено на сеянцах сосны, на цикламенах, на огурцах и томатах. Внесение биомассы глубинной культуры Duddingtonia flagrans в горшочки под рассаду огурца при ее пикировке в дозе 1% к массе субстрата, состоящего из опилок, торфа и почвы, привело к значительному опережению растений в росте, формировании листьев. Через 4 недели вегетации был проведен анализ огурца сорта “Кристалл”, результаты представлены в табл.5. Таблица 5Данные о стимулирующем эффекте на рост и развитие растений биомассы Duddingtonia flagrans T-89Вариант Высота растений, смКоличество листьев Вес надземной биомассы, г Вес корня, гБиомасса гриба D. flagrans12,86 7,73,2 Контроль7,144 2,22,1Пример 6. В декабре 2002 года в тепличном комбинате КГУП вЂњИндустриальный” г. Барнаула под огурцы сорта “Сапфир” в теплице №36 был внесен препарат на основе D. flagrans в дозе по 45 г в лунку под рассаду (450 растений). Учеты, проведенные через 5 недель, показали, что средняя высота опытных растений составляла 180 см, на растениях было много завязей и плодов массой до 100 г. На контрольной площади, где не вносился препарат, растения имели среднюю высоту 150 см, а завязи только начали развиваться. Эксперименты на разных видах нематод, проведенные в лабораторных и полевых испытаниях, свидетельствуют о проявлении хищным грибом Duddingtonia flagrans нематофаговых свойств по отношению к сапрозойной нематоде Panagrellus redivivus, фитопаразитическим нематодам из рода Meloidogyne (M. hapla, M. incognita, M. javanica, M. arenaria), энтомопатогенным нематодам Steinernema carpocasae и S. feltiae, а также стронгилятам желудочно-кишечного тракта лошади - Trichonema, Strongylus, Alfortia, Delafondia и личинкам Elaphostrongylus sp. - возбудителю гельминтоза головного мозга маралов. Пример 7. Для оценки стимулирующего влияния гриба Duddingtonia flagrans T-89 (номер F-882) на рост и развитие растений и одновременное проявление нематофаговой эффективности был проведен лабораторный опыт, в котором использовали культуры хищных грибов D. flagrans T-89 и Arthrobotrys oligospora BKMF-3062D (рабочее название Т-82). На основе этих культур предварительно был получен биопрепарат путем выращивания грибов на зернах ржи. В качестве тест-объекта использовали огурцы сорта Зозуля. Опыт проводили в пластмассовых стаканчиках, а в качестве субстрата использовали прокаленный речной песок. Для создания инфекционного фона использовали измельченные корневые галлы огурца из тепличного комбината “Индустриальный” (Барнаул). Биопрепарат вносили одновременно с посевом проросших семян огурцов в дозе 1% к массе субстрата в стаканчике, которая составляла 225г. В каждом варианте было по 5 растений. Полив растений осуществляли из расчета 20 мл на 1 растение через 2-3 дня по мере подсыхания почвы. Один раз в 10 дней растения поливали раствором “Золото Флоры”. Контроль был представлен сосудами, в которые биопрепарат не вносили. Продолжительность опыта составила 4 недели. Результаты проведенного опыта позволили установить различия в росте, развитии растений, а также проявлении нематофаговой эффективности в зависимости от штамма хищного гриба. Лучшие показатели отмечены в варианте с Duddingtonia flagrans T-89 (заявляемый штамм). К окончанию опыта ни одно растение в этом варианте не погибло. В варианте с A. oligospora (Т-82) 2 растения погибли, 2 имели желтые засохшие семядольные листья, у 5 растений отмечен хлороз листьев. Кроме различий в высоте растений, длине корневой системы, количестве листьев, варианты различались по количеству галлов на одно растение. Как видно из таблицы 6, наилучшие показатели роста, развития растений и проявления нематофагового эффекта были в варианте со штаммом Duddingtonia flagrans (см. фиг.2) Таблица 6Влияние разных штаммов хищных грибов на рост и развитие растений огурца и проявление нематофаговой эффективности ВариантПоказатели Высота растений, смДлина корней, смКоличество листьев, шт. Количество галлов на 1 растение, шт. Arthrobotrys oligospora Т-8213,7 5.82,343,3 Duddingtonia flagrans Т-89 15,56,42,5 28,3Контроль 10,22,21,3 55,0Промышленная применимость. Изобретение может быть использовано в микробиологической промышленности и сельском хозяйстве как продуцент для производства биопрепаратов. Формула изобретенияШтамм Duddingtonia flagrans Т-89, зарегистрированный в Коллекции культур микроорганизмов ГНЦ ВБ “Вектор” под номером F-882, проявляющий свойства против галловых нематод растений и паразитических нематод животных и стимулирующий рост и развитие растений. PC4A Государственная регистрация перехода исключительного права без заключения договора Лицо(а), исключительное право от которого(ых) переходит без заключения договора: Федеральное государственное унитарное предприятие «Государственный научный центр вирусологии и биотехнологии «Вектор» (73) Патентообладатель: Федеральное государственное учреждение науки «Государственный научный центр вирусологии и биотехнологии «Вектор» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека Дата и номер государственной регистрации перехода исключительного права: 16.04.2010 № РП0000704 Извещение опубликовано: 27.05.2010 БИ: 15/2010 QB4A Регистрация лицензионного договора на использование изобретения Лицензиар(ы): Федеральное государственное учреждение науки "Государственный научный центр вирусологии и биотехнологии "ВЕКТОР" Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека Вид лицензии*: ИЛ Лицензиат(ы): Общество с ограниченной ответственностью "МИКО-С" Договор № РД0072243 зарегистрирован 10.11.2010 Извещение опубликовано: 20.12.2010 БИ: 35/2010 * ИЛ - исключительная лицензия НИЛ - неисключительная лицензия PD4A Изменение наименования, фамилии, имени, отчества патентообладателя (73) Патентообладатель(и): Федеральное бюджетное учреждение науки «Государственный научный центр вирусологии и биотехнологии «Вектор» (RU) Дата публикации: 20.04.2012 QC4A Государственная регистрация расторжения зарегистрированного договора Дата и номер государственной регистрации расторгаемого договора: 10.11.2010 № РД0072243 Вид договора: лицензионный Лицо(а), передающее(ие) исключительное право: Федеральное бюджетное учреждение науки "Государственный научный центр вирусологии и биотехнологии "ВЕКТОР" (RU) Лицо, приобретающее право использования: Общество с ограниченной ответственностью "МИКО-С" (RU) Дата и номер государственной регистрации расторжения договора: 28.06.2012 РД0101973 Дата внесения записи в Государственный реестр: 28.06.2012 Дата публикации: 10.08.2012 Популярные патенты: 2230467 Добавка к пищевым продуктам, биоцидный препарат, 2-(1-окси- 4-гидроксифенилен)-бензохинон (варианты) и способ его получения ... сочетающего биоцидные и антиоксидантные свойства, и перспективного для использования в виде добавки к пищевым продуктам или в качестве биоцидного средства, а также способа их получения.Выделенный в ходе синтеза 2-(1-окси-4-гидроксифенилен) бензохинон, кристаллогидрат имел брутто-формулу C12H10O5.Молекулярная масса, определенная по криоскопическому методу (В.А. Попков, Г.М. Дугачева. Криоскопический метод определения чистоты лекарственных веществ. М.: Медицина, 1999, с.9-28) составил 234 к.е. (анализ 2408).Массовая доля углерода -59.5% (расчет 61.5%); массовая доля водорода -4.8% (расчет -4.3%).Вещество после кристаллизации и сушки образует игольчатые кристаллы серого цвета, ... 2108700 Способ оценки горных сенокосов и пастбищ ... период обеспечивает полную сохранность растительности к осеннему периоду. Нарушение дернины перед уходом в зиму классифицируется как неправильный уход за участком, и, следовательно, снижается его оценка. Если в весенний период есть нарушения дернины более, чем на 20%, оценивается как экологическое бедствие с оценкой в 2 балла. При наличии бобовых растений в фазу цветения около 20% оценка проводится с учетом первоначальной характеристики участка. Перед уходом в зиму возможно дальнейшее нарушение дернины с оценкой 2 балла. В этом случае сумма трех оценок делится на три. Пример 1. На пастбищах /высота 600-700 м над уровнем моря/, где почвы каштановые и карбонатные черноземы, определяли ... 2206985 Упряжь для собак ... Предлагаемая упряжь выполнена в виде шлейки, имеющей спинной элемент 1 (фиг. 1), в который жестко вшиты плечевые элементы 2, нагрудный элемент 3, подпругу 4, жестко вшитую в спинной ремень 1, и застежки 5 в виде металлических пряжек, посредством которых все названные элементы соединены между собой. Нагрудный элемент 3 выполнен цельнокроеным и имеет оригинальную форму перевернутого треугольника 6 (фиг.2) с дугообразными сторонами 7, что обеспечивает плотное и равномерное прилегание этого элемента к грудине 8 собаки, как это показано на фиг. 1. В вершину треугольника 6 (Фиг.2) жестко вшит ремень 9, присоединяемый застежкой 5 к подпруге 4, а на концах у основания этого треугольника 6 ... 2091380 Производные пиколиновой кислоты или их кислотно-аддитивные соли, способ их получения, нербицидная композиция и способ борьбы с сорняками ... ... 2180475 Устройство для поштучной подачи предметов, в частности семян сельскохозяйственных культур ... диаметр которых равен диаметру входных отверстий упомянутых наклонных каналов, а центр лежит на окружности, проходящей через центры входных отверстий, которые выполнены с возможностью, по меньшей мере, частичного поочередного совмещения с отверстиями в упомянутой шайбе при повороте бункера, причем устройство снабжено также средством для подачи сжатого газа к дополнительным отверстиям в шайбе. 7. Устройство по одному из пп. 1-6, отличающееся тем, что бесконечная лента представляет собой плоский текстропный ремень с продольным углублением для размещения подаваемых предметов, выполненным на поверхности, примыкающей к щели накопительного бункера. MM4A Досрочное прекращение действия ... |
Еще из этого раздела: 2422377 Биоцидный концентрат 2281637 Способ производства зеленого корма при возделывании в орошаемом земледелии и устройство для его осуществления 2264075 Рулонный пресс-подборщик лубяных культур 2479996 Экологический комплекс для аквакультуры и рекультивации морских вод 2088063 Широкозахватный сельскохозяйственный агрегат 2492650 Микроэмульсионная бактерицидная композиция 2216908 Комбайн для уборки урожая с кустарников 2093022 Устройство для выпаивания животных 2165137 Машина для уборки корней лекарственных растений 2405306 Способ определения содержания крахмала по содержанию глюкозы с учетом индивидуального коэффициента пересчета в растительном материале |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||