Способ криосохранения меристем, изолированных из растений малины красной (rubus idaeus l.), in vitroПатент на изобретение №: 2248121 Автор: Высоцкая О.Н. (RU), Попов А.С. (RU) Патентообладатель: Институт физиологии растений им. К.А. Тимирязева Российской Академии Наук (RU) Дата публикации: 20 Марта, 2005 Начало действия патента: 4 Декабря, 2003 Адрес для переписки: 127276, Москва, ул. Ботаническая, 35, Институт физиологии растений Российской Академии Наук, патентная служба Изображения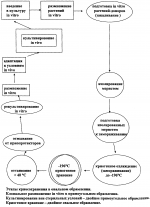 Изобретение относится к биотехнологии, в частности к криосохранению меристем малины красной (Rubus idaeus L.). Подготавливают растения-доноры меристем к замораживанию, где растения-доноры закаливают на твердой питательной среде, дополненной веществами цитокининового действия. Затем выделяют апексы и обрабатывают криопротекторами. Охлаждают апексы в криоампулах, с последующим криосохранением. Проводят посткриогенную регенерацию растений из кроисохраненных меристем. Предлагаемый способ криосохранения меристематических апексов, изолированных из закаленных in vitro растений, позволяет восстанавливать растения из криосохраненных меристем малины красной (Rubus idaeus L.), минуя стадию каллусообразования. 1 ил., 2 табл. Изобретение относится к биотехнологии, в частности к сохранению генетических ресурсов вегетативно размножаемых растений, и может использоваться в садоводстве для длительного криогенного хранения оздоровленных клонов ценных сортов малины красной (Rubus idaeus L.). Криобанк изолированных меристем позволяет длительное время и экономично сохранять оздоровленные клоны ценных отечественных и районированных в России иностранных сортов малины красной. Известен способ криосохранения меристем малины красной, принадлежащий Б.Рид и Х-Лагерстедт (Reed В.М., Lagerstedt H.B. Freeze preservation of apical meristems of rubus in liquid nitrogen //Hort. Science. 1987. V.22. №2. Р. 302-303). В этом способе авторы размножали растения малины пяти видов. Для этого была использована питательная среда Андерсона (Anderson W.C. Tissue culture propagation of red and black raspberries Rubus idaeus and R. occidentalis. //Acta Hort. 1980. V.112. P.13-20), дополненная: 43 Через год появилась статья, где был изложен усовершенствованный метод криосохранения меристем малины красной (Reed B.M. Cold acclimation as a method to improve survival of cryopreserved Rubus meristems // Cryo-Letters. 1988. V.9. P. 166-177). На этот раз для размножения растений малины in vitro автор использовала питательную среду МС - Мурасиге и Скуга (Murashige Т., F.Skoog A revised medium for rapid growth and bio-assays with tobacco tissue cultures //Physiol.Plantarum. 1962. 15. Р.473-497), дополненную, как и в предыдущей статье, 43 Следующий этап усовершенствования метода криосохранения меристем малины был представлен в 1993 году (Reed B.M. Responses to ABA and cold acclimation are genotype development for cryopreserved blackberry and raspberry meristems//Cryobiology. 1993. V.30. P.179-184). Растения малины размножали на модифицированной среде Мурасиге и Скуга, дополненной 1 мг/л бензиламинопурина, 0,05 мг/л индолилуксусной кислоты, 0,01 мг/л гиббереловой кислоты, 3% сахарозы, витаминами, 3,5 г/л агар-агара и 1,45 г/л гельрита, в сосудах фирмы "Magenta" (+25° C, освещение: 30 В последней из известных нам публикаций по криосохранению малины, предложено увеличить период холодовой акклиматизации для получения максимальной криоустойчивости меристем (Chang Y., Reed B.M. Cold acclimation improves the cryopreservation of in vitro - grown Pyrus and Rubus meristems / Cryopreservation of tropical plant germplasm. Ed. F.Engelmann and H.Takagi. Japan International Research Center for Agricultural Sciences Tsukuba, Japan. International Plant Genetic Resources Institute, Rome, Italy - 2000. - P.382-384). Размноженные in vitro растения "акклиматизировали" не более 15 недель в климатической камере при +22° С с освещением 3 Недостатком этого способа, приведенного в разных вариантах, является высокий уровень каллусообразования у выживших апикальных меристем: от 8-19% до 23% (Reed B.M., Lagerstedt H.B., 1987; Reed B.M., 1988). Причиной этому является использование в процессе криосохранения во всех вариантах способа высокоосмотичной и высокотоксичной смеси криопротекторов, под названием PGD, которая способствует образованию каллуса при регенерации растений из криосохраненых меристем, а следовательно, ведет к увеличению вероятности генетических изменений и снижению возможности сохранения сортовых свойств у посткриогенных регенерантов. Наиболее близким технологическим решением из известных нам является "способ криосохранения меристем земляники, изолированных из растений in vitro" (заявка на изобретение № 2002113550/13 от 24.05.2002 с решением о выдаче патента от 02.09.2003). В этом способе маточные растения земляники, размноженные in vitro, закаливали в течение 1-2 месяца на модифицированной питательной среде, дополненной 6% сахарозой или глюкозой, обработку изолированных меристем перед замораживанием (18-19 часов) проводили на жидкой питательной среде с криопротекторами - 6% сахарозы или глюкозы и 5-7% ДМСО, апексы охлаждали в криоампулах, заполненных раствором 6% сахарозы или глюкозы и 7-9% ДМСО, содержащим лед, в программируемом замораживателе по оригинальной программе со скоростью 0,3-0,33° С/мин до (-38)-(-40)° С, затем со скоростью 9-11° С/мин до -75° С с погружением в жидкий азот (-196° С) на срок не менее часа, посткриогенное восстановление растений из оттаявших меристем, освобожденных от избытка криопротекторов, проводили на модифицированной питательной среде с 0,5-1 мг/л бензиламинопурина и 3%-ными глюкозой или сахарозой при 19-20° С, 16-часовом дне и освещенности 0,5-1 клк. В результате этот способ позволил получить регенеранты из 62,5±9,0% криосохраненных меристем земляники 16 различных сортов. Однако этот способ, хотя и позволяет избегать стадию каллусообразования, оказался неприемлем для криосохранения апексов малины красной, поскольку не позволял стабильно получать растения - регенеранты этого вида растений из меристем после жидкого азота. Задачей, на решение которой направлено настоящее изобретение, является разработка метода криосохранения, который обеспечивает стабильное получение из меристематических апексов малины красной, после замораживания, хранения в жидком азоте и оттаивания, растений - регенерантов, принадлежащих сортам различной регенерационной способности (из каждой криоампулы, содержащей не менее 20 апикальных верхушек), минуя стадию каллусообразования. Поставленная задача решается тем, что в способе криосохранения меристематических апексов, изолированных из закаленных in vitro растений проводят охлаждение апексов в криоампулах до сверхнизких температур, хранение ампул с меристемами в жидком азоте и посткриогенную регенерацию растений из меристем в следующем порядке: закаливание растений-доноров в темноте 1-2 месяца на твердой агаризованной питательной среде, дополненной 6% сахарозой или глюкозой, обработку изолированных меристем перед замораживанием - 18-20 часов на жидкой питательной среде с криопротекторами - 6% сахарозы или глюкозы и 5% ДМСО, охлаждение апексов в герметично закрытых криоампулах, заполненных раствором 6% сахарозы и 7% ДМСО, содержащим лед, в программируемом замораживателе по оригинальной программе со скоростью 0,3-0,33° С/мин до - 38-40° С, затем со скоростью 9-11° С/мин до -75° С с погружением в жидкий азот (-196°С) на срок не менее часа, посткриогенное восстановление растений из оттаявших меристем, освобожденных от избытка криопротекторов, первый этап которого проходит на модифицированной питательной среде, дополненной веществами цитокининового действия и 3% сахаров (сахарозой и, или глюкозой) при +19-20° С, 16-часовом дне и освещенности 0,5-1 клк, причем при закаливании дополнительно использованы вещества цитокининового действия На чертеже представлена принципиальная схема криосохранения меристем, изолированных из растений, культивированных и закаленных in vitro, включающая в себя не только этапы подготовки растительного материала к замораживанию, его хранения в жидком азоте и посткриогенного восстановления, но и все традиционные процедуры культивирования растений при клональном размножении in vitro. Эта схема представляет собой полный цикл преобразований растительного материала от обычного растения до растения, восстановленного после хранения в жидком азоте, способного нормально размножаться и плодоносить в грунте. Суть настоящего изобретения в том, что предлагаемый способ криосохранения меристем малины красной представляет собой совокупность модифицированных этапов известных методов замораживания живых объектов и эффективно обеспечивает после процедуры криосохранения получение, минуя стадию каллусообразования, растений-регенерантов испытанных нами клонов малины красной, которые отличаются друг от друга регенерационной способностью, из каждой криосохраненной ампулы, содержащей не менее 20 меристем. Заявленный способ отличается от прототипа тем, что растения - доноры меристем закаливают в течение 4-10 недель на питательной среде, дополненной веществами цитокининового действия. Изобретение иллюстрируется следующими примерами. Пример 1. Растения малины красной сорта Скромница и селекционного клона М 2, отличающихся друг от друга различной регенерационной способностью, размножают in vitro на агаризованной питательной среде МС (табл. 1), дополненной 3% сахарозой и веществами цитокининового действия. Маточные растения малины, полученные в результате размножения, закаливают на питательной среде (ПС-1) с 6% сахарозой и 6-бензиламинопурином в течение 2 месяцев в темноте при температуре 4±4° С (табл. 1). Затем изолированные из них меристематические верхушки 18 часов культивируют на жидкой питательной среде (ПС-1), дополненной 6% сахарозой и 5% ДМСО (табл. 1) при 4±4° С в темноте и переносят в криоампулы с 6% сахарозы и 7% ДМСО. Криоампулы с меристематическими верхушками, содержащие лед, охлаждают в программируемом замораживателе ЗРК-1 со скоростью 0,3° С/мин до -40° С, а затем со скоростью 9° С/мин до -75° С и помещают на хранение в жидкий азот (-196° С). После криогенного хранения не менее часа ампулы с меристемами оттаивают в водяной бане при +38±2° С. Размороженные меристемы извлекают из ампул и освобождают от криопротекторов последовательным перемещением сначала на сухую стерильную фильтровальную бумагу, затем дважды на свежую полужидкую питательную среду с агарозой (ПС-3), дополненную 3% сахарозы и веществом цитокининового действия (табл. 1). После процедуры освобождения от криопротекторов меристемы помещают на среду ПС-3, дополненную 3% сахарозы и веществом цитокининового действия, для рекультивирования при 18° С 16-часовом дне и освещенности 0,5-1 клк. После месяца рекультивирования, минуя стадию каллусообразования, из 40-70% меристем клона М 2 и 50-100% меристем сорта Скромница были получены регенеранты (побеги с листьями), которые после размножения in vitro давали потомство, пригодное после процедуры акклиматизации для высадки в нестерильные условия. Таблица 1Питательные среды, использованные при криосохранении меристем земляники садовой Fragaria*ananassa DuchВещество, мг/лПитательные среды МС МС-1ПС-1ПС-2 ПС-3ПС-4 Аммоний азотнокислый NH4 NО31650 165016501650 16501650 Калий азотнокислый KNО3 19001900 190019001900 1900Магний сернокислый MgSО4 7Н2О 370370370 370370370 Калий фосфорнокислый КН2 РО4170 170170170 170170Кальций хлористый СаСl2 7Н2О 370370370 370370370 Калий фосфорнокислый КН2 РО4170 170170170 170170Кальций хлористый СаСl2 2Н2О 440440- -440440 Кальций азотнокислый Ca(NO 3)2 2Н2О 440440- -440440 Кальций азотнокислый Ca(NO 3)2 6H2O --708 708-- Железо сернокислое FeSO4 6H2O --708 708-- Железо сернокислое FeSO4  7H2O 55.655.627.8 27.855.6 55.6Трилон Б Na2 ЭДТА74.674.6 37.337.3 74.674.6Марганец сернокислый MnSO4 7H2O 55.655.627.8 27.855.6 55.6Трилон Б Na2 ЭДТА74.674.6 37.337.3 74.674.6Марганец сернокислый MnSO4 7Н2O 370370370 370370370 Натрий молибденовокислый Na 2MoO4 7Н2O 370370370 370370370 Натрий молибденовокислый Na 2MoO4 2H2O 0.250.250.25 0.250.25 0.25Борная кислота Н 3ВО36.2 6.26.2 6.26.26.2 Цинк сернокислый ZnSO4 2H2O 0.250.250.25 0.250.25 0.25Борная кислота Н 3ВО36.2 6.26.2 6.26.26.2 Цинк сернокислый ZnSO4  7Н2O 8.68.68.6 8.68.68.6 Калий йодистый KI0.83 0.830.83 0.830.830.83 Кобальт хлористый СоСl 2 7Н2O 8.68.68.6 8.68.68.6 Калий йодистый KI0.83 0.830.83 0.830.830.83 Кобальт хлористый СоСl 2 6H2О 0.0250.0250.025 0.0250.025 0.025Медь сернокислая CuSO 4 6H2О 0.0250.0250.025 0.0250.025 0.025Медь сернокислая CuSO 4 5Н2O 0.0250.0250.025 0.0250.025 0.025Тиамин 0.50.50.5 0.50.50.5 Пиридоксин0.5 0.50.50.5 0.50.5Никотиновая кислота0.50.5 0.50.5 0.50.5Аскорбиновая кислота1.01.0 1.01.0 1.01.0Глицин 2.02.0 2.02.02.0 2.0Мезоинозитол 100100100 100100100 Глюкоза- 30000-60000 30000 Сахароза30000- 60000- 30000-6-бениламинопурин 2- +-1 -Тидиазурон -0,2- +-0,1 Агароза- --- 40004000Агар-агар 70007000 90009000- -Диметилсульфоксид (ДМСО) --5% 7%-- pН5.6 5.66.06.0 5.65.6 Бидистиллированную воду добавляли до 10000 мл Таблица 2Регенерация растений из криосохраненных меристем методом замораживания, изложенным в представленном способеСорт, клонВариант способа криосохранения % регенерации растений* из 10 и более меристем из каждой криоампулысредний % посткриогенной регенерацииСкромница Из примера 150, 68, 86, 86, 89, 96, 100 82,1±6,6 Из примера 2 38, 43, 58, 60, 68, 74, 7759,7±5,6 Клон М 2 Из примера 140, 46, 57, 70 53,25±6,6 Из примера 225, 37, 56, 67 46,25±9,4* При расчете процента регенерации регистрировали только апексы без признаков каллуса. 5Н2O 0.0250.0250.025 0.0250.025 0.025Тиамин 0.50.50.5 0.50.50.5 Пиридоксин0.5 0.50.50.5 0.50.5Никотиновая кислота0.50.5 0.50.5 0.50.5Аскорбиновая кислота1.01.0 1.01.0 1.01.0Глицин 2.02.0 2.02.02.0 2.0Мезоинозитол 100100100 100100100 Глюкоза- 30000-60000 30000 Сахароза30000- 60000- 30000-6-бениламинопурин 2- +-1 -Тидиазурон -0,2- +-0,1 Агароза- --- 40004000Агар-агар 70007000 90009000- -Диметилсульфоксид (ДМСО) --5% 7%-- pН5.6 5.66.06.0 5.65.6 Бидистиллированную воду добавляли до 10000 мл Таблица 2Регенерация растений из криосохраненных меристем методом замораживания, изложенным в представленном способеСорт, клонВариант способа криосохранения % регенерации растений* из 10 и более меристем из каждой криоампулысредний % посткриогенной регенерацииСкромница Из примера 150, 68, 86, 86, 89, 96, 100 82,1±6,6 Из примера 2 38, 43, 58, 60, 68, 74, 7759,7±5,6 Клон М 2 Из примера 140, 46, 57, 70 53,25±6,6 Из примера 225, 37, 56, 67 46,25±9,4* При расчете процента регенерации регистрировали только апексы без признаков каллуса. Пример 2. Растения малины красной, принадлежащие к одному мериклону, размножают in vitro на агаризованной питательной среде МС-1 (табл. 1), дополненной 3% глюкозой и веществом цитокининового действия. Маточные растения малины, полученные в результате размножения, переносят на питательную среду (ПС-2) с 6 % глюкозой и тидиазуроном и закаливают их в течение 1 месяца в темноте при 4±4° С (табл. 1). Затем изолированные из них меристематические верхушки 19 часов культивируют на жидкой питательной среде (ПС-2), дополненной 6% глюкозой и 5% ДМСО (табл.1) при 4±4° С в темноте и переносят в криоампулы с 6% глюкозы и 7% ДМСО. Криоампулы с меристематическими верхушками, содержащие лед, охлаждают в программируемом замораживателе ЗРК-1 со скоростью 0,33° С/мин до -40° С, а затем со скоростью 11° С/мин до -75° С и помещают на хранение в жидкий азот (-196° С). После криогенного хранения не менее часа ампулы с меристемами оттаивают в водяной бане при +40° С. Размороженные меристемы извлекают из ампул и освобождают от криопротекторов последовательным перемещением сначала на сухую стерильную фильтровальную бумагу, затем дважды на свежую полужидкую питательную среду с агарозой (ПС-4), дополненную 3% глюкозы и веществом цитокининового действия (табл.1). После процедуры освобождения от криопротекторов меристемы помещают на среду ПС-4, дополненную 3% глюкозы и веществом цитокининового действия для рекультивирования при 20° С 16-часовом дне и освещенности 0,5-1,0 клк. После месяца культивирования из 38-77% меристем малины красной сорта Скромница и 25-67% клона М-2 были восстановлены растения с листьями и корнями, минуя стадию каллусообразования (табл. 2). Из результатов табл.2 следует, что предлагаемый способ криосохранения позволяет после криогенного хранения (не менее 20 меристем в каждой ампуле) восстанавливать растения разных клонов (сортов), различающихся по регенерационной способности, минуя стадию каллусообразования. Формула изобретенияСпособ криосохранения меристем, изолированных из растений малины красной (Rubus idaeus L.), закаленных in vitro, заключающийся в подготовке растений-доноров меристем к замораживанию, выделении апексов, их обработке криопротекторами, охлаждении апексов в криоампулах до сверхнизких температур, криосохранении ампул с меристемами и посткриогенной регенерации растений из криосохраненных меристем, отличающийся тем, что растения-доноры меристем закаливают на твердой питательной среде, дополненной веществами цитокининового действия. MM4A - Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 05.12.2005 Извещение опубликовано: 20.08.2007 БИ: 23/2007 Популярные патенты: 2456799 Ловушка для поимки животных, обитающих в земле ... первой оси 3.Могут быть использованы сторожки 16 двух видов - сторожок 16 подвесной или сторожок 16 цилиндрический. Сторожок 16 подвесной состоит из второй оси 18 и неустойчивого элемента 17. Неустойчивый элемент 17 и вторая ось 18 выполнены в виде стержней. Вторая ось 18 и неустойчивый элемент 17 соединены перпендикулярно друг другу. Длина второй оси 18 в сторожке 16 подвесном выполнена больше диаметра трубы 20. Длина неустойчивого элемента 17 в сторожке 16 подвесном выполнена меньше диаметра трубы 20. Вторая ось 18 в сторожке 20 подвесном присоединена своей центральной частью вблизи одного из концов неустойчивого элемента 17. Вторая ось 18 сторожка 16 подвесного расположена в ... 2253239 Способ производства средства для обработки растений (варианты) ... или переменном магнитном поле жидким экстрагентом, выбранным из группы, включающей низшие спирты, предельные и непредельные углеводороды, содержащие до 10 атомов углерода в молекуле, их галогенпроизводные, инертные газы, азот, закись азота, двуокись углерода и их смеси, отделение экстракта и введение в него неактивных компонентов с получением целевого продукта, согласно изобретению, используют биомассу микромицета Mortierella polycephala, а в процессе экстрагирования давление в экстракционной смеси периодически сбрасывают до значения, обеспечивающего вскипание экстрагента, и повышают до исходного значения.Тот же результат достигается тем, что в способе производства средства для ... 2195808 Способ хранения корнеплодов, картофеля и капусты ... уменьшилась незначительно, но прочность и огнестойкость покрытия увеличилась, так как наряду с хлористым кальцием образуется и гипс: Пример 6. Все операции проводят так же, как и в примере 5, но в качестве отвердителя берут разбавленный консервант ИБ-2, состоящий из серной и соляной кислоты. Результаты исследований приведены в таблице. Плотность покрытия увеличилась, а потери снизились благодаря более быстрому образованию углекислого газа, гипса и хлористого кальция. Испытания показали, что способ применим для хранения капусты и корнеплодов свеклы. Испытания показали, что в продукции содержания формальдегида не увеличивалось, более того, за счет снижения потерь в отдельных ... 2384052 Способ повышения эмбриональной жизнеспособности и естественной резистентности цыплят-бройлеров ... кислоты. Способ (2) (применение растворов комплекса препаратов янтарной кислоты и глицина путем двукратной обработки инкубационных яиц кросса «Смена-2»: предынкубационной и при переводе на вывод 0,1 и 0,55% растворами соответственно) мы принимаем в качестве прототипа.Целью предлагаемого изобретения является стимуляция эмбриональной жизнеспособности, естественной резистентности, повышения сохранности и продуктивности цыплят-бройлеров двухлинейного гибрида К39 кросса «Конкурент-3» в первые 6 недель выращивания. Указанная цель достигается путем двукратных инкубационных обработок яиц лимонтаром (смеси янтарной и лимонной кислот в соотношении 1:4): на первые сутки ... 2160520 Способ создания лакричных плантаций, предпочтительно солодки голой, на бросовых землях ... и сразу же уплотняются. Посев бобами обеспечивает заданную глубину заделки семян солодки в пределах 2-3 см. В течение двух последующих лет эти посевы охраняют от потрав - выпаса крупного и мелкого рогатого скота. В первый год жизни сеянцы солодки нуждаются в повышенной, стабильной влажности почвы. До появления 7-8 настоящих листьев необходимо по мере подсыхания почвы проводить подпитывающие поливы. В этот период у сеянцев энергично развивается корневая система, проникая на глубину 40-50 см и образуя массу тонких боковых корешков. Рост и развитие растений в условиях культуры происходят значительно интенсивней, чем в естественных условиях. Во второй половине лета в рост ... |
Еще из этого раздела: 2452165 Высевающий аппарат зерновой сеялки с централизованным дозированием семян 2130247 Замкнутый пневмосепаратор 2432394 Ингибирование образования биогенного сульфида посредством комбинации биоцида и метаболического ингибитора 2157603 Способ послепосевного прикатывания озимых культур и каток для его осуществления 2462866 Рыболовная катушка 2189736 Способ отбора гибридов кукурузы, устойчивых к засухе и стеблевым гнилям 2250583 Агрегат дернинный комбинированный 2195102 Устройство для отделения грунта и земли от корней и корневищ солодки в качестве лакричного сырья 2185045 Способ посева, устройство для его осуществления и семявысевающий аппарат конструкции ибрагимова 2271092 Сортировка барабанного типа |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||

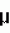 М аденин сульфата, 10
М аденин сульфата, 10