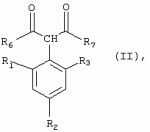
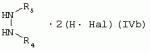Способ получения гербицидных производных и промежуточное соединениеПатент на изобретение №: 2244715 Автор: Томас МЭТЦКЕ (CH), Рене МУТТИ (CH), Анри ЩЕПАНСКИ (CH) Патентообладатель: ЗИНГЕНТА ПАРТИСИПЕЙШНС АГ (CH) Дата публикации: 27 Октября, 2003 Начало действия патента: 14 Июня, 2000 Адрес для переписки: 101000, Москва, пер. Малый Златоустинский, 10, кв.15, "ЕВРОМАРКПАТ", И.А.Веселицкой Описан способ получения соединений формулы (I) в которой R1, R2, R3 каждый независимо друг от друга означает С1-С 6-алкил, R2 может также представлять собой пиридил, R4 и R5 совместно с атомами азота, к которым они присоединены, образуют насыщенное 5-8-членное гетероциклическое кольцо, которое может быть прервано кислородом, G означает водород, заключающийся в том, что соединение формулы (II) в которой R1, R2 и R3 имеют вышеуказанные значения, R6-группа R8 R9N-, R7-группа R10R11 N-, R8, R9, R10, R11 каждый независимо друг от друга означает водород или C1 -С6алкил, подвергают взаимодействию в инертном органическом растворителе, необязательно в присутствии основания, с соединением формулы (IV), (IVa) или (IVb) в которой R4 и R5 имеют вышеуказанные значения, а H·Hal означает галогенид водорода и полученное соединение формулы I, в котором G представляет собой катион амония, превращают путем обработки кислотой Бренстеда в соответствующее соединение формулы I, в котором G представляет собой водород. Описано также соединение формулы (II), в которой R1 , R2, R3, R6, R7 имеют указанные выше значения. 2 с. и 7 з.п. ф-лы. Настоящее изобретение относится к новому способу получения гербицидно активных замещенных 3-гидрокси-4-арил-5-оксопиразолиновых производных. 3-гидрокси-4-арил-5-оксопиразолины, обладающие гербицидной активностью, и их получение описано, например, в WO 92/16510, ЕР-А-0508126, WO 95/01971, WO 96/21652, WO 96/25395, WO 97/02243 и WO 99/47525. При создании изобретения неожиданно было установлено, что замещенные 3-гидрокси-4-арил-5-оксопиразолиновые производные можно получать простым путем с высоким выходом и с высокой степенью чистоты конденсацией диамидов арилмалоновой кислоты или моноамидов арилмалоновой кислоты с производными гидразина. Таким образом, настоящее изобретение относится к способу получения соединений формулы I в которой R0 в каждом случае независимо означает галоген, C1-С6алкил, С2-С 6алкенил, С2-С6алкинил, C1 -С6галоалкил, циано-С1-С6алкил, С2-С6галоалкенил, циано-С2-С 6алкенил, С2-С6галоалкинил, циано-С2-С6алкинил, гидроксигруппу, гидрокси-С 1-С6алкил, C1-С6алкоксигруппу, нитрогруппу, аминогруппу, C1-С6алкиламиногруппу, ди(С1-С6алкил)аминогруппу, C1 -С6алкилкарбониламиногруппу, C1-С6 алкилсульфониламиногруппу, C1-С6алкиламиносульфонил, С1-С6алкилкарбонил, С1-С 6алкилкарбонил-С1-С6алкил, С 1-С6алкоксикарбонил-С1–С6 алкил, С1-С6алкилкарбонил-С2 -С6алкенил, С1-С6алкоксикарбонил-С 2-С6алкенил, С1-С6 алкилкарбонил-С2-С6алкинил, С1 -С6алкоксикарбонил-С2-С6алкинил, C1-С6алкоксикарбонил, цианогруппу, карбоксил, фенил или ароматическое кольцо, которое содержит 1 или 2 гетероатома, выбранных из группы, включающей азот, кислород и серу, при этом два последних ароматических кольца могут быть замещены C 1-С3алкилом, C1-С3галоалкилом, C1-С3алкоксигруппой, C1-С 3галоалкоксигруппой, галогеном, цианогруппой или нитрогруппой, или Ro вместе со смежными заместителями R1 , R2 и R3, образует насыщенный или ненасыщенный С3-С6углеводородный мостик, который может быть прерван 1 или 2 гетероатомами, выбранными из группы, включающей азот, кислород и серу, и/или может быть замещен С1 -С4алкилом, R1, R2 и R3 каждый независимо от другого означает водород, галоген, C1-С6алкил, С2-С6 алкенил, С2-С6алкинил, С3-С 6циклоалкил, C1-С6галоалкил, С 2-С6галоалкенил, С1-С6 алкоксикарбонил-С2-С6алкенил, C1 -С6алкилкарбонил-С2-С6алкенил, циано-С2-С6алкенил, нитро-С2 -С6алкенил, С2-С6галоалкинил, C1-С6алкоксикарбонил-С2-С 6алкинил, С1-С6алкилкарбонил-С 2-С6алкинил, циано-С2-С6 алкинил, нитро-С2-С6алкинил, С3 -С6галоциклоалкил, гидрокси-С1-С6 алкил, С1-С6алкокси-С1-С 6алкил, C1-С6алкилтио-С1 -С6алкил, цианогруппу, С1-С4 алкилкарбонил, C1-С6алкоксикарбонил, гидроксигруппу, C1-С10алкоксигруппу, С3-С 6алкенилоксигруппу, С3-С6алкинилоксигруппу, C1-С6галоалкоксигруппу, С3-С 6галоалкенилоксигруппу, С1-С6 алкокси-С1С6алкоксигруппу, меркаптогруппу, C1-С6алкилтиогруппу, C1-С 6галоалкилтиогруппу, C1-С6алкилсульфинил, C1-С6алкилсульфонил, нитрогруппу, аминогруппу, C1-С6алкиламиногруппу, ди(С1 -С6алкил)аминогруппу или феноксигруппу, где фенильное кольцо может быть замещено C1-С3алкилом, C1-С3галоалкилом, C1-С3 алкоксигруппой, C1-С3галоалкоксигруппой, галогеном, цианогруппой или нитрогруппой, R2 может также представлять собой фенил, нафтил или 5- либо 6-членное ароматическое кольцо, которое может содержать 1 или 2 гетероатома, выбранных из группы, включающей азот, кислород и серу, при этом фенильное кольцо, нафтильная кольцевая система и 5- либо 6-членное кольцо могут быть замещены галогеном, С3-С8 циклоалкилом, гидроксигруппой, меркаптогруппой, аминогруппой, цианогруппой, нитрогруппой или формилом, и/или фенильное кольцо, нафтильная кольцевая система и 5- либо 6-членное ароматическое кольцо могут быть замещены C1-С6алкилом, С1-С6алкоксигруппой, гидрокси-С1 –С6алкилом, С1-С6алкокси-С 1-С6алкилом, С1-С6алкокси-С 1-С6алкоксигруппой, C1-С 6алкилкарбонилом, C1-С6алкилтиогруппой, C1-С6алкилсульфинилом, C1-С 6алкилсульфонилом, моно-С1С6алкиламиногруппой, ди(С1-С6алкил)аминогруппой, C1 -С6алкилкарбониламиногруппой, С1-С 6алкилкарбонил(С1-С6алкил)аминогруппой, С2-С6алкенилом, С3-С6 алкенилоксигруппой, гидрокси-С3-С6алкенилом, С1-С6алкокси-С3-С6 алкенилом, С1-С6алкокси-С3-С 6алкенилоксигруппой, С2-С6алкенилкарбонилом, С2-С6алкенилтиогруппой, С2-С 6алкенилсульфинилом, C2-С6алкенилсульфонилом, моно- либо ди-(С2-С6алкенил)аминогруппой, С1-С6алкил(С3-С6алкенил)аминогруппой, С2-С6алкенилкарбониламиногруппой, С 2-С6алкенилкарбонил(С1-С6 алкил)аминогруппой, С2-С6алкинилом, С 3-С6алкинилоксигруппой, гидрокси-С3 -С6алкинилом, C1-С6алкокси-С 3-С6алкинилом, С1-С6 алкокси-С4-С6алкинилоксигруппой, С 2-С6алкинилкарбонилом, С2-С6 алкинилтиогруппой, С2-С6алкинилсульфинилом, С2-С6алкинилсульфонилом, моно- либо ди-(С 3-С6алкинил)аминогруппой, С1 -С6алкил(С3-С6алкинил)аминогруппой, С2-С6алкинилкарбониламиногруппой или С 2-С6алкинилкарбонил(С1-С6 алкил)аминогруппой, и/или фенильное кольцо, нафтильная кольцевая система и 5- либо 6-членное ароматическое кольцо могут быть замещены замещенными галогеном C1-С6алкилом, C 1-С6алкоксигруппой, гидрокси-С1-С 6алкилом, C1-С6алкокси-C 1-С6алкилом, С1-С6алкокси-С 1-С6алкоксигруппой, C1-С 6алкилкарбонилом, C1-С6алкилтиогруппой, C1-С6алкилсульфинилом, C1-С 6алкилсульфонилом, моно-С1-С6алкиламиногруппой, ди(С1-С6алкил)аминогруппой, С1 -С6алкилкарбониламиногруппой, С1-С 6алкилкарбонил(С1-С6алкил)аминогруппой, С2-С6алкенилом, С1-С6 алкенилоксигруппой, гидрокси-С3-С6алкенилом, С1-С6алкокси-С2-С6 алкенилом, C1-С6алкокси-С3-С 6алкенилоксигруппой, С2-С6алкенилкарбонилом, C2-С6алкенилтиогруппой, С2-С 6алкенилсульфинилом, C2-С6алкенилсульфонилом, моно- либо ди-(С2-С6алкенил)аминогруппой, C1-С6алкил-(С3-С6 алкенил)аминогруппой, С2-С6алкенилкарбониламиногруппой, С2-С6алкенилкарбонил(С1-С 6алкил)аминогруппой, С2-С6алкинилом, С3-С6алкинилоксигруппой, гидрокси-С 3-С6алкинилом, C1-С6алкокси-С 3-С6алкинилом, С1-С6 алкокси-С4-С6алкинилоксигруппой, С 2-С6алкинилкарбонилом, С2-С6 алкинилтиогруппой, С2-С6алкинилсульфинилом, С2-С6алкинилсульфонилом, моно- либо ди-(С 3-С6алкинил)аминогруппой, С1 -С6алкил(С3-С6алкинил)аминогруппой, С2-С6алкинилкарбониламиногруппой или С 2-С6алкинилкарбонил(С1-С6 алкил)аминогруппой, и/или фенильное кольцо, нафтильная кольцевая система и 5- либо 6-членное ароматическое кольцо могут быть замещены радикалом формулы COOR50, CONR51, SO 2NR53R54 или SO2OR 55, где R50, R51, R52, R53, R54 и R55 каждый независимо друг от друга представляет собой C1-С6алкил, С2-С6алкенил или С1-С6 алкинил либо замещенный галогеном, гидроксигруппой, алкоксигруппой, меркаптогруппой, аминогруппой, цианогруппой, нитрогруппой, алкилтиогруппой, алкилсульфинилом или алкилсульфонилом C1-С6 алкил, С2-С6алкенил либо С3-С 6алкинил, n означает 0, 1 или 2, R4 и R5 каждый независимо друг от друга означает водород, С1-С12алкил, C1-С12 галоалкил, С2-С8алкенил, С2-С 8алкинил, С1-С10алкокси-С 1-С8алкил, поли-С1-С10 алкокси-С1С8алкил, С1-С 10алкилтио-С1-С8алкил, С3 -С8циклоалкил, С3-С8галоциклоалкил, 4-8-членный гетероциклил, фенил, в которой R0, R1, R2, R3 и n имеют вышеуказанные значения, R6 представляет собой R8R9N-, R7 представляет собой R10R11N- или R 12O-и R8, R9, R10, R 11 и R12 каждый независимо друг от друга означает водород, C1-С6алкил, C1-С 6галоалкил, С3-С6алкенил или бензил, где фенильное кольцо бензильной группы может быть замещено С 1-С4алкилом, галогеном, С1-С 4галоалкилом, C1-С4алкоксигруппой или нитрогруппой, подвергают взаимодействию в инертном органическом растворителе, необязательно в присутствии основания, с соединением формулы IV, IVa или IVb где R4 и R5 имеют вышеуказанные значения, а Н·Наl представляет собой галогенид водорода, и полученное соединение формулы I, в котором G представляет собой эквивалент иона металла или катион аммония, необязательно переводят путем солеобразования в соответствующую соль соединения формулы I, в котором G представляет собой катион сульфония или фосфония, или путем обработки кислотой Бренстеда превращают в соответствующее соединение формулы I, в котором G представляет собой водород. Настоящее изобретение относится также к непосредственному ("in situ") превращению в одном реакционном сосуде соединений формулы I в соединения формулы Iа в которой R0, R1, R2, R3, R4, R5 и n имеют значения, указанные для формулы I, a G0 означает группу -С(O)-R30, -C(X1)-X2-R31 , -С(Х3)-N(R32)-R33, -SO 2-R34 или -Р(Х4)(R35 )-R36, где X1, Х2, Х3 и Х4 каждый независимо друг от друга означает кислород или серу, R30 означает незамещенный либо замещенный галогеном С1-С20алкил, C1-С 20алкенил, С1-С8алкокси-С1 -С8алкил, С1-С8алкилтио-С 1-С8алкил, поли-С1-С8алкокси-С 1-С8алкил или незамещенный либо замещенный галогеном, C1-С6алкилом или C1 -С6алкоксигруппой С3-С8циклоалкил, в котором по меньше мере один член кольца необязательно заменен на кислород и/или серу, С3-С6циклоалкил-С 1-С6алкил, гетероциклил-С1-С 6алкил, гетероарил-С1-С6алкил, незамещенный либо замещенный галогеном, цианогруппой, нитрогруппой, С1-С6алкилом, С1-С6 алкоксигруппой, С1-С6галоалкилом, С 1-С6галоалкоксигруппой, С1-С 6алкилтиогруппой или С1-С6алкилсульфонилом фенил, незамещенный либо замещенный галогеном, нитрогруппой, цианогруппой, С1-С6алкилом, С1 -С6алкоксигруппой, С1-С6галоалкилом или С1-С6галоалкоксигруппой фенил-С 1-С6алкил, незамещенный либо замещенный галогеном или С1-С6алкилом гетероарил, незамещенный либо замещенный галогеном или С1-С6алкилом фенокси-С1-С6алкил или незамещенный либо замещенный галогеном, аминогруппой или С1-С6 алкилом гетероарилокси- С1-С6алкил, R31 означает незамещенный либо замещенный галогеном С1-С20алкил, C2-С20 алкенил, С1-С8алкокси-С2-С 8алкил, поли-С1-С8алкокси-С2 -С8алкил, незамещенный либо замещенный галогеном, С1-С6алкилом или С1-С6 алкоксигруппой С3-С8циклоалкил, С3 -С6циклоалкил-С1-С6алкил, гетероциклил-С1-С6алкил, гетероарил-С 1-С6алкил, незамещенный либо замещенный галогеном, цианогруппой, нитрогруппой, С1-С6алкилом, С1-С6алкоксигруппой, С1-С 6галоалкилом или С1-С6галоалкоксигруппой фенил или бензил, R32 и R33 каждый независимо друг от друга означает водород, незамещенный либо замещенный галогеном C1-С8алкил, С 3-С8циклоалкил, С1-С8алкоксигруппу, С3-С8алкенил, С1-С8 алкокси-С1-С8алкил, незамещенный либо замещенный галогеном, С1-С8галоалкилом, С1 -С8алкилом или C1-С8алкоксигруппой фенил или бензил или R32 и R33 вместе образуют С3-С6алкиленовую цепь, в которой атом углерода необязательно заменен на кислород или серу, R34 означает незамещенный либо замещенный галогеном С1-С8алкил, С3-С8 алкенил, С3-С8галоалкенил, С3 -С8алкинил, С3-С8галоалкинил или незамещенный либо замещенный галогеном, C1-С 6алкилом, C1-С6алкоксигруппой, С 1-С4галоалкилом, С1-С4 галоалкоксигруппой, цианогруппой или нитрогруппой фенил или бензил, R35 и R36 каждый независимо друг от друга означает незамещенный либо замещенный галогеном С 1-С8алкил, С1-С8алкоксигруппу, C1-С8алкиламиногруппу, ди(С1 -С8алкил)аминогруппу, С1-С8алкилтиогруппу, С2-С8алкенилтиогруппу, С3-С 7циклоалкилтиогруппу или незамещенные либо замещенные галогеном, нитрогруппой, цианогруппой, C1-С4алкоксигруппой, С1-С4галоалкоксигруппой, С1-С 4алкилтиогруппой, C1-С4галоалкилтиогруппой, С1-С4алкилом или С1-С4 галоалкилом фенил, феноксигруппу или фенилтиогруппу, заключающемуся в том, что соединения формулы I необязательно в присутствии связывающего кислоту агента или катализатора, подвергают взаимодействию с электрофилом формулы XII или XIId где G0, R32 и Х3 имеют указанные выше значения, за исключением того, что R32 не означает водород, a L означает уходящую группу, например R30С(O)O-, R31X2- или галоген, предпочтительно хлор, бром или иод. В зависимости от заместителей R0-R5, G и G0 соединения формул I и Iа могут существовать в форме геометрических и/или оптических изомеров или смесей изомеров (атропоизомеров), а если G означает водород, эквивалент иона металла или катион аммония, сульфония либо фосфония, то они могут существовать в форме таутомеров или смесей таутомеров. Если исходные материалы используют не в виде чистых энантиомеров, то в результате осуществления вышеописанных реакций соединения формул I и Iа в целом получают в форме рацематов или смесей диастереомеров, которые при необходимости можно разделять на основе различий их физико-химических свойств по известным методам, таким, например, как фракционированная кристаллизация с последующим образованием соли с оптически чистыми основаниями, кислотами или комплексами металлов либо хроматография, например жидкостная хроматография высокого разрешения (ЖХВР) на ацетилцеллюлозе. Согласно настоящему изобретению, под соединениями формулы I и Iа понимаются и обогащенная и оптически чистая формы соответствующих стереоизомеров, а также рацематов и диастереомеров. Если в описании не дается конкретных указаний в отношении индивидуальных оптических антиподов, то под соединениями вышеприведенных формул понимаются рацемические смеси, полученные предлагаемым в изобретении способом. При наличии алифатической двойной связи С=С может проявляться также геометрическая изомерия. Настоящее изобретение относится также к солям, которые соединения формул I и Iа способны образовывать с кислотами. Пригодными для образования кислотно-аддитивных солей кислотами являются как органические, так и неорганические кислоты. В качестве примера таких кислот можно назвать соляную кислоту, бромистоводородную кислоту, азотную кислоту, фосфорные кислоты, серную кислоту, уксусную кислоту, пропионовую кислоту, масляную кислоту, валериановую кислоту, щавелевую кислоту, малоновую кислоту, фумаровую кислоту, органические сульфокислоты, молочную кислоту, винную кислоту, лимонную кислоту и салициловую кислоту. С учетом их кислотности соединения формулы I, в которых G означает водород, можно простым путем переводить в присутствии оснований (акцептора протонов) в соответствующие соли (где G представляет собой, например, эквивалент иона металла или катион аммония), как это описано, например, в ЕР-А 0508126. В качестве основания при этом можно использовать обычный акцептор протонов. В качестве примера подобных солей можно назвать соли щелочных металлов, например натриевые и калиевые соли, соли щелочно-земельных металлов, например кальциевые и магниевые соли, аммониевые соли, т.е. соли незамещенного аммония и соли моно- или полизамещенного аммония, например соли триэтиламмония и метиламмония, или соли с органическими основаниями либо иными катионами, например катионами сульфония или фосфония. К катионам сульфония относятся, например, катионы три(С1-С4алкил)сульфония, которые можно получать из соответствующих солей щелочных металлов, например, путем преобразования одной соли в другую, например с использованием катионообменника. Среди гидроксидов щелочных и щелочно-земельных металлов в качестве солеобразующих агентов особо можно отметить, например, гидроксиды лития, натрия, калия, магния и кальция, прежде всего гидроксиды натрия и калия. Приемлемые солеобразующие агенты описаны, например, в WO 97/41112. Примерами аминов, пригодных для образования аммониевых солей, служат аммиак, а также первичные, вторичные и третичные С1-С18 алкиламины, С1-С4гидроксиалкиламины и С2-С4алкоксиалкиламины, например метиламин, этиламин, н-пропиламин, изопропиламин, четыре изомера бутиламина, н-амиламин, изоамиламин, гексиламин, гептиламин, октиламин, нониламин, дециламин, пентадециламин, гексадециламин, гептадециламин, октадециламин, метилэтиламин, метилизопропиламин, метилгексиламин, метилнониламин, метилпентадециламин, метилоктадециламин, этилбутиламин, этилгептиламин, этилоктиламин, гекилгептиламин, гексилоктиламин, диметиламин, диэтиламин, ди-н-пропиламин, диизопропиламин, ди-н-бутиламин, ди-н-амиламин, диизоамиламин, дигексиламин, дигептиламин, диоктиламин, этаноламин, н-пропаноламин, изопропаноламин, N,N-диэтаноламин, N-этилпропаноламин, N-бутилэтаноламин, аллиламин, н-бутенил-2-амин, н-пентенил-2-амин, 2,3-диметилбутенил-2-амин, дибутенил-2-амин, н-гексенил-2-амин, пропилендиамин, триметиламин, триэтиламин, три-н-пропиламин, триизопропиламин, три-н-бутиламин, триизобутиламин, три-втор-бутиламин, три-н-амиламин, метоксэтиламин и этоксиэтиламин, гетероциклические амины, например пиридин, хинолин, изохинолин, морфолин, N-метилморфолин, тиоморфолин, пиперидин, пирролидин, индолин, хинуклидин и азепин, первичные ариламины, например анилины, метоксианилины, этоксианилины, о-, м- и п-толуидины, фенлендиамины, бензидины, нафтиламины и о-, м- и п-хлоранилины, прежде всего триэтиламин, изопропиламин и диизопропиламин. В приведенных выше значениях радикалов под галогеном понимается фтор, хлор, бром или иод, предпочтительно фтор, хлор или бром. Алкильными группами, указанными выше в значениях заместителей, являются, например, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил или трет-бутил, а также изомеры пентила, гексила, гептила, октила, нонила, децила, ундецил и додецила. Галоалкильные группы предпочтительно имеют цепь длиной от 1 до 6 атомов углерода. Галоалкил представляет собой, например, фторметил, дифторметил, дифторхлорметил, трифторметил, хлорметил, дихлорметил, дихлорфторметил, трихлорметил, 2,2,2-трифторэтил, 2-фторэтил, 2-хлорэтил, 2,2-дифторэтил, 2,2-дихлорэтил, 2,2,2-трихлорэтил или пентафторэтил, предпочтительно трхлорметил, дифторметил, дифторхлорметил, трифторметил или дихлорфторметил. Алкоксигруппы предпочтительно имеют цепь длиной от 1 до 6 атомов углерода. Алкоксигруппа представляет собой, например, метоксигруппу, этоксигруппу, н-пропоксигруппу,изопропоксигруппу, н-бутоксигруппу, изо-бутоксигруппу, втор-бутоксигруппу, трет-бутоксигруппу или пентилоксигруппу либо гексилокси-изомер, предпочтительно метоксигруппу, этоксигруппу или н-пропоксигруппу. Галоалкоксигруппа представляет собой, например, фторметоксигруппу, дифторметоксигруппу, трифторметоксигруппу, 2,2,2-трифторэтоксигруппу, 1,1,2,2-тетрафторэтоксигруппу, 2-фторэтоксигруппу, 2-хлорэтоксигруппу или 2,2,2-трихлорэтоксигруппу. В качестве примера алкенильных радикалов можно назвать винил, аллил, металлил, 1-метилвинил, бут-2-ен-1-ил, пентенил и 2-гексенил, предпочтительны алкенильные радикалы с длиной цепи от 3 до 6 атомов углерода. В качестве примера алкинильных радикалов можно назвать этинил, пропаргил, 1-метилпропаргил, 3-бутинил, бут-2-ин-1-ил, 2-метилбут-3-ин-2-ил, бут-3-ин-2-ил, 1-пентинил, пент-4-ин-1-ил и 2-гексенил, предпочтительны алкиниль-ные радикалы с длиной цепи от 3 до 6 атомов углерода. Соответствующие галоалкенильные радикалы представляют собой алкенильные группы, одно- или многократно замещенные галогеном, которым, в частности, является бром или иод и прежде всего фтор или хлор, например 2- и 3-фторпропенил, 2- и 3-хлорпропенил, 2- и 3-бромпропенил, 2,2-дифтор-1-метилвинил, 2,3,3-трифторпропенил, 3,3,3-трифторпропенил, 2,3,3-трихлорпропенил, 4,4,4-трифторбут-2-ен-1-ил и 4,4,4-трихлорбут-2-ен-1-ил. Предпочтительные алкенильные радикалы, одно-, дву- или трехкратнозамещенные галогеном, имеют цепь длиной от 3 до 6 атомов углерода. Алкенильные группы могут быть замещены галогеном у насыщенных или ненасыщенных атомов углерода. Соответствующие галоалкинильные группы представляют собой, например, алкинильные группы, одно- или многократно замещенные галогеном, которым является бром или иод и прежде всего фтор или хлор, например 3-фторпропинил, 3-хлорпропинил, 3-бромпропинил и 4,4,4-трифторбут-2-ин-1-ил. Алкенилоксигруппа представляет собой, например, аллилоксигруппу, металлилоксигруппу или бут-2-ен-1-илоксигруппу. Алкинилоксигруппа представляет собой, например, пропаргилоксигруппу или 1-метилпропаргилоксигруппу. Соответствующие галоалкенилоксигруппы представляют собой алкенилоксигруппы, одно- или многократно замещенные галогеном, которым является, в частности, бром или иод и прежде всего фтор или хлор, например 2- и 3-фторпропенилоксигруппу, 2- и 3-хлорпропенилоксигруппу, 2- и 3-бромпропенилоксигруппу, 2,3,3-трифторпропенилоксигруппу, 2,3,3-трихлорпропенилоксигруппу, 4,4,4-трифторбут-2-ен-1-илоксигруппу и 4,4,4-трихлорбут-2-ен-1-илоксигруппу. Алкоксиалкильные группы имеют предпочтительно от 1 до 6 атомов углерода. Алкоксиалкил представляет собой, например, метоксиметил, метоксиэтил, этоксиметил, этоксиэтил, н-пропоксиметил, н-пропоксиэтил, изопропоксиметил или изопропоксиэтил. Полиалкоксиалкил представляет собой, например, метоксиметоксиметил, этоксиметоксиметил, этоксиэтоксиметил, н-пропоксиэтоксиметил, изопропоксиэтоксиметил, метоксиметоксиэтил, этоксиметоксиэтил, этоксиэтоксиэтил, н-пропоксиэтоксиметил, н-пропоксиэтоксиэтил, изопропоксиэтоксиметил, изопропоксиэтоксиэтил или (этокси) 3-этил. Соответствующие циклоалкильные заместители содержат от 3 до 8 атомов углерода и представляют собой, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил. Эти заместители могут быть одно- или многократно замещены галогеном, предпочтительно фтором, хлором и/или бромом. Алкилкарбонил представляет собой прежде всего ацетил или пропионил. Алкоксикарбонил представляет собой, например, метоксикарбонил, этоксикарбонил, н-пропоксикарбонил, изопропоксикарбонил или изомер бутоксикарбонила, пентилоксикарбонила или гексилоксикарбонила, предпочтительно метоксикарбонил или этоксикарбонил. Фенил, феноксигруппа и нафтил могут присутствовать в замещенном виде, при этом заместители в зависимости от конкретных требований могут находиться в орто-, мета- и/или пара-положении, а в случае нафтильной кольцевой системы - дополнительно в 5-м, 6-м, 7-м и/или 8-м положении. Предпочтительными положениями заместителей являются орто- и пара-положение относительно места присоединения кольца. Если заместители фенила, феноксигруппы и нафтила не указаны в явном виде, то ими являются, например, С1-С4алкил, галоген, C1 -С6галоалкил, C1-С6алкоксигруппа, C1-С6галоалкоксигруппа, нитрогруппа, цианогруппа, аминогруппа, С1-С4алкиламиногруппа или ди(С1-С4алкил)аминогруппа. Алкилтиогруппы предпочтительно имеют цепь длиной от 1 до 6 атомов углерода. Алкилтиогруппа представляет собой, например, метилтиогруппу, этилтиогруппу, пропилтиогруппу, бутилтиогруппу, пентилтиогруппу или гексилтиогруппу либо их разветвленный изомер, при этом предпочтительны метилтиогруппа или этилтиогруппа. Галоалкилтиогруппа представляет собой, например, 2,2,2-трифторэтилтиогруппу или 2,2,2-трихлорэтилтиогруппу. Алкилсульфинил представляет собой, например, метилсульфинил, этилсульфинил, н-пропилсульфинил, изопропилсульфинил, н-бутилсульфинил, изо-бутилсульфинил, втор-бутилсульфинил или трет-бутилсульфинил, предпочтительно метилсульфинил или этилсульфинил. Алкилсульфонил представляет собой, например, метилсульфонил, этилсульфонил, н-пропилсульфонил, изопропилсульфонил, н-бутилсульфонил, изо-бутилсульфонил, втор-бутилсульфонил или трет-бутилсульфонил, предпочтительно метилсульфонил или этилсульфонил. Алкиламиногруппа представляет собой, например, метиламиногруппу, этиламиногруппу, н-пропиламиногруппу, изопропиламиногруппу или изомер бутил-, пентилили гексиламина. Диалкиламиногруппа представляет собой, например, диметиламиногруппу, метилэтиламиногруппу, диэтиламиногруппу, н-пропилметиламиногруппу, дибутиламиногруппу или диизопропиламиногруппу. Алкилтиоалкил представляет собой, например, метилтиометил, метилтиоэтил, этилтиометил, этилтиоэтил, н-пропилтиометил, н-пропилтиоэтил, изопропилтиометил или изопропилтиоэтил. Гетероциклильные радикалы представляют собой предпочтительно 4-8-членные кольца, содержащие 1 или 2 гетероатома, например N, S и/или О. Эти радикалы обычно являются насыщенными. Гетероарильные радикалы обычно представляют собой 5- или 6-членные ароматические гетероциклы, содержащие предпочтительно от 1 до 3 гетероатомов, таких как N, S и/или О. Примерами соответствующих гетероциклильных и гетероарильных радикалов служат пиридил, пирролидил, пиперидил, пиранил, диоксанил, азетидил, оксетанил, пиримидил, триазинил, тиазолил, триазолил, тиадиазолил, имидазолил, оксазолил, изоксазолил, пиразинил, фурил, тиенил, морфолил, пиперазинил, пиразолил, бензоксазолил, бензотиазолил, хиноксалил, индолил и хинолил. Такие гетероциклы и гетероароматические радикалы могут быть дополнительно замещены, при этом заместителями, если они не указаны в явном виде, служат, например, галоген, C1-С6алкил, C1-С6 алкоксигруппа, C1-С6галоалкил, C1 -С6галоалкоксигруппа, C1-С6алкилтиогруппа, аминогруппа, C1-С6алкиламиногруппа, ди(C 1-С6алкил)аминогруппа, фенил, нитрогруппа или цианогруппа. В приведенных выше определениях заместителей выражение, в соответствии с которым "R4 и R 5 вместе с атомами азота, к которым они присоединены, образуют насыщенное либо ненасыщенное 5-8-членное гетероциклическое кольцо, которое 1) может быть прервано кислородом, серой или группой –NR14- и/или может быть замещено галогеном, C 1-С10алкилом, C1-С10галоалкилом, гидроксигруппой, С1-С6алкоксигруппой, С 1 –С6алкокси-С1-С6 алкоксигруппой, C1-С6галоалкоксигруппой, меркаптогруппой, C1-С6алкилтиогруппой, С3-С7циклоалкилом, гетероарилом, гетероарил-С 1-С6алкилом, фенилом, фенил-C1 -С6алкилом или бензилоксигруппой, где фенильные кольца последних трех заместителей в свою очередь могут быть замещены галогеном, C1-С6алкилом, C1-С 6галоалкилом, С1-С6алкоксигруппой, C1-С6галоалкоксигруппой или нитрогруппой, и/или 2) может содержать конденсированную или спиросвязанную алкиленовую либо алкениленовую цепь с 2-6 атомами углерода, которая необязательно прервана кислородом или серой, или по меньшей мере один кольцевой атом насыщенного или ненасыщенного гетероциклического кольца образует мостиковую связь с этой алкиленовой или алкениленовой цепью", относится, например, к следующим гетероциклическим кольцевым системам: В представленных выше полициклических кольцевых системах группа, упрощенно представленная в виде фрагмента 5-8-членные гетероциклические кольца, которые могут быть образованы совсестно заместителями R4 и R5 , и конденсированные или спиросвязанные алкиленовые либо алкениленове цепи с длиной цепи от 2-6 атомов углерода могут быть соответственно одно- или многократно прерваны гетероатомами, такими, например, как кислород. Значения, соответствующие приведенным выше, могут относиться также к комбинированным определениям, таким как алкоксиалкокси, алкилсульфониламино, алкиламиносульфонил, алкоксикарбонил, алкилкарбониламино, фенилалкил, нафтилалкил и гетероарилалкил. В определениях алкилкарбонила алкилкарбониламиногруппы и алкоксикарбонила атом углерода карбонильной группы не включен в нижний и верхний пределы содержания атомов углерода, указанные в каждом конкретном случае. Комбинированные понятия, которые могут быть указаны в отношении радикалов R30, R 31 и R34, присутствующих в заместителе G 0 соединения формулы Iа, таких как циклоалкилтиорадикал, циклоалкилалкильный радикал, гетероциклилалкильный радикал, гетероарилалкильный радикал, фенилалкильный радикал, феноксиалкильный радикал и гетероарилоксиалкильный радикал, являются производными понятий, указанных для соответствующих заместителей в упомянутых выше радикалах. Гетероциклильные радикалы предпочтительно содержат 1 или 2 гетероатома, таких как N, S и О. Они обычно являются насыщенными. Гетероарильные радикалы обычно представляют собой ароматические гетероциклы, которые предпочтительно содержат от 1 до 3 гетероатомов, таких как N, S и/или О. Подобные гетероциклы и гетероароматические радикалы могут быть, кроме того, замещены, например галогеном, С1-С4алкилом и/или аминогруппой. С 2-С20алкенильные группы, указанные в качестве значений R31 могут быть моно- или полиненасыщенными. Они содержат предпочтительно от 2 до 12, прежде всего от 2 до 6 атомов углерода. К электрофилу G-L формулы XII отнсятся, например, следующие электрофилы: L-С(O)-R30 (XIIa), L-C(X1)-X2-R31 (ХIIb), L-С(Х 3)-N(R32)-R33 (ХIIс), R 32N=C=X3 (XIId), L-SO2-R34 (ХIIе) и L-Р(Х4)(R35)-R36 (XIIf). У электрофила формулы XII L означает уходящую группу, такую как R30С(O)O- или R31O- (где R 30 и R31 имеют значения, указанные для формулы Iа), или галоген, предпочтительно хлор, бром или иод. Предлагаемый в изобретении способ может в первую очередь использоваться для получения соединений формулы I, в которых R0 в каждом случае независимо означает галоген, C1-С6 алкил, C1-С6галоалкил, гидроксигруппу, C1-С6алкоксигруппу, нитрогруппу, аминогруппу, C1-С6алкиламиногруппу, ди(С1 -С6алкил)аминогруппу, C1-С6алкилкарбониламиногруппу, C1-С6алкилсульфониламиногруппу, C1 -С6алкиламиносульфонил, C1-С 4алкилкарбонил, C1-С6алкоксикарбонил или карбоксигруппу, a R1, R2 и R3 каждый независимо друг от друга означает водород, галоген, C 1-С6алкил, C1-С6алкенил, С2-С6алкинил, С3-С6 циклоалкил, C1-С6галоалкил, С2 -С6галоалкенил, С2-С6галоалкинил, С3-С6галоциклоалкил, C1-С 6алкокси-C1-С6алкил, C1 -С6алкилтио-C1-С6алкил, цианогруппу, С1-С4алкилкарбонил, C1-С 6алкоксикарбонил, гидроксигруппу, C1-С10 алкоксигруппу, С3-С6алкенилоксигруппу, С3-С6алкинилоксигруппу, C1-С 6галоалкоксигруппу, С3-С6галоалкенилоксигруппу, C1-С6алкокси-C1-С6 алкоксигруппу, меркаптогруппу, C1-С6алкилтиогруппу, C1-С6галоалкилтиогруппу, C1-С 6алкилсульфинил, C1-С6алкилсульфонил, нитрогруппу, аминогруппу, С1-С4алкиламиногруппу или ди(С1-С4алкил)аминогруппу. Предлагаемый в изобретении способ равным образом наиболее пригоден для получения соединений формулы I, в которых R1, R2, и R3 каждый независимо друг от друга означает водород, галоген, С1-С4алкил, С2-С 4алкенил, С1-С4алкинил, С1 -С4галоалкил, С3- или С4-галоалкенил, С3-С6циклоалкил, C1-С4 алкилкарбонил, C1-С6алкоксикарбонил, гидроксигруппу, С1-С4алкоксигруппу, С3- или С4-алкенилоксигруппу, С3- или С4 -алкинилоксигруппу, C1-С4галоалкоксигруппу, нитрогруппу или аминогруппу. Помимо этого способ по изобретению может использоваться также для получения прежде всего тех соединений формулы I, в которых R4 и R5 вместе с атомом азота, к которому они присоединены, образуют насыщенное либо ненасыщенное 6- или 7-членное гетероциклическое кольцо, которое 1) может быть однократно прервано кислородом или серой и/или 2) может содержать конденсированную или спиросоединенную алкиленовую цепь с 2-5 атомами углерода, которая необязательно одно- или двукратно прервана кислородом или серой, или по меньшей мере один кольцевой атом этого насыщенного или ненасыщенного гетероциклического кольца образует мостиковую связь с указанной алкиленовой цепью. В предпочтительном варианте осуществления предлагаемого способа целесообразно использовать соединения формулы II, в которых R8, R9, R10, R11 и R12 означают водород, C1-С6 алкил или бензил. Процесс получения соединений формул I и Iа более подробно проиллюстрирован ниже на реакционных схемах 1 и 2. Реакционная схема 1 Соединения формул II и IV, IVa или IVb можно использовать в эквимолярных количествах, однако более предпочтительным может оказаться использовать соединение формулы IV, IVa или IVb в избытке, составляющем от 5 до 50 мол.%. Реакцию соединения формулы II с соединением формулы IV, IVa или IVb осуществляют при температуре от 0 до 200°С, предпочтительно от 80 до 150°С. Для взаимодействия соединений формулы II с соединениями формулы IV, IVa или IVb пригодны, например, такие инертные органические растворители, как ароматические, алифатические и циклоалифатические углеводороды, например бензол, толуол, изомеры ксилола, такие как орто-, мета- и пара-ксилол, циклогексан и метилциклогексан, галогенированные углеводороды, например хлорбензол и изомеры дихлорбензола, такие как 1,2-, 1,3- и 1,4-дихлорбензол, простые эфиры, например дибутиловый эфир, трет-бутилметиловый эфир, 1,2-диметоксиэтан (ДМЭ), диметиловый эфир этиленгликоля, диметиловый эфир диэтиленгликоля, 1,3-диоксолан и диоксан, нитрилы, например ацетонитрил, пропионитрил и бензонитрил, диалкилсульфоксиды, например диметилсульфоксид (ДМСО), амиды и лактамы, например N,N-диметилформамид (ДМФ), N,N-диэтилформамид и N-метилпирролидон (N-МП), спирты, гликоли (диолы) и многоатомные спирты, например пропанол, бутанол, циклогексанол, этиленгликоль и 2-этоксиэтанол, а также в общем случае карбоновые кислоты, например уксусная кислота и пропионовая кислота, или смеси таких растворителей. Предпочтительны органические растворители, температура кипения которых составляет Наиболее предпочтительными растворителями являются толуол, изомеры ксилола, такие как орто-, мета- и параксилол, метилциклогексан, хлорбензол и изомеры дихлорбензола, такие как 1,2-, 1,3- и 1,4-дихлорбензол. Реакцию согласно изобретению предпочтительно проводить в атмосфере инертного газа, например в атмосфере азота или аргона. Конденсацию соединений формулы II с соединениями формулы IV можно осуществлять при добавлении или без добавления основания. Ту же самую конденсацию с соединениями формулы IVa или IVb (вместо соединений формулы IV) целесообразно осуществлять в присутствии основания. Пригодными для этой цели основаниями являются, например, азотистые основания как таковые, в частности третичные амины и пиридины, например C1-С6-триалкиламины, хинуклидин и 4-диметиламинопиридин. Другими пригодными для использования в вышеуказанных целях основаниями являются, например, алкоголяты щелочных металлов, в частности метанолят натрия и калия, этанолят натрия и калия и трет-бутанолят натрия и калия. Можно также использовать неорганические основания, например гидриды щелочных и щелочно-земельных металлов, такие как гидрид натрия, калия или кальция, гидроксиды щелочных и щелочноземельных металлов, такие как гидроксид натрия или калия, карбонаты щелочных и щелочноземельных металлов, такие как карбонат натрия или калия, и гидрокарбонаты щелочных и щелочноземельных металлов, такие как гидрокарбонат натрия или калия, прежде всего в виде растворов в спирте. Подобные основания используют в каталитических количествах либо в молярном избытке, составляющем вплоть до 5, в пересчете на соединение формулы II. В предпочтительном варианте осуществления предлагаемого способа в качестве реакционной среды, в которой растворены реагенты формул II и IV, IVa или IVb, используют ароматический углеводород с температурой кипения >80°С, например ксилол. Соединение формулы IV, IVa или IVb предпочтительно использовать в избытке, составляющем от 5 до 20 мол.% в пересчете на соединение формулы II. Реакционную смесь нагревают с обратным холодильником в течение 1-3 ч в атмосфере инертного газа при добавлении или без добавления основания, когда используют соединение формулы IV, и в присутствии органического основания, такого как триэтиламин, взятом в эквимолярном количестве или в избыточном количестве, которое при использовании соединения формулы IVa или IVb может вплоть до 5 раз превышать эквимолярное количество. После охлаждения и добавления разбавленной кислоты целевой продукт (G означает водород) выпадает в осадок в виде кристаллического твердого продукта, который можно непосредственно отфильтровывать и промывать пригодным для этой цели промывочным агентом, например водой и/или гексаном. Соединения формулы I, в которой R0, R1, R2, R 3, R4, R5 и n имеют вышеуказанные значения, a G означает водород, эквивалент иона металла или катион аммония, можно простым путем првращать в соединения Iа либо а) в соответствии с изобретением непосредственно в реакционном растворе в одном и том же реакционном сосуде без выделения, либо б) на последующей реакционной стадии после выделения взаимодействием, необязательно в присутствии связывающего кислоту агента или катализатора, с электрофилом формулы XII, в которой G0 имеет вышеуказанные значения, a L означает уходящую группу, например R30 С(O)O- или R31O- (где R30 и R31 имеют указанные для формулы Iа значения) либо галоген, предпочтительно хлор, бром или иод. Эта стадия дериватизации проиллюстрирована на реакционной схеме 2. Реакционная схема 2 Связывающие кислоту агенты, которые можно использовать в реакции соединения формулы I с электрофилом формулы XII, могут представлять собой традиционные акцепторы протонов, например гидриды щелочных металлов, алкоголяты щелочных металлов, карбонаты либо гидрокарбонаты щелочных или щелочноземельных металлов или азотистые основания в целом, например триэтиламин, диизопропиламин, пиридин, хинолин, диазабициклононен (ДБН) и диазабициклоундецен (ДБУ). В качестве катализаторов, ускоряющих протекание реакции соединения формулы I с электрофилом формулы IId, можно добавлять, например, оловоорганические соединения, в частности дилаурат дибутилолова. В качестве растворителей можно использовать любой растворитель, инертный в отношении электрофилов формул XII и XIIa-XIIf, например ароматические углеводороды, такие как бензол, толуол или изомер ксилола, галогенированные углеводороды, такие как дихлорметан, трихлорметан, хлорбензол или изомер дихлорбензола, амиды, такие как N,N-диметилформамид (ДМФ) или 1-метил-2-пирролидон (N-МП), или простые эфиры, такие как дибутиловый эфир, 1,2-диметоксиэтан (ДМЭ), 1,3-диоксолан, тетрагидрофуран или диоксан. Аналогичные реакции соединений формулы I, в которой G означает водород, соответствующие вышеуказанному варианту б), т.е. реакции, осуществляемые в виде отдельной стадии, описаны, например, в WO 97/02243 и ЕР-А 0508126. Соединения формулы I, которые получены предлагаемым в изобретении способом и в которых G представляет собой водород, эквивалент иона металла или катион аммония, сульфония либо фосфония, используют таким образом прежде всего в качестве исходных соединений для получения "in situ" соединений формулы Iа, в которых G0 представляет собой группу -С(O)-R30; -C(X1)-X2-R31 -С(Х3 )-N(R32)-R33, -SO2-R34 или -Р(Х4)(R35)-R36, а R 30, R31, R32, R33, R 34, R35, R36, X1, Х 2, Х3 и Х4 имеют указанные для формулы Iа значения. Соединения формулы I в которой R0 в каждом случае независимо означает галоген, С1-С6алкил, С2 -С6алкенил, С1-С6алкинил, C 1-С6галоалкил, циано-С1-С6 алкил, С2-С6галоалкенил, циано-С2 -С6алкенил, С1-С6галоалкинил, циано-С2-С6алкинил, гидроксигруппу, гидрокси-С 1-С6алкил, C1-С6алкоксигруппу, нитрогруппу, аминогруппу, С1-С6алкиламиногруппу, ди(С1-С6алкил)аминогруппу, C1 -С6алкилкарбониламиногруппу, C1-С6 алкилсульфониламиногруппу, С1-С6алкиламиносульфонил, С1-С6алкилкарбонил, С1-С 6алкилкарбонил-С1-С6алкил, С 1-С6алкоксикарбонил-С1-С6 алкил, С1-С6алкилкарбонил-С2 -С6алкенил, С1-С6алкоксикарбонил-С 2-С6алкенил, С1-С6 алкилкарбонил-С2-С6алкинил, С1 -С6алкоксикарбонил-С2-С6алкинил, C1-С6алкоксикарбонил, цианогруппу, карбоксил, фенил или ароматическое кольцо, содержащее 1 или 2 гетероатома, выбранных из группы, включающей азот, кислород и серу, при этом последние два ароматических кольца могут быть замещены C 1-С3алкилом, C1-С3галоалкилом, C1-С3алкоксигруппой, C1-С 3галоалкоксигруппой, галогеном, цианогруппой или нитрогруппой, или R0 вместе с соседними заместителями R 1, R2 и R3 образует насыщенный или ненасыщенный С3-С6углеводородный мостик, который может быть прерван 1 или 2 гетероатомами, выбранными из группы, включающей азот, кислород и серу, и/или может быть замещен С1-С4алкилом, R1 , R2 и R3 каждый независимо друг от друга означает водород, галоген, С1-С6алкил, С2-С6алкенил, С2-С6 алкинил, С3-С6циклоалкил, C1 -С6галоалкил, С2-С6галоалкенил, С1-С6алкоксикарбонил-С2-С 6алкенил, C1-С6алкилкарбонил-С 2-С6алкенил, циано-С2-С6 алкенил, нитро-С2-С6алкенил, С2 -С6галоалкинил, С1-С6алкоксикарбонил-С 2-С6алкинил, C1-С6 алкилкарбонил-С2-С6алкинил, циано-С 2-С6алкинил, нитро-С2-С6 алкинил, С3-С6-галоциклоалкил, гидрокси-С 1-С6алкил, С1-С6алкокси-С 1-С6алкил, С1-С6алкилтио-С 1-С6алкил, цианогруппу, С1-С 4алкилкарбонил, C1-С6алкоксикарбонил, гидроксигруппу, C1-С10алкоксигруппу, С 3-С6алкенилоксигруппу, С3-С6 алкинилоксигруппу, C1-С6галоалкоксигруппу, С3-С6галоалкенилоксигруппу, С1 -С6алкокси-С1-С6алкоксигруппу, меркаптогруппу, C1-С6алкилтиогруппу, C 1-С6галоалкилтиогруппу, C1-С 6алкилсульфинил, C1-С6алкилсульфонил, нитрогруппу, аминогруппу, C1-С6алкиламиногруппу, ди(С1-С6алкил)аминогруппу или феноксигруппу, в которой фенильное кольцо может быть замещено C1-С 3алкилом, C1-С3галоалкилом, C1-С3алкоксигруппой, C1-С 3галоалкоксигруппой, галогеном, цианогруппой или нитрогруппой, R2 может также означать фенил, нафтил или 5- или 6-членное ароматическое кольцо, которое может содержать 1 или 2 гетероатома, выбранных из группы, включающей азот, кислород и серу, где фенильное кольцо, нафтильная кольцевая система и 5- или 6-членное ароматическое кольцо могут быть замещены галогеном, С3-С8циклоалкилом, гидроксигруппой, меркаптогруппой, аминогруппой, цианогруппой, нитрогруппой или формилом, и/или фенильное кольцо, нафтильная кольцевая система и 5- или 6-членное ароматическое кольцо могут быть замещены C1-С 6алкилом, С1-С6алкоксигруппой, гидрокси-С 1-С6алкилом, С1-С6 алкокси-С1-С6алкилом, С1-С 6алкокси-С1-С6алкоксигруппой, С 1-С6алкилкарбонилом, С1-С6 алкилтиогруппой, С1-С6алкилсульфинилом, С1-С6алкилсульфонилом, моно- С1 -С6алкиламиногруппой, ди(С1-С6 алкил)аминогруппой, С1-С6алкилкарбониламиногруппой, С1-С6алкилкарбонил(С1-С 6алкил)аминогруппой, С2-С6алкенилом, С3-С6алкенилоксигруппой, гидрокси-С 3-С6алкенилом, C1-С6алкокси-С 2-С6алкенилом, C1-С6 алкокси-С3-С6алкенилоксигруппой, С 2-С6алкенилкарбонилом, С2-С6 алкенилтиогруппой, С2-С6алкенилсульфинилом, С2-С6алкенилсульфонилом, моно- либо ди-(С 2-С6алкенил)аминогруппой, С1 -С6алкил(С3-С6алкенил)аминогруппой, С2-С6алкенилкарбониламиногруппой, С 2-С6алкенилкарбонил(С1-С6 алкил)аминогруппой, С2-С6алкинилом, С 3-С6алкинилоксигруппой, гидрокси-С3 -С6алкинилом, C1-С6алкокси-С 3-С6алкинилом, C1-С6 алкокси-С4-С6алкинилоксигруппой, С 2-С6алкинилкарбонилом, С2-С6 алкинилтиогруппой, С2-С6алкинилсульфинилом, С2-С6алкинилсульфонилом, моно- либо ди-(С 3-С6алкинил)аминогруппой, C1 -С6алкил(С3-С6алкинил)аминогруппой, С2-С6алкинилкарбониламиногруппой или С 2-С6алкинилкарбонил(С1-С6 алкил)аминогруппой, и/или фенильное кольцо, нафтильная кольцевая система и 5- или 6-членное ароматическое кольцо могут быть замещены замещенными галогеном С1-С6алкилом, C 1-С6алкоксигруппой, гидрокси-С1-С 6алкилом, C1-С6алкокси-С 1-С6алкилом, С1-С6алкокси-С 1-С6алкоксигруппой, С1-С 6алкилкарбонилом, С1-С6алкилтиогруппой, С1-С6алкилсульфинилом, С1-С 6алкилсульфонилом, моно-C1-С6алкиламиногруппой, ди(С1-С6алкил)аминогруппой, C1 -С6алкилкарбониламиногруппой, С1-С 6алкилкарбонил(С1-С6алкил)аминогруппой, С2-С6алкенилом, С3-С6 алкенилоксигруппой, гидрокси-С3-С6алкенилом, С1-С6алкокси-С2-С6 алкенилом, C1-С6алкокси-С3-С 6алкенилоксигруппой, С2-С6алкенилкарбонилом, С2-С6алкенилтиогруппой, С2-С 6алкенилсульфинилом, С2-С6алкенилсульфонилом, моно- либо ди-(С2-С6алкенил)аминогруппой, С1-С6алкил-(С3-С6 алкенил)аминогруппой, С2-С6алкенилкарбониламиногруппой, С2-С6алкенилкарбонил(С1-С 6алкил)аминогруппой, С3-С6алкинилом, С3-С6алкинилоксигруппой, гидрокси-С 3-С6алкинилом, C1-С6алкокси-С 3-С6алкинилом, С1-С6 алкокси-С4-С6алкинилоксигруппой, С 2-С6алкинилкарбонилом, С2-С6 алкинилтиогруппой, С2-С6алкинилсульфинилом, С2-С6алкинилсульфонилом, моно- либо ди-(С 3-С6алкинил)аминогруппой, С1 -С6алкил(С3-С6алкинил)аминогруппой, С2-С6алкинилкарбониламиногруппой или С 2-С6алкинилкарбонил(С1-С6 алкил)аминогруппой, и/или фенильное кольцо, нафтильная кольцевая система и 5- или 6-членное ароматическое кольцо могут быть замещены радикалом формулы COOR50,CONR51, S0 2NR53R54 или SO2OR 55, где R50, R51, R52, R53, R54 и R55 каждый независимо друг от друга означает C1-С6алкил, С 2-С6алкенил или С3-С6алкинил или замещенный галогеном, гидроксигруппой, алкоксигруппой, меркаптогруппой, аминогруппой, цианогруппой, нитрогруппой, алкилтиогруппой, алкилсульфинилом или алкилсульфонилом C1-С6алкил, С 2-С6алкенил либо С3-С6 алкинил, n означает 1 или 2, R4 и R 5 вместе с атомами азота, к которым они присоединены, образуют насыщенное или ненасыщенное 5-8-членное гетероциклическое кольцо, которое 1) прервано кислородом, серой или группой –NR14 и может быть замещено галогеном, C1-С 10алкилом, C1-С10галоалкилом, гидроксигруппой, С1-С6алкоксигруппой, С1-С 6алкокси-С1-С6алкоксигруппой, С 1-С6галоалкоксигруппой, меркаптогруппой, C 1-С6алкилтиогруппой, С3-С7 циклоалкилом, гетероарилом, гетероарил-С1-С6 алкилом, фенилом, фенил-C1-С6алкилом или бензилоксигруппой, где фенильные кольца трех последних заместителей в свою очередь могут быть замещены галогеном, C1-С 6алкилом, C1-С6галоалкилом, C1-С6алкоксигруппой, C1-С 6галоалкоксигруппой или нитрогруппой, и 2) может содержать конденсированную или спиросвязанную алкиленовую либо алкениленовую цепь с 2-6 атомами углерода, которая необязательно прервана кислородом или серой, или по меньшей мере один кольцевой атом насыщенного или ненасыщенного гетероциклического кольца образует мостиковую связь с этой алкиленовой или алкениленовой цепью, при этом R 14 означает водород, С1-С4алкил, C1-С6алкилкарбонил, C1-С 6алкилсульфонил, С3-С6алкенил или С3-С6алкинил,и G означает водород, эквивалент иона металла или катион аммония, сульфония либо фосфония, являются новыми соединениями. Таким образом, изобретение относится также к этим соединениям. Соединения формулы Iа в которой R0 в каждом случае независимо означает галоген, C1-С6алкил, С2-С 6алкенил, С2-С6алкинил, C1 -С6галоалкил, циано-С1-С6алкил, С2-С6галоалкенил, циано-С2-С 6алкенил, С2-С6галоалкинил, циано-С2-С6алкинил, гидроксигруппу, гидрокси-С 1-С6алкил, C1-С6алкоксигруппу, нитрогруппу, аминогруппу, C1-С6алкиламиногруппу, ди(С1-С6алкил)аминогруппу, C1 -С6алкилкарбониламиногруппу, C1-С6 алкилсульфониламиногруппу, C1-С6алкиламиносульфонил, C1-С6алкилкарбонил, С1-С 6алкилкарбонил-C1-С6алкил, С 1-С6алкоксикарбонил-С1-С6 алкил, С1-С6алкилкарбонил-С2 -С6алкенил, С1-С6алкоксикарбонил-С 2-С6алкенил, С1-С6 алкилкарбонил-С2-С6алкинил, С1 -С6алкоксикарбонил-С2-С6алкинил, C1-С6алкоксикарбонил, цианогруппу, карбоксил, фенил или ароматическое кольцо, содержащее 1 или 2 гетероатома, выбранных из группы, включающей азот, кислород и серу, при этом два последних ароматических кольца могут быть замещены C 1-С3алкилом, C1-С3галоалкилом, C1-С3алкоксигруппой, C1-С 3галоалкоксигруппой, галогеном, цианогруппой или нитрогруппой, или R0 вместе с соседними заместителями R1 , R2 и R3, образует насыщенный или ненасыщенный С3-С6углеводородный мостик, который может быть прерван 1 или 2 гетероатомами, выбранными из группы, включающей азот, кислород и серу, и/или может быть замещен С1 -С4алкилом, R1, R2 и R3 каждый независимо друг от друга означает водород, галоген, C1-С6алкил, С2-С6 алкенил, С2-С6алкинил, С3-С 6циклоалкил, C1-С6галоалкил, С 2-С6галоалкенил, С1-С6 алкоксикарбонил-С2-С6алкенил, С1 -С6алкилкарбонил-С2-С6алкенил, циано-С2-С6алкенил, нитро-С2 -С6алкенил, С2-С6галоалкинил, С1-С6алкоксикарбонил-С2-С 6алкинил, C1-С6алкилкарбонил-С 2-С6алкинил, циано-С2-С6 алкинил, нитро-С2-С6алкинил, С3 -С6галоциклоалкил, гидрокси-С1-С6 алкил, С1-С6алкокси-С1-С 6алкил, C1-С6алкилтио-C1 -С6алкил, цианогруппу, С1-С4 алкилкарбонил, C1-С6алкоксикарбонил, гидроксигруппу, C1-С10алкоксигруппу, С3-С 6алкенилоксигруппу, С3-С6алкинилоксигруппу, C1-С6галоалкоксигруппу, С3-С 6галоалкенилоксигруппу, С1-С6 алкокси-С1-С6алкоксигруппу, меркаптогруппу, C1-С6алкилтиогруппу, C1-С 6галоалкилтиогруппу, C1-С6алкилсульфинил, C1-С6алкилсульфонил, нитрогруппу, аминогруппу, C1-С6алкиламиногруппу, ди(C1 -С6алкил)аминогруппу или феноксигруппу, где фенильное кольцо может быть замещено C1-С3алкилом, C1-С3галоалкилом, C1-С 3алкоксигруппой, C1-С3галоалкоксигруппой, галогеном, цианогруппой или нитрогруппой, R2 может также означать фенил, нафтил или 5- либо 6-членное ароматическое кольцо, которое может содержать 1 или 2 гетероатома, выбранных из группы, включающей азот, кислород и серу, при этом фенильное кольцо, нафтильная кольцевая система и 5- или 6-членное ароматическое кольцо могут быть замещены галогеном, С3-С8 циклоалкилом, гидроксигруппой, меркаптогруппой, аминогруппой, цианогруппой, нитрогруппой или формилом, и/или фенильное кольцо, нафтильная кольцевая система и 5- или 6-членное ароматическое кольцо могут быть замещены C1-С6алкилом, C1-С6алкоксигруппой, гидрокси-C1 -С6алкилом, C1-С6алкокси-C 1-С6алкилом, C1-С6алкокси-C 1-С6алкоксигруппой, C1-С 6алкилкарбонилом, C1-С6алкилтиогруппой, C1-С6алкилсульфинилом, C1-С 6алкилсульфонилом, моно-C1-С6алкиламиногруппой, ди(C1-С6алкил)аминогруппой, C1 -С6алкилкарбониламиногруппой, C1-С 6алкилкарбонил(C1-С6алкил)аминогруппой, С2-С6алкенилом, С3-С6 алкенилоксигруппой, гидрокси-С3-С6алкенилом, C1-С6алкокси-С2-С6 алкенилом, C1-С6алкокси-С3-С 6алкенилоксигруппой, С2-С6алкенилкарбонилом, С2-С6алкенилтиогруппой, C2-С 6алкенилсульфинилом, С2-С6алкенилсульфонилом, моно- либо ди-(С2-С6алкенил)аминогруппой, C1-С6алкил(С3-С6алкенил)аминогруппой, С2-С6алкенилкарбониламиногруппой, С 2-С6алкенилкарбонил(C1-С6 алкил)аминогруппой, С2-С6алкинилом, С 3-С6алкинилоксигруппой, гидрокси-С3 -С6алкинилом, C1-С6алкокси-С 3-С6алкинилом, C1-С6 алкокси-С4-С6алкинилоксигруппой, С 2-С6алкинилкарбонилом, C2-С6 алкинилтиогруппой, С2-С6алкинилсульфинилом, C2-С6алкинилсульфонилом, моно- либо ди-(С 3-С6алкинил)аминогруппой, C1 -С6алкил(С3-С6алкинил)аминогруппой, С2-С6алкинилкарбониламиногруппой или С 2-С6алкинилкарбонил(C1-С6 алкил)аминогруппой, и/или фенильное кольцо, нафтильная кольцевая система и 5- или 6-членное ароматическое кольцо могут быть замещены замещенными галогеном C1-С6алкилом, C 1-С6алкоксигруппой, гидрокси-C1-С 6алкилом, C1-С6алкокси-C 1-С6алкилом, C1-С6алкокси-C 1-С6алкоксигруппой, C1-С 6алкилкарбонилом, C1-С6алкилтиогруппой, C1-С6алкилсульфинилом, C1-С 6алкилсульфонилом, моно- C1-С6алкиламиногруппой, ди(C1-С6алкил)аминогруппой, C1 -С6алкилкарбониламиногруппой, C1-С 6алкилкарбонил(C1-С6алкил)аминогруппой, С2-С6алкенилом, С3-С6 алкенилоксигруппой, гидрокси-С3-С6алкенилом, C1-С6алкокси-С2-С6 алкенилом, C1-С6алкокси-С3-С 6алкенилоксигруппой, С2-С6алкенилкарбонилом, С2-С6алкенилтиогруппой, С2-С 6алкенилсульфинилом, С2-С6алкенилсульфонилом, моно- либо ди-(С2-С6алкенил)аминогруппой, C1-С6алкил-(С3-С6 алкенил)аминогруппой, С2-С6алкенилкарбониламиногруппой, С2-С6алкенилкарбонил(С1-С 6алкил)аминогруппой, С2-С6алкинилом, С3-С6алкинилоксигруппой, гидрокси-С 3-С6алкинилом, C1-С6алкокси-С 3-С6алкинилом, C1-С6 алкокси-С4-С6алкинилоксигруппой, С 2-С6алкинилкарбонилом, С2-С6 алкинилтиогруппой, С2-С6алкинилсульфинилом, С2-С6алкинилсульфонилом, моно- либо ди-(С 3-С6алкинил)аминогруппой, C1 -С6алкил(С3-С6алкинил)аминогруппой, С2-С6алкинилкарбониламиногруппой или С 2-С6алкинилкарбонил(С1-С6 алкил)аминогруппой, и/или фенильное кольцо, нафтильная кольцевая система и 5- или 6-членное ароматическое кольцо могут быть замещены радикалом формулы COOR50, CONR51, SO 2NR53R54 или SO2OR 55, где R50, R51, R52, R53, R54 и R55 каждый независимо друг от друга означает C1-С6алкил, С 2-С6алкенил или С3-С6алкинил либо замещенный галогеном, гидроксигруппой, алкоксигруппой, меркаптогруппой, аминогруппой, цианогруппой, нитрогруппой, алкилтиогруппой, алкилсульфинилом или алкилсульфонилом C1-С6алкил, С 2-С6алкенил либо С3-С6 алкинил, n означает 1 или 2, R4 и R 5 вместе с атомами азота, к которым они присоединены, образуют насыщенное или ненасыщенное 5-8-членное гетероциклическое кольцо, которое 1) прервано кислородом, серой или группой -NR14 - и может быть замещено галогеном, C1-С10 алкилом, C1-С10галоалкилом, гидроксигруппой, C1-С6алкоксигруппой, С1-С 6алкокси-C1-С6алкоксигруппой, C 1-С6галоалкоксигруппой, меркаптогруппой, C 1-С6алкилтиогруппой, С3-С7 циклоалкилом, гетероарилом, гетероарил- C1-С6 алкилом, фенилом, фенил-C1-С6алкилом или бензилоксигруппой, где фенильные кольца последних трех заместителей в свою очередь могут быть замещены галогеном, C1-С 6алкилом, C1-С6галоалкилом, C1-С6алкоксигруппой, C1-С 6галоалкоксигруппой или нитрогруппой, и 2) может содержать конденсированную или спиросвязанную алкиленовую или алкениленову цепь с 2-6 атомами углерода, которая необязательно прервана кислородом или серой, или по крайней мере один кольцевой атом насыщенного или ненасыщенного гетероциклического кольца мостиковую связь с этой алкиленовой или алкениленовой цепью, при этом R14 означает водород, С1-С4алкил, C 1-С6алкилкарбонил, C1-С6 алкилсульфонил, С3-С6алкенил или С 3-С6алкинил, и G0 означает группу -С(O)-R30, -C(X1)-X2-R 31 или -SO2-R34, где X 1, Х2, Х3 и Х4 каждый независимо друг от друга означает кислород или серу, R30 означает незамещенный либо замещенный галогеном С 1-С20алкил, С2-С20алкенил, С1-С8алкокси-С1-С8 алкил, С1-С8алкилтио-С1-С 8алкил, поли- С1-С8алкокси-С 1-С8алкил или незамещенный либо замещенный галогеном С3-С8циклоалкил, С3-С6 циклоалкил-С1-С6алкил, гетероциклил-С 1-С6алкил, гетероарил-С1-С6 алкил, незамещенный либо замещенный галогеном, цианогруппой, нитрогруппой, С1-С6алкилом, С1 -С6алкоксигруппой, С1-С6галоалкилом, С1-С6галоалкоксигруппой, С1-С 6алкилтиогруппой или С1-С6 алкилсульфонилом фенил, незамещенный либо замещенный галогеном, нитрогруппой, цианогруппой, С1-С6алкилом, С1 -С6алкоксигруппой, С1-С6 галоалкилом или С1-С6галоалкоксигруппой фенил-С1-С6алкил, незамещенный либо замещенный галогеном или С1-С6алкилом гетероарил, незамещенный либо замещенный галогеном или С1-С 6алкилом фенокси-С1-С6алкил или незамещенный либо замещенный галогеном, аминогруппой или С1-С 6алкилом гетероарилокси-С1-С6алкил, R31 означает незамещенный либо замещенный галогеном С1-С20алкил, С2-С20 алкенил, С1-С8алкокси-С2-С 8алкил, поли-С1-С8алкокси-С2 -С8алкил, незамещенный либо замещенный галогеном или C1-С6алкоксигруппой С3-С 8циклоалкил, С3-С6циклоалкил-C 1-С6алкил, гетероциклил-C1-С 6алкил, гетероарил-C1-С6алкил, незамещенный либо замещенный галогеном, цианогруппой, нитрогруппой, C1-С6алкилом, C1-С6 алкоксигруппой, C1-С6галоалкилом или C 1-С6галоалкоксигруппой фенил или бензил и R 34 означает незамещенный либо замещенный галогеном С 1-С8алкил или незамещенный либо замещенный галогеном, C1-С6алкилом, C1-С6 алкоксигруппой, С1-С4галоалкилом, С 1-С4галоалкоксигруппой, циано-группой или нитрогруппой фенил, являются новыми соединениями. Таким образом, изобретение относится также к этим соединениям. Соединения формулы II в которой R0, R1, R2, R3, R6, R7 и n имеют вышеуказанные значения, являются новыми и были специально разработаны для предлагаемого в изобретении способа. Изобретение относится соответственно и к этим соединениям. Предпочтительными являются те соединения формулы II, в которых R1, R2 и R3 каждый независимо друг от друга означает водород, галоген, С 1-С4алкил, С1-С4галоалкил, С2-С4алкенил, С2-С4 галоалкенил, С2-С4алкинил, С3 -С6циклоалкил, С1-С4алкилкарбонил, C1-С6алкоксикарбонил, гидроксигруппу, С 1-С4алкоксигруппу, С3- или С 4-алкенилоксигруппу, С3- или С4 -алкинилоксигруппу, С1-С4галоалкоксигруппу, нитрогруппу или аминогруппу. Предпочтительны далее соединения формулы II, в которых R1 означает С2-С 6алкил. Равным образом предпочтительны соединения формулы II, в которых n равен 0. Среди вышеуказанных соединений формулы II особенно предпочтительны соединения, в которых R 1 означает С2-С4алкил, С1 -С4алкоксигруппу, С2-С4алкинил или С3-С6циклоалкил, а R3 означает С1-С4алкил, С1-С4 алкоксигруппу, С2-С4алкинил или С3 -С6циклоалкил. Предпочтительны также те соединения формулы II, в которых R1 означает С 2-С6алкинил. Помимо этого предпочтительными являются содинения формулы II, в которых R1 и R 3 каждый независимо друг от друга означает С2 -С6алкил, C2-С6алкинил, C 1-С10алкоксигруппу или С3-С6 циклоалкил. Среди этих соединений особенно предпочтительны соединения, в которых R1 означает С2-С 6алкил, а R3 означает С2-С6 алкил, С2-С6алкинил или C1-С 10алкоксигруппу. Важное значение имеют также соединения формулы II, в которых R6 представляет собой группу R8R9N-, R7 означает группу R10R11N-, a R8, R9 , R10 и R11 имеют указанные для формулы II значения. Соединения формулы IIа в которой R0, R1, R2, R3 и n имеют указанные для формулы I значения, a R 8, R9, R10 и R11 означают водород, можно получать, например, непосредственно из соответствующих динитрилов фенилмалоновой кислоты формулы VI в которой R0, R1, R2, R3 и n имеют вышеуказанные значения, путем гидролиза. В качестве гидролизующих агентов при этом можно использовать концентрированные минеральные кислоты, такие как серная кислота или азотная кислота, при необходимости с добавлением воды. Процесс получения соединений формулы IIа в которой R0, R1, R2, R3 и n имеют указанные для формулы I значения, a R 8, R9, R10 и R11 каждый независимо друг от друга означает водород, C1 -С6алкил, C1-С6галоалкил, С 3-С6алкенил или бензил, где фенильное кольцо бензильной группы может быть замещено С1-С4 алкилом, галогеном, С1-С4галоалкилом, C 1-С4алкоксигруппой или нитрогруппой, может, например, заключаться в том, что: 1) фенилацетамид формулы VII в которой R0, R1, R2, R3, R8, R9 и n имеют вышеуказанные значения, либо а) подвергают взаимодействию с изоцианатом формулы XI в которой R10 имеет вышеуказанные значения, за исключением водорода, при этом реакцию необязательно катализируют основанием и проводят в инертной реакционной среде (R11 означает водород в соединении формулы IIа), либо б) подвергают взаимодействию при температуре перегонки с карбонатом формулы XIV в которой R12 означает C1-С 6алкил, C1-С6галоалкил, С3 -С6алкенил или бензил, где фенильное кольцо бензильной группы может быть замещено С1-С4алкилом, галогеном, С1-С4галоалкилом, С1 -С4алкоксигруппой или нитрогруппой, получая сначала соединение формулы IIb в которой R0, R1, R2, R3, R8, R9, R12 и n имеют вышеуказанные значения, и затем это соединение подвергают взаимодействию в инертном растворителе с амином формулы Х в которой R10 и R11 имеют вышеуказанные значения, или 2) эфир фенилуксусной кислоты формулы VIII в которой R0, R1, R2, R3, R12 и n имеют вышеуказанные значения, либо в) подвергают взаимодействию с изоцианатом формулы XV в которой R8 имеет вышеуказанные значения, за исключением водорода, при этом реакцию необязательно катализируют основанием и проводят в инертной реакционной среде, получая сначала соединение формулы IIb в которой R0, R1, R2, R3, R8, R12 и n имеют вышеуказанные значения, a R9 означает водород, и затем это соединение описанным выше в п.1) б) образом подвергают взаимодействию в инертном растворителе с амином формулы X, либо г) подвергают при повышенной температуре взаимодействию с карбонатом формулы XVI в которой R13 имеет те же значения, что и R 12, получая сначала диэфирфенилмалоновой кислоты формулы III в которой R0, R1, R2, R3, R12, R13 и n имеют вышеуказанные значения, и затем это соединение аналогично описанной в п.1) б) методике подвергают в инертном растворителе взаимодействию с амином формулы IX или Х где R8, R9, R10 и R 11 имеют вышеуказанные значения. Описанные выше варианты проиллюстрированы на реакционной схеме 3. Реакционная схема 3 Диамиды фенилмалоновой кислоты формулы IIа можно получать согласно реакционной схеме 3 (вариант а) в соответствии с известными процедурами из фенилацетамидов формулы VII, используя изоцианаты формулы XI, при этом реакцию необязательно катализируют основанием и проводят в инертном растворителе. Согласно реакционной схеме 3 (вариант б), диамиды фенилмалоновой кислоты формулы IIа можно также получать из фенилацетамидов формулы VII путем нагрева с обратным холодильником в течение нескольких часов в карбонатах формулы XIV в качестве растворителей, получая сначала соединения формулы IIb, с последующим амидированием в растворителе с использованием аминов формулы X. Аналогичные реакции с эфирными производными фенилуксусной кислоты и карбонатами формулы XVI описаны, например, в WO 97/02243. Другими альтернативными процессами получения диамидов фенилмалоновой кислоты формулы IIа исходя из эфиров фенилуксусной кислоты формулы VIII являются согласно реакционной схеме 3 два следующих варианта: в соответствии с вариантом в) соединения формулы VIII можно, например, первоначально подвергать аналогично Tetpahedron Lett. 1974, 2427, взаимодействию с изоцианатами формулы XV, катализируя реакцию основанием и проводя реакцию в инертной реакционной среде, с получением соединений формулы IIb (R9 означает водород), которые затем амидируют в инертном растворителе аналогично варианту б) с использованием аминов формулы X, либо в соответствии с вариантом г) соединения формулы VIII можно, например, первоначально подвергать взаимодействию при температуре перегонки в карбонатах формулы XVI в качестве растворителей с получением диэфиров фенилмалоновой кислоты формулы III, которые затем амидируют в растворителе аналогично варианту б) с использованием аминов формулы IX или X. Соединения формул IV, IVа и IVb либо являются известными соединениями, либо их можно получать по известным методам. Способы получения соединений формулы IV описаны, например, в WO 95/00521 и РСТ/ЕР99/01593. Динитрильные производные фенилмалоновой кислоты формулы VI либо являются известными соединениями, либо их можно получать по известным методам, описанным, например, в Chem. Commun. 1984, 932, или в J. Am. Chem. Soc. 121, 1473(1999). Фенилацетамиды и эфиры фенилуксусной кислоты формул VII и VIII являются известными соединениями. Эфиры фенилуксусной кислоты формулы VIII описаны, например, в WO 97/02243. Реагенты формул IX, X, XI, XII и ХIIа, XIIb, XIIc, XIId, XIIe и XIIf, XIV, XV и XVI, используемые в реакциях согласно реакционным схемам 1, 2 и 3 соответственно, либо являются известными соединениями, либо их можно получать по известным методам. Предлагаемый в изобретении способ характеризуется: а) легкодоступностью исходных соединений формулы II, б) простотой осуществления реакций и переработки, в) в целом высоким выходом продукта, г) экономическими и экологическими преимуществами процесса, осуществляемого в одном реакционном сосуде, в отношении последующей дериватизации соединений формулы I для получения соединений формулы Iа (например, при превращении заместителя G в G0) и д) экономическими и экологическими преимуществами, обусловленными возможностью осуществлять отдельные стадии способа, а именно начальное получение соединений формулы II (реакционная схема 3), их последующее взаимодействие с соединениями формулы IV, IVa или IVb с получением соединений формулы I (реакционная схема 1) и затем их взаимодействие с электрофилами формулы XII, ХIIа, ХIIb, ХIIс или XIId в виде непрерывной реакции с получением соединений формулы Iа. Предлагаемый в изобретении способ пригоден также прежде всего для получения в промышленном масштабе 4-арил-5-оксопиразолиновых производных формул I и Iа. Ниже предлагаемый в изобретении способ проиллюстрирован на примерах, которые не ограничивают объем изобретения. Примеры получения Пример Р1: Получение диамида 2,4,6-триметилфенилмалоновой кислоты Раствор 2,0 г (0,0109 моля) динитрила 2,4,6-триметилфенилмалоновой кислоты в 5 мл дихлорметана в течение 2 мин добавляют по каплям к смеси 5 мл концентрированной серной кислоты (97%-ной) и 0,4 мл (0,022 моля) воды. После перемешивания в течение 100 ч при 20°С реакционную смесь сливают на лед и дважды экстрагируют этилацетатом. Объединенные органические фазы промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют в вакууме при 60°С. Таким путем получают 2,0 г (83% от теории) целевого указанного в заголовке соединения в виде желтоватых кристаллов tпл 177-179°С. Пример Р2: Получение диамида 2,6-диэтил-4-метилфенилмалоновой кислоты 2,1 г (0,0099 моля) динитрила 2,6-диэтил-4-метилфенилмалоновой кислоты добавляют к смеси 5 мл концентрированной серной кислоты (97%-ной) и 0,36 мл (0,0198 моля) воды. После перемешивания в течение 5 мин при 50°С образуется гомогенный раствор красного цвета, который перемешивают еще в течение 5 ч при 50°С. Затем реакционную смесь охлаждают до 22°С и после этого сливают в смесь льда с водой. После двукратной экстракции этилацетатом объединенные органические фазы промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют в вакууме при 60°С. Таким путем получают 2,35 г (95,6% от теории) целевого указанного в заголовке соединения в виде желтоватых кристаллов с tпл 184-186°С. 1 Н-ЯМР (CDCl3): 7,19 част./млн (широкий s, 1H), 6,99 част./млн (s, 2H), 5,78 част./млн (широкий s, 1H), 4,69 част./млн (s, 1H), 2,55 част./млн (q, 4H), 2,32 част./млн (s, ЗН), 1,21 част./млн (t, 6H). Пример Р3: Получение 8-(2,4,6-триметилфенил)тетрагидропиразоло[1,2-d|[1,4,5]оксадиазепин-7,9-диона Раствор 1,5 г (0,0068 моля) диамида 2,4,6-триметилфенилмалоновой кислоты, 2,16 г (0,0082 моля) дигидробромида [1,4,5]оксадиазепана и 2,93 г (0,029 моля) триэтиламина в 50 мл ксилола в течение двух часов нагревают с обратным холодильником в атмосфере азота. Образовавшуюся суспензию охлаждают до 22°С, перемешивают с 1н. соляной кислотой и фильтруют. Кристаллический остаток промывают водой, а затем диэтиловым эфиром и после этого сушат в вакууме при 60°С. Таким путем получают целевое указанное в заголовке соединение с tпл 248-250°С. Пример Р4: Получение 8-(2,6-диэтил-4-метилфенил)тетрагидропиразоло[1,2-d][1,4,5]оксадиазепин-7,9-диона Раствор 2,15 г (0,00866 моля) диамида 2,6-диэтил-4-метилфенилмалоновой кислоты, 2,64 г (0,010 моля) дигидробромида [1,4,5]оксадиазепана и 3,54 г (0,035 моля) триэтиламина в 50 мл ксилола в течение 2 ч нагревают с обратным холодильником в атмосфере азота. Образовавшуюся суспензию охлаждают до 22°С, добавляют 50 мл 1н. соляной кислоты и смесь перемешивают в течение 5 мин. После добавления 50 мл гексана образовавшееся твердое вещество отфильтровывают, промывают небольшим количеством воды и гексана и сушат в вакууме при 80°С. Таким путем получают 2,15 г целевого указанного в заголовке соединения в виде бесцветного твердого вещества с tпл 193-194°С. Органическую фазу сушат над сульфатом натрия и концентрируют в вакууме при 60°С, получая дополнительно 0,23 г указанного в заголовке соединения. Общий выход продукта составляет 2,38 г (87% от теории). 1Н-ЯМР (CDCl 3): 6,92 част./млн (d, 2H), 4,72 част./млн (s, 1H), 4,30 част./млн (m, 2H), 3,98 част./млн (m, 4H), 3,79 част./млн (m, 2H), 2,80 част./млн (s, 3Н), 2,70 част./млн (q, 2H), 2,27 част./млн (q, 2H), 1,27 част./млн (t, 3H), 1,20 част./млн (t, 3Н). Пример Р5: Получение 8-(2,6-диэтил-4-метилфенил)тетрагидропиразоло[1,2-d][1,4,5]оксадиазепин-7,9-диона Раствор 0,55 г (0,002 моля) 2-(2,6-диэтил-4-метилфенил)-N,N’-диметилмалонамида, 0,42 г (0,0024 моля) дигидробромида [1,4,5]оксадиазепана и 1,17 мл (0,0084 моля) триэтиламина в 6 мл ксилола в течение 18 ч нагревают с обратным холодильником в атмосфере азота. Затем реакционную смесь сливают в воду, смесь подкисляют 2н. соляной кислотой и суспензию перемешивают с гексаном. Твердое вещество отфильтровывают, промывают водой и гексаном и сушат в вакууме при 50°С. Таким путем получают 0,33 г целевого указанного в заголовке соединения в виде бежевых кристаллов с tпл 192-193,5°С. Пример Р6: Получение 8-(2,6-диэтил-4-метилфенил)-9-оксо-1,2,4,5-тетрагидро-9Н-пиразало[1,2-d][1,4,5]оксадиазепин-7-илового эфира 2,2-диметилпропионовой кислоты в одном реакционном сосуде Раствор 1,0 г (0,004 моля) диамида 2,6-диэтил-4-метилфенилмалоновой кислоты, 0,84 г (0,0048 моля) дигидробромида [1,4,5]оксадиазепана и 1,62 г (0,016 моля) триэтиламина в 25 мл ксилола в течение 2 ч нагревают с обратным холодильником в атмосфере азота. Затем реакционную смесь охлаждают до комнатной температуры, добавляют 0,87 г (0,0072 моля) пивалоилхлорида и смесь перемешивают еще в течение 2 ч при 22°С. После этого реакционную смесь перемешивают с 25 мл 1н. соляной кислоты и экстрагируют этилацетатом. Органические экстракты промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют в вакууме при 60°С. Таким путем получают 2,3 г коричневого масла. После перекристаллизации из гексана получают 1,0 г целевого указанного в заголовке соединения в виде бесцветных кристаллов с tпл 120-122°С. 1H-ЯМР (СDСl3): 6,89 част./млн (s, 2H), 4,29 част./млн (m, 2H), 3,95 част./млн (m, 2H), 3,87 част./млн (m, 4Н), 2,49 част./млн (m, 4H), 2,30 част./млн (s, ЗН), 1,12 част./млн (t, 6Н), 1,04 част./млн (s, 9H). Пример Р7: Получение 2-(2,6-диэтил-4-метилфенил)-N,N’-диметилмалонамида 30 мл 33%-ного раствора метиламина в этаноле при 22°С добавляют к 4,18 г (0,015 моля) диметилового эфира 2-(2,6-диэтил-4-метилфенил)малоновой кислоты и смесь перемешивают при 75°С в течение 30 ч. Затем реакционную смесь сливают в воду, подкисляют концентрированной соляной кислотой и экстрагируют простым эфиром. Органические экстракты промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют в вакууме при 60°С. Полученный остаток (4,0 г коричневого масла) перемешивают с гексаном, получая 1,74 г целевого указанного в заголовке соединения в виде кристаллического продукта с tпл 98-100°С. Пример Р8: Получение 2-(2,4,6-триметилфенил)тетрагидропиразоло[1,2-а]пиридазин-1,3-диона (без добавления основания) Раствор 2,05 г (0,0093 моля) диамида 2,4,6-триметилфенилмалоновой кислоты и 0,95 г (0,0110 моля) гексагидропиридазина в 50 мл ксилола в течение 2 ч кипятят с обратным холодильником в атмосфере азота. Затем реакционную смесь охлаждают до 22°С и перемешивают с 50 мл 1н. соляной кислоты, после чего образовавшуюся суспензию фильтруют и кристаллический остаток промывают сначала диэтиловым эфиром, а затем водой и сушат в вакууме. Таким путем получают 2,2 г целевого указанного в заголовке соединения в виде бесцветных кристаллов с tпл 247-248°C. 1 Н-ЯМР (CDCl3): 6,93 част./млн (s, 1H), 6,83 част./млн (s, 1H), 4,65 част./млн (s, 1H), 3,67 част./млн (широкий s, 4H), 2,40 част./млн (s, 3H), 2,27 част./млн (s, 3H), 2,04 част./млн (s, 3H), 1,83 част./млн (широкий s, 4H). Пример Р9: Получение диамида 2,6-диэтил-4-(4-пиридил)фенилмалоновой кислоты 36 мг (0,002 моля) воды, а затем 360 мг (примерно 75%, 0,001 моля) динитрила 2,6-диэтил-4-(4-пиридил)фенилмалоновой кислоты добавляют к 0,5 мл серной кислоты (97%-ной) и смесь перемешивают при 50°С в течение 5,5 ч. Охлажденную реакционную смесь нейтрализуют насыщенным раствором гидрокарбоната натрия, образовавшийся осадок отфильтровывают и промывают водой, после чего кристаллы суспендируют в небольшом количестве диэтилового эфира, отфильтровывают и сушат. Таким путем получают 145 мг (47% от теории) целевого указанного в заголовке соединения с tпл 184-186°C. 1Н-ЯМР (СDСl3): 8,63 част./млн (d, 2H), 7,48 част./млн (d, 2H), 7,40 част./млн (s, 2H), 7,20 част./млн (широкий сигнал, 2H), 5,81 част./млн (широкий сигнал, 2H), 4,80 част./млн (s, 1H), 2,68 част./млн (q, 4H), 1,30 част./млн (t, 6H). Пример Р10: Диамид 2,6-диэтил-4-(2-пиридил)фенилмалоновой кислоты Указанное в заголовке соединение получают аналогично предыдущему примеру. tпл 230°C (разложение). 1H-ЯМР (CDCl3): 8,68 част./млн (d, 1H), 4,66-7,80 част./млн (m, 4H), 7,23 част./млн (m, 1H), 7,20 част./млн (шировкий сигнал, 2H), 5,67 част./млн (широкий сигнал, 2H), 4,80 част./млн (s, 1H), 2,67 част./млн (q, 4H), 1,30 част./млн (t, 6Н). Пример Р11: Получение 8-(2,6-диэтил-2-пиридин-4-илфенил)-9-оксо-1,2,4,5-тетрагидро-9Н-пиразоло[1,2-d][1,4,5]оксадиазепин-7-илового эфира 2,2-диметилпропионовой кислоты 290 мг (0,0011 моля) дигидробромида [1,4,5]оксадиазепана и 0,56 мл (0,004 моля) триэтиламина добавляют к 7 мл дегазированного ксилола, а затем добавляют 311 мг (0,001 моля) диамида 2,6-диэтил-4-(2-пиридил)фенилмалоновой кислоты и смесь перемешивают при 150°С в течение 4 ч. Реакционную смесь оставляют стоять в течение ночи при 20°С, затем охлаждают до температуры в пределах от 0 до 5°С, после чего по каплям добавляют 0,135 мл (0,0011 моля) хлорангидрида пивалиновой кислоты. Смесь для завершения реакции перемешивают в течение 3 ч при 20°С, после этого сливают в смесь льда с водой и дважды экстрагируют этилацетатом. Объединенные органические фазы промывают водой и рассолом, сушат над сульфатом натрия и концентрируют. Сырой продукт массой 345 мг (75% от теории) кристаллизуют из диэтилового эфира. Таким путем получают 160 мг целевого указанного в заголовке соединения (35% от теории) с tпл 146-147°С. 1Н-ЯМР (CDCl3): 8,70 част./млн (m, 1H), 7,72 част./млн (m, 2H), 7,70 част./млн (s, 2H), 7,22 част./млн (m, 1H), 4,30 част./млн (m, 2H), 3,97 част./млн (m, 2H), 3,89 част./млн (m, 4Н), 2,62 част./млн (m, 4H), 1,21 част./млн (t, 6H), 1,03 част./млн (s, 9H). Пример Р12: 8-(2,6-диэтил-4-пиридин-4-илфенил)-9-оксо-1,2,4,5-тетрагидро-9.Н.-пиразоло[1,2-d][1,4,5]оксадиазепин-7-иловый эфир 2,2-диметилпропионовой кислоты Указанное в заголовке соединение получают аналогично предыдущему примеру. 1Н-ЯМР (CDCl3): 8,19 част./млн (широкий сигнал, 2H), 7,53 част./млн (широкий сигнал, 2H), 7,35 част./млн (s, 2H), 4,30 част./млн (m, 2H), 3,96 част./млн (m, 2H), 3,89 част./млн (m, 4H), 2,62 част./млн (m, 4H), 1,20 част./млн (t, 6H), 1,05 част./млн (s, 9H). Формула изобретения1. Способ получения соединения формулы I в которой R1, R2 и R3 каждый независимо друг от друга означает C1 -С6алкил, R2 может также представлять собой пиридил, R4 и R5 совместно с атомами азота, к которым они присоединены, образуют насыщенное 5-8-членное гетероциклическое кольцо, которое может быть прервано кислородом, и G означает водород, заключающийся в том, что соединение формулы II в которой R1, R2 и R3 имеют вышеуказанные значения, R6 означает группу R8R9N-, R7 означает группу R 10R11N-, и R8, R9 , R10, R11 каждый независимо друг от друга означает водород или C1-С6алкил, подвергают взаимодействию в инертном органическом растворителе, необязательно в присутствии основания, с соединением формулы IV, IVa или IVb в которой R4 и R5 имеют вышеуказанные значения, а Н·Наl означает галогенид водорода, и полученное соединение формулы I, в котором G представляет собой катион аммония, превращают путем обработки кислотой Бренстеда в соответствующее соединение формулы I, в котором G представляет собой водород. 2. Способ по п.1, в котором соединение формулы IV, IVa или IVb используют в эквимолярном количестве или предпочтительно в избытке, составляющем от 5 до 50 мол.% в пересчете на соединение формулы II. 3. Способ по п.1, в котором реакцию проводят при температуре от 0 до 200°С. 4. Способ по п.1, в котором в качестве растворителя используют толуол или один из изомеров ксилола, такой как орто-, мета- и пара-ксилол. 5. Способ по п.1, в котором конденсацию осуществляют в атмосфере инертного газа. 6. Способ по п.1, в котором реакцию соединения формулы II с соединением формулы IVa или IVb осуществляют в присутствии основания. 7. Способ по п.6, в котором в качестве основания используют третичный амин или пиридин. 8. Способ по п.7, в котором основание используют в каталитическом количестве либо в молярном избытке, составляющем вплоть до 5 в пересчете на соединение формулы II. 9. Соединение формулы II в которой R1, R2, R3, R6 и R7 имеют указанные в п.1 значения. Популярные патенты: 2415570 Искусственное роение и борьба с естественным роением пчелиных семей ... следующие существенные недостатки: 1. Оно является стихийным и колеблется по годам. Все это создает трудности для планового увеличения количества семей пчел.2. После перехода семьи в роевое состояние у матки сокращается, а затем прекращается откладка яиц. Все это снижает темпы выращивания пчел.3. В роевом состоянии пчелы становятся пассивными, плохо собирают нектар и пыльцу, не строят соты. Роение снижает медосбор, если оно совпадает с начальным периодом сильного и короткого медосбора (например, с липы).4. Оно затрудняет племенную работу, так как роятся пчелиные семьи и с нежелательными признаками. 5. Естественное роение снижает производительность труда пчеловода и мешает ... 2145478 Гранулированное либо пеллетированное средство для защиты растений, способ его получения и способ борьбы с грибами ... ... 2275006 Устройство для крепления стеблей малины в вертикальном и горизонтальном положениях ... зазор между другой концевой U-образной частью U-образной скобы и натянутой проволокой при установленной на проволоке замкнутой части скобы равен размеру примерно 20 мм, обеспечивающему проход без задержек стебля малины, который в образованном треугольнике U-образной скобы, пристыкованной к натянутой проволоке, расположен с зазором между его сторонами, кроме того, для крепления стеблей малины в горизонтальном положении устройство содержит установленную в основании стебля малины дугу из проволоки, которая с одной стороны согнута по радиусу, равному примерно 0,25 м, и имеет вогнутые в обе стороны поперечно дуге, равномерно распределенные по дуге выступы, контактирующие со стеблем, а с ... 2150193 Установка для бесфреонового охлаждения молока ... и других предприятиях для охлаждения молока, воды и любых жидких продуктов. Установка не требует использования дорогих парокомпрессионных установок и компрессорно-конденсаторных агрегатов, дорогого дефицитного и экологически вредного фреона. В работе используется дешевый хладагент - вода, не требуются также дорогие испарители поточного действия и специальные дорогие молочные вакуумные резервуары. В результате использования изобретения за счет применения вакуумной герметизированной емкости в сочетании с универсальным молочным насосом и обратным клапаном расширяется сфера применения устройств, снижаются капитальные и эксплуатационные затраты, повышается эффективность и экологическая ... 2462016 Устройство для протравливания семян ... средств на семена.Известно устройство для опрыскивания семян по авторскому свидетельству SU 1688795 А1, А01С 1/08, опубл. 07.11.91, бюл. 41. Агрегат состоит из трактора с навешенным на него опрыскивающим устройством, снабженным насосом, емкостями для воды и арматурой. Сбоку трактора расположена установка для увлажнения семян хлопчатника перед посевом, закрепленная на лонжеронах трактора, включающая рамку с установленным шнековым транспортером с узлом привода, бункера с дозирующим устройством семян для обработки и распылителем жидкости. Узел привода транспортера соединен с гидросистемой трактора, а распылитель жидкости - с водосистемой опрыскивателя посредством трубопроводов, ... |
Еще из этого раздела: 2426302 Всепогодная теплица 2400069 Способ защиты материалов от микробного разрушения 2492633 Устройство для автоматического полива 2298909 Устройство для сбора семян 2182420 Устройство для перерезания стволов деревьев 2154938 Способ охлаждения молока на животноводческих фермах и устройство для его осуществления 2015654 Теплица для подземной выработки 2269243 Капсулированный посадочный материал с регулируемыми свойствами и способ его получения 2119738 Орудие для уборки грубых кормов 2494588 Лемех плуга |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||
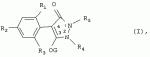
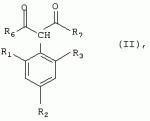
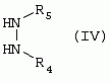
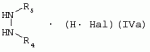 или
или 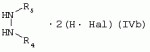
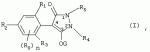
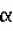 - либо
- либо 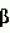 -нафтил, фенил-С1С6алкил,
-нафтил, фенил-С1С6алкил, 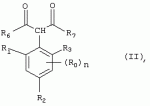

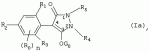
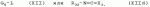

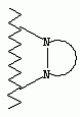 , представляет собой группу
, представляет собой группу
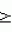 80°С, прежде всего
80°С, прежде всего 
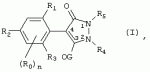
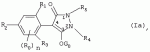
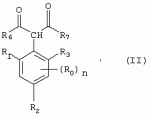
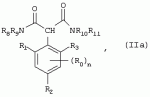
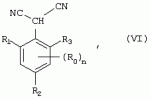
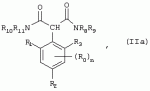
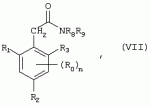
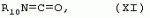
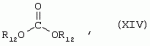
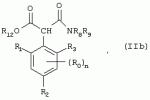

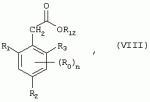
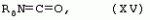
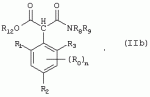

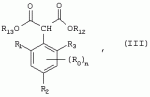
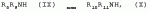
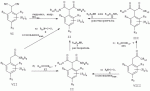
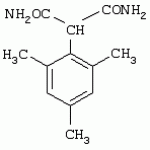
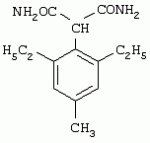
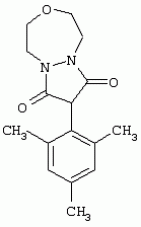
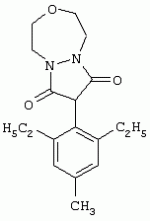

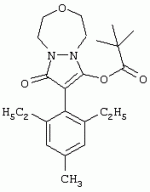
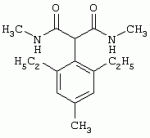
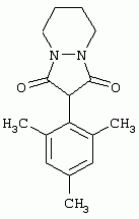
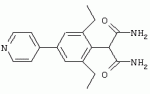
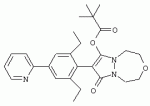
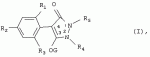
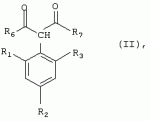
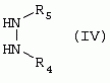
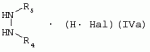 или
или