Способ подбора криопротекторов для криоконсервации биологических образцов (варианты)Патент на изобретение №: 2236466 Автор: Войнова Н.В. (RU), Чистяков В.А. (RU), Мирзоян А.В. (RU), Небесихина Н.А. (RU), Олейникова Н.Л. (RU) Патентообладатель: Государственное унитарное предприятие Азовский научно- исследовательский институт рыбного хозяйства (RU) Дата публикации: 20 Мая, 2004 Начало действия патента: 25 Ноября, 2002 Адрес для переписки: 344007, г.Ростов-на-Дону, ул. Береговая, 21/2, ГУП АзНИИРХ, зав. гр. ПС С.М. Маронову Изображения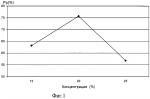 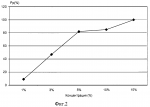   Изобретение относится к области криобиологии. Предложенный способ подбора криопротекторов предусматривает внесение исследуемых криопротекторов в среду для криоконсервации, содержащую биосенсор, замораживание 5 мин и оттаивание 30 мин. В качестве биосенсора используют рекомбинантный штамм В5356 Е.coli, хранящийся в ВКПМ, несущий плазмиду, содержащую Lux-оперон. В другом варианте, в среду для криоконсервации дополнительно добавляют модификатор - аскорбиновую кислоту, в концентрации 10 мкг/мл. Оценку протекторного эффекта определяют по изменению люминесценции опытных проб по сравнению с контрольными пробами. Предложенные способы позволяют существенно ускорить метод оценки потенциальных криопротекторов. Способы могут быть использованы в технологии криоконсервации биологических образцов. 2 н.п. ф-лы, 5 ил.
Изобретение относится к криобиологии и может быть использовано в технологии криоконсервации биологических образцов, например, спермы ценных видов промысловых рыб (осетровые, лососевые). Низкотемпературные криобанки спермы рыб являются одним из наиболее эффективных способов сохранения необходимого числа редких и исчезающих видов. Однако, поскольку глубокая заморозка - оттаивание это довольно сложные биотехнологические процессы, их эффективная работа зависит от множества технологических факторов, в том числе качества сред для криоконсервации. Известен способ определения качества криопротекторов (ДМСО, ДЭСО) методом проникающих катионов тетрафенилфосфония. В результате глубокого замораживания бактерий Е.соli мембранный потенциал резко уменьшается (с 198 до 85 мВ). Инкубация бактерий в среде, содержащей диметилсульфоксид и диэтилсульфоксид в качестве криопротекторов, приводит к уменьшению значений потенциала на 16 и 27 мВ соответственно. Таким образом, диэтилсульфоксид является более эффективным криопротектором по сравнению с диметилсульфоксидом /1/. ДМСО - это классический криопротектор, который широко применяется, в частности, при работе со спермой осетровых рыб /2/. Однако в высоких концентрациях это вещество становится токсичным. По этой причине, при увеличении концентрации ДМСО до 20-25% его защитное действие снижается. Для компенсации токсического действия и повышения его защитных свойств известно использование гликопротеина. В систему для заморозки, содержащую 1М и 3М растворы ДМСО, вносили раствор гликопротеина (концентрация 20 мг/мл), из трески (Gadus morhya), обитающей в Белом море. Количество эмбрионов, развившихся до стадии компактной морулы, составило 65% /3/. Наиболее близким по технической сущности и достигаемому эффекту к способу по п.1 формулы изобретения является использование биосенсора на основе светящихся рекомбинантных клеток E.coli, несущих ген люциферазы светляков, иммобилизированных в криогеле поливинилового спирта. Данный биосенсор использован для подбора криопротекоров, используемых для иммобилизации в криогеле лабильных макромолекул /4/. К способу по п.2, кроме вышеизложенного, наиболее близким является способ замораживания спермы баранов, сущность его в том, что в качестве криозащитных веществ в среду для заморозки добавляли синтетические жирорастворимые антиоксиданты (ИХФГАН - 1, ИХФГАН - 2, ИХФГАН - 3), синтезированные в институте химической физики РАН. Результаты осеменения спермой, замороженной с антиоксидантом, показали, что при однократном осеменении овец объягнилось на 9% больше, чем при осеменении спермой без антиоксиданта /5/. Целью настоящего изобретения является создание экспресс-метода для оценки качества потенциальных криопротекторов и повышение их криопротекторного эффекта с использованием в качестве тест-объекта светящихся бактерий. Эта цель достигается путем использования в качестве биосенсора рекомбинантного штамма В 5356 Е.Coli, несущего плазмиду, содержащую Lux-оперон, который помещают в среду для криоконсервации, содержащую анализируемый криопротектор, при плотности суспензии 106-107 кл/мл, экспозиции замораживания - 5 мин, экспозиции оттаивания – 30 мин, а силу протекторного эффекта определяют и по изменению люминесценции опытных проб по сравнению с контрольными. В другом варианте в качестве биосенсора используют рекомбинантный штамм В 5356 Е.Coli, несущий плазмиду, содержащую Lux-оперон, а в качестве модификатора в среду для криоконсервации, содержащую анализируемый криопротектор, добавляют аскорбиновую кислоту в концентрации 10 мкг/мл, при этом плотность суспензии составляет 106-107 кл/мл, экспозиция замораживания - 5 мин, экспозиция оттаивания - 30 мин, а силу протекторного эффекта определяют по изменению люминесценции опытных проб по сравнению с контрольными. Достижение положительного эффекта согласно цели настоящего изобретения обеспечивается тем, что в качестве тест-объекта используется рекомбинантный штамм Е.Coli HB 101/pGB lux 37, коллекционный номер В 5356, полученного из Всероссийской коллекции промышленных микроорганизмов - ВКПМ (г. Москва). Штамм несет плазмиду pGB lux 37, содержащую lux-оперон из Ph.leognati, под контролем конститутивного промотора. В другом варианте недостаточное защитное действие криопротектора компенсируется введением дополнительно в среду для криоконсервации модификатора, в качестве которого используют аскорбиновую кислоту в концентрации 10 мкг/мл. Основная клеточная мишень деструктивного действия замораживания-оттаивания - это клеточная мембрана. Один из наиболее информативных бактериальных тестов на повреждение мембран - биолюминесцентный тест. Общность структуры биомембран отмечается для всех живых систем, что ставит предложенный тест в разряд наиболее показательных при определении качества криопротекторов. Он основан на регистрации интенсивности люминесценции светящихся бактерий, которая зависит от работы дыхательной цепи, большинство ферментов которой связаны с мембраной. Поэтому повреждение мембран вызывает изменение интенсивности биолюминесценции светящихся бактерий. Добавление аскорбиновой кислоты в качестве модификатора в концентрации 10 мкг/мл полностью компенсирует токсическое действие высоких концентраций криопротекторов, например ДМСО, позволяет снизить их концентрации и при этом добиться достоверного повышения криопротекторного эффекта. Способ осуществляется следующим образом. Вариант I. В контрольные пробирки типа “Эппендорф” вносят по 1 мл буфера А (17% NaCl, 25% глюкоза, 1М трис - НСl, рН 7,5), в опытные пробирки - по 1 мл исследуемого криопротектора на основе буфера А. После этого во все пробирки добавляют по 50 мкл препарата штамма В 5356 Е.Соli и инкубируют в течение 10 мин. После инкубации часть контрольных и опытных пробирок подвергают замораживанию в жидком азоте (-196В°С) в течение 5 мин. Разморозку проб осуществляют на водяной бане (30В°С) в течение 30 мин. Измерения проводят на люминометре ЛТ-01. Результаты измерений вносят в протокол и по предложенной формуле рассчитывают силу протекторного эффекта Pp где T - процент падения свечения после замораживания в жидком азоте и последующего оттаивания. Процент падения свечения Т - величина безразмерная и определяется по формуле T=100%(Iо-I)/Iо, где Iо и I соответственно интенсивность биолюминесценции контрольной и исследуемой пробы через определенный интервал времени экспозиции исследуемого раствора с тест-объектом. Вариант II. В контрольные пробирки типа “Эппендорф” вносили по 1 мл буфера А (17% NaCl, 25% глюкоза, 1М трис - НСl, рН 7,5). Раствор аскорбиновой кислоты (10 мг/мл) готовили на основе предложенного буфера непосредственно перед использованием. В опытные пробирки вносили по 1 мл исследуемого криопротектора на основе буфера А с аскорбиновой кислотой. После этого во все пробирки добавляли по 50 мкл препарата штамма В 5356 Е.Соli и инкубировали в течение 10 мин. После инкубации часть контрольных и опытных пробирок подвергали замораживанию в жидком азоте (-196В°С) в течение 5 мин. Разморозку проб осуществляли на водяной бане (30В°С) в течение 30 мин. Измерения проводили на люминометре ЛТ-01. Результаты измерений вносили в протокол и по предложенной формуле рассчитывали силу протекторного эффекта Pp где T - процент падения свечения после замораживания в жидком азоте и последующего оттаивания. Процент падения свечения Т - величина безразмерная и определяется по формуле Т=100%(Iо-I)/Iо, где Iо и I соответственно интенсивность биолюминесценции контрольной и исследуемой пробы через определенный интервал времени экспозиции исследуемого раствора с тест-объектом. На фиг.1 - график изменения силы протекторного эффекта ДМСО различных концентраций при криоконсервации штамма В 5356 Е.Соli. На фиг.2 - график изменения силы протекторного эффекта глицерина различных концентраций при криоконсервации штамма В 5356 Е.Соli. На фиг.3 - график изменения силы протекторного эффекта трегалозы различных концентраций при криоконсервации штамма В 5356 Е.Coli. На фиг.4 - график зависимости силы протекторного эффекта ДМСО различных концентраций при внесении в среду для криоконсервации аскорбиновой кислоты. На фиг.5 - график зависимости силы протекторного эффекта глицерина различных концентраций при внесении в среду для криоконсервации аскорбиновой кислоты. Примеры осуществления способа по варианту I. Пример 1. 1. Подготовка к выполнению измерений. Подготовку люминометра и его калибровку проводили в соответствии с инструкцией по эксплуатации. 2. Выполнение анализа. 2.1 Приготовление буфера А (17% NaCl, 25% глюкоза, 1М трис - HCl, PH 7,5). 2.2 Приготовление раствора ДМСО - 15% на основе буфера А. 2.3 Полученный в 2.2 раствор добавляли по 1 мл в опытные пробирки, а в контрольные добавляли 1 мл буфера А. 2.4. Приготовление препарата штамма В 5356 Е.Coli. Для этого штамм В 5356 Е.Coli подращивали в течение 18 ч при 37В°С на чашке Петри с полной средой МПА с ампициллином в концентрации 50 мг/л. Затем клетки тестерного штамма смывали с чашки Петри буфером А. 2.5 50 мкл препарата штамма В 5356 Е.Coli добавляли в контрольные и в опытные пробирки. 2.6 Десятиминутная инкубация. 2.7 Пятиминутная заморозка в жидком азоте (-196В°С). 2.8 Размораживание на водяной бане (30В°С) в течение 30 мин. 2.9 Измерение биолюминесценции на люминометре ЛТ-01. 3 Обработка полученных данных. 3.1 Расчет процента падения свечения по формуле: Т=(0,847-0,557)/0,847 3.2 Расчет силы протекторного эффекта по формуле: Рр=(92,6-34,25)/92,6 Пример 2. Аналогично примеру 1 использовали 20% раствор ДМСО. Сила протекторного эффекта составила 74%. Пример 3. Аналогично примеру 1 использовали 25% раствор ДМСО. Сила протекторного эффекта составила 55,7%. Пример 4. Аналогично примеру 1 исследовали силу протекторного эффекта глицерина в концентрации 1%, которая составила 9%. Пример 5. Аналогично примеру 1 использовали 3% раствор глицерина. Сила протекторного эффекта составила 47%. Пример 6. Аналогично примеру 1 использовали 5% раствор глицерина. Сила протекторного эффекта составила 82,1%. Пример 7. Аналогично примеру 1 использовали 10% раствор глицерина. Сила протекторного эффекта составила 85%. Пример 8. Аналогично примеру 1 использовали 15% раствор глицерина. Сила протекторного эффекта составила 100%. Пример 9. Аналогично примеру 1 исследовали силу протекторного эффекта трегалозы в концентрации 0.25%, которая составила 11,8%. Пример 10. Аналогично примеру 1 использовали 0.5% раствор трегалозы. Сила протекторного эффекта составила 17,9%. Пример 11. Аналогично примеру 1 использовали 1% раствор трегалозы. Сила протекторного эффекта составила 66%. Пример 12. Аналогично примеру 1 использовали 2% раствор трегалозы. Сила протекторного эффекта составила 77%. Как видно из примеров 1-3 и графика на фиг.1, наибольший криопротекторный эффект ДМСО достигается при концентрации 15 и 20%, при дальнейшем повышении концентрации наблюдается резкое снижение протекторного действия и проявление токсичности, которая может быть обусловлена окисленными примесями, в том числе диметилсульфатом /6/. На фиг.2 сведены результаты опытов в примерах 4-8 криопротекторного эффекта глицерина. Полученные данные показывают, что криопротекторное действие глицерина практически линейно увеличивается с увеличением концентрации и достигает 100% при концентрации глицерина 15%, отметим, что 10-15% концентрации глицерина являются оптимальными для криоконсервации клеток самых разных водных объектов. На фиг.3 изображена сила протекторного эффекта трегалозы (примеры 9-12), чей протектррный эффект проявляется в значительно меньших, по сравнению с глицерином, концентрациях. Все исследованные криопротекторы известны, данные, полученные в результате испытаний, совпадают с литературными. Таким образом, вариант 1 способа позволяет как воспроизводить криопротекторное действие известных криопротекторов, так и оценивать силу протекторного эффекта новых, т.е. решать задачу широкого скрининга потенциальных криопротекторов среди веществ разных классов. Примеры осуществления способа по варианту II. Пример 13. 1. Подготовка к выполнению измерений. Подготовку люминометра и его калибровку проводили в соответствии с инструкцией по эксплуатации. 2. Выполнение анализа. 2.1 Приготовление буфера А (17% NaCl, 25% глюкоза, 1 М трис - НСl, РН 7,5). 2.2 Приготовление раствора аскорбиновой кислоты (10 мкг/мл) на основе буфера А. 2.3 Приготовление растворов ДМСО концентрацией 15% на основе раствора аскорбиновой кислоты. 2.4 Полученный в 2.3 раствор добавляли по 1 мл в опытные пробирки, а в контрольные добавляли 1 мл буфера А. 2.5 Приготовление препарата штамма В 5356 Е.Соli. Для этого штамм В 5356 Е.Соli растили в течение 18 ч при 37В°С на чашке Петри с полной средой МПА с ампициллином в концентрации 50 мг/л. Затем клетки тестерного штамма смывали с чашки Петри буфером А. 2.6 Добавление по 50 мкл препарата штамма В 5356 Е.Сoli в контрольные и в опытные пробирки. 2.7 Десятиминутная инкубация проб. 2.8 Пятиминутная заморозка в жидком азоте (-196В°С). 2.9 Размораживание на водяной бане (30В°С) в течение 30 мин. 2.10 Измерение биолюминесценции на люминометре ЛТ-01. 3. Обработка полученных данных. 3.1 Расчет среднеарифметического значения величины падения свечения. 3.2 Расчет процента падения свечения, Т=25,9%. 3.3 Расчет силы протекторного эффекта Рр проводили аналогично примеру 1, Рр=72%. Пример 14. Аналогично примеру 13 готовили раствор ДМСО концентрацией 20%. Сила протекторного эффекта составила 100%. Пример 15. Аналогично примеру 13 готовили раствор ДМСО концентрацией 25%. Сила протекторного эффекта составила 100%. Пример 16. Аналогично примеру 13 готовили раствор глицерина концентрацией 3%. Сила протекторного эффекта составила 73,22%. Пример 17. Аналогично примеру 13 готовили раствор глицерина концентрацией 5%. Сила протекторного эффекта составила 94,5%. Пример 18. Аналогично примеру 13 готовили раствор глицерина концентрацией 10%. Сила протекторного эффекта составила 95%. Как видно из примеров 13-15 и графика на фиг.4, внесение в среду для криоконсервации аскорбиновой кислоты снижает токсическое действие ДМСО и повышает силу протекторного эффекта. Из графика на фиг.5 и примеров 16-18 видно, что криопротекторный эффект глицерина значительно повышается при криоконсервации в присутствии аскорбиновой кислоты. Источники информации 1. Маркарян Ш.А., Баграмян К.А., Аракелян В.Б. Мембранный потенциал до и после глубокого замораживания Escherichia coli в присутствии диметилсульфоксида и диэтилсульфоксида // Биофизика, 2002, т.47, вып.2. С.315-317. 2. Odintsova N., Kiselev К., Sanina N., Kostetsky E. Cryopreservation of primary cell cultures of marine invertebratebrates. // Cryo Letters 2001 V.75. N.1 / P.299-310. 3. Каранова М.В., Цветкова Л.И., Петропавлов Н.Н. Криопротекторный эффект низкомолекулярных и высокомолекулярных антифризных гликопротеинов при замораживании спермы среднерусского карпа Cyprinus Widdle-Russia // Биофизика, 1997, т.42, вып.3. С.725-727. 4. Н.Н. Угарова, Л.Ю. Бровко. Биолюминесценция и биолюминесцентный анализ. Методические разработки, МГУ, химфак, 1981, 133 с. 5. Ерохин А.С., Епишина И.М., Чернова И.Е. Новый антиоксидант - криопротектор спермы баранов // Зоотехния, 1994. №10. С.28-29. 6. Hoffmarm G.R. Genetic effects of dimethyl sulfate, diethyl sulfate, and related compounds. // Mutat.Res. 1980 V.75. N.1. P.63-129. Формула изобретения1. Способ подбора криопротекторов для криоконсервации биологических образцов, включающий внесение в среду для криоконсервации, содержащую анализируемый криопротектор, биосенсора на основе культуры бактерий Е.Coli, заморозку-оттаивание опытных и контрольных проб и определение силы протекторного эффекта по изменению люминесценции опытных проб по сравнению с контрольными, отличающийся тем, что в качестве биосенсора используют рекомбинантный штамм В 5356 Е.Coli, несущий плазмиду, содержащую Lux-оперон, при плотности суспензии 106-107 кл/мл, экспозиции замораживания 5 мин, экспозиции оттаивания 30 мин. 2. Способ подбора криопротекторов для криоконсервации биологических образцов, включающий внесение в среду для криоконсервации, содержащую анализируемый криопротектор, биосенсора на основе культуры бактерий Е.Coli и модификатора криопротекторного эффекта, заморозку-оттаивание опытных и контрольных проб и определение силы протекторного эффекта по изменению люминесценции опытных проб по сравнению с контрольными, отличающийся тем, что в качестве биосенсора используют рекомбинантный штамм В 5356 Е.Coli, несущий плазмиду, содержащую Lux-оперон, а в качестве модификатора - аскорбиновую кислоту в концентрации 10 мкг/мл, при плотности суспензии 106-107 кл/мл, экспозиции замораживания 5 мин, экспозиции оттаивания 30 мин. MM4A - Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 26.11.2007 Извещение опубликовано: 27.06.2009 БИ: 18/2009 Популярные патенты: 2165134 Корнеподрезающий рабочий орган машины для добычи лакричного сырья ... органа, вид сбоку. На фиг. 5 - то же, вид сверху. На фиг. 6 - развертка левой боковины. На фиг. 7 - сечение А-А на фиг. 2, сопряжение горизонтальной части ножа с подъемником подрезанного слоя почвы. На фиг. 8 - вид Б на фиг. 1, взаимные положения наклонного подъемника, горизонтальной части ножа и фиксаторов подъемника. На фиг. 9 - сечение В-В на фиг. 2, поперечное сечение долота в месте стыка правой боковины и горизонтального ножа. На фиг. 10 - сечение Г-Г на фиг. 1, горизонтальный разрез левого долота в месте сопряжения левой боковины с горизонтальным ножом. Сведения, подтверждающие возможность осуществления заявленного технического решения, заключаются в следующем. ... 2060624 Валкообразующий транспортер жатки-накопителя ... за собой. На транспортере слой растений попадает под воздействие грузонесущих элементов 5, которые во время накопления растений имеют чередующееся встречноe движение, т. е. одна половина их (через один) движется в сторону схода растений с транспортера, а вторая в противоположном направлении. При этом силы трения, действующие на слой растений от противоположно движущихся грузонесущих элементов, уравновешиваются, т. к. по величине они равны (как произведения нормального давления на коэффициент трения), а по направлению противоположны: направление их совпадает с направлением движения каждого грузонесущего элемента. В результате для равномерно распределенного слоя растений создается ... 2111642 Высевающий аппарат ... 26, а следовательно, и количество проходящего через них высевного материала. Эта регулировка как раз и служит для изменения нормы высева семян. По положению пластины 35, неподвижно установленной на шпильке 33, судят о величине открытия высевных отверстий 26. Расстояние от пластины 35 до боковой стенки корпуса 24 высевающего устройства 4 показывает величину открытия высевных отверстий 26 (размер А на фиг. 3). С противоположной стороны к корпусу 24 высевающего устройства 4 приварена пластина 36 с отверстиями 37. Эти отверстия служат для присоединения к ним шатуна механизма привода 5, который другим концом присоединяется к одному из эксцентриков 20. Снизу к днищу 25 высевающего ... 2261583 Выгрузное устройство бункера зерноуборочного комбайна ... шнеков 2 и 20 остаются без изменения) и снижении объема зерна над заслонкой 3 включается гидропривод механизма регулировки заслонок и заслонка 3 приоткрывается до установки указателя 7 напротив метки III до начала открытия следующей заслонки 4. После значительного снижения объема зерна над заслонкой 3 вновь включается гидропривод механизма регулировки заслонок и масло под давлением поступает в плунжерную полость гидроцилиндра 5. Шток гидроцилиндра 5 воздействует одновременно через вал 6 и систему рычагов 9 на заслонку 3, а через тягу 10 и сектор 12 перемещает полый вал 11, который через систему рычагов 13 перемещает заслонку 4. Заслонки 3 и 4 открываются, причем открытие заслонки 4 ... 2438300 Молочная холодильная установка ... между охлаждаемым молоком и вскипающим хладоном. По мере охлаждения терморегулирующий вентиль (ТРВ) 17 прикрывается, уменьшая поток жидкого хладона. Если в резервуаре 1 имеется частичное заполнение молоком, например на четверть, так что контактируют с молоком только 10 нижних щелей испарителя, то ТРВ 17 автоматически прикроет свое дросселирующее отверстие, так, что щелевой испаритель 5 будет заполнен жидким хладоном лишь наполовину (щели инжектора 6), а щели коллектора 7 будут наполнены насыщенными парами хладона. Пар собирается в верхней части полости разворота 12 и всасывающего коллектора 7. Жидкий хладон во всасывающий трубопровод компрессора 13 не поступает и ККА 10 ... |
Еще из этого раздела: 2444885 Посевной агрегат 2236124 Способ создания местообитания и адаптации молоди объектов аквакультуры в водных экосистемах 2471341 Стойло, устройство в стойле и способ монтажа указанного устройства 2282959 Устройство для крепления навесного оборудования к транспортному средству 2197082 Установка для охлаждения молока с использованием естественного холода 2043709 Система управления работой форсунки разбрызгивателя 2051971 Способ определения биологической активности -эндотоксинов различных патотипов bacileus thuringiensis 2426302 Всепогодная теплица 2267261 Молочно-доильный комплекс 2201069 Травяное покрытие на основе гибкого полотна |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||


 100=34,25%.
100=34,25%.