Способ криоконсервирования гемопоэтических клеток человекаПатент на изобретение №: 2233589 Автор: Лобынцева Галина Степановна (UA) Патентообладатель: Лобынцева Галина Степановна (UA) Дата публикации: 10 Января, 2004 Начало действия патента: 23 Мая, 2002 Адрес для переписки: 04107, г. Киев, ул. Печенежская, 6, кв.12, Г.С. Лобынцевой Изобретение относится к медицине, а именно к способам консервирования гемопоэтических клеток человека. Сущность способа: в суспензию клеток добавляют криопротектор диметилсульфоксид до получения конечной концентрации 0,4-1,45 моль/л и осуществляют трехэтапное замораживание суспензии с последующим оттаиванием, при этом на первом этапе замораживание осуществляют со скоростью в пределах 0,7-1,2  С/мин до температуры минус 8,5 - минус 10,5 С/мин до температуры минус 8,5 - минус 10,5 С с применением сидинга при температуре минус 3,5 - минус 4 С с применением сидинга при температуре минус 3,5 - минус 4 С, на втором этапе - со скоростью 1,0-4,5 С, на втором этапе - со скоростью 1,0-4,5 С/мин до минус 30 - минус 40 С/мин до минус 30 - минус 40 С, при этом после второго этапа осуществляют температурную остановку при минус 30 - минус 40 С, при этом после второго этапа осуществляют температурную остановку при минус 30 - минус 40 С в течение 3-5 мин, а на третьем этапе - со скоростью 10-12 С в течение 3-5 мин, а на третьем этапе - со скоростью 10-12 С/мин до минус 130 - минус 196 С/мин до минус 130 - минус 196 С. Способ позволяет продлить период хранения и увеличить количество жизнеспособных клеток. 2 табл.
Изобретение относится к биологии и медицине и может быть использовано для криоконсервирования гемопоэтических клеток человека.Известен способ криоконсервирования тромбоцитов (смотри заявку России 99126524/14, МПК A 01 N 1/02, опубл. заявки 27.08.2001) который предусматривает криоконсервирование в гофрированных алюминиевых контейнерах с удалением излишка плазмы центрифугированием и с последующим ресуспендированием суспензии и добавлением криопротектора, в котором подготовку к консервированию осуществляют в полимерном контейнере, который помещают в дюралевый пенал-холдер, а замораживание проводят при температуре -80В°С, хранение осуществляют в этой же таре.Недостатком данного способа является то, что обозначенный режим замораживания травматичный для гемопоэтических клеток человека, потому что быстрое снижение температуры вызывает рост больших кристаллов, которые нарушают оболочки клеток. Это приводит к снижению периода хранения и уменьшению количества жизнеспособных клеток после периода хранения.Известен способ криоконсервирования и подготовки к трансфузии гемопоэтических клеток кордовой крови (см. патент Украины 42599, МПК А 01 N 1/00, А 01 N 1/02, А 61 К 35/14), который включает разведение цельной крови стабилизатором крови в соотношении 4:1, удаление эритроцитов, удаление надстоя клеточной взвеси, добавление равного объема криоконсерванта на основе поливинилпиролидона с дальнейшим программным замораживанием и размораживанием смеси, при котором удаление эритроцитов проводят после разбавления цельной кордовой крови стабилизующим раствором, обработкой разведенной кордовой крови раствором гидроксиметил-крахмала для осаждения эритроцитов, после чего осадок отделяют, свободный от эритроцитов надстой клеточной взвеси концентрируют, а криоконсервант добавляют к концентрату клеточной взвеси.Недостатком данного способа является его многоэтапность, которая усложняет способ и ухудшает условия стерильности. Неопределенный режим замораживания гемопоэтических клеток человека не позволяет получить приемлемые результаты, потому что жизнеспособность клеток обеспечивается лишь в узком интервале скорости снижения температуры. Это приводит к снижению периода хранения и уменьшению количества жизнеспособных клеток после периода хранения.Известен способ криоконсервирования костного мозга (см. патент России 2144290, МПК A 01 N 1/02, опубл. 20.01.2000), который осуществляют путем поэтапного замораживания в присутствии криозащитного раствора, при котором суспензию клеток, залитую в мягкий однократного использования контейнер, заполненный на 10-30%, размещенный в металлическом пенале, который обеспечивает толщину слоя суспензии 6-8 мм, на первом этапе помещают в жидкий хладагент с температурой минус 26-30 С. Способ позволяет продлить период хранения и увеличить количество жизнеспособных клеток. 2 табл.
Изобретение относится к биологии и медицине и может быть использовано для криоконсервирования гемопоэтических клеток человека.Известен способ криоконсервирования тромбоцитов (смотри заявку России 99126524/14, МПК A 01 N 1/02, опубл. заявки 27.08.2001) который предусматривает криоконсервирование в гофрированных алюминиевых контейнерах с удалением излишка плазмы центрифугированием и с последующим ресуспендированием суспензии и добавлением криопротектора, в котором подготовку к консервированию осуществляют в полимерном контейнере, который помещают в дюралевый пенал-холдер, а замораживание проводят при температуре -80В°С, хранение осуществляют в этой же таре.Недостатком данного способа является то, что обозначенный режим замораживания травматичный для гемопоэтических клеток человека, потому что быстрое снижение температуры вызывает рост больших кристаллов, которые нарушают оболочки клеток. Это приводит к снижению периода хранения и уменьшению количества жизнеспособных клеток после периода хранения.Известен способ криоконсервирования и подготовки к трансфузии гемопоэтических клеток кордовой крови (см. патент Украины 42599, МПК А 01 N 1/00, А 01 N 1/02, А 61 К 35/14), который включает разведение цельной крови стабилизатором крови в соотношении 4:1, удаление эритроцитов, удаление надстоя клеточной взвеси, добавление равного объема криоконсерванта на основе поливинилпиролидона с дальнейшим программным замораживанием и размораживанием смеси, при котором удаление эритроцитов проводят после разбавления цельной кордовой крови стабилизующим раствором, обработкой разведенной кордовой крови раствором гидроксиметил-крахмала для осаждения эритроцитов, после чего осадок отделяют, свободный от эритроцитов надстой клеточной взвеси концентрируют, а криоконсервант добавляют к концентрату клеточной взвеси.Недостатком данного способа является его многоэтапность, которая усложняет способ и ухудшает условия стерильности. Неопределенный режим замораживания гемопоэтических клеток человека не позволяет получить приемлемые результаты, потому что жизнеспособность клеток обеспечивается лишь в узком интервале скорости снижения температуры. Это приводит к снижению периода хранения и уменьшению количества жизнеспособных клеток после периода хранения.Известен способ криоконсервирования костного мозга (см. патент России 2144290, МПК A 01 N 1/02, опубл. 20.01.2000), который осуществляют путем поэтапного замораживания в присутствии криозащитного раствора, при котором суспензию клеток, залитую в мягкий однократного использования контейнер, заполненный на 10-30%, размещенный в металлическом пенале, который обеспечивает толщину слоя суспензии 6-8 мм, на первом этапе помещают в жидкий хладагент с температурой минус 26-30 С и выдерживают 15-25 мин, на втором этапе помещают в хранилище-холодильник с температурой минус 40-50 С и выдерживают 15-25 мин, на втором этапе помещают в хранилище-холодильник с температурой минус 40-50 С.Недостатком указанного способа является то, что указанный режим замораживания травматичен для гемопоэтических клеток человека, так как температура хранения по способу -40 - -50 С.Недостатком указанного способа является то, что указанный режим замораживания травматичен для гемопоэтических клеток человека, так как температура хранения по способу -40 - -50 С недостаточна для длительного хранения гемопоэтических клеток человека. Все это приводит к уменьшению периода хранения и снижению количества жизнеспособных клеток после периода сохранения.Наиболее близким к заявленному по признакам является способ сохранения при криогенной температуре ткани (преимущественно кожи) млекопитающих (см. патент США 5891617, МПК A 01 N 001/02, дата публикации 06.04.99 г.), который предусматривает погружение указанной ткани в раствор криоконсерванта, что представляет собой 1,5-2,5 М глицерин в среде Dulbecco’s Modified Eagle’s Mediuм (DMEM), перемешивание указанного раствора криоконсерванта и обозначенной погруженной ткани, внесение зародышей льда в внеклеточное пространство криоконсерванта и перфузированной ткани, охлаждение обозначенной ткани со скоростью примерно -10 С недостаточна для длительного хранения гемопоэтических клеток человека. Все это приводит к уменьшению периода хранения и снижению количества жизнеспособных клеток после периода сохранения.Наиболее близким к заявленному по признакам является способ сохранения при криогенной температуре ткани (преимущественно кожи) млекопитающих (см. патент США 5891617, МПК A 01 N 001/02, дата публикации 06.04.99 г.), который предусматривает погружение указанной ткани в раствор криоконсерванта, что представляет собой 1,5-2,5 М глицерин в среде Dulbecco’s Modified Eagle’s Mediuм (DMEM), перемешивание указанного раствора криоконсерванта и обозначенной погруженной ткани, внесение зародышей льда в внеклеточное пространство криоконсерванта и перфузированной ткани, охлаждение обозначенной ткани со скоростью примерно -10 С/мин до температуры примерно -6 С/мин до температуры примерно -6 С, или проводят замораживание со скоростью -1В°С/мин до температуры примерно -8 С, или проводят замораживание со скоростью -1В°С/мин до температуры примерно -8 С, продолжают охлаждение при скорости в пределах от -0,3-0,02 С, продолжают охлаждение при скорости в пределах от -0,3-0,02 С до температуры примерно -70 С до температуры примерно -70 С.Недостатком указанного способа является то, что инициация кристаллообразования осуществляется путем внесения зародышей льда во внеклеточное пространство, что усложняет способ и ухудшает условия стерильности среды.Применение среды Dulbecco’s Modified Eagle’s Mediuм в большинстве стран не разрешено для внутривенного использования и поэтому клетки, полученные таким способом, нельзя использовать в большинстве случаев лечения.Указанные режимы замораживания травматичны для гемопоэтических клеток человека, потому что быстрое снижение температуры на первом этапе вызывает рост больших кристаллов, которые разрушают мембраны клеток.Низкая скорость замораживания на завершающей стадии охлаждения существенно затягивает процесс выполнения способа. Температура по способу около -70 С.Недостатком указанного способа является то, что инициация кристаллообразования осуществляется путем внесения зародышей льда во внеклеточное пространство, что усложняет способ и ухудшает условия стерильности среды.Применение среды Dulbecco’s Modified Eagle’s Mediuм в большинстве стран не разрешено для внутривенного использования и поэтому клетки, полученные таким способом, нельзя использовать в большинстве случаев лечения.Указанные режимы замораживания травматичны для гемопоэтических клеток человека, потому что быстрое снижение температуры на первом этапе вызывает рост больших кристаллов, которые разрушают мембраны клеток.Низкая скорость замораживания на завершающей стадии охлаждения существенно затягивает процесс выполнения способа. Температура по способу около -70 С недостаточна для длительного хранения гемопоэтических клеток человека.Благодаря тому, что способ предусматривает использование большого количества криопротектора, полученные таким способом клетки перед использованием надлежит отмывать от криопротектора, что усложняет способ и обеспечивает негативное влияние дополнительных действий на клетки.Указанные недостатки приводят к уменьшению периода хранения и уменьшению количества жизнеспособных клеток после периода сохранения.Задачей изобретения является создание способа криоконсервирования гемопоэтических клеток человека, в котором путем изменения режимов способа криоконсервирования, найденных эмпирическим путем, обеспечивается упрощение способа, улучшение условий стерильности, увеличение периода сохранности и повышения количества жизнеспособных клеток после периода хранения.Для этого способ криоконсервирования гемопоэтических клеток предусматривает добавление к суспензии клеток криопротектора, многоэтапное замораживание с последующим оттаиванием.Новым в способе является то, что применяют криопротектор концентрации 0,4-1,45 мол/л, замораживание осуществляют в три этапа, при этом на первом этапе со скоростью 0,7-1,2 С недостаточна для длительного хранения гемопоэтических клеток человека.Благодаря тому, что способ предусматривает использование большого количества криопротектора, полученные таким способом клетки перед использованием надлежит отмывать от криопротектора, что усложняет способ и обеспечивает негативное влияние дополнительных действий на клетки.Указанные недостатки приводят к уменьшению периода хранения и уменьшению количества жизнеспособных клеток после периода сохранения.Задачей изобретения является создание способа криоконсервирования гемопоэтических клеток человека, в котором путем изменения режимов способа криоконсервирования, найденных эмпирическим путем, обеспечивается упрощение способа, улучшение условий стерильности, увеличение периода сохранности и повышения количества жизнеспособных клеток после периода хранения.Для этого способ криоконсервирования гемопоэтических клеток предусматривает добавление к суспензии клеток криопротектора, многоэтапное замораживание с последующим оттаиванием.Новым в способе является то, что применяют криопротектор концентрации 0,4-1,45 мол/л, замораживание осуществляют в три этапа, при этом на первом этапе со скоростью 0,7-1,2 С/мин до -8,5 - -10,5 С/мин до -8,5 - -10,5 С с применением сидинга при температуре -3,5 - -4 С с применением сидинга при температуре -3,5 - -4 С, на втором этапе со скоростью 1,0-4,5 С, на втором этапе со скоростью 1,0-4,5 С/мин до -30 - -40 С/мин до -30 - -40 С, после второго этапа осуществляют температурную остановку при -30 - -40В°С на протяжении 3-5 мин, а на третьем этапе со скоростью 10-12В°С/мин до -130 - -196 С, после второго этапа осуществляют температурную остановку при -30 - -40В°С на протяжении 3-5 мин, а на третьем этапе со скоростью 10-12В°С/мин до -130 - -196 С.Вследствие применения новой совокупности признаков способа инициация кристаллообразования осуществляется без дополнительного контакта с клеточной суспензией, что упрощает способ и улучшает условия стерильности среды. Примененные в способе среды разрешены для внутривенного использования.Указанные режимы замораживания не травматичны для гемопоэтических клеток человека, потому что эмпирически подобранный режим снижения температуры не вызывает рост больших кристаллов, которые могут нарушить целостность клеточной мембраны.Указанные преимущества приводят к удлинению периода хранения и увеличению количества жизнеспособных клеток после периода замораживания.Для сравнения прототипа и предложенного способа осуществляли способ по прототипу и предложенный на указанных ниже примерах 1-64. В примерах осуществляли такие действия.Независимо от источника получения (костный мозг, кордовая кровь, эмбриональная печень, периферическая кровь) приготовление клеточной суспензии по прототипу и предложенным способом осуществляли одинаково.В таблице 1 указаны режимы выполнения примеров 1-8 по прототипу. При подготовке клеток к низкотемпературному консервированию по прототипу в полученную взвесь клеток, которые предназначены для криоконсервирования, через инъекционную иглу по капле добавляли такой же объем криоконсерванта, который представлял собой 1,5-2,5 мол/л глицерина в среде Dulbecco’s Modified Eagle’s Mediuм при легком перемешивании взвеси путем покачивания пробирки.С помощью шприца через инъекционную иглу гемопоэтические клетки разливали по 1 мл в полиэтиленовые криоампулы объемом 1,8 мл фирмы Nunc (CryoStore Boxes).Криоампулы герметично закрывали крышками и маркировали. Замораживание осуществляли при различных режимах, указанных в таблице 1. Замораживание гемопоэтических клеток за прототипом выполняли с помощью программного замораживателя, который позволяет варьировать скорость снижения температуры на различных этапах. Для инициализации кристаллообразования дополнительно вносили в криоампулы зародыши льда во внеклеточное пространство.Хранили криоконсервированные гемопоэтические клетки в низкотемпературном хранилище при -70 С.Вследствие применения новой совокупности признаков способа инициация кристаллообразования осуществляется без дополнительного контакта с клеточной суспензией, что упрощает способ и улучшает условия стерильности среды. Примененные в способе среды разрешены для внутривенного использования.Указанные режимы замораживания не травматичны для гемопоэтических клеток человека, потому что эмпирически подобранный режим снижения температуры не вызывает рост больших кристаллов, которые могут нарушить целостность клеточной мембраны.Указанные преимущества приводят к удлинению периода хранения и увеличению количества жизнеспособных клеток после периода замораживания.Для сравнения прототипа и предложенного способа осуществляли способ по прототипу и предложенный на указанных ниже примерах 1-64. В примерах осуществляли такие действия.Независимо от источника получения (костный мозг, кордовая кровь, эмбриональная печень, периферическая кровь) приготовление клеточной суспензии по прототипу и предложенным способом осуществляли одинаково.В таблице 1 указаны режимы выполнения примеров 1-8 по прототипу. При подготовке клеток к низкотемпературному консервированию по прототипу в полученную взвесь клеток, которые предназначены для криоконсервирования, через инъекционную иглу по капле добавляли такой же объем криоконсерванта, который представлял собой 1,5-2,5 мол/л глицерина в среде Dulbecco’s Modified Eagle’s Mediuм при легком перемешивании взвеси путем покачивания пробирки.С помощью шприца через инъекционную иглу гемопоэтические клетки разливали по 1 мл в полиэтиленовые криоампулы объемом 1,8 мл фирмы Nunc (CryoStore Boxes).Криоампулы герметично закрывали крышками и маркировали. Замораживание осуществляли при различных режимах, указанных в таблице 1. Замораживание гемопоэтических клеток за прототипом выполняли с помощью программного замораживателя, который позволяет варьировать скорость снижения температуры на различных этапах. Для инициализации кристаллообразования дополнительно вносили в криоампулы зародыши льда во внеклеточное пространство.Хранили криоконсервированные гемопоэтические клетки в низкотемпературном хранилище при -70 С на протяжении двух месяцев.Процедуру отмывания клеток от криопротектора осуществляли путем добавления раствора, который содержит вдвое меньшую концентрацию криопротектора, раствор центрифугировали при скорости 2000 об/мин на протяжении 10 минут. Потом надосадок снимали, еще раз добавляли вдвое меньшую концентрацию криопротектора, повторяли процесс центрифугирования. Надосадок снимали, к осадку прибавляли раствор физиологичного раствора до достижения начального объема суспензии.В таблице 2 указаны режимы выполнения примеров 9-64 в соответствии с предложенным способом.В примерах 9-22, таблица 2а, использовали гемопоэтические клетки эмбриональной печени; в примерах 23-36, таблица 2б, - гемопоэтические клетки кордовой крови; в примерах 37-50, таблица 2с, - гемопоэтические клетки периферической крови; в примерах 51-64, таблица 2д, - гемопоэтические клетки костного мозга.Подготовка клеток к низкотемпературному консервированию по предложенному способу.Криопротектор диметилсульфоксид (далее ДМСО) 7,0 мол/л концентрации разводили до 0,8 и 2,9 мол/л концентрации, а потом добавляли к клеткам в соотношении 1:1 до получения 0,4-1,45 мол/л конечных концентраций. В полученную взвесь клеток, которые предназначены для криоконсервирования, через инъекционную иглу по капле добавляли такой же объем 0,4-1,45 моль/л ДМСО при легком перемешивании взвеси путем покачивания пробирки.С помощью шприца через инъекционную иглу гемопоэтические клетки разливали по 1 мл в полиэтиленовые криоампулы объемом 1-1,8 мл фирмы Nunc (CryoStore Boxes). Криоампулы герметично закрывали крышками и маркировали.Замораживание гемопоэтических клеток выполняли с помощью программного замораживателя, который позволяет варьировать скорость снижения температуры на различных этапах криоконсервирования и автоматически осуществлять инициирование процесса кристаллизации (сидинг) при определенной температуре путем разового пропускания жидкого азота через соответствующую трубку.При замораживании клеточной суспензии в ампулах использовали специальные укладки, в которые вставляли контейнеры вертикально и укладку размещали в теплообменную камеру замораживателя на соответствующем устройстве, которое выполняет инициацию кристаллообразования.Замораживание клеток выполняли по трехэтапной программе. На первом этапе от комнатной температуры 20В±4 С на протяжении двух месяцев.Процедуру отмывания клеток от криопротектора осуществляли путем добавления раствора, который содержит вдвое меньшую концентрацию криопротектора, раствор центрифугировали при скорости 2000 об/мин на протяжении 10 минут. Потом надосадок снимали, еще раз добавляли вдвое меньшую концентрацию криопротектора, повторяли процесс центрифугирования. Надосадок снимали, к осадку прибавляли раствор физиологичного раствора до достижения начального объема суспензии.В таблице 2 указаны режимы выполнения примеров 9-64 в соответствии с предложенным способом.В примерах 9-22, таблица 2а, использовали гемопоэтические клетки эмбриональной печени; в примерах 23-36, таблица 2б, - гемопоэтические клетки кордовой крови; в примерах 37-50, таблица 2с, - гемопоэтические клетки периферической крови; в примерах 51-64, таблица 2д, - гемопоэтические клетки костного мозга.Подготовка клеток к низкотемпературному консервированию по предложенному способу.Криопротектор диметилсульфоксид (далее ДМСО) 7,0 мол/л концентрации разводили до 0,8 и 2,9 мол/л концентрации, а потом добавляли к клеткам в соотношении 1:1 до получения 0,4-1,45 мол/л конечных концентраций. В полученную взвесь клеток, которые предназначены для криоконсервирования, через инъекционную иглу по капле добавляли такой же объем 0,4-1,45 моль/л ДМСО при легком перемешивании взвеси путем покачивания пробирки.С помощью шприца через инъекционную иглу гемопоэтические клетки разливали по 1 мл в полиэтиленовые криоампулы объемом 1-1,8 мл фирмы Nunc (CryoStore Boxes). Криоампулы герметично закрывали крышками и маркировали.Замораживание гемопоэтических клеток выполняли с помощью программного замораживателя, который позволяет варьировать скорость снижения температуры на различных этапах криоконсервирования и автоматически осуществлять инициирование процесса кристаллизации (сидинг) при определенной температуре путем разового пропускания жидкого азота через соответствующую трубку.При замораживании клеточной суспензии в ампулах использовали специальные укладки, в которые вставляли контейнеры вертикально и укладку размещали в теплообменную камеру замораживателя на соответствующем устройстве, которое выполняет инициацию кристаллообразования.Замораживание клеток выполняли по трехэтапной программе. На первом этапе от комнатной температуры 20В±4 С со скоростью 0,7-1,2 С со скоростью 0,7-1,2 С в минуту до минус 8,5-10,5 С в минуту до минус 8,5-10,5 С. На протяжении первого этапа замораживания при достижении температуры -3,5-4 С. На протяжении первого этапа замораживания при достижении температуры -3,5-4 С осуществляли захолаживание (сидинг) одной стороны контейнера с клеточной суспензией путем разового пропуска через трубку жидкого азота, благодаря чему при соответствующей температуре автоматически происходила инициация кристаллообразования.На втором со скоростью 1,0-4,5 С осуществляли захолаживание (сидинг) одной стороны контейнера с клеточной суспензией путем разового пропуска через трубку жидкого азота, благодаря чему при соответствующей температуре автоматически происходила инициация кристаллообразования.На втором со скоростью 1,0-4,5 С в 1 минуту до минус 30-40 С в 1 минуту до минус 30-40 С и на третьем - со скоростью 10-12 С и на третьем - со скоростью 10-12 С в 1 минуту до минус 130-196 С в 1 минуту до минус 130-196 С. Конкретные режимы указаны в таблице 2. Концентрация криопротектора составляла 0,4-1,4 моль/л. После завершения замораживания контейнеры с помощью щипцов вынимали из укладки и переносили в среду жидкого азота в специальное хранилище биологических продуктов (марки СБ 0,5), оборудованное ячейками со сменными кассетами.Хранили криоконсервированные гемопоэтические клетки в низкотемпературном хранилище при минус 130-196В°С на протяжении трех месяцев.Эффективность режимов, указанных в примерах, оценивали путем проверки жизнеспособности клеток, которые оценивали методом последующего культивирования в агаровой среде клеток, замороженных по режимам, указанным в примерах 1-8, после двухмесячного хранения, а в примерах 9-64 - после трехмесячного хранения при конечной температуре охлаждения, обозначенной в примерах. Эффективность метода также оценивали проведением бактериологического контроля криоконсервированных гемопоэтических клеток.Бактериологический контроль криоконсервированных гемопоэтических клеток на отсутствие грампозитивной и грамнегативной флоры осуществляли согласно "Инструкции по контролю стерильности консервированной крови, ее компонентов, препаратов, консервированного костного мозга, кровезаменителей, консервирующих растворов и условий их заготовки", утвержденной МОЗ Украины в 1996 г.С этой целью сателлит изымали из низкотемпературного банка и размораживали в водяной бане (плюс 40В±0,5 С. Конкретные режимы указаны в таблице 2. Концентрация криопротектора составляла 0,4-1,4 моль/л. После завершения замораживания контейнеры с помощью щипцов вынимали из укладки и переносили в среду жидкого азота в специальное хранилище биологических продуктов (марки СБ 0,5), оборудованное ячейками со сменными кассетами.Хранили криоконсервированные гемопоэтические клетки в низкотемпературном хранилище при минус 130-196В°С на протяжении трех месяцев.Эффективность режимов, указанных в примерах, оценивали путем проверки жизнеспособности клеток, которые оценивали методом последующего культивирования в агаровой среде клеток, замороженных по режимам, указанным в примерах 1-8, после двухмесячного хранения, а в примерах 9-64 - после трехмесячного хранения при конечной температуре охлаждения, обозначенной в примерах. Эффективность метода также оценивали проведением бактериологического контроля криоконсервированных гемопоэтических клеток.Бактериологический контроль криоконсервированных гемопоэтических клеток на отсутствие грампозитивной и грамнегативной флоры осуществляли согласно "Инструкции по контролю стерильности консервированной крови, ее компонентов, препаратов, консервированного костного мозга, кровезаменителей, консервирующих растворов и условий их заготовки", утвержденной МОЗ Украины в 1996 г.С этой целью сателлит изымали из низкотемпературного банка и размораживали в водяной бане (плюс 40В±0,5 С) и осуществляли скрининг.Качественные характеристики продуктов, полученных по известному способу, указаны в таблице 1 в конкретных примерах. Как видно из результатов, большинство образцов имеет контаминацию различными видами микрофлоры, что свидетельствует о нарушении стерильности при внесении кристаллов льда.В примерах 9-64 в таблице 2а, 2б, 2с, 2д указано количество колоний и кластеров (на 105 посаженных в культуру клеток) на 8-10 сутки. Примеры 9-64 характеризуются отсутствием грампозитивной и грамнегативной флоры в полученном продукте.Как видно из полученных результатов, предложенный способ имеет лучшие результаты сохранности клеток.Инициация кристаллообразования в этом способе осуществляется автоматически без дополнительного контакта с клеточной суспензией, что упрощает способ и улучшает условия стерильности среды.Примененные в способе среды разрешены для внутривенного использования и потому клетки, полученные таким способом, можно использовать в большинстве случаев лечения.Указанные режимы замораживания не травматичны для гемопоэтических клеток человека, потому что эмпирически подобранный режим снижения температуры не вызывает рост больших кристаллов, которые могут разрушить клеточную мембрану.Благодаря тому, что способ предусматривает использование уменьшенной концентрации криопротектора, полученные описанным способом клетки можно использовать сразу после размораживания без отмывания от криопротектора, что упрощает способ и уменьшает негативное влияние дополнительных воздействий на клетки.Указанные преимущества, как показывают примеры, обеспечивают увеличение периода хранения и увеличение количества жизнеспособных клеток после периода замораживания. С) и осуществляли скрининг.Качественные характеристики продуктов, полученных по известному способу, указаны в таблице 1 в конкретных примерах. Как видно из результатов, большинство образцов имеет контаминацию различными видами микрофлоры, что свидетельствует о нарушении стерильности при внесении кристаллов льда.В примерах 9-64 в таблице 2а, 2б, 2с, 2д указано количество колоний и кластеров (на 105 посаженных в культуру клеток) на 8-10 сутки. Примеры 9-64 характеризуются отсутствием грампозитивной и грамнегативной флоры в полученном продукте.Как видно из полученных результатов, предложенный способ имеет лучшие результаты сохранности клеток.Инициация кристаллообразования в этом способе осуществляется автоматически без дополнительного контакта с клеточной суспензией, что упрощает способ и улучшает условия стерильности среды.Примененные в способе среды разрешены для внутривенного использования и потому клетки, полученные таким способом, можно использовать в большинстве случаев лечения.Указанные режимы замораживания не травматичны для гемопоэтических клеток человека, потому что эмпирически подобранный режим снижения температуры не вызывает рост больших кристаллов, которые могут разрушить клеточную мембрану.Благодаря тому, что способ предусматривает использование уменьшенной концентрации криопротектора, полученные описанным способом клетки можно использовать сразу после размораживания без отмывания от криопротектора, что упрощает способ и уменьшает негативное влияние дополнительных воздействий на клетки.Указанные преимущества, как показывают примеры, обеспечивают увеличение периода хранения и увеличение количества жизнеспособных клеток после периода замораживания. 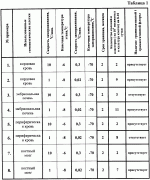 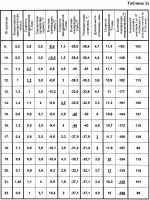 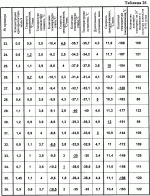 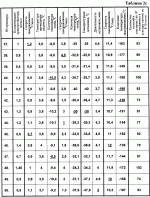 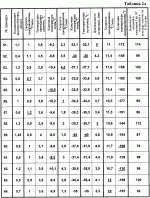
Формула изобретенияСпособ криоконсервирования гемопоэтических клеток человека, который включает добавление в суспензию клеток криопротектора диметилсульфоксида, трехэтапное замораживание суспензии с последующим оттаиванием, при этом на первом этапе замораживание осуществляют со скоростью в пределах 0,7-1,2 С/мин, отличающийся тем, что применяют концентрации криопротектора 0,4-1,45 моль/л, на первом этапе замораживание осуществляют до минус 8,5-минус 10,5 С/мин, отличающийся тем, что применяют концентрации криопротектора 0,4-1,45 моль/л, на первом этапе замораживание осуществляют до минус 8,5-минус 10,5 С с применением сидинга при температуре минус 3,5-минус 4 С с применением сидинга при температуре минус 3,5-минус 4 С, на втором этапе - со скоростью 1,0-4,5 С, на втором этапе - со скоростью 1,0-4,5 С/мин до минус 30-минус 40 С/мин до минус 30-минус 40 С, при этом после второго этапа осуществляют температурную остановку при минус 30-минус 40 С, при этом после второго этапа осуществляют температурную остановку при минус 30-минус 40 С в течение 3-5 мин, а на третьем этапе - со скоростью 10-12 С в течение 3-5 мин, а на третьем этапе - со скоростью 10-12 С/мин до минус 130-минус 196 С/мин до минус 130-минус 196 С. С.
MM4A Досрочное прекращение действия патента из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 24.05.2012 Дата публикации: 20.03.2013 Популярные патенты: 2265300 Способ борьбы с нежелательной порослью топинамбура ... обработки (биологич. фаза)Высота растений, см до обработкипосле проявления эффекта, тек. годна следующий год В текущем годуна следующий год 1. Вспашка на глубину от 18 до 22 см Раундап, 5 л/га (360 г глифосата к-ты)В начале образования столонов40-50 6238114 38,7+83,8 Массовый рост столонов80-90 9827135 72,4+37,8 Начало образования клубней (утолщение столонов) 110-12012232 16073,8 +31,12. Культивация на глубину 8-10 см Раундап, 5 л/га (360 г глифосата к-ты)В начале образования столонов40-50 11001,5 10098,6Массовый рост столонов80-90 10900 100100Начало образования клубней (утолщение столонов) 110-1201020 1110089,2 3. Культивация на глубину 8-10 смГранстар, ... 2407284 Акустический анализатор роевого состояния пчелосемей ... выход которого через аналого-цифровой преобразователь подключен к блоку отображения информации, выполненному в виде цифрового жидкокристаллического ... 2040900 Фунгицидное средство ... соответствует обычному стандартному применению. Обработанные семена в пахотную землю. Пахотную землю укладывают в поддоны размером: глубина 11 см, длина 40 см, ширина 30 см. В каждый поддон засеивают по 100 зерен. Для каждой комбинации проводят по 3 параллельных опыта. Эффективность для отдельных продуктов определяют с применением метода, опубликованного Холмсом и Колхоуном (S.Y. J.Holmes and J.Colhoun: "Method for ussesing the efficacy of sud intectants for the control of sud born Septoria nodonium on wheat "Annols of Applied Biology 75 pp. 225-232, 1973. Поддоны после засеивания выдерживают 2 недели в отсутствии света при 8-10оС, затем устанавливают в теплице и там ... 2083070 Способ предпосевной обработки семян и устройство для его осуществления ... 3 табл. , , ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУ Изобретение относится к сельскому хозяйству, а именно к предпосевной обработке семян сельскохозяйственных культур, и может быть использовано для обработки семян в магнитном поле. Известен способ предпосевной обработки семян в магнитном поле 1,5 5 Э, частотой 2 20 кГц, при длительности обработки 5 10 мин. Устройство для реализации этого способа представляет собой излучатель магнитного поля, выполненный в виде катушки индуктивности, входящей в колебательный контур, подключенный в звуковому генератору. Наиболее близким по совокупности признаков является способ обработки семян импульсивным магнитным полем (ИМЦ) с ... 2121258 Устройство для вентилирования зерна или другого сыпучего материала (варианты) ... что основной или выравнивающий, или каждый коллектор нечетного или четного ряда газопроводов размещен в емкости и имеет стенку с наклонной верхней частью, кромка которой прикреплена к стенке емкости, а газопроводы открытыми торцами присоединены к стенке коллектора так, что нижние кромки их стенок и стенки коллектора расположены на одном уровне, причем между нижней кромкой стенки коллектора и стенкой емкости выполнен зазор. 7. Устройство по п.6, отличающееся тем, что ширина зазора снизу основного или выравнивающего, или каждого коллектора определяется выражением D < S 0,5F, где D - наибольший размер поперечного сечения наиболее крупного компонента, который может быть внесен в ... |
Еще из этого раздела: 2078495 Устройство для транспортирования кормов в хранилищах башенного типа 2120709 Рама плуга 2216908 Комбайн для уборки урожая с кустарников 2178965 Картофелекопатель ручной мотыжный 2100354 Макроциклический лактон, фармацевтическая композиция, обладающая антибиотической активностью, и инсектоакарицидная композиция 2197796 Рабочий орган ручного почвообрабатывающего орудия 2162635 Устройство для аэрозольного распыления (варианты) 2153256 Инсектицидное средство и способ борьбы с вредителями сельскохозяйственных культур 2091023 Способ защиты растений от заболеваний, вызванных нематодами 2229783 Способ посева семян трав и кустарников для создания пастбищ |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||