Композиция для консервации и хранения органа, предназначенного для имплантации пациентуПатент на изобретение №: 2019965 Автор: Белзер Фолкерт О.[US], Саутхард Джеймс Х.[US] Патентообладатель: Висконсин Алюмни Рисерч Фаундейшн (US) Дата публикации: 30 Сентября, 1994 Изображения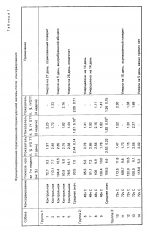 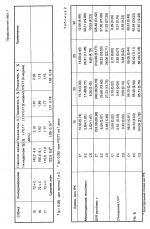 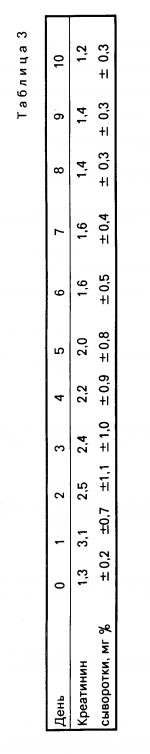 Предлагается композиция, пригодная для консервации и хранения органа, предназначенного для имплантации пациенту, содержащая лактобионат и оксиэтилированный крахмал, свободный от этиленгликоля, этиленхлоргидрина, хлорида натрия и ацетона, и имеющий мол.м. от 150000 до 350000 дальтон. 2 з.п.ф-лы, 3 табл. Консервирование почки, например, при хранении в условиях "вне виво" трупных почек, является относительно новой областью. Консервирование трупных почек для трансплантации является общепринятой практикой в больницах, однако успеху операций консервирования препятствуют неудачные и ошибочные экспериментирования. Хотя такой подход частично успешен с клинической точки зрения, фактически принципы, обуславливающие этот успех, не совсем ясны. Хотя почечная трансплантация была разработана исключительно в процессе исследования для клинической терапии на последней стадии почечного заболевания, операция консервирования почки вышла за пределы лабораторного исследования и перешла к установленному клиническому способу. В настоящее время существуют два наиболее общепринятых способа консервирования почки: простое хранение в гипотермических условиях и непрерывная перфузия. При хранении в гипотермических условиях, наиболее общепринятом способе, органы удаляются из трупа-донора и быстро охлаждаются. Обычно это достигается за счет сочетания наружного охлаждения и кратковременной перфузии для насколько возможно быстрого понижения температуры центральной массы ткани. Затем почки хранятся погруженными в промывающую струю раствора в простой пластмассовой емкости и выдерживаются при температуре 0-4оС при погружении этой пластмассовой емкости в лед. Преимущества данного способа заключаются в его простоте, низкой стоимости и легкости транспортировки органов. Тщательно изучен состав промывающей струи раствора, обеспечивающий оптимальное консервирование. Второй способ консервирования почки, который прошел тщательное лабораторное исследование, а также клиническое испытание, заключается в непрерывной пульсирующей перфузии. Основными ингредиентами пульсирующей перфузии обычно являются пульсирующий поток, гипотермия, мембранная оксигенация и перфузат, содержащий как альбумин, так и липиды. Способ непрерывной перфузии имеет ряд преимуществ. Во-первых, перфузия обеспечивает достаточное время для того, чтобы трупная трансплантация стала частично избирательной операцией. Во-вторых, данный способ позволяет производить испытания на жизнеспособность до имплантации. Значительное улучшение результатов трупной почечной трансплантации может быть достигнуто в случае, если время консервирования может быть увеличено до пяти-семи дней, что необходимо для данных способов испытания смешанной лимфоцитной культуры. Способность успешного консервирования человеческих почек в течение 2-3 дней либо путем простого хранения на холоду после первичной промывки струей раствора внутриклеточного электролита, либо путем пульсирующей перфузии электролитно-белковым раствором обеспечивает достаточное время для испытания на гистосовместимость донора и реципиента, распределения почки среди центров трансплантата, тщательной дооперационной подготовки реципиента, достаточное время для того, чтобы были получены результаты анализа донора и чтобы до имплантации обеспечивалось сосудистое восстановление почечного трансплантанта. Консервирование почки в течение 72 ч с использованием гипотермической пульсирующей перфузии с криопреципитированной плазмой имеет значительное преимущество для консервирования человеческой почки и обеспечивает предпочтительный способ консервирования. Консервирование почки струей охлажденного льдом раствора внутриклеточного электролита с последующим простым хранением по холоду успешно использовалось для консервирования человеческой почки в течение времени вплоть до 61 ч. Сывороточный альбумин в его различных формах используется исключительно для клинического консервирования органов для получения необходимого онкотического давления. Эти формы включают криопреципитированную плазму, фракцию белковой плазмы, альбумин человеческой сыворотки и обработанную селикагелем плазму. Однако, поскольку эти перфузата получаются из материалов естественного происхождения, то неизбежны варианты. Особенно желательно, если доступно получение перфузата, содержащего синтетический коллоид. Раньше уже проводили испытания большого количества синтетических коллоидных материалов на эффективность их действия при консервировании почки. Эти коллоиды включают декстрины, поливинилпирролидин, плюроны, оксиэтиловый крахмал (HES), фиколл, аравийскую камедь и полиэтиленгликоль. Ни один из этих коллоидов не является таким же эффективным, как сывороточный альбумин. Однако HES был эффективен в течение 24 ч и в некоторых случаях в течение 72 ч консервирования. Все эти коллоидные вещества подвергались испытанию в перфузатах на основе физиологического раствора. Недавно было выявлено прекрасное 72-часовое консервирование собачьей почки с использованием перфузата, содержащего анионы глюконата вместо хлорида с альбумином человеческой сыворотки (HSA) для осмотической коллоидной подложки. В конце 60-х годов два очень важных исследования продемонстpировали, что почки могут быть безопасно консервированы в течение 30 ч при хранении на холоду и в течение 72 ч в результате непрерывной перфузии. Эти два исследования позволили изменить клиническую трансплантацию трупных почек с экстренной процедуры на полуизбирательную процедуру. Раствор Коллинза или модифицированный раствор Эйроколлинза является предпочтительным для большинства центров трансплантации, где почки консервируются за счет их хранения на холоду. В 80-х годах снова начал проявляться интерес к вводу циклоспорина для иммуноподавления при трансплантации других органов, в частности печени, поджелудочной железы, сердца, легких и сердца-легких. Однако те способы консервирования, которые успешны для почек, неуспешны для указанных других органов. Следовательно, клиническое консервирование сердца, почек и поджелудочной железы сохраняет их минимальное время, не более 6-10 ч. Эти органы в порядке их значимости более сложны для трансплантации, чем почки, и данные операции неизменно осуществляются ночью, когда операционные помещения в больницах доступны. Короткий период времени для консервирования сердца и печени требует работы двух хирургических групп, одной группы для донора и другой группы для реципиента. Продление срока консервирования этих органов до 30 ч окажет такое же воздействие на их трансплантацию, как и на трансплантацию почки, а именно увеличение доступности органов, снижение потери органов, увеличение участка органа и снижение стоимости. Консервирующий раствор, используемый для всех органов доноров, желателен как для охлаждения органа непосредственно в донорском участке, так и для хранения на холоду после извлечения органа. Согласно изобретению, предусматривается композиция, пригодная для консервирования и хранения органа, предназначенного для имплантации в организм пациента, которая включает лактобионат и оксиэтиловый крахмал, который практически свободен от этиленгликоля, этиленхлоргидрина, хлорида натрия и ацетона, и который имеет мол.м. от 150000 до 350000 Дальтон, а также предусматривается способ консервирования органа, предназначенного для имплантации в организм пациента, который включает помещение этого органа в такую композицию. Такая композиция или перфузат обеспечивает сохранение в течение 72 ч поджелудочной железы, в течение 48 ч и не менее чем в течение 24 ч печени. Хотя перфузат на основе альбумина сыворотки (HSA) сохраняет жизнеспособность почки в течение вплоть до трех дней, эта почка повреждается, что проявляется по повышенному посттрансплантационному количеству сывороточного креалина и по времени, необходимому для возврата этих повышенных количеств к нормальному количеству. Таким образом, приемлемых способов почечного консервирования пока нет. Те способы, которые считались клинически эффективными, ограничиваются кратким сроком хранения (три дня) и значительно сниженной жизнеспособностью. Изобретение описывает биохимическую композицию перфузата и раствора для хранения, которые в наибольшей мере пригодны для гипотермически консервированных органов, и новый осмотический синтетический коллоидный агент, который обеспечивает значительно более длительное время хранения при консервировании. Замораживание и непрерывная аэробная перфузия является теоретически единственным средством получения фактически длительного срока хранения (от месяца до нескольких лет). Просто хранение на холоду приводит к определенному ограничению времени, за пределами которого орган уже более нежизнеспособен. Гипотермия снижает скорость, с которой происходит разложение внутриклеточными ферментами основных клеточных компонентов, необходимых для жизнеспособности органа. Было показано, что простое охлаждение ишемических почек холодной кpовью сохраняет их деятельность в течение 12 ч Collins (Lancet 1969;2, 1219-1222) показал, что использование подходящего раствора в форме сильной струи дополнительно увеличивает продолжительность хранения почек в три раза (до 30 ч). Непригодность этого раствора для консервирования других органов, таких как поджелудочная железа, печень и сердце, связана с различиями специфических для органов метаболических процессов. Струя промывающего раствора, чтобы она была отвечающей требованиям и эффективной, должна иметь состав, который сводит до минимума гипотермической индуцированное набухание клеток, не допускает увеличения внеклеточного пространства в период промывки струей, не допускает повреждения от свободных от кислорода радикалов, особенно в ходе вторичной перфузии, и обеспечивает субстраты для регенерации высокоэнергетических фосфатных соединений в течение вторичной перфузии. Гипотермически индуцированное набухание клеток обусловлено аккумулированием воды. Эта тенденция к набуханию может быть устранена путем ввода 110-140 ммоль (110-140 мосм/кг осмотическая сила) веществ, которые непроницаемы для клеток (импермеанты). Концентрация этих непроницаемых для клеток веществ примерно равна концентрации глюкозы в растворе Collins хранения на холоду (120 ммоль) и концентрации непроницаемых для клеток веществ в других растворах хранения на холоду. Таким образом, основным компонентом эффективных растворов хранения на холоду является эффективное непроницаемое для клеток вещество в нужной концентрации. Эффективный холодный промывающий раствор в форме струи должен предотвращать расширение внеклеточного пространства, расширение, которое может иметь место при промывке органов струей непосредственно на донорском участке и после изъятия органов. Такое расширение может подавить капиллярную систему и привести к слабому распределению струи промывочного раствора в ткани. Большинство растворов хранения на холоду не содержит веществ, которые создают давление онкотической подложки (альбумин или другие коллоиды). В связи с этим компоненты струи промывочного раствора быстро диффундируют во внеклеточные пространства и вызывают отек ткани. Таким образом, идея заключается в том, чтобы раствор промывки в форме струи непосредственно на донорском участке содержал вещества, которые создают осмотическое давление коллоида и обеспечивал свободный обмен основных составляющих компонентов промывочного раствора без расширения внеклеточного пространства. Существуют значительные различия в метаболизме почек, печени и поджелудочной железы, и эти различия могут повлиять на качества консервирования органов. Подавление набухания клеток вызывает необходимость в эффективной обработке. Глюкоза, основное непроницаемое для клеток вещество, в растворе Collins неэффективна для печени или поджелудочной железы и легко входит в клетки (Southаrd и др., Gryobiology, 1986 г., 23, 477-482). Маннит, другое общеизвестное непроницаемое вещество, обладает примерно такой же проницаемостью, как и глюкоза в печени. Таким образом, причиной того, что растворы хранения на холоду, которые зависят от глюкозы и маннита, неэффективны для печени и поджелудочной железы, является отсутствие в этих растворах непроницаемых для клеток веществ (импермеантов). Согласно изобретению раствор для консервирования органов содержит анионный лактобионат и предпочтительно раффинозу в качестве непроницаемых веществ для клеток; осмомолярность этого раствора составляет предпочтительно примерно 320 мосм/L, K+ 120 ммоль и Na+ 30 ммоль. Предпочтительным коллоидом является модифицированный оксиэтиловый крахмал с мол.м. от 150000 до 350000, особенно от 200000 до 300000 Дальтон, и со степенью замещения от 0,4 до 0,7. Предпочтительный коллоид свободен от оксиэтилового крахмала, имеющего мол.м. менее чем 50000 Дальтон. Согласно изобретению, оксиэтиловый крахмал диализируется на дистиллированной - деионизированной воде или обрабатывается для удаления некоторых загрязнений, ранее неизвестных, которые оказывают нежелательное действие на эффективность препаратов оксиэтилового крахмала. Вещества, удаляемые путем процесса диализа, являются самыми незначительными компонентами оксиэтилового крахмала, включающими этиленгликолевые и этиленхлоргидриновые побочные продукты оксиэтилирования, а также остаточный ацетон и хлористый натрий. Как известно, этиленгликоль и этиленхлоргидрин являются токсичными веществами. Следовательно, их удаление желательно, даже если они присутствуют в незначительном количестве. Следующим очень важным условием успешного хранения на холоду является предотвращение внутриклеточного ацидоза: ишемия даже на холоду стимулирует гликолиз или гликогенолиз (эффект Пастера), она также увеличивает продуцирование молочной кислоты и концентрацию водородных ионов. Ацидоз ткани смертелен для клеток и вызывает лизосомную неустойчивость, активизирует лизосомные ферменты и изменяет митохрящевые свойства. Таким образом, предотвращение внутриклеточного ацидоза является очень важным условием для хорошего консервирования. Некоторые исследования показали, что эффективное образование буфера раствора хранения на холоду или использование промывочных растворов в форме струи с щелочным значением рН улучшает консервирование печени Lie TS и др., Transplant Proc, 1984, 16, 134-137) и поджелудочной железы (Аннотированные доклады 13-й ежегодной конференции Американского общества по хирургии трансплантации, 28-29 мая 1987 г.). Предпочтительная композиция, отвечающая изобретению, имеет величину рН примерно 7,4. Другим очень важным аспектом эффективного хранения на холоду является фактор повреждения от свободных от кислорода радикалов в ходе вторичной перфузии, но точная роль этих агентов пока еще не ясна. Можно полагать, что свободные от кислорода радикалы могут оказывать незначительное влияние на человеческие печень и почки, поскольку эндогенная ксантиноксидаза имеет относительно низкую активность по сравнению с высокоэндогенной активностью высшего оксида дисмутазы, который устраняет анионы высшего оксида. В противоположность этому, повреждение, вызванное свободными от кислорода радикалами, может быть очень значительным в легких и в кишечнике, которые очень чувствительны к этому повреждению. Предпочтительно, следовательно, композиция содержит глютотион. Другим очень важным аспектом является энергетический метаболизм. Аденозинтрифосфат (АТР) быстро разлагается в процессе гипотермического хранения, и это разложение приводит в результате к образованию конечных продуктов (аденозина, инозина и гипоксантина), по отношению к которым оболочка плазмы легко проницаема. Перфузия органа требует быстрой регенерации активности натриевого насоса, который требует АТР. Следовательно, наличие АТР предшественников может иметь очень большое значение для успешного консервирования органа. Предпочтительная препаративная форма, соответственно, содержит аденозин; Оксиэтиловый крахмал обычно присутствует в количестве от 3 до 8 мас.%. Согласно предпочтительному аспекту раствор консервирования и композиция перфузата включает, но не ограничивается ими, следующие предпочтительные приближенные количества (в 1 л): К+ -лактобионат 100 ммоль КН2РО4 25 ммоль MgSO4 5 ммоль Раффиноза 30 ммоль Аденозин 30 ммоль Глутатионин 3 ммоль Инсулин 100 ед. Бактрим 0,5 мл Лексаметазон 8 мг Аллопуринол 1 ммоль Оксиэтиловый крахмал с мол,м, 50 г от 200000 до 300000 Дальтон и со степенью замещения от 0,4 до 0,7 Раствор доводят до величины рН 7,4 при комнатной температуре посредством NaOH. Конечные концентрации составляют: Na = 30  5 ммол, К+ = 120 5 ммол, К+ = 120  5 ммоль. мосм/л = 320 5 ммоль. мосм/л = 320 5. Бактрима = Триметоприма = 16 мг/мл и сульфаметоксазола = = 80 мг/мл. Другой предпочтительной рецептурой является следующая: Локтобионовая кислота 35,83 г Фосфат калия одноосновный 3,40 г Раффиноза*, пен- тагидрат 17,83 г Сульфат магния, семигадрат* 1,23 г Аденозин 1,34 г Аллопуринол 0,136 г Глутатион 0,922 г (восстановленный) Пентафракция 50,00 г Гидроокись калия (10 нормальн.) 10,0 мл Гидроокись натрия или соляная кис- лота, доведением рН до 7,4 Вода для инъекции в количестве до общего объема 1 л, * Могут использоваться и другие гидраты, обеспечивающие одинаковое количество. ** Гидроксиэтил, крахмал, полученный в примере 1. Согласно данному изобретению обеспечивается увеличенное время консервированного сохранения клинического органа, и использование синтетического коллоида сводит к минимуму отклонения, которые являются следствием перфузатов, полученных из материала естественного происхождения. П р и м е р 1. Приготовление гидрооксиэтилового крахмала (HES). 100 г оксиэтилового крахмала растворяют в дистиллированной-деионизированной воде для получения раствора концентрацией 10 мас.%. Этот раствор HES помещают в диализные мешки (34 мм х 18 дюймов), содержащие фракции с мол.м. 50000 Дальтон, которые помещают в 10-15-литровую емкость с дистиллированной - деионизированной водой, и перемешивают в течение 72 ч. Вода ежедневно заменяется, HES собирается и замораживается при -20оС и хранится в таком состоянии до использования, он имеет мол.м. от 200000-300000 Дальтон и степень замещения примерно 0,4-0,5. П р и м е р 2. 72-часовое консервирование собачьей поджелудочной железы. Для данного эксперимента используются самки собак нечистокровной породы массой 15-25 кг. Осуществление процедуры. Анестезия осуществляется пентатолом и поддерживается галотаном. Путем срединной стереотомии извлекается левый сегмент (хвост) поджелудочной железы. Имплантат с фиксированной селезенкой трансплантируется на подвздошные сосуды либо непосредственно после промывки (контрольное), либо про прошествии 48 и 72 ч хранения на холоду. Проход поджелудочной железы остается открытым, что позволяет соку поджелудочной железы свободно стекать в брюшную полость. Не используется никаких антикоагулянтов. Правый сегмент поджелудочной железы удаляется во время трансплантации. Протокол ведения эксперимента. Все собаки получают внутривенно 0,5 г мандола до извлечения органа в течение первых трех дней после трансплантации. Собаки получают стандартный собачий рацион с содержанием в пище виоказы. Животные разделяются на три группы. Группа 1 (контрольная): после извлечения и промывки имплантаты сразу же трансплантируются; группа 2 (хранение 48 ч на холоду); группа 3 (хранение 72 ч на холоду). Концентрация глюкозы в крови определяется ежедневно в течение первой посттрансляционной недели, а затем один раз в две недели. Испытание на толерантность к вводимой внутривенно глюкозе (IYGTT) осуществляется через 24 ч, 2 недели и 4 недели после трансплантации. Имплантаты удаляются через 4 недели и через 2-3 дня после проведения испытаний IYGTT. Для проведения испытания IYGTT осуществляется инъекция глюкозы (0,5 г/кг массы тела) и определяется концентрация глюкозы крови через 1, 5, 10, 20, 30, 60, 90 и 120 мин. Величина К рассчитывается по концентрации глюкозы крови, полученной при измерении после 5-60 мин. Глюкозные показатели более чем 150 мг% в течение более чем 2 дней и показатель К менее чем 1 является признаком диабета. Консервирование. После удаления поджелудочной железы ее промывают струей примерно 250-300 мл промывочного раствора с высоты 60 см. Имплантат помещается в двойной пластмассовый мешок, покрытый консервирующим раствором, который помещается в баню лед-вода. Статистическая оценка. Статистическая оценка осуществляется путем студенческого испытания Т. Данные приведены как средние значения 5. Бактрима = Триметоприма = 16 мг/мл и сульфаметоксазола = = 80 мг/мл. Другой предпочтительной рецептурой является следующая: Локтобионовая кислота 35,83 г Фосфат калия одноосновный 3,40 г Раффиноза*, пен- тагидрат 17,83 г Сульфат магния, семигадрат* 1,23 г Аденозин 1,34 г Аллопуринол 0,136 г Глутатион 0,922 г (восстановленный) Пентафракция 50,00 г Гидроокись калия (10 нормальн.) 10,0 мл Гидроокись натрия или соляная кис- лота, доведением рН до 7,4 Вода для инъекции в количестве до общего объема 1 л, * Могут использоваться и другие гидраты, обеспечивающие одинаковое количество. ** Гидроксиэтил, крахмал, полученный в примере 1. Согласно данному изобретению обеспечивается увеличенное время консервированного сохранения клинического органа, и использование синтетического коллоида сводит к минимуму отклонения, которые являются следствием перфузатов, полученных из материала естественного происхождения. П р и м е р 1. Приготовление гидрооксиэтилового крахмала (HES). 100 г оксиэтилового крахмала растворяют в дистиллированной-деионизированной воде для получения раствора концентрацией 10 мас.%. Этот раствор HES помещают в диализные мешки (34 мм х 18 дюймов), содержащие фракции с мол.м. 50000 Дальтон, которые помещают в 10-15-литровую емкость с дистиллированной - деионизированной водой, и перемешивают в течение 72 ч. Вода ежедневно заменяется, HES собирается и замораживается при -20оС и хранится в таком состоянии до использования, он имеет мол.м. от 200000-300000 Дальтон и степень замещения примерно 0,4-0,5. П р и м е р 2. 72-часовое консервирование собачьей поджелудочной железы. Для данного эксперимента используются самки собак нечистокровной породы массой 15-25 кг. Осуществление процедуры. Анестезия осуществляется пентатолом и поддерживается галотаном. Путем срединной стереотомии извлекается левый сегмент (хвост) поджелудочной железы. Имплантат с фиксированной селезенкой трансплантируется на подвздошные сосуды либо непосредственно после промывки (контрольное), либо про прошествии 48 и 72 ч хранения на холоду. Проход поджелудочной железы остается открытым, что позволяет соку поджелудочной железы свободно стекать в брюшную полость. Не используется никаких антикоагулянтов. Правый сегмент поджелудочной железы удаляется во время трансплантации. Протокол ведения эксперимента. Все собаки получают внутривенно 0,5 г мандола до извлечения органа в течение первых трех дней после трансплантации. Собаки получают стандартный собачий рацион с содержанием в пище виоказы. Животные разделяются на три группы. Группа 1 (контрольная): после извлечения и промывки имплантаты сразу же трансплантируются; группа 2 (хранение 48 ч на холоду); группа 3 (хранение 72 ч на холоду). Концентрация глюкозы в крови определяется ежедневно в течение первой посттрансляционной недели, а затем один раз в две недели. Испытание на толерантность к вводимой внутривенно глюкозе (IYGTT) осуществляется через 24 ч, 2 недели и 4 недели после трансплантации. Имплантаты удаляются через 4 недели и через 2-3 дня после проведения испытаний IYGTT. Для проведения испытания IYGTT осуществляется инъекция глюкозы (0,5 г/кг массы тела) и определяется концентрация глюкозы крови через 1, 5, 10, 20, 30, 60, 90 и 120 мин. Величина К рассчитывается по концентрации глюкозы крови, полученной при измерении после 5-60 мин. Глюкозные показатели более чем 150 мг% в течение более чем 2 дней и показатель К менее чем 1 является признаком диабета. Консервирование. После удаления поджелудочной железы ее промывают струей примерно 250-300 мл промывочного раствора с высоты 60 см. Имплантат помещается в двойной пластмассовый мешок, покрытый консервирующим раствором, который помещается в баню лед-вода. Статистическая оценка. Статистическая оценка осуществляется путем студенческого испытания Т. Данные приведены как средние значения  SEM. Результаты. Все имплантаты подвергаются тщательной перфузии сразу же после трансплантации. В консервированных имплантатах через 5-10 мин после повторной перфузии развивается внутридольковый отек в изменяющейся степени. Селезенка подвергается тщательной перфузии во всех случаях. Как показано в таблице, пять собак погибли: три в контрольной группе и две в группе 3 (72-часовое консервирование). Причины смерти не связаны с трансплантатом и все собаки погибли с функционирующими имплантатами. Во время резекции поджелудочной железы все имплантаты (даже контрольные) показали различные признаки фиброза, как и селезенка. Артериальный и венозный тромбоз не обнаружен ни в одном из имплантатов. Показатели глюкозы крови посттрансплантата и результаты испытания IYGTT приведены в таблице для каждого животного. Изучали средние результаты ( SEM. Результаты. Все имплантаты подвергаются тщательной перфузии сразу же после трансплантации. В консервированных имплантатах через 5-10 мин после повторной перфузии развивается внутридольковый отек в изменяющейся степени. Селезенка подвергается тщательной перфузии во всех случаях. Как показано в таблице, пять собак погибли: три в контрольной группе и две в группе 3 (72-часовое консервирование). Причины смерти не связаны с трансплантатом и все собаки погибли с функционирующими имплантатами. Во время резекции поджелудочной железы все имплантаты (даже контрольные) показали различные признаки фиброза, как и селезенка. Артериальный и венозный тромбоз не обнаружен ни в одном из имплантатов. Показатели глюкозы крови посттрансплантата и результаты испытания IYGTT приведены в таблице для каждого животного. Изучали средние результаты ( SEM) для каждой группы, которые приведены в таблице. Средний показатель глюкозы крови в течение первой недели после трансплантации самый высокий у группы 3 (124 SEM) для каждой группы, которые приведены в таблице. Средний показатель глюкозы крови в течение первой недели после трансплантации самый высокий у группы 3 (124 6 мг%) и этот показатель значительно различается (Р < 005) по сравнению с показателями группы 1 (94 6 мг%) и этот показатель значительно различается (Р < 005) по сравнению с показателями группы 1 (94 7 мг%) и группы 2 (108 7 мг%) и группы 2 (108 7 мг%). Среднее значение К в первый день также значительно ниже (Р < 0,05) у группы 3 (185 7 мг%). Среднее значение К в первый день также значительно ниже (Р < 0,05) у группы 3 (185 0,15%) по сравнению с группой 1 (2,44 0,15%) по сравнению с группой 1 (2,44 0,14%) и группой 2 (2,53 0,14%) и группой 2 (2,53 0,22%). У группы 3 показатели К, определяемые на 14 день (1,7 0,22%). У группы 3 показатели К, определяемые на 14 день (1,7 0,1%) и на 28 день (1,61 0,1%) и на 28 день (1,61 0,19%) остаются такими же, как показатель К на 1 день (Р = NS). В группах 1 и 2 показатели К снижаются и через 2 недели после трансплантации не обнаружено никаких значительных различий между этими тремя группами. На четвертой неделе показатель К для группы 3 лучше, чем для группы 2, но несколько ниже, чем у контрольной группы (статистическое значение не может быть получено ввиду малочисленности группы 1). Все собаки стали гипергликемическими (показатель глюкозы крови более чем 200 мг% ) после удаления поджелудочной железы, что говорит о том, что исключительно трансплантированный орган ответственен за гомеостаз глюкозы. Четыре животных из группы 3 исследовались на срок жизнеспособности. Одна собака умерла через 7 недель после трансплантации от пневмонии, но оставалась нормогликемической (с нормальным содержанием сахара в крови). Две собаки умерщвлены на третьем и четвертом месяце, Одна собака жила в течение 6 месяцев. Ни одно из животных не обнаружило признаков диабета и все они были нормогликемическими (см.табл.1). П р и м е р 3. 24-часовое консервирование печени. Клиническое консервирование печени ограничивается примерно 6-10 ч, увеличение времени консервирования до 24 ч и более может оказывать значительное влияние на трансплантацию печени. Изолированная подвергнутая перфузии печень кролика была использована для определения качества консервирования после хранения на холоду в растворе Collins, в фракции белка кровяной плазмы Кэмбридж (Cambridge) (PPF), в растворе Marshalls и в предлагаемом растворе. Образование желчи в ходе нормальной термической перфузии подвергнутой хранению на холоду печени является наиболее показательным параметром жизнеспособности, и скорость образования желчи (мл 100 г/ч 0,19%) остаются такими же, как показатель К на 1 день (Р = NS). В группах 1 и 2 показатели К снижаются и через 2 недели после трансплантации не обнаружено никаких значительных различий между этими тремя группами. На четвертой неделе показатель К для группы 3 лучше, чем для группы 2, но несколько ниже, чем у контрольной группы (статистическое значение не может быть получено ввиду малочисленности группы 1). Все собаки стали гипергликемическими (показатель глюкозы крови более чем 200 мг% ) после удаления поджелудочной железы, что говорит о том, что исключительно трансплантированный орган ответственен за гомеостаз глюкозы. Четыре животных из группы 3 исследовались на срок жизнеспособности. Одна собака умерла через 7 недель после трансплантации от пневмонии, но оставалась нормогликемической (с нормальным содержанием сахара в крови). Две собаки умерщвлены на третьем и четвертом месяце, Одна собака жила в течение 6 месяцев. Ни одно из животных не обнаружило признаков диабета и все они были нормогликемическими (см.табл.1). П р и м е р 3. 24-часовое консервирование печени. Клиническое консервирование печени ограничивается примерно 6-10 ч, увеличение времени консервирования до 24 ч и более может оказывать значительное влияние на трансплантацию печени. Изолированная подвергнутая перфузии печень кролика была использована для определения качества консервирования после хранения на холоду в растворе Collins, в фракции белка кровяной плазмы Кэмбридж (Cambridge) (PPF), в растворе Marshalls и в предлагаемом растворе. Образование желчи в ходе нормальной термической перфузии подвергнутой хранению на холоду печени является наиболее показательным параметром жизнеспособности, и скорость образования желчи (мл 100 г/ч  SD) в контрольной группе для печени кролика, подвергнутой хранению на холоду 24 ч, следующая: Контрольная Раствор lamb- Консервирущий группа ridge PPF Eurocolling Marshalls раствор 5,4 SD) в контрольной группе для печени кролика, подвергнутой хранению на холоду 24 ч, следующая: Контрольная Раствор lamb- Консервирущий группа ridge PPF Eurocolling Marshalls раствор 5,4 1,7 1,8 1,7 1,8 0,9 1,9 0,9 1,9 1,3 3,1 1,3 3,1 0,5 4,4 0,5 4,4 0,5 Как показывают данные, образование желчи после 24 ч хранения на холоду (2,4оС) и нормальной термической повторной перфузии, описанный раствор консервирования превосходит другие растворы холодного хранения. Конечной оценкой успешного консервирования печени является модель трансплантации. Ввиду этого раствор консервирования был проанализирован на модели ортотопического трансплантата собачьей печени. После простой перфузии струей раствора последовательно три собачьи печени подвергались хранению в течение 24 ч и 26 ч. Трансплантация осуществлялась путем комбинированного метода "манжеты" и хирургического сшивания. Все печени показали удовлетворительный внешний вид и все три собаки быстро пробуждались и находились на ногах в течение 4 ч завершения операции. Количество тромбоцитов было нормальным в течение 6 ч после операции. Значения билирубина и фермента через 6 ч и в последующие 7 дней приведены ниже (среднее значение 0,5 Как показывают данные, образование желчи после 24 ч хранения на холоду (2,4оС) и нормальной термической повторной перфузии, описанный раствор консервирования превосходит другие растворы холодного хранения. Конечной оценкой успешного консервирования печени является модель трансплантации. Ввиду этого раствор консервирования был проанализирован на модели ортотопического трансплантата собачьей печени. После простой перфузии струей раствора последовательно три собачьи печени подвергались хранению в течение 24 ч и 26 ч. Трансплантация осуществлялась путем комбинированного метода "манжеты" и хирургического сшивания. Все печени показали удовлетворительный внешний вид и все три собаки быстро пробуждались и находились на ногах в течение 4 ч завершения операции. Количество тромбоцитов было нормальным в течение 6 ч после операции. Значения билирубина и фермента через 6 ч и в последующие 7 дней приведены ниже (среднее значение  SD), и они показывают быстрое восстановление нормальной деятельности печени. Одна собака умерла на 5 день после операции вследствие инвагината. 6 ч 1 день 3 день 5 день 7 день Билирубин/ мг% 0,6 SD), и они показывают быстрое восстановление нормальной деятельности печени. Одна собака умерла на 5 день после операции вследствие инвагината. 6 ч 1 день 3 день 5 день 7 день Билирубин/ мг% 0,6 0,3 0,7 0,3 0,7 0,6 0,9 0,6 0,9 0,7 0,5 0,7 0,5 0,4 0,4 0,4 0,4 0,2 SGOT 2148 0,2 SGOT 2148 983 1835 983 1835 1145 61 1145 61 16 55 16 55 40 45 40 45 21 Желочн. фосфат 186 21 Желочн. фосфат 186 14 217 14 217 47 273 47 273 126 311 126 311 64 315 64 315 48 П р и м е р 4. Консервирование почки. Описанный раствор хранения на холоду (CS) был исследован на консервирование почки, и было изучено его влияние на почечную деятельность после повторной перфузии: на модели изолированной подвергнутой перфузии собачьей почки (IPK) и на модели собачьего трансплантата. Собачьи почки либо хранились на холоду в течение 48 ч в растворе Eurocollins (EC) либо в описанном растворе хранения на холоду (CS). Почечная деятельность определялась в ходе повторной перфузии на модели IPK с использованием оксигенированного содержащего модифицированный альбумин раствора Krebs-Henseleit при температуре 37оС в течение 90 мин. Образцы мочи собирали через каждые 10 мин и подвергали анализу. Рассчитывали прозрачность креатинина GFR отношение моча/белок кровяной плазмы (U/P) и повторную абсорбцию фракционного натрия (% Na). Результаты приведены в табл.2. как средние значения, в скобках указаны отклонения от средних значений. Обе группы почек хранения на холоду показывают снижение почечной деятельности в момент повторной перфузии (по сравнению с контрольными почками); В отличие от почек хранения в растворе ЕС, почки хранения в растворе CS имеют улучшенное значение GFR и значительно улучшенное значение повторной абсорбции натрия в IPK. Это улучшение почечной деятельности подтверждает, что почки, консервированные в растворе CS, способны восстанавливать холодные ишемические нарушения быстрее чем почки, консервированные в растворе КС. Была осуществлена последовательная аутотрансплантация восьми собачьих почек, консервированных в течение 48 ч в растворе CS. Трое животных были умерщвлены за счет осложнений (артериальный тромбоз, инвагинация). В табл.3 приведены значения креатинина сыворотки посттрансплантата (среднее значение 48 П р и м е р 4. Консервирование почки. Описанный раствор хранения на холоду (CS) был исследован на консервирование почки, и было изучено его влияние на почечную деятельность после повторной перфузии: на модели изолированной подвергнутой перфузии собачьей почки (IPK) и на модели собачьего трансплантата. Собачьи почки либо хранились на холоду в течение 48 ч в растворе Eurocollins (EC) либо в описанном растворе хранения на холоду (CS). Почечная деятельность определялась в ходе повторной перфузии на модели IPK с использованием оксигенированного содержащего модифицированный альбумин раствора Krebs-Henseleit при температуре 37оС в течение 90 мин. Образцы мочи собирали через каждые 10 мин и подвергали анализу. Рассчитывали прозрачность креатинина GFR отношение моча/белок кровяной плазмы (U/P) и повторную абсорбцию фракционного натрия (% Na). Результаты приведены в табл.2. как средние значения, в скобках указаны отклонения от средних значений. Обе группы почек хранения на холоду показывают снижение почечной деятельности в момент повторной перфузии (по сравнению с контрольными почками); В отличие от почек хранения в растворе ЕС, почки хранения в растворе CS имеют улучшенное значение GFR и значительно улучшенное значение повторной абсорбции натрия в IPK. Это улучшение почечной деятельности подтверждает, что почки, консервированные в растворе CS, способны восстанавливать холодные ишемические нарушения быстрее чем почки, консервированные в растворе КС. Была осуществлена последовательная аутотрансплантация восьми собачьих почек, консервированных в течение 48 ч в растворе CS. Трое животных были умерщвлены за счет осложнений (артериальный тромбоз, инвагинация). В табл.3 приведены значения креатинина сыворотки посттрансплантата (среднее значение  SD) для пяти выживших собак. Данное исследование показывает хорошее сохранение почечной деятельности в течение 48 ч хранения на холоду в растворе CS. Следовательно, этот раствор способен консервировать почки, поджелудочную железу и печень, и может быть использован как для хранения на холоду, так и для непрерывной перфузии. SD) для пяти выживших собак. Данное исследование показывает хорошее сохранение почечной деятельности в течение 48 ч хранения на холоду в растворе CS. Следовательно, этот раствор способен консервировать почки, поджелудочную железу и печень, и может быть использован как для хранения на холоду, так и для непрерывной перфузии.
Формула изобретения1. КОМПОЗИЦИЯ ДЛЯ КОНСЕРВАЦИИ И ХРАНЕНИЯ ОРГАНА, ПРЕДНАЗНАЧЕННОГО ДЛЯ ИМПЛАНТАЦИИ ПАЦИЕНТУ, включающая гидроксиэтилкрахмал и аденозин, отличающаяся тем, что она содержит следующие компоненты, г/л: Гидроксиэтилкрахмал Около 50 Лактобионовая кислота Около 36 Ион фосфата Около 2,5 Ион сульфата Около 0,5 Ион магния Около 0,12 Пентагидрат рафинозы Около 18 Аденозин Около 1,5 Аллопуринол Около 0,14 Глютатион Около 1 г Вода для инъекций До 1 л причем гидроксиэтилкрахмал имеет средний мол.м. от 150000 до 350000 дальтон со степенью замещения от 0,4 до 0,5 и практически не содержит гидроксиэтилкрахмала с мол.м. менее 50000 дальтон и этиленгликоля, этилен хлоргидрина, ацетона и хлорида натрия. 2. Композиция по п.1, отличающаяся тем, что глютатион упаковывают как отдельную добавку и добавляют к раствору перед тем, как его использовать. 3. Композиция по любому из пп.1 - 3, отличающаяся тем, что крахмал имеет мол.м. от 200000 до 300000 дальтон и степень замещения 0,4 - 0,5.Популярные патенты: 2189718 Пневматический высевающий аппарат ... меньшим диаметра окружности, описывающей внутренние поверхности сквозных вырезов, и механизм смещения второй накладки относительно первой в пределах нахождения присасывающих отверстий второй накладки в зоне просасывающих отверстий первой накладки. MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 08.09.2002 Номер и год публикации бюллетеня: 14-2004 Извещение опубликовано: ... 2039429 Линия производства молочных продуктов ... Творог загружается в бункер 22 устройства 21. Включается привод 23 шнека, размещенного внутри бункера 22, осуществляющий подпрессовку творога в дозатор. Поворотом рычага 24 вручную осуществляют выдачу в баночку фиксированной дозы творога 50 (40) г. Укупоривают баночки с творогом крышками вручную. Хранят готовую продукцию в контейнерах в холодильной камере 25. Доставка готовой продукции в камеру и отправка для выдачи потребителям осуществляются тележкой 26. Выдача готовой продукции потребителю осуществляется из холодильного прилавка 27. В случае необходимости нормализации молока по жиру или для выработки сливок используют сепаратор 28. Санитарная обработка оборудования ... 2142331 Устройство для гомогенизации и гомогенизирующая головка ... гомогенизирующую головку с входным и выходным каналами, отличающееся тем, что оно содержит не менее чем две гомогенизирующие головки, выходной канал каждой гомогенизирующей головки имеет два отвода, у одного из которых пропускная способность не менее чем в три раза превышает пропускную способность другого, отводы с большей пропускной способностью всех выходных каналов гомогенизирующих головок через патрубки соединены с подводящим трубопроводом, отводы с меньшей пропускной способностью всех выходных каналов гомогенизирующих головок через патрубки соединены с отводящим трубопроводом, подводящий трубопровод соединен с входным патрубком насоса, выходной патрубок которого через ... 2056737 Способ диагностики морозоустойчивости плодовых культур ... что позволяет сделать предварительный вывод о новизне заявляемого способа. Признак, касающийся использования в качестве объекта исследования содержания фруктозы в клетках растения известен по работе Алешина Е. П. и Воробьева Н. В. Изучение влияния пониженных температур на содержание сахаров в проростках риса с целью разработки методов повышения их жизнеспособности. Тр. Кубанского СХИ. Краснодар, 1975, вып. 98(126), с. 3-8. Однако в известном техническом решении накопление фруктозы в клетках проростков риса при действии пониженных положительных температур связывают с их жизнеспособностью. В предлагаемом же решении определяют характер изменения под влиянием низких отрицательных ... 2165141 Тепличный гидропонный комплекс ... металлической рамы, соединенной с покрытым светопроницаемым покрытием каркасом, установленные внутри которого перегородки образуют два вегетационных отсека с расположенным между ними технологическим отсеком, сообщающиеся герметично закрываемыми дверями, при этом размещенные в вегетационных отсеках вентиляционные отверстия выполнены в виде открывающихся наружу форточек. 2. Тепличный гидропонный комплекс по п.1, отличающийся тем, что каркас культивационного сооружения выполнен из соединенных с жесткой рамой поперечных рам и соединенных с ними коньковых прогонов. 3. Тепличный гидропонный комплекс по п.1, отличающийся тем, что размещенная в культивационном сооружении наружная дверь ... |
Еще из этого раздела: 2455815 Самоходный универсальный комбайн для уборки картофеля и топинамбура 2148319 Растительное средство для борьбы с пресноводными моллюсками 2454055 Устройство для ротационного внутрипочвенного рыхления с механическим приводом 2415542 Пневматический высевающий аппарат 2394414 Соединительное устройство для сельскохозяйственной машины 2154939 Способ выращивания кроликов и устройство для его осуществления 2067832 Способ борьбы с грибковыми инфекциями растений 2456799 Ловушка для поимки животных, обитающих в земле 2399194 Способ и устройство контроля воздушного режима в корнеобитаемой среде 2465761 Способ повышения плодородия песчаных почв |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||