Варианты стимулируемой солями желчи липазы, кодирующие их молекулы днк и трансгенные млекопитающие, не принадлежащие к человекуПатент на изобретение №: 2219239 Автор: БЛЕКБЕРГ Ларс (SE), ЭДЛУНД Михаэль (SE), ХАНССОН Леннарт (SE), ХЕРНЕЛЛЬ Олле (SE), ЛУНДБЕРГ Леннарт (SE), СТРЁМКВИСТ Матс (SE), ТЁРНЕЛЛЬ Ян (SE) Патентообладатель: АСТРА АКТИЕБОЛАГ (SE) Дата публикации: 27 Декабря, 1997 Начало действия патента: 25 Февраля, 1994 Адрес для переписки: 129010, Москва, ул. Б. Спасская, 25, стр.3, ООО "Юридическая фирма Городисский и Партнеры", пат.пов. Н.Г.Лебедевой Изображения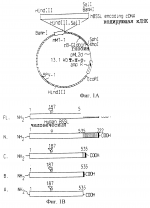    Изобретение относится к области биотехнологии. Полипептид - вариант BSSL включает аминокислотную последовательность 1-535 SEQID NO:3 и фрагмент из 536-722 SEQ ID NO:3, или аминокислотную последовательность, которая, по крайней мере, на 90% гомологична аминокислотной последовательности SEQ ID NO: 7, или аминокислотную последовательность SEQ ID NO:2, в которой аминокислотные остатки -23-0 и 536-711 делетированы (SEQ ID NO:5); или аминокислотные остатки -23-0, 536-568 и 591-711 делетированы (SEQ ID NO:6); или аминокислотные остатки -23-0 делетированы и аминокислота Asn в положении 187 заменена на Gln (SEQ ID NO:7); или аминокислотные остатки 632-708 делетированы (SEQ ID NO:9). Предложена также молекула нуклеиновой кислоты, кодирующая упомянутые полипептиды, гибридный ген, способный опосредовать экспрессию указанной молекулы нуклеиновой кислоты в клетке млекопитающих, плазмида, в которую встроен гибридный ген, клеточная линия, несущая гибридный ген. Предложен способ продуцирования варианта BSSL, варианты способа продуцирования трансгенного млекопитающего и фармацевтическая композиция для лечения заболеваний поджелудочной железы. Изобретение позволяет увеличить выход стимулируемой солями желчи липазы (BSSL) и повысить эффективность лечения патологических состояний, связанных с нарушением деятельности поджелудочной железы. 12 с. и 8 з.п.ф-лы, 19 ил., 3 табл. Область техники, к которой относится изобретение Изобретение относится к новым полипептидам, которые представляют собой варианты стимулируемой солями желчи липазы (BSSL; EC 3.1.1.1.). Оно также относится к молекулам ДНК, кодирующим упомянутые полипептиды, и к субпродуктам, содержащим упомянутые молекулы ДНК. Изобретение также относится к способам продуцирования упомянутых вариантов BSSL и к продуцированию трансгенных млекопитающих, не принадлежащих к человеку, способных экспрессировать варианты BSSL. Кроме того, изобретение относится к таким трансгенным животным, а также к детскому питанию (infant formula), содержащему таких трансгенных животных. Изобретение также относится к фармацевтическим композициям, содержащим упомянутые полипептиды и к применению упомянутых полипептидов и молекул ДНК в производстве лекарственных препаратов. Предпосылки создания изобретения Гидролиз пищевых липидов Пищевые липиды являются важным источником энергии. Богатые энергией триацилглицеролы составляют более 95% таких липидов. Некоторые из липидов, например некоторые жирные кислоты и жирорастворимые витамины, являются существенными составляющими пищи. До желудочно-кишечной абсорбции триацилглицеролы, так же, как и минорные компоненты, т.е. эстерифицированные жирорастворимые витамины и холестерол и диацилфосфатидилглицеролы, требуют гидролиза сложноэфирных связей, чтобы дать начало менее гидрофобным абсорбируемым продуктам. Эти реакции катализируются специфической группой ферментов, называемых липазами. Полагают, что существенными для человека липазами являются желудочная липаза, панкреатическая зависящая от колипазы липаза (гидролиз три- и диацилглицеролов), панкреатическая фосфолипаза А2 (гидролиз диацилфосфатидилглицеролов) и карбоксилэстеразы (СЕН) (гидролиз холестерилэфиров и эфиров жирорастворимых витаминов, но также три-, ди- и моноацилглицеролов). При грудном вскармливании новорожденных стимулируемая солями желчи липаза (BSSL) играет важную роль в гидролизе некоторых из вышеупомянутых липидов. Вместе с солями желчи продукты переваривания липидов образуют смешанные мицеллы или однослойные везикулы (Hernell et al., 1990), из которых происходит абсорбция. Стимулируемая солями желчи липаза Стимулируемая солями желчи липаза (BSSL) является составной частью молока ряда видов, например человека, гориллы, кошек и собак (Hernell et al., 1989, Hamosh et al., 1986). При смешении с желчью в содержимом верхнего отдела тонкого кишечника BSSL специфически активируется первичными солями желчи (Hernell, 1975). BSSL, которая отвечает приблизительно за 1% всего белка молока  1981), не разрушается во время прохождения через желудок, и в дуоденальном содержимом защищается солями желчи от инактивации панкреатическими протеазами, такими как трипсин и химотрипсин. Тепловая обработка человеческого молока (пастеризация при 62,5oС 30 мин), которая инактивирует BSSL полностью (Bjorksten et al., 1980), снижает коэффициент поглощения жиров у недоношенных новорожденных приблизительно на 1/3 (Williamson et al., 1978, Atkinson et al., 1981). Следовательно, лучшее усвоение триацилглицерола свежего человеческого молока по сравнению с усвоением детского питания с подобным жировым составом происходит благодаря BSSL (Hernel et al., 1991, Chapell et al., 1986). BSSL является неспецифической липазой (ЕС 3.1.1.1.), поскольку она гидролизует не только триглицерол, но также и ди- и моноглицерол, сложные холестерилэфиры и сложные эфиры жирорастворимых витаминов 1981), не разрушается во время прохождения через желудок, и в дуоденальном содержимом защищается солями желчи от инактивации панкреатическими протеазами, такими как трипсин и химотрипсин. Тепловая обработка человеческого молока (пастеризация при 62,5oС 30 мин), которая инактивирует BSSL полностью (Bjorksten et al., 1980), снижает коэффициент поглощения жиров у недоношенных новорожденных приблизительно на 1/3 (Williamson et al., 1978, Atkinson et al., 1981). Следовательно, лучшее усвоение триацилглицерола свежего человеческого молока по сравнению с усвоением детского питания с подобным жировым составом происходит благодаря BSSL (Hernel et al., 1991, Chapell et al., 1986). BSSL является неспецифической липазой (ЕС 3.1.1.1.), поскольку она гидролизует не только триглицерол, но также и ди- и моноглицерол, сложные холестерилэфиры и сложные эфиры жирорастворимых витаминов  1983). Так, после активации BSSL имеет возможность гидролизовать большинство липидов человеческого молока сама по себе, хотя наиболее эффективное усвоение триглицерола человеческого молока требует синергичного действия желудочной липазы (ЕС 3.1.1.3.), зависящей от колипазы панкреатической липазы (EC 3.1.1.3) и BSSL 1983). Так, после активации BSSL имеет возможность гидролизовать большинство липидов человеческого молока сама по себе, хотя наиболее эффективное усвоение триглицерола человеческого молока требует синергичного действия желудочной липазы (ЕС 3.1.1.3.), зависящей от колипазы панкреатической липазы (EC 3.1.1.3) и BSSL  1990). Последние исследования говорят о том, что молочный фермент является особенно важным для усвоения новорожденными длинноцепных полиненасыщенных жирных кислот (1993). Такие жирные кислоты являются важными предшественниками эйкозаноидов и важны для развития нервной системы. Новорожденные, особенно родившиеся преждевременно, имеют ограниченную способность синтеза таких жирных кислот и их предшественников. Следовательно, они считаются важными в течение пока еще не установленного периода после рождения. В последних исследованиях ряда лабораторий охарактеризованы структуры кДНК как молочной липазы, так и карбоксиэстеразы поджелудочной железы (СЕН) (Е. С. 3.1.1.1.) (Baba et al., 1991, Hui et al., 1991, Nilsson et al., 1990, Reue et al. , 1991), и делается вывод, что молочный фермент и фермент поджелудочной железы являются продуктами одного и того же гена. Последовательность кДНК и выведения аминокислотная последовательность гена BSSL (СЕН) SEQ ID NO:1) раскрываются также в ВОИС 91/15234 (Oklahoma Medical Research Foundation) и в ВОИС 91/18923 (Aktiebolaget Astra). BSSL является гликопротеином с одной цепью. Выведенный белок (SEQ ID NO: 3) содержит 722 аминокислотных остатка и является высоко гликозилированным (Abouakil et al., 1989). N-концевая половина белка показывает удивительную гомологию с ацетилхолинэстеразой и некоторыми другими эстеразами (Nilsson et al., 1990). Предполагаемый остаток серина с активным сайтом располагается в серине-194; последовательность вблизи этого серина согласуется с консенсусной последовательностью активного сайта серингидролаз. Единственный предполагаемый сайт N-гликозилирования определяется только семью N-концевыми остатками серина активного сайта (Nilsson et al., 1990). Последовательность BSSL содержит в своей С-концевой части 16 богатых пролином повторов из 11 аминокислотных остатков каждый. Оказывается, что изменение в числе повторов является главным объяснением различий в размере молекул и аминокислотном составе между соответствующими ферментами различных видов (Han et al., 1987, Fontaine et al., 1991, Kyder et al., 1989). Эти повторы несут большую часть 15-20% углевода белка (Baba et al., 1991, Abouakil et al., 1989). Уникальное структурное различие между BSSL и типичными эстеразами кроется в С-концевой части полипептидной цепи, т.е. в 16 богатых пролином повторных из 11 аминокислотных остатков. Соответствующие ферменты поджелудочной железы коровы и крысы имеют только 3 и 4 повтора соответственно (Han et al., 1987, Kyder et al., 1989). Следовательно, возможно предположение, что С-концевая часть, или по крайней мере часть ее, обязательны для липазной активности, т.е. для действия против эмульгированного длинноцепного тирацилглицерола. Липидная малабсорбция Обычными причинами малабсорбции и, следовательно, недостаточного питания являются пониженные внутрипросветные (intraluminal) уровни панкреатической, зависящей от колипазы, липазы и/или солей желчи. Типичными примерами случаев такой липазной недостаточности являются пацианты, страдающие муковисцидозом - обычным генетическим нарушением, приводящим к недостаточности в течение всей жизни у 80% пациентов, и страдающие хроническим панкреатитом, часто вследствие хронического алкоголизма. В настоящее время лечение пациентов, страдающих от дефицита панкреатической липазы, состоит в пероральном введении весьма больших доз сырого препарата панкреатических ферментов. Однако зависящая от колипазы панкреатическая липаза инактивируется при низком рН, преобладающем в желудке. Этот эффект не может быть полностью преодолен применением больших доз фермента. Таким образом, большие вводимые дозы являются неадекватными для большинства пациентов, и, сверх того, препараты являются неочищенными и неприятными. Сформулированы некоторые таблетки, которые проходят через кислотные отделы желудка и выделяют фермент только в относительно щелочной среде тощей кишки. Однако многие пациенты, страдающие панкреатическими нарушениями, имеют патологически кислую среду в тощей кишке, и в таких случаях фермент из таблеток может не выделиться. Более того, так как препараты, имеющиеся в настоящее время на рынке, происходят из нечеловеческого источника, существует опасность иммунореакций, которые могут вызвать опасные для пациента эффекты или привести к снижению эффективности лечения. Другим недостатком имеющихся препаратов является то, что не установлено содержание в них других липолитических активностей, кроме зависящей от колипазы липазы. В действительности, большинство из них имеет очень низкий уровень активности BSSL/СЕН. Это может быть одной из причин, почему многие пациенты, страдающие от муковисцидоза, вопреки дополнительному лечению, страдают от недостатка жирорастворимых витаминов и основных жирных кислот. Таким образом, существует большая потребность в продуктах со свойствами и структурой, происходящими от липаз человека, и с широкой субстратной специфичностью, которые могут быть введены перорально пациентам, страдающим от нехватки одного или нескольких липолитических ферментов. Продукты, которые могут быть получены при применении настоящего изобретения, удовлетворяют этой потребности сами по себе или в сочетании с препаратами, содержащими другие липазы. Краткое изложение сущности изобретения Варианты рекомбинатной BSSL по настоящему изобретению сохраняют каталитическую активность, но содержат меньше сайтов гликозилирования, чем полная BSSL, и получаются, таким образом, с потенциально пониженной степенью углеводной гетерогенности. Это уменьшенное разнообразие облегчает очистку и исследование рекомбинатного белка, что будет приводить к более эффективному, по стоимости, производству полипептидов, обладающих активностью BSSL. С другой стороны, пониженная степень гликозилирования менее требовательна к хозяину и допускает более высокое продуцирование в некоторых клетках-хозяевах. И еще, уменьшенное число сайтов гликозилирования в варианте BSSL допускает эффективное продуцирование в низших эукариотах и ограничивает потенциальный риск гликозилирования с отклонениями от нормы, которые могут вызвать иммунологические реакции. Уменьшенный размер и меньшая сложность гликозилирования также предполагает, что круг хозяев шире, чем для белка, имеющего очень сложные и тяжелые углеводные составляющие. Терапевтическое применение варианта BSSL, который меньше по размеру, но равен по активности, означает, что уменьшается масса вещества, необходимая для добавления. Другим возможным преимуществом варианта рекомбинатной BSSL, лишенного большинства или всех О-гликозилированных повторов, является уменьшенный риск иммунологической реакции у отдельного реципиента. Это происходит благодаря тому, что О-связанный сахар может очень гетерогенно зависеть от клетки, в которой он продуцируется. В научной литературе имеются указания, что нативная BSSL связывается с и поглощается слизистой оболочкой кишечника. Вариант BSSL, который выбирают для уменьшения поглощения, будет активным на субстратах пищевых липидов в течение более продолжительного периода времени, что ведет к более эффективному внутрипросветному перевариванию. Примерами таких вариантов являются молекулы с пониженным гликозилированием. Как упоминалось выше, предполагается, что BSSL имеет особую важность для усвоения длинноцепных полиненасыщенных жирных кислот (Нernell et al., 1993), которые имеют большое значение для развития нервной системы у новорожденных и для усвоения витамина А. Вариант BSSL по изобретению, который является в этом отношении более эффективным, может быть выбран известными способами. Усеченный, или укороченный, фермент должен, вероятно, отличаться в отношении конформации, которая может влиять на специфичность против различных липидных субстратов. Раскрытие сущности изобретения С одной стороны, изобретение относится к молекуле нуклеиновой кислоты, кодирующей полипептид, который представляет собой вариант BSSL короче 722 аминокислот, причем упомянутый вариант BSSL содержит часть аминокислотной последовательности, представляемой как остатки 536-722 в SEQ ID NO:3. Выражение "часть аминокислотной последовательности" следует понимать как одну единственную аминокислоту, а также и как последовательность нескольких аминокислот или несколько таких соединенных последовательностей. Термин "вариант BSSL" следует понимать как полипептид, имеющий активность BSSL и содержащий часть аминокислотной последовательности человеческой BSSL, представленной в списке последовательностей как SEQ ID NO:3. Термин "полипептид, имеющий активность BSSL" следует понимать, как полипептид, обладающий по крайней мере свойствами (а) подходить для перорального введения, (b) активироваться специфическими солями желчи, (с) активирования, как неспецифической липазы, в содержимом тонких кишок, т. е. , способность гидролизовать липиды, относительно независимые по своей химической структуре и физическому состоянию (эмульгированные, мицеллы, растворенные), и, не обязательно, обладающие одним или несколькими из следующих свойств, (d) способность гидролизовать триацилглицеролы с жирными кислотами с различной длиной цепи и различной степенью ненасыщенности, (е) способность гидролизовать также диацилглицерол, моноацилглицерол, сложные холестерилэфиры, лизофосфатилилацилглицерол и ретинил и другие сложные эфиры жирорастворимых витаминов, (f) способность гидролизовать в триацилглицероле не только сложноэфирные связи sn-1 (3), но также и сложноэфирные связи sn-2, (g) способность взаимодействовать не только с первичными, но так же и со вторичными солями желчи, (h) зависимость оптимальной активности от солей желчи, (i) устойчивость в том смысле, что содержимое желудка не будет влиять на каталитическую эффективность в сколько-нибудь заметной степени, (j) устойчивость к инактивации панкреатической протеазой, например трипсином, при условии, что присутствуют соли желчи, (k) способность связываться с гепарином или производными гепарина, например с гепаринсульфатом, (l) способность связываться с интерфазами липид-вода, (m) достаточная устойчивость, которая допускает линофилизацию, (n) устойчивость при смешении с составляющими пищи, такими как человеческое молоко или молочная смесь. С другой стороны, изобретение относится к молекуле нуклеиновой кислоты в соответствии с вышесказанным, при этом упомянутый вариант BSSL имеет остаток фенилаланина в своем С-концевом положении или содержит в С-концевой части последовательность Gln-Met-Pro, альтернативно содержит аминокислотную последовательность, представляемую как остатки 712-722 в SEQ ID NO:3 в своей С-концевой части. В контексте настоящего описания термин "С-концевое положение" означает положение заключительного С-концевого остатка, в то время как термин "С-концевая часть" следует понимать, как приблизительно 50 аминокислотных остатков, которые составляют С-концевое окончание варианта BSSL. Изобретение также относится к молекуле нуклеиновой кислоты в соответствии с вышесказанными, при этом упомянутый вариант BSSL содержит менее 16 повторяющихся единиц. В контексте настоящего описания термин "повторяющаяся единица" означает одну из повторяющихся единиц из 33 нуклеотидов каждая, которые указываются в списке последовательностей в SEQ ID NO: 1. В других аспектах изобретение относится к молекуле нуклеиновой кислоты в соответствии с вышесказанным, которая кодирует полипептид, аминокислотная последовательность которого по крайней мере на 90% гомологична с аминокислотой последовательностью, показанной как SEQ ID NO:5, 6 или 9 в списке последовательностей, так же, как и к молекуле нуклеиновой кислоты, которая кодирует полипептид, аминокислотная последовательность которого по крайней мере на 90% гомологична аминокислотной последовательности, показанной как SEQ ID NO: 7 в списке последовательностей, за исключением тех молекул нуклеиновых кислот, которые кодируют полипептиды, которые имеют остаток аспарагина в положении 187. Изобретение также относится к полипептиду, выявленному как SEQ ID NO:5, 6, 7 или 9 в списке последовательностей, так же как и к полипептиду, кодируемому аминокислотной последовательностью, как упоминается выше. Изобретение также относится к гибридному гену, содержащему молекулу нуклеиновой кислоты, в соответствии с вышеупомянутым, к вектору воспроизводимой экспрессии, содержащему такой гибридный ген, и к клетке, несущей такой гибридный ген. Эта клетка может быть прокариотной клеткой, одноклеточным эукариотным организмом или клеткой, происходящей от многоклеточного организма, например от млекопитающего. В контексте настоящего описания термин "гибридный ген" означает последовательность нуклеиновых кислот, содержащую, с одной стороны, последовательность нуклеиновой кислоты, кодирующую вариант BSSL, как определяется выше, и с другой стороны последовательность нуклеиновой кислоты гена, который способен посредничать в экспрессии продукта гибридного гена. Термин "ген" обозначает полный ген, как и его субпоследовательность, которые способны посредничать и нацеливать экспрессию гибридного гена в ткани, представляющей интерес. Обычно упомянутая субпоследовательность представляет собой субпоследовательность, которая включает один или несколько промоторных участков, сайт инициации транскрипции, 3' и 5'-некодирующие участки и структурные последовательности. Гибридный ген образуется, предпочтительно, вставкой in vitro последовательности нуклеиновой кислоты, кодирующей вариант BSSL, в ген, способный посредничать в экспрессии, с применением технических приемов, известных в технике. С другой стороны, последовательность нуклеиновой кислоты, кодирующая вариант BSSL, может быть вставлена in vivo путем гомологической рекомбинации. В контексте настоящего описания термин "воспроизводимый" означает, что вектор способен реплицироваться в данном типе клетки-хозяина, в которую он введен. Непосредственно в обратном направлении последовательности нуклеиновой кислоты может быть получена последовательность, кодирующая сигнальный пептид, присутствие которого обеспечивает секрецию варианта BSSL, экспрессированного клетками-хозяевами, несущими вектор. Сигнальная последовательность может представлять собой последовательность, естественно ассоциируемую с последовательностью нуклеиновой кислоты или другого происхождения. Вектор может представлять собой любой вектор, который можно удобно подвергнуть технологии рекомбинатных ДНК, и выбор вектора часто будет зависеть от клетки-хозяина, в которую он должен быть введен. Таким образом, вектор может представлять собой автономно реплицирующийся вектор, т.е. вектор, который существует как внехромосомный объект, репликация которого не зависит от хромосомной репликации, примерами такого вектора являются плазмида, фаг, космида, минихромосома или вирус. С другой стороны, вектор может представлять собой вектор, который, когда вводится в клетку-хозяина, интегрируется с геном клетки-хозяина и реплицируется вместе с хромосомой (хромосомами), с которой он объединен. Примерами подходящих векторов являются вектор бактериальной экспрессии и вектор экспрессии дрожжей. Вектор настоящего изобретения может нести любую из последовательностей нуклеиновых кислот по изобретению, о которых упоминалось выше. С другой стороны, изобретение относится к способу продуцирования рекомбинатного полипептида, причем упомянутый способ включает (i) вставку молекулы нуклеиновой кислоты, упоминающейся выше, в гибридный ген, который способен реплицироваться в специфической клетке-хозяине или организме; (ii) введение получающегося в результате рекомбинатного гибридного гена в клетку-хозяина или организм; (iii) выращивание образующейся в результате клетки в или на культуральной среде, или идентифицирование и репродуцирование организма для экспрессии полипептида; и (iv) извлечение полипептида. Среда, используемая для выращивания клеток, может быть любой обычной средой, подходящей для этой цели. Подходящим вектором может быть любой вектор из описанных выше, и соответствующая клетка-хозяин может быть любой из типа клеток, описанных выше. Способы, используемые для конструирования вектора и осуществления введения его в клетку-хозяина, могут быть любыми из известных методов, применяемых для этих целей в технологии рекомбинатных ДНК. Вариант рекомбинатной человеческой BSSL, экспрессированный клетками, может быть секретирован, т. е. транспортирован через клеточную мембрану, способом, зависящим от типа клетки и состава вектора. Если вариант BSSL продуцируется внутриклеточно рекомбинатным хозяином, т. е. он клеткой не секретируется, он может быть извлечен стандартными процедурами, включающими разрушение клетки механическими способами, например ультразвуком или гомогенизацией, или ферментами или химическими способами с последующей очисткой. В целях секреции последовательности ДНК, кодирующей вариант BSSL, должна предшествовать последовательность, кодирующая сигнальный пептид, присутствие которого обеспечивает секрецию варианта BSSL из клеток таким образом, что по крайней мере значительная часть экспрессированного варианта BSSL секретируется в культуральную среду и извлекается. Изобретение также относится к системе экспрессии, содержащей гибридный ген, который экспрессируется в клетке-хозяине или организме-хозяине, несущих упомянутый гибридный ген, так что рекомбинатный полипептид продуцируется, когда экспрессируется гибридный ген, причем упомянутый гибридный ген продуцируется посредством вставки последовательности нуклеиновой кислоты, упомянутой выше, в ген, способный посредничать в экспрессии упомянутого гибридного гена. Возможным способом получения варианта рекомбинатной BSSL по изобретению является способ с использованием трансгенных, не принадлежащих к человеку, млекопитающих, способных выделять вариант BSSL в свое молоко. Использование трансгенных, не относящихся к человеку, млекопитающих имеет то преимущество, что можно получать большой выход варианта рекомбинатной BSSL при разумной стоимости, и особенно то, что, когда не относящимся к человеку млекопитающим является корова, вариант рекомбинатной BSSL продуцируется в молоке, которое является естественной составляющей, например, детского питания, так что не требуется дорогостоящей очистки, когда вариант рекомбинатной BSSL должен использоваться в качестве питательной добавки к продуктам на основе молока. Кроме того, продуцирование в высшем организме, таком как не принадлежащее к человеку млекопитающее, естественно, ведет к правильному процессингу белка млекопитающего, например, в отношении посттрансляционного процессинга, как обсуждается выше, и к надлежащей складчатости. Также можно получить большое количество, по существу, чистого варианта BSSL. Соответственно система экспрессии, отнесенная к вышеупомянутой, может представлять собой систему экспрессии у млекопитающего, содержащую последовательность ДНК, кодирующую вариант BSSL, вставленную в ген, кодирующий белок молока не принадлежащего к человеку млекопитающего, с тем, чтобы образовать гибридный ген, который экспрессируется в молочной железе взрослой самки млекопитающего, несущей упомянутый гибридный ген. Молочная железа, как ткань экспрессии, и гены, кодирующие белки молока, вообще, рассматриваются как особенно подходящие для использования при производстве гетерологичных белков в трансгенных, не принадлежащих к человеку, млекопитающих, так как белки молока продуцируются естественно при высоком уровне экспрессии в молочной железе. Кроме того, молоко легко собирается и доступно в больших количествах. В связи с этим использование генов белка молока при продуцировании варианта рекомбинатной BSSL, имеет еще то преимущество, что он продуцируется в условиях, подобных условиям его естественного производства в смысле регуляции экспрессии и места продуцирования (молочная железа). Когда гибридный ген, упомянутый выше, используется в трансгенном млекопитающем, он, предпочтительно, содержит последовательность, кодирующую сигнальный пептид, с тем, чтобы создать возможность правильного секретирования гибридного генного продукта в молочной железе. Сигнальный пептид будет, как правило, представлять собой пептид, который обычно обнаруживается в гене молочного белка, о котором идет речь, или пептид, ассоциированный с последовательностью ДНК, кодирующей вариант BSSL. Однако другие сигнальные последовательности, способные посредничать в секреции продукта гибридного гена в молочную железу, также являются уместными. Конечно, различные элементы гибридного гена должны сливаться таким образом, чтобы создать возможность для правильной экспрессии и процессинга генного продукта. Таким образом, последовательность ДНК, кодирующая сигнальный пептид отбора, должна быть точно слита с N-концевой частью последовательности ДНК, кодирующей вариант BSSL. В гибридном гене последовательность ДНК, кодирующая вариант BSSL, будет обычно содержать его стоп-кодон, но не расщепление своей собственной информации и сайт полиаденилирования. В прямом направлении последовательности ДНК, кодирующей вариант BSSL, процессинговые последовательности мРНК гена белка молока будут обычно сохраняться. Предполагается, что ряд факторов является ответственным за фактический уровень экспрессии определенного гибридного гена. Способность промотора, как и других регуляторных последовательностей, как упоминается выше, интеграция сайта системы экспрессии с геномом млекопитающего, интеграция сайта последовательности ДНК, кодирующей вариант BSSL, с геном, кодирующим белок молока, элементы, сообщающие посттранскрипциональную регуляцию, и другие подобные факторы могут представлять существенное значение для получаемого уровня экспрессии. На основе знаний о различных факторах, влияющих на уровень экспрессии гибридного гена, специалисту будет известно, как сконструировать систему экспрессии, подходящую для данной цели. Ген белка молока, который используется, может быть получен из того же вида, в котором должна размещаться система экспрессии, или он может быть получен от другого вида. В этой связи показано, что регуляторные элементы, которые нацеливают экспрессию гена в молочную железу, являются границами функционально перекрестных видов, что может происходить благодаря возможному общему предшественнику (Hennighausen et. al., 1990). Примеры подходящих генов, кодирующих белок молока или эффективные последовательности, которые используются при конструировании системы экспрессии настоящего изобретения, обычно находят среди белков молочной сыворотки, полученной от различных млекопитающих, например ген кислого белка молочной сыворотки (WAP), предпочтительно от мыши, и ген 1990). Последние исследования говорят о том, что молочный фермент является особенно важным для усвоения новорожденными длинноцепных полиненасыщенных жирных кислот (1993). Такие жирные кислоты являются важными предшественниками эйкозаноидов и важны для развития нервной системы. Новорожденные, особенно родившиеся преждевременно, имеют ограниченную способность синтеза таких жирных кислот и их предшественников. Следовательно, они считаются важными в течение пока еще не установленного периода после рождения. В последних исследованиях ряда лабораторий охарактеризованы структуры кДНК как молочной липазы, так и карбоксиэстеразы поджелудочной железы (СЕН) (Е. С. 3.1.1.1.) (Baba et al., 1991, Hui et al., 1991, Nilsson et al., 1990, Reue et al. , 1991), и делается вывод, что молочный фермент и фермент поджелудочной железы являются продуктами одного и того же гена. Последовательность кДНК и выведения аминокислотная последовательность гена BSSL (СЕН) SEQ ID NO:1) раскрываются также в ВОИС 91/15234 (Oklahoma Medical Research Foundation) и в ВОИС 91/18923 (Aktiebolaget Astra). BSSL является гликопротеином с одной цепью. Выведенный белок (SEQ ID NO: 3) содержит 722 аминокислотных остатка и является высоко гликозилированным (Abouakil et al., 1989). N-концевая половина белка показывает удивительную гомологию с ацетилхолинэстеразой и некоторыми другими эстеразами (Nilsson et al., 1990). Предполагаемый остаток серина с активным сайтом располагается в серине-194; последовательность вблизи этого серина согласуется с консенсусной последовательностью активного сайта серингидролаз. Единственный предполагаемый сайт N-гликозилирования определяется только семью N-концевыми остатками серина активного сайта (Nilsson et al., 1990). Последовательность BSSL содержит в своей С-концевой части 16 богатых пролином повторов из 11 аминокислотных остатков каждый. Оказывается, что изменение в числе повторов является главным объяснением различий в размере молекул и аминокислотном составе между соответствующими ферментами различных видов (Han et al., 1987, Fontaine et al., 1991, Kyder et al., 1989). Эти повторы несут большую часть 15-20% углевода белка (Baba et al., 1991, Abouakil et al., 1989). Уникальное структурное различие между BSSL и типичными эстеразами кроется в С-концевой части полипептидной цепи, т.е. в 16 богатых пролином повторных из 11 аминокислотных остатков. Соответствующие ферменты поджелудочной железы коровы и крысы имеют только 3 и 4 повтора соответственно (Han et al., 1987, Kyder et al., 1989). Следовательно, возможно предположение, что С-концевая часть, или по крайней мере часть ее, обязательны для липазной активности, т.е. для действия против эмульгированного длинноцепного тирацилглицерола. Липидная малабсорбция Обычными причинами малабсорбции и, следовательно, недостаточного питания являются пониженные внутрипросветные (intraluminal) уровни панкреатической, зависящей от колипазы, липазы и/или солей желчи. Типичными примерами случаев такой липазной недостаточности являются пацианты, страдающие муковисцидозом - обычным генетическим нарушением, приводящим к недостаточности в течение всей жизни у 80% пациентов, и страдающие хроническим панкреатитом, часто вследствие хронического алкоголизма. В настоящее время лечение пациентов, страдающих от дефицита панкреатической липазы, состоит в пероральном введении весьма больших доз сырого препарата панкреатических ферментов. Однако зависящая от колипазы панкреатическая липаза инактивируется при низком рН, преобладающем в желудке. Этот эффект не может быть полностью преодолен применением больших доз фермента. Таким образом, большие вводимые дозы являются неадекватными для большинства пациентов, и, сверх того, препараты являются неочищенными и неприятными. Сформулированы некоторые таблетки, которые проходят через кислотные отделы желудка и выделяют фермент только в относительно щелочной среде тощей кишки. Однако многие пациенты, страдающие панкреатическими нарушениями, имеют патологически кислую среду в тощей кишке, и в таких случаях фермент из таблеток может не выделиться. Более того, так как препараты, имеющиеся в настоящее время на рынке, происходят из нечеловеческого источника, существует опасность иммунореакций, которые могут вызвать опасные для пациента эффекты или привести к снижению эффективности лечения. Другим недостатком имеющихся препаратов является то, что не установлено содержание в них других липолитических активностей, кроме зависящей от колипазы липазы. В действительности, большинство из них имеет очень низкий уровень активности BSSL/СЕН. Это может быть одной из причин, почему многие пациенты, страдающие от муковисцидоза, вопреки дополнительному лечению, страдают от недостатка жирорастворимых витаминов и основных жирных кислот. Таким образом, существует большая потребность в продуктах со свойствами и структурой, происходящими от липаз человека, и с широкой субстратной специфичностью, которые могут быть введены перорально пациентам, страдающим от нехватки одного или нескольких липолитических ферментов. Продукты, которые могут быть получены при применении настоящего изобретения, удовлетворяют этой потребности сами по себе или в сочетании с препаратами, содержащими другие липазы. Краткое изложение сущности изобретения Варианты рекомбинатной BSSL по настоящему изобретению сохраняют каталитическую активность, но содержат меньше сайтов гликозилирования, чем полная BSSL, и получаются, таким образом, с потенциально пониженной степенью углеводной гетерогенности. Это уменьшенное разнообразие облегчает очистку и исследование рекомбинатного белка, что будет приводить к более эффективному, по стоимости, производству полипептидов, обладающих активностью BSSL. С другой стороны, пониженная степень гликозилирования менее требовательна к хозяину и допускает более высокое продуцирование в некоторых клетках-хозяевах. И еще, уменьшенное число сайтов гликозилирования в варианте BSSL допускает эффективное продуцирование в низших эукариотах и ограничивает потенциальный риск гликозилирования с отклонениями от нормы, которые могут вызвать иммунологические реакции. Уменьшенный размер и меньшая сложность гликозилирования также предполагает, что круг хозяев шире, чем для белка, имеющего очень сложные и тяжелые углеводные составляющие. Терапевтическое применение варианта BSSL, который меньше по размеру, но равен по активности, означает, что уменьшается масса вещества, необходимая для добавления. Другим возможным преимуществом варианта рекомбинатной BSSL, лишенного большинства или всех О-гликозилированных повторов, является уменьшенный риск иммунологической реакции у отдельного реципиента. Это происходит благодаря тому, что О-связанный сахар может очень гетерогенно зависеть от клетки, в которой он продуцируется. В научной литературе имеются указания, что нативная BSSL связывается с и поглощается слизистой оболочкой кишечника. Вариант BSSL, который выбирают для уменьшения поглощения, будет активным на субстратах пищевых липидов в течение более продолжительного периода времени, что ведет к более эффективному внутрипросветному перевариванию. Примерами таких вариантов являются молекулы с пониженным гликозилированием. Как упоминалось выше, предполагается, что BSSL имеет особую важность для усвоения длинноцепных полиненасыщенных жирных кислот (Нernell et al., 1993), которые имеют большое значение для развития нервной системы у новорожденных и для усвоения витамина А. Вариант BSSL по изобретению, который является в этом отношении более эффективным, может быть выбран известными способами. Усеченный, или укороченный, фермент должен, вероятно, отличаться в отношении конформации, которая может влиять на специфичность против различных липидных субстратов. Раскрытие сущности изобретения С одной стороны, изобретение относится к молекуле нуклеиновой кислоты, кодирующей полипептид, который представляет собой вариант BSSL короче 722 аминокислот, причем упомянутый вариант BSSL содержит часть аминокислотной последовательности, представляемой как остатки 536-722 в SEQ ID NO:3. Выражение "часть аминокислотной последовательности" следует понимать как одну единственную аминокислоту, а также и как последовательность нескольких аминокислот или несколько таких соединенных последовательностей. Термин "вариант BSSL" следует понимать как полипептид, имеющий активность BSSL и содержащий часть аминокислотной последовательности человеческой BSSL, представленной в списке последовательностей как SEQ ID NO:3. Термин "полипептид, имеющий активность BSSL" следует понимать, как полипептид, обладающий по крайней мере свойствами (а) подходить для перорального введения, (b) активироваться специфическими солями желчи, (с) активирования, как неспецифической липазы, в содержимом тонких кишок, т. е. , способность гидролизовать липиды, относительно независимые по своей химической структуре и физическому состоянию (эмульгированные, мицеллы, растворенные), и, не обязательно, обладающие одним или несколькими из следующих свойств, (d) способность гидролизовать триацилглицеролы с жирными кислотами с различной длиной цепи и различной степенью ненасыщенности, (е) способность гидролизовать также диацилглицерол, моноацилглицерол, сложные холестерилэфиры, лизофосфатилилацилглицерол и ретинил и другие сложные эфиры жирорастворимых витаминов, (f) способность гидролизовать в триацилглицероле не только сложноэфирные связи sn-1 (3), но также и сложноэфирные связи sn-2, (g) способность взаимодействовать не только с первичными, но так же и со вторичными солями желчи, (h) зависимость оптимальной активности от солей желчи, (i) устойчивость в том смысле, что содержимое желудка не будет влиять на каталитическую эффективность в сколько-нибудь заметной степени, (j) устойчивость к инактивации панкреатической протеазой, например трипсином, при условии, что присутствуют соли желчи, (k) способность связываться с гепарином или производными гепарина, например с гепаринсульфатом, (l) способность связываться с интерфазами липид-вода, (m) достаточная устойчивость, которая допускает линофилизацию, (n) устойчивость при смешении с составляющими пищи, такими как человеческое молоко или молочная смесь. С другой стороны, изобретение относится к молекуле нуклеиновой кислоты в соответствии с вышесказанным, при этом упомянутый вариант BSSL имеет остаток фенилаланина в своем С-концевом положении или содержит в С-концевой части последовательность Gln-Met-Pro, альтернативно содержит аминокислотную последовательность, представляемую как остатки 712-722 в SEQ ID NO:3 в своей С-концевой части. В контексте настоящего описания термин "С-концевое положение" означает положение заключительного С-концевого остатка, в то время как термин "С-концевая часть" следует понимать, как приблизительно 50 аминокислотных остатков, которые составляют С-концевое окончание варианта BSSL. Изобретение также относится к молекуле нуклеиновой кислоты в соответствии с вышесказанными, при этом упомянутый вариант BSSL содержит менее 16 повторяющихся единиц. В контексте настоящего описания термин "повторяющаяся единица" означает одну из повторяющихся единиц из 33 нуклеотидов каждая, которые указываются в списке последовательностей в SEQ ID NO: 1. В других аспектах изобретение относится к молекуле нуклеиновой кислоты в соответствии с вышесказанным, которая кодирует полипептид, аминокислотная последовательность которого по крайней мере на 90% гомологична с аминокислотой последовательностью, показанной как SEQ ID NO:5, 6 или 9 в списке последовательностей, так же, как и к молекуле нуклеиновой кислоты, которая кодирует полипептид, аминокислотная последовательность которого по крайней мере на 90% гомологична аминокислотной последовательности, показанной как SEQ ID NO: 7 в списке последовательностей, за исключением тех молекул нуклеиновых кислот, которые кодируют полипептиды, которые имеют остаток аспарагина в положении 187. Изобретение также относится к полипептиду, выявленному как SEQ ID NO:5, 6, 7 или 9 в списке последовательностей, так же как и к полипептиду, кодируемому аминокислотной последовательностью, как упоминается выше. Изобретение также относится к гибридному гену, содержащему молекулу нуклеиновой кислоты, в соответствии с вышеупомянутым, к вектору воспроизводимой экспрессии, содержащему такой гибридный ген, и к клетке, несущей такой гибридный ген. Эта клетка может быть прокариотной клеткой, одноклеточным эукариотным организмом или клеткой, происходящей от многоклеточного организма, например от млекопитающего. В контексте настоящего описания термин "гибридный ген" означает последовательность нуклеиновых кислот, содержащую, с одной стороны, последовательность нуклеиновой кислоты, кодирующую вариант BSSL, как определяется выше, и с другой стороны последовательность нуклеиновой кислоты гена, который способен посредничать в экспрессии продукта гибридного гена. Термин "ген" обозначает полный ген, как и его субпоследовательность, которые способны посредничать и нацеливать экспрессию гибридного гена в ткани, представляющей интерес. Обычно упомянутая субпоследовательность представляет собой субпоследовательность, которая включает один или несколько промоторных участков, сайт инициации транскрипции, 3' и 5'-некодирующие участки и структурные последовательности. Гибридный ген образуется, предпочтительно, вставкой in vitro последовательности нуклеиновой кислоты, кодирующей вариант BSSL, в ген, способный посредничать в экспрессии, с применением технических приемов, известных в технике. С другой стороны, последовательность нуклеиновой кислоты, кодирующая вариант BSSL, может быть вставлена in vivo путем гомологической рекомбинации. В контексте настоящего описания термин "воспроизводимый" означает, что вектор способен реплицироваться в данном типе клетки-хозяина, в которую он введен. Непосредственно в обратном направлении последовательности нуклеиновой кислоты может быть получена последовательность, кодирующая сигнальный пептид, присутствие которого обеспечивает секрецию варианта BSSL, экспрессированного клетками-хозяевами, несущими вектор. Сигнальная последовательность может представлять собой последовательность, естественно ассоциируемую с последовательностью нуклеиновой кислоты или другого происхождения. Вектор может представлять собой любой вектор, который можно удобно подвергнуть технологии рекомбинатных ДНК, и выбор вектора часто будет зависеть от клетки-хозяина, в которую он должен быть введен. Таким образом, вектор может представлять собой автономно реплицирующийся вектор, т.е. вектор, который существует как внехромосомный объект, репликация которого не зависит от хромосомной репликации, примерами такого вектора являются плазмида, фаг, космида, минихромосома или вирус. С другой стороны, вектор может представлять собой вектор, который, когда вводится в клетку-хозяина, интегрируется с геном клетки-хозяина и реплицируется вместе с хромосомой (хромосомами), с которой он объединен. Примерами подходящих векторов являются вектор бактериальной экспрессии и вектор экспрессии дрожжей. Вектор настоящего изобретения может нести любую из последовательностей нуклеиновых кислот по изобретению, о которых упоминалось выше. С другой стороны, изобретение относится к способу продуцирования рекомбинатного полипептида, причем упомянутый способ включает (i) вставку молекулы нуклеиновой кислоты, упоминающейся выше, в гибридный ген, который способен реплицироваться в специфической клетке-хозяине или организме; (ii) введение получающегося в результате рекомбинатного гибридного гена в клетку-хозяина или организм; (iii) выращивание образующейся в результате клетки в или на культуральной среде, или идентифицирование и репродуцирование организма для экспрессии полипептида; и (iv) извлечение полипептида. Среда, используемая для выращивания клеток, может быть любой обычной средой, подходящей для этой цели. Подходящим вектором может быть любой вектор из описанных выше, и соответствующая клетка-хозяин может быть любой из типа клеток, описанных выше. Способы, используемые для конструирования вектора и осуществления введения его в клетку-хозяина, могут быть любыми из известных методов, применяемых для этих целей в технологии рекомбинатных ДНК. Вариант рекомбинатной человеческой BSSL, экспрессированный клетками, может быть секретирован, т. е. транспортирован через клеточную мембрану, способом, зависящим от типа клетки и состава вектора. Если вариант BSSL продуцируется внутриклеточно рекомбинатным хозяином, т. е. он клеткой не секретируется, он может быть извлечен стандартными процедурами, включающими разрушение клетки механическими способами, например ультразвуком или гомогенизацией, или ферментами или химическими способами с последующей очисткой. В целях секреции последовательности ДНК, кодирующей вариант BSSL, должна предшествовать последовательность, кодирующая сигнальный пептид, присутствие которого обеспечивает секрецию варианта BSSL из клеток таким образом, что по крайней мере значительная часть экспрессированного варианта BSSL секретируется в культуральную среду и извлекается. Изобретение также относится к системе экспрессии, содержащей гибридный ген, который экспрессируется в клетке-хозяине или организме-хозяине, несущих упомянутый гибридный ген, так что рекомбинатный полипептид продуцируется, когда экспрессируется гибридный ген, причем упомянутый гибридный ген продуцируется посредством вставки последовательности нуклеиновой кислоты, упомянутой выше, в ген, способный посредничать в экспрессии упомянутого гибридного гена. Возможным способом получения варианта рекомбинатной BSSL по изобретению является способ с использованием трансгенных, не принадлежащих к человеку, млекопитающих, способных выделять вариант BSSL в свое молоко. Использование трансгенных, не относящихся к человеку, млекопитающих имеет то преимущество, что можно получать большой выход варианта рекомбинатной BSSL при разумной стоимости, и особенно то, что, когда не относящимся к человеку млекопитающим является корова, вариант рекомбинатной BSSL продуцируется в молоке, которое является естественной составляющей, например, детского питания, так что не требуется дорогостоящей очистки, когда вариант рекомбинатной BSSL должен использоваться в качестве питательной добавки к продуктам на основе молока. Кроме того, продуцирование в высшем организме, таком как не принадлежащее к человеку млекопитающее, естественно, ведет к правильному процессингу белка млекопитающего, например, в отношении посттрансляционного процессинга, как обсуждается выше, и к надлежащей складчатости. Также можно получить большое количество, по существу, чистого варианта BSSL. Соответственно система экспрессии, отнесенная к вышеупомянутой, может представлять собой систему экспрессии у млекопитающего, содержащую последовательность ДНК, кодирующую вариант BSSL, вставленную в ген, кодирующий белок молока не принадлежащего к человеку млекопитающего, с тем, чтобы образовать гибридный ген, который экспрессируется в молочной железе взрослой самки млекопитающего, несущей упомянутый гибридный ген. Молочная железа, как ткань экспрессии, и гены, кодирующие белки молока, вообще, рассматриваются как особенно подходящие для использования при производстве гетерологичных белков в трансгенных, не принадлежащих к человеку, млекопитающих, так как белки молока продуцируются естественно при высоком уровне экспрессии в молочной железе. Кроме того, молоко легко собирается и доступно в больших количествах. В связи с этим использование генов белка молока при продуцировании варианта рекомбинатной BSSL, имеет еще то преимущество, что он продуцируется в условиях, подобных условиям его естественного производства в смысле регуляции экспрессии и места продуцирования (молочная железа). Когда гибридный ген, упомянутый выше, используется в трансгенном млекопитающем, он, предпочтительно, содержит последовательность, кодирующую сигнальный пептид, с тем, чтобы создать возможность правильного секретирования гибридного генного продукта в молочной железе. Сигнальный пептид будет, как правило, представлять собой пептид, который обычно обнаруживается в гене молочного белка, о котором идет речь, или пептид, ассоциированный с последовательностью ДНК, кодирующей вариант BSSL. Однако другие сигнальные последовательности, способные посредничать в секреции продукта гибридного гена в молочную железу, также являются уместными. Конечно, различные элементы гибридного гена должны сливаться таким образом, чтобы создать возможность для правильной экспрессии и процессинга генного продукта. Таким образом, последовательность ДНК, кодирующая сигнальный пептид отбора, должна быть точно слита с N-концевой частью последовательности ДНК, кодирующей вариант BSSL. В гибридном гене последовательность ДНК, кодирующая вариант BSSL, будет обычно содержать его стоп-кодон, но не расщепление своей собственной информации и сайт полиаденилирования. В прямом направлении последовательности ДНК, кодирующей вариант BSSL, процессинговые последовательности мРНК гена белка молока будут обычно сохраняться. Предполагается, что ряд факторов является ответственным за фактический уровень экспрессии определенного гибридного гена. Способность промотора, как и других регуляторных последовательностей, как упоминается выше, интеграция сайта системы экспрессии с геномом млекопитающего, интеграция сайта последовательности ДНК, кодирующей вариант BSSL, с геном, кодирующим белок молока, элементы, сообщающие посттранскрипциональную регуляцию, и другие подобные факторы могут представлять существенное значение для получаемого уровня экспрессии. На основе знаний о различных факторах, влияющих на уровень экспрессии гибридного гена, специалисту будет известно, как сконструировать систему экспрессии, подходящую для данной цели. Ген белка молока, который используется, может быть получен из того же вида, в котором должна размещаться система экспрессии, или он может быть получен от другого вида. В этой связи показано, что регуляторные элементы, которые нацеливают экспрессию гена в молочную железу, являются границами функционально перекрестных видов, что может происходить благодаря возможному общему предшественнику (Hennighausen et. al., 1990). Примеры подходящих генов, кодирующих белок молока или эффективные последовательности, которые используются при конструировании системы экспрессии настоящего изобретения, обычно находят среди белков молочной сыворотки, полученной от различных млекопитающих, например ген кислого белка молочной сыворотки (WAP), предпочтительно от мыши, и ген 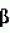 -лактоглубулина, предпочтительно происходящего от овцы. Найдено, что также гены казеина различного происхождения могут быть подходящими для трансгенного получения варианта BSSL, например коровий -лактоглубулина, предпочтительно происходящего от овцы. Найдено, что также гены казеина различного происхождения могут быть подходящими для трансгенного получения варианта BSSL, например коровий 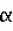 S1-казеин и кроличий S1-казеин и кроличий 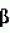 -казеин. Предпочтительным, в данном случае, геном является ген мышиного WAP, так как обнаружено, что он способен обеспечивать высокий уровень экспрессии ряда чужеродных человеческих белков в молоке различных трансгенных животных (Hennighausen et al., 1990). Другой последовательностью, предпочтительно взаимодействующей с системой экспрессии настоящего изобретения, является так называемая стабилизирующая экспрессию последовательность, способная посредничать в экспрессии высокого уровня. Существуют твердые указания, что такие стабилизирующие последовательности обнаруживаются около и в обратном направлении генов белков молока. В изобретение также включается способ продуцирования трансгенного, не принадлежащего к человеку, млекопитающего, способного экспрессировать вариант BSSL, включающий (а) введение вышеупомянутой системы экспрессии в оплодотворенную яйцеклетку или клетку эмбриона не принадлежащего к человеку млекопитающего с тем, чтобы включить систему экспрессии в зародыш млекопитающего, и (b) развитие получающихся в результате интродуцированных оплодотворенной яйцеклетки или эмбриона во взрослую самку млекопитающего, не принадлежащего к человеку. Включение системы экспрессии в зародыш млекопитающего может быть осуществлено с использованием подходящих технических приемов, описанных, например, в "Manipulating the Mouse Embryo", A laboratory Manual Cold Harbor Laboratory Press, 1986. Например, несколько сот молекул системы экспрессии могут быть введены непосредственно в оплодотворенную яйцеклетку, например в оплодотворенную одноклеточную яйцеклетку или в ее пронуклеус или в эмбрион отобранного млекопитающего, и микроинъецированные яйцеклетки затем переносят в яйцеводы псевдобеременных приемных матерей и оставляют развиваться. Способ продуцирования трансгенного, не принадлежащего к человеку млекопитающего, способного экспрессировать вариант BSSL, может также включать метод, при котором упомянутое млекопитающее, по существу, не способно экспрессировать BSSL из самого млекопитающего. Такой способ включает (а) разрушение способности экспрессирования BSSL млекопитающего таким образом, что BSSL млекопитающего, по существу, не экспрессируется, и введение вышеупомянутой системы экспрессии в зародыш млекопитающего так, что в млекопитающем экспрессируется вариант BSSL, и/или (b) замещение гена BSSL млекопитающего или его части на вышеупомянутую систему экспрессии. Способность экспрессирования BSSL млекопитающего может быть подходящим образом разрушена путем введения мутаций в последовательность ДНК, ответственную за экспрессию BSSL. Такие мутации могут включать мутации, которые выставляют последовательность ДНК из рамки, вводят стоп-кодон или осуществляют делецию одного или нескольких нуклеотидов из последовательности ДНК. Ген BSSL млекопитающего или его часть могут быть замещены системой экспрессии, определенной выше, или последовательностью ДНК, кодирующей вариант BSSL, путем использования хорошо известных принципов гомологичной рекомбинации. Важным аспектом изобретения является также трансгенное, не относящееся к человеку, млекопитающее, несущее в своем геноме последовательность ДНК, упомянутую выше. Упомянутая последовательность ДНК может присутствовать, предпочтительно, в зародыше млекопитающего и в гене белка молока млекопитающего. Трансгенное, не принадлежащее к человеку, млекопитающее может быть выбрано, предпочтительно, из группы, состоящий из мышей, крыс, кроликов, овец, свиней и крупного рогатого скота. В изобретение также включаются потомство упомянутого, не принадлежащего к человеку, млекопитающего, а также молоко, полученное от такого трансгенного, не принадлежащего к человеку, млекопитающего. Изобретение также относится к детской формуле (детскому питанию), содержащей вышеупомянутое молоко, и к детской формуле, содержащей вышеупомянутый вариант BSSL. Детская формула может быть получена с использованием обычных технических приемов и содержать любые необходимые добавки, такие как минеральные соли, витамины и т.п. Изобретение относится также к фармацевтической композиции, содержащей вышеупомянутый вариант BSSL, а также к применению такого варианта BSSL при лечении. В других аспектах, изобретение относится к применению вышеупомянутого варианта BSSL для производства лекарственных препаратов для лечения патологического состояния, относящегося к экзокринной недостаточности поджелудочной железы, муковисцидозу, хроническому панкреатиту, жировой малабсорбции, малабсорбции жирорастворимых витаминов, жировой малабсорбции вследствие физиологических причин. Изобретение также относится к применению варианта BSSL для производства лекарственных препаратов для улучшения усвоения пищевых липидов, в особенности, недоношенными детьми. Примеры 1. Экспрессия рекомбинатной BSSL в эукариотных и прокариотных клетках 1.1. Методики экспериментов 1.1.1. Рекомбинатные плазмиды Плазмиду рS 146, содержащую кДНК человеческой BSSL с 2,3 т.п.о., клонированную в рUC 19, переваривают с Hind III и Sal I, и кДНК BSSL вводят в вектор экспрессии вируса папилломы коровы (BPV) pS 147 (фиг.1). Этот вектор содержит кДНК человеческой BSSL под контролем энхансера - мышиного металлотионеина 1 (mМТ-1) и промоторного элемента (Povlakis & Hamer, 1983). Сигналы процессинга мРНК обеспечиваются геномным фрагментом, содержащим часть экзона II, интрона II, экзона III, и в прямом направлении элементы гена кроличьего -казеин. Предпочтительным, в данном случае, геном является ген мышиного WAP, так как обнаружено, что он способен обеспечивать высокий уровень экспрессии ряда чужеродных человеческих белков в молоке различных трансгенных животных (Hennighausen et al., 1990). Другой последовательностью, предпочтительно взаимодействующей с системой экспрессии настоящего изобретения, является так называемая стабилизирующая экспрессию последовательность, способная посредничать в экспрессии высокого уровня. Существуют твердые указания, что такие стабилизирующие последовательности обнаруживаются около и в обратном направлении генов белков молока. В изобретение также включается способ продуцирования трансгенного, не принадлежащего к человеку, млекопитающего, способного экспрессировать вариант BSSL, включающий (а) введение вышеупомянутой системы экспрессии в оплодотворенную яйцеклетку или клетку эмбриона не принадлежащего к человеку млекопитающего с тем, чтобы включить систему экспрессии в зародыш млекопитающего, и (b) развитие получающихся в результате интродуцированных оплодотворенной яйцеклетки или эмбриона во взрослую самку млекопитающего, не принадлежащего к человеку. Включение системы экспрессии в зародыш млекопитающего может быть осуществлено с использованием подходящих технических приемов, описанных, например, в "Manipulating the Mouse Embryo", A laboratory Manual Cold Harbor Laboratory Press, 1986. Например, несколько сот молекул системы экспрессии могут быть введены непосредственно в оплодотворенную яйцеклетку, например в оплодотворенную одноклеточную яйцеклетку или в ее пронуклеус или в эмбрион отобранного млекопитающего, и микроинъецированные яйцеклетки затем переносят в яйцеводы псевдобеременных приемных матерей и оставляют развиваться. Способ продуцирования трансгенного, не принадлежащего к человеку млекопитающего, способного экспрессировать вариант BSSL, может также включать метод, при котором упомянутое млекопитающее, по существу, не способно экспрессировать BSSL из самого млекопитающего. Такой способ включает (а) разрушение способности экспрессирования BSSL млекопитающего таким образом, что BSSL млекопитающего, по существу, не экспрессируется, и введение вышеупомянутой системы экспрессии в зародыш млекопитающего так, что в млекопитающем экспрессируется вариант BSSL, и/или (b) замещение гена BSSL млекопитающего или его части на вышеупомянутую систему экспрессии. Способность экспрессирования BSSL млекопитающего может быть подходящим образом разрушена путем введения мутаций в последовательность ДНК, ответственную за экспрессию BSSL. Такие мутации могут включать мутации, которые выставляют последовательность ДНК из рамки, вводят стоп-кодон или осуществляют делецию одного или нескольких нуклеотидов из последовательности ДНК. Ген BSSL млекопитающего или его часть могут быть замещены системой экспрессии, определенной выше, или последовательностью ДНК, кодирующей вариант BSSL, путем использования хорошо известных принципов гомологичной рекомбинации. Важным аспектом изобретения является также трансгенное, не относящееся к человеку, млекопитающее, несущее в своем геноме последовательность ДНК, упомянутую выше. Упомянутая последовательность ДНК может присутствовать, предпочтительно, в зародыше млекопитающего и в гене белка молока млекопитающего. Трансгенное, не принадлежащее к человеку, млекопитающее может быть выбрано, предпочтительно, из группы, состоящий из мышей, крыс, кроликов, овец, свиней и крупного рогатого скота. В изобретение также включаются потомство упомянутого, не принадлежащего к человеку, млекопитающего, а также молоко, полученное от такого трансгенного, не принадлежащего к человеку, млекопитающего. Изобретение также относится к детской формуле (детскому питанию), содержащей вышеупомянутое молоко, и к детской формуле, содержащей вышеупомянутый вариант BSSL. Детская формула может быть получена с использованием обычных технических приемов и содержать любые необходимые добавки, такие как минеральные соли, витамины и т.п. Изобретение относится также к фармацевтической композиции, содержащей вышеупомянутый вариант BSSL, а также к применению такого варианта BSSL при лечении. В других аспектах, изобретение относится к применению вышеупомянутого варианта BSSL для производства лекарственных препаратов для лечения патологического состояния, относящегося к экзокринной недостаточности поджелудочной железы, муковисцидозу, хроническому панкреатиту, жировой малабсорбции, малабсорбции жирорастворимых витаминов, жировой малабсорбции вследствие физиологических причин. Изобретение также относится к применению варианта BSSL для производства лекарственных препаратов для улучшения усвоения пищевых липидов, в особенности, недоношенными детьми. Примеры 1. Экспрессия рекомбинатной BSSL в эукариотных и прокариотных клетках 1.1. Методики экспериментов 1.1.1. Рекомбинатные плазмиды Плазмиду рS 146, содержащую кДНК человеческой BSSL с 2,3 т.п.о., клонированную в рUC 19, переваривают с Hind III и Sal I, и кДНК BSSL вводят в вектор экспрессии вируса папилломы коровы (BPV) pS 147 (фиг.1). Этот вектор содержит кДНК человеческой BSSL под контролем энхансера - мышиного металлотионеина 1 (mМТ-1) и промоторного элемента (Povlakis & Hamer, 1983). Сигналы процессинга мРНК обеспечиваются геномным фрагментом, содержащим часть экзона II, интрона II, экзона III, и в прямом направлении элементы гена кроличьего 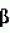 -глобина. Эту единицу транскрипции клонируют в вектор, содержащий полный геном BPV. Транскрипция является однонаправленной для BPV и для единицы транскрипции BSSL. Для размножения вектора в Е.coli вектор содержит рМL 2d производное рВR 322 (Salver et. al, 1982). Вектор экспрессии рS котрансфецируют вектором, кодирующим ген устойчивости к неомицину, произведенному 5'-длинным концевым повтором вируса саркомы Харвея и сигналами полиаденилирования обезьяньего вируса 40 (Lusky & Botchan? 1984). Для экспрессии BSSL в Е.coli кДНК субклонируют как фрагмент Ndel I-Bam HI из плазмиды рT7-7 (Ausubel et.al., 1992) в плазмиду рGEMEX-1 (Promega, Madison, WI, USA (Studier & Moffat, 1986). Этой процедурой клонирования кодирующую последовательность гена 10 Т7 замещают геном BSSL, кодирующим зрелый белок, предшествующий иницирующему кодону. Окончательный вектор экспрессии, рGEMEX/BSSL, подтверждается расшифровкой последовательности ДНК с использованием внутренних праймеров специфичной BSSL. 1.1.2. Мутагенез Нуклеотидный номер 1 присваивается А в инициирующем кодоне ATG. Для нумерации аминокислот первый метионин в сигнальном пептиде является 23, и первый аминокислотный остаток зрелого белка - аланин - снабжается номером 1. Для конструирования варианта делеции А (SEQ ID NO:4) синтезируется два праймера PCR-PCR-1 и PCR-2 (табл.1). Для клонирования в различных плазмидах создают сайты Нind III, Sal I и Bam HI. Сайт Bcl I генерируют в последовательности BSSL без изменения аминокислотной последовательности. Это делается для облегчения добавления синтетической ДНК для получения других вариантов. Праймер PCR-2 содержит два синтетических стоп-кодона. Получающиеся в результате фрагменты PCR переваривают Bam HI и Hind III и клоинируют в рUС18 для анализа последовательности. Эту плазмиду обозначают рS157. Правильный фрагмент РСR вставляют в вектор экспрессии ВРV путем слияния с последовательностью в уникальном сайте АSр700 (положение 1405 в кДНК BSSL), и в сайте Sal I перед фрагментом гена -глобина. Эту единицу транскрипции клонируют в вектор, содержащий полный геном BPV. Транскрипция является однонаправленной для BPV и для единицы транскрипции BSSL. Для размножения вектора в Е.coli вектор содержит рМL 2d производное рВR 322 (Salver et. al, 1982). Вектор экспрессии рS котрансфецируют вектором, кодирующим ген устойчивости к неомицину, произведенному 5'-длинным концевым повтором вируса саркомы Харвея и сигналами полиаденилирования обезьяньего вируса 40 (Lusky & Botchan? 1984). Для экспрессии BSSL в Е.coli кДНК субклонируют как фрагмент Ndel I-Bam HI из плазмиды рT7-7 (Ausubel et.al., 1992) в плазмиду рGEMEX-1 (Promega, Madison, WI, USA (Studier & Moffat, 1986). Этой процедурой клонирования кодирующую последовательность гена 10 Т7 замещают геном BSSL, кодирующим зрелый белок, предшествующий иницирующему кодону. Окончательный вектор экспрессии, рGEMEX/BSSL, подтверждается расшифровкой последовательности ДНК с использованием внутренних праймеров специфичной BSSL. 1.1.2. Мутагенез Нуклеотидный номер 1 присваивается А в инициирующем кодоне ATG. Для нумерации аминокислот первый метионин в сигнальном пептиде является 23, и первый аминокислотный остаток зрелого белка - аланин - снабжается номером 1. Для конструирования варианта делеции А (SEQ ID NO:4) синтезируется два праймера PCR-PCR-1 и PCR-2 (табл.1). Для клонирования в различных плазмидах создают сайты Нind III, Sal I и Bam HI. Сайт Bcl I генерируют в последовательности BSSL без изменения аминокислотной последовательности. Это делается для облегчения добавления синтетической ДНК для получения других вариантов. Праймер PCR-2 содержит два синтетических стоп-кодона. Получающиеся в результате фрагменты PCR переваривают Bam HI и Hind III и клоинируют в рUС18 для анализа последовательности. Эту плазмиду обозначают рS157. Правильный фрагмент РСR вставляют в вектор экспрессии ВРV путем слияния с последовательностью в уникальном сайте АSр700 (положение 1405 в кДНК BSSL), и в сайте Sal I перед фрагментом гена  -глобина, получая в результате рS257. Конструкцию В-варината (SEQ ID NO:5) создают, используя олигонуклеотиды с номерами 3, 4, 7 и 8 (табл. 1). Гибридизованные олигонуклеотиды кодируют самую С-концевую аминокислотную последовательность, представляющую в белке полной длины часть с лизина 712 по фенилаланин 722. Этот фрагмент сливают с глутаминов 535. Конец трансляции вставляют прямо после последнего фенилаланина. Фрагмент содержит сайт Bcl I в 5'-окончании и сайт Sal I в 3'-окончании, допуская интропродукцию в рS157. Получающую в результате плазмиду переваривают с Asp700 и Sal I, и фрагмент 313 т.п.о. вставляют в вектор экспрессии, как описано выше. Получающуюся в результате плазмиду обозначают рS258. В табл. 1 приведены синтетические олигонуклеотиды, используемые для конструирования вариантов BSSL. Нуклеотиды сайтов рестрикции подчеркнуты. Стоп-сигналы трансляции указываются жирными буквами. Измененный кодон в варианте N указывается в PCR-3 жирными буквами и звездочкой. Чтобы сконструировать ген, кодирующий С-вариант (SEG ID NO:6), используют олигонуклеотиды с 1 по 6 (табл. 1). Фрагмент гибридизованной ДНК содержит два повторения, кодирующих одиннадцать аминокислот, идентичные консенсусу (Nilsson et al., 1990), вставляемых между глутамином 535 и последовательностью с лизина 712 по фенилаланин 722. Этот фрагмент содержит также сайт Bcl I в 5'-окончании и сайт Sal I в 3'-окончании, создавая условия для такой же стратегии клонирования, которая описана выше. Получающаяся в результате плазмида обозначается рS259. Для конструирования варианта N (вариант не N-гликозилированный, SEQ ID NO: 7) синтезируют два праймера PCR (PCR-3 и PCR-4 в табл. 1). Создают сайты EcoR I и Bam Н1 для клонирования продукта PCR в 360 т.п.о. в рUС19 для анализа последовательности. Сайт потенциального N-связанного гликозилирования в аспарагине 187 заменяют на глутамин. Модифицированную последовательность выделяют как фрагмент Bal I - Hind III и клонируют в Sal I и Hind III расщепленную pUC19 вместе с Sac I и Bal I фрагментом, содержащим промотор mMT-1 и 5'-окончание кДНК BSSL. Из этой плазмиды выделяют фрагмент Sac I - Dra III приблизительно в 1,2 т.п.о. и вставляют в элемент mMT-1 и последовательность кДНК BSSL соответственно в вектор экспрессии. Получающуюся в результате плазмиду обозначают рS299. 1.1.3. Культура клеток млекопитающего и трансфекции Векторы котрансфецируют в клеточную линию мышей С127 (ATCC CRL 1616) в соответствии со способом осаждения фосфатом кальция (Graham & Van der Eb, 1973). Клетки С127 выращивают в смеси Ham's F12 и модифицированной по способу Дульбекко среды Игла (DМЕМ) (1:1) с добавлением 10% фетальной телячьей сыворотки. Отбирают клоны клеток, устойчивых к неомицину, с 1,5 мг х мл-1 G 418, и через 10-15 дней выделяют клоны устойчивых клеток из мастер-планшетов и берут на анализ. 1.1.4. Бактериальные штаммы и условия культивирования Для экспериментов по экспрессии вектор pGEMEX/В трансформируют в штаммы Е.coli JМ109(DЕ3) и ВL 21 (DE3) рLys S. Эксперименты по экспрессии выполняют так, как описано в Studier et al. (1986). После сбора бактерий клетки осаждают центрифугированием (5000 х g в течение 10 мин при 4oС). Для получения фракций периплазмы и цитоплазмы осадок ресуспендируют в 4 мл Трис-Cl с 20% сахарозы, рН 8,0, 200 мкл 0,1 М ЭДТК и 40 мкл лизоцима (15 мг/мл в воде) на грамм клеточного осадка. Суспензию инкубируют на льду в течение 40 минут. Добавляют 160 мкл 0,5 М МgСl на грамм осадка, после чего суспензию центрифугируют при 12000 х g. Образующийся в результате супернатант содержит белки периплазмы, и осадок представляет собой цитоплазменную фракцию. С другой стороны, для получения растворимых белков клетки суспендируют в 40 мМ Трис-Cl, 0,1 мМ ЭДТК, 0,5 мМ фенилметилсульфонилфторида, рН 8,2, замораживают-оттаивают и разрушают ультразвуком в течение некоторого времени, чтобы вызвать лизис. Клеточный лизат центрифугируют (30000 х g в течение 30 мин при 25oС). 1.1.5. Анализ нуклеиновых кислот РНК и ДНК получают из изолированных клеточных линий млекопитающего или из клеток Е.соli (Ausubel et al., 1992). РНК и ДНК фракционируют на агарозных гелях и блотируют на GeneScreen Plus (New England Nuclear), гибридизируют в соответствии с указаниями поставщика. 1.1.6. Получение нативного фермента Стимулируемую солями желчи липазу очищают от человеческого молока, как описано ранее ( -глобина, получая в результате рS257. Конструкцию В-варината (SEQ ID NO:5) создают, используя олигонуклеотиды с номерами 3, 4, 7 и 8 (табл. 1). Гибридизованные олигонуклеотиды кодируют самую С-концевую аминокислотную последовательность, представляющую в белке полной длины часть с лизина 712 по фенилаланин 722. Этот фрагмент сливают с глутаминов 535. Конец трансляции вставляют прямо после последнего фенилаланина. Фрагмент содержит сайт Bcl I в 5'-окончании и сайт Sal I в 3'-окончании, допуская интропродукцию в рS157. Получающую в результате плазмиду переваривают с Asp700 и Sal I, и фрагмент 313 т.п.о. вставляют в вектор экспрессии, как описано выше. Получающуюся в результате плазмиду обозначают рS258. В табл. 1 приведены синтетические олигонуклеотиды, используемые для конструирования вариантов BSSL. Нуклеотиды сайтов рестрикции подчеркнуты. Стоп-сигналы трансляции указываются жирными буквами. Измененный кодон в варианте N указывается в PCR-3 жирными буквами и звездочкой. Чтобы сконструировать ген, кодирующий С-вариант (SEG ID NO:6), используют олигонуклеотиды с 1 по 6 (табл. 1). Фрагмент гибридизованной ДНК содержит два повторения, кодирующих одиннадцать аминокислот, идентичные консенсусу (Nilsson et al., 1990), вставляемых между глутамином 535 и последовательностью с лизина 712 по фенилаланин 722. Этот фрагмент содержит также сайт Bcl I в 5'-окончании и сайт Sal I в 3'-окончании, создавая условия для такой же стратегии клонирования, которая описана выше. Получающаяся в результате плазмида обозначается рS259. Для конструирования варианта N (вариант не N-гликозилированный, SEQ ID NO: 7) синтезируют два праймера PCR (PCR-3 и PCR-4 в табл. 1). Создают сайты EcoR I и Bam Н1 для клонирования продукта PCR в 360 т.п.о. в рUС19 для анализа последовательности. Сайт потенциального N-связанного гликозилирования в аспарагине 187 заменяют на глутамин. Модифицированную последовательность выделяют как фрагмент Bal I - Hind III и клонируют в Sal I и Hind III расщепленную pUC19 вместе с Sac I и Bal I фрагментом, содержащим промотор mMT-1 и 5'-окончание кДНК BSSL. Из этой плазмиды выделяют фрагмент Sac I - Dra III приблизительно в 1,2 т.п.о. и вставляют в элемент mMT-1 и последовательность кДНК BSSL соответственно в вектор экспрессии. Получающуюся в результате плазмиду обозначают рS299. 1.1.3. Культура клеток млекопитающего и трансфекции Векторы котрансфецируют в клеточную линию мышей С127 (ATCC CRL 1616) в соответствии со способом осаждения фосфатом кальция (Graham & Van der Eb, 1973). Клетки С127 выращивают в смеси Ham's F12 и модифицированной по способу Дульбекко среды Игла (DМЕМ) (1:1) с добавлением 10% фетальной телячьей сыворотки. Отбирают клоны клеток, устойчивых к неомицину, с 1,5 мг х мл-1 G 418, и через 10-15 дней выделяют клоны устойчивых клеток из мастер-планшетов и берут на анализ. 1.1.4. Бактериальные штаммы и условия культивирования Для экспериментов по экспрессии вектор pGEMEX/В трансформируют в штаммы Е.coli JМ109(DЕ3) и ВL 21 (DE3) рLys S. Эксперименты по экспрессии выполняют так, как описано в Studier et al. (1986). После сбора бактерий клетки осаждают центрифугированием (5000 х g в течение 10 мин при 4oС). Для получения фракций периплазмы и цитоплазмы осадок ресуспендируют в 4 мл Трис-Cl с 20% сахарозы, рН 8,0, 200 мкл 0,1 М ЭДТК и 40 мкл лизоцима (15 мг/мл в воде) на грамм клеточного осадка. Суспензию инкубируют на льду в течение 40 минут. Добавляют 160 мкл 0,5 М МgСl на грамм осадка, после чего суспензию центрифугируют при 12000 х g. Образующийся в результате супернатант содержит белки периплазмы, и осадок представляет собой цитоплазменную фракцию. С другой стороны, для получения растворимых белков клетки суспендируют в 40 мМ Трис-Cl, 0,1 мМ ЭДТК, 0,5 мМ фенилметилсульфонилфторида, рН 8,2, замораживают-оттаивают и разрушают ультразвуком в течение некоторого времени, чтобы вызвать лизис. Клеточный лизат центрифугируют (30000 х g в течение 30 мин при 25oС). 1.1.5. Анализ нуклеиновых кислот РНК и ДНК получают из изолированных клеточных линий млекопитающего или из клеток Е.соli (Ausubel et al., 1992). РНК и ДНК фракционируют на агарозных гелях и блотируют на GeneScreen Plus (New England Nuclear), гибридизируют в соответствии с указаниями поставщика. 1.1.6. Получение нативного фермента Стимулируемую солями желчи липазу очищают от человеческого молока, как описано ранее ( 1981). Очищенный препарат является гомогенным, судя по SDS - PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия), и имеет специфическую активность в 100 мкмоль выделенных жирных кислот х мин-1 и мг-1, когда испытывается с длинноцепным триацилглицеролом в качестве субстрата. 1.1.7. Ферментный анализ Ферментный анализ проводят как описано в ( 1981). Очищенный препарат является гомогенным, судя по SDS - PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия), и имеет специфическую активность в 100 мкмоль выделенных жирных кислот х мин-1 и мг-1, когда испытывается с длинноцепным триацилглицеролом в качестве субстрата. 1.1.7. Ферментный анализ Ферментный анализ проводят как описано в ( 1981), используя в качестве субстрата триолеин, эмульгированный с аравийской камедью. Инкубацию выполняют с 10 мМ холата натрия в качестве активирующей соли желчи. Когда проверяют зависимость от соли желчи, соли желчи (холат натрия или дезоксихолат натрия, Sigma Chem. Co) добавляют до концентраций, данных на фиг. 3. 1.1.8. Вестерн-блоттинг Для получения важных реакций в блоттинг-экспериментах кондиционные среды концентрируют хроматографией на сефарозе Blue (Pharmacia LKB Biotechnology). Соответствующие среды смешивают с сефарозой (приблизительно 10 мл среды на 1 мл геля). Гель промывают (10 мл на 1 мл геля) 0,5 М буфером Трис-Cl, pН 7,4, содержащим 0,1 М KCl. Ферментную активность оценивают в том же буфере с 1,5 М KCl. По этой процедуре получают 25-30-кратную концентрацию, так же, как и 3-5-кратную очистку. SDS-PAGE выполняют на 10% полиакриламидных гелях в соответствии, по существу, с Laemmli (1970). После переноса в нитроцеллюлозные мембраны и инкубации с поликлональной кроличьей антисывороткой к очищенной ВSSL осуществляют определение, используя козий антикроличий IgG, конъюгированный с щелочной фосфатазой и проявляющий набор от Вiо-Rad. 1.1.9. Обработка N-гликозидазой F K 10 мкл варианта В, содержащим активность ВSSL в 2,5 мкмоль выделенных жирных кислот х мин-1, добавляют 1 мкл 1 М 1981), используя в качестве субстрата триолеин, эмульгированный с аравийской камедью. Инкубацию выполняют с 10 мМ холата натрия в качестве активирующей соли желчи. Когда проверяют зависимость от соли желчи, соли желчи (холат натрия или дезоксихолат натрия, Sigma Chem. Co) добавляют до концентраций, данных на фиг. 3. 1.1.8. Вестерн-блоттинг Для получения важных реакций в блоттинг-экспериментах кондиционные среды концентрируют хроматографией на сефарозе Blue (Pharmacia LKB Biotechnology). Соответствующие среды смешивают с сефарозой (приблизительно 10 мл среды на 1 мл геля). Гель промывают (10 мл на 1 мл геля) 0,5 М буфером Трис-Cl, pН 7,4, содержащим 0,1 М KCl. Ферментную активность оценивают в том же буфере с 1,5 М KCl. По этой процедуре получают 25-30-кратную концентрацию, так же, как и 3-5-кратную очистку. SDS-PAGE выполняют на 10% полиакриламидных гелях в соответствии, по существу, с Laemmli (1970). После переноса в нитроцеллюлозные мембраны и инкубации с поликлональной кроличьей антисывороткой к очищенной ВSSL осуществляют определение, используя козий антикроличий IgG, конъюгированный с щелочной фосфатазой и проявляющий набор от Вiо-Rad. 1.1.9. Обработка N-гликозидазой F K 10 мкл варианта В, содержащим активность ВSSL в 2,5 мкмоль выделенных жирных кислот х мин-1, добавляют 1 мкл 1 М 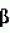 -меркаптоэтанола и 0,5 мкл 10% (м/о) SDS. После кипячения в течение 5 мин добавляют 10 мкл Na-фосфатного буфера, рН 8,0, 6 мкл 0,1 М ЭДТК, 4 мкл 7,5% (м/о) нонидета P 40 и 5 мкл (1E) N-гликозидазы F (Boehringer, Mannheim). Для контроля обрабатывают идентично такое же количество варианта В, за исключением того, что гликозидазу не добавляют. После инкубации в течение ночи при 37oС образцы прогоняют на SDS-PAGE и блотируют, используя поликлональную кроличью антисыворотку BSSL. 1.2. Результаты 1.2.1. Конструирование вариантов в BSSL Модификации вариантов BSSL по отношению к BSSL с полной длиной суммируются в табл. 2 и на фиг. 1. Стратегия, применяемая для генерации этих вариантов, описывается в разделе 1.1. Для варианта А (SEQ ID NO:4) вводят стоп-кодон после глутамина в положении 535, удаляя, тем самым, последние 187 аминокислот белка полной длины. Для варианта В (SEQ ID NO:5) домен, кодирующий 11 самых С-концевых аминокислот, и первоначальный трансляционный конец сливают с глутамином-535. Следовательно, этот вариант лишен всех повторов. Для варианта С SEQ ID NO:6) фрагмент, содержащий два повтора, имеющих последовательность, идентичную консенсусу (Nilsson et al., 1990), вставляют между глутамином-535 и последовательностью с лизина-712 по фенилаланин-722. Чтобы проанализировать важность единственной экспериментальной N-связанной углеводной структуры, расположенной около активного сайта серина-194, конструируют вариант. Вариант N (SEQ ID NO:7) получают путем перестройки сайта потенциального N-гликозилирования в аспарагине-187 в глутамин. Аминокислотные последовательности вариантов BSSL относительно последовательности человеческой BSSL приведены в табл. 2 (см. в конце описания). 1.2.2. Исследование рекомбинантной ДНК в клеточных линиях млекопитающего Образцы ДНК получают из клеточных линий, трансфецированных векторами экспрессии, кодирующими различные варианты BSSL. Полученные ДНК расщепляют Bam НI, фракционируют на агарозных гелях и переносят на мембраны для гибридизации. Используемым зондом является кДНК BSSL, меченая 32Р. Результаты гибридизации подтверждают присутствие рекомбинантных генов, а также то, что число копий вектора приблизительно одинаково в различных клеточных линиях (фиг. 2). Положения гибридизующихся фрагментов отражают различную длину последовательностей различных ВSSL и согласуются с ожидаемыми размерами. Положения подобны также ДНК, полученной из бактерий, используемой в эксперименте с трансфекцией, что указывает, что в клеточных линиях не происходит главной реаранжировки векторной ДНК (фиг. 2). Верхние сигналы гибридизации в образце ДНК, представляющем вариант А, существуют, вероятно, вследствие частичного расщепления. 1.2.3. Экспрессия мРНК для ВSSL полной длины и мутированной в клетках млекопитающего Чтобы проанализировать экспрессию различных рекомбинантных ВSSL, гены РНК получают из изолированных клеточных линий. Нозерн-блот-эксперименты и гибридизация с кДНК ВSSL, меченой 32Р, показывают, что рекомбинантную мРНК можно обнаружить во всех клеточных линиях, несущих вектор ВSSL (фиг. 3). Гибридизация не обнаруживается в контрольном образце, полученном из клеточной линии, содержащей идентичный вектор, за исключением кДНК BSSL (фиг. 3). Различная длина гибридизующихся мРНК находится в соответствии с модификациями кДНК. Уровни устойчивого состояния вариантов мРНК рекомбинантных ВSSL являются одинаковыми за исключением варианта А (фиг. 3). Причина уменьшенного накопления мРНК варианта А неизвестна, но ее наблюдают в двух популяциях клеточных линий, как и в изолированных клонах. Присутствие равных количеств РНК в различных образцах подтверждается гибридизацией с зондом к мышиному -меркаптоэтанола и 0,5 мкл 10% (м/о) SDS. После кипячения в течение 5 мин добавляют 10 мкл Na-фосфатного буфера, рН 8,0, 6 мкл 0,1 М ЭДТК, 4 мкл 7,5% (м/о) нонидета P 40 и 5 мкл (1E) N-гликозидазы F (Boehringer, Mannheim). Для контроля обрабатывают идентично такое же количество варианта В, за исключением того, что гликозидазу не добавляют. После инкубации в течение ночи при 37oС образцы прогоняют на SDS-PAGE и блотируют, используя поликлональную кроличью антисыворотку BSSL. 1.2. Результаты 1.2.1. Конструирование вариантов в BSSL Модификации вариантов BSSL по отношению к BSSL с полной длиной суммируются в табл. 2 и на фиг. 1. Стратегия, применяемая для генерации этих вариантов, описывается в разделе 1.1. Для варианта А (SEQ ID NO:4) вводят стоп-кодон после глутамина в положении 535, удаляя, тем самым, последние 187 аминокислот белка полной длины. Для варианта В (SEQ ID NO:5) домен, кодирующий 11 самых С-концевых аминокислот, и первоначальный трансляционный конец сливают с глутамином-535. Следовательно, этот вариант лишен всех повторов. Для варианта С SEQ ID NO:6) фрагмент, содержащий два повтора, имеющих последовательность, идентичную консенсусу (Nilsson et al., 1990), вставляют между глутамином-535 и последовательностью с лизина-712 по фенилаланин-722. Чтобы проанализировать важность единственной экспериментальной N-связанной углеводной структуры, расположенной около активного сайта серина-194, конструируют вариант. Вариант N (SEQ ID NO:7) получают путем перестройки сайта потенциального N-гликозилирования в аспарагине-187 в глутамин. Аминокислотные последовательности вариантов BSSL относительно последовательности человеческой BSSL приведены в табл. 2 (см. в конце описания). 1.2.2. Исследование рекомбинантной ДНК в клеточных линиях млекопитающего Образцы ДНК получают из клеточных линий, трансфецированных векторами экспрессии, кодирующими различные варианты BSSL. Полученные ДНК расщепляют Bam НI, фракционируют на агарозных гелях и переносят на мембраны для гибридизации. Используемым зондом является кДНК BSSL, меченая 32Р. Результаты гибридизации подтверждают присутствие рекомбинантных генов, а также то, что число копий вектора приблизительно одинаково в различных клеточных линиях (фиг. 2). Положения гибридизующихся фрагментов отражают различную длину последовательностей различных ВSSL и согласуются с ожидаемыми размерами. Положения подобны также ДНК, полученной из бактерий, используемой в эксперименте с трансфекцией, что указывает, что в клеточных линиях не происходит главной реаранжировки векторной ДНК (фиг. 2). Верхние сигналы гибридизации в образце ДНК, представляющем вариант А, существуют, вероятно, вследствие частичного расщепления. 1.2.3. Экспрессия мРНК для ВSSL полной длины и мутированной в клетках млекопитающего Чтобы проанализировать экспрессию различных рекомбинантных ВSSL, гены РНК получают из изолированных клеточных линий. Нозерн-блот-эксперименты и гибридизация с кДНК ВSSL, меченой 32Р, показывают, что рекомбинантную мРНК можно обнаружить во всех клеточных линиях, несущих вектор ВSSL (фиг. 3). Гибридизация не обнаруживается в контрольном образце, полученном из клеточной линии, содержащей идентичный вектор, за исключением кДНК BSSL (фиг. 3). Различная длина гибридизующихся мРНК находится в соответствии с модификациями кДНК. Уровни устойчивого состояния вариантов мРНК рекомбинантных ВSSL являются одинаковыми за исключением варианта А (фиг. 3). Причина уменьшенного накопления мРНК варианта А неизвестна, но ее наблюдают в двух популяциях клеточных линий, как и в изолированных клонах. Присутствие равных количеств РНК в различных образцах подтверждается гибридизацией с зондом к мышиному  -актину (фиг. 3, нижний снимок). 1.2.4. Получение ВSSL полной длины и вариантов ВSSL в клетках млекопитающего Среды из отдельных клонов клеток С127, трансфецированных ВSSL полной длины и ВSSL различных мутированных форм, собирают и испытывают на активность ВSSL (фиг. 4). Для молекулы полной длины и вариантов N, В и С активность в клонах с наивысшей экспрессией лежит в интервале от 0,7 до 2,3 мкмоль выделенных жирных кислот х мин-1 х(мл среды)-1. Для специфичной активности, сравнимой с активностью нативной В молока, это будет соответствовать уровню экспрессии 7-23 мкг х (мл среды)-1. Для варианта А все анализированные клоны имеют активность ниже 0,05 мкмоль выделенных жирных кислот х мин-1 и (мл среды)-1. Концентрация сефарозы Blue и лиофилизация клона, демонстрирующего наивысшую активность, показывают, что активный фермент в самом деле экспрессируется, хотя с очень низким уровнем. Вероятность, что низкая активность, полученная для варианта А, частично может быть объяснена значительно более низкой специфической активностью, не может быть исключена. Вестерн-блоты клонов различных экспериментов с трансфекцией приводятся на фиг. 5А. Как и ожидалось, существуют явные Mr вариантов BSSL. Однако следует отметить, что для BSSL полной длины, как и для вариантов В и С, получают двойную полосу. Поскольку все три имеют единственный неповрежденный сайт N-гликозилирования, тогда как вариант N, который не демонстрирует двойной полосы, не имеет такого сайта, вероятным объяснением будет то, что двойная полоса является результатом различий в N-гликозилирования. Следовательно, вариант В подвергается перевариванию с N-гликозидазой F. Как видно из фиг. 5В, только следовые количества остаются от верхней полосы, в то время как нижняя полоса усиливается, указывая, что только часть экспрессированного варианта N-гликозилируется. Одной из особенностей ВSSL является ее специфическое активирование первичными солями желчи, например холатом (Hernell, 1975). Все различные рекомбинантные формы BSSL показывают одну и ту же зависимость от концентрации для активации холатом (фиг. 6). Максимальную активность в использованной системе испытаний получают при 10 мМ. Когда холат заменяют на дезоксихолат (вторичная соль), активации не происходит. Таким образом, рекомбинант полной длины так же, как и различные варианты, обнаруживает одинаковую специфичность относительно активации солями желчи. 1.2.5. Экспрессия и биохимические исследования BSSL полной длины в E. coli Два штамма Е. соli - JМ109 (DЕ3) и BL 21(DЕ3) pLys S (Studier et al. 1986) - трансформируют вектором экспрессии pGEMEX/BSSL, содержащим кДНК человеческой BSSL под контролем промотора Т7. Трансформанты из обоих штаммов идентифицируют, культивируют и индуцируют IРТG (изопропилтиогалактозидом) в течение около 90 мин (Studier et al., 1986). Анализ полной мРНК нозерн-блотированием использованием кДНК BSSL в виде пробы, меченой 32Р, показывает, что экспрессия эффективно индуцируется в обоих штаммах и что транскрипция твердо регулируется (фиг. 7А). Обнаруженный размер мРНК рекомбинантной В - приблизительно 2,4 т. п.о. - соответствует ожидаемой длине. Разделение образцов белка SDS-РAGE и иммунологический анализ с антителами анти-ВSSL, показывают, что BSSL полной длины эффективно продуцируется в E. coli (фиг. 7В). В штамме ВL 21 (DE3) рLys S секретируется белка в периплазму больше, чем в штамме JM109(DE3) (фиг. 7В). Индуцированные IРТG культуры Е.соli содержат активную растворимую ВSSL в количестве, соответствующем 0,5-4 мкг белка ВSSL на 1 мл культуры. Вестерн-блоттинг показывает, что в нерастворимом осадке находится от 20 до 60% реакционноспособного материала. Неиндуцированные бактерии не содержат сколько-нибудь заметной активности BSSL. Активность липазы из выращенных бактерий показывает такую же зависимость от солей желчи, как и нативная молочная BSSL. 2. Очистка и исследование рекомбинантных полной длины и мутированных форм стимулируемой солями желчи липазы 2.1. Методики экспериментов 2.1.1. Ферменты а варианты ферментов Конструируют и экспрессируют рекомбинантные BSSL с полной длиной и варианты BSSL В, С и N, как описано ранее. По сравнению с нативным ферментом вариант В (SEQ ID NO:5) не имеет все 16 уникальных, О-гликозилированных, богатых пролином С-концевых повторов (аа 536 - 711), но имеет наибольший С-концевой фрагмент (аа 712 - 722), слитый с глутамином 535. Вариант С (SEQ ID NO:6) содержит такой же С-концевой фрагмент и два повтора из 11 остатков между глутамином 535 и лизином 712. В варианте N (не-N-гликозилированный вариант, SEQ ID NO:7) аспарагин 187, ответственный за единственный N-связываемый сахар, обменивается на остаток глутамина. Нативную ВSSL очищают от человеческого молока, как описано в -актину (фиг. 3, нижний снимок). 1.2.4. Получение ВSSL полной длины и вариантов ВSSL в клетках млекопитающего Среды из отдельных клонов клеток С127, трансфецированных ВSSL полной длины и ВSSL различных мутированных форм, собирают и испытывают на активность ВSSL (фиг. 4). Для молекулы полной длины и вариантов N, В и С активность в клонах с наивысшей экспрессией лежит в интервале от 0,7 до 2,3 мкмоль выделенных жирных кислот х мин-1 х(мл среды)-1. Для специфичной активности, сравнимой с активностью нативной В молока, это будет соответствовать уровню экспрессии 7-23 мкг х (мл среды)-1. Для варианта А все анализированные клоны имеют активность ниже 0,05 мкмоль выделенных жирных кислот х мин-1 и (мл среды)-1. Концентрация сефарозы Blue и лиофилизация клона, демонстрирующего наивысшую активность, показывают, что активный фермент в самом деле экспрессируется, хотя с очень низким уровнем. Вероятность, что низкая активность, полученная для варианта А, частично может быть объяснена значительно более низкой специфической активностью, не может быть исключена. Вестерн-блоты клонов различных экспериментов с трансфекцией приводятся на фиг. 5А. Как и ожидалось, существуют явные Mr вариантов BSSL. Однако следует отметить, что для BSSL полной длины, как и для вариантов В и С, получают двойную полосу. Поскольку все три имеют единственный неповрежденный сайт N-гликозилирования, тогда как вариант N, который не демонстрирует двойной полосы, не имеет такого сайта, вероятным объяснением будет то, что двойная полоса является результатом различий в N-гликозилирования. Следовательно, вариант В подвергается перевариванию с N-гликозидазой F. Как видно из фиг. 5В, только следовые количества остаются от верхней полосы, в то время как нижняя полоса усиливается, указывая, что только часть экспрессированного варианта N-гликозилируется. Одной из особенностей ВSSL является ее специфическое активирование первичными солями желчи, например холатом (Hernell, 1975). Все различные рекомбинантные формы BSSL показывают одну и ту же зависимость от концентрации для активации холатом (фиг. 6). Максимальную активность в использованной системе испытаний получают при 10 мМ. Когда холат заменяют на дезоксихолат (вторичная соль), активации не происходит. Таким образом, рекомбинант полной длины так же, как и различные варианты, обнаруживает одинаковую специфичность относительно активации солями желчи. 1.2.5. Экспрессия и биохимические исследования BSSL полной длины в E. coli Два штамма Е. соli - JМ109 (DЕ3) и BL 21(DЕ3) pLys S (Studier et al. 1986) - трансформируют вектором экспрессии pGEMEX/BSSL, содержащим кДНК человеческой BSSL под контролем промотора Т7. Трансформанты из обоих штаммов идентифицируют, культивируют и индуцируют IРТG (изопропилтиогалактозидом) в течение около 90 мин (Studier et al., 1986). Анализ полной мРНК нозерн-блотированием использованием кДНК BSSL в виде пробы, меченой 32Р, показывает, что экспрессия эффективно индуцируется в обоих штаммах и что транскрипция твердо регулируется (фиг. 7А). Обнаруженный размер мРНК рекомбинантной В - приблизительно 2,4 т. п.о. - соответствует ожидаемой длине. Разделение образцов белка SDS-РAGE и иммунологический анализ с антителами анти-ВSSL, показывают, что BSSL полной длины эффективно продуцируется в E. coli (фиг. 7В). В штамме ВL 21 (DE3) рLys S секретируется белка в периплазму больше, чем в штамме JM109(DE3) (фиг. 7В). Индуцированные IРТG культуры Е.соli содержат активную растворимую ВSSL в количестве, соответствующем 0,5-4 мкг белка ВSSL на 1 мл культуры. Вестерн-блоттинг показывает, что в нерастворимом осадке находится от 20 до 60% реакционноспособного материала. Неиндуцированные бактерии не содержат сколько-нибудь заметной активности BSSL. Активность липазы из выращенных бактерий показывает такую же зависимость от солей желчи, как и нативная молочная BSSL. 2. Очистка и исследование рекомбинантных полной длины и мутированных форм стимулируемой солями желчи липазы 2.1. Методики экспериментов 2.1.1. Ферменты а варианты ферментов Конструируют и экспрессируют рекомбинантные BSSL с полной длиной и варианты BSSL В, С и N, как описано ранее. По сравнению с нативным ферментом вариант В (SEQ ID NO:5) не имеет все 16 уникальных, О-гликозилированных, богатых пролином С-концевых повторов (аа 536 - 711), но имеет наибольший С-концевой фрагмент (аа 712 - 722), слитый с глутамином 535. Вариант С (SEQ ID NO:6) содержит такой же С-концевой фрагмент и два повтора из 11 остатков между глутамином 535 и лизином 712. В варианте N (не-N-гликозилированный вариант, SEQ ID NO:7) аспарагин 187, ответственный за единственный N-связываемый сахар, обменивается на остаток глутамина. Нативную ВSSL очищают от человеческого молока, как описано в  (1981). 2.1.2. Ферментный анализ Активность липазы проверяют так, как описано в (1981). 2.1.2. Ферментный анализ Активность липазы проверяют так, как описано в  (1981), используя в качестве субстрата триолеин, эмульгированный в аравийской камеди. В качестве активирующей соли желчи используют холат натрия (10 мМ). Различные модификации испытаний даются в подписях к фигурам. 2.1.3. Получение иммуносорбента Очищенную молочную ВSSL (5 мг) связывают с сефарозой, используя CNBr, как рекомендует производитель. Через колонку пропускают 40 мл поликлональной антисыворотки, полученной в кролике против очищенной молочной ВSSL. Специфичные антитела элюируют 0,1 М глицином HCl, рН 2,5. Сразу же доводят рН до приблизительно 8 твердым Трисом. После обессоливания и лиофилизации 6 мг аффинных очищенных антител связывают с сефарозой, как описано выше. 2.1.4. Процедура очистки Кондиционные культуральные среды, содержащие 5-25 мкг рекомбинантной экспрессированной ВSSL или варианта BSSL, смешивают с сефарозой синей (Pharmacia Sweden) - 10 мл среды на 1 мл структурированного геля. После перемешивания в течение 30 мин гель ополаскивают 0,05 М Трис-Сl, рН 7,0, 0,05 M KCl, и липазную активность элюируют 0,05 M Трис-Cl, рН 7,0, 1,5 M КСl. Пики активности объединяют и диализуют против 5 мМ натрийверонала, рН 7,4, 0,05 М NaСl. Диализат вносят в колонку с гепаринсефарозой. Колонку элюируют градиентом 0,05-1,0 М NaCl в 5 мМ натрийверональном буфере, рН 7,4. Фракции, содержащие липазную активность, объединяют и вносят в колонку с иммуносорбентом. После промывания 0,05 М Трис-Cl, рН 7,5, 0,15 М NаСl, связанную липазу элюируют 0,1 М глицином с HCl, рН 2,5. Величину рН фракций сразу же доводят до приблизительно 8 твердым Трисом. 2.1.5. Электрофорез Электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) осуществляют, по существу, в соответствии с Laemmli (1970). Белки подкрашивают кумассии бриллиантовым голубым. 2.1.6. Анализ N-концевой последовательности Анализ аминокислотных последовательностей осуществляют на пульсирующем жидкофазном секвенаторе Applied Biosystems Inc. 477А и на линейном фенилтиогидантоиновом анализаторе 120 А с регулярными циклическими программами и химикатами от производителя. Вычисленные из секвенированного стандартного белка ( (1981), используя в качестве субстрата триолеин, эмульгированный в аравийской камеди. В качестве активирующей соли желчи используют холат натрия (10 мМ). Различные модификации испытаний даются в подписях к фигурам. 2.1.3. Получение иммуносорбента Очищенную молочную ВSSL (5 мг) связывают с сефарозой, используя CNBr, как рекомендует производитель. Через колонку пропускают 40 мл поликлональной антисыворотки, полученной в кролике против очищенной молочной ВSSL. Специфичные антитела элюируют 0,1 М глицином HCl, рН 2,5. Сразу же доводят рН до приблизительно 8 твердым Трисом. После обессоливания и лиофилизации 6 мг аффинных очищенных антител связывают с сефарозой, как описано выше. 2.1.4. Процедура очистки Кондиционные культуральные среды, содержащие 5-25 мкг рекомбинантной экспрессированной ВSSL или варианта BSSL, смешивают с сефарозой синей (Pharmacia Sweden) - 10 мл среды на 1 мл структурированного геля. После перемешивания в течение 30 мин гель ополаскивают 0,05 М Трис-Сl, рН 7,0, 0,05 M KCl, и липазную активность элюируют 0,05 M Трис-Cl, рН 7,0, 1,5 M КСl. Пики активности объединяют и диализуют против 5 мМ натрийверонала, рН 7,4, 0,05 М NaСl. Диализат вносят в колонку с гепаринсефарозой. Колонку элюируют градиентом 0,05-1,0 М NaCl в 5 мМ натрийверональном буфере, рН 7,4. Фракции, содержащие липазную активность, объединяют и вносят в колонку с иммуносорбентом. После промывания 0,05 М Трис-Cl, рН 7,5, 0,15 М NаСl, связанную липазу элюируют 0,1 М глицином с HCl, рН 2,5. Величину рН фракций сразу же доводят до приблизительно 8 твердым Трисом. 2.1.5. Электрофорез Электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) осуществляют, по существу, в соответствии с Laemmli (1970). Белки подкрашивают кумассии бриллиантовым голубым. 2.1.6. Анализ N-концевой последовательности Анализ аминокислотных последовательностей осуществляют на пульсирующем жидкофазном секвенаторе Applied Biosystems Inc. 477А и на линейном фенилтиогидантоиновом анализаторе 120 А с регулярными циклическими программами и химикатами от производителя. Вычисленные из секвенированного стандартного белка ( -лактоглобулин), начальный выход и выход повторов (repetitive) составляют 47% и 97% соответственно. 2.2.Результаты 2.2.1. Очистка рекомбинантной BSSL и вариантов ВSSL Хроматографию на сефарозе синей кондиционных сред используют, прежде всего, как стадию концентрирования. Последующая хроматография на гепарин-сефарозе дает начальную очистку, главным образом, за счет удаления большей части альбумина, присутствующего в культуральной среде. Эта стадия также показывает, что молекулы рекомбинантной BSSL остаются все связанные гепарином. После иммуносорбента оказывается, что все варианты ВSSL имеют чистоту более 90%, судя по SDS-PAGE (фиг. 8). Фермент полной длины, как и варианты В и С, мигрирует как дублет. Обнаруженные Мr различных вариантов приводятся в табл. 3. Анализ N-концевой последовательности дает единственную последовательность для всех вариантов для 8 циклов: Ala-Lуs-Lеu-Glу-Ala-Val-Tyr-Тhr-. 2.2.2. Активность липазы В табл. 3 указывается найденная молекулярная масса различных препаратов. Специфические активности препаратов находятся в интервале от 75 до 120 мкмоль выделенных свободных жирных кислот в мин и на 1 мг белка. Следовательно, нельзя обнаружить существенного различия в активности между ВSSL с полной длиной и вариантами ВSSL. Все препараты демонстрируют абсолютную необходимость первичной соли желчи (холат натрия) для активности против эмульгированного длинноцепного триацилглицерола (фиг. 9A). Дезоксихолат натрия активирует некоторые варианты (данные не приводятся). Однако, когда соединяют различные соли желчи, дезоксихолат имеет двойное действие (фиг. 9В и С). Во-первых, он снижает концентрацию холата, необходимую для активации, и, во-вторых, он ингибирует ферментную активность при более высокой концентрации соли желчи. 2.2.3. Устойчивость рекомбинантной BSSL и вариантов BSSL Рекомбинантная ВSSL, как и варианты BSSL, обнаруживают ту же рН-устойчивость, что и нативная молочная ВSSL (фиг.10). Инактивация во всех случаях происходит при рН 2,5-3. При рН свыше 3 все варианты совершенно устойчивы при условии, что концентрация белка достаточно высока. Это достигается путем добавления альбумина коровьей сыворотки или яичного альбумина (данные не приводятся). Разбавленные образцы менее устойчивы при всех проверенных рН, но предел остается тем же самым (данные не приводятся). Фиг. 11 показывает, что термостойкость рекомбинантных ферментов сравнима с термостойкостью нативного молочного фермента. При температуре 37- 40oС активность начинает снижаться. Варианты (В, С и N) оказываются несколько менее устойчивыми, чем рекомбинантный фермент с полной длиной и фермент молока. Однако, если концентрация белка увеличивается путем добавления альбумина коровьей сыворотки, все варианты являются устойчивыми также при 40oС (фиг. 11). Нативная молочная BSSL и все рекомбинантные варианты чувствительны к трипсину. Получают зависимость инактивации от времени (фиг. 12). Однако, если в буфер включаются соли желчи, т.е. холат, варианты липазы защищаются, и активность липазы сохраняется (фиг. 12). Таким образом, что касается характеристик in vitro, т.е. активации солями желчи, связывания гепарином, рН- и термоустойчивости и защиты солью желчи от инактивации протеазами, то не обнаружено существенных различий при сравнении различных вариантов BSSL с нативной молочной BSSL. 3. Экспрессия в трансгенных животных 3.1. Конструирование векторов экспрессии Чтобы сконструировать вектор экспрессии для продуцирования варианта человеческой рекомбинантной ВSSL в молоке трансгенных животных, используют следующую стратегию (фиг. 13). Получают три плазмиды, содержащие различные части гена человеческой BSSL (рS309, рS310 и рS311), используя способы, описанные в Lidberg et al. (1992). Плазмида рS309 содержит фрагмент Sрh I, перекрывающий ген BSSL от 5'-нетранскрибируемой области до части четвертого интрона. Плазмида рS310 содержит фрагмент Sac I, перекрывающий генную последовательность варианта ВSSL от части первого интрона до части шестого интрона. Наконец, плазмида рS311 содержит фрагмент Ваm НI, перекрывающий ген BSSL из основной части пятого интрона и остатка структуры интрон/экзон с делециями в экзоне 11. Последовательности с делециями представляют собой 231 п.о., что приводит к последовательности, кодирующей вариант ВSSL, который содержит точно 77 аминокислот или на семь повторов меньше, чем ВSSL с полной длиной. Нуклеотидная последовательность получающегося в результате варианта ВSSL ("Вариант Т") дается в списке последовательностей как SEQ ID NO:8. Аминокислотная последовательность варианта Т приводится в списке последовательностей как SEQ ID NO:9. Вследствие высоко повторяющейся последовательности в экзоне 11 гена человеческой BSSL, можно ожидать относительно высокую частоту реаранжировок, когда эту последовательность клонируют в плазмиде и размножают в бактериях. На основе этого предположения нужный вариант BSSL, который содержит усеченный экзон 11, идентифицируют, изолируют и проводят анализ последовательности. Другую плазмиду рS283, содержащую часть кДНК человеческой ВSSL, клонированную в плазмиде рUС19 в сайтах Hind III и Sac I, используют для слияния геномных последовательностей. Плазмиду рS283 также используют, чтобы получить сайт правильной рестрикции фермента, Крn I, расположенный в 5'-нетранслируемой лидерной последовательности ВSSL. Плазмиду рS283 раскрепляют Nco I и Sac I, и электрофорезом выделяют фрагмент около 2,7 т.п.о. Плазмиду рS309 расщепляют Nco I и ВspE, и выделяют фрагмент около 2,3 т. п.о., содержащий 5'-часть гена BSSL. Плазмиду рS310 расщепляют ВsрЕ I и Sac I, и выделяют фрагмент около 2,7 т.п.о., содержащий часть средней области гена BSSL. Эти три фрагмента лигируют и трансформируют в компетентный Е. соli, штамм TG2, и трансформанты изолируют отбором с ампициллином. Получают плазмиды из некоторого количества трансформантов, и одну плазмиду, называемую рS312 (фиг. 14), содержащую нужную конструкцию, используют для дальнейших экспериментов. Чтобы получить модификацию рS311, в которой сайт Ваm НI, расположенный в прямом направлении от стоп-кодона, был превращен в сайт Sal I для облегчения дальнейшего клонирования, используют следующий способ. Плазмиду рS311 переводят в линейную форму частичным перевариванием Ваm HI. Выделяют фрагмент, приобретший линейную форму, и вставляют линкер синтетической ДНК, который конвертирует сайт Ваm НI в сайт Sal I (5'-GATCGTCGAC-3'), разрушая этим сайт ВаM HI. Так как существуют два возможных положения для интеграции синтетического линкера, получающиеся в результате плазмиды анализируют путем рестрикционного ферментативного гидролиза. Плазмиду с линкером, вставленным в нужном положении в прямом направлении экзона 11, изолируют и обозначают рS313. Чтобы получить конечную конструкцию вектора экспрессии, несущего геномные последовательности варианта человеческой ВSSL, используют существующий вектор экспрессии, рS314, предназначенный для промежуточной стадии и специфической экспрессии ткани в клетках молочной железы в периоды лактации. Плазмида рS314 содержит геномный фрагмент из гена кислого белка сыворотки (WAP) мыши (Campbel et al., 1984), клонированный как фрагмент Not I. Геномный фрагмент имеет приблизительно 4,5 т.п.о. регуляторных последовательностей, все четыре экзона мышиного WАР и все интронные последовательности, и 3-т.п.о.-последовательность в прямом направлении последнего от экзона. Уникальный сайт Крn I располагается в первом экзоне в 24 п.о. в обратном направлении от инициирующего кодона трансляции природного WAP. Другой уникальный сайт фермента рестрикции представляет собой сайт Sal I, расположенный в экзоне 3. Геномную последовательность варианта человеческой BSSL вставляют между этими сайтами - Kpn I и Sal I - по следующей стратегии. Во-первых, рS134 переваривают с Крn I и Sal I, и фрагмент, представляющий собой расщепленную плазмиду, выделяют электрофорезом. Во-вторых, рS132 переваривают с Крn I и Ваm НI и выделяют фрагмент приблизительно в 4,7 т.п.о., представляющий собой 5'-часть гена человеческой BSSL. В-третьих, рS313 переваривают с Ваm НI и Sаl I и выделяют 3'-часть гена человеческой BSSL. Эти три фрагмента лигируют, трансформируют в компетентную бактерию Е.coli, и трансформанты изолируют после селекции с ампициллином. Получают плазмиды из нескольких трансформантов и тщательно анализируют путем рестрикционного ферментного картирования и анализа последовательностей. Одну плазмиду, представляющую нужный вектор экспрессии, характеризуют и обозначают рS317 (фиг. 15). Чтобы удалить прокариотные плазмидные последовательности, рS317 расщепляют Not I. Элемент рекомбинантного вектора, состоящий из последовательности мышиного WAP, примыкающей сбоку геномного фрагмента варианта человеческой BSSL, затем выделяют электрофорезом в агарозе. Изолированный фрагмент затем очищают электроэлюцией перед тем, как вводить его в мышиные эмбрионы. Рекомбинантный ген для экспрессии варианта человеческой В в молоке трансгенных мышей приводится на фиг. 16. 3.2. Генерация трансгенных животных Фрагмент Not I выделяют из плазмиды рS317 в соответствии с разделом 3.1. Этот фрагмент ДНК состоит из промотора мышиного WАР, связанного с геномной последовательностью, кодирующей вариант человеческой ВSSL. Выделенный фрагмент при концентрации 3 нг/мкл вводят в пронуклеус эмбрионов 350 С57В1/6J x CBA/2J - f2, полученных от доноров-мышей, подвергнутых воздействию 5 ИЕ гонадотропина сыворотки беременной конематки, для суперовуляции. Животных С57В1/6J x CBA/2J - f1 получают из Bomholtgard Breeding and Research Centre LTD, Ry, Denmark. После сбора эмбрионов из яйцеводов их отделяют от клеток яйцевого бугорка посредством обработки гиалуронидазой в среде M2 (Hogan et al., 1986). После промывания эмбрионы переносят в среду М16 Hogan et al., 1986) и выдерживают в инкубаторе в атмосфере с 5% СО2. Инъекции выполняют в микрокапле М2 под легким парафиновым маслом, используя гидравлические микроманипуляторы Narishigi и инвертированный микроскоп Nikon, снабженный оптикой Nomarski. После инъекции 267 выглядящих здоровыми эмбрионов имплантируют в 12 псевдобеременных С57В1/6J x CBA/2J - f1 реципиентов, получивших интраперитонеально 0,37 мл 2,5% авертина. Мышей, которые интегрировали трансген, идентифицируют РСR-анализом ДНК из образцов хвоста для биопсии, полученных через три недели после рождения животных. Позитивные результаты подтверждаются саузерн-блот-анализом. Для отбора молока дающим молоко самкам вводят 2 ИЕ окситоцина интраперитонеально и через 10 минут дают наркоз 0,40 мл 2,5% авертина интраперитонеально. Устройство для накопления молока подсоединяют к ниппелю через силицированный трубопровод, и молоко собирают в 1,5 мл пробирки Эппендорфа (Eppendorf), осторожно массируя молочную железу. Количество молока изменяется в зависимости от дня лактации от 0,1 до 1,5 мл от мыши за сбор. 3.3. Экспрессия варианта В в трансгенных мышах Трансгенных мышей идентифицируют посредством анализа ДНК, которую получают из образцов, отрезанных от хвоста. Образцы ткани инкубируют с протеиназой K и экстрагируют фенолом с хлороформом. Выделенную ДНК используют в полимеразно-цепных реакциях (PCR) с праймерами, которые усиливают специфичные фрагменты, если присутствует гетерологичная введенная ДНК, представляющая фрагмент вектора экспрессии. Животных также проверяют опытами гибридизации ДНК, чтобы подтвердить данные РСR и проверить на возможные реаранжировки, структуру элементов интегрированного вектора и получить информацию о числе копий элементов интегрированного вектора. В одной серии экспериментов анализируют 31 мышь двумя методами, и результаты показывают, что 1 мышь несет элемент вектора гетерологичной ДНК, полученный из рS317. Результаты PCR-анализа и экспериментов с гибридизацией являются идентичными (фиг. 17). Вообще, обнаруживают, что 10 из 65 проверенных животных являются трансгенными для рS317. Мышь, идентифицированную как несущую элемент векторной ДНК (животное-основатель), затем спаривают, и помет F1 проверяют на трансген по тем же методикам. РНК, выделенную из различных тканей рS317-трансгенных самок в период лактации, отделяют электрофорезом в агарозном геле с формальдегидом, блоттируют на мембраны и гибридизуют с кДНК BSSL, меченной 32P, в качестве зонда. Полученные результаты показывают, что экспрессия ограничивается молочной железой в период лактации (фиг. 18). Образцы молока отбирают под наркозом от животного-основателя, обработанного окситоцином для индуцирования лактации, и анализируют на присутствие варианта рекомбинантной человеческой BSSL. Это делается SDS-PAGE, переносом на нитроцеллюлозные мембраны и инкубацией с поликлональными антителами, генерированными против нативной человеческой BSSL. Полученные результаты демонстрируют экспрессию варианта рекомбинантной человеческой BSSL в молоке трансгенных мышей. Фиг. 19 показывает присутствие варианта рекомбинантной человеческой ВSSL в молоке трансгенных мышей. Разделение SDS-PAGE и иммуноблотирование образцов молока, полученных от различных трансгенных для рS317 мышей, показывают эффективное продуцирование варианта рекомбинантной BSSL с уменьшенной определяемой молекулярной массой по сравнению с рекомбинантной BSSL с полной длиной, полученной из молока мыши, трансгенной для рS314. Плазмида рS314 подобна рS317, за исключением того, что рS314 содержит кДНК человеческой BSSL с полной длиной вместо геномного варианта. Дублетная полоса, которая выявляется во всех образцах мышиного молока, представляет мышиную BSSL и показывает, таким образом, перекрестную реактивность антисыворотки. Этот вывод подтверждается также наблюдением, что эта дублетная полоса появляется в узкой полоске 9 на фиг. 19, которая содержит очищенную мышиную BSSL. Генерируют устойчивые линии трансгенных животных. Подобным образом могут быть получены другие трансгенные животные, такие как кролики, коровы или овцы, способные экспрессировать варианты человеческой BSSL. Депозиты Перечисленные в табл.4 плазмиды депонированы в соответствии с Будас Будапештским договором в DSM (Deutche Sammlung von Mikroorganismen und Zellkulturen). Краткое описание чертежей Фиг. 1. А. Карта вектора на основе BPV, используемого для экспрессии различных вариантов BSSL. В. Схематичное изображение различных анализированных вариантов BSSL. FL обозначает BSSL полной длины. Активный сайт указывается кружочком, а сайт для возможного N-присоединенного углевода указывается треугольником. Область, содержащая повторы, указывается в виде заштрихованного пространства, а область сохраненного С-окончания - в виде зачерненного участка. Фиг. 2 Саузерн блот-анализ ДНК из клеточных линий, экспрессирующих варианты ВSSL. Анализировали ДНК, полученные из клеточных линий, экспрессирующих ВSSL полной длины (FL), вариант A (А), вариант В (В), вариант С (С) и вариант N (N). ДНК, произведенные соответственными полученными клетками (слева) (5 мкг) и 1 нг векторной ДНК, произведенной очищенными бактериями (справа), переварены с Ваm НI. Образцы ДНК разделены на агарозном геле, перенесены на мембрану GeneScreen Plus и гибридизованы с кДНК человеческой BSSL, меченой 32Р. Фиг. 3 Нозерн-блот-анализ РНК из изолированных клеточных линий, экспрессирующих варианты BSSL. Анализированы 10 мкг полной РНК, полученной из клеточных линий, продуцирующих BSSL полной длины (FL), вариант А (А), вариант В (В), вариант С (С) и вариант N (N). РНК из клеточной линии С127, таящей вектор BPV, идентичный вектору на фиг. 1, за исключением того, что он кодирует белок, не родственный BSSL, использовали в качестве негативного контроля (-) (верхний снимок). Фильтры гибридизованы с кДНК ВSSL, меченой 32Р. Фильтр затем регибридизован с зондом кДНК мышиного -лактоглобулин), начальный выход и выход повторов (repetitive) составляют 47% и 97% соответственно. 2.2.Результаты 2.2.1. Очистка рекомбинантной BSSL и вариантов ВSSL Хроматографию на сефарозе синей кондиционных сред используют, прежде всего, как стадию концентрирования. Последующая хроматография на гепарин-сефарозе дает начальную очистку, главным образом, за счет удаления большей части альбумина, присутствующего в культуральной среде. Эта стадия также показывает, что молекулы рекомбинантной BSSL остаются все связанные гепарином. После иммуносорбента оказывается, что все варианты ВSSL имеют чистоту более 90%, судя по SDS-PAGE (фиг. 8). Фермент полной длины, как и варианты В и С, мигрирует как дублет. Обнаруженные Мr различных вариантов приводятся в табл. 3. Анализ N-концевой последовательности дает единственную последовательность для всех вариантов для 8 циклов: Ala-Lуs-Lеu-Glу-Ala-Val-Tyr-Тhr-. 2.2.2. Активность липазы В табл. 3 указывается найденная молекулярная масса различных препаратов. Специфические активности препаратов находятся в интервале от 75 до 120 мкмоль выделенных свободных жирных кислот в мин и на 1 мг белка. Следовательно, нельзя обнаружить существенного различия в активности между ВSSL с полной длиной и вариантами ВSSL. Все препараты демонстрируют абсолютную необходимость первичной соли желчи (холат натрия) для активности против эмульгированного длинноцепного триацилглицерола (фиг. 9A). Дезоксихолат натрия активирует некоторые варианты (данные не приводятся). Однако, когда соединяют различные соли желчи, дезоксихолат имеет двойное действие (фиг. 9В и С). Во-первых, он снижает концентрацию холата, необходимую для активации, и, во-вторых, он ингибирует ферментную активность при более высокой концентрации соли желчи. 2.2.3. Устойчивость рекомбинантной BSSL и вариантов BSSL Рекомбинантная ВSSL, как и варианты BSSL, обнаруживают ту же рН-устойчивость, что и нативная молочная ВSSL (фиг.10). Инактивация во всех случаях происходит при рН 2,5-3. При рН свыше 3 все варианты совершенно устойчивы при условии, что концентрация белка достаточно высока. Это достигается путем добавления альбумина коровьей сыворотки или яичного альбумина (данные не приводятся). Разбавленные образцы менее устойчивы при всех проверенных рН, но предел остается тем же самым (данные не приводятся). Фиг. 11 показывает, что термостойкость рекомбинантных ферментов сравнима с термостойкостью нативного молочного фермента. При температуре 37- 40oС активность начинает снижаться. Варианты (В, С и N) оказываются несколько менее устойчивыми, чем рекомбинантный фермент с полной длиной и фермент молока. Однако, если концентрация белка увеличивается путем добавления альбумина коровьей сыворотки, все варианты являются устойчивыми также при 40oС (фиг. 11). Нативная молочная BSSL и все рекомбинантные варианты чувствительны к трипсину. Получают зависимость инактивации от времени (фиг. 12). Однако, если в буфер включаются соли желчи, т.е. холат, варианты липазы защищаются, и активность липазы сохраняется (фиг. 12). Таким образом, что касается характеристик in vitro, т.е. активации солями желчи, связывания гепарином, рН- и термоустойчивости и защиты солью желчи от инактивации протеазами, то не обнаружено существенных различий при сравнении различных вариантов BSSL с нативной молочной BSSL. 3. Экспрессия в трансгенных животных 3.1. Конструирование векторов экспрессии Чтобы сконструировать вектор экспрессии для продуцирования варианта человеческой рекомбинантной ВSSL в молоке трансгенных животных, используют следующую стратегию (фиг. 13). Получают три плазмиды, содержащие различные части гена человеческой BSSL (рS309, рS310 и рS311), используя способы, описанные в Lidberg et al. (1992). Плазмида рS309 содержит фрагмент Sрh I, перекрывающий ген BSSL от 5'-нетранскрибируемой области до части четвертого интрона. Плазмида рS310 содержит фрагмент Sac I, перекрывающий генную последовательность варианта ВSSL от части первого интрона до части шестого интрона. Наконец, плазмида рS311 содержит фрагмент Ваm НI, перекрывающий ген BSSL из основной части пятого интрона и остатка структуры интрон/экзон с делециями в экзоне 11. Последовательности с делециями представляют собой 231 п.о., что приводит к последовательности, кодирующей вариант ВSSL, который содержит точно 77 аминокислот или на семь повторов меньше, чем ВSSL с полной длиной. Нуклеотидная последовательность получающегося в результате варианта ВSSL ("Вариант Т") дается в списке последовательностей как SEQ ID NO:8. Аминокислотная последовательность варианта Т приводится в списке последовательностей как SEQ ID NO:9. Вследствие высоко повторяющейся последовательности в экзоне 11 гена человеческой BSSL, можно ожидать относительно высокую частоту реаранжировок, когда эту последовательность клонируют в плазмиде и размножают в бактериях. На основе этого предположения нужный вариант BSSL, который содержит усеченный экзон 11, идентифицируют, изолируют и проводят анализ последовательности. Другую плазмиду рS283, содержащую часть кДНК человеческой ВSSL, клонированную в плазмиде рUС19 в сайтах Hind III и Sac I, используют для слияния геномных последовательностей. Плазмиду рS283 также используют, чтобы получить сайт правильной рестрикции фермента, Крn I, расположенный в 5'-нетранслируемой лидерной последовательности ВSSL. Плазмиду рS283 раскрепляют Nco I и Sac I, и электрофорезом выделяют фрагмент около 2,7 т.п.о. Плазмиду рS309 расщепляют Nco I и ВspE, и выделяют фрагмент около 2,3 т. п.о., содержащий 5'-часть гена BSSL. Плазмиду рS310 расщепляют ВsрЕ I и Sac I, и выделяют фрагмент около 2,7 т.п.о., содержащий часть средней области гена BSSL. Эти три фрагмента лигируют и трансформируют в компетентный Е. соli, штамм TG2, и трансформанты изолируют отбором с ампициллином. Получают плазмиды из некоторого количества трансформантов, и одну плазмиду, называемую рS312 (фиг. 14), содержащую нужную конструкцию, используют для дальнейших экспериментов. Чтобы получить модификацию рS311, в которой сайт Ваm НI, расположенный в прямом направлении от стоп-кодона, был превращен в сайт Sal I для облегчения дальнейшего клонирования, используют следующий способ. Плазмиду рS311 переводят в линейную форму частичным перевариванием Ваm HI. Выделяют фрагмент, приобретший линейную форму, и вставляют линкер синтетической ДНК, который конвертирует сайт Ваm НI в сайт Sal I (5'-GATCGTCGAC-3'), разрушая этим сайт ВаM HI. Так как существуют два возможных положения для интеграции синтетического линкера, получающиеся в результате плазмиды анализируют путем рестрикционного ферментативного гидролиза. Плазмиду с линкером, вставленным в нужном положении в прямом направлении экзона 11, изолируют и обозначают рS313. Чтобы получить конечную конструкцию вектора экспрессии, несущего геномные последовательности варианта человеческой ВSSL, используют существующий вектор экспрессии, рS314, предназначенный для промежуточной стадии и специфической экспрессии ткани в клетках молочной железы в периоды лактации. Плазмида рS314 содержит геномный фрагмент из гена кислого белка сыворотки (WAP) мыши (Campbel et al., 1984), клонированный как фрагмент Not I. Геномный фрагмент имеет приблизительно 4,5 т.п.о. регуляторных последовательностей, все четыре экзона мышиного WАР и все интронные последовательности, и 3-т.п.о.-последовательность в прямом направлении последнего от экзона. Уникальный сайт Крn I располагается в первом экзоне в 24 п.о. в обратном направлении от инициирующего кодона трансляции природного WAP. Другой уникальный сайт фермента рестрикции представляет собой сайт Sal I, расположенный в экзоне 3. Геномную последовательность варианта человеческой BSSL вставляют между этими сайтами - Kpn I и Sal I - по следующей стратегии. Во-первых, рS134 переваривают с Крn I и Sal I, и фрагмент, представляющий собой расщепленную плазмиду, выделяют электрофорезом. Во-вторых, рS132 переваривают с Крn I и Ваm НI и выделяют фрагмент приблизительно в 4,7 т.п.о., представляющий собой 5'-часть гена человеческой BSSL. В-третьих, рS313 переваривают с Ваm НI и Sаl I и выделяют 3'-часть гена человеческой BSSL. Эти три фрагмента лигируют, трансформируют в компетентную бактерию Е.coli, и трансформанты изолируют после селекции с ампициллином. Получают плазмиды из нескольких трансформантов и тщательно анализируют путем рестрикционного ферментного картирования и анализа последовательностей. Одну плазмиду, представляющую нужный вектор экспрессии, характеризуют и обозначают рS317 (фиг. 15). Чтобы удалить прокариотные плазмидные последовательности, рS317 расщепляют Not I. Элемент рекомбинантного вектора, состоящий из последовательности мышиного WAP, примыкающей сбоку геномного фрагмента варианта человеческой BSSL, затем выделяют электрофорезом в агарозе. Изолированный фрагмент затем очищают электроэлюцией перед тем, как вводить его в мышиные эмбрионы. Рекомбинантный ген для экспрессии варианта человеческой В в молоке трансгенных мышей приводится на фиг. 16. 3.2. Генерация трансгенных животных Фрагмент Not I выделяют из плазмиды рS317 в соответствии с разделом 3.1. Этот фрагмент ДНК состоит из промотора мышиного WАР, связанного с геномной последовательностью, кодирующей вариант человеческой ВSSL. Выделенный фрагмент при концентрации 3 нг/мкл вводят в пронуклеус эмбрионов 350 С57В1/6J x CBA/2J - f2, полученных от доноров-мышей, подвергнутых воздействию 5 ИЕ гонадотропина сыворотки беременной конематки, для суперовуляции. Животных С57В1/6J x CBA/2J - f1 получают из Bomholtgard Breeding and Research Centre LTD, Ry, Denmark. После сбора эмбрионов из яйцеводов их отделяют от клеток яйцевого бугорка посредством обработки гиалуронидазой в среде M2 (Hogan et al., 1986). После промывания эмбрионы переносят в среду М16 Hogan et al., 1986) и выдерживают в инкубаторе в атмосфере с 5% СО2. Инъекции выполняют в микрокапле М2 под легким парафиновым маслом, используя гидравлические микроманипуляторы Narishigi и инвертированный микроскоп Nikon, снабженный оптикой Nomarski. После инъекции 267 выглядящих здоровыми эмбрионов имплантируют в 12 псевдобеременных С57В1/6J x CBA/2J - f1 реципиентов, получивших интраперитонеально 0,37 мл 2,5% авертина. Мышей, которые интегрировали трансген, идентифицируют РСR-анализом ДНК из образцов хвоста для биопсии, полученных через три недели после рождения животных. Позитивные результаты подтверждаются саузерн-блот-анализом. Для отбора молока дающим молоко самкам вводят 2 ИЕ окситоцина интраперитонеально и через 10 минут дают наркоз 0,40 мл 2,5% авертина интраперитонеально. Устройство для накопления молока подсоединяют к ниппелю через силицированный трубопровод, и молоко собирают в 1,5 мл пробирки Эппендорфа (Eppendorf), осторожно массируя молочную железу. Количество молока изменяется в зависимости от дня лактации от 0,1 до 1,5 мл от мыши за сбор. 3.3. Экспрессия варианта В в трансгенных мышах Трансгенных мышей идентифицируют посредством анализа ДНК, которую получают из образцов, отрезанных от хвоста. Образцы ткани инкубируют с протеиназой K и экстрагируют фенолом с хлороформом. Выделенную ДНК используют в полимеразно-цепных реакциях (PCR) с праймерами, которые усиливают специфичные фрагменты, если присутствует гетерологичная введенная ДНК, представляющая фрагмент вектора экспрессии. Животных также проверяют опытами гибридизации ДНК, чтобы подтвердить данные РСR и проверить на возможные реаранжировки, структуру элементов интегрированного вектора и получить информацию о числе копий элементов интегрированного вектора. В одной серии экспериментов анализируют 31 мышь двумя методами, и результаты показывают, что 1 мышь несет элемент вектора гетерологичной ДНК, полученный из рS317. Результаты PCR-анализа и экспериментов с гибридизацией являются идентичными (фиг. 17). Вообще, обнаруживают, что 10 из 65 проверенных животных являются трансгенными для рS317. Мышь, идентифицированную как несущую элемент векторной ДНК (животное-основатель), затем спаривают, и помет F1 проверяют на трансген по тем же методикам. РНК, выделенную из различных тканей рS317-трансгенных самок в период лактации, отделяют электрофорезом в агарозном геле с формальдегидом, блоттируют на мембраны и гибридизуют с кДНК BSSL, меченной 32P, в качестве зонда. Полученные результаты показывают, что экспрессия ограничивается молочной железой в период лактации (фиг. 18). Образцы молока отбирают под наркозом от животного-основателя, обработанного окситоцином для индуцирования лактации, и анализируют на присутствие варианта рекомбинантной человеческой BSSL. Это делается SDS-PAGE, переносом на нитроцеллюлозные мембраны и инкубацией с поликлональными антителами, генерированными против нативной человеческой BSSL. Полученные результаты демонстрируют экспрессию варианта рекомбинантной человеческой BSSL в молоке трансгенных мышей. Фиг. 19 показывает присутствие варианта рекомбинантной человеческой ВSSL в молоке трансгенных мышей. Разделение SDS-PAGE и иммуноблотирование образцов молока, полученных от различных трансгенных для рS317 мышей, показывают эффективное продуцирование варианта рекомбинантной BSSL с уменьшенной определяемой молекулярной массой по сравнению с рекомбинантной BSSL с полной длиной, полученной из молока мыши, трансгенной для рS314. Плазмида рS314 подобна рS317, за исключением того, что рS314 содержит кДНК человеческой BSSL с полной длиной вместо геномного варианта. Дублетная полоса, которая выявляется во всех образцах мышиного молока, представляет мышиную BSSL и показывает, таким образом, перекрестную реактивность антисыворотки. Этот вывод подтверждается также наблюдением, что эта дублетная полоса появляется в узкой полоске 9 на фиг. 19, которая содержит очищенную мышиную BSSL. Генерируют устойчивые линии трансгенных животных. Подобным образом могут быть получены другие трансгенные животные, такие как кролики, коровы или овцы, способные экспрессировать варианты человеческой BSSL. Депозиты Перечисленные в табл.4 плазмиды депонированы в соответствии с Будас Будапештским договором в DSM (Deutche Sammlung von Mikroorganismen und Zellkulturen). Краткое описание чертежей Фиг. 1. А. Карта вектора на основе BPV, используемого для экспрессии различных вариантов BSSL. В. Схематичное изображение различных анализированных вариантов BSSL. FL обозначает BSSL полной длины. Активный сайт указывается кружочком, а сайт для возможного N-присоединенного углевода указывается треугольником. Область, содержащая повторы, указывается в виде заштрихованного пространства, а область сохраненного С-окончания - в виде зачерненного участка. Фиг. 2 Саузерн блот-анализ ДНК из клеточных линий, экспрессирующих варианты ВSSL. Анализировали ДНК, полученные из клеточных линий, экспрессирующих ВSSL полной длины (FL), вариант A (А), вариант В (В), вариант С (С) и вариант N (N). ДНК, произведенные соответственными полученными клетками (слева) (5 мкг) и 1 нг векторной ДНК, произведенной очищенными бактериями (справа), переварены с Ваm НI. Образцы ДНК разделены на агарозном геле, перенесены на мембрану GeneScreen Plus и гибридизованы с кДНК человеческой BSSL, меченой 32Р. Фиг. 3 Нозерн-блот-анализ РНК из изолированных клеточных линий, экспрессирующих варианты BSSL. Анализированы 10 мкг полной РНК, полученной из клеточных линий, продуцирующих BSSL полной длины (FL), вариант А (А), вариант В (В), вариант С (С) и вариант N (N). РНК из клеточной линии С127, таящей вектор BPV, идентичный вектору на фиг. 1, за исключением того, что он кодирует белок, не родственный BSSL, использовали в качестве негативного контроля (-) (верхний снимок). Фильтры гибридизованы с кДНК ВSSL, меченой 32Р. Фильтр затем регибридизован с зондом кДНК мышиного  -актина. Сигналы мРНК -актина. Сигналы мРНК  -актина (нижние снимки) использовали в качестве внутреннего контроля количества РНК, загруженной на каждую дорожку (полосу). Фиг. 4. Экспрессия активности BSSL в клетках С127, трансфектированных человеческой ВSSL полной длины и ее мутированными формами. Клетки С127 трансфектированы различными конструкциями ВSSL: полной длины (FL), вариантом N (N), вариантом С (С), вариантом В (В), вариантом А (А). После начального периода роста отбирали отдельные клоны и давали им возможность расти до слияния. Число отобранных клонов (n) указывается на фигуре Активность липазы определяли на кондиционных средах. Значения выражаются в мкмолях выделенной жирной кислоты x мин-1 х(мл кондиционной среды)-1. Фиг. 5. А. Вестерн-блоттинг полной длины и мутированных рекомбинантных BSSL. Количество липазной активности, выраженное в мкмолях выделенный жирной кислоты х мин-1, нанесенной на гель, составляет: при полной длине - 0,2 (полоска 1), для варианта N - 0,16 (полоска 2), для варианта С - 0,6 (полоска 3), для варианта В - 0,8 (полоска 4) и для нативной ВSSL - 0,1 (полоска 5), Применяют антисыворотку, полученную в кролике против BSSL, очищенной от человеческого молока. Положение маркеров размера (предварительно окрашенные SDS-PAGE Standards, Low Range, BioRad) указывается слева. В. Вестерн-блоттинг варианта В, обработанного N-гликозидазой F. Вариант В переваривали с N-гликозидазой F, как описано в методиках экспериментов. Полоска 1 относится к необработанному, а полоска 2 - к обработанному варианту В. Фиг. 6 Зависимость BSSL полной длины и ее мутированных форм от солей желчи. Липазную активность определяли в присутствии различных концентраций холата натрия (сплошные линии) или дезоксихолата натрия (прерывистые линии) на кондиционных средах для рекомбинантной ВSSL полной длины (*), варианта А -актина (нижние снимки) использовали в качестве внутреннего контроля количества РНК, загруженной на каждую дорожку (полосу). Фиг. 4. Экспрессия активности BSSL в клетках С127, трансфектированных человеческой ВSSL полной длины и ее мутированными формами. Клетки С127 трансфектированы различными конструкциями ВSSL: полной длины (FL), вариантом N (N), вариантом С (С), вариантом В (В), вариантом А (А). После начального периода роста отбирали отдельные клоны и давали им возможность расти до слияния. Число отобранных клонов (n) указывается на фигуре Активность липазы определяли на кондиционных средах. Значения выражаются в мкмолях выделенной жирной кислоты x мин-1 х(мл кондиционной среды)-1. Фиг. 5. А. Вестерн-блоттинг полной длины и мутированных рекомбинантных BSSL. Количество липазной активности, выраженное в мкмолях выделенный жирной кислоты х мин-1, нанесенной на гель, составляет: при полной длине - 0,2 (полоска 1), для варианта N - 0,16 (полоска 2), для варианта С - 0,6 (полоска 3), для варианта В - 0,8 (полоска 4) и для нативной ВSSL - 0,1 (полоска 5), Применяют антисыворотку, полученную в кролике против BSSL, очищенной от человеческого молока. Положение маркеров размера (предварительно окрашенные SDS-PAGE Standards, Low Range, BioRad) указывается слева. В. Вестерн-блоттинг варианта В, обработанного N-гликозидазой F. Вариант В переваривали с N-гликозидазой F, как описано в методиках экспериментов. Полоска 1 относится к необработанному, а полоска 2 - к обработанному варианту В. Фиг. 6 Зависимость BSSL полной длины и ее мутированных форм от солей желчи. Липазную активность определяли в присутствии различных концентраций холата натрия (сплошные линии) или дезоксихолата натрия (прерывистые линии) на кондиционных средах для рекомбинантной ВSSL полной длины (*), варианта А  ) варианта В ) варианта В  варианта С ( варианта С ( ), варианта N ( ), варианта N ( ) и очищенной BSSL человеческого молока ) и очищенной BSSL человеческого молока  Для варианта А кондиционную среду концентрировали на сефарозе голубой, как описано в методиках экспериментов. Количество источника соответствующего фермента выбирали таким образом, чтобы получить одинаковые уровни максимальной активности, за исключением варианта А, который имел максимальную активность только в одну десятую от других. Контрольные эксперименты показали, что среда роста не влияет на уровень активности или на зависимость от солей желчи нативной BSSL (данные не приводятся). Фиг. 7 А. Нозерн-блоттинг BSSL, полученной различными штаммами Е.соli с использованием pGEMEX. Бактерии индуцировали IPTG, как описано в экспериментальных методиках. Условия эксперимента такие же, какие описаны в 2.2. Полоса 1 - штамм ВL 21 (DE3) pLysS, не индуцирован; полоса 2 - штамм ВL 21(DE3) pLysS, индуцирован; полоса 3 - штамм JM109 (DE3), не индуцирован; полоса 4 - штамм JM109 (DЕ3), индуцирован. В. Вестерн-блоттинг, с использованием антител к очищенной молочной BSSL, из 8-18% SDS-РAGЕ, показывающего экспрессию рекомбинантной ВSSL в различных штаммах Е. coli с применением pGEMEX. Бактерии индуцировали IРТG, и цитоплазменные и периплазменные белки получали из лизата, как описано в методиках экспериментов. Количества бактериальных белков, загруженных на полосы 2-5 (периплазменные препараты) и 7-10 (цитоплазменные препараты), представляют одинаковый объем культуры, дающий окраску, пропорциональную уровню продуцирования. Полоса 1 - маркеры размера молекулы Pharmacia; полосы 2 и 8 штамм JM109 (DЕ3), индуцирован; полосы 3 и 7 - штамм JM109(DЕ3), не индуцирован; полосы 4 и 10 - штамм ВL 21 (DЕ3) pLysS, индуцирован; полосы 5 и 9 - штамм ВL 21 (DE3) pLysS, не индуцирован; полоса 6-25 нг очищенной нативной ВSSL. Фиг. 8 SDS-PAGE очищенных рекомбинантной BSSL и вариантов ВSSL Рекомбинантную ВSSL полной длины (FL) и варианты BSSL N, В и С очищали так, как описано. Наносили по 3 мкг каждого, за исключением варианта В, который использовали в количестве 1,5 мкг. Наносили 5 мкг очищенной молочной BSSL (ПАТ). Положение маркеров размера указывается слева. Фиг. 9 Влияние дезоксихолата на активацию рекомбинантной ВSSL и вариантов BSSL холатом натрия. Проверяли липазную активность очищенных препаратов рекомбинантной ВSSL полной длины ( Для варианта А кондиционную среду концентрировали на сефарозе голубой, как описано в методиках экспериментов. Количество источника соответствующего фермента выбирали таким образом, чтобы получить одинаковые уровни максимальной активности, за исключением варианта А, который имел максимальную активность только в одну десятую от других. Контрольные эксперименты показали, что среда роста не влияет на уровень активности или на зависимость от солей желчи нативной BSSL (данные не приводятся). Фиг. 7 А. Нозерн-блоттинг BSSL, полученной различными штаммами Е.соli с использованием pGEMEX. Бактерии индуцировали IPTG, как описано в экспериментальных методиках. Условия эксперимента такие же, какие описаны в 2.2. Полоса 1 - штамм ВL 21 (DE3) pLysS, не индуцирован; полоса 2 - штамм ВL 21(DE3) pLysS, индуцирован; полоса 3 - штамм JM109 (DE3), не индуцирован; полоса 4 - штамм JM109 (DЕ3), индуцирован. В. Вестерн-блоттинг, с использованием антител к очищенной молочной BSSL, из 8-18% SDS-РAGЕ, показывающего экспрессию рекомбинантной ВSSL в различных штаммах Е. coli с применением pGEMEX. Бактерии индуцировали IРТG, и цитоплазменные и периплазменные белки получали из лизата, как описано в методиках экспериментов. Количества бактериальных белков, загруженных на полосы 2-5 (периплазменные препараты) и 7-10 (цитоплазменные препараты), представляют одинаковый объем культуры, дающий окраску, пропорциональную уровню продуцирования. Полоса 1 - маркеры размера молекулы Pharmacia; полосы 2 и 8 штамм JM109 (DЕ3), индуцирован; полосы 3 и 7 - штамм JM109(DЕ3), не индуцирован; полосы 4 и 10 - штамм ВL 21 (DЕ3) pLysS, индуцирован; полосы 5 и 9 - штамм ВL 21 (DE3) pLysS, не индуцирован; полоса 6-25 нг очищенной нативной ВSSL. Фиг. 8 SDS-PAGE очищенных рекомбинантной BSSL и вариантов ВSSL Рекомбинантную ВSSL полной длины (FL) и варианты BSSL N, В и С очищали так, как описано. Наносили по 3 мкг каждого, за исключением варианта В, который использовали в количестве 1,5 мкг. Наносили 5 мкг очищенной молочной BSSL (ПАТ). Положение маркеров размера указывается слева. Фиг. 9 Влияние дезоксихолата на активацию рекомбинантной ВSSL и вариантов BSSL холатом натрия. Проверяли липазную активность очищенных препаратов рекомбинантной ВSSL полной длины ( ), вариантов рекомбинантной ВSSL В ), вариантов рекомбинантной ВSSL В  С ( С ( ) и N ) и N  и очищенной нативной молочной BSSL ( и очищенной нативной молочной BSSL ( ) при различных концентрациях холата натрия в отсутствии (левый график) и в присутствии 5 мМ (график в центре) или 10 мМ (правый график) дезоксихолата. Фиг. 10 Устойчивость рекомбинантной BSSL и вариантов BSSL при различных рН. Нативную BSSL, рекомбинантную В полной длины и варианты BSSL инкубировали при 37oС в различных буферах с рН 2-8. Все буферы содержали 1 мг/мл альбумина коровьей сыворотки. Через 30 мин отбирали аликвоты и проверяли липазную активность. Пояснения символов см. в описании фиг. 9. Фиг. 11 Термоустойчивость рекомбинантной BSSL и вариантов ВSSL Очищенные рекомбинантную BSSL полной длины, варианты BSSL и нативную молочную ВSSL инкубировали при указанных температурах в 50 мМ буфере Трис-Cl, рН 7,5. К одной серии образцов добавляли альбумин коровьей сыворотки (ВSА) до 1 мг/мл. Через 30 мин отбирали образцы и проверяли липазную активность. Активность выражают в процентах от активности каждого образца при 0 мин. Пояснения символов см. в описании фиг. 9. Фиг. 12 Влияние солей желчи на инактивацию рекомбинантной ВSSL и вариантов ВSSL трипсином. Очищенные рекомбинантную ВSSL полной длины, варианты BSSL и нативную молочную ВSSL (15 мкл, содержащие 1-4 мкг) добавляли к 60 мкл 1,0 Трис-Сl, рН 7,4 с 10 мкг трипсина (ТРСК-трипсин, Boehringer-Mannheim) при 25oС в отсутствии (прерывистые линии) и в присутствии (сплошные линии) 10 мМ холата натрия. В указанное время отбирали аликвоты и проверяли на липазную активность. Величины выражаются в процентах от величин, полученных при контрольных инкубированиях в отсутствие трипсина. Пояснения символов см. в описании фиг. 9. Фиг. 13 Способ получения плазмиды рS317. Подробности см. в разделе 3.1. Фиг. 14 Схематическое строение плазмиды рS312. Фиг. 15 Схематическое строение плазмиды рS317. Фиг. 16 Физическая карта, отражающая физическое введение геномной структуры варианта человеческой ВSSL в первый экзон гена WАР, как описано в разделе 3.1. Фиг. 17 А. Схематическое изображение локализации праймеров РСR, применяемых для идентификации трансгенных животных. Праймер 5' располагается в последовательности WAP, начинающейся в положении 148 п.о. в обратном направлении слияния между WАР и вариантом ВSSL. Праймер 3 располагается в первом интроне варианта ВSSL, заканчивающем 400 п.о. в прямом направлении из точки слияния. В. Последовательности использованных праймеров РСR. С. Полученные на агарозном геле показатели типичного анализа анализов РСR потенциальных животных-основателей. М: молекулярная масса маркеров. Полоса 1 - контрольный продукт РСR, генерированный из плазмиды рS317. Полосы 2-13 - реакции PCR с препаратами ДНК от потенциальных животных-основателей. Фиг. 18 Нозерн-блоттинг РНК, полученных из различных тканей, выделенных из самки мыши, трансгенной для рS317. Ткани выделяли на четвертый день лактации. Анализировали 10 мкг полной РНК из каждой ткани посредством агарозно-формальдегидного разделения, переносили на мембраны и гибридизовали с кДНК человеческой BSSL, меченой 32Р. Полосы содержат: Mg - молочную железу; Li - печень; Кi - почку; Sp - селезенку; Не - сердце; Lu - легкое; Sg - слюнную железу; Br - головной мозг. Размеры ДНК в нуклеотидах указываются слева. Фиг. 19 Вестерн-блоттинг молока, полученного от трансгенных для рS314 мышей, от мышей, трансгенных для вектора кДНК полной длины рS314, и контрольных животных. Образцы отделяли SDS-PAGE и переносили на иммобилизующие (Immobilon) фильтры и иммуноблотировали с антисывороткой против нативной человеческой ВSSL. Полоса 1 - маркеры молекулярной массы; полосы 2, 3 и 4 - 2 мкл молока от трех F1-дочерей (F1 30, 31 и 33) рS317-основателя FO # 91; полоса 5 - 2 мкл молока от рS314-основателя # 90. Полосы 6, 7 и 8 - 2 мкл молока от трех нетрансгенных для ВSSL животных; полоса 9 - очищенная мышиная ВSSL; полоса 10 - очищенная человеческая нативная BSSL. Список последовательностей Информация о последовательности 1 (SEQ ID NO:1) (i) Характеристики последовательности (A) Длина: 2428 пар оснований (В) Тип: нуклеиновая кислота (С) Число нитей: двунитевая (D) Топология: линейная (ii) Тип молекулы: кДНК с мРНК (iii) Гипотетичность: нет (iii) Источник происхождения (А) Организм: Homo Sapiens (В) Тип ткани: молочная железа (ix) Признак (А) Название/ключ: (В) Локализация: 82..2319 (D) Другая информация: продукт = "стимулируемая солями желчи липаза" (ix) Признак (А) Название/ключ: экзон (В) Локализация: 985..1173 (ix) Признак (А) Название/ключ: экзон (В) Локализация: 1174..1377 (ix) Признак (А) Название/ключ: экзон (В) Локализация: 1378..1575 (ix) Признак (А) Название/ключ: экзон (В) Локализация: 1576..2415 (ix) Признак (А) Название/ключ: зрел. пептид (В) Локализация: 151..2316 (ix) Признак (А) Название/ключ: сигнал полиА. (В) Локализация: 2397..2402 (ix) Признак (А) Название/ключ: повтор. область (В) Локализация: 1756..2283 (ix) Признак (А) Название/ключ: 5' UTR (В) Локализация: 1..81 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 1756..1788 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 1789..1821 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 1822..1854 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 1855..1887 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 1888..1920 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 1921..1953 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 1954..1986 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 1987..2019 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 2020..2052 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 2053..2085 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 2086..2118 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 2119..2151 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 2152..2184 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 2185..2217 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 2218..2250 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 2251..2283 (xi) описание последовательности SEQ ID NO:1Н ) при различных концентрациях холата натрия в отсутствии (левый график) и в присутствии 5 мМ (график в центре) или 10 мМ (правый график) дезоксихолата. Фиг. 10 Устойчивость рекомбинантной BSSL и вариантов BSSL при различных рН. Нативную BSSL, рекомбинантную В полной длины и варианты BSSL инкубировали при 37oС в различных буферах с рН 2-8. Все буферы содержали 1 мг/мл альбумина коровьей сыворотки. Через 30 мин отбирали аликвоты и проверяли липазную активность. Пояснения символов см. в описании фиг. 9. Фиг. 11 Термоустойчивость рекомбинантной BSSL и вариантов ВSSL Очищенные рекомбинантную BSSL полной длины, варианты BSSL и нативную молочную ВSSL инкубировали при указанных температурах в 50 мМ буфере Трис-Cl, рН 7,5. К одной серии образцов добавляли альбумин коровьей сыворотки (ВSА) до 1 мг/мл. Через 30 мин отбирали образцы и проверяли липазную активность. Активность выражают в процентах от активности каждого образца при 0 мин. Пояснения символов см. в описании фиг. 9. Фиг. 12 Влияние солей желчи на инактивацию рекомбинантной ВSSL и вариантов ВSSL трипсином. Очищенные рекомбинантную ВSSL полной длины, варианты BSSL и нативную молочную ВSSL (15 мкл, содержащие 1-4 мкг) добавляли к 60 мкл 1,0 Трис-Сl, рН 7,4 с 10 мкг трипсина (ТРСК-трипсин, Boehringer-Mannheim) при 25oС в отсутствии (прерывистые линии) и в присутствии (сплошные линии) 10 мМ холата натрия. В указанное время отбирали аликвоты и проверяли на липазную активность. Величины выражаются в процентах от величин, полученных при контрольных инкубированиях в отсутствие трипсина. Пояснения символов см. в описании фиг. 9. Фиг. 13 Способ получения плазмиды рS317. Подробности см. в разделе 3.1. Фиг. 14 Схематическое строение плазмиды рS312. Фиг. 15 Схематическое строение плазмиды рS317. Фиг. 16 Физическая карта, отражающая физическое введение геномной структуры варианта человеческой ВSSL в первый экзон гена WАР, как описано в разделе 3.1. Фиг. 17 А. Схематическое изображение локализации праймеров РСR, применяемых для идентификации трансгенных животных. Праймер 5' располагается в последовательности WAP, начинающейся в положении 148 п.о. в обратном направлении слияния между WАР и вариантом ВSSL. Праймер 3 располагается в первом интроне варианта ВSSL, заканчивающем 400 п.о. в прямом направлении из точки слияния. В. Последовательности использованных праймеров РСR. С. Полученные на агарозном геле показатели типичного анализа анализов РСR потенциальных животных-основателей. М: молекулярная масса маркеров. Полоса 1 - контрольный продукт РСR, генерированный из плазмиды рS317. Полосы 2-13 - реакции PCR с препаратами ДНК от потенциальных животных-основателей. Фиг. 18 Нозерн-блоттинг РНК, полученных из различных тканей, выделенных из самки мыши, трансгенной для рS317. Ткани выделяли на четвертый день лактации. Анализировали 10 мкг полной РНК из каждой ткани посредством агарозно-формальдегидного разделения, переносили на мембраны и гибридизовали с кДНК человеческой BSSL, меченой 32Р. Полосы содержат: Mg - молочную железу; Li - печень; Кi - почку; Sp - селезенку; Не - сердце; Lu - легкое; Sg - слюнную железу; Br - головной мозг. Размеры ДНК в нуклеотидах указываются слева. Фиг. 19 Вестерн-блоттинг молока, полученного от трансгенных для рS314 мышей, от мышей, трансгенных для вектора кДНК полной длины рS314, и контрольных животных. Образцы отделяли SDS-PAGE и переносили на иммобилизующие (Immobilon) фильтры и иммуноблотировали с антисывороткой против нативной человеческой ВSSL. Полоса 1 - маркеры молекулярной массы; полосы 2, 3 и 4 - 2 мкл молока от трех F1-дочерей (F1 30, 31 и 33) рS317-основателя FO # 91; полоса 5 - 2 мкл молока от рS314-основателя # 90. Полосы 6, 7 и 8 - 2 мкл молока от трех нетрансгенных для ВSSL животных; полоса 9 - очищенная мышиная ВSSL; полоса 10 - очищенная человеческая нативная BSSL. Список последовательностей Информация о последовательности 1 (SEQ ID NO:1) (i) Характеристики последовательности (A) Длина: 2428 пар оснований (В) Тип: нуклеиновая кислота (С) Число нитей: двунитевая (D) Топология: линейная (ii) Тип молекулы: кДНК с мРНК (iii) Гипотетичность: нет (iii) Источник происхождения (А) Организм: Homo Sapiens (В) Тип ткани: молочная железа (ix) Признак (А) Название/ключ: (В) Локализация: 82..2319 (D) Другая информация: продукт = "стимулируемая солями желчи липаза" (ix) Признак (А) Название/ключ: экзон (В) Локализация: 985..1173 (ix) Признак (А) Название/ключ: экзон (В) Локализация: 1174..1377 (ix) Признак (А) Название/ключ: экзон (В) Локализация: 1378..1575 (ix) Признак (А) Название/ключ: экзон (В) Локализация: 1576..2415 (ix) Признак (А) Название/ключ: зрел. пептид (В) Локализация: 151..2316 (ix) Признак (А) Название/ключ: сигнал полиА. (В) Локализация: 2397..2402 (ix) Признак (А) Название/ключ: повтор. область (В) Локализация: 1756..2283 (ix) Признак (А) Название/ключ: 5' UTR (В) Локализация: 1..81 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 1756..1788 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 1789..1821 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 1822..1854 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 1855..1887 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 1888..1920 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 1921..1953 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 1954..1986 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 1987..2019 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 2020..2052 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 2053..2085 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 2086..2118 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 2119..2151 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 2152..2184 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 2185..2217 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 2218..2250 (ix) Признак (А) Название/ключ: повтор. единица (В) Локализация: 2251..2283 (xi) описание последовательности SEQ ID NO:1Н
Формула изобретения1. Полипептид, представляющий собой укороченный по С-концу вариант природной BSSL, включающей аминокислотную последовательность 1-535-SEQID NO:3 и фрагмент из 536-722 SEQ ID NO:3.2. Полипептид по п.1, отличающийся тем, что имеет фенилаланиновый остаток в своем С-окончании.3. Полипептид по п.1 или 2, отличающийся тем, что включает последовательность Gln-Met-Pro в своей С-концевой части.4. Полипептид по любому из пп.1-3, отличающийся тем, что включает аминокислотную последовательность, представляемую в виде остатков 712-722 в SEQ ID NO:3 в своей С-концевой части.5. Полипептид по любому из пп.1-4, отличающийся тем, что включает менее 16 повторяющихся аминокислотных остатков.6. Полипептид-вариант BSSL, аминокислотная последовательность которого, по крайней мере, на 90% гомологична аминокислотной последовательности, представленной в SEQ ID NO:7 в списке последовательностей, при условии, что в положении 187 отсутствует аспарагиновый остаток.7. Полипептид по п.6, отличающийся тем, что аминокислотная последовательность указанного полипептида представлена в SEQ ID NO:7 в списке последовательностей.8. Полипептид-вариант BSSL, имеющий аминокислотную последовательность SEQ ID NO:2, в которой аминокислотные остатки -23-0 и 536-711 делетированы (SEQ ID NO:5) ; или аминокислотные остатки -23-0, 536-568 и 591-711 делетированы (SEQ ID NO:6); или аминокислотные остатки -23-0 делетированы и аминокислота Asn в положении 187 заменена на Gln (SEQ ID NO:7); или аминокислотные остатки 632-708 делетированы (SEQ ID NO:9).9. Полипептид по любому из пп.1-8, отличающийся тем, что является, по существу, очищенным.10. Молекула нуклеиновой кислоты, кодирующая BSSL и имеющая нуклеотидную последовательность, соответствующую аминокислотной последовательности полипептида по любому из пп.1-7.11. Гибридный ген, в котором молекула нуклеиновой кислоты по п.10 встроена в ген, способный опосредовать экспрессию указанной молекулы нуклеиновой кислоты в клетке млекопитающих так, чтобы была возможна экспрессия гибридного гена в целом.12. Гибридный ген по п.11, отличающийся тем, что молекула нуклеиновой кислоты по п.10 встроена в ген белка молока млекопитающего, не принадлежащего к человеку.13. Плазмида рS317 с депозитным номером DSM7104 для экспрессии полипептида по любому из пп.1-7, в которую встроен гибридный ген по п.11.14. Клеточная линия мыши Mus musculus С127, несущая гибридный ген по п.11.15. Способ продуцирования полипептида по п.1, включающий (i) встраивание молекулы нуклеиновой кислоты по п.10 в гибридный ген, который способен реплицироваться, в специфической клетке-хозяине или организме; (ii) введение в результате образующегося рекомбинантного гибридного гена в клетку-хозяин или в организм; (iii) идентификацию и выращивание полученной клетки в или на культуральной среде, или идентификацию и репродуцирование организма для экспрессии полипептида; и (iv) извлечение полипептида.16. Способ по п.15, отличающийся тем, что гибридный ген включается в вектор вируса папилломы коровы pS258, рS259 или рS299.17. Вектор экспрессии, представляющий собой плазмиду, в которую встроен гибридный ген по п.11.18. Способ продуцирования трансгенного, не принадлежащего к человеку млекопитающего, способного экспрессировать полипептид по п.1, при том, что на первом этапе осуществляют введение вектора экспрессии по п.17 в оплодотворенную яйцеклетку или в клетку эмбриона, не принадлежащего к человеку млекопитающего, для встраивания вектора экспрессии в зародыш млекопитающего и на втором этапе осуществляют введение получающихся в результате встраивания оплодотворенной яйцеклетки или эмбриона во взрослую самку не принадлежащего к человеку млекопитающего для дальнейшего развития.19. Способ продуцирования трансгенного, не принадлежащего к человеку млекопитающего, способного экспрессировать полипептид по п.1 и, по существу, неспособного экспрессировать указанный полипептид из самого млекопитающего, при том, что (а) разрушают способность млекопитающего экспрессировать BSSL таким образом, что, по существу, весь BSSL не экспрессируется, и вводят вектор экспрессии по п.17 в зародыш млекопитающего таким образом, что вариант BSSL экспрессируется в млекопитающем; и/или (б) замещают ген BSSL или его части вектором экспрессии по п.17.20. Фармацевтическая композиция для использования в лечении патологических состояний, связанных с экзокринной недостаточностью поджелудочной железы, муковисцидозом, хроническим панкреатитом, жировой малабсорбцией, вследствие физиологических причин, включающая эффективное количество полипептида по любому из пп.1-9 в качестве активного ингредиента, и фармацевтически приемлемый носитель.PD4A - Изменение наименования обладателя патента СССР или патента Российской Федерации на изобретение (73) Новое наименование патентообладателя: АстраЗенека АБ (SE) Адрес для переписки: 129090, Москва, ул. Б. Спасская, 25, стр. 3, ООО "Юридическая фирма Городисский и Партнеры" Извещение опубликовано: 27.06.2007 БИ: 18/2007 PC4A - Регистрация договора об уступке патента СССР или патента Российской Федерации на изобретение Прежний патентообладатель: АстраЗенека АБ (SE) (73) Патентообладатель: Арексис АБ (SE) Договор № РД0024348 зарегистрирован 19.07.2007 Извещение опубликовано: 27.08.2007 БИ: 24/2007 Популярные патенты: 2167648 Средство для защиты от укусов кровососущих насекомых (варианты) и способ его получения ... выше техническая задача решается также за счет того, что средство для защиты от укусов кровососущих насекомых получают следующим способом. Осуществляют предварительную структурную модификацию репеллента путем взаимодействия N,N- диэтил-м-толуамида или смесь N,N-диэтилтолуамида и диметилфталата при температуре 20-70oC с сополимером малеинового ангидрида с виниловым и/или акриловым мономером общей формулы где R1:- H,-CH3, R2: -CmH2m+1, -C6H5, -C6H4CH3, -O-CmH2m+1, -O-CO-CmH2m+1, -CO-O-CmH2m+1, n=100...60000, m=1...16 при соотношении репеллент : сополимер 5,7-17,0 : 1 до получения полупродукта, имеющего показатель динамической вязкости при 25oC =0,8-1,6 Пас. Приготавливают водную ... 2195644 Монитор для определения качества зерна ... диффузного отражения, определяется выражением A=LOG10(R-D/S-D) Кроме того, поскольку изменения поглощения, соотносимые с присутствием протеина, весьма малы, для получения желаемой величины поглощения на конкретной длине волны обычно применяют многократные повторения описанной операции (шаг 109), усреднение и анализ вторых производных. В связи с этим последующая обработка данных может предусматривать использования второй производной указанной функции для устранения постоянных и линейных отклонений, чтобы в определении содержания протеина использовались только квадратичные компоненты спектра поглощения, а также компоненты более высокого порядка. ЭКВИВАЛЕНТЫ Из подробного описания ... 2050099 Косилка с всасывающим устройством ... исключения узлов, создающих дополнительный всасывающий поток при одновременном изменении конструкции конфузора. Упрощение изготовления достигается за счет изготовления предлагаемой конструкции из простых геометрических элементов (полуцилиндров, части поверхности пирамиды, т.е. из треугольных элементов, и т.д.). Данные преимущества приводят к снижению прямых и эксплуатационных затрат при изготовлении и эксплуатации. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. КОСИЛКА С ВСАСЫВАЮЩИМ УСТРОЙСТВОМ, содержащая конфузор, состоящий из боковых направителей воздушного потока, верхней поверхности и нижнего основания и имеющий входное и выходное отверстие, и режущий аппарат, который расположен перед входным ... 2242875 Энергосберегающий способ зимовки и содержания пчел на воле в однокорпусном улье усова ... и дополнительной теплосберегающей поролоновой оболочки 5. Таким образом, выполняется принцип термостатирования. В теплое весенне-летнее время при расширении гнезда удаляются межрамочные вкладыши, резиновая трубка 17 и верхние части рамки 7 заменяются на полнообъемные сотовые части, пробка 12 в верхнем летке и в вентиляционном отверстии 25 удаляется при наступлении жары и главного взятка.В предгрозовые периоды летная пчела со статическим зарядом “обнуляется” при контакте с летковой полоской фольги 28, тем самым устраняется возможность перераспределения статического заряда между летной и гнездовой пчелой. Металлопленка 13 и токопроводящая краска 26, гальванически соединенные ... 2241327 Многоопорная дождевальная машина ... 7 отсоединяет от гидранта 8, а управляющий трубопровод 6 от гидранта 13. Рукав 7 переносит на гидрант 13, а трубопровод 6 – к последующему гидранту на закрытом трубопроводе 9. При открытии задвижки на гидранте 13 дождевальная машина начинает работать на новой позиции. Лабиринтное уплотнение 32 на фланцах 23 и 24 муфты 20 исключает течь воды и не требует точной соосности при соединении труб 18 и 19 водоподводящего пояса. Винтами средств 33 на фланце 23 выдерживается равный зазор в лабиринтном уплотнении 32 в парах фланцев 23 и 24.Для замены трубы 18 или трубы 19 в секциях 14 и 15 оператор поступает следующим образом. Освободив болты и гайки крепежных средств 21, удаляет ... |
Еще из этого раздела: 2492640 Способ выращивания рыбы в мелководных заморных озерах с применением глубокого водоема-спутника 2076603 Способ повышения урожайности сельскохозяйственных культур 2060624 Валкообразующий транспортер жатки-накопителя 2446659 Способ и устройство для органического возделывания зерновых культур 2180475 Устройство для поштучной подачи предметов, в частности семян сельскохозяйственных культур 2233582 Устройство для охлаждения молока 2294617 Устройство для отрезания и погрузки силоса и сенажа 2465767 Оросительный мат для распределения воды на большой площади 2271096 Способ прогнозирования урожайности озимых зерновых культур в условиях засушливого климата 2054235 Лесопосадочная машина |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||