Способ селекции картофеля на устойчивость к ризоктониозуПатент на изобретение №: 2217906 Автор: Леонова Н.С., Шалдяева Е.М., Гуркин Д.А. Патентообладатель: Институт цитологии и генетики СО РАН Дата публикации: 20 Июня, 2003 Начало действия патента: 19 Ноября, 2001 Адрес для переписки: 630090, г.Новосибирск, пр. акад. Лаврентьева, 10, ИЦиГ СО РАН, патентный отдел Изображения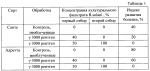 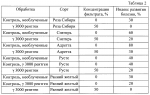 Изобретение предназначено для использования в области сельского хозяйства. Способ включает облучение исходного материала гамма-излучением в дозе 1500-3000 ренген. Культивирование материала проводят на селективной питательной среде, содержащей токсичную концентрацию культурального фильтрата патогена. Высаживают в грунт отселектированные на устойчивость растения и проводят последующий отбор растений, устойчивых к патогену. При этом в качестве исходного материала используют интактные растения, выращенные in vitro. Культивирование черенков проводят сначала на среде, содержащей 40-50% культурального фильтрата штамма Rhizoctonia solani AG 3 1, а затем на среде, содержащей 80-100% культурального фильтрата штамма Rhizoctonia solani AG 3 2. Отселектированные растения высаживают в грунт, зараженный двумя этими же штаммами по 6-7 пропагул каждого из штаммов на 100 г почвы. Изобретение позволяет снизить трудоемкость, а также время на получение устойчивых форм картофеля. 2 з.п. ф-лы, 2 табл. Изобретение относится к области биотехнологии и сельского хозяйства и может быть использовано для получения форм картофеля, устойчивых к ризоктониозу. Ризоктониоз известен во всех странах, где занимаются возделыванием картофеля. Это заболевание распространено в США, странах западной Европы. Ризоктониоз широко распространен и вредоносен во всех трех зонах картофелеводства Сибири и Дальнего Востока. Первые признаки этой болезни проявляются на всходах - коричнево-ржавые пятна, которые охватывают подземную часть стебля. Такие побеги со временем отмирают. К концу вегетации гриб образует половую стадию - грязновато-белый налет у основания стебля "белую ножку". Образующиеся базидиоспоры заражают клубни картофеля нового урожая. Потери урожая от этого заболевания ежегодно составляют 17-30%, достигая в отдельные годы до 45%. Многообразие форм проявления ризоктониоза обуславливает высокую вредоносность данного заболевания. Поэтому очень остро стоит вопрос о получении сортов картофеля, устойчивых к этому заболеванию. А в настоящее время еще не имеется сведений о получении абсолютно устойчивых сортов к ризоктониозу. Известен способ селекции картофеля на устойчивость к патогену, включающий культивирование каллусной ткани на селективной питательной среде с токсином Coryne bacterium sepedonicum. В результате были получены каллусные линии двух сортов картофеля, некоторые из которых дали регенеранты, устойчивые к патогену (Хромова Л.М., Седнина Г.В. и др. Клеточная селекция картофеля. Сельхозбиология, 1983, 6). Недостатками известного способа являются низкая эффективность и высокая трудоемкость. Наиболее ближайшим к заявляемому способу - прототипом является способ селекции картофеля на устойчивость к фитофторе, включающий облучение каллусной культуры гамма-излучением в дозе 2000 рентген, культивирование последней на селективной питательной среде, содержащей токсичную концентрацию Phytophtora infestans, высаживание отселектированных растений в грунт и последующий отбор растений, устойчивых к патогену. В результате было получено 34 растения картофеля при регенерации от 10 различных каллусов, отселектированных на устойчивость к культуральному фильтрату Phytophtora infestans и 15 контрольных растений от неселектированных каллусов. Недостатками известного способа являются длительность, трудоемкость и ограниченность в выборе материала для селекции. Технической задачей изобретения является повышение эффективности способа за счет уменьшения его трудоемкости и времени, требуемого для получения устойчивых к ризоктониозу форм картофеля. Предлагаемый способ заключается в следующем. Исходные растения картофеля, выращенные in vitro, облучают гамма-излучением в дозе 1500-3000 рентген. Облученные растения разрезают на черенки с единичной пазушной почкой и высаживают на селективную питательную среду, состоящую из среды Мурасига-Скуга и культурального фильтрата гриба Rhizoctonia solani, выращенного на среде Richardsa в течение 14 дней. При этом отбор проводят двукратный на двух штаммах Rhizoctonia solani, принадлежащих к одной анастамозной группе Ag-3 и отличающихся по фитотоксичности. Причем сначала черенки помещают на среду, содержащую культуральный фильтрат менее токсичного штамма ( 1) с концентрацией 40-50%, выжившие побеги микроклонально размножают на среде Мурасига-Скуга и высаживают на селективную среду, содержащую более фитотоксичный штамм ( 2). Для более жесткого отбора на среде со штаммом 2 используют 80-100% концентрацию культурального фильтрата. Выжившие на второй селективной среде почки снова микроклонально размножают и растения высаживают в вазоны с грунтом, искусственно зараженным инокулюмом двух штаммов R.solani. Через 3 месяца вегетации проводят учет пораженности подземных органов растений картофеля ризоктониозом по шкале Franka: 0 баллов - нет поражений; 1 балл - одно поражение <25 мм; 2 балла - одно поражение длиной 26-50 мм или несколько мелких поражений длиной <50 мм; 3 балла - одно или несколько поражений более 50 мм, но не окольцовывающих стебель; 4 балла - одно или несколько поражений; 5 баллов - одно или несколько поражений >25 мм, окольцовывающих менее 25 мм, окольцовывающих стебель; стебель. Индекс развития болезни определяют по формуле R=[ 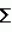 (а (а в)]/(N в)]/(N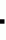 К К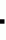 100%), где а - количество пораженных стеблей; в - соответствующий балл поражения; N - количество учтенных растений; К - высший балл шкалы. Растения, имеющие нулевой индекс развития болезни, считают устойчивыми к ризоктониозу. Такие растения отбирают и используют как исходный материал картофеля, устойчивый к ризоктониозу для улучшения сорта. Отличительными признаками заявляемого способа по сравнению с прототипом являются: 1. В качестве исходных форм картофеля используют интактные растения, выращенные in vitro, а не каллусную культуру, что позволяет упростить способ и снизить трудоемкость, связанную с получением регенерантов. 2. Исходные формы картофеля подвергают облучению гамма-излучением в дозе 1500-3000 рентген, что позволяет получить большее количество мутантных форм и выделить более устойчивые к ризоктониозу формы, чем среди необлученных. 3. Черенки облученных растений выращивают последовательно, сначала на селективной питательной среде, содержащей 40-50% культурального фильтрата R. solani AG 3 штамма 1, а выжившие растения подвергают отбору на второй селективной среде, содержащей 80-100% культурального фильтрата более фитотоксичного штамма 2, что позволяет повысить эффективность способа в получении более устойчивых форм. 4. Отселектированные таким образом растения высаживают в грунт, зараженный инокулюмом этих же штаммов, что позволяет оценить степень их устойчивости к ризоктониозу и повысить надежность отбора. При этом концентрация патогенов в грунте составляет 12-14 пропагул на 100 г почвы, что соответствует естественному фону этого возбудителя в природе. Изобретение иллюстрируется следующими примерами конкретного выполнения способа. Пример 1. Селекция форм картофеля на устойчивость к ризоктониозу была проведена на 6 сортах картофеля: Адретта, Роза Сибири, Русте, Санте, Снегирь и Ранний Желтый в лабораторных и тепличных условиях Института цитологии и генетики СО РАН. Исходные растения картофеля (7-10 пробирок каждого сорта), выращенные в условиях in vitro, были облучены дозой 3000 рентген. Облученные растения были разрезаны на черенки с единичными пазушными почками и высажены по 5-10 штук в стаканчики на селективную среду, состоящую из среды Мурасига-Скуга с добавлением 40-50% культурального фильтрата R.solani AG-3 штамма 1, выращенного на среде Ричардса в течение 14 дней. Выжившие почки отсаживали на среду Мурасига-Скуга, где их размножали. Выросшие растения снова черенковали таким же образом, как и в первом случае и затем высаживали на вторую селективную среду, содержащую 80-100% культурального фильтрата R.solani AG-3 штамма 2, обладающего большей фитотоксичностью, чем штамм 1. Выжившие почки отсаживали для микроклонального размножения на среду Мурасига-Скуга, а затем высадили в теплице в вазонах с почвой, искусственно зараженной инокулюмом этих же двух штаммов R.solani AG-3. После 3-х месяцев вегетации провели оценку данного материала на устойчивость к ризоктониозу. В таблице 1 приведены данные по влиянию отбора на культуральном фильтрате R.solani на устойчивость к ризоктониозу. Из данных таблицы 1 видно, что проведенный двухкратный отбор в очень жестких условиях второго отбора на 100% культуральном фильтрате штамма 2 дает возможность отобрать растения с нулевым индексом развития болезни. Так, растения сорта Санте, при однократном отборе на первой селективной среде с 40% концентрацией культурального фильтрата имели индекс развития болезни 20%, а прошедшие двукратный отбор имели нулевой индекс развития болезни. Растения сорта Адретта менее устойчивы к ризоктониозу. Так, в контроле, растения сорта Санте имели 40% индекс развития болезни, а у Адретты - 80% и растения после однократного отбора имели индекс 60%, но после двукратного отбора растения имели нулевой индекс. В таблице 2 представлены данные по влиянию генотипа сорта картофеля на результаты отбора на культуральном фильтрате R.solani. Из таблицы 2 видно, что исследуемые сорта имеют разную устойчивость к ризоктониозу. Так, сорта Роза Сибири, Ранний желтый и Русте более устойчивы, чем Снегирь и Адретта. Но на всех сортах, даже после однократного отбора, удалось получить растения, более устойчивые к ризоктониозу. Так, у сортов Роза Сибири и Ранний желтый получили растения с нулевым индексом развития болезни, а у неустойчивых сортов (сорт Снегирь) получены растения с 20% индексом развития болезни по сравнению с 60% в контроле; у Адретты с 30% по сравнению с 80% индексом развития болезни в контроле. В результате были получены следующие устойчивые формы. Из сорта Санте было выделено 2 полностью устойчивые формы. Из сорта Роза Сибири 1 форма. Из сорта Ранний желтый - 1. Из сорта Адретта - 1. Из сортов Снегирь и Русте полностью устойчивых форм выделить не удалось, но отобранные из них формы показали большую устойчивость по сравнению с исходным сортом. Отобранные формы картофеля использовали в дальнейшей селекционной роботе как исходный материал, для получения устойчивых к ризоктониозу сортов. Используя экспериментально подобранные оптимальные условия двухстадийного отбора на селективной питательной среде, содержащей культуральные фильтраты вышеназванных штаммов в определенных концентрациях, можно за короткое время получить устойчивые к ризоктониозу формы картофеля. Весь технологический процесс может занять следующее время: 14 дней на получение культурального фильтрата на среде Ричардса, затем 7 дней на селективной среде с метаболитами 1-го штамма, размножение отобранных растений 3-5 недель, затем 7 дней на селективной среде с метаболитами 2-го штамма, затем размножение до нужного количества (3-7 недель), высадка в грунт или в теплицу на инфекционный фон и окончательная оценка и отбор устойчивых форм растений (3 месяца). То есть весь процесс может занять от 22 до 28 недель (5,5-7 месяцев). Способ прост в исполнении, не требует получения регенерантов. Источники информации Прототип: BEHNKE M. Selection of potato callus for resistantce to culture filtrates of phitophtora infestance and regenerations of resistant plants. Theor. and Appl., 1979, v.55, p.69-71. 100%), где а - количество пораженных стеблей; в - соответствующий балл поражения; N - количество учтенных растений; К - высший балл шкалы. Растения, имеющие нулевой индекс развития болезни, считают устойчивыми к ризоктониозу. Такие растения отбирают и используют как исходный материал картофеля, устойчивый к ризоктониозу для улучшения сорта. Отличительными признаками заявляемого способа по сравнению с прототипом являются: 1. В качестве исходных форм картофеля используют интактные растения, выращенные in vitro, а не каллусную культуру, что позволяет упростить способ и снизить трудоемкость, связанную с получением регенерантов. 2. Исходные формы картофеля подвергают облучению гамма-излучением в дозе 1500-3000 рентген, что позволяет получить большее количество мутантных форм и выделить более устойчивые к ризоктониозу формы, чем среди необлученных. 3. Черенки облученных растений выращивают последовательно, сначала на селективной питательной среде, содержащей 40-50% культурального фильтрата R. solani AG 3 штамма 1, а выжившие растения подвергают отбору на второй селективной среде, содержащей 80-100% культурального фильтрата более фитотоксичного штамма 2, что позволяет повысить эффективность способа в получении более устойчивых форм. 4. Отселектированные таким образом растения высаживают в грунт, зараженный инокулюмом этих же штаммов, что позволяет оценить степень их устойчивости к ризоктониозу и повысить надежность отбора. При этом концентрация патогенов в грунте составляет 12-14 пропагул на 100 г почвы, что соответствует естественному фону этого возбудителя в природе. Изобретение иллюстрируется следующими примерами конкретного выполнения способа. Пример 1. Селекция форм картофеля на устойчивость к ризоктониозу была проведена на 6 сортах картофеля: Адретта, Роза Сибири, Русте, Санте, Снегирь и Ранний Желтый в лабораторных и тепличных условиях Института цитологии и генетики СО РАН. Исходные растения картофеля (7-10 пробирок каждого сорта), выращенные в условиях in vitro, были облучены дозой 3000 рентген. Облученные растения были разрезаны на черенки с единичными пазушными почками и высажены по 5-10 штук в стаканчики на селективную среду, состоящую из среды Мурасига-Скуга с добавлением 40-50% культурального фильтрата R.solani AG-3 штамма 1, выращенного на среде Ричардса в течение 14 дней. Выжившие почки отсаживали на среду Мурасига-Скуга, где их размножали. Выросшие растения снова черенковали таким же образом, как и в первом случае и затем высаживали на вторую селективную среду, содержащую 80-100% культурального фильтрата R.solani AG-3 штамма 2, обладающего большей фитотоксичностью, чем штамм 1. Выжившие почки отсаживали для микроклонального размножения на среду Мурасига-Скуга, а затем высадили в теплице в вазонах с почвой, искусственно зараженной инокулюмом этих же двух штаммов R.solani AG-3. После 3-х месяцев вегетации провели оценку данного материала на устойчивость к ризоктониозу. В таблице 1 приведены данные по влиянию отбора на культуральном фильтрате R.solani на устойчивость к ризоктониозу. Из данных таблицы 1 видно, что проведенный двухкратный отбор в очень жестких условиях второго отбора на 100% культуральном фильтрате штамма 2 дает возможность отобрать растения с нулевым индексом развития болезни. Так, растения сорта Санте, при однократном отборе на первой селективной среде с 40% концентрацией культурального фильтрата имели индекс развития болезни 20%, а прошедшие двукратный отбор имели нулевой индекс развития болезни. Растения сорта Адретта менее устойчивы к ризоктониозу. Так, в контроле, растения сорта Санте имели 40% индекс развития болезни, а у Адретты - 80% и растения после однократного отбора имели индекс 60%, но после двукратного отбора растения имели нулевой индекс. В таблице 2 представлены данные по влиянию генотипа сорта картофеля на результаты отбора на культуральном фильтрате R.solani. Из таблицы 2 видно, что исследуемые сорта имеют разную устойчивость к ризоктониозу. Так, сорта Роза Сибири, Ранний желтый и Русте более устойчивы, чем Снегирь и Адретта. Но на всех сортах, даже после однократного отбора, удалось получить растения, более устойчивые к ризоктониозу. Так, у сортов Роза Сибири и Ранний желтый получили растения с нулевым индексом развития болезни, а у неустойчивых сортов (сорт Снегирь) получены растения с 20% индексом развития болезни по сравнению с 60% в контроле; у Адретты с 30% по сравнению с 80% индексом развития болезни в контроле. В результате были получены следующие устойчивые формы. Из сорта Санте было выделено 2 полностью устойчивые формы. Из сорта Роза Сибири 1 форма. Из сорта Ранний желтый - 1. Из сорта Адретта - 1. Из сортов Снегирь и Русте полностью устойчивых форм выделить не удалось, но отобранные из них формы показали большую устойчивость по сравнению с исходным сортом. Отобранные формы картофеля использовали в дальнейшей селекционной роботе как исходный материал, для получения устойчивых к ризоктониозу сортов. Используя экспериментально подобранные оптимальные условия двухстадийного отбора на селективной питательной среде, содержащей культуральные фильтраты вышеназванных штаммов в определенных концентрациях, можно за короткое время получить устойчивые к ризоктониозу формы картофеля. Весь технологический процесс может занять следующее время: 14 дней на получение культурального фильтрата на среде Ричардса, затем 7 дней на селективной среде с метаболитами 1-го штамма, размножение отобранных растений 3-5 недель, затем 7 дней на селективной среде с метаболитами 2-го штамма, затем размножение до нужного количества (3-7 недель), высадка в грунт или в теплицу на инфекционный фон и окончательная оценка и отбор устойчивых форм растений (3 месяца). То есть весь процесс может занять от 22 до 28 недель (5,5-7 месяцев). Способ прост в исполнении, не требует получения регенерантов. Источники информации Прототип: BEHNKE M. Selection of potato callus for resistantce to culture filtrates of phitophtora infestance and regenerations of resistant plants. Theor. and Appl., 1979, v.55, p.69-71.
Формула изобретенияСпособ селекции картофеля на устойчивость к ризоктониозу, включающий облучение исходного материала гамма-излучением, культивирование материала на селективной питательной среде, содержащей токсичную концентрацию культурального фильтрата патогена, высаживание в грунт отселектированных на устойчивость растений и последующий отбор растений, устойчивых к патогену, отличающийся тем, что в качестве исходного материала используют интактные растения, выращенные in vitro, культивирование черенков проводят сначала на среде, содержащей 40-50% культурального фильтрата штамма Rhizoctonia solani AG 3 № 1, а затем на среде, содержащей 80-100% культурального фильтрата штамма Rhizoctonia solani AG 3 № 2, а отселектированные растения высаживают в грунт, зараженный двумя этими же штаммами.2. Способ по п.1, отличающийся тем, что исходные растения облучают в дозе 1500-3000 ренген.3. Способ по п.1, отличающийся тем, что зараженный грунт содержит по 6-7 пропагул каждого из штаммов Rhizoctonia solani AG 3 № 1 и Rhizoctonia solani AG 3 № 2 на 100 г почвы.MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 20.11.2003 Извещение опубликовано: 20.12.2004 БИ: 35/2004 Популярные патенты: 2165141 Тепличный гидропонный комплекс ... наружной 10 и внутренних 11 дверей. Такая топология помещений позволяет, кроме того, рационально разместить оборудование электропитания, водоснабжения и управления, что облегчает эксплуатацию тепличного комплекса. Выполнение пола вегетационных отсеков 7 в виде сплошного бетонного полового покрытия 5 надежно изолирует их от грунта, в котором могут содержаться болезнетворные образования и обитают переносчики инфекции. Конструкция тепличного комплекса предусматривает регулируемый обмен воздуха внутри вегетационных отсеков 7. При этом снабжение вентиляционных форточек 12 мелкоячеистой сеткой позволяет предотвратить проникновение внутрь вегетационных отсеков 7 летучих и ползучих ... 2444769 Жидкостный резервуар, устройство наблюдения для наблюдения под поверхностью жидкости и оптическая пленка ... поверхностью жидкости, включающих в себя защитные очки и акваскопы. Например, в защитных очках может происходить отражение на поверхности линзы.В качестве технологии предотвращения такого отражения от поверхности "микрорельефная структура", разновидность наноструктуры, известна в области оптических материалов. Микрорельефная структура включает в себя большое количество наноскопических конических выступов, сформированных, например, на поверхности прозрачной подложки. Согласно патентным документам 3-6 микрорельефная структура допускает непрерывное изменение показателя преломления от воздуха к прозрачной подложке, в результате чего падающий свет не распознает границу раздела ... 2057432 Биологический состав кузнецова для подсочки деревьев, в том числе каучуконосов (варианты), и способ его приготовления ... активированный ацетил, легко проникаемый в цитоплазму клетки, в митохондрии клетки в цикл Кребса совместно с оксалоацетатом, обеспечивающим цикличность подачи энергии при большой утечке ее из цикла Кребса на различные биосинтезы. Таким образом, недостатка ацетил-КоА для биосинтеза изопреноидов, при огромной массе продуктов биосинтеза, большинство которых свой углерод в цикл Кребса подают через ацетил-КоА, не ощущается. Активный транспорт, в свою очередь, требует усиленного потребления энергии. Таким источником энергии являются ионы натрия. Здесь важную роль играет калийно-натриевый насос электронов, работу которого активирует поступление в межмембранную липидную прослойку продуктов ... 2067798 Агромостовой комплекс ... и в режиме непрерывного фронтального движения, например, для предварительного прокоса трав около главной жесткой колеи и около колей у концов фермы, прежде, чем начать челночную уборку продукта в старт-стопном режиме использования агромоста. При этом исполнительные сельхозорудия повертывают на 90o и ставят в одно из положений, указанных на фиг. 3 пунктиром. В этом же режиме движения агромоста выполняют и другие работы, не требующие больших энергетических затрат на взаимодействие с грунтом и растениями, например, дождевание, опыление, опрыскивание по всему фронту движения агромоста. Положительный эффект устройства в том, что: комплекс обладает одной жесткой колеей, ... 2414114 Зерноуборочный комбайн ... свидетельство 1510763 А1, М. кл 4 A01D 41/12. Наклонная камера зерноуборочного комбайна. / Э.Г.Федоренко, А.И.Бортников, Н.В.Ефимкин, А.В.Черногубов, И.Я.Мамай (СССР). - Заявка 4399744/30-15; Заявлено 15.02.1988; Опубл. 30.09.1989, Бюл. 36 // Открытия. Изобретения. - 1989. - 36).Описанная наклонная камера не обеспечивает получение семенного материала при обмолоте любых с.-х. культур. Известна молотилка для обмолота сельскохозяйственных культур, включающая два последовательно расположенных молотильных барабана и охватывающие их решетчатые подбарабанья, снабженные первое на выходе, а второе на входе регулируемыми направляющими щитками, основную и дополнительную ... |
Еще из этого раздела: 2469534 Перезаряжаемая электронная ловушка для животных с перегородкой, механическим переключателем в конфигурации с множеством поражающих пластин 2476277 Способ защиты почв от остатков пестицидов 2020793 Способ выращивания растений и стаканчик для его осуществления 2040900 Фунгицидное средство 2157612 Способ уборки корней растений, преимущественно лакрицы, и устройство для его осуществления 2209542 Контейнер 2446659 Способ и устройство для органического возделывания зерновых культур 2114555 Способ электродиагностики вымени крупного рогатого скота и устройство для его осуществления 2493697 Технологическая линия для подготовки к скармливанию пророщенного зерна 2492650 Микроэмульсионная бактерицидная композиция |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||