Способ потенциации пестицидной активности пестицида, полученного на основе бактерий, относящихся к роду bacillusПатент на изобретение №: 2192744 Автор: ЛИДСТЕР Уильям Д. (US), МАКИНТОШ Сузан К. (US), МЭНКЕР Дэнайз К. (US), СТАНИС Роберт Л. (US) Патентообладатель: АББОТТ ЛАБОРЭТРИЗ (US) Дата публикации: 10 Февраля, 2000 Начало действия патента: 30 Мая, 1996 Адрес для переписки: 103055, Москва, а/я 11, пат.пов. Н.К.Попеленскому Изображения 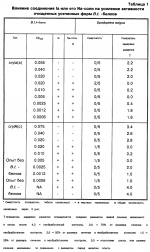   Изобретение относится к биотехнологии, а именно к микробиологическому способу получения потенциатора пестицидной активности пестицида. Способ состоит в получении путем культивирования бактерий рода Bacillus (Bacillus thuringiensis) вещества структуры I или его соли, применяемого совместно с пестицидом, полученным на основе бактерий, относящихся к роду Bacillus. Способ с использованием вышеуказанного потенциатора позволяет многократно усилить активность кристаллических дельта-эндотоксинов белковой природы, выделенных из Bacillus thuringiensis. 10 з.п.ф-лы., 7 табл., 4 ил. Эта заявка является частичным продолжением заявки США 08/295283, поданной 23.08.1994, которая в свою очередь является частичным продолжением заявки США 08/146852, поданной 03.11.1993, которая является частичным продолжением заявки США 08/095240, поданной 20.07.1993, которая является частичным продолжением заявки США 07/990202, поданной 14.12.92, которая является частичным продолжением заявки США 07/971786, поданной 05. 11. 1992. Область техники, к которой относится изобретение Изобретение относится к способу получения и идентификации потенциатора, который усиливает активность пестицида, имеющего отношение к бактериям рода Bacillus, пестицида, полученного химическим путем, и/или вируса, имеющего пестицидные свойства. Предшествующий уровень техники Каждый год из-за вредителей, наносящих урон сельскому хозяйству, лесам и здоровью людей, приходится тратить миллионы долларов. Для регулирования распространения вредителей используют несколько подходов. Один из них заключается в использовании химических пестицидных средств с широким диапазоном или спектром действия. Однако использование химических пестицидов имеет ряд недостатков. В частности, из-за широкого спектра действия такие пестициды могут отрицательно воздействовать и на другие, не предназначенные для этого организмы, такие как полезные насекомые и паразиты насекомых-вредителей. Кроме этого, химические пестициды часто токсичны для животных и человека. Далее у подлежащих уничтожению вредителей нередко развивается резистентность к пестицидам при их многократном применении. Другой путь заключается в использовании биопестицидов для регулирования насекомых, грибков и сорняков. Биопестициды представляют собой природные патогены и/или вещества, продуцируемые данными патогенами. Преимущество использования биопестицидов состоит в том, что они, в целом, менее опасны для остальных организмов и окружающей среды по сравнению с химическими пестицидами. Bacillus thuringiensis Наиболее широко используемый биопестицид - Bacillus thuringiensis. Bacillus thuringiensis - это подвижные палочкообразные грамположительные бактерии, которые широко распространены в природе, особенно в почве и других объектах, зараженных насекомыми. Во время споруляции Bacillus thuringiensis образует параспоральные кристаллические включения, которые обладают инсектицидной активностью при проглатывании личинками чувствительных насекомых отрядов Lepidoptera, Diptera и Coleoptera. Включения могут варьировать по размеру, количеству и составу. Они включают один или несколько белков, названных дельта-эндотоксинами, которые могут иметь мол. массу от 27 до 140 кДа. Инсектицидные дельта-эндотоксины расщепляются под действием протеаз в кишечном тракте личинки с образованием меньших по размерам усеченных токсичных полипептидов, вызывающих повреждение кишечника и в конце концов гибель насекомого (Hofte and Whiteley, 1989, Microbiological Reviews 53: 242-255). Известны различные штаммы Bacillus thuringiensis, используемые в качестве биопестицидов в лесоводстве, сельском хозяйстве и озеленении. Bacillus thuringiensis subsp. kurstaki и Bacillus thuringiensis subsp. aizawai продуцируют дельта-эндотоксины, специфичные к Lepidoptera. Дельта-эндотоксин, специфичный к Coleoptera, продуцируется Bacillus thuringiensis subsp. tenebrionis (Krieg et al., 1988, U.S. Патент 4766203). Далее, Bacillus thuringiensis subsp. israelensis продуцирует дельта-эндотоксины, специфичные к Diptera (Goldberg, 1979, US, патент 4166112). Описаны также и другие штаммы Bacillus thuringiensis, специфичные к вредителям отряда Diptera. Установлено, что изолят Bacillus thuringiensis токсичен для Diptera и Lepidoptera (Hodgman et al., 1993, FEMS Microbiology Letters, 114: 17-22). С помощью электрофореза в SDS-полиакриламидном геле очищенного кристаллического дельта-эндотоксина из указанного изолята обнаружены три вида белков, соответствующих cryIA(b)-, cryIB- и cryIIA-токсинам. Также описан изолят Bacillus thuringiensis, продуцирующий кристаллические белки с мол. массой 140, 122, 76, 72 и 38 кДа, активные в отношении насекомых отряда Diptera (Payne, 1994, US, патент 5275815). В заявке ЕР 480762 описывается пять штаммов В.t., каждый из которых является активным в отношении вредителей, относящихся к отряду Diptera, и содержит уникальный кристаллический эндоксин. Описаны несколько штаммов Bacillus thuringiensis, обладающих пестицидной активностью по отношению к вредителям, не относящимся к отрядам Lepidoptera Coleoptera и Diptera. Охарактеризованы пять штаммов Bacillus thuringiensis, продуцирующие дельта-эндотоксины, токсичные для нематод (Edwards, Payne, and Soares, 1988, ЕР, патент 0303426 В1). Описан также штамм Bacillus thuringiensis PS81F, который можно использовать для лечения людей и животных, зараженных паразитическими простейшими (Thompson и Gaertner, 1991, ЕР, заявка 0461799 А2). Кроме того, идентифицированы определенные изоляты Bacillus thuringiensis, которые обладают активностью против клещей. Данные изоляты продуцируют кристаллические белки с молекулярной массой в широком диапазоне, а именно от 35 кДа до 155 кДа (Payne, Cannon и Bagley, 1992, заявка РСТ WO 92/19106). Описаны также штаммы Bacillus thuringiensis, активные против вредителей отряда Hymenoptera (Payne, Kennedy, Randall, Meier and Uick, 1992, ЕР, заявка 0516306 А2); вредителей отряда Hemiptera (Payne and Cannon, 1993, US, патент 5262159); трематод (Hickle, Sick, Schwab, Narva and Payne, 1993, US, патент 5262399); и вредителей отряда Phthiraptera (Payne and Hickle, 1993, US, патент 5273746). Далее, было обнаружено, что другой штамм Bacillus thuringiensis subsp. kurstaki WB3S-16, выделенный из обрезков шерсти австралийской овцы, является токсичным по отношению к воши Damalinia ovis, вредителю отряда Phthiraptera (Drummond. Miller and Pinnock, 1992, J. Invert. Path. 60: 102-103). Дельта-эндотоксины кодируются cry-генами (от англ. crystal protein - кристаллический белок), которые в основном локализованы в плазмидах. cry-Гены подразделяют на шесть классов и несколько подклассов в зависимости от относительной гомологии аминокислот и пестицидной специфичности. Главными классами являются: Lepidoptera-специфичные (cry I); Lepidoptera- и Diptera-специфичные (cry II); Coleoptera-специфичные (cry III); Diptera-специфичные (cry IV) (Hofte and Whiteley, 1989, Microbiological Reviews 53: 242-255); Coleoptera- и Lepidoptera-специфичные (отнесенные к cry V генам Taylor'ом et al., 1992, Molecular Microbiology 6:1211-1217); и нематод-специфичные (отнесенные к cry V и cry VI генам Feitelson et al., 1992, Bio/Technology 10: 271-275). Дельта-эндотоксины получают методами рекомбинантных ДНК. Полученные методами рекомбинантных ДНК дельта-эндотоксины могут быть в кристаллической форме или нет. Показано, что некоторые штаммы Bacillus thuringiensis продуцируют термоустойчивый, обладающий пестицидной активностью аденин-нуклеотидный аналог, известный как  -экзотоксин типа I, или "турингиензин", который сам по себе является пестицидом (Sebesta et al., in Н. D. Burges (ed.), Microbial Control of Pests and Plant Diseases, Academic Press, New York, 1980, pp. 249-281). -экзотоксин типа I, или "турингиензин", который сам по себе является пестицидом (Sebesta et al., in Н. D. Burges (ed.), Microbial Control of Pests and Plant Diseases, Academic Press, New York, 1980, pp. 249-281).  -Экзотоксин типа I обнаружен в суспернанте некоторых культур Bacillus thuringiensis. Он имеет молекулярную массу, равную 701, и состоит из аденозина, глюкозы и аллариковой кислоты (Farkas et al., 1977, Coll. Czechosslovak Chem. Comm. 42: 909-929; Lutny et al., in Kurstar (ed.), Microbial and Viral Pesticides, Marcel Dekker, New York, 1982, pp. 35-72). Круг его хозяев включает, но не ограничивается указанным: Musca domestica, Mamestra configurata Walker, Tetranychus urticae, Drosophila melanogaster и Tetranychus cinnabarinus. Полагают, что токсичность -Экзотоксин типа I обнаружен в суспернанте некоторых культур Bacillus thuringiensis. Он имеет молекулярную массу, равную 701, и состоит из аденозина, глюкозы и аллариковой кислоты (Farkas et al., 1977, Coll. Czechosslovak Chem. Comm. 42: 909-929; Lutny et al., in Kurstar (ed.), Microbial and Viral Pesticides, Marcel Dekker, New York, 1982, pp. 35-72). Круг его хозяев включает, но не ограничивается указанным: Musca domestica, Mamestra configurata Walker, Tetranychus urticae, Drosophila melanogaster и Tetranychus cinnabarinus. Полагают, что токсичность  -экзотоксин типа I обусловлена ингибированием ДНК-зависимой РНК-полимеразы при конкурировании с АТФ. Было показано, что -экзотоксин типа I обусловлена ингибированием ДНК-зависимой РНК-полимеразы при конкурировании с АТФ. Было показано, что  -экзотоксин типа I кодируется cry плазмидой в пяти штаммах Васillus thuringiensis (Levinson et al., 1990, J. Bacteriol. 172: 3172-3179). Установлено, что -экзотоксин типа I кодируется cry плазмидой в пяти штаммах Васillus thuringiensis (Levinson et al., 1990, J. Bacteriol. 172: 3172-3179). Установлено, что  -экзотоксин типа I продуцируется Bacillus thuringiensis subsp. thuringiensis серотипа 1, Bacillus thuringiensis subsp. tolworthi серотипа 9, и Bacillus thuringiensis subsp. darmstadinsis серотипа 10. Описан другой -экзотоксин типа I продуцируется Bacillus thuringiensis subsp. thuringiensis серотипа 1, Bacillus thuringiensis subsp. tolworthi серотипа 9, и Bacillus thuringiensis subsp. darmstadinsis серотипа 10. Описан другой 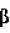 -экзотоксин, классифицированный как -экзотоксин, классифицированный как  -экзотоксин типа II (Levinson et al. , 1990, J. Bacteriol. 172: 3172-3179). Установлено, что -экзотоксин типа II (Levinson et al. , 1990, J. Bacteriol. 172: 3172-3179). Установлено, что  -экзотоксин типа II продуцируется Bacillus thuringiensis subsp. morrisoni серотипа 8 ab и является активным против Leptinotarsa decemlineata. Структура -экзотоксин типа II продуцируется Bacillus thuringiensis subsp. morrisoni серотипа 8 ab и является активным против Leptinotarsa decemlineata. Структура 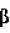 -экзотоксина типа II полностью не известна, но она существенно отличается от структуры -экзотоксина типа II полностью не известна, но она существенно отличается от структуры 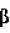 -экзотоксина типа I, в котором псевдоуридиновая группа занимает положение аденина в точке присоединения к рибозному кольцу, которая в противном случае была бы занята водородом. (Levinson, in Hickle and Finch (eds. ), Analytical Chemistry of Bacillus thuringiensis, ACS Sumposium Series, Washington, D. C. 1990, pp.114-136). Далее, в протоновом ЯМР-спектре получен только один сигнал, соответствующий нуклеотидному основанию (при 7,95 ppm), и не получено сигнала аномерного белка рибозного типа (5,78 ppm). Другие водорастворимые вещества, которые были выделены из Bacillus thuringiensis, включают альфа-экзотоксин, который токсичен по отношению к личинкам Musca domestica (Luthy, 1980, FEMS Microbiol. Lett. 8:1-7); гамма-экзотоксины, представляющие собой различные ферменты, включающие лецитиназы, хитиназы и протеазы, токсические эффекты которых проявляются только в сочетании с бета-экзотоксином (Forsberg et al., 1976, Bacillus thuringiensis: Its Effects on Environmental Quality, National Research Council of Canada, NRC Associate Committee on Scientific Criteria for Environmental Quality, Subcommittees on Pesticides and Related Compounds and Biological Phenomena); сигма-экзотоксин, который имеет структуру, подобную таковой бета-экзотоксина, и тоже активен против Leptinotarsa decemlineata (Arganeer et al., 1991, J. Entomol. Sci 26:206-213); и ангидротурингиензин (Prystas et al., 1975, Coll. Czechosslovak Chem. Comm. 40:1775). Цвиттермицин Из Bacillus cereus было выделено вещество, которое ингибирует рост вредителя растений Phytophthora medicaginis и уменьшает заражение люцерны (см. , например, US, патент 4877738 и 4878936). Никакой другой активности обнаружено не было. Нижеследующая формула характеризует структуру цвиттермицина А (Не et al., Tet. Lett. 35: 2499-2502): -экзотоксина типа I, в котором псевдоуридиновая группа занимает положение аденина в точке присоединения к рибозному кольцу, которая в противном случае была бы занята водородом. (Levinson, in Hickle and Finch (eds. ), Analytical Chemistry of Bacillus thuringiensis, ACS Sumposium Series, Washington, D. C. 1990, pp.114-136). Далее, в протоновом ЯМР-спектре получен только один сигнал, соответствующий нуклеотидному основанию (при 7,95 ppm), и не получено сигнала аномерного белка рибозного типа (5,78 ppm). Другие водорастворимые вещества, которые были выделены из Bacillus thuringiensis, включают альфа-экзотоксин, который токсичен по отношению к личинкам Musca domestica (Luthy, 1980, FEMS Microbiol. Lett. 8:1-7); гамма-экзотоксины, представляющие собой различные ферменты, включающие лецитиназы, хитиназы и протеазы, токсические эффекты которых проявляются только в сочетании с бета-экзотоксином (Forsberg et al., 1976, Bacillus thuringiensis: Its Effects on Environmental Quality, National Research Council of Canada, NRC Associate Committee on Scientific Criteria for Environmental Quality, Subcommittees on Pesticides and Related Compounds and Biological Phenomena); сигма-экзотоксин, который имеет структуру, подобную таковой бета-экзотоксина, и тоже активен против Leptinotarsa decemlineata (Arganeer et al., 1991, J. Entomol. Sci 26:206-213); и ангидротурингиензин (Prystas et al., 1975, Coll. Czechosslovak Chem. Comm. 40:1775). Цвиттермицин Из Bacillus cereus было выделено вещество, которое ингибирует рост вредителя растений Phytophthora medicaginis и уменьшает заражение люцерны (см. , например, US, патент 4877738 и 4878936). Никакой другой активности обнаружено не было. Нижеследующая формула характеризует структуру цвиттермицина А (Не et al., Tet. Lett. 35: 2499-2502): 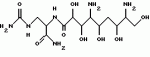 Сущность изобретения Усилия специалистов направлены на повышение активности пестицидов на основе В.t. Для этого ведется поиск новых штаммов с повышенным уничтожающим воздействием, предпринимаются попытки искусственного создания таких штаммов и разработки более эффективных препаратов путем комбинирования спор и кристаллов В. t. с новыми пестицидными носителями, химическими пестицидами или потенциаторами (усилителями) их активности (см., например, US, патент 5250515, касающийся ингибитора трипсина). Таким образом, предметом настоящего изобретения является усиление пестицидной активности соответствующих средств. Изобретение относится к способу потенциации, который усиливает активность пестицида, полученного на основе бактерий рода Bacillus, включающему следующие стадии: а) культивирование штамма Bacillus в подходящих условиях; б) выделение указанного потенциатора из супернатанта культуры, полученной на стадии а). Штамм Bacillus, в частности, выбирают из группы, включающей Bacillus subtilis, Bacillus licheniformis и Bacillus thuringiensis. Предпочтительно потенциатор получают по существу в очищенной форме. Используемое здесь понятие "по существу очищенный потенциатор" означает, что данный потенциатор содержит менее 10% примесей, например, белкового дельта-эндотоксина. Такой, по существу, очищенный потенциатор может быть получен выделением, например хроматографией на колонке. Используемое здесь понятие "потенциатор" означает вещество (фактор), которое, не обладая само по себе значительной пестицидной активностью, например, имеющее LC50 более чем около 3000 мкг/г, как определено методом биологического анализа (Раздел "Сведения, подтверждающие возможность осуществления изобретения") (LC50 - это концентрация вещества, необходимая для уничтожения 50% вредителей), способствует увеличению пестицидной активности пестицида, полученного на основе бактерий рода Bacillus, по крайней мере на 50% и не вызывает задержки развития личинок. Известны и другие вещества, способные усиливать активность пестицидов, такие как ингибиторы трипсина и экзотоксины, обладающие пестицидной активностью. В предпочтительном варианте осуществления изобретения целевой потенциатор является водорастворимым. В соответствии с приведенным здесь определением вещество или соединение является "водорастворимым", если по крайней мере 1 мг вещества может быть растворен в 1 мг воды. Потенциатор способен усиливать пестицидную активность химических пестицидов и/или вируса с пестицидными свойствами. Используемое здесь понятие "пестицид, полученный на основе бактерий рода Bacillus", означает штамм Bacillus (например, Bacillus thuringiensis или Bacillus subtilis), споры или вещество, например белок или его фрагмент, обладающие активностью против вредителей или способные уничтожать вредителей, или микроорганизм, способный экспрессировать ген Bacillus, кодирующий белок Bacillus или его фрагмент, обладающие активностью против вредителей или способные уничтожать вредителей (например, дельта-эндотоксин Bacillus thuringiensis), в сочетании с подходящим носителем. Вредитель может представлять собой насекомое, нематоду, клеща или улитку. Микроорганизмы, способные экспрессировать ген Bacillus, кодирующий белок Bacillus или его фрагмент, обладающие активностью против вредителей или способные уничтожать вредителей, обитают на поверхности листьев растений, и/или в ризосфере (почве у корней растений), и/или в водной среде и способны успешно конкурировать в определенном окружении (сельскохозяйственные культуры или другие места обитания насекомых) с микроорганизмами дикого типа и устойчиво экспрессировать ген Bacillus, кодирующий белок Bacillus или его фрагмент, обладающие активностью против вредителей или способные уничтожать их. Примеры таких микроорганизмов включают (но не ограничиваются указанными) бактерии, например, родов Bacillus, Pseudomonas, Erwinia, Serratia, Klebsiella, Xanthomonas, Streptomyces, Rhizobium, Rhodopseudomonas, Methylophilius, Agrobacterium, Acetobacter, Lactobacillus, Arthrobacter, Azotobacter, Leuconostoc, Alcaligenes и Clostridium; водоросли, например, семейств Cyanophyceal, Prochlorophyceae, Rhodophyceae, Dinophyceae, Chrysophyceal, Prymnesiophyceae, Xanthophyceal, Raphidophyceal, Bacillariophycee, Eustigmatophycee, Gryptophyceae, Euglenophyceae, Prasinophyceae и Chlorophyceae и грибы, особенно дрожжи, и, например, родов Saccharomyces, cryptococcus, Kluyveromyces, Sporobolomyces, Rhodotorula и Awreobasidium. Используемое здесь понятие "пестицидная активность" соответствует степени активности в отношении вредителей, которая достаточна для уничтожения или остановки роста вредителей или защиты растений от заражения вредителями. Полученный согласно заявленному изобретению потенциатор может быть включен в композицию, содержащую потенциатор и пестицидный носитель, так же, как и потенциатор и пестицид, полученный на основе бактерий рода Bacillus, химический пестицид и/или вирус с пестицидными свойствами. Такие композиции могут использоваться для контроля вредителей и снижения устойчивости вредителей к пестициду на основе Bacillus, включая обеспечение контакта вредителей с указанной композицией, содержащей потенциатор и носитель, или усиления активности пестицида, полученного на основе Bacillus. Изобретение также относится к способу идентификации указанного потенциатора, включающему следующие стадии: а) культивирование штамма Bacillus; б) выделение супернатанта культуры, полученной на стадии а); и в) исследование супернатанта на способность усиливать активность пестицида, полученного на основе Bacillus. Перечень чертежей На фиг.1 схематически показана основная методика, используемая для очистки Ia. На фиг.2 показан 13С ЯМР-спектр Ia. На фиг.3 показан протоновый ЯМР-спектр Ia. На фиг.4 показаны результаты nОе-экспериментов с ацетилированным производным Ia. Сведения, подтверждающие возможность осуществления изобретения Заявленный потенциатор усиливает активность пестицида на основе бактерий рода Bacillus и может иметь молекулярную массу от около 350 до около 1200 или в предпочтительном случае от около 350 до около 700. Фактор усиливает активность пестицида на основе бактерий рода Bacillus по меньшей мере примерно в 1,5-1000 раз, предпочтительно в 100-400 раз. В определенном варианте осуществления изобретения потенциатор усиливает пестицидную активность дельта-эндотоксина Bacillus thuringiensis, включая (но не ограничиваясь указанным) cry I (cry IA, cry IB и cry IC), cry II, cry III, cry IV, cry V или cry VI белок полной длины или подвергнутый протеолизу, или имеющий усеченную форму, примерно в 1,5-1000 раз. В частности, потенциатор усиливает действие дельта-эндотоксина В. t. приблизительно в 100-400 раз. Кроме того, потенциатор может усиливать пестицидную активность химического пестицида и/или вируса с пестицидными свойствами. Фактор может быть водорастворимым, стабильным в воде при нагревании до 1000oС по крайней мере в течение 5 минут, стабильным при воздействии прямого солнечного света по крайней мере около 10 часов и/или стабильным при рН около 2 в течение 10 дней. Фактор имеет 13 углеродных атомов. Кроме того, потенциатор может иметь 1Н ЯМР колебания при (1,5, 3,22, 3,29, 3,35, 3,43, 3,58, 3,73, 3,98, 4,07, 4,15, 4,25, 4,35. В самом предпочтительном варианте осуществления изобретения данный потенциатор имеет структуру Ia или представляет собой соответствующую соль. Сущность изобретения Усилия специалистов направлены на повышение активности пестицидов на основе В.t. Для этого ведется поиск новых штаммов с повышенным уничтожающим воздействием, предпринимаются попытки искусственного создания таких штаммов и разработки более эффективных препаратов путем комбинирования спор и кристаллов В. t. с новыми пестицидными носителями, химическими пестицидами или потенциаторами (усилителями) их активности (см., например, US, патент 5250515, касающийся ингибитора трипсина). Таким образом, предметом настоящего изобретения является усиление пестицидной активности соответствующих средств. Изобретение относится к способу потенциации, который усиливает активность пестицида, полученного на основе бактерий рода Bacillus, включающему следующие стадии: а) культивирование штамма Bacillus в подходящих условиях; б) выделение указанного потенциатора из супернатанта культуры, полученной на стадии а). Штамм Bacillus, в частности, выбирают из группы, включающей Bacillus subtilis, Bacillus licheniformis и Bacillus thuringiensis. Предпочтительно потенциатор получают по существу в очищенной форме. Используемое здесь понятие "по существу очищенный потенциатор" означает, что данный потенциатор содержит менее 10% примесей, например, белкового дельта-эндотоксина. Такой, по существу, очищенный потенциатор может быть получен выделением, например хроматографией на колонке. Используемое здесь понятие "потенциатор" означает вещество (фактор), которое, не обладая само по себе значительной пестицидной активностью, например, имеющее LC50 более чем около 3000 мкг/г, как определено методом биологического анализа (Раздел "Сведения, подтверждающие возможность осуществления изобретения") (LC50 - это концентрация вещества, необходимая для уничтожения 50% вредителей), способствует увеличению пестицидной активности пестицида, полученного на основе бактерий рода Bacillus, по крайней мере на 50% и не вызывает задержки развития личинок. Известны и другие вещества, способные усиливать активность пестицидов, такие как ингибиторы трипсина и экзотоксины, обладающие пестицидной активностью. В предпочтительном варианте осуществления изобретения целевой потенциатор является водорастворимым. В соответствии с приведенным здесь определением вещество или соединение является "водорастворимым", если по крайней мере 1 мг вещества может быть растворен в 1 мг воды. Потенциатор способен усиливать пестицидную активность химических пестицидов и/или вируса с пестицидными свойствами. Используемое здесь понятие "пестицид, полученный на основе бактерий рода Bacillus", означает штамм Bacillus (например, Bacillus thuringiensis или Bacillus subtilis), споры или вещество, например белок или его фрагмент, обладающие активностью против вредителей или способные уничтожать вредителей, или микроорганизм, способный экспрессировать ген Bacillus, кодирующий белок Bacillus или его фрагмент, обладающие активностью против вредителей или способные уничтожать вредителей (например, дельта-эндотоксин Bacillus thuringiensis), в сочетании с подходящим носителем. Вредитель может представлять собой насекомое, нематоду, клеща или улитку. Микроорганизмы, способные экспрессировать ген Bacillus, кодирующий белок Bacillus или его фрагмент, обладающие активностью против вредителей или способные уничтожать вредителей, обитают на поверхности листьев растений, и/или в ризосфере (почве у корней растений), и/или в водной среде и способны успешно конкурировать в определенном окружении (сельскохозяйственные культуры или другие места обитания насекомых) с микроорганизмами дикого типа и устойчиво экспрессировать ген Bacillus, кодирующий белок Bacillus или его фрагмент, обладающие активностью против вредителей или способные уничтожать их. Примеры таких микроорганизмов включают (но не ограничиваются указанными) бактерии, например, родов Bacillus, Pseudomonas, Erwinia, Serratia, Klebsiella, Xanthomonas, Streptomyces, Rhizobium, Rhodopseudomonas, Methylophilius, Agrobacterium, Acetobacter, Lactobacillus, Arthrobacter, Azotobacter, Leuconostoc, Alcaligenes и Clostridium; водоросли, например, семейств Cyanophyceal, Prochlorophyceae, Rhodophyceae, Dinophyceae, Chrysophyceal, Prymnesiophyceae, Xanthophyceal, Raphidophyceal, Bacillariophycee, Eustigmatophycee, Gryptophyceae, Euglenophyceae, Prasinophyceae и Chlorophyceae и грибы, особенно дрожжи, и, например, родов Saccharomyces, cryptococcus, Kluyveromyces, Sporobolomyces, Rhodotorula и Awreobasidium. Используемое здесь понятие "пестицидная активность" соответствует степени активности в отношении вредителей, которая достаточна для уничтожения или остановки роста вредителей или защиты растений от заражения вредителями. Полученный согласно заявленному изобретению потенциатор может быть включен в композицию, содержащую потенциатор и пестицидный носитель, так же, как и потенциатор и пестицид, полученный на основе бактерий рода Bacillus, химический пестицид и/или вирус с пестицидными свойствами. Такие композиции могут использоваться для контроля вредителей и снижения устойчивости вредителей к пестициду на основе Bacillus, включая обеспечение контакта вредителей с указанной композицией, содержащей потенциатор и носитель, или усиления активности пестицида, полученного на основе Bacillus. Изобретение также относится к способу идентификации указанного потенциатора, включающему следующие стадии: а) культивирование штамма Bacillus; б) выделение супернатанта культуры, полученной на стадии а); и в) исследование супернатанта на способность усиливать активность пестицида, полученного на основе Bacillus. Перечень чертежей На фиг.1 схематически показана основная методика, используемая для очистки Ia. На фиг.2 показан 13С ЯМР-спектр Ia. На фиг.3 показан протоновый ЯМР-спектр Ia. На фиг.4 показаны результаты nОе-экспериментов с ацетилированным производным Ia. Сведения, подтверждающие возможность осуществления изобретения Заявленный потенциатор усиливает активность пестицида на основе бактерий рода Bacillus и может иметь молекулярную массу от около 350 до около 1200 или в предпочтительном случае от около 350 до около 700. Фактор усиливает активность пестицида на основе бактерий рода Bacillus по меньшей мере примерно в 1,5-1000 раз, предпочтительно в 100-400 раз. В определенном варианте осуществления изобретения потенциатор усиливает пестицидную активность дельта-эндотоксина Bacillus thuringiensis, включая (но не ограничиваясь указанным) cry I (cry IA, cry IB и cry IC), cry II, cry III, cry IV, cry V или cry VI белок полной длины или подвергнутый протеолизу, или имеющий усеченную форму, примерно в 1,5-1000 раз. В частности, потенциатор усиливает действие дельта-эндотоксина В. t. приблизительно в 100-400 раз. Кроме того, потенциатор может усиливать пестицидную активность химического пестицида и/или вируса с пестицидными свойствами. Фактор может быть водорастворимым, стабильным в воде при нагревании до 1000oС по крайней мере в течение 5 минут, стабильным при воздействии прямого солнечного света по крайней мере около 10 часов и/или стабильным при рН около 2 в течение 10 дней. Фактор имеет 13 углеродных атомов. Кроме того, потенциатор может иметь 1Н ЯМР колебания при (1,5, 3,22, 3,29, 3,35, 3,43, 3,58, 3,73, 3,98, 4,07, 4,15, 4,25, 4,35. В самом предпочтительном варианте осуществления изобретения данный потенциатор имеет структуру Ia или представляет собой соответствующую соль. 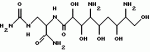 Соль должна обладать способностью усиливать действие пестицида на основе бактерий рода Bacillus. Получение потенциатора Потенциатор можно получить с помощью штаммов микроорганизмов рода Bacillus (например, Bacillus subtilis, Bacillus lichemiformis и Bacillus thuringiensis) при выращивании в качалочных колбах или ферментере. В одном варианте осуществления изобретения потенциатор можно получить из супернатанта культуры Bacillus thuringiensis, включая (но не ограничиваясь указанными микроорганизмами), Bacillus thuringiensis подвид kurstaki, Bacillus thuringiensis подвид aizawai, Bacillus thuringiensis подвид galleriae, Bacillus thuringiensis подвид entomocidus, Bacillus thuringiensis подвид tenebrionis, Bacillus thuringiensis подвид thuringiensis, Bacillus thuringiensis подвид alesti, Bacillus thuringiensis подвид canadiensis, Bacillus thuringiensis подвид darmstadiensis, Bacillus thuringiensis подвид dendrolimus, Bacillus thuringiensis подвид finitimus, Bacillus thuringiensis подвид kenyae, Bacillus thuringiensis подвид morrisoni, Bacillus thuringiensis подвид subtoxicus, Bacillus thuringiensis подвид, toumanoffi and Bacillus thuringiensis подвид israelensis. Предпочтительно потенциатор получают из супернатанта Bacillus thuringiensis subsp. kurstaki, Bacillus thuringiensis subsp. aizawai или Bacillus thuringiensis subsp. gallerial или их мутантов, имеющих в основном ту же самую усиливающую активность. В определенном варианте осуществления изобретения потенциатор выделяют из cry-Spo-мутанта Bacillus thuringiensis subsp. kurstaki. Bacillus можно культивировать, используя известные специалистам среды и технологию ферментации (см., например, Rogoff et al., 1969, J. Invertebrate Path. 14: 122-129; Dulmage et al., in Microbial Control of Pests and Plant Diseases, H.D. Burges, ed., Academic Press, N.Y. 1980). По завершении цикла выделяют супернатант, отделяя споры B.t. и кристаллы от культуральной ферментационной среды известным способом, например центрифугированием и/или ультрафильтрацией. Содержащийся в супернатанте потенциатор может быть выделен с помощью известных методов, например ультрафильтрацией, выпариванием и распылительной сушкой. Процедура очистки более подробно описана в нижеследующих разделах. Очистку потенциатора выполняют различными способами, известными специалистам, включая (но не ограничиваясь указанными) хроматографию (например, ионообменную, аффинную и гель-хроматографию на колонке), электрофоретические методы, перерастворение, экстракцию, а также любыми другими стандартными хорошо известными методами. Свойство потенциатора усиливать активность пестицидов на основе бактерий рода Bacillus, пестицидную активность вирусов, активность химических пестицидов, направленных против различных вредителей, может быть определено и исследовано с помощью известных методов, таких как применение искусственной диеты для насекомых, обработка листьев (поверхностная и погружение их в раствор), использование спреев для нанесения на листья и т. д. Специальные примеры таких исследований приведены ниже в Разделе "Пример: характеристика Iа". Композиции, содержащие потенциатор Полученный потенциатор может быть использован как сам по себе, так и совместно с пестицидами на основе бактерий рода Bacillus, который, как указано выше, может представлять собой штамм Bacillus, споры, белок или его фрагмент или другое вещество, обладающее активностью по отношению к вредителям или способствующее их уничтожению или предохраняющее растения от вредителей; с химическим пестицидом и/или энтомопатогенным вирусом и подходящим носителем в составе пестицидной композиции (композиций), которая, например, может представлять собой раствор, эмульсию, порошок, диспергируемые гранулы, смачиваемый порошок, эмульгируемый концентрат, аэрозоль или импрегнированные гранулы. Примерами таких штаммов Bacillus являются (но не ограничиваются указанными): Bacillus thuringiensis subsp. kurstaki (обозначаемые как DIPELTM от Abbott Laboratories, Inc. , JAVELINTM от Sandoz, BIOBITTM от Novo Nordisk A/S, FORAYTM от Novo Nordisk A/S, BIOCOTTM от Novo Nordisk A/S, MVPTM от Mycogen, BACTOSPEINETM от Novo Nordisk A/S, и THURICIDETM от Sandoz); Bacillus thuringiensis subsp. aizawai (обозначаемые как FLORBACTM от Novo Nordisk A/S, и XENTARITM от Abbott laboratories, Inc.); Bacillus thuringiensis subsp. enebrionis (обозначаемый как NOVODORTM от Novo Nordisk A/S, TRIDENTTM от Sandoz и M-TRAKTM и M-ONETM от Mycogen); Bacillus thuringiensis subsp. israelensis (обозначаемые или BACTIMOSTM или SKEETALTM от Novo Nordisk A/S, TEKNARTM от Sandoz, и VECTOBACTM от Abbotts Laboratories, Inc. ); Bacillus thuringiensis subsp. kurstaki/tenebrionis (обозначаемые как FOILTM от Eoogen); Bacillus thuringiensis subsp. kurstaki/aizawai (обозначаемые как CONDORTM от Ecogen и AGREETM от Ciba-Geigy); и Bacillus thuringiensis subsp. kurstaki/kurstaki (обозначаемые как CUTLASSTM от Ecogen). Белок Bacillus может быть выбран из группы, включающей (без ограничений указанным) cry I, cry II, cry III, cry IV, cry V, cry VI. Химический пестицид может, например, представлять собой регулятор роста насекомых, такой как дифторбензурон, карбомат, такой как тиодикарб и метомил, органофосфат, такой как хлорпирифос, пиретроид, такой как циперметрин и эсфенвалерат, неорганический фторид, такой как криолит, и пиррол. Энтомопатогенный вирус может быть бакуловирусом, например вирусом ядерного полиэдроза (NPV), Autographa californica, Syngrapha falcifera NPV, Cydia pomonella GV (вирус гранулеза), Heliothis zea, NPV, Lymantria dispar NPV, Orgyia pseudotsugata NPV, Spodoptera exigua NPV, Neodiprion lecontei NPV, Neodiprion sertifer NPV, Harrisina brillians NPV и Endopiza viteana Clemens NPV. В композиции, содержащей усиливающий активность потенциатор и пестицид, полученный на основе бактерий рода Bacillus, потенциатор может присутствовать в количестве по крайней мере 0,1 г/BIU или 0,05 г потенциатора на 1 г дельта-эндотоксина Bacillus и спор, около 300 г/BIU или 150 г потенциатора на 1 г дельта-эндотоксина Bacillus и спор, предпочтительно 2 г/BIU или 1 г потенциатора на 1 г дельта-эндотоксина Bacillus и спор. "BIU" означает здесь биллион международных единиц, определяемых биоисследованием. Биоисследование включает сравнение образца со стандартным материалом Bacillus при использовании Trichoplusia ni или другого насекомого в качестве стандартного насекомого для тестирования. Усиливающая активность определяется делением референс-стандарта LC50 и умножением на значение усиливающей активности референс-стандарта. В другом варианте осуществления изобретения композиция может включать потенциатор в очищенном виде или супернатант, полученный при выращивании Bacillus, в сухой, концентрированной или жидкой форме и приемлемый для пестицида носитель, примеры которых приведены в настоящем описании. Эта композиция может быть применена по отношению к отдельному растению, например к трансгенному растению. В частности, композиция может быть использована на растениях, уже содержащих и экспрессирующих ген Bacillus thuringiensis. В другом случае композиция может быть использована на растениях, предварительно подвергнутых воздействию композиции на основе Bacillus thuringiensis. В ином варианте композиция может быть использована в других местах обитания вредителей, относящихся к отряду Diptera, например в воде или почве. Целевое вещество (потенциатор активности) входит в состав композиции в интервале концентраций от около 0,001% до 60% (по весу). Композиция, состоящая из потенциатора и приемлемого для пестицида носителя, помимо контролирования вредителей может быть также использована для снижения устойчивости вредителей к пестициду. Альтернативно, композиция может быть использована для усиления действия пестицида, полученного на основе бактерий рода Bacillus. Композиция в одном случае может быть применена одновременно с пестицидом в количестве, составляющем по крайней мере примерно от 2 г потенциатора вещества/BIU до около 300 г потенциатора вещества/BIU. В другом случае композицию можно использовать как адъювант в последующие 24 часа после применения пестицида для пролонгирования действия оставшегося пестицида. Такие, описанные выше композиции могут быть получены добавлением поверхностно активного вещества, инертного носителя, консервирующего средства, увлажнителя, стимулятора поедания, аттрактанта, инкапсулирующего агента, связывающего агента, эмульгатора, красителя, УФ-протектора, буфера, агента, придающего текучесть, или другого компонента для облегчения манипуляций с продуктом и применения его по отношению к определенным вредителям. Подходящие поверхностно-активные вещества включают анионоактивные соединения, такие как карбоксилаты, например металлокарбоксилаты на основе длинноцепочечной жирной кислоты; N-ацилсаркозинат; моно- или диэфиры фосфорной кислоты с этоксилатами спиртов жирного ряда или соли этих эфиров; сульфаты спиртов жирного ряда, такие как доцетил сульфат натрия, октадецилсульфат натрия или цетилсульфат натрия; этоксилированные сульфаты спиртов жирного ряда; этоксилированные алкилфенольные сульфаты; сульфаты лингина; нефтяные сульфонаты; алкиларилсульфонаты, такие как алкилбензолсульфонаты или низшие алкилнафталинсульфонаты, например бутилнафталин сульфонат; соли сульфонированных нафталинформальдегидовых конденсатов; соли сульфонированных фенолформальдегидовых конденсатов или более сложные сульфонаты, такие как амидные сульфонаты, например сульфонированный продукт конденсации олеиновой кислоты и N-метилтаурина, или диалкилсульфосукцинаты, например сульфонат натрия или диоктилсукцинат. Неионные реагенты включают продукты конденсации; эфиры жирных кислот, спиртов жирного ряда, амидов жирных кислот или алкил- или алкинилзамещенных фенолов с этиленоксидом, эфиров жирных кислот многоатомных спиртов, например сорбитановые эфиры жирной кислоты; продукты конденсации указанных эфиров с этиленоксидом, например полиоксиэтилен сорбитаровые эфиры жирной кислоты, блок-сополимеры этиленоксида и пропиленоксида, гликоли ацетиленового ряда, такие как 2,4,7,9-тетраэтил-5-децин-4,7-диол, или этоксилированные гликоли ацетиленового ряда. Примеры катионных поверхностно-активных веществ включают, например, алифатический моно-, ди- или полиамин, скажем ацетат, нафтенат или олеат; кислородсодержащий амин, такой как аминоксид полиоксиэтиленалкиламида; содержащий амидные связи амин, полученный конденсацией карбоновой кислоты с ди- или полиамином; или четвертичную аммониевую соль. Примерами инертных носителей являются неорганические, минеральные материалы, такие как каолин, слюда, гипс, удобрение, филлосиликаты, карбонаты, сульфаты или фосфаты; органические вещества - сахар, крахмал, циклодекстрины; или ботанические материалы - продукты переработки древесины, пробка, кукурузные кочерыжки, истертые в порошок, рисовая шелуха, скорлупа орехов арахиса и грецких орехов. Композиции, которые являются предметом настоящего изобретения, могут быть получены как в форме, пригодной для непосредственного использования, так и в виде концентрата или первичной композиции, которая требует растворения в соответствующем количестве воды или другого растворителя перед применением. Концентрация пестицида может варьировать в зависимости от природы данной композиции и, особенно, от того, является она концентратом или формой, уже готовой к применению. Композиция содержит от 1 до 98% твердого или жидкого инертного носителя и 0-50%, предпочтительно 0,1-50% поверхностно-активного вещества. Применение указанных композиций будет осуществляться в соответствии с нормами, установленными для коммерческого продукта, предпочтительно от 1,84 г до 0,92 кг на га (от 4,54 г до 2,27 кг на акр) в сухом виде и от 0,0019 л до 4,76 л на га (от 0,0047 л до 11,75 л на акр) в жидком виде. Далее предварительная отработка кристаллического дельта-эндотоксина Bacillus thuringiensis и/или потенциатора может быть осуществлена до приготовления композиции для пролонгирования действия пестицида при применении в среде, зараженной вредителями, поскольку предварительная обработка не оказывает неблагоприятного эффекта на кристаллический дельта-эндотоксин или потенциатор. Такая обработка может быть проведена как химическими, так и/или физическими методами, не оказывающими нежелательного воздействия на свойства композиции(ий). Примерами химических реагентов являются (но не ограничиваются указанными): галогенирующие агенты; альдегиды, например формальдегид и глутаральдегид; антиинфекционные агенты, например зефиранхлорид; спирты, например изопропанол и этанол; и гистологические фиксаторы, такие как фиксатор Боуина и фиксатор Хелли (см., например, Humason, Animal Tissue Techniques, W.H. Freeman and Co., 1967). Композиции, полученные согласно настоящему изобретению, могут быть нанесены непосредственно на растения, например, разбрызгиванием или распылением в то время, когда вредитель уже начал появляться на растении, или перед появлением вредителей в целях предохранительной защиты. К растениям, которые могут быть защищены в соответствии в данным изобретением относятся (но не ограничиваются указанными): злаковые (пшеница, ячмень, рожь, овес, рис, сорго и соответствующие культуры); свекловичные (сахарная свекла и кормовая свекла); косточковые, плодовые и культуры с мягкими плодами (яблони, груши, сливы, персики, миндаль, вишня, клубника, малина, ежевика); бобовые (люцерна, бобы, чечевица, горох, соя); масличные (рапс, горчица, мак, оливы, подсолнечник, кокосовые пальмы, растения, дающие касторовое масло, деревья какао, земляной орех); огуречные (огурец, кабачки, дыни); волокнистые растения (хлопчатник, лен, конопля, джут); цитрусовые (апельсины, грейпфруты, мандарины); овощные культуры (шпинат, салат, спаржа, капуста и др. крестоцветные, морковь, лук, томаты, картофель); лавровые деревья (авокадо, коричное дерево, камфорное дерево); лиственные и хвойные деревья (липа, тис, дуб, ольха, тополь, береза, ель, лиственница, сосна) или такие растения, как маис, торфяные растения, табак, орех, кофейное дерево, сахарный тростник, чайный куст, виноградная лоза, хмель, банановое дерево, каучуковые деревья, а также декоративные растения. Композицию можно нанести на листья, пахотную борозду, рассеять в виде гранул, нанести на почву или пропитать ими почву. Чрезвычайно важно обеспечить должный контроль за вредителями на ранних стадиях роста растений, т.к. именно в это время растение может быть особенно серьезно повреждено. Разбрызгиваемая жидкость или распыляемый порошок могут включать и другой пестицид, если это считается необходимым. Предпочтительно, композицию наносят непосредственно на растение. Композиции, полученные согласно данному изобретению, могут быть непосредственно использованы и для обработки водоемов, озер, рек, ручьев, стоячей воды и других объектов, подвергающихся заражению вредителями отряда Diptera, особенно, когда это имеет отношение к здоровью человека. Композиции можно применять разбрызгиванием, распылением, путем полива и т. п. Композиции, полученные согласно настоящему изобретению, могут быть эффективны против насекомых-вредителей отряда Lepidoptera, например Achroia grisella, Acleris gloverana, Acleris variana, Adoxophyes orana, Agrotis ipsilon, Alabama argillacea, Alsophila pometaria, Amyelois transitella, Anagasta kuehniella, Anarsia lineatella, Aaisota senatoria, Antheraea pernyi, Anticarsia gemmatalis, Archips sp., Argyrotaenia sp., Athetis mindara, Bombyx тоri, Bucculatrix thurberiella, Cadra cautella, Choristoneura sp., Cochylis hospes, Colias eurytheme, Corcyra cephalonica, Cydia latiferreanus, Cydia pomonella, Datana integerrima, Dendrolimus sibericus, Desmia funeralis, Diaphania hyalinata, Diaphania nitidalis, Diatraea grandiosella, Diatraea saccharalis, Ennomos subsignaria, Eoreuma loftini, Ephestia elutella, Erannis tiliaria, Estigmene acrea, Eulia salubricola, Eupoecilia ambiguella, Euproctis chrysorrhoea, Euxoa messoria, Galleria mellonella, Grapholita molesta, Harrisina virescens, Hemileuca oliviae, Homoeosoma electellum, Hyphantria cunea, Keiferia lycopersicella, Lambdina fiscellaria fiscellaria, Lambdina fiscellaria lugubrosa, Leucoma salicis, Lobesia botrana, Loxostege sticticalis, Lymantria dispar, Macalla thyrsisalis, Malacosoma sp., Mamestra brassicae, Mamestra configurata, Manduca quinquemaculata, Manduca sexta, Maruca testulalis, Melanchra picta, Operophtera brumata, Orgyia sp., Ostrinia nubilalis, Paleacrita vernata, Papilio cresphontes, Pectinophora gossypiella, Phryganidia californica, Phyllonorycter blancardella, Pieris napi, Pieris rapae, Plathypena scabra, Platynota flouendana, Platynota sultana, Platyptilia carduidactyla, Ptodia interpunctella, Plutella xylostella, Pontia protodice, Pseudaletia unipuncta, Pseudoplusia includens, Sabulodes aegrotata, Schizura concinna, Sitotroga cerealella, Spilonota ocellana, Spodoptera sp., Thaurnstopoea pityocampa, Tineola bisselliella, Trichoplusia ni, Udea rubigalis, Xylomyges curialis, Yponomeuta padella; order Diptera, e. g. , Aedes sp., Andes vittatus, Anastrepha ludens, Anastrepha suspensa, Anopheles barberi, Anopheles quadrimaculatus, Armigeres subalbatus, Calliphora stygian, Calliphora vicina, Ceratitis capitata, Chironomus tentans, Chrysomya rufifacies, Cochliomyia macellaria, Culex sp., Culiseta inornata, Dacus oleae, Delia antiqua, Dilia ptatura, Delia radicum, Drosophila melanogaster, Eupeodes corollae, Glossina austeni, Glossina morsitans morsitans, Glossina morsitans submorsitans, Glossina pallidipes, Glossina palpalis gambiensis, Glossina palpalis palpalis, Glossina tachinoides, Haemagogus equinus, Haemagogus irritans, Hypoderma bovis, Hypoderma lineatum, Leucopis ninae, Lucilia cuprina, Lucilia sericata, Lutzomyia longlpaipis, Lutzomyia shannoni, Lycoriella mali, Mayetiola destructor, Musca autumnalis, Musca domestica, Neobellieria sp., Nephrotoma suturalis, Ophyra aenescens, Phaenicia sericata, Phlebotomus sp., Phormia regina, Sabethes cyaneus, Sarcophaga bullata, Sarcophaga stercoraria, Stomoxys calcitrans, Toxorhynchites amboinensis, Tripteroides bambusa. Однако композиции по изобретению также могут быть эффективными против насекомых-вредителей отряда Coleoptera, например Leptinotarsa sp., Acanthoscelides obtectus, Callosobruchus chinensis, Epilachna varivestis, Pyrrhalta luteola, Cylas formicarius elegantulus, Listronotud oregonensis, Sitophilus sp., Cyclocephala borealis, Cyclocephala immaculata, Macrodactylus subspinosus, Popillia japonica, Rhizotrogus majalis, Alphitobious diaperinus, Palorus ratzeburgi, Tenebrio molitor, Tenebrio obscurus, Tribolium castaneum, Tribolium confusum, Tribolius destructor; Acari, например Oligonychus pratensis, Panonychus ulmi, Tetranychus urticae; Hymenoptera, например Iridomyrmex humilis, Solenopsis invicta; Isoptera, например Reticulitermes hesperus, Reticulitermes flavipes, Coptotermes formosanus, Zootermopsis angusticollis, Neotermes connexus, Incisitermes minor, Incisiterimes immigrans; Siphonaptera, например Ceratophyllus gallinae, Ceratophyllus niger, Nosopsyllus fasciatus, Leptopsylla segnis, Ctenocephlides canis, Ctenocephlides felis, Echicnophaga gallinacea, Pulex irritans, Xenopsylla cheopis, Xenopsylla vexabilis, Tunga penetrans; и Tylenchida, например Melodidogyne incognita, Pratylenchus penetrans. Следующие примеры поясняют, но не ограничивают данное изобретение. Пример: характеристика Iа Как указывается в данном описании, продукт Iа выделен и очищен. Характеристика его приводится ниже. Выделение и очистка Iа Штамм В. thuringiensis subsp. kurstaki EMCC0086 (депонированный в NRRL под номером В-21147) культивируют при 30oС в течение 72 час в среде, содержащей в качестве источника углерода крахмал или глюкозу и в качестве источника азота - белок, гидролизованный белок или жидкий кукурузный экстракт. Образование Ia начинается спустя 13 часов после начала ферментации. Пик активности выявляется приблизительно через 30 часов. После ферментации отделяют центрифугированием супернатант культуры В. thuringiensis subsp. kurstaki, затем очищают его ультрафильтрацией через 30 кДа-MW-CO мембрану с помощью УФ-системы Rhone Poulenc. 30 кДа-фильтрация удаляет любой оставшийся клеточный дебрис, кристаллы дельта-эндотоксина, споры и растворимый белок с молекулярной массой более 30 кДа. Пермеат концентрируют в 10 раз выпариванием, центрифугируют и затем фильтруют (размер пор мембраны 0,2 мкм) для дальнейшего удаления из раствора нерастворимых остатков и получают очищенный раствор, содержащий Ia. Очистку Ia до гомогенного состояния осуществляют с помощью многостадийной процедуры, схематически изображенной на фиг.1. В соответствии с указанной выше процедурой очистку продолжают со стадии 5 кДа-ультрафильтрации. Полученный после 5 кДа-ультрафильтрации пермеат адсорбируют на Сульфопропил (SР)-катионнообменной смоле и элюируют раствором ацетата аммония. Продукт затем концентрируют приблизительно в 30 раз лиофилизацией, а солевые и другие примеси удаляют с помощью колонки BioRad Р2 (исключение по размеру). Объем, полученный с Р2 колонки, пропускают через катионообменную колонку высокого разрешения (SP HPLC), что приводит к получению гомогенного препарата. Контаминирующие солевые примеси удаляют повторной мофилизацией. Активность проверяют микробиологическим исследованием с помощью Spodoptera exigua, а степень очистки определяют капиллярным электрофорезом. Образец, содержащий 50 мкл Ia - и 50 мкл cry IA (с) - белка (15 мкг/мл), выделенного из BIOBITTM FC (100 мкл), вносят в индивидуальные лунки планшета, содержащие 500 мкл твердообразной искусственной питательной основы для насекомых. Планшеты, содержащие различные образцы, высушивают на воздухе. В лунки с высушенными образцами добавляют от 2 до 4 личинок Spodoptera exigua на 2-й и ранней 3-й стадии развития. Лунки закрывают полиэфирной пленкой с отверстиями и инкубируют планшеты 2-3 дня при 30oС. Затем определяют (Mylar) степень задержки развития и процент гибели личинок. Обычно для тестирования каждого образца используют 5 лунок. РАЗЪЯСНЕНИЯ ПО ПОВОДУ СТРУКТУРЫ Установлено, что активное соединение растворимо в воде и нерастворимо в органических растворителях. Оно положительно заряжено и реагирует с нингидрином, что подтверждается тонкослойной хроматографией на кремнеземе. 13С и протоновый ЯРМ-спектры соединения приведены на фиг.2 и 3 соответственно. 13С ЯМР-эксперименты выявили наличие в составе соединения 13 атомов углерода (относительно 3-[триметилсилилпропионовой кислоты] ). DEPT-эксперимент показал, что в соединение входит три четвертичных атома углерода (С), семь метиновых (СН) групп, три метиленовых (СН2) группы и отсутствуют метильные группы (СН3). С помощью протонсвязывающих экспериментов, таких как 1-D разрыв и COSY, была идентифицирована одна большая спиновая система, содержащая восемь атомов углерода. Кроме того, обнаружена меньшая спиновая система, состоящая из двух атомов углерода. Эксперимент по корреляции протона атома углерода (НМВС) позволил соотнести резонанс каждого протона в молекуле с соответствующим атомом углерода. Обработка активного соединения (13 мг) уксусным ангидридом в пиридине приводит к образованию ацетилированного производного, которое гораздо менее поляризовано. Это производное очищают с помощью HPLC до получения 3 мг чистого ацетилированного производного. Масс-спектроскопический анализ показал, что производное имеет 7 ацетагрупп и молекулярную массу 690. Это свидетельствует о том, что молекулярная масса исходного активного соединения составляет 396 и оно содержит несколько атомов азота. Кроме того, выявлены фрагменты содержащие 6 и 5 ацетагрупп. Данные экспериментов по высокому разрешению для 5 и 6 ацетатных дочерних ионов составляют 645,2594 (6 ацетагрупп) и 607,2519 (5 ацетагрупп). Это позволяет установить молекулярную формулу соединения Ia: C13H28N6O8. Обработка активного соединения (13 мг) 6 н. HCl приводит к образованию производного, положительного по нингидрину. Это свидетельствует о наличии амидных связей. Производное имеет то же самое значение Rf, определенное методом тонкослойной хроматографии, что и 2,3-диаминопропионовая кислота. Эти результаты наряду с данными ЯМР позволяют предположить наличие 2,3-диаминопропионовой кислоты. Другой метод, который используют для анализа Iа, называется "nОе" (Nuclear Overhauser Effect), он позволяет определить близость расстояния между протонами в пространстве. Метод "nОе" применяют к ацетилированному производному Iа. В двумерном "nОе"-эксперименте (NOESY) эффекты (NOEs) наблюдаются между N-H протоном при 8,06 ppm и 5,17 ppm (фиг.4). Для Ia была установлена нижеследующая структурная формула Соль должна обладать способностью усиливать действие пестицида на основе бактерий рода Bacillus. Получение потенциатора Потенциатор можно получить с помощью штаммов микроорганизмов рода Bacillus (например, Bacillus subtilis, Bacillus lichemiformis и Bacillus thuringiensis) при выращивании в качалочных колбах или ферментере. В одном варианте осуществления изобретения потенциатор можно получить из супернатанта культуры Bacillus thuringiensis, включая (но не ограничиваясь указанными микроорганизмами), Bacillus thuringiensis подвид kurstaki, Bacillus thuringiensis подвид aizawai, Bacillus thuringiensis подвид galleriae, Bacillus thuringiensis подвид entomocidus, Bacillus thuringiensis подвид tenebrionis, Bacillus thuringiensis подвид thuringiensis, Bacillus thuringiensis подвид alesti, Bacillus thuringiensis подвид canadiensis, Bacillus thuringiensis подвид darmstadiensis, Bacillus thuringiensis подвид dendrolimus, Bacillus thuringiensis подвид finitimus, Bacillus thuringiensis подвид kenyae, Bacillus thuringiensis подвид morrisoni, Bacillus thuringiensis подвид subtoxicus, Bacillus thuringiensis подвид, toumanoffi and Bacillus thuringiensis подвид israelensis. Предпочтительно потенциатор получают из супернатанта Bacillus thuringiensis subsp. kurstaki, Bacillus thuringiensis subsp. aizawai или Bacillus thuringiensis subsp. gallerial или их мутантов, имеющих в основном ту же самую усиливающую активность. В определенном варианте осуществления изобретения потенциатор выделяют из cry-Spo-мутанта Bacillus thuringiensis subsp. kurstaki. Bacillus можно культивировать, используя известные специалистам среды и технологию ферментации (см., например, Rogoff et al., 1969, J. Invertebrate Path. 14: 122-129; Dulmage et al., in Microbial Control of Pests and Plant Diseases, H.D. Burges, ed., Academic Press, N.Y. 1980). По завершении цикла выделяют супернатант, отделяя споры B.t. и кристаллы от культуральной ферментационной среды известным способом, например центрифугированием и/или ультрафильтрацией. Содержащийся в супернатанте потенциатор может быть выделен с помощью известных методов, например ультрафильтрацией, выпариванием и распылительной сушкой. Процедура очистки более подробно описана в нижеследующих разделах. Очистку потенциатора выполняют различными способами, известными специалистам, включая (но не ограничиваясь указанными) хроматографию (например, ионообменную, аффинную и гель-хроматографию на колонке), электрофоретические методы, перерастворение, экстракцию, а также любыми другими стандартными хорошо известными методами. Свойство потенциатора усиливать активность пестицидов на основе бактерий рода Bacillus, пестицидную активность вирусов, активность химических пестицидов, направленных против различных вредителей, может быть определено и исследовано с помощью известных методов, таких как применение искусственной диеты для насекомых, обработка листьев (поверхностная и погружение их в раствор), использование спреев для нанесения на листья и т. д. Специальные примеры таких исследований приведены ниже в Разделе "Пример: характеристика Iа". Композиции, содержащие потенциатор Полученный потенциатор может быть использован как сам по себе, так и совместно с пестицидами на основе бактерий рода Bacillus, который, как указано выше, может представлять собой штамм Bacillus, споры, белок или его фрагмент или другое вещество, обладающее активностью по отношению к вредителям или способствующее их уничтожению или предохраняющее растения от вредителей; с химическим пестицидом и/или энтомопатогенным вирусом и подходящим носителем в составе пестицидной композиции (композиций), которая, например, может представлять собой раствор, эмульсию, порошок, диспергируемые гранулы, смачиваемый порошок, эмульгируемый концентрат, аэрозоль или импрегнированные гранулы. Примерами таких штаммов Bacillus являются (но не ограничиваются указанными): Bacillus thuringiensis subsp. kurstaki (обозначаемые как DIPELTM от Abbott Laboratories, Inc. , JAVELINTM от Sandoz, BIOBITTM от Novo Nordisk A/S, FORAYTM от Novo Nordisk A/S, BIOCOTTM от Novo Nordisk A/S, MVPTM от Mycogen, BACTOSPEINETM от Novo Nordisk A/S, и THURICIDETM от Sandoz); Bacillus thuringiensis subsp. aizawai (обозначаемые как FLORBACTM от Novo Nordisk A/S, и XENTARITM от Abbott laboratories, Inc.); Bacillus thuringiensis subsp. enebrionis (обозначаемый как NOVODORTM от Novo Nordisk A/S, TRIDENTTM от Sandoz и M-TRAKTM и M-ONETM от Mycogen); Bacillus thuringiensis subsp. israelensis (обозначаемые или BACTIMOSTM или SKEETALTM от Novo Nordisk A/S, TEKNARTM от Sandoz, и VECTOBACTM от Abbotts Laboratories, Inc. ); Bacillus thuringiensis subsp. kurstaki/tenebrionis (обозначаемые как FOILTM от Eoogen); Bacillus thuringiensis subsp. kurstaki/aizawai (обозначаемые как CONDORTM от Ecogen и AGREETM от Ciba-Geigy); и Bacillus thuringiensis subsp. kurstaki/kurstaki (обозначаемые как CUTLASSTM от Ecogen). Белок Bacillus может быть выбран из группы, включающей (без ограничений указанным) cry I, cry II, cry III, cry IV, cry V, cry VI. Химический пестицид может, например, представлять собой регулятор роста насекомых, такой как дифторбензурон, карбомат, такой как тиодикарб и метомил, органофосфат, такой как хлорпирифос, пиретроид, такой как циперметрин и эсфенвалерат, неорганический фторид, такой как криолит, и пиррол. Энтомопатогенный вирус может быть бакуловирусом, например вирусом ядерного полиэдроза (NPV), Autographa californica, Syngrapha falcifera NPV, Cydia pomonella GV (вирус гранулеза), Heliothis zea, NPV, Lymantria dispar NPV, Orgyia pseudotsugata NPV, Spodoptera exigua NPV, Neodiprion lecontei NPV, Neodiprion sertifer NPV, Harrisina brillians NPV и Endopiza viteana Clemens NPV. В композиции, содержащей усиливающий активность потенциатор и пестицид, полученный на основе бактерий рода Bacillus, потенциатор может присутствовать в количестве по крайней мере 0,1 г/BIU или 0,05 г потенциатора на 1 г дельта-эндотоксина Bacillus и спор, около 300 г/BIU или 150 г потенциатора на 1 г дельта-эндотоксина Bacillus и спор, предпочтительно 2 г/BIU или 1 г потенциатора на 1 г дельта-эндотоксина Bacillus и спор. "BIU" означает здесь биллион международных единиц, определяемых биоисследованием. Биоисследование включает сравнение образца со стандартным материалом Bacillus при использовании Trichoplusia ni или другого насекомого в качестве стандартного насекомого для тестирования. Усиливающая активность определяется делением референс-стандарта LC50 и умножением на значение усиливающей активности референс-стандарта. В другом варианте осуществления изобретения композиция может включать потенциатор в очищенном виде или супернатант, полученный при выращивании Bacillus, в сухой, концентрированной или жидкой форме и приемлемый для пестицида носитель, примеры которых приведены в настоящем описании. Эта композиция может быть применена по отношению к отдельному растению, например к трансгенному растению. В частности, композиция может быть использована на растениях, уже содержащих и экспрессирующих ген Bacillus thuringiensis. В другом случае композиция может быть использована на растениях, предварительно подвергнутых воздействию композиции на основе Bacillus thuringiensis. В ином варианте композиция может быть использована в других местах обитания вредителей, относящихся к отряду Diptera, например в воде или почве. Целевое вещество (потенциатор активности) входит в состав композиции в интервале концентраций от около 0,001% до 60% (по весу). Композиция, состоящая из потенциатора и приемлемого для пестицида носителя, помимо контролирования вредителей может быть также использована для снижения устойчивости вредителей к пестициду. Альтернативно, композиция может быть использована для усиления действия пестицида, полученного на основе бактерий рода Bacillus. Композиция в одном случае может быть применена одновременно с пестицидом в количестве, составляющем по крайней мере примерно от 2 г потенциатора вещества/BIU до около 300 г потенциатора вещества/BIU. В другом случае композицию можно использовать как адъювант в последующие 24 часа после применения пестицида для пролонгирования действия оставшегося пестицида. Такие, описанные выше композиции могут быть получены добавлением поверхностно активного вещества, инертного носителя, консервирующего средства, увлажнителя, стимулятора поедания, аттрактанта, инкапсулирующего агента, связывающего агента, эмульгатора, красителя, УФ-протектора, буфера, агента, придающего текучесть, или другого компонента для облегчения манипуляций с продуктом и применения его по отношению к определенным вредителям. Подходящие поверхностно-активные вещества включают анионоактивные соединения, такие как карбоксилаты, например металлокарбоксилаты на основе длинноцепочечной жирной кислоты; N-ацилсаркозинат; моно- или диэфиры фосфорной кислоты с этоксилатами спиртов жирного ряда или соли этих эфиров; сульфаты спиртов жирного ряда, такие как доцетил сульфат натрия, октадецилсульфат натрия или цетилсульфат натрия; этоксилированные сульфаты спиртов жирного ряда; этоксилированные алкилфенольные сульфаты; сульфаты лингина; нефтяные сульфонаты; алкиларилсульфонаты, такие как алкилбензолсульфонаты или низшие алкилнафталинсульфонаты, например бутилнафталин сульфонат; соли сульфонированных нафталинформальдегидовых конденсатов; соли сульфонированных фенолформальдегидовых конденсатов или более сложные сульфонаты, такие как амидные сульфонаты, например сульфонированный продукт конденсации олеиновой кислоты и N-метилтаурина, или диалкилсульфосукцинаты, например сульфонат натрия или диоктилсукцинат. Неионные реагенты включают продукты конденсации; эфиры жирных кислот, спиртов жирного ряда, амидов жирных кислот или алкил- или алкинилзамещенных фенолов с этиленоксидом, эфиров жирных кислот многоатомных спиртов, например сорбитановые эфиры жирной кислоты; продукты конденсации указанных эфиров с этиленоксидом, например полиоксиэтилен сорбитаровые эфиры жирной кислоты, блок-сополимеры этиленоксида и пропиленоксида, гликоли ацетиленового ряда, такие как 2,4,7,9-тетраэтил-5-децин-4,7-диол, или этоксилированные гликоли ацетиленового ряда. Примеры катионных поверхностно-активных веществ включают, например, алифатический моно-, ди- или полиамин, скажем ацетат, нафтенат или олеат; кислородсодержащий амин, такой как аминоксид полиоксиэтиленалкиламида; содержащий амидные связи амин, полученный конденсацией карбоновой кислоты с ди- или полиамином; или четвертичную аммониевую соль. Примерами инертных носителей являются неорганические, минеральные материалы, такие как каолин, слюда, гипс, удобрение, филлосиликаты, карбонаты, сульфаты или фосфаты; органические вещества - сахар, крахмал, циклодекстрины; или ботанические материалы - продукты переработки древесины, пробка, кукурузные кочерыжки, истертые в порошок, рисовая шелуха, скорлупа орехов арахиса и грецких орехов. Композиции, которые являются предметом настоящего изобретения, могут быть получены как в форме, пригодной для непосредственного использования, так и в виде концентрата или первичной композиции, которая требует растворения в соответствующем количестве воды или другого растворителя перед применением. Концентрация пестицида может варьировать в зависимости от природы данной композиции и, особенно, от того, является она концентратом или формой, уже готовой к применению. Композиция содержит от 1 до 98% твердого или жидкого инертного носителя и 0-50%, предпочтительно 0,1-50% поверхностно-активного вещества. Применение указанных композиций будет осуществляться в соответствии с нормами, установленными для коммерческого продукта, предпочтительно от 1,84 г до 0,92 кг на га (от 4,54 г до 2,27 кг на акр) в сухом виде и от 0,0019 л до 4,76 л на га (от 0,0047 л до 11,75 л на акр) в жидком виде. Далее предварительная отработка кристаллического дельта-эндотоксина Bacillus thuringiensis и/или потенциатора может быть осуществлена до приготовления композиции для пролонгирования действия пестицида при применении в среде, зараженной вредителями, поскольку предварительная обработка не оказывает неблагоприятного эффекта на кристаллический дельта-эндотоксин или потенциатор. Такая обработка может быть проведена как химическими, так и/или физическими методами, не оказывающими нежелательного воздействия на свойства композиции(ий). Примерами химических реагентов являются (но не ограничиваются указанными): галогенирующие агенты; альдегиды, например формальдегид и глутаральдегид; антиинфекционные агенты, например зефиранхлорид; спирты, например изопропанол и этанол; и гистологические фиксаторы, такие как фиксатор Боуина и фиксатор Хелли (см., например, Humason, Animal Tissue Techniques, W.H. Freeman and Co., 1967). Композиции, полученные согласно настоящему изобретению, могут быть нанесены непосредственно на растения, например, разбрызгиванием или распылением в то время, когда вредитель уже начал появляться на растении, или перед появлением вредителей в целях предохранительной защиты. К растениям, которые могут быть защищены в соответствии в данным изобретением относятся (но не ограничиваются указанными): злаковые (пшеница, ячмень, рожь, овес, рис, сорго и соответствующие культуры); свекловичные (сахарная свекла и кормовая свекла); косточковые, плодовые и культуры с мягкими плодами (яблони, груши, сливы, персики, миндаль, вишня, клубника, малина, ежевика); бобовые (люцерна, бобы, чечевица, горох, соя); масличные (рапс, горчица, мак, оливы, подсолнечник, кокосовые пальмы, растения, дающие касторовое масло, деревья какао, земляной орех); огуречные (огурец, кабачки, дыни); волокнистые растения (хлопчатник, лен, конопля, джут); цитрусовые (апельсины, грейпфруты, мандарины); овощные культуры (шпинат, салат, спаржа, капуста и др. крестоцветные, морковь, лук, томаты, картофель); лавровые деревья (авокадо, коричное дерево, камфорное дерево); лиственные и хвойные деревья (липа, тис, дуб, ольха, тополь, береза, ель, лиственница, сосна) или такие растения, как маис, торфяные растения, табак, орех, кофейное дерево, сахарный тростник, чайный куст, виноградная лоза, хмель, банановое дерево, каучуковые деревья, а также декоративные растения. Композицию можно нанести на листья, пахотную борозду, рассеять в виде гранул, нанести на почву или пропитать ими почву. Чрезвычайно важно обеспечить должный контроль за вредителями на ранних стадиях роста растений, т.к. именно в это время растение может быть особенно серьезно повреждено. Разбрызгиваемая жидкость или распыляемый порошок могут включать и другой пестицид, если это считается необходимым. Предпочтительно, композицию наносят непосредственно на растение. Композиции, полученные согласно данному изобретению, могут быть непосредственно использованы и для обработки водоемов, озер, рек, ручьев, стоячей воды и других объектов, подвергающихся заражению вредителями отряда Diptera, особенно, когда это имеет отношение к здоровью человека. Композиции можно применять разбрызгиванием, распылением, путем полива и т. п. Композиции, полученные согласно настоящему изобретению, могут быть эффективны против насекомых-вредителей отряда Lepidoptera, например Achroia grisella, Acleris gloverana, Acleris variana, Adoxophyes orana, Agrotis ipsilon, Alabama argillacea, Alsophila pometaria, Amyelois transitella, Anagasta kuehniella, Anarsia lineatella, Aaisota senatoria, Antheraea pernyi, Anticarsia gemmatalis, Archips sp., Argyrotaenia sp., Athetis mindara, Bombyx тоri, Bucculatrix thurberiella, Cadra cautella, Choristoneura sp., Cochylis hospes, Colias eurytheme, Corcyra cephalonica, Cydia latiferreanus, Cydia pomonella, Datana integerrima, Dendrolimus sibericus, Desmia funeralis, Diaphania hyalinata, Diaphania nitidalis, Diatraea grandiosella, Diatraea saccharalis, Ennomos subsignaria, Eoreuma loftini, Ephestia elutella, Erannis tiliaria, Estigmene acrea, Eulia salubricola, Eupoecilia ambiguella, Euproctis chrysorrhoea, Euxoa messoria, Galleria mellonella, Grapholita molesta, Harrisina virescens, Hemileuca oliviae, Homoeosoma electellum, Hyphantria cunea, Keiferia lycopersicella, Lambdina fiscellaria fiscellaria, Lambdina fiscellaria lugubrosa, Leucoma salicis, Lobesia botrana, Loxostege sticticalis, Lymantria dispar, Macalla thyrsisalis, Malacosoma sp., Mamestra brassicae, Mamestra configurata, Manduca quinquemaculata, Manduca sexta, Maruca testulalis, Melanchra picta, Operophtera brumata, Orgyia sp., Ostrinia nubilalis, Paleacrita vernata, Papilio cresphontes, Pectinophora gossypiella, Phryganidia californica, Phyllonorycter blancardella, Pieris napi, Pieris rapae, Plathypena scabra, Platynota flouendana, Platynota sultana, Platyptilia carduidactyla, Ptodia interpunctella, Plutella xylostella, Pontia protodice, Pseudaletia unipuncta, Pseudoplusia includens, Sabulodes aegrotata, Schizura concinna, Sitotroga cerealella, Spilonota ocellana, Spodoptera sp., Thaurnstopoea pityocampa, Tineola bisselliella, Trichoplusia ni, Udea rubigalis, Xylomyges curialis, Yponomeuta padella; order Diptera, e. g. , Aedes sp., Andes vittatus, Anastrepha ludens, Anastrepha suspensa, Anopheles barberi, Anopheles quadrimaculatus, Armigeres subalbatus, Calliphora stygian, Calliphora vicina, Ceratitis capitata, Chironomus tentans, Chrysomya rufifacies, Cochliomyia macellaria, Culex sp., Culiseta inornata, Dacus oleae, Delia antiqua, Dilia ptatura, Delia radicum, Drosophila melanogaster, Eupeodes corollae, Glossina austeni, Glossina morsitans morsitans, Glossina morsitans submorsitans, Glossina pallidipes, Glossina palpalis gambiensis, Glossina palpalis palpalis, Glossina tachinoides, Haemagogus equinus, Haemagogus irritans, Hypoderma bovis, Hypoderma lineatum, Leucopis ninae, Lucilia cuprina, Lucilia sericata, Lutzomyia longlpaipis, Lutzomyia shannoni, Lycoriella mali, Mayetiola destructor, Musca autumnalis, Musca domestica, Neobellieria sp., Nephrotoma suturalis, Ophyra aenescens, Phaenicia sericata, Phlebotomus sp., Phormia regina, Sabethes cyaneus, Sarcophaga bullata, Sarcophaga stercoraria, Stomoxys calcitrans, Toxorhynchites amboinensis, Tripteroides bambusa. Однако композиции по изобретению также могут быть эффективными против насекомых-вредителей отряда Coleoptera, например Leptinotarsa sp., Acanthoscelides obtectus, Callosobruchus chinensis, Epilachna varivestis, Pyrrhalta luteola, Cylas formicarius elegantulus, Listronotud oregonensis, Sitophilus sp., Cyclocephala borealis, Cyclocephala immaculata, Macrodactylus subspinosus, Popillia japonica, Rhizotrogus majalis, Alphitobious diaperinus, Palorus ratzeburgi, Tenebrio molitor, Tenebrio obscurus, Tribolium castaneum, Tribolium confusum, Tribolius destructor; Acari, например Oligonychus pratensis, Panonychus ulmi, Tetranychus urticae; Hymenoptera, например Iridomyrmex humilis, Solenopsis invicta; Isoptera, например Reticulitermes hesperus, Reticulitermes flavipes, Coptotermes formosanus, Zootermopsis angusticollis, Neotermes connexus, Incisitermes minor, Incisiterimes immigrans; Siphonaptera, например Ceratophyllus gallinae, Ceratophyllus niger, Nosopsyllus fasciatus, Leptopsylla segnis, Ctenocephlides canis, Ctenocephlides felis, Echicnophaga gallinacea, Pulex irritans, Xenopsylla cheopis, Xenopsylla vexabilis, Tunga penetrans; и Tylenchida, например Melodidogyne incognita, Pratylenchus penetrans. Следующие примеры поясняют, но не ограничивают данное изобретение. Пример: характеристика Iа Как указывается в данном описании, продукт Iа выделен и очищен. Характеристика его приводится ниже. Выделение и очистка Iа Штамм В. thuringiensis subsp. kurstaki EMCC0086 (депонированный в NRRL под номером В-21147) культивируют при 30oС в течение 72 час в среде, содержащей в качестве источника углерода крахмал или глюкозу и в качестве источника азота - белок, гидролизованный белок или жидкий кукурузный экстракт. Образование Ia начинается спустя 13 часов после начала ферментации. Пик активности выявляется приблизительно через 30 часов. После ферментации отделяют центрифугированием супернатант культуры В. thuringiensis subsp. kurstaki, затем очищают его ультрафильтрацией через 30 кДа-MW-CO мембрану с помощью УФ-системы Rhone Poulenc. 30 кДа-фильтрация удаляет любой оставшийся клеточный дебрис, кристаллы дельта-эндотоксина, споры и растворимый белок с молекулярной массой более 30 кДа. Пермеат концентрируют в 10 раз выпариванием, центрифугируют и затем фильтруют (размер пор мембраны 0,2 мкм) для дальнейшего удаления из раствора нерастворимых остатков и получают очищенный раствор, содержащий Ia. Очистку Ia до гомогенного состояния осуществляют с помощью многостадийной процедуры, схематически изображенной на фиг.1. В соответствии с указанной выше процедурой очистку продолжают со стадии 5 кДа-ультрафильтрации. Полученный после 5 кДа-ультрафильтрации пермеат адсорбируют на Сульфопропил (SР)-катионнообменной смоле и элюируют раствором ацетата аммония. Продукт затем концентрируют приблизительно в 30 раз лиофилизацией, а солевые и другие примеси удаляют с помощью колонки BioRad Р2 (исключение по размеру). Объем, полученный с Р2 колонки, пропускают через катионообменную колонку высокого разрешения (SP HPLC), что приводит к получению гомогенного препарата. Контаминирующие солевые примеси удаляют повторной мофилизацией. Активность проверяют микробиологическим исследованием с помощью Spodoptera exigua, а степень очистки определяют капиллярным электрофорезом. Образец, содержащий 50 мкл Ia - и 50 мкл cry IA (с) - белка (15 мкг/мл), выделенного из BIOBITTM FC (100 мкл), вносят в индивидуальные лунки планшета, содержащие 500 мкл твердообразной искусственной питательной основы для насекомых. Планшеты, содержащие различные образцы, высушивают на воздухе. В лунки с высушенными образцами добавляют от 2 до 4 личинок Spodoptera exigua на 2-й и ранней 3-й стадии развития. Лунки закрывают полиэфирной пленкой с отверстиями и инкубируют планшеты 2-3 дня при 30oС. Затем определяют (Mylar) степень задержки развития и процент гибели личинок. Обычно для тестирования каждого образца используют 5 лунок. РАЗЪЯСНЕНИЯ ПО ПОВОДУ СТРУКТУРЫ Установлено, что активное соединение растворимо в воде и нерастворимо в органических растворителях. Оно положительно заряжено и реагирует с нингидрином, что подтверждается тонкослойной хроматографией на кремнеземе. 13С и протоновый ЯРМ-спектры соединения приведены на фиг.2 и 3 соответственно. 13С ЯМР-эксперименты выявили наличие в составе соединения 13 атомов углерода (относительно 3-[триметилсилилпропионовой кислоты] ). DEPT-эксперимент показал, что в соединение входит три четвертичных атома углерода (С), семь метиновых (СН) групп, три метиленовых (СН2) группы и отсутствуют метильные группы (СН3). С помощью протонсвязывающих экспериментов, таких как 1-D разрыв и COSY, была идентифицирована одна большая спиновая система, содержащая восемь атомов углерода. Кроме того, обнаружена меньшая спиновая система, состоящая из двух атомов углерода. Эксперимент по корреляции протона атома углерода (НМВС) позволил соотнести резонанс каждого протона в молекуле с соответствующим атомом углерода. Обработка активного соединения (13 мг) уксусным ангидридом в пиридине приводит к образованию ацетилированного производного, которое гораздо менее поляризовано. Это производное очищают с помощью HPLC до получения 3 мг чистого ацетилированного производного. Масс-спектроскопический анализ показал, что производное имеет 7 ацетагрупп и молекулярную массу 690. Это свидетельствует о том, что молекулярная масса исходного активного соединения составляет 396 и оно содержит несколько атомов азота. Кроме того, выявлены фрагменты содержащие 6 и 5 ацетагрупп. Данные экспериментов по высокому разрешению для 5 и 6 ацетатных дочерних ионов составляют 645,2594 (6 ацетагрупп) и 607,2519 (5 ацетагрупп). Это позволяет установить молекулярную формулу соединения Ia: C13H28N6O8. Обработка активного соединения (13 мг) 6 н. HCl приводит к образованию производного, положительного по нингидрину. Это свидетельствует о наличии амидных связей. Производное имеет то же самое значение Rf, определенное методом тонкослойной хроматографии, что и 2,3-диаминопропионовая кислота. Эти результаты наряду с данными ЯМР позволяют предположить наличие 2,3-диаминопропионовой кислоты. Другой метод, который используют для анализа Iа, называется "nОе" (Nuclear Overhauser Effect), он позволяет определить близость расстояния между протонами в пространстве. Метод "nОе" применяют к ацетилированному производному Iа. В двумерном "nОе"-эксперименте (NOESY) эффекты (NOEs) наблюдаются между N-H протоном при 8,06 ppm и 5,17 ppm (фиг.4). Для Ia была установлена нижеследующая структурная формула  Данное соединение может быть классифицировано как уреидоамид. Заместители - 2 амидные группы, мочевина, две аминогруппы и пять гидроксильных групп. Оно содержит семь хиральных центров. Свойства Ia Установлено, что Ia усиливает активность кристаллических дельта-эндотоксинов белковой природы, выделенных из Bacillus thuringiensis subsp. kurstaki и Bacillus thuringiensis subsp. aizawai, обладающих пестицидной активностью по отношению к Spodoptera exigua, независимо от формы пестицидных белков. Фактор усиливает пестицидную активность В.t.k., выделенных кристаллов, белков полной длины (молекулярная масса 130 кДа) и усеченных - cry IA белков (молекулярная масса около 65 кДа). Активность включений cry II и cry IC также усиливается. Установлено усиление активности и для индивидуальных белков cry IA (а), (b), (с). Показано также, что время взаимодействия Ia и cry-белка не является критическим для проявления биоактивности. Однако сам по себе Ia не активен. Установлено, что уровень усиления для усеченных cry IA белков и cry IC и cry II включений составляет величину 100-200 и приблизительно 320 для cry IA (с) полной длины (см. табл. 1 и 2 соответственно). В частности, для белков полной длины показано, что добавление Ia к 0,75 мкг/мл cry IA (с) обеспечивает такую же смертность (задержку развития насекомых), как и собственно cry IA (с) в дозе 240 мкг/мл. В случае усеченного белка cry IA (с) при OD280= 0,0006 и в сочетании с Ia эффект задержки развития был таким же, как если бы cry IA (с) был использован сам по себе в дозе, соответствующей OD280=0,075. Включения cry II в концентрации 0,6 мкг/мл и в сочетании с la обеспечивали такую же степень задержки развития и смертности насекомых, что и cry II белок сам по себе в дозе 75 мкг/мл, т.е. наблюдалось 125-кратное усиление активности. Использование cry IC включений в дозе 0,3 мкг/мл с добавлением Ia обеспечивает такую же смертность /задержку развития насекомых, как и применение одного cry IC белка в дозе 75 мкг/мл, что соответствует 250-кратному усилению активности. Концентрация cry IA белка, которая приводит к задержке развития, обеспечивала при добавлении Ia гибель насекомых. С помощью биоисследований, описанных в Разделе "Выделение и очистка Iа", установлено, что Iа стабилен при кипячении в течение 5 минут, но теряет активность при автоклавировании(>190oС). Далее, он стабилен при воздействии прямого солнечного света по крайней мере в течение 10 часов. Ia остается стабильным при рН 2 в течение 3 дней и не стабилен при рН 12. Установлено, что Ia полностью утрачивает активность в йодной кислоте или в концентрированной HCl. Оценка других подвидов Bacillus thuringiensis и других видов рода Bacillus Оценивают возможность получения Iа на основе нескольких видов Bacillus. Штаммы культивируют при 30oС в течение 72 часов в среде, содержащей в качестве источника углерода крахмал, гидролизованный крахмал или глюкозу, а в качестве источника азота белок, гидролизованный белок или жидкий кукурузный экстракт. В супернатантах определяют наличие Iа с помощью микробиоисследования при использовании Spodoptera exigua, описанного выше. Было установлено, что В. thuringiensis subsp. aizawai штамм ЕМСС 0087 (депонированный в NRRL под N В-21148) и В. thuringiensis subsp. gallerriae (депонированный в NRRL) продуцируют Ia в том же количестве, что и B. thuringiensis subsp. kurstaki. С помощью капиллярного электрофореза было обнаружено, что Ia продуцируют В. subtilis, В. cereus, В.t. subsp. alesti, В.t. subsp. canadiensis, В.t. subsp. darmstadiensis, В. t. subsp. dendrolimus, B.t. subsp. entomocidus, B. t. subsp. finitimus, B. t. subsp. israelensis, B.t. subsp. kenyae, B.t. subsp. morrisoni, B. t. subsp. subtoxicus, B.t. subsp. tenebrionis, B.t. subsp. thuringiensis, B. t. subsp. toumanoffi, B. cereus, B. subtilis и В. thuringiensis subsp. kurstaki cry-Spo-мутант. В частности, для определения количества Ia использовали систему капиллярного электрофореза Р/АСЕ Beckman, снабженную капилляром (50 мкм Данное соединение может быть классифицировано как уреидоамид. Заместители - 2 амидные группы, мочевина, две аминогруппы и пять гидроксильных групп. Оно содержит семь хиральных центров. Свойства Ia Установлено, что Ia усиливает активность кристаллических дельта-эндотоксинов белковой природы, выделенных из Bacillus thuringiensis subsp. kurstaki и Bacillus thuringiensis subsp. aizawai, обладающих пестицидной активностью по отношению к Spodoptera exigua, независимо от формы пестицидных белков. Фактор усиливает пестицидную активность В.t.k., выделенных кристаллов, белков полной длины (молекулярная масса 130 кДа) и усеченных - cry IA белков (молекулярная масса около 65 кДа). Активность включений cry II и cry IC также усиливается. Установлено усиление активности и для индивидуальных белков cry IA (а), (b), (с). Показано также, что время взаимодействия Ia и cry-белка не является критическим для проявления биоактивности. Однако сам по себе Ia не активен. Установлено, что уровень усиления для усеченных cry IA белков и cry IC и cry II включений составляет величину 100-200 и приблизительно 320 для cry IA (с) полной длины (см. табл. 1 и 2 соответственно). В частности, для белков полной длины показано, что добавление Ia к 0,75 мкг/мл cry IA (с) обеспечивает такую же смертность (задержку развития насекомых), как и собственно cry IA (с) в дозе 240 мкг/мл. В случае усеченного белка cry IA (с) при OD280= 0,0006 и в сочетании с Ia эффект задержки развития был таким же, как если бы cry IA (с) был использован сам по себе в дозе, соответствующей OD280=0,075. Включения cry II в концентрации 0,6 мкг/мл и в сочетании с la обеспечивали такую же степень задержки развития и смертности насекомых, что и cry II белок сам по себе в дозе 75 мкг/мл, т.е. наблюдалось 125-кратное усиление активности. Использование cry IC включений в дозе 0,3 мкг/мл с добавлением Ia обеспечивает такую же смертность /задержку развития насекомых, как и применение одного cry IC белка в дозе 75 мкг/мл, что соответствует 250-кратному усилению активности. Концентрация cry IA белка, которая приводит к задержке развития, обеспечивала при добавлении Ia гибель насекомых. С помощью биоисследований, описанных в Разделе "Выделение и очистка Iа", установлено, что Iа стабилен при кипячении в течение 5 минут, но теряет активность при автоклавировании(>190oС). Далее, он стабилен при воздействии прямого солнечного света по крайней мере в течение 10 часов. Ia остается стабильным при рН 2 в течение 3 дней и не стабилен при рН 12. Установлено, что Ia полностью утрачивает активность в йодной кислоте или в концентрированной HCl. Оценка других подвидов Bacillus thuringiensis и других видов рода Bacillus Оценивают возможность получения Iа на основе нескольких видов Bacillus. Штаммы культивируют при 30oС в течение 72 часов в среде, содержащей в качестве источника углерода крахмал, гидролизованный крахмал или глюкозу, а в качестве источника азота белок, гидролизованный белок или жидкий кукурузный экстракт. В супернатантах определяют наличие Iа с помощью микробиоисследования при использовании Spodoptera exigua, описанного выше. Было установлено, что В. thuringiensis subsp. aizawai штамм ЕМСС 0087 (депонированный в NRRL под N В-21148) и В. thuringiensis subsp. gallerriae (депонированный в NRRL) продуцируют Ia в том же количестве, что и B. thuringiensis subsp. kurstaki. С помощью капиллярного электрофореза было обнаружено, что Ia продуцируют В. subtilis, В. cereus, В.t. subsp. alesti, В.t. subsp. canadiensis, В.t. subsp. darmstadiensis, В. t. subsp. dendrolimus, B.t. subsp. entomocidus, B. t. subsp. finitimus, B. t. subsp. israelensis, B.t. subsp. kenyae, B.t. subsp. morrisoni, B. t. subsp. subtoxicus, B.t. subsp. tenebrionis, B.t. subsp. thuringiensis, B. t. subsp. toumanoffi, B. cereus, B. subtilis и В. thuringiensis subsp. kurstaki cry-Spo-мутант. В частности, для определения количества Ia использовали систему капиллярного электрофореза Р/АСЕ Beckman, снабженную капилляром (50 мкм  57 см), емкостью с 0,2 М фосфатным буфером, рН 6,8, устройством с напряжением тока 15 кВ и устройством определения поглощения при 200 нм. Используют образцы объемом 20 нл, время исследования (прогона) составляет 25 минут. Калибровочную кривую получают при использовании в качестве стандарта следующих количеств Iа: 1,25 мг/мл, 0,625 мг/мл, 0,3125 мг/мл, 0,156 мг/мл, 0,078 мг/мл. Затем строят линейный график. Для определения концентрации Ia в каждой пробе используют полученную зависимость у=mx+b. Пред каждым исследованием капилляр промывают буфером для "прогона" (0,2 М фосфат, рН 6,8) в течение трех минут. После каждого 25-минутного прогона капилляр промывают 1 н. NaOH в течение одной минуты, отфильтрованной при использовании HPLC водой в течение 1 минуты, 0,5 М фосфорной кислотой - 3 минуты, отфильтрованной при использовании HPLC водой - 1 минуту. Интегрируют площадь под каждым пиком и определяют общую площадь пиков, конечную концентрацию вычисляют по калибровочной кривой. Оценка продуктов, полученных на основе В.t. Количество Ia, присутствующего в различных коммерчески доступных продуктах, определяют с помощью капиллярного электрофореза. От фирмы Novo Nordisk A/S получают препараты BACTOSPEINETM, JAVELINTM, NOVODORTM, SPHERIMOSTM, BACTIMOSTM, FORAYTM, FLORBACTM и BIOBITTM. XENTARITM и DIPELTM получают от Abbott Laboratories. AGREETM получают от Ciba-Geigy; MVPTM получают от Mycogen и CUTLASSTM получают от Ecogen. Результаты исследований проводятся в табл. 3; они показывают, что Ia присутствует в различных количествах, варьирующих в пределах от менее чем 0,001 г Ia/BIU до 0,071 г Ia/BIU. Биоисследования с использованием питательных сред Активность S. t. k. определяют биометодом с помощью синтетических питательных сред для насекомых с использованием личинок Spodoptera exigua, на третьей стадии развития, личинок второй стадии Helicoverpa zеа, личинок третьей стадии Spodoptera frugiperda, личинок второй стадии Heliothis virescens, личинок третьей стадии Trichoplusia ni, личинок третьей стадии Pseudoplusia includens, личинок третьей стадии Plutella xylostella, личинок третьей стадии Spodoptera littoralis и личинок третьей стадии Mamestra brassicae. Для того чтобы определить степень усиления активности, вызванную добавлением Iа к В. t.-продуктам, и установить круг насекомых, которые подвержены этому воздействию, проводят биологические испытания с использованием специальных питательных сред для насекомых. В опытах с применением высоких концентраций Iа против Spodoptera exigua (7,4-23,7 г Ia/BIU) очищенный Ia (70% активного ингредиента, 30% ацетат-иона) используют для усиления активности BIOBITTM FC (FC представляет собой текучий концентрат). Полученные данные, представленные в табл. 4, показывают усиление активности BIOBITTM HPWP (высокоактивный смачиваемый порошок) в сочетании с Iа (0,658% активного ингредиента). S. littoralis и М. brassicae тестируют при использовании FLORBACTM HPWP в сочетании с Iа. Различные В. t.-продукты взвешивают, и Iа добавляют в количестве от 0,1 до 237 г Ia/BIU. Объем доводят 0,1%-ным Твином (TweenTM). Образцы обрабатывают ультразвуком в течение 1 минуты и затем разводят до конечного объема. Приготавливают также чистые образцы (без Iа) и контрольные образцы. Контрольные образцы включают B. t. k. HD-1-S-1980 (получают из коллекции NRRL), активность которого соответствует 16000 международных единиц (IU) на миллиграмм, и JAVELINTM WG, активность которого составляет 53000 Spodoptera Единиц/мг (SU). Стандартные синтетические питательные среды, включающие воду, агар, сахар, казеин, пшеничные ростки, метилпарабен, сорбиновую кислоту, масло семян льна, целлюлозу, соли и витамины, готовят в 20-литровом котле при нагревании. Это обеспечивает достаточный объем питательной среды для проведения испытания 10-12 образцов с семью различными концентрациями каждого тестируемого вещества. В.t.-растворы последовательно разводят с получением 16 мл аликвот. Каждую аликвоту добавляют к 184 г расплавленной среды. Смесь в достаточной степени гомогенизируют и затем разливают в пластиковый планшет, имеющий 40 индивидуальных ячеек. Для каждой партии среды готовят три контрольных планшета. Как только среда остывает и становится твердой, в каждую ячейку помещают по одному насекомому известного возраста (личинки 2-3-го поколения), планшеты накрывают прозрачной перфорированной полиэфирной пленкой (mylar). Планшеты устанавливают на полки и инкубируют в течение четырех дней при 28oС и 65% относительной влажности. Через четыре дня определяют, сколько насекомых погибло. Каждый планшет резко встряхивают на поверхности стола и неподвижные личинки учитывают как мертвые. Вычисляют процентную долю погибших личинок и данные анализируют в параллельных независимых опытах. Вычисляют LC50s, LC90s, наклон линий регрессии, коэффициент вариабельности и уровень активности. Образцы исследуют по крайней мере три раза или до тех пор, пока три полученные величины активности не попадут в 20%-ный интервал от вычисленного значения активности для каждого образца. Чтобы вычислить увеличение активности, обеспечиваемое каждой концентрацией Ia, LC50 пробы В.t./Ia корректируют с поправкой на количество В. t. в образце. Значение LC50 спаренных "чистых" образцов делят на скорректированные значения LC50, чтобы определить порядок снижения LC50, ассоциированного с Iа. Для исследования Lobesia bothrana используют следующую методику. Виноград, пораженный Lobesia bothrana, собирают на необработанном пестицидами поле и удаляют личинки. Готовят последовательные разведения Iа в воде (250 мкг/мл, 500 мкг/мл и 1000 мкг/мл). Одну личинку помещают в центр чашки Петри. Если наблюдают, что личинка пьет, ее переносят в чашку Петри со свежесорванными ягодами винограда. Личинок сохраняют при 22oС в течение 3-4 дней. Как показано в табл. 4, наблюдается значительное уменьшение значений LC50 для всех образцов. Усиление воздействия различных продуктов на Spodoptera exigua благодаря Ia определяют биологическим методом при использовании питательных сред, как описано выше. Количества добавленного Ia/BIU продукта приведены в табл. 5. Смесь Ia/B. t.-продукт вводят в агаризованную питательную среду, содержащую пшеничные ростки и казеин. Насекомых помещают на эту среду на 4-дневный период и выдерживают при 28oС. Гибель насекомых регистрируют и исследуют с помощью вероятностных исследований. LC50, LC90 и усиление активности определяют с учетом соответствующего продукта, не содержащего Ia. Результаты, представленные в табл. 5, показывают, что Ia усиливает активность различных В.t.k.- и B.t.а.-продуктов, полученных из различных источников. Штаммы В.t., содержащие эти продукты, описаны в предшествующих таблицах. Биологические исследования с использованием листьев Фолиарные биологические испытания осуществляют на личинках Spodoptera exigua второй стадии с помощью растений брокколи с использованием BIOBITTM FC и Iа. Отношение Iа и BIOBITTM FC то же - 2 г Ia/BIU BIOBITTM FC. Обработку растений брокколи осуществляют путем направленного разбрызгивания препарата в объеме носителя 30,64 л на га (75,7 л на акр). После того как остаток разбрызганной жидкости высыхает, с растений срезают листья с личинками Spodoptera exigua второй стадии. Результаты исследований представлены в табл. 6. 100%-ная смертность насекомых наблюдается при обработке дозой 8,7 BIU/гектар BIOBITTM FC+Ia, тогда как BIOBITTM FC сам по себе уничтожает 92% личинок в дозе 58,8 BIU/гектар и 8% личинок в дозе 17,6 BIU/гектар. Обработанные растения также подвергают воздействию прямого солнечного света в течение 8 часов, после чего обрывают зараженные листья. После такой 8-часовой экспозиции на свету BIOBITTM FC сам по себе обеспечивает 27%-ную смертность насекомых в дозе 58,8 BIU/гектар, тогда как BIOBITTM FC+Ia обеспечивает 100%-ную смертность в дозе 8,7 BIU/гектар. Фолиарные исследования, проведенные с помощью личинок четвертой ранней стадии, показывает, что BIOBITTM FC сам по себе обеспечивает 75%-ную смертность личинок в дозе 52 BIU/гектар и 100%-ную смертность в дозе 13 BIU/гектар при совместном применении BIOBITTM FC (FC обозначает "текучий концентрат" )+Ia. Полевые испытания Опыты в поле на бобах (насекомое Spodoptera exigua) показывают, что BIOBITTM FC сам по себе в дозе 70 BIU/гектар обеспечивает 51%-ный контроль, тогда как 2 г Ia/BIU BIOBITTM FC в дозе 40 BIU/гектар обеспечивают 89%-ный контроль (по сравнению с необработанным полем). JAVELINTM WG в дозе 45 BIU/гектар обеспечивает 51%-ный контроль. Полевые эксперименты на сладкой кукурузе (насекомое Spodoptera frugiperda) показывают, что 2 г Ia/BIU BIOBITTM FC в дозе 39,5 BIU/гектар обеспечивают 84%-ный контроль. Коэффициенты устойчивости Исследуют колонии восприимчивых и устойчивых Plutella xylostella. Устойчивые мотыльки представляют собой особей, собранных на полях Флориды, которые уже приобрели устойчивость по отношению к В.t. вследствие интенсивного использования JAVELINTM WC. BIOBITTM HPWP в комплексе с Iа исследуют методом погруженных листьев. Устойчивость к JAVELINTM и XENTARITM изучают без добавления Iа. Листовые диски капусты диаметром 6 см погружают на 10 секунд в один из восьми препаратов на основе В.t. с различной концентрацией или в смесь указанных препаратов с Ia. Концентрация варьирует от 1 до 1000 ppm. Листовым дискам дают подсохнуть на воздухе в течение двух часов и помещают их в пластиковые чашки Петри с личинками второй стадии (0,2-0,4 мг). Двадцать пять насекомых/доза/день дважды реплицируют, чтобы получить 50 насекомых/доза. После инкубирования в течение 72 часов при 27oС регистрируют смертность. Снижение смертельной дозы исследуют путем вероятностного анализа. Коэффициенты устойчивости рассчитывают делением величин LC50 и LC90 для восприимчивых особей. Результаты исследований приведены в табл. 7. Они показывают, что BIOBITTM HPWP усиливает активность при совместном использовании 2 г Ia/BIU и 4 г Ia/BIU. В частности, при использовании 4 г Ia/BIU имеет место двукратное уменьшение коэффициента устойчивости LC50 и 10-кратное уменьшение коэффициента устойчивости LC90. Описанное и заявленное изобретение не должно ограничиваться частными вариантами его осуществления, приведенными здесь, поскольку примеры приводятся только в целях иллюстрации некоторых аспектов данного изобретения. Предполагается, что любые равнозначные варианты воплощения изобретения входят в его объем. Действительно, различные модификации изобретения, дополняющие те, которые раскрыты в настоящем описании, очевидным образом следуют из него и понятны специалисту в данной области исследований. Такие модификации также охватываются заявленными пунктами формулы. Цитируемые в настоящем описании источники информации приведены исключительно в качестве ссылок. Депонирование микроорганизмов В соответствии с Будапештским Договором нижеследующие штаммы Bacillus thuringiensis были депонированы в Коллекции культур для целей патентной процедуры сельскохозяйственной исследовательской службы (NRRL), Northern Regional Research Center, 1815 University Street, Peoria, Illinois, 61604, USA. Штамм EMCC0086; номер NRRL B-21147; дата депонирования - 6 октября 1993. Штаммы депонированы при условии гарантированной доступности культуры в течение периода, предшествующего выдаче патента какому-либо лицу, определенному Комиссаром ведомства по патентам и товарным знакам, согласно 37 С.F. R. 1.44 и 35 U.S.С. 122. Для депонирования представляется чистая культура депонируемого штамма. Депозит и его потомки являются доступными в соответствии с требованиями патентных законов других стран, в которые подается заявка. Однако следует понимать, что доступность депонированной культуры не дает права воспроизводить объект изобретения в нарушение прав, обеспечиваемых патентом, выданным от лица государства. 57 см), емкостью с 0,2 М фосфатным буфером, рН 6,8, устройством с напряжением тока 15 кВ и устройством определения поглощения при 200 нм. Используют образцы объемом 20 нл, время исследования (прогона) составляет 25 минут. Калибровочную кривую получают при использовании в качестве стандарта следующих количеств Iа: 1,25 мг/мл, 0,625 мг/мл, 0,3125 мг/мл, 0,156 мг/мл, 0,078 мг/мл. Затем строят линейный график. Для определения концентрации Ia в каждой пробе используют полученную зависимость у=mx+b. Пред каждым исследованием капилляр промывают буфером для "прогона" (0,2 М фосфат, рН 6,8) в течение трех минут. После каждого 25-минутного прогона капилляр промывают 1 н. NaOH в течение одной минуты, отфильтрованной при использовании HPLC водой в течение 1 минуты, 0,5 М фосфорной кислотой - 3 минуты, отфильтрованной при использовании HPLC водой - 1 минуту. Интегрируют площадь под каждым пиком и определяют общую площадь пиков, конечную концентрацию вычисляют по калибровочной кривой. Оценка продуктов, полученных на основе В.t. Количество Ia, присутствующего в различных коммерчески доступных продуктах, определяют с помощью капиллярного электрофореза. От фирмы Novo Nordisk A/S получают препараты BACTOSPEINETM, JAVELINTM, NOVODORTM, SPHERIMOSTM, BACTIMOSTM, FORAYTM, FLORBACTM и BIOBITTM. XENTARITM и DIPELTM получают от Abbott Laboratories. AGREETM получают от Ciba-Geigy; MVPTM получают от Mycogen и CUTLASSTM получают от Ecogen. Результаты исследований проводятся в табл. 3; они показывают, что Ia присутствует в различных количествах, варьирующих в пределах от менее чем 0,001 г Ia/BIU до 0,071 г Ia/BIU. Биоисследования с использованием питательных сред Активность S. t. k. определяют биометодом с помощью синтетических питательных сред для насекомых с использованием личинок Spodoptera exigua, на третьей стадии развития, личинок второй стадии Helicoverpa zеа, личинок третьей стадии Spodoptera frugiperda, личинок второй стадии Heliothis virescens, личинок третьей стадии Trichoplusia ni, личинок третьей стадии Pseudoplusia includens, личинок третьей стадии Plutella xylostella, личинок третьей стадии Spodoptera littoralis и личинок третьей стадии Mamestra brassicae. Для того чтобы определить степень усиления активности, вызванную добавлением Iа к В. t.-продуктам, и установить круг насекомых, которые подвержены этому воздействию, проводят биологические испытания с использованием специальных питательных сред для насекомых. В опытах с применением высоких концентраций Iа против Spodoptera exigua (7,4-23,7 г Ia/BIU) очищенный Ia (70% активного ингредиента, 30% ацетат-иона) используют для усиления активности BIOBITTM FC (FC представляет собой текучий концентрат). Полученные данные, представленные в табл. 4, показывают усиление активности BIOBITTM HPWP (высокоактивный смачиваемый порошок) в сочетании с Iа (0,658% активного ингредиента). S. littoralis и М. brassicae тестируют при использовании FLORBACTM HPWP в сочетании с Iа. Различные В. t.-продукты взвешивают, и Iа добавляют в количестве от 0,1 до 237 г Ia/BIU. Объем доводят 0,1%-ным Твином (TweenTM). Образцы обрабатывают ультразвуком в течение 1 минуты и затем разводят до конечного объема. Приготавливают также чистые образцы (без Iа) и контрольные образцы. Контрольные образцы включают B. t. k. HD-1-S-1980 (получают из коллекции NRRL), активность которого соответствует 16000 международных единиц (IU) на миллиграмм, и JAVELINTM WG, активность которого составляет 53000 Spodoptera Единиц/мг (SU). Стандартные синтетические питательные среды, включающие воду, агар, сахар, казеин, пшеничные ростки, метилпарабен, сорбиновую кислоту, масло семян льна, целлюлозу, соли и витамины, готовят в 20-литровом котле при нагревании. Это обеспечивает достаточный объем питательной среды для проведения испытания 10-12 образцов с семью различными концентрациями каждого тестируемого вещества. В.t.-растворы последовательно разводят с получением 16 мл аликвот. Каждую аликвоту добавляют к 184 г расплавленной среды. Смесь в достаточной степени гомогенизируют и затем разливают в пластиковый планшет, имеющий 40 индивидуальных ячеек. Для каждой партии среды готовят три контрольных планшета. Как только среда остывает и становится твердой, в каждую ячейку помещают по одному насекомому известного возраста (личинки 2-3-го поколения), планшеты накрывают прозрачной перфорированной полиэфирной пленкой (mylar). Планшеты устанавливают на полки и инкубируют в течение четырех дней при 28oС и 65% относительной влажности. Через четыре дня определяют, сколько насекомых погибло. Каждый планшет резко встряхивают на поверхности стола и неподвижные личинки учитывают как мертвые. Вычисляют процентную долю погибших личинок и данные анализируют в параллельных независимых опытах. Вычисляют LC50s, LC90s, наклон линий регрессии, коэффициент вариабельности и уровень активности. Образцы исследуют по крайней мере три раза или до тех пор, пока три полученные величины активности не попадут в 20%-ный интервал от вычисленного значения активности для каждого образца. Чтобы вычислить увеличение активности, обеспечиваемое каждой концентрацией Ia, LC50 пробы В.t./Ia корректируют с поправкой на количество В. t. в образце. Значение LC50 спаренных "чистых" образцов делят на скорректированные значения LC50, чтобы определить порядок снижения LC50, ассоциированного с Iа. Для исследования Lobesia bothrana используют следующую методику. Виноград, пораженный Lobesia bothrana, собирают на необработанном пестицидами поле и удаляют личинки. Готовят последовательные разведения Iа в воде (250 мкг/мл, 500 мкг/мл и 1000 мкг/мл). Одну личинку помещают в центр чашки Петри. Если наблюдают, что личинка пьет, ее переносят в чашку Петри со свежесорванными ягодами винограда. Личинок сохраняют при 22oС в течение 3-4 дней. Как показано в табл. 4, наблюдается значительное уменьшение значений LC50 для всех образцов. Усиление воздействия различных продуктов на Spodoptera exigua благодаря Ia определяют биологическим методом при использовании питательных сред, как описано выше. Количества добавленного Ia/BIU продукта приведены в табл. 5. Смесь Ia/B. t.-продукт вводят в агаризованную питательную среду, содержащую пшеничные ростки и казеин. Насекомых помещают на эту среду на 4-дневный период и выдерживают при 28oС. Гибель насекомых регистрируют и исследуют с помощью вероятностных исследований. LC50, LC90 и усиление активности определяют с учетом соответствующего продукта, не содержащего Ia. Результаты, представленные в табл. 5, показывают, что Ia усиливает активность различных В.t.k.- и B.t.а.-продуктов, полученных из различных источников. Штаммы В.t., содержащие эти продукты, описаны в предшествующих таблицах. Биологические исследования с использованием листьев Фолиарные биологические испытания осуществляют на личинках Spodoptera exigua второй стадии с помощью растений брокколи с использованием BIOBITTM FC и Iа. Отношение Iа и BIOBITTM FC то же - 2 г Ia/BIU BIOBITTM FC. Обработку растений брокколи осуществляют путем направленного разбрызгивания препарата в объеме носителя 30,64 л на га (75,7 л на акр). После того как остаток разбрызганной жидкости высыхает, с растений срезают листья с личинками Spodoptera exigua второй стадии. Результаты исследований представлены в табл. 6. 100%-ная смертность насекомых наблюдается при обработке дозой 8,7 BIU/гектар BIOBITTM FC+Ia, тогда как BIOBITTM FC сам по себе уничтожает 92% личинок в дозе 58,8 BIU/гектар и 8% личинок в дозе 17,6 BIU/гектар. Обработанные растения также подвергают воздействию прямого солнечного света в течение 8 часов, после чего обрывают зараженные листья. После такой 8-часовой экспозиции на свету BIOBITTM FC сам по себе обеспечивает 27%-ную смертность насекомых в дозе 58,8 BIU/гектар, тогда как BIOBITTM FC+Ia обеспечивает 100%-ную смертность в дозе 8,7 BIU/гектар. Фолиарные исследования, проведенные с помощью личинок четвертой ранней стадии, показывает, что BIOBITTM FC сам по себе обеспечивает 75%-ную смертность личинок в дозе 52 BIU/гектар и 100%-ную смертность в дозе 13 BIU/гектар при совместном применении BIOBITTM FC (FC обозначает "текучий концентрат" )+Ia. Полевые испытания Опыты в поле на бобах (насекомое Spodoptera exigua) показывают, что BIOBITTM FC сам по себе в дозе 70 BIU/гектар обеспечивает 51%-ный контроль, тогда как 2 г Ia/BIU BIOBITTM FC в дозе 40 BIU/гектар обеспечивают 89%-ный контроль (по сравнению с необработанным полем). JAVELINTM WG в дозе 45 BIU/гектар обеспечивает 51%-ный контроль. Полевые эксперименты на сладкой кукурузе (насекомое Spodoptera frugiperda) показывают, что 2 г Ia/BIU BIOBITTM FC в дозе 39,5 BIU/гектар обеспечивают 84%-ный контроль. Коэффициенты устойчивости Исследуют колонии восприимчивых и устойчивых Plutella xylostella. Устойчивые мотыльки представляют собой особей, собранных на полях Флориды, которые уже приобрели устойчивость по отношению к В.t. вследствие интенсивного использования JAVELINTM WC. BIOBITTM HPWP в комплексе с Iа исследуют методом погруженных листьев. Устойчивость к JAVELINTM и XENTARITM изучают без добавления Iа. Листовые диски капусты диаметром 6 см погружают на 10 секунд в один из восьми препаратов на основе В.t. с различной концентрацией или в смесь указанных препаратов с Ia. Концентрация варьирует от 1 до 1000 ppm. Листовым дискам дают подсохнуть на воздухе в течение двух часов и помещают их в пластиковые чашки Петри с личинками второй стадии (0,2-0,4 мг). Двадцать пять насекомых/доза/день дважды реплицируют, чтобы получить 50 насекомых/доза. После инкубирования в течение 72 часов при 27oС регистрируют смертность. Снижение смертельной дозы исследуют путем вероятностного анализа. Коэффициенты устойчивости рассчитывают делением величин LC50 и LC90 для восприимчивых особей. Результаты исследований приведены в табл. 7. Они показывают, что BIOBITTM HPWP усиливает активность при совместном использовании 2 г Ia/BIU и 4 г Ia/BIU. В частности, при использовании 4 г Ia/BIU имеет место двукратное уменьшение коэффициента устойчивости LC50 и 10-кратное уменьшение коэффициента устойчивости LC90. Описанное и заявленное изобретение не должно ограничиваться частными вариантами его осуществления, приведенными здесь, поскольку примеры приводятся только в целях иллюстрации некоторых аспектов данного изобретения. Предполагается, что любые равнозначные варианты воплощения изобретения входят в его объем. Действительно, различные модификации изобретения, дополняющие те, которые раскрыты в настоящем описании, очевидным образом следуют из него и понятны специалисту в данной области исследований. Такие модификации также охватываются заявленными пунктами формулы. Цитируемые в настоящем описании источники информации приведены исключительно в качестве ссылок. Депонирование микроорганизмов В соответствии с Будапештским Договором нижеследующие штаммы Bacillus thuringiensis были депонированы в Коллекции культур для целей патентной процедуры сельскохозяйственной исследовательской службы (NRRL), Northern Regional Research Center, 1815 University Street, Peoria, Illinois, 61604, USA. Штамм EMCC0086; номер NRRL B-21147; дата депонирования - 6 октября 1993. Штаммы депонированы при условии гарантированной доступности культуры в течение периода, предшествующего выдаче патента какому-либо лицу, определенному Комиссаром ведомства по патентам и товарным знакам, согласно 37 С.F. R. 1.44 и 35 U.S.С. 122. Для депонирования представляется чистая культура депонируемого штамма. Депозит и его потомки являются доступными в соответствии с требованиями патентных законов других стран, в которые подается заявка. Однако следует понимать, что доступность депонированной культуры не дает права воспроизводить объект изобретения в нарушение прав, обеспечиваемых патентом, выданным от лица государства.
Формула изобретения1. Способ потенциации пестицидной активности пестицида, полученного на основе бактерий, относящихся к роду Bacillus, включающий добавление к пестициду потенциатора, полученного путем культивирования штамма бактерий рода Bacillus с последующим выделением потенциатора из супернатанта культуры, полученного на предыдущей стадии, отличающийся тем, что используют потенциатор, который имеет структуру I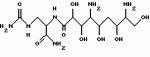 и характеризуется 1Н ЯМР - сдвигами приблизительно в следующих точках: и характеризуется 1Н ЯМР - сдвигами приблизительно в следующих точках:  1,5, 3,22, 3,29, 3,35, 3,43, 3,58, 3,73, 3,98, 4,07, 4,15, 4,25 и 4,35 и 13С сдвигами приблизительно в следующих точках: 1,5, 3,22, 3,29, 3,35, 3,43, 3,58, 3,73, 3,98, 4,07, 4,15, 4,25 и 4,35 и 13С сдвигами приблизительно в следующих точках:  31,6, 37,2, 51,1, 53,3, 54,0, 54,4, 61,5, 61,6, 64,1, 65,6, 158,3, 170,7 и 171,3, или его соль. 2. Способ по п. 1, отличающийся тем, что культивирование осуществляют процессом ферментации. 3. Способ по п. 1, отличающийся тем, что выделение указанного потенциатора из супернатанта осуществляют хроматографией на колонке. 4. Способ по п. 1, отличающийся тем, что штамм, относящийся к роду Bacillus, представляет собой штамм Bacillus thuringiensis. 5. Способ по п. 4, отличающийся тем, что штамм Bacillus thuringiensis выбирают из группы, включающей в себя штаммы Bacillus thuringiensis подвид aizawai, Bacillus thuringiensis подвид alesti, Bacillus thuringiensis подвид canadiensis, Bacillus thuringiensis подвид colmeri, Bacillus thuringiensis подвид coreanensis, Bacillus thuringiensis подвид dakota, Bacillus thuringiensis подвид darmstadiensis, Bacillus thuringiensis подвид dendrolimus, Bacillus thuringiensis подвид entomocidus, Bacillus thuringiensis подвид finitimus, Bacillus thuringiensis подвид galleriae, Bacillus thuringiensis подвид indiana, Bacillus thuringiensis подвид israelensis, Bacillus thuringiensis подвид kenyae, Bacillus thuringiensis подвид kumamotoensis, Bacillus thuringiensis подвид kurstaki, Bacillus thuringiensis подвид kyushuensis, Bacillus thuringiensis подвид japonensis, Bacillus thuringiensis подвид mexcanensis, Bacillus thuringiensis подвид morrisoni, Bacillus thuringiensis подвид neoleonensis, Bacillus thuringiensis подвид nigeriae, Bacillus thuringiensis подвид ostriniae, Bacillus thuringiensis подвид pakistani, Bacillus thuringiensis подвид pondicheriensis, Bacillus thuringiensis подвид shandongiensis, Bacillus thuringiensis подвид silo, Bacillus thuringiensis подвид sotto, Bacillus thuringiensis подвид subtoxicus, Bacillus thuringiensis подвид tenebrionis, Bacillus thuringiensis подвид thompsoni, Bacillus thuringiensis подвид tochigiensis, Bacillus thuringiensis подвид tohokuensis, Bacillus thuringiensis подвид tolworthi, Bacillus thuringiensis подвид toumanoffi, Bacillus thuringiensis подвид wuhanensis, Bacillus thuringiensis подвид yunnanensis. 6. Способ по п. 4, отличающийся тем, что штамм Bacillus thuringiensis представляет собой штамм Bacillus thuringiensis подвид kurstaki. 7. Способ по п. 1, отличающийся тем, что пестицид, полученный на основе бактерий рода Bacillus, является дельта-эндотоксином Bacillus thuringiensis или его фрагментом, обладающим пестицидной активностью. 8. Способ по п. 7, отличающийся тем, что дельта-эндотоксин Bacillus thuringiensis или его фрагмент, обладающий пестицидной активностью, выбирают из группы, состоящей из cry I, cry II, cry III, cry IV, cry V и cry VI. 9. Способ по п. 8, отличающийся тем, что дельта-эндотоксин Bacillus thuringiensis или его фрагмент, обладающий пестицидной активностью, представляет собой cry IA дельта-эндотоксин или его фрагмент, обладающий пестицидной активностью. 10. Способ по п. 8, отличающийся тем, что дельта-эндотоксин Bacillus thuringiensis или его фрагмент, обладающий пестицидной активностью, представляет собой cry IC дельта-эндотоксин или его фрагмент, обладающий пестицидной активностью. 11. Способ по п. 1, отличающийся тем, что пестицид, полученный на основе бактерий рода Bacillus, представляет собой споры Bacillus thuringiensis. 31,6, 37,2, 51,1, 53,3, 54,0, 54,4, 61,5, 61,6, 64,1, 65,6, 158,3, 170,7 и 171,3, или его соль. 2. Способ по п. 1, отличающийся тем, что культивирование осуществляют процессом ферментации. 3. Способ по п. 1, отличающийся тем, что выделение указанного потенциатора из супернатанта осуществляют хроматографией на колонке. 4. Способ по п. 1, отличающийся тем, что штамм, относящийся к роду Bacillus, представляет собой штамм Bacillus thuringiensis. 5. Способ по п. 4, отличающийся тем, что штамм Bacillus thuringiensis выбирают из группы, включающей в себя штаммы Bacillus thuringiensis подвид aizawai, Bacillus thuringiensis подвид alesti, Bacillus thuringiensis подвид canadiensis, Bacillus thuringiensis подвид colmeri, Bacillus thuringiensis подвид coreanensis, Bacillus thuringiensis подвид dakota, Bacillus thuringiensis подвид darmstadiensis, Bacillus thuringiensis подвид dendrolimus, Bacillus thuringiensis подвид entomocidus, Bacillus thuringiensis подвид finitimus, Bacillus thuringiensis подвид galleriae, Bacillus thuringiensis подвид indiana, Bacillus thuringiensis подвид israelensis, Bacillus thuringiensis подвид kenyae, Bacillus thuringiensis подвид kumamotoensis, Bacillus thuringiensis подвид kurstaki, Bacillus thuringiensis подвид kyushuensis, Bacillus thuringiensis подвид japonensis, Bacillus thuringiensis подвид mexcanensis, Bacillus thuringiensis подвид morrisoni, Bacillus thuringiensis подвид neoleonensis, Bacillus thuringiensis подвид nigeriae, Bacillus thuringiensis подвид ostriniae, Bacillus thuringiensis подвид pakistani, Bacillus thuringiensis подвид pondicheriensis, Bacillus thuringiensis подвид shandongiensis, Bacillus thuringiensis подвид silo, Bacillus thuringiensis подвид sotto, Bacillus thuringiensis подвид subtoxicus, Bacillus thuringiensis подвид tenebrionis, Bacillus thuringiensis подвид thompsoni, Bacillus thuringiensis подвид tochigiensis, Bacillus thuringiensis подвид tohokuensis, Bacillus thuringiensis подвид tolworthi, Bacillus thuringiensis подвид toumanoffi, Bacillus thuringiensis подвид wuhanensis, Bacillus thuringiensis подвид yunnanensis. 6. Способ по п. 4, отличающийся тем, что штамм Bacillus thuringiensis представляет собой штамм Bacillus thuringiensis подвид kurstaki. 7. Способ по п. 1, отличающийся тем, что пестицид, полученный на основе бактерий рода Bacillus, является дельта-эндотоксином Bacillus thuringiensis или его фрагментом, обладающим пестицидной активностью. 8. Способ по п. 7, отличающийся тем, что дельта-эндотоксин Bacillus thuringiensis или его фрагмент, обладающий пестицидной активностью, выбирают из группы, состоящей из cry I, cry II, cry III, cry IV, cry V и cry VI. 9. Способ по п. 8, отличающийся тем, что дельта-эндотоксин Bacillus thuringiensis или его фрагмент, обладающий пестицидной активностью, представляет собой cry IA дельта-эндотоксин или его фрагмент, обладающий пестицидной активностью. 10. Способ по п. 8, отличающийся тем, что дельта-эндотоксин Bacillus thuringiensis или его фрагмент, обладающий пестицидной активностью, представляет собой cry IC дельта-эндотоксин или его фрагмент, обладающий пестицидной активностью. 11. Способ по п. 1, отличающийся тем, что пестицид, полученный на основе бактерий рода Bacillus, представляет собой споры Bacillus thuringiensis.
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 31.05.2003 Извещение опубликовано: 27.09.2004 БИ: 27/2004 Популярные патенты: 2165134 Корнеподрезающий рабочий орган машины для добычи лакричного сырья ... листа не должна превышать 16 мм. При указанной толщине листа обеспечивается устойчивое подрезание корнесодержащего пласта на глубине 0,6 - 0,65 м при минимальном лобовом тяговом сопротивлении. Одностороннее лезвие 8 боковины 10 выполнено с углом заточки не выше 18 - 21o. Толщина режущей кромки 2 не превышает 0,4 - 0,7 мм. Лезвие 8 подвержено объемной закалке до 40 - 50 HRC. Остальная часть боковины 10 остается без термообработки. Нижняя часть каждой боковины 10 (11) имеет криволинейный участок 15 и монтажный участок 16. Радиус искривления (r) участка 15 (фиг. 3) должен быть выполнен не менее 150 мм. Этим исключаются любые нависания корней солодки, залипание почвой и грунтом, а также ... 2218755 Способ длительного клонирования пайзы (echinochloa frumentacea link) ... основаны на получении побегов в каллусных культурах зрелых семян Е. oryzicola Vasing [1] , регенерантных растений в культурах листьев Е. oryzicola Vasing [2], сегментов молодых соцветий Е. crusgalli и Е. colonum (L.) Link [3, 4], мезокотилей Е. crusgalli var. oryzicola и Е. muricata [5]. Наиболее совершенным является способ клонирования Е. glabrescens Munro ex Hook F. в культурах незрелых соцветий и листьев [6]. Он основан на использовании 3 типов сред: каллусогенной, регенерационной и поддерживающей регенерационный потенциал в состоянии покоя в течение продолжительного (примерно 7 месяцев) периода времени. Недостаток описанного способа клонирования состоит в том, что отсутствует ... 2083070 Способ предпосевной обработки семян и устройство для его осуществления ... полупериода, после чего цикл повторяется, формируя последовательность импульсов магнитного поля. Пример 1 осуществления способа. На семена ячменя воздействовали серией импульсов магнитного поля длительностью 30 мкс и амплитудной напряженности 100 кА/м, варьируя число импульсов от 300 до 2000. Результаты приведены в табл. 1. Каждый опыт из серии проводился на площади 1 га в реальных условиях Воронежской обл. При числе импульсов менее 400 эффект повышения всхожести отсутствует, а при числе импульсов более 1000 не превышает контрольной всхожести и снижается ниже контрольной при увеличении числа импульсов. Пример 2. На семена ячменя воздействовали серией импульсов магнитного ... 2059362 Установка для выращивания мидий ... замыкает электрическую цепь, питающую электрический звонок 31 и реле времени 32. Если на плоту имеются люди, они должны за определенный отрезок времени покинуть плот 1. Через определенный отрезок времени реле 32 времени срабатывает и размыкает электрическую цепь, питающую соленоиды 33. При этом штоки 34 соленоидов 33 перемещаются вперед и контактируют с золотниками 35, при этом клапаны открываются, и сжатый воздух из всех надувных камер 6 удаляется. Надувные камеры уменьшаются в объеме и погружаются на дно моря, при перемещении плота на дно моря плот опирается на ножки 20. Канаты 15 под действием упругости материалов деформируются в спираль, уменьшаясь в объеме, что предотвращает ... 2262220 Способ возделывания кормовых культур в условиях астраханской области (варианты) ... (SU, авторское свидетельство №843808, М. Кл.2 А 01 С 7/00. Способ возделывания сельскохозяйственных культур / М.М.Мельников (СССР). -Заявка №2786254/30-15; Заявлено 15.06.1979; Опубл. 07.07.1981, Бюл. №25 // Открытия. Изобретения. - 1981. №25).К недостаткам этого способа, принятого нами в качестве наиближайшего аналога, относятся неудовлетворительное качество корма, наличие недопустимых химических веществ, несбалансированность корма, низкая поедаемость животными.Сущность изобретения заключается в следующем.Задача, на решение которой направлено заявляемое изобретение, - создание непрерывного зеленого конвейера для откорма дойного стада крупного рогатого скота.Технический результат - ... |
Еще из этого раздела: 2132610 Устройство обогрева сельскохозяйственных животных и птицы 2196403 Почвообрабатывающий модуль 2120753 Способ получения пестицидного водного суспензионного концентрата и пестицидный водный суспензионный концентрат 2160533 Способ профилактики и коррекции транспортного стресса у крупного рогатого скота 2167510 Способ и устройство для изготовления круглых тюков соломы или подобного материала с пленочным защитным покрытием 2125366 Доильный аппарат 2084132 Устройство для выращивания растений 2281645 Устройство для размещения цветов и растений с подсветкой (варианты) 2488263 Система механической подачи недомолота для вторичного обмолота на возвратную доску 2197817 Поплавок для рыболовных удочек и снастей |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||