Модифицированные ингибиторы протеиназыПатент на изобретение №: 2182598 Автор: ЭТКИНСОН Хауард Джон (GB), МАКФЕРСОН Майкл Джон (GB), ЭРВИН Питер Эдвард (GB) Патентообладатель: НОВАРТИС АГ (CH) Дата публикации: 20 Мая, 2002 Начало действия патента: 20 Ноября, 1995 Адрес для переписки: 193036, Санкт-Петербург, а/я 24, "НЕВИНПАТ", А.В. Поликарпову Изображения    Изобретение относится к биотехнологии и может быть использовано в селекции организмов, например растений. Цистатиновый ингибитор протеиназы (оризацистатин 1), имеющий делецию аспарагиновой кислоты в положении 86, и гибридный ингибитор протеиназы, включающий цистатин и ингибитор протеиназы, используют для борьбы с патогенами, паразитами или вредителями. Трансформация организма молекулой ДНК, кодирующей ингибиторы протеиназы, придает ему устойчивость к протеолитическому расщеплению. Ингибиторы протеиназ могут быть также получены с использованием праймеров. 7 с. и 11 з.п. ф-лы, 6 ил., 4 табл. , , , , , , , , , , ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУИзобретение относится к ингибиторам протеиназы, в частности к новым ингибиторам протеиназы, способам их получения и к содержащим их продуктам и процессам. Протеиназы - это разрушающие белки ферменты, весьма значительно различающиеся по избирательности к субстратам, что препятствует их использованию как основы для классификации. Как правило, лучше классифицировать эти ферменты, руководствуясь природой катализируемых ими реакций. Так, протеиназы разделяют на четыре группы, определяемые как сериновые, цистеиновые, аспарагиновые протеиназы и металлопротеиназы. Сериновые и цистеиновые протеиназы широко распространены и весьма разнообразны. Их находят в организмах и прокариот, и эукариот, включая растения и животных. В отличие от них аспарагиновые протеиназы, по-видимому, были выявлены только в организмах эукариот. Поскольку эти ферменты служат для разрушения белков, их полезность или вредность для данного организма обусловлена их происхождением и/или локализацией. К примеру, вредны ферменты, используемые патогенами, паразитами или вредителями для разрушения ткани клеточной стенки хозяина. Такие патогены, паразиты или вредители, как бактерии, грибы, растения, насекомые, нематоды и так далее, продуцируют протеиназы, разрушающие ткань клеточной стенки хозяина, принося ему вред. К примеру, причиняемые грибами ежегодные глобальные потери урожая превышают миллиард фунтов. Патоген Botrytis cinerea имеет ведущее экономическое значение, поскольку вызывает заболевания у культурных растений тридцати видов, способен нанести серьезный вред в тепличном хозяйстве, в виноградарстве и вследствие порчи фруктов и овощей после уборки. Этот важный патоген может быть подавлен фунгицидами, но к сожалению, их использование связано с рядом недостатков, а именно, с финансовыми потерями, потенциальной опасностью для окружающей среды при применении токсичных фунгицидов и соответствующим беспокойством потребителя, а главное - с проблемой устойчивости патогенов к фунгицидам. Кроме того, многие фунгициды эффективны только против ограниченного ряда патогенных грибов. Указанные недостатки имеют место и при применении синтетических продуктов, производимых для борьбы с другими патогенами, паразитами или вредителями, такими как насекомые или определенные их виды, бактерии или определенные их виды и другие эукариотические организмы, включая таких простейших, как амебы, кишечные жгутиковые и реснитчатые, таких геможгутиковых, как лейшмании или трипаносомы, таких споровиков, как возбудители малярии, передаваемые членистоногими, таких гельминтов, как трематоды или плоские черви, цестоды, акантоцефалы, нематоды, трихурии, трихины, анкилостомы, филярии, спируроиды, таких членистоногих, как акарины или клещи, разнокрылые клещи, вши, блохи; таких двукрылых, как переносящие болезни мухи, включая комаров, личинки и миаз, но не ограничиваясь ими. Известно, что ингибирование протеиназ обычно имеет место после заражения патогеном. Например, было показано (1), что после заражения Phytophthora infestans томаты ряда сортов способны сопротивляться грибам, повышая продуцирование ингибиторов протеиназ. Эту связь между устойчивостью и способностью продуцировать ингибиторы протеиназ используют для достижения положительного эффекта в борьбе с заболеваниями, вызванными патогенами, вредителями и паразитами. Например, из большинства известных заявителю публикаций по этому вопросу ясно, что с вредителями растений можно бороться с помощью ингибитора протеиназы на основе животного цистатина белка куриного яйца (CEWC), рекомбинанатно встроенного в такие однодольные растения, как хлебные злаки, фуражные или газонные травы, или такие двудольные, как овощи, трубчатые или сахароносные культуры (ЕР 0 348 348). Аналогично, с растительными нематодами боролись, применяя ингибитор протеиназы растительного происхождения, а именно, ингибитор трипсина из вигны китайской, который был рекомбинантно встроен в табак, томат, хлопок, рапс, овощные культуры или декоративные растения (ЕР 0 502 730). Также было предложено применять ингибиторы протеиназ как антипаразитарные белки, которые идеально могут быть введены хозяйским видам в составе либо лекарства, либо пищи (заявка на патент Великобритании 94 03819.7). Далее, известно применение ингибиторов протеиназ для нейтрализации действия протеиназ и, таким образом, для борьбы с результатами действия патогенов, паразитов или вредителей. В частности, известны трансгенные растения, которые снабжены таким специфическим ингибитором протеиназы, как ингибитор цистеиновой протеиназы. Тем не менее, в основу изобретения положена задача создать модифицированные ингибиторы протеиназ, которые обладали бы большей эффективностью в сравнении с их немодифицированными аналогами или природными ингибиторами протеиназ, или альтернативно - синтетически изготовить и усовершенствовать ингибиторы протеиназ с тем, чтобы создать, согласно одному из воплощений, гибридные ингибиторы протеиназ. В одном аспекте этого изобретения авторы сконцентрировались на группе ингибиторов протеиназ, известных как цистатины. Примерно для 25 из них известны последовательности аминокислот. Это позволило провести сравнительный анализ их первичных последовательностей для создания основы для идентификации структурных аналогий и выяснить, что между растительными и животными цистатинами существует довольно много различий, подтвердив необходимость раздельной классификации обеих групп. Так, сравнение растительного цистатина, Оризацистатина I - Ос-I, структура ДНК-последовательности которого приведена на фиг.3, и с животного цистатина, цистатина белка яйца, показало значительные различия и небольшое сходство их общего аминокислотного состава. Более того, животные и растительные цистатины существенно различны по связывающим свойствам. Например, константа диссоциации Ki для цистатина белка яйца составляет 5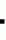 10-12 M, а растительного цистатина Ос-I из риса - 3 10-12 M, а растительного цистатина Ос-I из риса - 3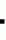 10-8 М. Данные сравнительного анализа первичной структуры ряда цистатинов представлены на фиг.1. Аминокислоты пронумерованы от 1 до 181. Из этих данных можно видеть, что имеется сохраняемый ингибирующий сайт в положениях от 100 до 104 выравненных аминокислотных последовательностей, представленный мотивом QVVAG (или QLVAG), и, далее, что имеется сохраняемый PW-мотив в положениях 160 и 161 выравненных аминокислотных последовательностей. Это сохранение проявляется примерно в двух третях известных последовательностей, а на основании структурных исследований считается, что оно обеспечивает функционирование белка и, следовательно, ингибирование протеиназ. Однако, в некоторых цистатинах с низким значением Ki этот PW-мотив отсутствует, а потому его роль в функционировании цистатина неясна. В других работах описаны полученные рекомбинацией новые цистатины. Например, был изменен ингибитор человеческой цистеиновой протеиназы - цистатин С, который участвует во внутриклеточном катаболизме белков и пептидов, в протеолитической конверсии прогормонов, во внеклеточном разложении коллагена и в проникновении злокачественных клеток в нормальные ткани. Разработчики модифицировали цистатин С заменой одной или более аминокислот в положениях 5-17, 55-59 и/или 68 на другие аминокислоты при сохранении структурной последовательности 120 аминокислот. Модификацию провели для создания животного цистатина С с постоянной активностью (WO 88/09384). Было неожиданно обнаружено, что сайт-направленная модификация растительного цистатина, например, Оризацистатина I (Oc-I), может улучшить его связывающие свойства и таким образом повысить эффективность фермента по ингибированию протеиназ. Указанная модификация состоит в удалении аминокислоты (аспарагиновой кислоты) в положении 86 в структуре последовательности аминокислот растительного цистатина и повышает Ki в 13 раз - до 2,3 10-8 М. Данные сравнительного анализа первичной структуры ряда цистатинов представлены на фиг.1. Аминокислоты пронумерованы от 1 до 181. Из этих данных можно видеть, что имеется сохраняемый ингибирующий сайт в положениях от 100 до 104 выравненных аминокислотных последовательностей, представленный мотивом QVVAG (или QLVAG), и, далее, что имеется сохраняемый PW-мотив в положениях 160 и 161 выравненных аминокислотных последовательностей. Это сохранение проявляется примерно в двух третях известных последовательностей, а на основании структурных исследований считается, что оно обеспечивает функционирование белка и, следовательно, ингибирование протеиназ. Однако, в некоторых цистатинах с низким значением Ki этот PW-мотив отсутствует, а потому его роль в функционировании цистатина неясна. В других работах описаны полученные рекомбинацией новые цистатины. Например, был изменен ингибитор человеческой цистеиновой протеиназы - цистатин С, который участвует во внутриклеточном катаболизме белков и пептидов, в протеолитической конверсии прогормонов, во внеклеточном разложении коллагена и в проникновении злокачественных клеток в нормальные ткани. Разработчики модифицировали цистатин С заменой одной или более аминокислот в положениях 5-17, 55-59 и/или 68 на другие аминокислоты при сохранении структурной последовательности 120 аминокислот. Модификацию провели для создания животного цистатина С с постоянной активностью (WO 88/09384). Было неожиданно обнаружено, что сайт-направленная модификация растительного цистатина, например, Оризацистатина I (Oc-I), может улучшить его связывающие свойства и таким образом повысить эффективность фермента по ингибированию протеиназ. Указанная модификация состоит в удалении аминокислоты (аспарагиновой кислоты) в положении 86 в структуре последовательности аминокислот растительного цистатина и повышает Ki в 13 раз - до 2,3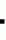 10-9 М. Эта модификация представлена удалением аспарагиновой кислоты (символ D) в положении 163 в последовательности выравненных аминокислот на фиг.1. Ясно, что это улучшение растения не обеспечивает доведения значения Ki растительного цистатина до Ki животного цистатина, в частности цистатина белка яйца. Однако, это усиливает интерес к более свободному подходу к трансгенной гибридизации. Это подразумевает введение в ген одного вида целого неповрежденного фрагмента из гена другого вида, к примеру, введение в растения человеческих генов, кодирующих человеческие белки, и наоборот. Пока наши представления о последствиях манипуляций с генами неполны, следует проявлять осторожность и предусмотрительность, учитывая возможность ошибки, и проявлять более рациональный подход к этим манипуляциям. Так, для борьбы с встречающимися в мире болезнями растений можно предложить применение белков растительного происхождения или альтернативно - подобных им белков с такими же или существенно подобными структурными, биохимическими и физиологическими функциями. Последняя категория включает, но без ограничения, гибридные молекулы. Далее, многие животные цистатины с низкими Ki имеют в молекулах несколько дисульфидных мостиков, которые не найдены в изученных растительных цистатинах. Поэтому для правильного построения белковой молекулы благоразумно использовать, хотя бы частично, растительный цистатин в растительных системах. Так, предложенная сайт-направленная модификация растительных ингибиторов протеиназ, в частности, растительного цистатина, и предложенные гибридные ингибиторы протеиназ, включающие по меньшей мере часть растительного ингибитора протеиназы, обеспечивают получение новых улучшенных белков для использования предпочтительно, но не исключительно в растительных системах. Поскольку при сравнительном анализе структур аминокислотных последовательностей, как представлено на фиг.1, установлено, что выше выравненной аминокислоты 104 в них очень мало общего, постольку наши наблюдения кажутся еще более поразительными. Предыдущие работы по сайт-направленной модификации цистатинов были сконцентрированы на хорошо сохраняемом упомянутом мотиве QVVAG, но его модификация всегда приводила к отрицательным результатам (12). Как следует из изложенного, задачей этого изобретения является создание нового ингибитора протеиназы с улучшенной, по меньшей мере по способности связываться с протеиназой, эффективностью. Далее, в задачу изобретения также входит создание нового ингибитора протеиназы с улучшенной в идеале эффективностью, но также содержащего гибридную молекулу, которая предпочтительно, но не исключительно содержит часть ингибитора протеиназы одного вида и часть ингибитора протеиназы другого вида. В задачу изобретения входит создание продуктов, включающих весь новый белок или его часть, или же всю молекулу ДНК или ее часть, кодирующую этот белок, и применение этого нового белка и/или ДНК. Согласно первому аспекту изобретения предложен ингибитор протеиназы, модифицированный или изготовленный таким образом, что он в сравнении с его природным аналогом является более эффективным при ингибировании протеиназы, с которой он взаимодействует. В идеале этот ингибитор протеиназы сильнее связывается с этой протеиназой. Соответственно предложен синтетический ингибитор протеиназы с Ki по меньшей мере в 10 раз меньше, чем у природного аналога. Например, изменение Ki от 3 10-9 М. Эта модификация представлена удалением аспарагиновой кислоты (символ D) в положении 163 в последовательности выравненных аминокислот на фиг.1. Ясно, что это улучшение растения не обеспечивает доведения значения Ki растительного цистатина до Ki животного цистатина, в частности цистатина белка яйца. Однако, это усиливает интерес к более свободному подходу к трансгенной гибридизации. Это подразумевает введение в ген одного вида целого неповрежденного фрагмента из гена другого вида, к примеру, введение в растения человеческих генов, кодирующих человеческие белки, и наоборот. Пока наши представления о последствиях манипуляций с генами неполны, следует проявлять осторожность и предусмотрительность, учитывая возможность ошибки, и проявлять более рациональный подход к этим манипуляциям. Так, для борьбы с встречающимися в мире болезнями растений можно предложить применение белков растительного происхождения или альтернативно - подобных им белков с такими же или существенно подобными структурными, биохимическими и физиологическими функциями. Последняя категория включает, но без ограничения, гибридные молекулы. Далее, многие животные цистатины с низкими Ki имеют в молекулах несколько дисульфидных мостиков, которые не найдены в изученных растительных цистатинах. Поэтому для правильного построения белковой молекулы благоразумно использовать, хотя бы частично, растительный цистатин в растительных системах. Так, предложенная сайт-направленная модификация растительных ингибиторов протеиназ, в частности, растительного цистатина, и предложенные гибридные ингибиторы протеиназ, включающие по меньшей мере часть растительного ингибитора протеиназы, обеспечивают получение новых улучшенных белков для использования предпочтительно, но не исключительно в растительных системах. Поскольку при сравнительном анализе структур аминокислотных последовательностей, как представлено на фиг.1, установлено, что выше выравненной аминокислоты 104 в них очень мало общего, постольку наши наблюдения кажутся еще более поразительными. Предыдущие работы по сайт-направленной модификации цистатинов были сконцентрированы на хорошо сохраняемом упомянутом мотиве QVVAG, но его модификация всегда приводила к отрицательным результатам (12). Как следует из изложенного, задачей этого изобретения является создание нового ингибитора протеиназы с улучшенной, по меньшей мере по способности связываться с протеиназой, эффективностью. Далее, в задачу изобретения также входит создание нового ингибитора протеиназы с улучшенной в идеале эффективностью, но также содержащего гибридную молекулу, которая предпочтительно, но не исключительно содержит часть ингибитора протеиназы одного вида и часть ингибитора протеиназы другого вида. В задачу изобретения входит создание продуктов, включающих весь новый белок или его часть, или же всю молекулу ДНК или ее часть, кодирующую этот белок, и применение этого нового белка и/или ДНК. Согласно первому аспекту изобретения предложен ингибитор протеиназы, модифицированный или изготовленный таким образом, что он в сравнении с его природным аналогом является более эффективным при ингибировании протеиназы, с которой он взаимодействует. В идеале этот ингибитор протеиназы сильнее связывается с этой протеиназой. Соответственно предложен синтетический ингибитор протеиназы с Ki по меньшей мере в 10 раз меньше, чем у природного аналога. Например, изменение Ki от 3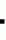 10-8 М до 3 10-8 М до 3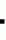 10-9 М считается ее улучшением. В соответствии со вторым аспектом изобретения предложен ингибитор протеиназы с сайт-направленной делецией и/или заменой по меньшей мере одной аминокислоты с понижением KL белка минимум в 10 раз. Предпочтительно белок является цистатином, а сайт-направленная делеция или замена относится к делеции аспарагиновой кислоты в положении 86 структуры аминокислотной последовательности Ос-I, либо альтернативно, делеции аспарагиновой кислоты в положении 163 в приведенной на фиг.1 структуре выравненных аминокислотных последовательностей выравненного ингибитора протеиназы такого как цистатин, либо альтернативно, к делеции ее функционального аналога в родственных ингибиторах протеиназы или цистатинах. В другом случае сайт-направленная модификация состоит в замене указанной аспарагиновой кислоты в указанном положении на другую аминокислоту, свойства которой противоположны функциональным свойствам исключаемой аспарагиновой кислоты. Соответственно третьему аспекту изобретения предложена вся структура ДНК-последовательности, представленная на фиг.2, или ее часть, которая кодирует белок согласно первому аспекту изобретения. Все белки согласно изобретению или соответствующие им ДНК-последовательности применяют в борьбе с заболеваниями, симптомы которых хотя бы частично обусловлены или заключаются в продуцировании протеиназы. Поэтому новые белки и соответствующие им ДНК-последовательности могут быть прямо или косвенно применены для предотвращения, облегчения или ослабления таких болезненных состояний. Например, поражения организма-хозяина, вызванные патогенами, вредителями или паразитами и обусловленные разложением белков протеиназами, могут быть облегчены применением по меньшей мере одного белка согласно изобретению. Лечение может быть проведено либо непосредственным воздействием такого белка на заболевший организм, к примеру, в виде химического препарата типа пестицида, фунгицида и так далее, или лекарства, либо введением кодирующей такой белок генетической структурной последовательности в геном организма-хозяина, что обеспечивает экспрессию указанного белка по изобретению таким организмом и приобретение им способности бороться с заболеванием. Так, как описано выше, можно применять любой или несколько белков согласно изобретению. Например, произвольная комбинация таких белков, включающая сайт-направленно модифицированые и/или гибридные белки, может быть применена для противодействия эффектам одной или нескольких протеиназ. В идеале трансформированным организмом является растение. Далее предложен способ повышения устойчивости к протеолитическому повреждению, при котором модифицируют или трансформируют организм-хозяин таким образом, что он экспрессирует белок согласно изобретению. Предложен также конструкт, включающий всю или часть ДНК-последовательности согласно изобретению и могущий быть плазмидой или вектором. Предусмотрено также применение белка или ДНК-последовательности согласно изобретению в качестве лекарственного средства для лечения протеолитических состояний, вызванных патогенами, паразитами или вредителями. Далее, предложена композиция, включающая в себя белок согласно изобретению, эффективная против вызванных патогенами, паразитами или вредителями болезней. Согласно еще одному аспекту изобретения, предложено трансгенное растение, трансформированное ДНК, кодирующей белок по изобретению, и в идеале ДНК, показанной на фиг. 2, сшитой с подходящей промоторной последовательностью так, что возможна экспрессия белка согласно изобретению. В идеале эта экспрессия происходит либо во всем растении, либо в местах воздействия на него патогенов, паразитов или вредителей. Например, в (13) предусмотрены общие методы идентификации промоторов, полученных из мест действия вредителей, паразитов или патогенов в растении. В ином или дополнительном случае экспрессия может быть задана так, чтобы она происходила в нужный момент времени. Предпочтительно указанными трансформированными растениями являются зерновые, овощные, масличные, сахароносные культуры, фуражные или газонные травы, волокнистые, пряные, фруктовые и любые декоративные растения. Далее, предложен трансформированный организм, растение или иной организм, который включает в себя кодирующую белок согласно изобретению ДНК, а в идеале - ДНК, показанную на фиг.2, так что указанный белок может быть получен с целью обеспечения его источников. Предпочтительно, когда указанный конструкт снабжен подходящими промоторами, гарантирующими экспрессию белка согласно изобретению. Предложен также способ борьбы с патогеном, паразитом и вредителем, при котором на указанного патогена, паразита или вредителя воздействуют белком согласно изобретению. Далее, предложено применение белка согласно изобретению для борьбы с патогеном, паразитом или вредителем. Предусмотрен также один или большее число праймеров, представленных в таблице 2, или праймеров сходной природы, имеющих в себе добавки, делеции или модификации, которые все же дают этим праймерам возможность функционировать так как описано выше. Модифицированные ингибиторы протеиназ согласно изобретению могут также включать новые комбинации ингибиторов протеиназ, происходящих из того же самого или другого царства, типа, класса, отряда, семейства, рода или вида. Например, фрагмент(ы) ингибитора протеиназы животного происхождения могут быть объединены с фрагментом(ами) ингибитора протеиназы растительного происхождения, по меньшей мере один, несколько или все из которых могут быть или не быть модифицированы для повышения эффективности, как описано выше. Иначе говоря, возможно как получение новых растительных ингибиторов протеиназ комбинированием различных сортов и типов растительных ингибиторов протеиназ, так и получение новых ингибиторов протеиназ комбинированием разных сортов и типов животных ингибиторов протеиназ, по меньшей мере один, несколько или все из которых могут быть или не быть модифицированы для повышения эффективности, как описано выше. Далее, согласно изобретению предложен белок и/или ДНК-последовательность, содержащие первую часть из первого ингибитора протеиназы и по меньшей мере одну другую часть из по меньшей мере одного другого ингибитора протеиназы. В предпочтительном воплощении изобретения ДНК-последовательность предусмотрена в таком конструкте, что соответствующий белок может продуцироваться в ткани-мишени, например в клеточных тканях хозяина. Согласно еще одному аспекту изобретения предложена ткань-мишень или клеточная ткань хозяина, трансформированная ДНК-последовательностью согласно еще одному аспекту изобретения. Кроме того, согласно изобретению предложен белок, содержащий первую часть из первого цистатина и по меньшей мере одну другую часть из по меньшей мере одного другого цистатина. В предпочтительном воплощении изобретения указанная первая часть указанной ДНК-последовательности или указанного белка содержит ДНК или белок растительного цистатина, соответственно, а указанная по меньшей мере одна другая часть содержит ДНК или белок животного цистатина, соответственно. В идеале указанные ДНК или белок животного происхождения соответствуют ДНК или белку из активного сайта животного цистатина, и, предпочтительно, указанные ДНК или белок, происходящие из растительного цистатина, соответствуют ДНК или белку из структурного сайта или нескольких структурных сайтов указанных растительных цистатинов. В одном из вариантов указанные ДНК-последовательность или белок содержат различные сорта или типы растительных цистатинов. В другом варианте указанные ДНК-последовательность или белок содержат различные сорта или типы животного цистатина. И, наконец, согласно изобретению предложены белок и/или ДНК-последовательность, относящиеся к новому ингибитору протеиназы, включающие вышеупомянутый гибридный ингибитор протеиназы и вышеупомянутую сайт-направленную модификацию. Все ингибиторы протеиназ согласно изобретению применимы для противодействия эффектам протеиназ и для использования в способах такого противодействия. Таким образом, в широком плане суть изобретения состоит в создании белков с повышенной функциональной активностью. Сайт-направленные модификации состоят в замене области последовательности аминокислот либо соответствующей областью белка (из любого организма), который проявляет нужные свойства, либо задуманной синтетической последовательностью. Аминокислотный остов исходного белка идеально сохраняется в полученной гибридной молекуле. Сущность изобретения далее поясняется примерами со ссылками на приложенные графические материалы, где: На фиг. 1 представлен сравнительный анализ первичных структур последовательностей нескольких цистатинов; На фиг.2 представлена ДНК-последовательность нового белка согласно изобретению; На фиг. 3 представлена ДНК-последовательность рисового ингибитора цистеиновой протеиназы оризацистатина Ос-I; На фиг.4 представлено влияние экспрессии цистатина на рост самок G.pallida, паразитирующих на А. rhizogenes-трансформированных корнях томатов (размеры тела нематод даны как площади их контура в мкм2, причем а - контроль, б и в - результат экспрессии соответственно Ос-I и Oc-IdeltaD86); На фиг. 5 представлено подавление роста грибов из спор на агаре через 6 суток после добавления 45 мкг PI(s) в центральные лунки; На фиг.6 представлено относительное (в %) ингибирование соответствующих протеиназ под действием различных гибридных ингибиторов протеиназ. В таблице 1 приведены константы диссоциации Ki различных цистатинов как в нативном виде, так и после специфической модификации. В таблице 2 приведены последовательности 23 олигонуклеотидных праймеров (Р1-23), применяемых в ПЦР-реакциях, и два линкера (L1-2), используемых при клонировании. В таблице 2а приведены последовательности праймеров (Р24-39), используемых в ПЦР-реакциях при получении гибридных молекул. В таблице 3 показана природа полученных гибридных молекул. Решетка отображает длину белка Ос-I, а темные зоны представляют области, замененные аминокислотной последовательностью CEWC. Материалы и методы Штаммы и векторы Получение ДНК и операции с нею Плазмидную ДНК выделяли от культур Е-соli методом щелочного лизиса (2). Реакции рестрикции и лигирования провели по рекомендациям производителя. Фрагменты ДНК выделяли из агарозных гелей в ячейке для электроэлюирования (IВI) согласно рекомендациям изготовителя. Олигонуклеотиды синтезировали с помощью установки Applied Biosystems 381 А, дальнейшей очистке с помощью СОР хроматографического картриджа с обращенной фазой (Cruachem. Glasgow, UK) подвергли только олигонуклеотиды, использовавшиеся в протоколах "Altered Sites II" сайт-направленного мутагенеза. ДНК-секвенирование двунитевой плазмидной ДНК проводили с использованием Sequenase version 2,0 (Amersham) согласно инструкции производителя. Клонирование цистатинов и ингибитора протеиназы C.elegans Oc-I был амплифицирован из геномной ДНК Oriza sativa L. japanica с помощью определенных по опубликованным данным о последовательностях (3) праймеров Р1 и Р2 (см. таблицу 2) и с добавлением сайтов ферментативной рестрикции для облегчения клонирования. Интрон удаляли методом ПЦР для SOEing генов (4а и 4б), при котором пары праймеров Р1/Р3 и Р2/Р4 использовали для амплификации двух экзонов. Эти продукты затем совместно подвергли операции SOEn путем амплификации с праймерами Р1 и Р4, а продукт клонировали в pBluescript, подвергнутый Sma I/Eco R1 рестрикции. Последовательность клонированной кодирующей области была подтверждена сравнением с известными данными для Oc-I (3). Амплификацию и удаление интронов гена цистеиновой протеиназы C. elegans, gcp-1, проводили аналогичным образом с использованием определенных по информации о последовательности (5) праймеров Р5-8 (таблица 2). Конечный ПЦР-продукт клонировали в pBluscript и проконтролировали анализом последовательности. Информацию о ДНК-последовательности ингибитора цистеиновой протеиназы из вигны китайской, CCPI (6), использовали для создания олигонуклеотидных праймеров Р9 и Р10 (таблица 2). Эти праймеры вместе с клоном кДНК, несущим ген CCPI (любезно предоставленный проф. П.Шеври), использовали для ПЦР-амплификации продукта, который клонировали непосредственно в экспрессирующий вектор pQE30 (Quigen, California, USA) с использованием введенных в ПЦР-праймеры сайтов по Bam H1 и Hind III. Гены клонировали в экспрессирующие векторы типа IV pQE (Qiagen, California, USA) (Bam HI/Hind III), а белки экспрессировали в штамме F-coli M15[pREP4]. Мутагенез а) N-концевые делеции Для получения обширной делеции размером 72 п.н. с 5"-конца Ос-I, обозначенной pdelta240c-I, pQE30/Oc-I подвергали рестрикции с использованием Sma I и Hinc II, крупный фрагмент выделяли из агарозного геля и собирали. Для получения делеции 63 п.н. (обозначаемой pdelta21Оc-I) pQE30/Oc-I подвергали рестрикции, используя Bam HI и Hinc II, и выделяли из геля. Область 9 п.н., расположенную непосредственно на 5" относительно сайта Hinc II, вместе с последовательностью, кодирующей сайт узнавания энтерокиназы, вводили путем лигирования подвергнутых отжигу олигонуклеотидных линкеров L1 и L2 с выделенным фрагментом. б) С-концевые делеции Осуществляли делеции экзонуклеаза III/нуклеаза фасоли золотистой (2) для получения делеции размером 24, 27, 30 и 33 п.н. на 3"-конце гена. в) Точечные мутации Для создания конструктов, экспрессирующих перестройки единичных кодонов, использовали стратегию "Элиминация уникальных сайтов" ("Unique Site Elimination" (USE)) (Farmacia, Upsalla, Sweden) с применением праймеров P11-P20 (таблица 2), получая в результате вариантные формы Ос-I, имеющие следующие изменения аминокислотного состава: а) вставка лейцина между положениями 81 и 82; б) делеция Е13, D86, А74, М85, в) замена (с, , на): D86N, E89L, Q91L, Р83А, W84A. Систему "Altered Sites II" (Promega, Madison, USA), включающую субклонирование Oc-I в вектор pALT-Ex2, (Promega, Madison, USA) использовали для создания мутантов, в которых кодоны для Р83, W84, D86 были заменены на терминирующий амбер-кодон (TAG). Для этого использовали олигонуклеотиды Р-21-Р23 согласно таблице 2, где терминирующие амбер-кодоны выделены жирным шрифтом, а точечная мутация для удаления сайта Sac I (GAGCTC) обозначена обычным шрифтом (эти изменения не меняют аминокислотную последовательность). Отсутствие сайта Sac I используют как диагностический тест для мутанта. Метод "Interchange" (Promega, Madison, USA) применяли для получения аминокислотных замен на цистеин, глутаминовую кислоту, фенилаланин, глицин, гистидин, пролин, аргинин, лизин, глутамин, серин и тирозин по терминирующему амбер-кодону введением мутантных клонов в 12 определенных штаммов амбер-супрессоров. Экспрессия Ос-I и дср-1 в E.coli Кодируемый вектором Ос-I, экспрессированный из pQE30 (система "QIAexpression"), для придания способности к образованию одноступенчатых хелатов с никелем содержал шесть N-концевых остатков гистидина. Белок Ос-I был выделен и очищен из 11 культур E.coli M15 [pREP4], содержащих экспрессирующую плазмиду на основе pQE30. 20 мл ночной культуры инокулировали в 1 литр LB-среды и выращивали при 37oС до А600, равного 0,7-0,9. Затем добавили изопропилтиогалактозид (IPTG) до конечной концентрации 2 мМ, и рост культуры продолжался в течение еще 2 часов. Клетки отделили центрифугированием при 10000 g в течение 10 мин, ресуспендировали в 12 мл буфера для обработки ультразвуком (50 мМ Na2HPO4, 300 мМ NaCl) и выдержали в течение ночи при -20oС. Образец взболтали, отобрали аликвоты в три 15 мл пробирки и при охлаждении льдом подвергли короткопериодной ультразвуковой обработке (3х30 с). Клеточный дебрис осадили центрифугированием (10000 g), в каждую пробирку внесли примерно по 0,5-0,75 мл суспензии смолы Ni-NTA (Qiagen, Califonia, USA) и осторожно перемешали на льду в течение часа. Смолу отделили (1000 g в течение 1 минуты) и промыли 5 раз по 5 мл буфера (50 мМ Na2HPO4 с рН 6,0, 500 мМ NaCl, 40 мМ имидазола при 4oС в течение получаса). Белок элюировали 1 мл буфера для элюции (50 мМ Na2HPO4, 300 мМ NaCl, 100 мМ EDTA) и затем смолу переосадили при 1000 g в течение 1 минуты, после чего элюирование провели еще дважды. Протеиназу glp-1 из C.elegans экспрессировали идентичным образом. Delta21Оc-I содержал последовательность узнавания энтерокиназы (Asp-Asp-Asp-Asp-Lys) между шестью N-концевыми гистидинами (6х His-хвост) и N-концевым остатком усеченного Ос-I белка. Энтерокиназу (Boeringer) использовали для отсечения 6х His-хвоста от Delta21Оc-I, который был очищен от 6х His-хвоста посредством хроматографии по сродству к никелю. "Centricon 10s"" (Amicon) использовали согласно инструкциям для отделения Ос-I от примесей энтерокиназы. Определение Ki Для определения Ki цистатинов осуществляли биохимические анализы согласно процедуре Barrett (7), величины Ki рассчитывали, как описано Abe et al. (3). ДДС-ПААГ и вестерн-блоттинг анализ Все очищенные белки проанализировали с помощью ДДС-ПААГ (электрофорез в полиакриламидном геле с додецилсульфатом натрия) (8). Вестерн-блоттинг проводили согласно протоколу для "mini protein II"" (Biorad, Hertfordshire, UK), применяя PVDF-мембрану (Millipore, Massachusetts, USA). Получение антител Поликлональные антитела против Oc-I были наработаны в самцах крыс Wistar (возраст 6 недель). Три внутрибрюшинные инъекции 100 мкг Oc-I общим объемом 300 мл выполнили с интервалами четыре недели. При первой инъекции вводили эмульсию белка с полным адъювантом Фрейнда в соотношении 1:1 по объему, вторая и третья инъекции были аналогичными, но использовали неполный адъювант Фрейнда. Спустя 10 суток после последней инъекции собрали кровь, скоагулировали ее при 4oС и центрифугировали при 5000 g в течение 10 минут. Полученную сыворотку собрали и хранили в 50%-ном (по объему) глицерине при -70oС. Сыворотка дает оптимальные результаты в ELISA-тесте при разведении 1/10000 и распознает как нативный, так и денатурированный белок Oc-I. ELISA-тесты Тесты ELISA (твердофазный иммуноферментный анализ) применили для определения уровня экспрессии цистатинов в трансгенных корнях, примерно двухмиллиметровые сегменты которых измельчили в жидком азоте, перенесли в Falcon-пробирку объемом 15 мл, добавили 1 мл 0,5хЗФР (забуференный фосфатом физиологический раствор) и встряхивали при 4oС в течение 15 минут для растворения растворимой белковой фракции. Затем белок осадили ацетоном и осадок ресуспендировали в буфере для сенсибилизации поверхности (15 мМ Na2HPO4, 34 мМ МаНСО3, рН 9,6). Концентрацию белка определяли по стандартной методике (14). В лунки титрационного микропланшета Maxisorb внесли по 100 мг белка на 48 часов при 4oС. Планшеты блокировали антителами против Ос-I (разведение 1/10000). Активность определяли добавлением субстрата, поглощение образцов измеряли при 405 нм после развития окраски. Различные количества Ос-I добавили к аликвотам по 100 мг общего белка, экстрагированного из нетрансформированных корней, и вместе с неизвестными образцами использовали в анализах ELISA для создания внутренних стандартов в пределах 0-2% Oc-I в общем растворимом белке. Культивирование C.elegans Caenorhaboditis elegans культивировали на NGM-агаре с газоном клеток Е. coli OP50, как описано Wood (9). Популяции выдерживали в течение 5 суток до переноса агарового слоя в свежую среду. При необходимости цистатины добавляли в среду в конечной концентрации 2,5 мг/л непосредственно перед полимеризацией. Отдельные нематоды были перенесены с не содержащих добавок агаровых чашек на чашки, содержащие Oc-I, DeltaD86Оc-I или БСА (бычий сывороточный альбумин). При необходимости для каждого вида обработки проводили десять повторений. Культивирование трансгенных корней томатов Гены, происходящие из Oc-I, клонировали в вектор рВ1М19 и затем электротрансформацией ввели в Agrobacterium rhizogenes штамм LBA9402 для использования в трансформации Licopersicon esculentum сорт Ailsa Craig no стандартной методике (15). Затем в ходе предварительного отбора корни культивировали на твердой среде с основной смесью солей 0,5х Murashige & Skoog с добавкой Gamborgs B5 витаминов, 3% (масс./о) сахарозы, 0,2% фитагеля (масс. /о), 100 мг/л канамицина. Для подтверждения присутствия Ос-I или его мутантных форм в предположительно трансформированных корнях использовали вестерн-блоттинг. Контрольное заражение корней с помощью Globodera pallida Из цист G.pallida были получены J2, которые были тщательно простерилизованы перед использованием. Цисты вымачивали в проточной водопроводной воде в течение 2-3 дней, затем в течение ночи в 0,1%-ном (о/о) растворе малахитового зеленого при комнатной температуре, промывали проточной водопроводной водой в течение 8 часов и вымачивали в течение ночи при 4oС в растворе антибиотиков (8 мг/мл сульфата стрептомицина, 6 мг/мл пенициллина G, 6,13 мг/мл полимицина В, 5 мг/мл тетрациклина и 1 мг/мл амфотерицина В). Далее цисты промывали стерилизованной фильтрованием водопроводной водой и помещали в стерилизованный фильтрованием диффузат корней картофеля для дальнейшего развития. По истечении ночи выводок J 12 был подсчитан и простерилизован последовательно в течение 10 минут следующими антибиотиками: 0,1%-ным сульфатом стрептомицина, 0,1%-ным пенициллином G, 0,1%-ным амфотерицином В и 0,1%-ным цетилтриметиламмонийбромидом (Cetavlon). Между стадиями обработки нематоды отделяли непродолжительным микроцентрифугированием. Их интенсивно промывали в стерилизованной фильтрованием водопроводной воде и немедленно использовали. Корни трансформированных линий культивировали в течение 4 недель, затем корни длиной 2 см перенесли в свежую среду. Спустя еще 3-4 суток аликвоты по 5 мл, содержащие по 35 J12, были пипетированы на каждый активно растущий корень приблизительно в 1 см от его верхушки. Для облегчения заражения каждый участок покрыли кусочком стерильной фильтровальной бумаги марки GFA площадью 1 см2, который удалили через 24 часа. Собранные инфицированные корни удалили из чашек Петри, промыли водой и погрузили на 2 минуты в 1%-ный (масс./о) раствор гипохлорита натрия и сразу же после этого на 1 минуту корни погрузили в кипящий 0,1%-ный водный кислый фуксин, промыли водой и выдержали в течение ночи в подкисленном глицерине при 60oС для облегчения визуализации нематод. Через некоторое время их можно было обнаружить визуально без окрашивания и вырезать из корней. Нематод определяли под микроскопом (DBRM, Leica) при увеличении 50-200х, площадь поперечных срезов измеряли с использованием присоединенного к микроскопу анализатора изображения (Quantimet 5000C, Leica). Демонстрация антигрибной активности Авторы показали, что Pls (ингибиторы протеиназ), выделенные после экспрессии в pQE30 (смотри выше), проявляют антигрибную активность. 45 мкг выделенного РI в концентрации 1 мкг/мкл ввели в центральную лунку на агаровых пластинках, содержащих споры B.cinerea (2,2 10-9 М считается ее улучшением. В соответствии со вторым аспектом изобретения предложен ингибитор протеиназы с сайт-направленной делецией и/или заменой по меньшей мере одной аминокислоты с понижением KL белка минимум в 10 раз. Предпочтительно белок является цистатином, а сайт-направленная делеция или замена относится к делеции аспарагиновой кислоты в положении 86 структуры аминокислотной последовательности Ос-I, либо альтернативно, делеции аспарагиновой кислоты в положении 163 в приведенной на фиг.1 структуре выравненных аминокислотных последовательностей выравненного ингибитора протеиназы такого как цистатин, либо альтернативно, к делеции ее функционального аналога в родственных ингибиторах протеиназы или цистатинах. В другом случае сайт-направленная модификация состоит в замене указанной аспарагиновой кислоты в указанном положении на другую аминокислоту, свойства которой противоположны функциональным свойствам исключаемой аспарагиновой кислоты. Соответственно третьему аспекту изобретения предложена вся структура ДНК-последовательности, представленная на фиг.2, или ее часть, которая кодирует белок согласно первому аспекту изобретения. Все белки согласно изобретению или соответствующие им ДНК-последовательности применяют в борьбе с заболеваниями, симптомы которых хотя бы частично обусловлены или заключаются в продуцировании протеиназы. Поэтому новые белки и соответствующие им ДНК-последовательности могут быть прямо или косвенно применены для предотвращения, облегчения или ослабления таких болезненных состояний. Например, поражения организма-хозяина, вызванные патогенами, вредителями или паразитами и обусловленные разложением белков протеиназами, могут быть облегчены применением по меньшей мере одного белка согласно изобретению. Лечение может быть проведено либо непосредственным воздействием такого белка на заболевший организм, к примеру, в виде химического препарата типа пестицида, фунгицида и так далее, или лекарства, либо введением кодирующей такой белок генетической структурной последовательности в геном организма-хозяина, что обеспечивает экспрессию указанного белка по изобретению таким организмом и приобретение им способности бороться с заболеванием. Так, как описано выше, можно применять любой или несколько белков согласно изобретению. Например, произвольная комбинация таких белков, включающая сайт-направленно модифицированые и/или гибридные белки, может быть применена для противодействия эффектам одной или нескольких протеиназ. В идеале трансформированным организмом является растение. Далее предложен способ повышения устойчивости к протеолитическому повреждению, при котором модифицируют или трансформируют организм-хозяин таким образом, что он экспрессирует белок согласно изобретению. Предложен также конструкт, включающий всю или часть ДНК-последовательности согласно изобретению и могущий быть плазмидой или вектором. Предусмотрено также применение белка или ДНК-последовательности согласно изобретению в качестве лекарственного средства для лечения протеолитических состояний, вызванных патогенами, паразитами или вредителями. Далее, предложена композиция, включающая в себя белок согласно изобретению, эффективная против вызванных патогенами, паразитами или вредителями болезней. Согласно еще одному аспекту изобретения, предложено трансгенное растение, трансформированное ДНК, кодирующей белок по изобретению, и в идеале ДНК, показанной на фиг. 2, сшитой с подходящей промоторной последовательностью так, что возможна экспрессия белка согласно изобретению. В идеале эта экспрессия происходит либо во всем растении, либо в местах воздействия на него патогенов, паразитов или вредителей. Например, в (13) предусмотрены общие методы идентификации промоторов, полученных из мест действия вредителей, паразитов или патогенов в растении. В ином или дополнительном случае экспрессия может быть задана так, чтобы она происходила в нужный момент времени. Предпочтительно указанными трансформированными растениями являются зерновые, овощные, масличные, сахароносные культуры, фуражные или газонные травы, волокнистые, пряные, фруктовые и любые декоративные растения. Далее, предложен трансформированный организм, растение или иной организм, который включает в себя кодирующую белок согласно изобретению ДНК, а в идеале - ДНК, показанную на фиг.2, так что указанный белок может быть получен с целью обеспечения его источников. Предпочтительно, когда указанный конструкт снабжен подходящими промоторами, гарантирующими экспрессию белка согласно изобретению. Предложен также способ борьбы с патогеном, паразитом и вредителем, при котором на указанного патогена, паразита или вредителя воздействуют белком согласно изобретению. Далее, предложено применение белка согласно изобретению для борьбы с патогеном, паразитом или вредителем. Предусмотрен также один или большее число праймеров, представленных в таблице 2, или праймеров сходной природы, имеющих в себе добавки, делеции или модификации, которые все же дают этим праймерам возможность функционировать так как описано выше. Модифицированные ингибиторы протеиназ согласно изобретению могут также включать новые комбинации ингибиторов протеиназ, происходящих из того же самого или другого царства, типа, класса, отряда, семейства, рода или вида. Например, фрагмент(ы) ингибитора протеиназы животного происхождения могут быть объединены с фрагментом(ами) ингибитора протеиназы растительного происхождения, по меньшей мере один, несколько или все из которых могут быть или не быть модифицированы для повышения эффективности, как описано выше. Иначе говоря, возможно как получение новых растительных ингибиторов протеиназ комбинированием различных сортов и типов растительных ингибиторов протеиназ, так и получение новых ингибиторов протеиназ комбинированием разных сортов и типов животных ингибиторов протеиназ, по меньшей мере один, несколько или все из которых могут быть или не быть модифицированы для повышения эффективности, как описано выше. Далее, согласно изобретению предложен белок и/или ДНК-последовательность, содержащие первую часть из первого ингибитора протеиназы и по меньшей мере одну другую часть из по меньшей мере одного другого ингибитора протеиназы. В предпочтительном воплощении изобретения ДНК-последовательность предусмотрена в таком конструкте, что соответствующий белок может продуцироваться в ткани-мишени, например в клеточных тканях хозяина. Согласно еще одному аспекту изобретения предложена ткань-мишень или клеточная ткань хозяина, трансформированная ДНК-последовательностью согласно еще одному аспекту изобретения. Кроме того, согласно изобретению предложен белок, содержащий первую часть из первого цистатина и по меньшей мере одну другую часть из по меньшей мере одного другого цистатина. В предпочтительном воплощении изобретения указанная первая часть указанной ДНК-последовательности или указанного белка содержит ДНК или белок растительного цистатина, соответственно, а указанная по меньшей мере одна другая часть содержит ДНК или белок животного цистатина, соответственно. В идеале указанные ДНК или белок животного происхождения соответствуют ДНК или белку из активного сайта животного цистатина, и, предпочтительно, указанные ДНК или белок, происходящие из растительного цистатина, соответствуют ДНК или белку из структурного сайта или нескольких структурных сайтов указанных растительных цистатинов. В одном из вариантов указанные ДНК-последовательность или белок содержат различные сорта или типы растительных цистатинов. В другом варианте указанные ДНК-последовательность или белок содержат различные сорта или типы животного цистатина. И, наконец, согласно изобретению предложены белок и/или ДНК-последовательность, относящиеся к новому ингибитору протеиназы, включающие вышеупомянутый гибридный ингибитор протеиназы и вышеупомянутую сайт-направленную модификацию. Все ингибиторы протеиназ согласно изобретению применимы для противодействия эффектам протеиназ и для использования в способах такого противодействия. Таким образом, в широком плане суть изобретения состоит в создании белков с повышенной функциональной активностью. Сайт-направленные модификации состоят в замене области последовательности аминокислот либо соответствующей областью белка (из любого организма), который проявляет нужные свойства, либо задуманной синтетической последовательностью. Аминокислотный остов исходного белка идеально сохраняется в полученной гибридной молекуле. Сущность изобретения далее поясняется примерами со ссылками на приложенные графические материалы, где: На фиг. 1 представлен сравнительный анализ первичных структур последовательностей нескольких цистатинов; На фиг.2 представлена ДНК-последовательность нового белка согласно изобретению; На фиг. 3 представлена ДНК-последовательность рисового ингибитора цистеиновой протеиназы оризацистатина Ос-I; На фиг.4 представлено влияние экспрессии цистатина на рост самок G.pallida, паразитирующих на А. rhizogenes-трансформированных корнях томатов (размеры тела нематод даны как площади их контура в мкм2, причем а - контроль, б и в - результат экспрессии соответственно Ос-I и Oc-IdeltaD86); На фиг. 5 представлено подавление роста грибов из спор на агаре через 6 суток после добавления 45 мкг PI(s) в центральные лунки; На фиг.6 представлено относительное (в %) ингибирование соответствующих протеиназ под действием различных гибридных ингибиторов протеиназ. В таблице 1 приведены константы диссоциации Ki различных цистатинов как в нативном виде, так и после специфической модификации. В таблице 2 приведены последовательности 23 олигонуклеотидных праймеров (Р1-23), применяемых в ПЦР-реакциях, и два линкера (L1-2), используемых при клонировании. В таблице 2а приведены последовательности праймеров (Р24-39), используемых в ПЦР-реакциях при получении гибридных молекул. В таблице 3 показана природа полученных гибридных молекул. Решетка отображает длину белка Ос-I, а темные зоны представляют области, замененные аминокислотной последовательностью CEWC. Материалы и методы Штаммы и векторы Получение ДНК и операции с нею Плазмидную ДНК выделяли от культур Е-соli методом щелочного лизиса (2). Реакции рестрикции и лигирования провели по рекомендациям производителя. Фрагменты ДНК выделяли из агарозных гелей в ячейке для электроэлюирования (IВI) согласно рекомендациям изготовителя. Олигонуклеотиды синтезировали с помощью установки Applied Biosystems 381 А, дальнейшей очистке с помощью СОР хроматографического картриджа с обращенной фазой (Cruachem. Glasgow, UK) подвергли только олигонуклеотиды, использовавшиеся в протоколах "Altered Sites II" сайт-направленного мутагенеза. ДНК-секвенирование двунитевой плазмидной ДНК проводили с использованием Sequenase version 2,0 (Amersham) согласно инструкции производителя. Клонирование цистатинов и ингибитора протеиназы C.elegans Oc-I был амплифицирован из геномной ДНК Oriza sativa L. japanica с помощью определенных по опубликованным данным о последовательностях (3) праймеров Р1 и Р2 (см. таблицу 2) и с добавлением сайтов ферментативной рестрикции для облегчения клонирования. Интрон удаляли методом ПЦР для SOEing генов (4а и 4б), при котором пары праймеров Р1/Р3 и Р2/Р4 использовали для амплификации двух экзонов. Эти продукты затем совместно подвергли операции SOEn путем амплификации с праймерами Р1 и Р4, а продукт клонировали в pBluescript, подвергнутый Sma I/Eco R1 рестрикции. Последовательность клонированной кодирующей области была подтверждена сравнением с известными данными для Oc-I (3). Амплификацию и удаление интронов гена цистеиновой протеиназы C. elegans, gcp-1, проводили аналогичным образом с использованием определенных по информации о последовательности (5) праймеров Р5-8 (таблица 2). Конечный ПЦР-продукт клонировали в pBluscript и проконтролировали анализом последовательности. Информацию о ДНК-последовательности ингибитора цистеиновой протеиназы из вигны китайской, CCPI (6), использовали для создания олигонуклеотидных праймеров Р9 и Р10 (таблица 2). Эти праймеры вместе с клоном кДНК, несущим ген CCPI (любезно предоставленный проф. П.Шеври), использовали для ПЦР-амплификации продукта, который клонировали непосредственно в экспрессирующий вектор pQE30 (Quigen, California, USA) с использованием введенных в ПЦР-праймеры сайтов по Bam H1 и Hind III. Гены клонировали в экспрессирующие векторы типа IV pQE (Qiagen, California, USA) (Bam HI/Hind III), а белки экспрессировали в штамме F-coli M15[pREP4]. Мутагенез а) N-концевые делеции Для получения обширной делеции размером 72 п.н. с 5"-конца Ос-I, обозначенной pdelta240c-I, pQE30/Oc-I подвергали рестрикции с использованием Sma I и Hinc II, крупный фрагмент выделяли из агарозного геля и собирали. Для получения делеции 63 п.н. (обозначаемой pdelta21Оc-I) pQE30/Oc-I подвергали рестрикции, используя Bam HI и Hinc II, и выделяли из геля. Область 9 п.н., расположенную непосредственно на 5" относительно сайта Hinc II, вместе с последовательностью, кодирующей сайт узнавания энтерокиназы, вводили путем лигирования подвергнутых отжигу олигонуклеотидных линкеров L1 и L2 с выделенным фрагментом. б) С-концевые делеции Осуществляли делеции экзонуклеаза III/нуклеаза фасоли золотистой (2) для получения делеции размером 24, 27, 30 и 33 п.н. на 3"-конце гена. в) Точечные мутации Для создания конструктов, экспрессирующих перестройки единичных кодонов, использовали стратегию "Элиминация уникальных сайтов" ("Unique Site Elimination" (USE)) (Farmacia, Upsalla, Sweden) с применением праймеров P11-P20 (таблица 2), получая в результате вариантные формы Ос-I, имеющие следующие изменения аминокислотного состава: а) вставка лейцина между положениями 81 и 82; б) делеция Е13, D86, А74, М85, в) замена (с, , на): D86N, E89L, Q91L, Р83А, W84A. Систему "Altered Sites II" (Promega, Madison, USA), включающую субклонирование Oc-I в вектор pALT-Ex2, (Promega, Madison, USA) использовали для создания мутантов, в которых кодоны для Р83, W84, D86 были заменены на терминирующий амбер-кодон (TAG). Для этого использовали олигонуклеотиды Р-21-Р23 согласно таблице 2, где терминирующие амбер-кодоны выделены жирным шрифтом, а точечная мутация для удаления сайта Sac I (GAGCTC) обозначена обычным шрифтом (эти изменения не меняют аминокислотную последовательность). Отсутствие сайта Sac I используют как диагностический тест для мутанта. Метод "Interchange" (Promega, Madison, USA) применяли для получения аминокислотных замен на цистеин, глутаминовую кислоту, фенилаланин, глицин, гистидин, пролин, аргинин, лизин, глутамин, серин и тирозин по терминирующему амбер-кодону введением мутантных клонов в 12 определенных штаммов амбер-супрессоров. Экспрессия Ос-I и дср-1 в E.coli Кодируемый вектором Ос-I, экспрессированный из pQE30 (система "QIAexpression"), для придания способности к образованию одноступенчатых хелатов с никелем содержал шесть N-концевых остатков гистидина. Белок Ос-I был выделен и очищен из 11 культур E.coli M15 [pREP4], содержащих экспрессирующую плазмиду на основе pQE30. 20 мл ночной культуры инокулировали в 1 литр LB-среды и выращивали при 37oС до А600, равного 0,7-0,9. Затем добавили изопропилтиогалактозид (IPTG) до конечной концентрации 2 мМ, и рост культуры продолжался в течение еще 2 часов. Клетки отделили центрифугированием при 10000 g в течение 10 мин, ресуспендировали в 12 мл буфера для обработки ультразвуком (50 мМ Na2HPO4, 300 мМ NaCl) и выдержали в течение ночи при -20oС. Образец взболтали, отобрали аликвоты в три 15 мл пробирки и при охлаждении льдом подвергли короткопериодной ультразвуковой обработке (3х30 с). Клеточный дебрис осадили центрифугированием (10000 g), в каждую пробирку внесли примерно по 0,5-0,75 мл суспензии смолы Ni-NTA (Qiagen, Califonia, USA) и осторожно перемешали на льду в течение часа. Смолу отделили (1000 g в течение 1 минуты) и промыли 5 раз по 5 мл буфера (50 мМ Na2HPO4 с рН 6,0, 500 мМ NaCl, 40 мМ имидазола при 4oС в течение получаса). Белок элюировали 1 мл буфера для элюции (50 мМ Na2HPO4, 300 мМ NaCl, 100 мМ EDTA) и затем смолу переосадили при 1000 g в течение 1 минуты, после чего элюирование провели еще дважды. Протеиназу glp-1 из C.elegans экспрессировали идентичным образом. Delta21Оc-I содержал последовательность узнавания энтерокиназы (Asp-Asp-Asp-Asp-Lys) между шестью N-концевыми гистидинами (6х His-хвост) и N-концевым остатком усеченного Ос-I белка. Энтерокиназу (Boeringer) использовали для отсечения 6х His-хвоста от Delta21Оc-I, который был очищен от 6х His-хвоста посредством хроматографии по сродству к никелю. "Centricon 10s"" (Amicon) использовали согласно инструкциям для отделения Ос-I от примесей энтерокиназы. Определение Ki Для определения Ki цистатинов осуществляли биохимические анализы согласно процедуре Barrett (7), величины Ki рассчитывали, как описано Abe et al. (3). ДДС-ПААГ и вестерн-блоттинг анализ Все очищенные белки проанализировали с помощью ДДС-ПААГ (электрофорез в полиакриламидном геле с додецилсульфатом натрия) (8). Вестерн-блоттинг проводили согласно протоколу для "mini protein II"" (Biorad, Hertfordshire, UK), применяя PVDF-мембрану (Millipore, Massachusetts, USA). Получение антител Поликлональные антитела против Oc-I были наработаны в самцах крыс Wistar (возраст 6 недель). Три внутрибрюшинные инъекции 100 мкг Oc-I общим объемом 300 мл выполнили с интервалами четыре недели. При первой инъекции вводили эмульсию белка с полным адъювантом Фрейнда в соотношении 1:1 по объему, вторая и третья инъекции были аналогичными, но использовали неполный адъювант Фрейнда. Спустя 10 суток после последней инъекции собрали кровь, скоагулировали ее при 4oС и центрифугировали при 5000 g в течение 10 минут. Полученную сыворотку собрали и хранили в 50%-ном (по объему) глицерине при -70oС. Сыворотка дает оптимальные результаты в ELISA-тесте при разведении 1/10000 и распознает как нативный, так и денатурированный белок Oc-I. ELISA-тесты Тесты ELISA (твердофазный иммуноферментный анализ) применили для определения уровня экспрессии цистатинов в трансгенных корнях, примерно двухмиллиметровые сегменты которых измельчили в жидком азоте, перенесли в Falcon-пробирку объемом 15 мл, добавили 1 мл 0,5хЗФР (забуференный фосфатом физиологический раствор) и встряхивали при 4oС в течение 15 минут для растворения растворимой белковой фракции. Затем белок осадили ацетоном и осадок ресуспендировали в буфере для сенсибилизации поверхности (15 мМ Na2HPO4, 34 мМ МаНСО3, рН 9,6). Концентрацию белка определяли по стандартной методике (14). В лунки титрационного микропланшета Maxisorb внесли по 100 мг белка на 48 часов при 4oС. Планшеты блокировали антителами против Ос-I (разведение 1/10000). Активность определяли добавлением субстрата, поглощение образцов измеряли при 405 нм после развития окраски. Различные количества Ос-I добавили к аликвотам по 100 мг общего белка, экстрагированного из нетрансформированных корней, и вместе с неизвестными образцами использовали в анализах ELISA для создания внутренних стандартов в пределах 0-2% Oc-I в общем растворимом белке. Культивирование C.elegans Caenorhaboditis elegans культивировали на NGM-агаре с газоном клеток Е. coli OP50, как описано Wood (9). Популяции выдерживали в течение 5 суток до переноса агарового слоя в свежую среду. При необходимости цистатины добавляли в среду в конечной концентрации 2,5 мг/л непосредственно перед полимеризацией. Отдельные нематоды были перенесены с не содержащих добавок агаровых чашек на чашки, содержащие Oc-I, DeltaD86Оc-I или БСА (бычий сывороточный альбумин). При необходимости для каждого вида обработки проводили десять повторений. Культивирование трансгенных корней томатов Гены, происходящие из Oc-I, клонировали в вектор рВ1М19 и затем электротрансформацией ввели в Agrobacterium rhizogenes штамм LBA9402 для использования в трансформации Licopersicon esculentum сорт Ailsa Craig no стандартной методике (15). Затем в ходе предварительного отбора корни культивировали на твердой среде с основной смесью солей 0,5х Murashige & Skoog с добавкой Gamborgs B5 витаминов, 3% (масс./о) сахарозы, 0,2% фитагеля (масс. /о), 100 мг/л канамицина. Для подтверждения присутствия Ос-I или его мутантных форм в предположительно трансформированных корнях использовали вестерн-блоттинг. Контрольное заражение корней с помощью Globodera pallida Из цист G.pallida были получены J2, которые были тщательно простерилизованы перед использованием. Цисты вымачивали в проточной водопроводной воде в течение 2-3 дней, затем в течение ночи в 0,1%-ном (о/о) растворе малахитового зеленого при комнатной температуре, промывали проточной водопроводной водой в течение 8 часов и вымачивали в течение ночи при 4oС в растворе антибиотиков (8 мг/мл сульфата стрептомицина, 6 мг/мл пенициллина G, 6,13 мг/мл полимицина В, 5 мг/мл тетрациклина и 1 мг/мл амфотерицина В). Далее цисты промывали стерилизованной фильтрованием водопроводной водой и помещали в стерилизованный фильтрованием диффузат корней картофеля для дальнейшего развития. По истечении ночи выводок J 12 был подсчитан и простерилизован последовательно в течение 10 минут следующими антибиотиками: 0,1%-ным сульфатом стрептомицина, 0,1%-ным пенициллином G, 0,1%-ным амфотерицином В и 0,1%-ным цетилтриметиламмонийбромидом (Cetavlon). Между стадиями обработки нематоды отделяли непродолжительным микроцентрифугированием. Их интенсивно промывали в стерилизованной фильтрованием водопроводной воде и немедленно использовали. Корни трансформированных линий культивировали в течение 4 недель, затем корни длиной 2 см перенесли в свежую среду. Спустя еще 3-4 суток аликвоты по 5 мл, содержащие по 35 J12, были пипетированы на каждый активно растущий корень приблизительно в 1 см от его верхушки. Для облегчения заражения каждый участок покрыли кусочком стерильной фильтровальной бумаги марки GFA площадью 1 см2, который удалили через 24 часа. Собранные инфицированные корни удалили из чашек Петри, промыли водой и погрузили на 2 минуты в 1%-ный (масс./о) раствор гипохлорита натрия и сразу же после этого на 1 минуту корни погрузили в кипящий 0,1%-ный водный кислый фуксин, промыли водой и выдержали в течение ночи в подкисленном глицерине при 60oС для облегчения визуализации нематод. Через некоторое время их можно было обнаружить визуально без окрашивания и вырезать из корней. Нематод определяли под микроскопом (DBRM, Leica) при увеличении 50-200х, площадь поперечных срезов измеряли с использованием присоединенного к микроскопу анализатора изображения (Quantimet 5000C, Leica). Демонстрация антигрибной активности Авторы показали, что Pls (ингибиторы протеиназ), выделенные после экспрессии в pQE30 (смотри выше), проявляют антигрибную активность. 45 мкг выделенного РI в концентрации 1 мкг/мкл ввели в центральную лунку на агаровых пластинках, содержащих споры B.cinerea (2,2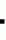 104/пластинку). Споры не прорастали и грибам не удавалось вырасти в тех случаях, когда из центральной лунки в агар диффундировали CPTI или Ос-I. Сильный эффект наблюдали в течение многих недель, при этом он усиливался при совместном применении ингибиторов сериновой и цистеиновой протеиназ. Особенно важно, что Oc-IdeltaD86 был более эффективен, чем нативная форма Ос-I (фиг.3). Также установлено, что Pls эффективны в отношении других микроорганизмов, включая Aspergillus fumigatus (грибной патоген млекопитающих; фиг. 5) и Erwinia carotovora (бактериальный патоген растений). Этим продемонстрированы два главных положения, на которых основана эта заявка: 1) этот подход имеет высокую перспективность в борьбе против самых разнообразных грибов, 2) белковая инженерия может увеличить антигрибную эффективность Pls. Получение гибридных генов Цистатин белка куриного яйца (CEWC) является более мощным ингибитором, чем Ос-I или Ос-ID86. Авторы заменили фрагменты Ос-I соответствующими последовательностями CWEC с целью получить ген по существу растительного происхождения, но со значительно более сильными ингибирующими свойствами. Материалы и методы Замена N-конца ос-I соответствующей областью cewc Были синтезированы два олигонуклеотидных перекрывающихся своими 3"-концами праймера (Р24 и Р25). Их подвергли отжигу и произвели достраивание с помощью ДНК-полимеразы I (фрагмент Кленова) для получения двухцепочечной полноразмерной последовательности, кодирующей N-конец зрелой формы CWEC - SEDRSRLLGAPVPVD (остатки 1-15, нумерация CWEC). Праймеры Р26 и Р27 были использованы для амплификации ос-I, в котором отсутствуют первые 51 п.н. кодирующей последовательности. Затем последовательности ос-I и cewc были соединены с использованием ПЦР-реакции, известной как SOEing (4a и 4б) с получением в результате гибридного гена, обозначаемого oc-nterm 1-15. Замена центрального QVVAG и соседней области ос-I соответствующей областью cewc Была создана вторая гибридная молекула, в которой центральная петля трехчастного клина, содержащего активный сайт Ос-I, была заменена соответствующей частью CWEC. Были синтезированы четыре олигонуклеотида (Р28, Р29, Р30, Р31), которые все вместе кодируют последовательность CEWC -YSSRVVRVISAKRQLVSGIKYILQ (остатки 40-63) Пары праймеров Р28/Р29 и Р30/Р31 были подвергнуты отжигу и обработаны ДНК-полимеразой 1 (фрагмент Кленова) для получения двух двунитевых фрагментов, которые далее были совместно подвергнуты SOEn. Фрагменты ос-I, кодирующие N- и С-концевые области, были амплифицированы с использованием праймеров Р32/Р33 и Р27/Р34. Синтическую последовательность cewc (P28-31) подвергли операции SOEn с N-концевым фрагментом ос-I, который, в свою очередь, был подвергнут той же операции с С-концевым фрагментом ос-I с получением гибридного гена glvsg40-63. Замена С-конца ос-I соответствующей областью cewc Область cewc, кодирующая 20 С-концевых аминокислот, FVVYSIPWLNQIKLLESKCQ (остатки 97-116), был создана с использованием праймеров Р35 и Р36 способом, идентичным вышеописанному способу кодирования N-конца. Праймеры Р32 и Р37 использовали для амплификации ос-I, у которого отсутствуют концевые 51 п.н. кодирующей последовательности. Последовательности ос-I и cewc вместе подвергли операции SOEn для получения гибрида, обозначаемого oc-cterm97-116. Получение гибридов с укороченными последовательностями cewc Для определения того, могут ли укороченные области cewc придавать гибридным цистатинам большую ингибирующую активность в сравнении с нативным Ос-I, были созданы гибридные молекулы, содержащие уменьшенные области CWEC. Подобные гибридные белки могли бы сохранять большую часть аминокислотной последовательности исходной молекулы растительного происхождения. При проведении USE мутагенных реакций использовали два праймера Р38 и Р39 и получили два гибридных гена, обозначаемых oc-glvsg52-60 и oc-pw101-107, которые кодируют соседние cewc остатки RQLVSGIKY (остатки 52-60, критический активный сайт cewc [12] ) и SIPWLNQ (остатки 101-107, важная область С-конца [16]), соответственно. Получение матрицы гибридных молекул Гибридные молекулы, в которых многочисленные участки ос-I были заменены соответствующими последовательностями cewc, были получены с использованием удобно сайтов ферментативной рестрикции в ос-I. Последовательности, кодирующие N-конец нативного ос-I или N-концевого гибридного гена, удалили путем рестрикции с помощью Hinc II. Последовательности, кодирующие С-конец нативного ос-I или С-концевого гибридного гена, удалили путем рестрикции с помощью Fос I. Лигированием фрагмента одного гибридного гена с фрагментом другого были получены дополнительные гибридные молекулы, в которых два или три фрагмента исходного ос-I были заменены фрагментами cewc. Всего было создано 15 гибридных генов (таблица 3). РЕЗУЛЬТАТЫ Моделирование Сравнительный анализ первичных структур белковых последовательностей был произведен с использованием программы SOMAP для сравнения с первичной структурой белковой последовательности, выбранной из базы данных OWL. Начальный сравнительный анализ первичных структур последовательностей цистеиновых протеиназ послужил для демонстрации высокой степени консервативности внутри семейства цистеиновых протеиназ, а также подтвердил, что нецелесообразно использовать папаин в качестве нашей исходной мишени. Был осуществлен второй сравнительный анализ первичных структур 25 ингибиторов цистеиновых протеиназ (фиг.1) с пригодными последовательностями, который послужил для выявления ранее идентифицированных консервативных аминокислот и обеспечил основу для сравнения известных величин Ki ингибиторов цистеиновых протеиназ с особенностями последовательностей. Полученная при этом информация была использована при разработке стратегии мутагенеза. Для структурного моделирования координаты, относящиеся к цистатину белка куриного яйца (10) и комплексу человеческий стефин (stefin) В/папаин (11), были любезно предоставлены проф. Боде (Bode). Их использовали при создании трехмерной модели Ос-I, которую энергетически минимизировали по программе Xplor, чтобы быть уверенными в том, что эта модель имела разумную стереохимию. Клонирующая экспрессия и очистка цистеиновой протеиназы C.elegans Для определения значений Ki против папаина и нематодной протеиназы, цистеиновую протеиназу C. elegans экспрессировали и выделяли из препаратов Е. соli gcр-1, а для определения чистоты анализировали методом ДДС-ПААГ. Экспрессия и мутагенез цистатинов Экспрессированные и выделенные из E.coli цистатины и мутантные варианты белков Ос-I анализировали методом ДДС-ПААГ для определения чистоты. Сравнительный анализ первичной структуры ингибиторов цистеиновых протеиназ (фиг. 1) показывает, что оризацистатин не имеет лидерной последовательности (в отличие от маисовых гомологов) и потому лучше, чтобы он продуцировался внутриклеточно. Определение величин Ki для трех ингибиторов дикого типа, ингибитора из вигны китайской (CCPI), маисового цистатина II и Ос-I, показало, что они близки по ингибирующей активности. В начале работы CCPI не был охарактеризован. Именно поэтому Ос-I и был выбран для мутационного анализа. Предыдущие публикации подтверждают, что усеченная по N-концу форма Ос-I немного активнее нативного белка, однако, хотя эти вариантные Ос-I белки лишены 21 и 24 аминокислот Ос-I, они сохраняют кодируемые векторными последовательностями N-концевые последовательности, которые тем самым могли бы способствовать взаимодействию с протеиназой. Для прояснения этого вопроса были экспрессированы белки с N-концевыми 21 и 24 аминокислотными делециями и с С-концевыми 8, 9, 10, 11 и 12 аминокислотными делециями. Для этих вариантных белковых форм определили Ki, используя папаин или протеиназу C.elegans, gcp-1 (таблица 1). Было установлено, что ни один из укороченных белков не имел более низких значений Ki, чем Ос-I дикого типа, а 21 и 24 аминокислотные делеции не повлияли на активность. Это наводит на мысль, что результаты других исследователей обусловлены влиянием добавленных векторных остатков, содействующих активности. Сравнительный анализ первичной структуры белковых последовательностей и модель Ос-I вместе с опубликованными данными по величинам Ki использовали для идентификации мутаций, которые могли бы улучшить ингибирующие способности Ос-I. Так, независимо были делегированы аминокислоты Е13 и D86. Делеция остатка Е13 не отразилась на Ki Oc-I против папаина и gcp-1, а делеция остатка Delta86 понизило Ki Oc-I примерно в 13 раз: с 7 до 0,5 нМ - для папаина и с 8 до 0,6 нМ - для протеиназы C.elegans, gcp-1 (таблица 1). Для дальнейших исследований мутагенеза была выбрана область ингибитора вокруг D86. В таблице 1 приведены значения Ki для всех дополнительных мутаций, проанализированных против цистеиновой протеиназы C.elegans. Из этих данных ясно, что все мутации с заменой влекут рост значений Ki, что предполагает ослабление активности. Единственной мутацией со сходным или чуть меньшим Ki в сравнении с Ki для Oc-I дикого типа была делеция остатка М85 (с 8 до 7,1 нМ при взаимодействии с gcp-1). Эффективность цистатинов против C.elegans in vivo Для изучения влияния ингибиторов протеиназ на рост нематод провели опыты по откорму с использованием C.elegans. Сразу после того, как двуполые стали заметны на нормальном агаре, их перенесли на отдельные пластинки с Oc-I, Oc-Idelta86, CCPI или БСА (бычий сывороточный альбумин) и наблюдали отложение яиц. Независимо от состава культуральной среды двуполые отложили в среднем примерно по 300 яиц. Половину этих яиц перенесли на нормальные пластинки без ингибиторов. После выхода из яиц наблюдали развитие личинок. В любых условиях их выход составлял не менее 95%, а их развитие завершилось для 94%, 92,5%, 97% и 96% личинок, вылупившихся из яиц, перенесенных с пластинок со средами с добавками соответственно ОС-I, Oc-IdeltaD86, CCPI и БСА. В другом эксперименте вылупившиеся в нормальных условиях личинки перенесли на среды, в которые были добавлены белки, как описано выше. 50 личинок были пересажены через 6, 12, 24 и 30 часов, что соответствует преобладанию стадий развития L1, L2, L3, L4. При этом, когда личинки были перенесены на содержащие Oc-I, Oc-IdeltaD86 или CCPI среды через 6, 12 или 24 часа после выхода из яиц, до взрослого состояния они не развивались. Личинки, переставшие развиваться на содержащих цистатины средах, оставались нежизнеспособными и неспособными выздороветь при перенесении на свежие, не содержащие ингибиторов среды. Они также не двигались и не реагировали на прикосновения и в итоге погибали. Однако, 76% личинок, пересаженных через 30 часов после выхода из яиц, развивались до взрослых самцов или двуполых особей. Все недоразвитые особи, выведенные из яиц, отложенных на среды с БСА и перенесенных на нормальные среды, развивались до взрослых нематод. Влияние цистатина на Globodera pallida in vivo Предыдущие испытания с Oc-I и Oc-IdeltaD86 показали, что поликлональные антитела против обоих Oc-I распознают оба белка одинаково хорошо. Методом ELISA установили, что наивысший уровень экспрессии в линии экспрессирующих Oc-I трансформированных волосатых корней томатов составлял 0,54+0,02% от суммарного растворимого белка. Подобные испытания идентифицировали Oc-IdeltaD86 линию со сходным уровнем экспрессии, равным 0,51+0,01% от фракции суммарного растворимого белка, которая была выбрана для сравнительного анализа. Рост нематод на двух трансгенных цистатиновых линиях и нетрансформированном контроле измеряли для особей, собранных с нескольких корней с примерно недельными интервалами в течение 6 недель. Размеры площади контуров нематод определяли на анализаторе образов. Зависимость средних величин этих значений от времени для трех линий корней представлена на фиг.4. Для сравнения обеих цистатиновых линий с контролем для каждого дня измерений был проделан статистический анализ с использованием одностороннего ANOVA с априорным контрастом (12). Этим анализом была установлена значительно меньшая площадь контуров (Р<0,05) через 1, 2, 4, 5 и 6 недель. Кроме того, никакого заметного увеличения размеров животных на линии Ос-IdeltaD86 между 4 и 6 неделями не происходило (P<0,05; SNK), в отличие от двух других линий. Сравнительные испытания, проведенные как описано Urwin et al. (16), в которых ингибирование посредством CEWC было произвольно принято за 100%, были проведены с первыми семью гибридными молекулами, представленными в таблице 3. Из этих семи только одна, OC-NTERM1-15QVLSG40-63CTERM97-116, содержащая 57 CEWC остатков, показала ингибирование на уровне 90%. Это больше, чем у нативного Ос-I (60%) и у Ос-I 104/пластинку). Споры не прорастали и грибам не удавалось вырасти в тех случаях, когда из центральной лунки в агар диффундировали CPTI или Ос-I. Сильный эффект наблюдали в течение многих недель, при этом он усиливался при совместном применении ингибиторов сериновой и цистеиновой протеиназ. Особенно важно, что Oc-IdeltaD86 был более эффективен, чем нативная форма Ос-I (фиг.3). Также установлено, что Pls эффективны в отношении других микроорганизмов, включая Aspergillus fumigatus (грибной патоген млекопитающих; фиг. 5) и Erwinia carotovora (бактериальный патоген растений). Этим продемонстрированы два главных положения, на которых основана эта заявка: 1) этот подход имеет высокую перспективность в борьбе против самых разнообразных грибов, 2) белковая инженерия может увеличить антигрибную эффективность Pls. Получение гибридных генов Цистатин белка куриного яйца (CEWC) является более мощным ингибитором, чем Ос-I или Ос-ID86. Авторы заменили фрагменты Ос-I соответствующими последовательностями CWEC с целью получить ген по существу растительного происхождения, но со значительно более сильными ингибирующими свойствами. Материалы и методы Замена N-конца ос-I соответствующей областью cewc Были синтезированы два олигонуклеотидных перекрывающихся своими 3"-концами праймера (Р24 и Р25). Их подвергли отжигу и произвели достраивание с помощью ДНК-полимеразы I (фрагмент Кленова) для получения двухцепочечной полноразмерной последовательности, кодирующей N-конец зрелой формы CWEC - SEDRSRLLGAPVPVD (остатки 1-15, нумерация CWEC). Праймеры Р26 и Р27 были использованы для амплификации ос-I, в котором отсутствуют первые 51 п.н. кодирующей последовательности. Затем последовательности ос-I и cewc были соединены с использованием ПЦР-реакции, известной как SOEing (4a и 4б) с получением в результате гибридного гена, обозначаемого oc-nterm 1-15. Замена центрального QVVAG и соседней области ос-I соответствующей областью cewc Была создана вторая гибридная молекула, в которой центральная петля трехчастного клина, содержащего активный сайт Ос-I, была заменена соответствующей частью CWEC. Были синтезированы четыре олигонуклеотида (Р28, Р29, Р30, Р31), которые все вместе кодируют последовательность CEWC -YSSRVVRVISAKRQLVSGIKYILQ (остатки 40-63) Пары праймеров Р28/Р29 и Р30/Р31 были подвергнуты отжигу и обработаны ДНК-полимеразой 1 (фрагмент Кленова) для получения двух двунитевых фрагментов, которые далее были совместно подвергнуты SOEn. Фрагменты ос-I, кодирующие N- и С-концевые области, были амплифицированы с использованием праймеров Р32/Р33 и Р27/Р34. Синтическую последовательность cewc (P28-31) подвергли операции SOEn с N-концевым фрагментом ос-I, который, в свою очередь, был подвергнут той же операции с С-концевым фрагментом ос-I с получением гибридного гена glvsg40-63. Замена С-конца ос-I соответствующей областью cewc Область cewc, кодирующая 20 С-концевых аминокислот, FVVYSIPWLNQIKLLESKCQ (остатки 97-116), был создана с использованием праймеров Р35 и Р36 способом, идентичным вышеописанному способу кодирования N-конца. Праймеры Р32 и Р37 использовали для амплификации ос-I, у которого отсутствуют концевые 51 п.н. кодирующей последовательности. Последовательности ос-I и cewc вместе подвергли операции SOEn для получения гибрида, обозначаемого oc-cterm97-116. Получение гибридов с укороченными последовательностями cewc Для определения того, могут ли укороченные области cewc придавать гибридным цистатинам большую ингибирующую активность в сравнении с нативным Ос-I, были созданы гибридные молекулы, содержащие уменьшенные области CWEC. Подобные гибридные белки могли бы сохранять большую часть аминокислотной последовательности исходной молекулы растительного происхождения. При проведении USE мутагенных реакций использовали два праймера Р38 и Р39 и получили два гибридных гена, обозначаемых oc-glvsg52-60 и oc-pw101-107, которые кодируют соседние cewc остатки RQLVSGIKY (остатки 52-60, критический активный сайт cewc [12] ) и SIPWLNQ (остатки 101-107, важная область С-конца [16]), соответственно. Получение матрицы гибридных молекул Гибридные молекулы, в которых многочисленные участки ос-I были заменены соответствующими последовательностями cewc, были получены с использованием удобно сайтов ферментативной рестрикции в ос-I. Последовательности, кодирующие N-конец нативного ос-I или N-концевого гибридного гена, удалили путем рестрикции с помощью Hinc II. Последовательности, кодирующие С-конец нативного ос-I или С-концевого гибридного гена, удалили путем рестрикции с помощью Fос I. Лигированием фрагмента одного гибридного гена с фрагментом другого были получены дополнительные гибридные молекулы, в которых два или три фрагмента исходного ос-I были заменены фрагментами cewc. Всего было создано 15 гибридных генов (таблица 3). РЕЗУЛЬТАТЫ Моделирование Сравнительный анализ первичных структур белковых последовательностей был произведен с использованием программы SOMAP для сравнения с первичной структурой белковой последовательности, выбранной из базы данных OWL. Начальный сравнительный анализ первичных структур последовательностей цистеиновых протеиназ послужил для демонстрации высокой степени консервативности внутри семейства цистеиновых протеиназ, а также подтвердил, что нецелесообразно использовать папаин в качестве нашей исходной мишени. Был осуществлен второй сравнительный анализ первичных структур 25 ингибиторов цистеиновых протеиназ (фиг.1) с пригодными последовательностями, который послужил для выявления ранее идентифицированных консервативных аминокислот и обеспечил основу для сравнения известных величин Ki ингибиторов цистеиновых протеиназ с особенностями последовательностей. Полученная при этом информация была использована при разработке стратегии мутагенеза. Для структурного моделирования координаты, относящиеся к цистатину белка куриного яйца (10) и комплексу человеческий стефин (stefin) В/папаин (11), были любезно предоставлены проф. Боде (Bode). Их использовали при создании трехмерной модели Ос-I, которую энергетически минимизировали по программе Xplor, чтобы быть уверенными в том, что эта модель имела разумную стереохимию. Клонирующая экспрессия и очистка цистеиновой протеиназы C.elegans Для определения значений Ki против папаина и нематодной протеиназы, цистеиновую протеиназу C. elegans экспрессировали и выделяли из препаратов Е. соli gcр-1, а для определения чистоты анализировали методом ДДС-ПААГ. Экспрессия и мутагенез цистатинов Экспрессированные и выделенные из E.coli цистатины и мутантные варианты белков Ос-I анализировали методом ДДС-ПААГ для определения чистоты. Сравнительный анализ первичной структуры ингибиторов цистеиновых протеиназ (фиг. 1) показывает, что оризацистатин не имеет лидерной последовательности (в отличие от маисовых гомологов) и потому лучше, чтобы он продуцировался внутриклеточно. Определение величин Ki для трех ингибиторов дикого типа, ингибитора из вигны китайской (CCPI), маисового цистатина II и Ос-I, показало, что они близки по ингибирующей активности. В начале работы CCPI не был охарактеризован. Именно поэтому Ос-I и был выбран для мутационного анализа. Предыдущие публикации подтверждают, что усеченная по N-концу форма Ос-I немного активнее нативного белка, однако, хотя эти вариантные Ос-I белки лишены 21 и 24 аминокислот Ос-I, они сохраняют кодируемые векторными последовательностями N-концевые последовательности, которые тем самым могли бы способствовать взаимодействию с протеиназой. Для прояснения этого вопроса были экспрессированы белки с N-концевыми 21 и 24 аминокислотными делециями и с С-концевыми 8, 9, 10, 11 и 12 аминокислотными делециями. Для этих вариантных белковых форм определили Ki, используя папаин или протеиназу C.elegans, gcp-1 (таблица 1). Было установлено, что ни один из укороченных белков не имел более низких значений Ki, чем Ос-I дикого типа, а 21 и 24 аминокислотные делеции не повлияли на активность. Это наводит на мысль, что результаты других исследователей обусловлены влиянием добавленных векторных остатков, содействующих активности. Сравнительный анализ первичной структуры белковых последовательностей и модель Ос-I вместе с опубликованными данными по величинам Ki использовали для идентификации мутаций, которые могли бы улучшить ингибирующие способности Ос-I. Так, независимо были делегированы аминокислоты Е13 и D86. Делеция остатка Е13 не отразилась на Ki Oc-I против папаина и gcp-1, а делеция остатка Delta86 понизило Ki Oc-I примерно в 13 раз: с 7 до 0,5 нМ - для папаина и с 8 до 0,6 нМ - для протеиназы C.elegans, gcp-1 (таблица 1). Для дальнейших исследований мутагенеза была выбрана область ингибитора вокруг D86. В таблице 1 приведены значения Ki для всех дополнительных мутаций, проанализированных против цистеиновой протеиназы C.elegans. Из этих данных ясно, что все мутации с заменой влекут рост значений Ki, что предполагает ослабление активности. Единственной мутацией со сходным или чуть меньшим Ki в сравнении с Ki для Oc-I дикого типа была делеция остатка М85 (с 8 до 7,1 нМ при взаимодействии с gcp-1). Эффективность цистатинов против C.elegans in vivo Для изучения влияния ингибиторов протеиназ на рост нематод провели опыты по откорму с использованием C.elegans. Сразу после того, как двуполые стали заметны на нормальном агаре, их перенесли на отдельные пластинки с Oc-I, Oc-Idelta86, CCPI или БСА (бычий сывороточный альбумин) и наблюдали отложение яиц. Независимо от состава культуральной среды двуполые отложили в среднем примерно по 300 яиц. Половину этих яиц перенесли на нормальные пластинки без ингибиторов. После выхода из яиц наблюдали развитие личинок. В любых условиях их выход составлял не менее 95%, а их развитие завершилось для 94%, 92,5%, 97% и 96% личинок, вылупившихся из яиц, перенесенных с пластинок со средами с добавками соответственно ОС-I, Oc-IdeltaD86, CCPI и БСА. В другом эксперименте вылупившиеся в нормальных условиях личинки перенесли на среды, в которые были добавлены белки, как описано выше. 50 личинок были пересажены через 6, 12, 24 и 30 часов, что соответствует преобладанию стадий развития L1, L2, L3, L4. При этом, когда личинки были перенесены на содержащие Oc-I, Oc-IdeltaD86 или CCPI среды через 6, 12 или 24 часа после выхода из яиц, до взрослого состояния они не развивались. Личинки, переставшие развиваться на содержащих цистатины средах, оставались нежизнеспособными и неспособными выздороветь при перенесении на свежие, не содержащие ингибиторов среды. Они также не двигались и не реагировали на прикосновения и в итоге погибали. Однако, 76% личинок, пересаженных через 30 часов после выхода из яиц, развивались до взрослых самцов или двуполых особей. Все недоразвитые особи, выведенные из яиц, отложенных на среды с БСА и перенесенных на нормальные среды, развивались до взрослых нематод. Влияние цистатина на Globodera pallida in vivo Предыдущие испытания с Oc-I и Oc-IdeltaD86 показали, что поликлональные антитела против обоих Oc-I распознают оба белка одинаково хорошо. Методом ELISA установили, что наивысший уровень экспрессии в линии экспрессирующих Oc-I трансформированных волосатых корней томатов составлял 0,54+0,02% от суммарного растворимого белка. Подобные испытания идентифицировали Oc-IdeltaD86 линию со сходным уровнем экспрессии, равным 0,51+0,01% от фракции суммарного растворимого белка, которая была выбрана для сравнительного анализа. Рост нематод на двух трансгенных цистатиновых линиях и нетрансформированном контроле измеряли для особей, собранных с нескольких корней с примерно недельными интервалами в течение 6 недель. Размеры площади контуров нематод определяли на анализаторе образов. Зависимость средних величин этих значений от времени для трех линий корней представлена на фиг.4. Для сравнения обеих цистатиновых линий с контролем для каждого дня измерений был проделан статистический анализ с использованием одностороннего ANOVA с априорным контрастом (12). Этим анализом была установлена значительно меньшая площадь контуров (Р<0,05) через 1, 2, 4, 5 и 6 недель. Кроме того, никакого заметного увеличения размеров животных на линии Ос-IdeltaD86 между 4 и 6 неделями не происходило (P<0,05; SNK), в отличие от двух других линий. Сравнительные испытания, проведенные как описано Urwin et al. (16), в которых ингибирование посредством CEWC было произвольно принято за 100%, были проведены с первыми семью гибридными молекулами, представленными в таблице 3. Из этих семи только одна, OC-NTERM1-15QVLSG40-63CTERM97-116, содержащая 57 CEWC остатков, показала ингибирование на уровне 90%. Это больше, чем у нативного Ос-I (60%) и у Ос-I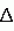 D86 (88%). Степень ингибирования, наблюдавшаяся для оставшихся шести гибридных молекул, была меньше (фиг.6). Обсуждение Как видно из данных таблицы 1, удаление аспарагиновой кислоты в положении 86 в аминокислотной последовательности понижает величину Ki примерно в 13-14 раз, а удаление метионина в соседнем положении 85 лишь слабо влияет на ингибирование папаина. Далее, замена аспарагиновой кислоты в положении 86 двенадцатью другими аминокислотами негативно влияет на Ki. Следовательно, удаление одной из аминокислот и тем самым укорочение белкового остова, вероятно, является важным фактором, влияющим на улучшение Ki. Более того, удаление аминокислоты в положении 86, вероятно, очень важно. Мы считаем, что содержащая этот остаток петля является частью ингибирующего сайта молекулы и при делеции аспарагиновой кислоты из положения 86 возникает структура, более сходная со структурами других цистатинов, возможно, улучшающая взаимодействие с протеиназой сохраненных в положениях 83 и 84 вышеуказанного сайта PW аминокислот. Из таблицы 1 видно, что эффективность нативных и модифицированных ингибиторов протеиназ была определена по отношению к папаину и gср-1, полученной из нематод C.elegans, питающихся бактериями. Более того, другая приведенная здесь информация свидетельствует о том, что модифицированный белок эффективен в ингибировании протеиназ и, таким образом, функционально активен. Вдобавок, представленные данные по гибридным молекулам показывают возможность конструирования белков, в частности, модификации растительных белков включением в их состав по меньшей мере части животного белка с тем, чтобы функциональная активность ингибитора протеиназы возрастала, то есть чтобы функциональная активность растительных белков приближалась к активности животных белков. Представленные данные указывают на то, что предыдущие сообщения о недостаточно сильном воздействии на насекомых при достигнутых уровнях экспрессии нативных ингибиторов протеиназ могут быть опровергнуты путем использованием белковой инженерии, как продемонстрировано в этой заявке. Авторы показали, что белковая инженерия позволяет уменьшить и тем самым улучшить значения Ki и тем самым понизить минимальный эффективный уровень белка, который должен быть экспрессирован в растениях для их эффективной защиты. Источники информации 1. Peng, JH & Black LL (1976) Phytopatholgy. 66:958-963. 2. Maniatis T., Fritsch EF & Sambrook J (eds)(1982). Molecular cloning a laboratory manual. Cold Spring Harbor Laboratory. pp. 545. 3. Abe K, Emori Y, Kondo H, Suzuki К & Arai S. (1987). Molecular cloning of a cysteine proteinase inhibitor of rice (Orozacystatin) Homology with animal cystains and transient expression of the ripening process of rice seeds. The Journal of Biological Chemistry. 262: 16793-16797. 4а. Но SN, Hunt HD, Horton RM, Pullen JK and Pease LR (1989). Gene 77: 51. 4б. Horton RM, Hunt HD, Ho SN, Pullen JK and Pease LR (1989). Gene 77: 61. 5. Ray С. and McKerrow JH (1992). Gut-specific and developmental expression of a Caenorhabditis elegans cysteine protease gene. Molecular and Biochemical Parasitology. 51:239-250. 6. Fernandes KVS, Sabelli PA, Barratt DHP, Richardson M, Xavier-Filho J and Shewry PR (1993). The resistance of cowpea seeds to bruchid beetles is not related to levels of cysteine proteinase inhibitors. Plant Molecular Biology 23: 215-219. 7. Barrett AJ (1972). A new assay for Cathepsin Bl and other thiol proteinases. Analytical Biochemistry 47:280-293. 8. Hames BD and Rickwood D (eds) (1981). Gel electrophoresis of proteins a practical approach. IRL press limited pp. 290. 9. Wood В (ed) (1988). The nematode C.elegans. Cold Spring Harbor Laboratory press. pp. 606. 10. Bode W, Engh R, Musil D, Thiele U, Huber R, Karshikov A, Brzin J, Kos J and Turk V (1988). The 2.0 A X-ray crystal structure of chicken egg white cystatin and possible mode of interaction with cysteine proteinases. The EMBO Journal 7:2593-2599. 11. Stubbs M, Laber В, Bode W, Huber R, Jerala R, Lenarcic В (1990). The refined 2.4 A X-ray crystal structure of combinant human stefin В in complex with the cysteine proteinase papain: a novel type of proteinase inhibitor interaction. The EMBO Journal 9:1939-1947. 12. Arai S, Watanabe H, Kondo, Emori Y and Abe К (1991). Papaininhibitory activity of oryzacystatin, a rice seed cysteine protease inhibitor, depends on the central Gin-Val-Val-Ala-Gly region conserved among cystatin superfamily members. J Biochem. 109:294-298. 13. Sijmons PC, Atkinson HJ and Wyss U (1994). Parasitic Strategies of Root Nematodes and Associated Host Cell Responses. Annual Review of Phytopathology 32:235-259. 14. Bradford M, (1976). A rapid and sensitive method for the quantitation of microgramme quantities of protein utilising the principle of protein dye binding. Analytical Biochemistry 72:248-254. 15. Tefer D (1984). Transformation of several species of higher plant by Agrobacterium rhizogenes. Sexual transmition of the transformed genotype and phenotype. Cell 37:959-967. 16. Urwin РЕ, Atkinson, HJ, Waller D and McPherson MJ (1995). Engineered Oryzacystatin-I expressed in transgenic hairy roots confers resistance to Globodera pallida. The Plant Journal 8:121-131. D86 (88%). Степень ингибирования, наблюдавшаяся для оставшихся шести гибридных молекул, была меньше (фиг.6). Обсуждение Как видно из данных таблицы 1, удаление аспарагиновой кислоты в положении 86 в аминокислотной последовательности понижает величину Ki примерно в 13-14 раз, а удаление метионина в соседнем положении 85 лишь слабо влияет на ингибирование папаина. Далее, замена аспарагиновой кислоты в положении 86 двенадцатью другими аминокислотами негативно влияет на Ki. Следовательно, удаление одной из аминокислот и тем самым укорочение белкового остова, вероятно, является важным фактором, влияющим на улучшение Ki. Более того, удаление аминокислоты в положении 86, вероятно, очень важно. Мы считаем, что содержащая этот остаток петля является частью ингибирующего сайта молекулы и при делеции аспарагиновой кислоты из положения 86 возникает структура, более сходная со структурами других цистатинов, возможно, улучшающая взаимодействие с протеиназой сохраненных в положениях 83 и 84 вышеуказанного сайта PW аминокислот. Из таблицы 1 видно, что эффективность нативных и модифицированных ингибиторов протеиназ была определена по отношению к папаину и gср-1, полученной из нематод C.elegans, питающихся бактериями. Более того, другая приведенная здесь информация свидетельствует о том, что модифицированный белок эффективен в ингибировании протеиназ и, таким образом, функционально активен. Вдобавок, представленные данные по гибридным молекулам показывают возможность конструирования белков, в частности, модификации растительных белков включением в их состав по меньшей мере части животного белка с тем, чтобы функциональная активность ингибитора протеиназы возрастала, то есть чтобы функциональная активность растительных белков приближалась к активности животных белков. Представленные данные указывают на то, что предыдущие сообщения о недостаточно сильном воздействии на насекомых при достигнутых уровнях экспрессии нативных ингибиторов протеиназ могут быть опровергнуты путем использованием белковой инженерии, как продемонстрировано в этой заявке. Авторы показали, что белковая инженерия позволяет уменьшить и тем самым улучшить значения Ki и тем самым понизить минимальный эффективный уровень белка, который должен быть экспрессирован в растениях для их эффективной защиты. Источники информации 1. Peng, JH & Black LL (1976) Phytopatholgy. 66:958-963. 2. Maniatis T., Fritsch EF & Sambrook J (eds)(1982). Molecular cloning a laboratory manual. Cold Spring Harbor Laboratory. pp. 545. 3. Abe K, Emori Y, Kondo H, Suzuki К & Arai S. (1987). Molecular cloning of a cysteine proteinase inhibitor of rice (Orozacystatin) Homology with animal cystains and transient expression of the ripening process of rice seeds. The Journal of Biological Chemistry. 262: 16793-16797. 4а. Но SN, Hunt HD, Horton RM, Pullen JK and Pease LR (1989). Gene 77: 51. 4б. Horton RM, Hunt HD, Ho SN, Pullen JK and Pease LR (1989). Gene 77: 61. 5. Ray С. and McKerrow JH (1992). Gut-specific and developmental expression of a Caenorhabditis elegans cysteine protease gene. Molecular and Biochemical Parasitology. 51:239-250. 6. Fernandes KVS, Sabelli PA, Barratt DHP, Richardson M, Xavier-Filho J and Shewry PR (1993). The resistance of cowpea seeds to bruchid beetles is not related to levels of cysteine proteinase inhibitors. Plant Molecular Biology 23: 215-219. 7. Barrett AJ (1972). A new assay for Cathepsin Bl and other thiol proteinases. Analytical Biochemistry 47:280-293. 8. Hames BD and Rickwood D (eds) (1981). Gel electrophoresis of proteins a practical approach. IRL press limited pp. 290. 9. Wood В (ed) (1988). The nematode C.elegans. Cold Spring Harbor Laboratory press. pp. 606. 10. Bode W, Engh R, Musil D, Thiele U, Huber R, Karshikov A, Brzin J, Kos J and Turk V (1988). The 2.0 A X-ray crystal structure of chicken egg white cystatin and possible mode of interaction with cysteine proteinases. The EMBO Journal 7:2593-2599. 11. Stubbs M, Laber В, Bode W, Huber R, Jerala R, Lenarcic В (1990). The refined 2.4 A X-ray crystal structure of combinant human stefin В in complex with the cysteine proteinase papain: a novel type of proteinase inhibitor interaction. The EMBO Journal 9:1939-1947. 12. Arai S, Watanabe H, Kondo, Emori Y and Abe К (1991). Papaininhibitory activity of oryzacystatin, a rice seed cysteine protease inhibitor, depends on the central Gin-Val-Val-Ala-Gly region conserved among cystatin superfamily members. J Biochem. 109:294-298. 13. Sijmons PC, Atkinson HJ and Wyss U (1994). Parasitic Strategies of Root Nematodes and Associated Host Cell Responses. Annual Review of Phytopathology 32:235-259. 14. Bradford M, (1976). A rapid and sensitive method for the quantitation of microgramme quantities of protein utilising the principle of protein dye binding. Analytical Biochemistry 72:248-254. 15. Tefer D (1984). Transformation of several species of higher plant by Agrobacterium rhizogenes. Sexual transmition of the transformed genotype and phenotype. Cell 37:959-967. 16. Urwin РЕ, Atkinson, HJ, Waller D and McPherson MJ (1995). Engineered Oryzacystatin-I expressed in transgenic hairy roots confers resistance to Globodera pallida. The Plant Journal 8:121-131.
ФОРМУЛА ИЗОБРЕТЕНИЯ1. Цистатиновый ингибитор протеиназы, включающий по меньшей мере одну сайт-направленную аминокислотную делецию, которая представляет собой делецию аспарагиновой кислоты в положении 86 оризацистатина 1 или эквивалентного остатка в его гомологе или аналоге после сравнительного анализа первичной структуры белковой последовательности указанного гомолога или аналога со структурой белковой последовательности оризацистатина 1. 2. Гибридный ингибитор протеиназы, включающий в себя 1) первую часть, состоящую из цистатина или его фрагмента; 2) вторую часть, состоящую из ингибитора протеиназы или его фрагмента; 3) возможно еще одну или большее число частей, состоящих из ингибиторов протеиназы или их фрагментов. 3. Гибридный ингибитор протеиназы по п. 2, отличающийся тем, что указанная вторая часть состоит из цистатина или его фрагмента. 4. Гибридный ингибитор протеиназы по п. 3, отличающийся тем, что указанная первая часть состоит из растительного цистатина или его фрагмента, а указанная вторая часть состоит из животного цистатина или его фрагмента. 5. Гибридный ингибитор протеиназы по п. 2, отличающийся тем, что указанный цистатин представляет собой модифицированный растительный цистатин, у которого по меньшей мере одна из следующих областей: N-конец, С-конец и активный сайт полностью или частично заменена эквивалентными областями животного цистатина. 6. Гибридный ингибитор протеиназы по п. 4 или 5, отличающийся тем, что животный цистатин является цистатином белка куриного яйца. 7. Гибридный ингибитор протеиназы по п. 4 или 5, отличающийся тем, что растительный цистатин является оризацистатином. 8. Гибридный ингибитор протеиназы по пп. 4, 5 или 7, отличающийся тем, что растительный цистатин является цистатиновым ингибитором протеиназы по п. 1. 9. Молекула ДНК, содержащая ДНК, кодирующую цистатиновый ингибитор протеиназы по п. 1. 10. Композиция для подавления действия протеиназы, содержащая по меньшей мере ингибитор протеиназы по любому из пп. 1-8. 11. Композиция по п. 10, отличающаяся тем, что она дополнительно содержит подходящий носитель. 12. Способ борьбы с патогеном, паразитом или вредителем, при котором на указанного патогена, паразита или вредителя воздействуют ингибитором протеиназы по любому из пп. 1-8. 13. Способ борьбы с патогеном, паразитом или вредителем по п. 12, отличающийся тем, что указанную борьбу осуществляют путем придания устойчивости к протеолитическому повреждению, при котором модифицируют или трансформируют организм, исключая человека, таким образом, что он экспрессирует ингибитор по любому из пп. 1-8. 14. Способ по п. 13, отличающийся тем, что указанной экспрессией управляют с помощью выбранного промотора, выделенного из подходящего гена или модифицированного таким образом, чтобы экспрессия могла происходить временно или локально так, чтобы этот ингибитор экспрессировался либо в заданный выбранный момент времени, либо в заданном месте в зависимости от физиологических и/или анатомических особенностей организма. 15. Способ по п. 13 или 14, отличающийся тем, что указанный организм является растением. 16. Способ по п. 15, отличающийся тем, что указанное растение представляет собой зерновую культуру. 17. Способ получения ингибитора протеиназы по любому из пп. 1-8, при котором организм-хозяин, исключая человека, трансформируют таким образом, чтобы его генетический материал включал ДНК, кодирующую ингибитор протеиназы по любому из пп. 1-8, и затем указанный трансформированный организм культивируют и/или выращивают в условиях, при которых указанный ингибитор протеиназы экспрессируется. 18. Способ получения ингибитора протеиназы по любому из пп. 1-8, при котором применяют один или большее число праймеров, представленных в Таблице 2 или 2а, или праймеров, имеющих в себе добавки, делеции или модификации, которые дают этому праймеру возможность продуцировать указанный ингибитор протеиназы. Приоритет по пунктам: 21.11.1994 - по пп. 1, 9, 10-18, включающие признаки цистатинового ингибитора протеиназы по заявкам 9423477.0 и 9423450.7; 20.11.1995 - по пп. 2-8, 10-18, включающие признаки гибридного ингибитора протеиназы по заявке РСТ/GB 95/02711.Популярные патенты: 2079266 Устройство для гранулирования кормов ... кормов, таких как трава, солома и т.д. включающее боковые кольца с двумя рядами отверстий и расположенные между ними радиальными пластинами, образующие вместе с поперечными пластинами прессовальные каналы. В радиальных пластинах выполнены два сквозных отверстия, совпадающих с отверстиями в боковых кольцах. Радиальные пластины крепятся к боковым кольцам штифтами, устанавливаемыми в отверстия боковых колец и радиальных пластин. Недостатком устройства является малая производительность. Малая производительность обусловлена тем, что толщину радиальных пластин определяют диаметры штифтов, используемых для крепления их к боковым кольцам. Ввиду большого усилия, действующего на ... 2472336 Соломорезка и оснащенная такой соломорезкой уборочная машина ... ножей 32, 33 различна в соответствии с их положением вдоль оси соломорезки 8. Длина подобрана такой, что вершины всех вращающихся ножей 32 находятся на одинаковом расстоянии от корпуса 29 или вершины всех неподвижных ножей 33 находятся на одинаковом расстоянии от основного тела 37 ротора 28. Валы 39 для управления перестановкой ножей 33 проходят параллельно наружной стороне корпуса 29 вдоль половины его ширины.Как показано на фиг.1, к выходу соломорезки 8 подсоединен разбрасыватель 38, который разбрасывает измельченную массу по ширине полосы, соответствующей ширине полосы, обработанной жатвенным аппаратом 3. Разбрасыватель может быть выполнен, например, в виде радиального ... 2250602 Широкозахватный колесный дождеватель ... полиэтиленовых труб размещены между полками смежных С-образных гнутых профилей несущего элемента 9. Дождевальные насадки 6 с ниппелями 16 соединены посредством механизмов самоустановки (в силу известности серийно выпускаемого узла на чертежах не показаны).Каждое крыло водопроводящего трубопровода соединено с центральной секцией 4 посредством муфты предельного момента (см. фиг.4). На фланце 17 несущего элемента 9 центральной секции сварным швом по контуру соединено кольцо 18.На фланце 19 боковой секции 5 смонтировано аналогичным образом кольцо 20 с лепестками 21, образованными за счет прорезей вдоль образующих поверхности кольца 20. Между кольцами 18 и 20 размещено разрезное ... 2440712 Автоматизированная система для хранения в поле, возможности оперативного контроля и выгрузки убранных продуктов урожая из уборочной машины ... в настоящее время варианты изобретения, примеры которых проиллюстрированы приложенными чертежами. В общем, согласно фиг.1 и фиг.4-7, представлено устройство 100 для сбора и хранения убранного продукта. В настоящем варианте осуществления устройство 100 включает в себя выполненный непрерывным гибкий контейнер 102, такой как непрерывный лист гибкого материала (например, пластмассы), для сбора убранного продукта. Например, гибкий контейнер может быть непрерывным листом пластмассы, формирующим гибкую трубу 402, имеющую термосваренные края 408. Труба из пластмассового листового материала может храниться в виде рулона 502 и может быть соединена с уборочной машиной 404, ... 2230467 Добавка к пищевым продуктам, биоцидный препарат, 2-(1-окси- 4-гидроксифенилен)-бензохинон (варианты) и способ его получения ... ... |
Еще из этого раздела: 2108695 Орудие для образования гребней в почве 2093016 Устройство для водоподачи 2264065 Способ возделывания сельскохозяйственных культур на корм 2112337 Рабочий орган культиватора 2281637 Способ производства зеленого корма при возделывании в орошаемом земледелии и устройство для его осуществления 2272399 Зерноуборочный комбайн 2231250 Устройство для промышленного выращивания земляники и других растений 2024226 Производные s- -тиоакриламидов и композиция для предотвращения или ингибирования роста бактерий 2012206 Инсектицидная композиция для борьбы с тараканами 2415570 Искусственное роение и борьба с естественным роением пчелиных семей |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||