Способ получения биомассы энтомопатогенных нематодПатент на изобретение №: 2168893 Автор: Данилов Л.Г., Айрапетян В.Г., Салятов Л.Ю. Патентообладатель: Всероссийский институт защиты растений, Общество с ограниченной ответственностью "Городской учебно- консультационный центр" Дата публикации: 20 Июня, 2001 Начало действия патента: 21 Марта, 2000 Адрес для переписки: 189620, Санкт-Петербург, Пушкин, ш. Подбельского 3, ВИЗР Изображения Изобретение относится к микробиологической промышленности, а именно к способу получения биомассы энтомопатогенных нематод. В способе используют искусственную питательную среду, которую наносят на твердый инертный носитель. Питательная среда состоит из следующих компонентов, %: соевая мука 16, растительное масло 5, пивные дрожжи 1, вода 50, поролоновая крошка 8. Инокуляцию чистой культуры симбиотических бактерий и моноксенной культуры нематод в питательную среду проводят одновременно, а также с дополнительным внесением адаптогена - дибазола (2-бензил-бензимидазол) в концентрации 1 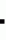 10-9 г/мл искусственной питательной среды. Добавление дибазола в питательную среду способствует повышению резистентности организмов к неблагоприятным условиям культивирования при совместной инокуляции. Емкости с питательной средой инкубируют в течение 20 - 30 дней при 20 - 28В°С. Культуру нематод выделяют вымыванием из поролоновой крошки. Выход биомассы нематод в способе составил 920,0 тыс. инвазионных личинок с 1 г питательной среды. При этом показатель энтомопатогенной активности нематод составил LD50 = 22,0 + 2,7. 2 табл. 10-9 г/мл искусственной питательной среды. Добавление дибазола в питательную среду способствует повышению резистентности организмов к неблагоприятным условиям культивирования при совместной инокуляции. Емкости с питательной средой инкубируют в течение 20 - 30 дней при 20 - 28В°С. Культуру нематод выделяют вымыванием из поролоновой крошки. Выход биомассы нематод в способе составил 920,0 тыс. инвазионных личинок с 1 г питательной среды. При этом показатель энтомопатогенной активности нематод составил LD50 = 22,0 + 2,7. 2 табл.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУИзобретение относится к микробиологической промышленности, а именно к способам получения биомассы энтомопатогенных нематод, применяемых в качестве биологических препаратов в борьбе с насекомыми-вредителями. Известен способ получения биомассы энтомопатогенных нематод, который заключается в том, что компоненты питательной среды - яичный порошок, дрожжи, кукурузное масло, соевую муку и воду смешивают, помещают в ферментер и стерилизуют. В охлажденную смесь инокулируют предварительно размноженную на питательном бульоне в другом ферментере жидкую культуру симбиотических бактерий. После 48-часового выращивания бактерий в питательную среду инокулируют предварительно простерилизованную моноксенную культуру инвазионных личинок нематод. Зрелую биомассу нематод после завершения цикла развития отделяют от остатков питательной среды с помощью центрифугирования (1). В качестве недостатков культивирования нематод в жидкой питательной среде в ферментерах следует отметить следующие: длительный срок развития нематод - до 60 дней; низкий выход биомассы, не превышающий 106 инвазионных личинок с 1 мл питательной среды; большая энергоемкость процесса культивирования. Наиболее близким из известных, принятым за прототип, является способ, включающий получение биомассы нематод с использованием полужидких питательных сред, состоящих из следующих компонентных составов: а) куриные потроха, говяжий жир и вода; б) куриные яйца, кукурузная мука, растительное масло, дрожжевой экстракт и вода (2). Гомогенатом питательной среды пропитывают поролоновую крошку, в которую после стерилизации инокулируют симбиотических бактерий. Бактерии размножают при температуре 25-30oC в течение 2-3 суток, затем в емкость со средой с бактериями инокулируют моноксенную культуру нематод. Недостатки прототипа определяются наличием двух разновременных операций, проводимых с одними и теми же емкостями с питательной средой в стерильных условиях - сначала инокулируют в питательную среду бактерий, а затем нематод. И кроме того, при таком способе размножения нематод с 1 г питательной среды получают невысокий выход биомассы этих паразитов (не более 450 тысяч), что существенно отражается на эффективности всего процесса производства и себестоимости продукта. Задача, решаемая изобретением, - повышение выхода биомассы энтомопатогенных нематод и снижение себестоимости конечного продукта. Предлагаемый способ заключается в том, что микроорганизмы, в частности, энтомопатогенные нематоды и их симбиотические бактерии выращивают в емкостях с естественной аэрацией на твердом инертном носителе - поролоновой крошке (объем кусочков поролоновой крошки - 1-6 см), пропитанной гомогенатом искусственной питательной среды, состоящей из следующих компонентов: соевая мука - 16%, растительное масло (кукурузное, рапсовое, подсолнечное) - 5%, пивные дрожжи - 1%, вода - 50%, поролоновая крошка - 8% с дополнительным внесением адаптогена - дибазола (2-бензил-бензимидазол) в концентрации 1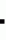 10-9 г/мл искусственной питательной среды при одновременной инокуляции в питательную среду симбиотических бактерий и моноксенной культуры инвазионных личинок нематод. Добавление дибазола в питательную среду способствует повышению резистентности организмов к неблагоприятным условиям культивирования, отличающимся от условий развития нематод в насекомых. Первоначальный процесс культивирования начинают с приготовления чистой культуры симбиотических бактерий и моноксенной культуры (т.е. культуры инвазионных личинок нематод, с одним видом бактерий - симбиотических) нематод. Чистую культуру симбиотических бактерий получают путем заражения нематодами гусениц большой вощинной моли (Galleria mellonella L.), спустя 24 часа в стерильных условиях отбирают бактерии, содержащиеся в гемолимфе насекомых, и переносят их в чашки Петри с питательным агаром (дрожжевой экстракт - 10 г, декстроза - 5 г, CaCO3 - 20 г, агар - 15 г, вода - 1 л). После суточной инкубации при температуре 25-30oC отбирают колонии бактерий и инокулируют их в колбы с МПБ, которые помещают на качалку на 2 суток при температуре 25-30oC. Моноксенную культуру нематод получают путем стерилизации инвазионных личинок нематод в 0,1% растворе мертиолата в течение 30 минут, затем их переносят в свежий 0,1% раствор мертиолата и держат 3 часа, после чего личинок трижды промывают в стерильной воде и переносят в чашки Петри на питательный агар с двухсуточной культурой симбиотических бактерий и инкубируют при 25-28oC. Когда размножение нематод прекращается (обычно спустя 20- 30 суток), полученную моноксенную культуру нематод используют для размножения их на искусственной питательной среде. В производственных условиях чистые субкультуры симбиотических бактерий хранят на питательном агаре при температуре 12oC и проверяют их на чистоту ежемесячно. Эти культуры используют затем в процессе производства, а моноксенную культуру нематод берут из емкостей, в которых нематоды завершили цикл развития из расчета 1 г поролоновой крошки с нематодами на 10 г поролоновой крошки с питательной средой. В процессе производства искусственную питательную среду смешивают в отдельной емкости (соевую муку, яичный порошок, растительное масло, пивные дрожжи, воду). Полученной гомогенной массой пропитывают поролоновую крошку, которую затем помещают в емкости и автоклавируют при температуре 121oC и давлении 1 атм в течение 30 минут. В охлажденную питательную смесь в стерильных условиях инокулируют, в расчете на 1 г среды, жидкую двухсуточную культуру симбиотических бактерий (12,1 10-9 г/мл искусственной питательной среды при одновременной инокуляции в питательную среду симбиотических бактерий и моноксенной культуры инвазионных личинок нематод. Добавление дибазола в питательную среду способствует повышению резистентности организмов к неблагоприятным условиям культивирования, отличающимся от условий развития нематод в насекомых. Первоначальный процесс культивирования начинают с приготовления чистой культуры симбиотических бактерий и моноксенной культуры (т.е. культуры инвазионных личинок нематод, с одним видом бактерий - симбиотических) нематод. Чистую культуру симбиотических бактерий получают путем заражения нематодами гусениц большой вощинной моли (Galleria mellonella L.), спустя 24 часа в стерильных условиях отбирают бактерии, содержащиеся в гемолимфе насекомых, и переносят их в чашки Петри с питательным агаром (дрожжевой экстракт - 10 г, декстроза - 5 г, CaCO3 - 20 г, агар - 15 г, вода - 1 л). После суточной инкубации при температуре 25-30oC отбирают колонии бактерий и инокулируют их в колбы с МПБ, которые помещают на качалку на 2 суток при температуре 25-30oC. Моноксенную культуру нематод получают путем стерилизации инвазионных личинок нематод в 0,1% растворе мертиолата в течение 30 минут, затем их переносят в свежий 0,1% раствор мертиолата и держат 3 часа, после чего личинок трижды промывают в стерильной воде и переносят в чашки Петри на питательный агар с двухсуточной культурой симбиотических бактерий и инкубируют при 25-28oC. Когда размножение нематод прекращается (обычно спустя 20- 30 суток), полученную моноксенную культуру нематод используют для размножения их на искусственной питательной среде. В производственных условиях чистые субкультуры симбиотических бактерий хранят на питательном агаре при температуре 12oC и проверяют их на чистоту ежемесячно. Эти культуры используют затем в процессе производства, а моноксенную культуру нематод берут из емкостей, в которых нематоды завершили цикл развития из расчета 1 г поролоновой крошки с нематодами на 10 г поролоновой крошки с питательной средой. В процессе производства искусственную питательную среду смешивают в отдельной емкости (соевую муку, яичный порошок, растительное масло, пивные дрожжи, воду). Полученной гомогенной массой пропитывают поролоновую крошку, которую затем помещают в емкости и автоклавируют при температуре 121oC и давлении 1 атм в течение 30 минут. В охлажденную питательную смесь в стерильных условиях инокулируют, в расчете на 1 г среды, жидкую двухсуточную культуру симбиотических бактерий (12,1 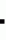 107 бактериальных клеток) и моноксенную культуру нематод (50 тыс. инвазионных личинок). Емкости с питательной средой инкубируют в течение 20-30 дней при температуре 20-28oC. Зрелую культуру нематод выделяют из инертного носителя в воде путем вымывания и последующей концентрации инвазионных личинок с помощью гидроциклона и центрифуги. Подсчетом нематод в определенном объеме осадка определяют численность нематод перед закладкой их на хранение. Пример 1. Получение биомассы нематод вида Steinernema carpocapsae штамм "agriotos" проводили в стеклянных колбах объемом 700 см3 на питательной среде, содержащей: соевая мука - 16%, яичный порошок - 20%, кукурузное масло - 5%, пивные дрожжи - 1%, поролоновая крошка - 8%, вода - 50% с добавлением дибазола в концентрациях 1 107 бактериальных клеток) и моноксенную культуру нематод (50 тыс. инвазионных личинок). Емкости с питательной средой инкубируют в течение 20-30 дней при температуре 20-28oC. Зрелую культуру нематод выделяют из инертного носителя в воде путем вымывания и последующей концентрации инвазионных личинок с помощью гидроциклона и центрифуги. Подсчетом нематод в определенном объеме осадка определяют численность нематод перед закладкой их на хранение. Пример 1. Получение биомассы нематод вида Steinernema carpocapsae штамм "agriotos" проводили в стеклянных колбах объемом 700 см3 на питательной среде, содержащей: соевая мука - 16%, яичный порошок - 20%, кукурузное масло - 5%, пивные дрожжи - 1%, поролоновая крошка - 8%, вода - 50% с добавлением дибазола в концентрациях 1 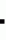 10-7 г/мл, 1 10-7 г/мл, 1 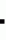 10-9 г/мл и 1 10-9 г/мл и 1 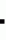 10-11 г/мл. Общая масса среды в колбе составляла 70 г. После стерилизации и охлаждения в среду инокулировали микроорганизмы одновременно. В одном контрольном опыте микроорганизмы инокулировали в среду раздельно, сначала симбиотических бактерий вида Xenorhabdus nematophilus, а затем после 48-часовой инкубации среды с бактериями при температуре 25oC дополнительно в среду инокулировали моноксенных личинок нематод. В другом контрольном опыте микроорганизмы инокулировали в среду одновременно. Колбы с питательной средой и микроорганизмами содержали в темноте при температуре 25oC в течение 20 дней. Зрелую культуру нематод выделяли вымыванием из поролоновой крошки и подсчитывали количество нематод в полученной водной суспензии инвазионных личинок в опытных и контрольных вариантах с одновременным определением их инвазионной (энтомопатогенной) активности по показателю LD50 для тест-насекомых (3). Выход биомассы нематод при добавлении дибазола в концентрации 1 10-11 г/мл. Общая масса среды в колбе составляла 70 г. После стерилизации и охлаждения в среду инокулировали микроорганизмы одновременно. В одном контрольном опыте микроорганизмы инокулировали в среду раздельно, сначала симбиотических бактерий вида Xenorhabdus nematophilus, а затем после 48-часовой инкубации среды с бактериями при температуре 25oC дополнительно в среду инокулировали моноксенных личинок нематод. В другом контрольном опыте микроорганизмы инокулировали в среду одновременно. Колбы с питательной средой и микроорганизмами содержали в темноте при температуре 25oC в течение 20 дней. Зрелую культуру нематод выделяли вымыванием из поролоновой крошки и подсчитывали количество нематод в полученной водной суспензии инвазионных личинок в опытных и контрольных вариантах с одновременным определением их инвазионной (энтомопатогенной) активности по показателю LD50 для тест-насекомых (3). Выход биомассы нематод при добавлении дибазола в концентрации 1 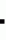 10-9 г/мл составил 920,0 тыс. инвазионных личинок с 1 г питательной среды, в контрольном опыте при совместной инокуляции микроорганизмов, соответственно, 646,6 тыс. нематод и в другом контрольном опыте при раздельной инокуляции получено 720,0 тыс. нематод с 1 г среды. С увеличением и уменьшением концентрации дибазола от оптимальной (1 10-9 г/мл составил 920,0 тыс. инвазионных личинок с 1 г питательной среды, в контрольном опыте при совместной инокуляции микроорганизмов, соответственно, 646,6 тыс. нематод и в другом контрольном опыте при раздельной инокуляции получено 720,0 тыс. нематод с 1 г среды. С увеличением и уменьшением концентрации дибазола от оптимальной (1 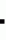 10-9 г/мл) выход биомассы снижался (Таблица 1). При этом наилучший показатель инвазионной (энтомопатогенной) активности нематод (LD50 = 22,0 10-9 г/мл) выход биомассы снижался (Таблица 1). При этом наилучший показатель инвазионной (энтомопатогенной) активности нематод (LD50 = 22,0 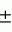 2,7) - был в варианте с добавлением дибазола к питательной среде в концентрации 1 2,7) - был в варианте с добавлением дибазола к питательной среде в концентрации 1 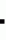 10-9 г/мл (Таблица 2). С увеличением и уменьшением концентрации дибазола инвазионная активность нематод снижалась. В вариантах без дибазола при раздельном и совместном внесении микроорганизмов в питательную среду показатели LD50 так же были значительно ниже, соответственно, 35,1 10-9 г/мл (Таблица 2). С увеличением и уменьшением концентрации дибазола инвазионная активность нематод снижалась. В вариантах без дибазола при раздельном и совместном внесении микроорганизмов в питательную среду показатели LD50 так же были значительно ниже, соответственно, 35,1 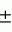 4,7 и 38,3 4,7 и 38,3 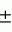 4,5. Таким образом, наилучшие результаты по выходу биомассы нематод и их инвазионной (энтомопатогенной) активности получены при добавлении к питательной среде дибазола в концентрации 1 4,5. Таким образом, наилучшие результаты по выходу биомассы нематод и их инвазионной (энтомопатогенной) активности получены при добавлении к питательной среде дибазола в концентрации 1  10-9 г/мл. При этом выход биомассы с 1 г питательной среды за счет применения дибазола и одновременной инокуляции микроорганизмов в питательную среду повышается на 42,3%, что свидетельствует о возможности сокращения трудоемкой операции в процессе производства, связанной с инокуляцией двух микроорганизмов в питательную среду, и тем самым достигается существенное повышение производительности труда, а в целом за счет применения нового способа культивирования достигается увеличение выхода биомассы нематод и значительное снижение себестоимости биомассы нематодных препаратов. Источники 1. Surrey M.R., R.J. Davies (1996). Pilot-scale liquid culture and harvesting of an entomopathogenic nematode, Heterorhabditis bacteriophora. J. Invertebrate Pathologi, Vol.67, N 1, pp. 92-99. 2. Bedding R. A. , M.S. Stanfield, G.W. Crompton (1991). Apparatus fad Method for Rearing Nematodes, Fungi, Tissue Cultures and The Like, and For Harvesting Nematodes. Internacional Patent Application N PCT/AU91/ 00136 48 pp. 3. Веремчук Г.В., Данилов Л.Г. Методические указания по определению инвазионной активности нематодных культур рода Neoaplectana (Steinernematidae). Л., 1978, 7 стр. 10-9 г/мл. При этом выход биомассы с 1 г питательной среды за счет применения дибазола и одновременной инокуляции микроорганизмов в питательную среду повышается на 42,3%, что свидетельствует о возможности сокращения трудоемкой операции в процессе производства, связанной с инокуляцией двух микроорганизмов в питательную среду, и тем самым достигается существенное повышение производительности труда, а в целом за счет применения нового способа культивирования достигается увеличение выхода биомассы нематод и значительное снижение себестоимости биомассы нематодных препаратов. Источники 1. Surrey M.R., R.J. Davies (1996). Pilot-scale liquid culture and harvesting of an entomopathogenic nematode, Heterorhabditis bacteriophora. J. Invertebrate Pathologi, Vol.67, N 1, pp. 92-99. 2. Bedding R. A. , M.S. Stanfield, G.W. Crompton (1991). Apparatus fad Method for Rearing Nematodes, Fungi, Tissue Cultures and The Like, and For Harvesting Nematodes. Internacional Patent Application N PCT/AU91/ 00136 48 pp. 3. Веремчук Г.В., Данилов Л.Г. Методические указания по определению инвазионной активности нематодных культур рода Neoaplectana (Steinernematidae). Л., 1978, 7 стр.
ФОРМУЛА ИЗОБРЕТЕНИЯСпособ получения биомассы энтомопатогенных нематод, включающий нанесение искусственной питательной среды на инертный носитель, инокуляцию чистой культуры симбиотических бактерий и моноксенной культуры инвазионных личинок нематод в питательную среду, выращивание нематод и выделение биомассы инвазионных личинок из носителя, отличающийся тем, что инокуляцию нематод и бактерий в питательную среду проводят одновременно и с дополнительным внесением адаптогена, в качестве которого использован дибазол в концентрации 1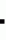 10-9 г/мл. 10-9 г/мл.Популярные патенты: 2197817 Поплавок для рыболовных удочек и снастей ... части в металлический "киль" с кольцом для пропуска лески, позволяет обеспечить вертикальную устойчивость поплавка и размещать и крепить на леске наконечник стационарно, а выполнение патрубков у поплавков с различными объемами воздушных камер с одинаковыми размерами и конусностью наружной поверхности, идентичными внутренним параметрам наконечника, позволяет использовать один наконечник для поплавков с различными объемами воздушных камер. Изменение объема воздушной камеры за счет перемещения поршня позволяет использовать грузовую оснастку на удочках и других снастях не одного постоянного фиксированного веса, а в пределах определенного весового интервала и упростить оснастку ... 2231250 Устройство для промышленного выращивания земляники и других растений ... по М. кл. А 01 G 31/06, 1998 г., патент РФ 2105468 по М. кл. А 01 G 31/06).Ближе всего к настоящему изобретению может быть патент РФ 2105468 “Устройство для промышленного выращивания земляники” по М. кл. А 01 G 31/06.Прототипное устройство содержит каркас, на который крепится вертикально расположенная растильня в виде двустороннего многослойного растительного поля (с несущей сеткой, светопоглощающей и светоотражающей пленками), внутренний слой которого выполнен гигроскопическим. Устройство также имеет систему подачи питательного раствора рециркуляторного типа с биофильтром, двумя резервуарами, поддоном, систему освещения, санпропускник, систему кондиционирования с использованием ... 2452165 Высевающий аппарат зерновой сеялки с централизованным дозированием семян ... цилиндров витки с левосторонней навивкой, а в другой паре - с правосторонней, а основания внешних цилиндров надеты на концевые части приемных камер.2. Высевающий аппарат зерновой сеялки с централизованным дозированием семян по п.1, отличающийся тем, что между парами цилиндров установлен U-образный щиток с выгрузным окном.3. Высевающий аппарат зерновой сеялки с централизованным дозированием семян по п.1, отличающийся тем, что дозирующее устройство выполнено с возможностью вращения с различной частотой. 4. Высевающий аппарат зерновой сеялки с централизованным дозированием семян по п.1, отличающийся тем, что на концевые части приводного вала установлены ворошилки. MM4A Досрочное ... 2092004 Композиционный состав для обработки растений и их органов ... кислоты 0,005-0,15; жидкие макроэлементы 1,0-45,0; микроэлементы 0,1-2,0; 1-этоксисилатран 0,001-0,01; средство защиты растений 0,1--20,0; вода остальное. 2 з.п.ф-лы, 1 табл. , , ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУ Изобретение относится к сельскому хозяйству и может быть использовано для обработки семян, клубней и вегетативных органов растений. Современная интенсивная технология возделывания сельскохозяйственных культур предусматривает широкое использование различного вида композиционных составов для обработки растений и их органов. Например, разработан гидрофобизирующий пленкообразующий состав, содержащий протравитель. Этот состав в настоящее время не ... 2295848 Способ дезинсекции и дезинфекции материалов зернового происхождения и устройство для его осуществления ... и верхнем днище узла ввода СВЧ энергии, а в этом днище и на периферии наконечника выполнены ориентированные вдоль оси устройства отверстия, формирователь вихревого газового потока размещен на конусном переходе, и в боковой стенке разрядной камеры выполнены запредельные на частоте используемых электромагнитных волн отверстия в плоскости, расположенной примерно на половине высоты разрядной камеры. Для реализации возможности использования энергии постоянного электрического тока внутренний проводник основного узла ввода СВЧ энергии изолирован от остальных частей устройства, а вокруг разрядной камеры установлен соленоид, стабилизирующий процессы протекания тока в ... |
Еще из этого раздела: 2453091 Способ обработки почвы 2312500 Способ защиты смородины от вредителей и болезней 2296457 Устройство для магнитно-импульсной обработки растений 2192734 Устройство для производства прессованных кип из корней лекарственных растений 2192721 Орудие для обработки засоленных почв 2114107 Производные триазола, способ их получения и инсектоакарицидная композиция 2278503 Способ управления формированием качества виноградного вина 2475025 Средство для обработки семян зерновых и зернобобовых культур, пораженных фузариозом 2297128 Способ мелиорации солонцовых почв в условиях орошения 2216923 Способ выращивания льна-долгунца |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||