5-гидроксипиразол-4-илкарбонилзамещенные производные сахарина, обладающие гербицидным действием и гербицидное средствоПатент на изобретение №: 2159244 Автор: Петер ПЛАТ (DE), Вольфганг ФОН ДЕЙН (DE), Стефан ЭНГЕЛЬ (DE), Уве КАРДОРФФ (DE), Хартманн КЕНИГ (DE), Харальд РАНГ (DE), Маттиас ГЕРБЕР (DE), Хельмут ВАЛЬТЕР (DE), Карл-Отто ВЕСТФАЛЕН (DE) Патентообладатель: БАСФ АКЦИЕНГЕЗЕЛЬШАФТ (DE) Дата публикации: 20 Ноября, 2000 Начало действия патента: 27 Июля, 1995 Адрес для переписки: 101000, Москва, Малый Златоустинский пер., д.10, кв.15, "ЕВРОМАРКПАТ", Веселицкой И.А. Изображения   Изобретение относится к новым 5-гидроксипиразол-4-илкарбонилзамещенным производным сахарина формулы I 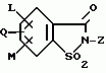 в которой заместители имеют следующее значение: L, M означают водород, C1-C4алкил, хлор, Z означает водород, C1-C4алкил, C3-C8алкенил, C3-C5алкинил, фенил, Q означает радикал CO-J; J означает связанное в положение 4 бензольного кольца 5-гидроксипиразольное кольцо формулы II в которой заместители имеют следующее значение: L, M означают водород, C1-C4алкил, хлор, Z означает водород, C1-C4алкил, C3-C8алкенил, C3-C5алкинил, фенил, Q означает радикал CO-J; J означает связанное в положение 4 бензольного кольца 5-гидроксипиразольное кольцо формулы II 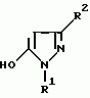 в которой R1 означает C1-C4алкил и R2 означает водород или метил, а также обычно применяемые в сельском хозяйстве соли соединений (I). Гербицидное средство, содержащее производное сахарина формулы I и обычные инертные добавки, используется для борьбы с нежелательной растительностью. 2 с. и 2 з.п. ф-лы, 3 табл.
, , в которой R1 означает C1-C4алкил и R2 означает водород или метил, а также обычно применяемые в сельском хозяйстве соли соединений (I). Гербицидное средство, содержащее производное сахарина формулы I и обычные инертные добавки, используется для борьбы с нежелательной растительностью. 2 с. и 2 з.п. ф-лы, 3 табл.
, , ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУПредметом настоящего изобретения являются 5-гидроксипиразол-4-илкарбонилзамещенные производные сахарина формулы I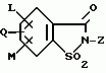 в которой заместители имеют следующее значение: L, M означают водород, C1-C4алкил, хлор, Z означает водород, C1-C4алкил, C3-C6алкенил, C3-C5алкинил, фенил; Q означает радикал CO-J; J означает связанное в положении 4 5-гидроксипиразоловое кольцо формулы II в которой заместители имеют следующее значение: L, M означают водород, C1-C4алкил, хлор, Z означает водород, C1-C4алкил, C3-C6алкенил, C3-C5алкинил, фенил; Q означает радикал CO-J; J означает связанное в положении 4 5-гидроксипиразоловое кольцо формулы II 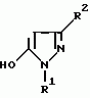 в которой R1 означает C1-C4алкил и R2 означает водород или метил, а также обычно применяемые в сельском хозяйстве соли соединений I. Предметом изобретения являются далее гербицидные препараты, содержащие соединения формулы I, а также способ борьбы с нежелательной растительностью с помощью производных сахарина I. Производные сахарина, обладающие гербицидным действием, в уровне техники до настоящего времени не были описаны. Что же касается незамещенного сахарина (амид о-сульфобензойной кислоты, т.е. L, M, Q и Z в формуле I означают H), то он известен с давних пор в качестве синтетического подслащивающего вещества. В качестве такого подслащивающего вещества известен далее 4-гидроксисахарин (см. выложенную заявку Германии DE-OS 3607343). Известно также применение производных сахарина в качестве фунгицидов для борьбы с сельскохозяйственными вредителями (см., например, публикацию Японии 72/00419 и 73/35457) и в фармацевтике (см., например, европейскую заявку EP-A 594257 и приведенные в ней в качестве ссылок патенты). Гетероциклические соединения с кольцом, содержащим сульфонамидную группу, приобрели известность в качестве гербицидов, типичным представителем которых следует назвать в этой связи бентазон формулы в которой R1 означает C1-C4алкил и R2 означает водород или метил, а также обычно применяемые в сельском хозяйстве соли соединений I. Предметом изобретения являются далее гербицидные препараты, содержащие соединения формулы I, а также способ борьбы с нежелательной растительностью с помощью производных сахарина I. Производные сахарина, обладающие гербицидным действием, в уровне техники до настоящего времени не были описаны. Что же касается незамещенного сахарина (амид о-сульфобензойной кислоты, т.е. L, M, Q и Z в формуле I означают H), то он известен с давних пор в качестве синтетического подслащивающего вещества. В качестве такого подслащивающего вещества известен далее 4-гидроксисахарин (см. выложенную заявку Германии DE-OS 3607343). Известно также применение производных сахарина в качестве фунгицидов для борьбы с сельскохозяйственными вредителями (см., например, публикацию Японии 72/00419 и 73/35457) и в фармацевтике (см., например, европейскую заявку EP-A 594257 и приведенные в ней в качестве ссылок патенты). Гетероциклические соединения с кольцом, содержащим сульфонамидную группу, приобрели известность в качестве гербицидов, типичным представителем которых следует назвать в этой связи бентазон формулы 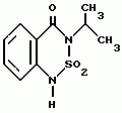 В основу изобретения была положена задача по созданию новых гербицидов с неизвестной до настоящего времени для этой индикации основной структурой. В соответствии с этой задачей были получены соединения формулы I приведенного выше состава. Соединения формулы I получают благодаря тому, что 5-гидроксипиразолы формулы II ацилируют хлорангидридом кислоты формулы IV и образовавшийся пиразоловый эфир перегруппировывают до производных сахарина формулы I.1. В основу изобретения была положена задача по созданию новых гербицидов с неизвестной до настоящего времени для этой индикации основной структурой. В соответствии с этой задачей были получены соединения формулы I приведенного выше состава. Соединения формулы I получают благодаря тому, что 5-гидроксипиразолы формулы II ацилируют хлорангидридом кислоты формулы IV и образовавшийся пиразоловый эфир перегруппировывают до производных сахарина формулы I.1. 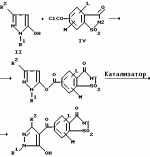 В вышеприведенных формулах L, M и Z имеют указанное выше значение. Первую стадию последовательного проведения реакции, т. е. ацилирование, осуществляют по общеизвестной методике, например, добавлением хлорангидрида кислоты формулы IV к раствору или суспензии 5-гидроксипиразола II в присутствии вспомогательного основания. Реагенты и вспомогательное основание при этом целесообразно применять приблизительно в эквимолярных количествах. Небольшой избыток вспомогательного основания, например, 1,2-1,5 мол. эквивалента в пересчете на количество соединений II, при определенных обстоятельствах может оказаться предпочтительным. В качестве вспомогательного основания пригодны, например, третичные алкиламины, пиридин или карбонаты щелочных металлов, а в качестве растворителей могут использоваться, например, метиленхлорид, диэтиловый эфир, толуол или этиловый эфир уксусной кислоты. При введении добавок хлорангидрида кислоты реакционную смесь предпочтительно охлаждать до 0-10oC, после чего перемешивать ее при повышенной температуре, например, в диапазоне от 25 до 50oC, до завершения обменной реакции. Переработку осуществляют по обычной методике, например, реакционную смесь сливают в воду и требуемый продукт экстрагируют, например, метиленхлоридом. После сушки органической фазы и удаления растворителя сырой 5-гидроксипиразоловый эфир можно без последующей очистки использовать для перегруппировки. Примеры получения эфиров бензойной кислоты 5-гидроксипиразолов можно найти, например, в европейской заявке EP-A 282944 или в патенте США 4643757. Перегруппировку 5-гидроксипиразоловых эфиров до соединений формулы I.1 целесообразно проводить при температурах в интервале от 20 до 40oC в растворителе и в присутствии вспомогательного основания, а также с помощью цианосоединения, служащего катализатором. В качестве растворителей могут использоваться, например, ацетонитрил, метиленхлорид, 1,2-дихлорэтан, этиловый эфир уксусной кислоты или толуол. Предпочтительным растворителем является ацетонитрил. В качестве вспомогательного основания пригодны третичные алкиламины, пиридин или карбонаты щелочных металлов, которые применяют предпочтительно в эквимолярном количестве или с избытком, до четырехкратного. Предпочтительным вспомогательным основанием является триэтиламин в удвоенном количестве. В качестве катализаторов приемлемы среди прочих цианидовые соединения, такие, как цианид калия или ацетонциангидрин, предпочтительно в количестве от 1 до 50 мол.%, прежде всего от 5 до 20 мол.% в пересчете на 5-гидроксипиразоловый эфир. Целесообразно применять ацетонциангидрин, например, в количестве 10 мол.%. Примеры перегруппировки бензойнокислотных эфиров 5-гидроксипиразолов можно найти, например, в европейской заявке EP-A 282944 или в патенте США 4643757, однако в качестве катализатора в этих публикациях применяют только лишь карбонат калия либо карбонат натрия в диоксане. Применение цианида калия или ацетонциангидрина в связи с проведением аналогичной перегруппировки енольных эфиров циклогексан-1,3-дионов хотя и известно (см. патент США 4695673), тем не менее в литературе нет примеров, подтверждающих, что цианидовые соединения особенно пригодны для осуществления перегруппировки по Фрису O-ацильных производных 5-гидроксипиразола. Переработку осуществляют по известной методике. Так, например, реакционную смесь подкисляют разбавленными минеральными кислотами, такими, как 5%-ная соляная кислота или серная кислота, и экстрагируют, например, метиленхлоридом или этиловым эфиром уксусной кислоты. Для очистки экстракт экстрагируют холодным 5-10%-ным раствором карбоната щелочного металла, причем конечный продукт переходит в водную фазу. Подкислением водного раствора продукт формулы I осаждают или его повторно экстрагируют метиленхлоридом, сушат и затем удаляют из него растворитель. Используемые в качестве исходного материала 5-гидроксипиразолы формулы II известны и могут быть получены по известным способам (ср. европейскую заявку EP-A 240001 и Journ. Prakt. Chem. 315, 382 (1973)). 1,3-диметил-5-гидроксипиразол является коммерчески доступным соединением. Исходные вещества формулы IV получают по известной методике взаимодействием сахаринкарбоновой кислоты формулы III с тионилхлоридом. В вышеприведенных формулах L, M и Z имеют указанное выше значение. Первую стадию последовательного проведения реакции, т. е. ацилирование, осуществляют по общеизвестной методике, например, добавлением хлорангидрида кислоты формулы IV к раствору или суспензии 5-гидроксипиразола II в присутствии вспомогательного основания. Реагенты и вспомогательное основание при этом целесообразно применять приблизительно в эквимолярных количествах. Небольшой избыток вспомогательного основания, например, 1,2-1,5 мол. эквивалента в пересчете на количество соединений II, при определенных обстоятельствах может оказаться предпочтительным. В качестве вспомогательного основания пригодны, например, третичные алкиламины, пиридин или карбонаты щелочных металлов, а в качестве растворителей могут использоваться, например, метиленхлорид, диэтиловый эфир, толуол или этиловый эфир уксусной кислоты. При введении добавок хлорангидрида кислоты реакционную смесь предпочтительно охлаждать до 0-10oC, после чего перемешивать ее при повышенной температуре, например, в диапазоне от 25 до 50oC, до завершения обменной реакции. Переработку осуществляют по обычной методике, например, реакционную смесь сливают в воду и требуемый продукт экстрагируют, например, метиленхлоридом. После сушки органической фазы и удаления растворителя сырой 5-гидроксипиразоловый эфир можно без последующей очистки использовать для перегруппировки. Примеры получения эфиров бензойной кислоты 5-гидроксипиразолов можно найти, например, в европейской заявке EP-A 282944 или в патенте США 4643757. Перегруппировку 5-гидроксипиразоловых эфиров до соединений формулы I.1 целесообразно проводить при температурах в интервале от 20 до 40oC в растворителе и в присутствии вспомогательного основания, а также с помощью цианосоединения, служащего катализатором. В качестве растворителей могут использоваться, например, ацетонитрил, метиленхлорид, 1,2-дихлорэтан, этиловый эфир уксусной кислоты или толуол. Предпочтительным растворителем является ацетонитрил. В качестве вспомогательного основания пригодны третичные алкиламины, пиридин или карбонаты щелочных металлов, которые применяют предпочтительно в эквимолярном количестве или с избытком, до четырехкратного. Предпочтительным вспомогательным основанием является триэтиламин в удвоенном количестве. В качестве катализаторов приемлемы среди прочих цианидовые соединения, такие, как цианид калия или ацетонциангидрин, предпочтительно в количестве от 1 до 50 мол.%, прежде всего от 5 до 20 мол.% в пересчете на 5-гидроксипиразоловый эфир. Целесообразно применять ацетонциангидрин, например, в количестве 10 мол.%. Примеры перегруппировки бензойнокислотных эфиров 5-гидроксипиразолов можно найти, например, в европейской заявке EP-A 282944 или в патенте США 4643757, однако в качестве катализатора в этих публикациях применяют только лишь карбонат калия либо карбонат натрия в диоксане. Применение цианида калия или ацетонциангидрина в связи с проведением аналогичной перегруппировки енольных эфиров циклогексан-1,3-дионов хотя и известно (см. патент США 4695673), тем не менее в литературе нет примеров, подтверждающих, что цианидовые соединения особенно пригодны для осуществления перегруппировки по Фрису O-ацильных производных 5-гидроксипиразола. Переработку осуществляют по известной методике. Так, например, реакционную смесь подкисляют разбавленными минеральными кислотами, такими, как 5%-ная соляная кислота или серная кислота, и экстрагируют, например, метиленхлоридом или этиловым эфиром уксусной кислоты. Для очистки экстракт экстрагируют холодным 5-10%-ным раствором карбоната щелочного металла, причем конечный продукт переходит в водную фазу. Подкислением водного раствора продукт формулы I осаждают или его повторно экстрагируют метиленхлоридом, сушат и затем удаляют из него растворитель. Используемые в качестве исходного материала 5-гидроксипиразолы формулы II известны и могут быть получены по известным способам (ср. европейскую заявку EP-A 240001 и Journ. Prakt. Chem. 315, 382 (1973)). 1,3-диметил-5-гидроксипиразол является коммерчески доступным соединением. Исходные вещества формулы IV получают по известной методике взаимодействием сахаринкарбоновой кислоты формулы III с тионилхлоридом. 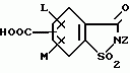 Сахаринкарбоновые кислоты III частично известны (4-COOH: Zincke, Liebigs Ann. 427. 231 (1922), 5-COOH: Jacobsen, Chem. Ber. 13, 1554 (1980), 6-COOH: Weber, Chem. Ber. 25, 1740 (1982)). Далее, в выложенной заявке Германии DE-OS 3607343 описано получение 4-хлорсахарин-5-карбоновой кислоты. Возможность получения сахаринкарбоновых кислот состоит также в том, что соответствующие бром- либо иодзамещенные производные сахарина формулы A1 Сахаринкарбоновые кислоты III частично известны (4-COOH: Zincke, Liebigs Ann. 427. 231 (1922), 5-COOH: Jacobsen, Chem. Ber. 13, 1554 (1980), 6-COOH: Weber, Chem. Ber. 25, 1740 (1982)). Далее, в выложенной заявке Германии DE-OS 3607343 описано получение 4-хлорсахарин-5-карбоновой кислоты. Возможность получения сахаринкарбоновых кислот состоит также в том, что соответствующие бром- либо иодзамещенные производные сахарина формулы A1 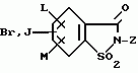 в которой L, M и Z имеют указанное выше значение, или, если Z не означает H, соединения формулы A2 в которой L, M и Z имеют указанное выше значение, или, если Z не означает H, соединения формулы A2 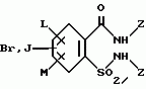 в присутствии катализатора на основе переходного металла из группы, включающей палладий, никель, кобальт или родий, и основания подвергают взаимодействию с моноокисью углерода и водой, соответственно с C1-C6спиртом при повышенном давлении. Иодсахарины уже известны из литературы, в частности 6-иодсахарин: см. De Roode, Amer. Chem. Journal 13, 231 (1981). Их можно получить либо перманганатным окислением иодзамещенных 2-метилбензолсульфонамидов, либо по реакции Зандмейера из аминосахаринов. Аминосахарины получают по известной методике путем восстановления нитросахаридов, которые в свою очередь либо известны (см. Kastle, Amer. Chem. Journal 11, 184 (1989) или DRP 551423 (1930)), либо могут быть синтезированы по известным из публикаций методам из соответствующих производных нитробензола (см. Liebigs Ann. 669, 85 (1963)) или нитробензолсульфонамидов. В случае, если, например, L означает метил, а M и Z означают водород, последовательность проведения реакции может быть представлена в следующем виде: в присутствии катализатора на основе переходного металла из группы, включающей палладий, никель, кобальт или родий, и основания подвергают взаимодействию с моноокисью углерода и водой, соответственно с C1-C6спиртом при повышенном давлении. Иодсахарины уже известны из литературы, в частности 6-иодсахарин: см. De Roode, Amer. Chem. Journal 13, 231 (1981). Их можно получить либо перманганатным окислением иодзамещенных 2-метилбензолсульфонамидов, либо по реакции Зандмейера из аминосахаринов. Аминосахарины получают по известной методике путем восстановления нитросахаридов, которые в свою очередь либо известны (см. Kastle, Amer. Chem. Journal 11, 184 (1989) или DRP 551423 (1930)), либо могут быть синтезированы по известным из публикаций методам из соответствующих производных нитробензола (см. Liebigs Ann. 669, 85 (1963)) или нитробензолсульфонамидов. В случае, если, например, L означает метил, а M и Z означают водород, последовательность проведения реакции может быть представлена в следующем виде:  Никелевые, кобальтовые, родиевые и прежде всего палладиевые катализаторы могут быть представлены в металлической форме либо в форме обычных солей, таких, как галогеновые соединения, например, PdCl2, RhCl3 Никелевые, кобальтовые, родиевые и прежде всего палладиевые катализаторы могут быть представлены в металлической форме либо в форме обычных солей, таких, как галогеновые соединения, например, PdCl2, RhCl3 H2O, ацетатов, например, Pd(OAc)2, цианидов и т.д., с известной степенью валентности. Далее могут быть представлены металлокомплексы с третичными фосфинами, алкилкарбонилы металлов, карбонилы металлов, например, CO2(CO)8, Ni(CO)4, металлокарбонильные комплексы с третичными фосфинами, например, (PPh3)2Ni(CO)2, или соли переходных металлов, образующие комплексы с третичными фосфинами. Этот последний вариант выполнения особенно предпочтителен в случае палладиевого катализатора. При этом тип фосфиновых лигандов может варьироваться в широких пределах. Их можно представить, например, в виде следующих формул: H2O, ацетатов, например, Pd(OAc)2, цианидов и т.д., с известной степенью валентности. Далее могут быть представлены металлокомплексы с третичными фосфинами, алкилкарбонилы металлов, карбонилы металлов, например, CO2(CO)8, Ni(CO)4, металлокарбонильные комплексы с третичными фосфинами, например, (PPh3)2Ni(CO)2, или соли переходных металлов, образующие комплексы с третичными фосфинами. Этот последний вариант выполнения особенно предпочтителен в случае палладиевого катализатора. При этом тип фосфиновых лигандов может варьироваться в широких пределах. Их можно представить, например, в виде следующих формул: 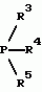 или или 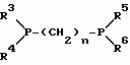 где n означает числа 1, 2, 3 или 4, а радикалы R3-R6 представляют собой низкомолекулярный алкил, например, C1-C6алкил, арил, C1-C4алкиларил, например, бензил или фенетил, или же арилокси. Арил представляет собой, например, нафтил, антрил и предпочтительно необязательно замещенный фенил, причем касательно заместителей следует учитывать лишь их инертность по отношению к реакции карбоксилирования, в остальном их можно варьировать в широких пределах и они включают все инертные C-органические радикалы, такие, как C1-C6алкильные радикалы, например, метил, карбоксильные радикалы, такие, как COOH, COOM (M представляет собой, например, соль щелочного, щелочноземельного металла или аммониевую соль), или же C-органические радикалы, связанные через кислород, такие, как C1-C6алкокси. Получение фосфиновых комплексов может осуществляться по известной методике, например, так, как это описано в указанных выше публикациях. Так, например, исходят из обычных, коммерчески доступных солей металлов, таких, как PdCl2 или Pd(OCOCH3)2, и добавляют фосфин, например, P(C6H5)3, P(н-C4H9)3, PCH3(C6H5)2, 1,2-бис(дифенилфосфино)этан. Количество фосфина по отношению к переходному металлу составляет обычно 0-20, прежде всего 0,1-10 мол. эквивалентов, особенно предпочтительно 1-5 мол.эквивалентов. Количество переходного металла не является решающим фактором. Естественно при этом, что по соображениям экономичности предпочитают использовать небольшое количество, например, от 0,1 до 10 мол.%, прежде всего от 1 до 5 мол% в пересчете на исходное соединение A1, соответственно A2. Для получения сахаринкарбоновых кислот формулы III осуществляют взаимодействие с моноокисью углерода и по меньшей мере эквимолярными количествами воды в пересчете на исходные соединения A1, соответственно A2. Реакционный компонент вода может служить одновременно также растворителем, иными словами, ее максимальное количество не играет решающей роли. В зависимости от типа исходных веществ и применяемого катализатора может оказаться также целесообразным использовать вместо вышеназванного реакционного компонента какой-либо другой инертный растворитель или же использовать в качестве растворителя основание, которое применяют для карбоксилирования. В качестве инертных растворителей приемлемы таковые, обычно используемые для реакций карбоксилирования, в частности углеводороды, например, толуол, ксилол, гексан, пентан, циклогексан, простые эфиры, такие, как метил-трет-бутиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан, замещенные амиды, такие, как диметилформамид, перзамещенные мочевины, такие, как тетра-C1-C4алкилмочевины, или нитрилы, такие, как бензонитрил или ацетонитрил. В одном из предпочтительных вариантов осуществления способа один из реакционных компонентов, прежде всего основание, применяют в избытке, вследствие чего отпадает необходимость в дополнительномм растворителе. Пригодными для осуществления способа основаниями являются основания, способные связывать высвобождающийся во время реакции йодистый водород, соответственно бромистый водород. В качестве примеров можно назвать в этой связи третичные амины, такие, как триэтиламин, циклические амины, такие, как N-метилпиперидин или N,N"-диметилпиперазин, пиридин, гидроксиды, карбонаты либо гидрокарбонаты щелочных или щелочноземельных металлов, или тетраалкилзамещенные производные мочевины, такие, как тетра-C1-C4алкилмочевина, например, тетраметилмочевина. Количество основания не является решающим фактором, обычно применяют от 1 до 10, прежде всего от 1 до 5 молей. При одновременном использовании основания в качестве растворителя его количество выбирают таким образом, чтобы компоненты реакции были растворены, причем по соображениям практичности избегают без необходимости больших избытков в целях экономии средств, а также для обеспечения возможности использовать небольшие реакционные сосуды и условий для максимального контакта между реакционными компонентами. Во время реакции давление моноокиси углерода устанавливают так, чтобы обеспечить постоянный избыток CO по отношению к соединениям A1, соответственно A2. Предпочтительно давление моноокиси углерода при комнатной температуре составляет от 1 до 250 бар, прежде всего от 5 до 150 бар CO. Карбонилирование проводят, как правило, при температурах в интервале от 20 до 250oC, прежде всего от 30 до 150, непрерывно либо по полунепрерывному механизму. При работе в периодическом режиме для поддержания постоянного давления целесообразно моноокись углерода непрерывно подавать на реакционную смесь. Из получаемой реакционной смеси продукты могут быть выделены по обычной методике, например, путем перегонки. Необходимые для осуществления реакции исходные вещества формул A1, соответственно A2 известны либо могут быть получены по известной методике, например, так, как это описано в приведенном выше уровне техники. Кроме того, их можно получить аналогично рекомендациям в примерах 1-12. С учетом целевого применения предпочтительны такие производные сахарина формулы I, в которой радикалы L, соответственно M означают водород, метил, метокси, метилтио, хлор, циано, метилсульфонил, нитро или трифторметил. Предпочтительными значениями L, соответственно M являются далее водород, C1-C4алкил и хлор. К предпочтительным относятся далее такие соединения формулы I, где L и M означают водород либо один из радикалов L, соответственно M означает водород, а другой представляет собой метил или хлор. Радикал R1 в формуле I означает предпочтительно метил, a R2 означает предпочтительно водород или метил. Радикал Z представляет собой особенно предпочтительно один из вышеназванных органических радикалов, прежде всего метил, этил, пропаргил, ацетил или фенил. Наиболее предпочтительные действующие вещества представлены в таблице 1. Указанные в таблице 1 для одного заместителя группы представляют собой, кроме того, сами по себе - независимо от специального сочетания с другими заместителями, в котором они представлены, - особенно предпочтительные значения соответствующего заместителя. Соединения формулы I могут быть представлены в виде их приемлемых для использования в сельском хозяйстве солей, причем это в принципе не зависит от типа соли. Обычно применяют соли таких оснований, которые не оказывают отрицательного воздействия на гербицидную эффективность соединений I. В качестве основных солей пригодны прежде всего таковые щелочных металлов, предпочтительно соли натрия и калия, щелочноземельных металлов, предпочтительно соли кальция, магния и бария, и переходных металлов, предпочтительно соли марганца, меди, цинка и железа, а также аммониевые соли, которые могут нести от одного до трех C1-C4алкильных, гидрокси-C1-C4алкильных заместителей и/или один фенильный либо бензильный заместитель, предпочтительно соли диизопропиламмония, тетраметиламмония, тетрабутиламмония, триметилбензиламмония и триметил(2-гидрокси-этил)аммония, соли фосфония, соли сульфония, предпочтительно соли три(C1-C4)алкилсульфония, и соли сульфоксония, предпочтительно три(C1-C4)алкилсульфоксония. Соединения формулы I, содержащие эти соединения гербицидцые препараты, равно как и их экологически приемлемые соли, например, щелочных и щелочноземельных металлов или аммиака и аминов, соответственно содержащие эти соли гербицидные препараты могут с высокой эффективностью применяться для борьбы с сорняками и вредоносными растениями в таких культурах, как пшеница, рис, кукуруза, соя и хлопчатник, практически не повреждая при этом культурные растения. Такого эффекта достигают прежде всего при низких нормах расхода. С учетом многообразия методов обработки соединения формулы I, соответственно содержащие их препараты могут применяться для борьбы с нежелательной растительностью также в целом ряде других полезных растений. Среди таковых можно назвать следующие культуры: Allium сера, Ananas comosus, Arachis hypogaea, Asparagus officinalis, Beta vulgaris spp. altissima. Beta vulgaris spp. rapa, Brassica napus var. napus, Brassica napus var. napobrassica, Brassica rapa var. silvestris, Camellia sinensis, Carthamus tinctorius, Carya illinoinensis, Citrus limon, Citrus sinensis, Coffea arabica (Coffea canephora, Coffea liberica), Cucumis sativus, Cynodon dactylon, Daucus carota, Elaeis guineensis, Fragaria vesca, Glycine max, Gossypium hirsutum, (Gossypium arboreum, Gossypium herbaceum, Gossypium vitifolium), Helianthus annuus, Hevea brasiliensis, Hordeum vulgare, Humulus lupulus, Ipomoea batatas, Juglans regia, Lens culinaris, Linum usitatissimum, Lycopersicon lycopersicum, Malus spp., Manihot esculenta, Medicago sativa, Musa spp., Nicotiana tabacum (N. rustica), Olea europaea, Oryza sativa, Phaseolus lunatus, Phaseolus vulgaris, Picea abies, Pinus spp., Pisum sativum, Prunus avium, Prunus persica, Pyrus communis, Ribes sylvestre, Ricinus communis, Saccharum officinarum, Secale cereale, Solanum tuberosum, Sorghum bicolor (S. vulgare), Theobroma cacao, Trifolium pratense, Triticum aestivum, Triticum durum, Vicia faba, Vitis vinifera и Zea mays. Кроме того, соединения формулы I могут применяться также в культурах, которые благодаря методам селекции и/или генной инженерии приобрели значительную устойчивость к действию соединений 1 или к другим гербицидам. Действующие вещества, соответственно гербицидные препараты могут применяться в методах как предвсходовой, так и послевсходовой обработки. Если действующие вещества обладают недостаточной совместимостью с некоторыми культурными растениями, то рекомендуется применять такую технологию обработки, при которой гербицидные препараты следует распылять с помощью опрыскивателей так, чтобы они по возможности не попадали на листья чувствительных культур, а были направлены на листья растущих среди них нежелательных растений или на открытые участки почвы (способ направленного опрыскивания, способ ленточного опрыскивания). Соединения формулы I, соответственно содержащие их гербицидные препараты могут применяться, например, в виде предназначенных для непосредственного опрыскивания водных растворов, порошков, суспензий, в том числе высококонцентрированных водных, масляных или каких-либо других суспензий, или дисперсий, эмульсий, масляных дисперсий, паст, препаратов для опыливания, препаратов для опудривания или гранулятов, которые используют для обработки самыми разными методами, такими, как опрыскивание, обработка в виде туманов, опыливание, опудривание или полив. Методика обработки и используемые формы зависят от целей применения, но во всех случаях должно быть обеспечено максимально тонкое и равномерное распределение действующих веществ по изобретению. В качестве инертных вспомогательных агентов для приготовления предназначенных для непосредственного опрыскивания растворов, эмульсий, паст или масляных дисперсий могут рассматриваться в основном следующие: фракции нефтяного топлива с температурой кипения от средней до высокой, такие, как керосин и дизельное топливо, далее каменноугольное масло, а также масла растительного или животного происхождения, алифатические, циклические и ароматические углеводороды, например, парафины, тетрагидронафталин, алкилированные нафталины либо их производные, алкилированные бензолы и их производные, спирты, такие, как метанол, этанол, пропанол, бутанол и циклогексанол, кетоны, такие, как циклогексанон, сильно полярные растворители, например, амины, такие, как N-метилпирролидон, или вода. Водные формы применения могут приготавливаться из эмульсионных концентратов, суспензий, паст, смачивающихся порошков или диспергируемых в воде гранулятов добавлением воды. Для приготовления эмульсий, паст или масляных дисперсий субстраты как таковые либо после их растворения в масле или растворителе можно с помощью смачивателей, адгезивов, диспергаторов или эмульгаторов гомогенизировать в воде. Возможно также из действующего вещества, смачивателей, адгезивов, диспергаторов или эмульгаторов и необязательно растворителей или масла получать концентраты, пригодные для разбавления водой. В качестве поверхностно-активных веществ могут использоваться соли щелочных и щелочноземельных металлов и аммониевые соли ароматических сульфокислот, например, лигнин-, фенол-, нафталин- и дибутилнафталинсульфокислоты, а также соли жирных кислот, алкил- и алкиларилсульфонаты, алкилсульфаты, сульфаты лаурилового эфира и жирных спиртов и соли сульфатированных гекса-, гепта- и октадеканолов, а также гликолевых эфиров жирных спиртов, продукты конденсации сульфированного нафталина и его производных с формальдегидом, продукты конденсации нафталина, соответственно нафталинсульфокислот с фенолом и формальдегидом, полиоксиэтиленоктилфеноловый эфир, этоксилированный изооктил-, октил- или нонилфенол, полигликолевые эфиры алкилфенила и трибутилфенила, алкилариловые полиэфиры спиртов, изотридециловый спирт, конденсаты этиленоксида и жирных спиртов, этоксилированное касторовое масло, полиоксиэтилен- или полиоксипропиленалкиловые эфиры, ацетат эфира лаурилового спирта и полигликоля, сложные эфиры сорбита, отработанный лигнинсульфитный щелок или метилцеллюлоза. Порошковые препараты, препараты для опыливания и опудривания могут приготавливаться путем смешения или совместного измельчения действующих веществ с каким-либо твердым наполнителем. Грануляты, например, грануляты в оболочке, импрегнированные грануляты и гомогенные грануляты могут быть получены за счет связывания действующих веществ с твердыми наполнителями. В качестве таковых могут служить минеральные земли, в частности кремниевые кислоты, силикагели, силикаты, тальк, каолин, известняк, известь, мел, болюс, лесс, глина, доломит, диатомовая земля, сульфат кальция и магния, оксид магния, измельченные синтетические материалы, удобрения, такие, как сульфат аммония, фосфат аммония, нитрат аммония, мочевины и растительные продукты, такие, как мука зерновых, мука из коры деревьев, древесная мука и мука из ореховой скорлупы, целлюлозные порошки или какие-либо другие твердые наполнители. Концентрация действующих веществ в композициях может варьироваться в широких пределах, в основном от 0,01 до 95 мас.%, предпочтительно от 0,5 до 90 мас.%. Действующие вещества применяют при этом со степенью чистоты от 90% до 100%, предпочтительно от 95% до 100% (согласно ЯМР-спектру). Соединения формул Ia, соответственно Ia" согласно изобретению могут использоваться, например, для приготовления следующих композиций: I. 20 мас.частей соединения N 1.08 растворяют в смеси, состоящей из 80 мас. частей алкилированного бензола, 10 мас.частей продукта присоединения 8-10 молей этиленоксида к 1 молю N-моноэтаноламида олеиновой кислоты, 5 мас. частей кальциевой соли додецилбензолсульфокислоты и 5 мас.частей продукта присоединения 40 молей этиленоксида к 1 молю касторового масла. После декантирования и тонкого равномерного распределения раствора в 100000 мас.частях воды получают водную дисперсию, содержащую 0,02 мас.% действующего вещества. II. 20 мас.частей соединения N 1.08 растворяют в смеси, состоящей из 40 мас.частей циклогексанона, 30 мас.частей изобутанола, 20 мас.частей продукта присоединения 7 молей этиленоксида к 1 молю изооктилфенола и 10 мас.частей продукта присоединения 40 молей этиленоксида к 1 молю касторового масла. После декантирования и тонкого равномерного распределения раствора в 100000 мас. частях воды получают водную дисперсию, содержащую 0,02 мас.% действующего вещества. III. 20 мас. частей действующего вещества N 1.08 растворяют в смеси, состоящей из 25 мас. частей циклогексанона, 65 мас.частей получаемой при перегонке нефти фракции нефтяного топлива с температурой кипения 210-280oC и 10 мас. частей продукта присоединения 40 молей этиленоксида к 1 молю касторового масла. После декантирования и тонкого равномерного распределения раствора в 100000 мас.частях воды получают водную дисперсию, содержащую 0,02 мас.% действующего вещества. IV. 20 мас.частей действующего вещества N 1.08 тщательно перемешивают с 3 мас. частями натриевой соли диизобутилнафталин- где n означает числа 1, 2, 3 или 4, а радикалы R3-R6 представляют собой низкомолекулярный алкил, например, C1-C6алкил, арил, C1-C4алкиларил, например, бензил или фенетил, или же арилокси. Арил представляет собой, например, нафтил, антрил и предпочтительно необязательно замещенный фенил, причем касательно заместителей следует учитывать лишь их инертность по отношению к реакции карбоксилирования, в остальном их можно варьировать в широких пределах и они включают все инертные C-органические радикалы, такие, как C1-C6алкильные радикалы, например, метил, карбоксильные радикалы, такие, как COOH, COOM (M представляет собой, например, соль щелочного, щелочноземельного металла или аммониевую соль), или же C-органические радикалы, связанные через кислород, такие, как C1-C6алкокси. Получение фосфиновых комплексов может осуществляться по известной методике, например, так, как это описано в указанных выше публикациях. Так, например, исходят из обычных, коммерчески доступных солей металлов, таких, как PdCl2 или Pd(OCOCH3)2, и добавляют фосфин, например, P(C6H5)3, P(н-C4H9)3, PCH3(C6H5)2, 1,2-бис(дифенилфосфино)этан. Количество фосфина по отношению к переходному металлу составляет обычно 0-20, прежде всего 0,1-10 мол. эквивалентов, особенно предпочтительно 1-5 мол.эквивалентов. Количество переходного металла не является решающим фактором. Естественно при этом, что по соображениям экономичности предпочитают использовать небольшое количество, например, от 0,1 до 10 мол.%, прежде всего от 1 до 5 мол% в пересчете на исходное соединение A1, соответственно A2. Для получения сахаринкарбоновых кислот формулы III осуществляют взаимодействие с моноокисью углерода и по меньшей мере эквимолярными количествами воды в пересчете на исходные соединения A1, соответственно A2. Реакционный компонент вода может служить одновременно также растворителем, иными словами, ее максимальное количество не играет решающей роли. В зависимости от типа исходных веществ и применяемого катализатора может оказаться также целесообразным использовать вместо вышеназванного реакционного компонента какой-либо другой инертный растворитель или же использовать в качестве растворителя основание, которое применяют для карбоксилирования. В качестве инертных растворителей приемлемы таковые, обычно используемые для реакций карбоксилирования, в частности углеводороды, например, толуол, ксилол, гексан, пентан, циклогексан, простые эфиры, такие, как метил-трет-бутиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан, замещенные амиды, такие, как диметилформамид, перзамещенные мочевины, такие, как тетра-C1-C4алкилмочевины, или нитрилы, такие, как бензонитрил или ацетонитрил. В одном из предпочтительных вариантов осуществления способа один из реакционных компонентов, прежде всего основание, применяют в избытке, вследствие чего отпадает необходимость в дополнительномм растворителе. Пригодными для осуществления способа основаниями являются основания, способные связывать высвобождающийся во время реакции йодистый водород, соответственно бромистый водород. В качестве примеров можно назвать в этой связи третичные амины, такие, как триэтиламин, циклические амины, такие, как N-метилпиперидин или N,N"-диметилпиперазин, пиридин, гидроксиды, карбонаты либо гидрокарбонаты щелочных или щелочноземельных металлов, или тетраалкилзамещенные производные мочевины, такие, как тетра-C1-C4алкилмочевина, например, тетраметилмочевина. Количество основания не является решающим фактором, обычно применяют от 1 до 10, прежде всего от 1 до 5 молей. При одновременном использовании основания в качестве растворителя его количество выбирают таким образом, чтобы компоненты реакции были растворены, причем по соображениям практичности избегают без необходимости больших избытков в целях экономии средств, а также для обеспечения возможности использовать небольшие реакционные сосуды и условий для максимального контакта между реакционными компонентами. Во время реакции давление моноокиси углерода устанавливают так, чтобы обеспечить постоянный избыток CO по отношению к соединениям A1, соответственно A2. Предпочтительно давление моноокиси углерода при комнатной температуре составляет от 1 до 250 бар, прежде всего от 5 до 150 бар CO. Карбонилирование проводят, как правило, при температурах в интервале от 20 до 250oC, прежде всего от 30 до 150, непрерывно либо по полунепрерывному механизму. При работе в периодическом режиме для поддержания постоянного давления целесообразно моноокись углерода непрерывно подавать на реакционную смесь. Из получаемой реакционной смеси продукты могут быть выделены по обычной методике, например, путем перегонки. Необходимые для осуществления реакции исходные вещества формул A1, соответственно A2 известны либо могут быть получены по известной методике, например, так, как это описано в приведенном выше уровне техники. Кроме того, их можно получить аналогично рекомендациям в примерах 1-12. С учетом целевого применения предпочтительны такие производные сахарина формулы I, в которой радикалы L, соответственно M означают водород, метил, метокси, метилтио, хлор, циано, метилсульфонил, нитро или трифторметил. Предпочтительными значениями L, соответственно M являются далее водород, C1-C4алкил и хлор. К предпочтительным относятся далее такие соединения формулы I, где L и M означают водород либо один из радикалов L, соответственно M означает водород, а другой представляет собой метил или хлор. Радикал R1 в формуле I означает предпочтительно метил, a R2 означает предпочтительно водород или метил. Радикал Z представляет собой особенно предпочтительно один из вышеназванных органических радикалов, прежде всего метил, этил, пропаргил, ацетил или фенил. Наиболее предпочтительные действующие вещества представлены в таблице 1. Указанные в таблице 1 для одного заместителя группы представляют собой, кроме того, сами по себе - независимо от специального сочетания с другими заместителями, в котором они представлены, - особенно предпочтительные значения соответствующего заместителя. Соединения формулы I могут быть представлены в виде их приемлемых для использования в сельском хозяйстве солей, причем это в принципе не зависит от типа соли. Обычно применяют соли таких оснований, которые не оказывают отрицательного воздействия на гербицидную эффективность соединений I. В качестве основных солей пригодны прежде всего таковые щелочных металлов, предпочтительно соли натрия и калия, щелочноземельных металлов, предпочтительно соли кальция, магния и бария, и переходных металлов, предпочтительно соли марганца, меди, цинка и железа, а также аммониевые соли, которые могут нести от одного до трех C1-C4алкильных, гидрокси-C1-C4алкильных заместителей и/или один фенильный либо бензильный заместитель, предпочтительно соли диизопропиламмония, тетраметиламмония, тетрабутиламмония, триметилбензиламмония и триметил(2-гидрокси-этил)аммония, соли фосфония, соли сульфония, предпочтительно соли три(C1-C4)алкилсульфония, и соли сульфоксония, предпочтительно три(C1-C4)алкилсульфоксония. Соединения формулы I, содержащие эти соединения гербицидцые препараты, равно как и их экологически приемлемые соли, например, щелочных и щелочноземельных металлов или аммиака и аминов, соответственно содержащие эти соли гербицидные препараты могут с высокой эффективностью применяться для борьбы с сорняками и вредоносными растениями в таких культурах, как пшеница, рис, кукуруза, соя и хлопчатник, практически не повреждая при этом культурные растения. Такого эффекта достигают прежде всего при низких нормах расхода. С учетом многообразия методов обработки соединения формулы I, соответственно содержащие их препараты могут применяться для борьбы с нежелательной растительностью также в целом ряде других полезных растений. Среди таковых можно назвать следующие культуры: Allium сера, Ananas comosus, Arachis hypogaea, Asparagus officinalis, Beta vulgaris spp. altissima. Beta vulgaris spp. rapa, Brassica napus var. napus, Brassica napus var. napobrassica, Brassica rapa var. silvestris, Camellia sinensis, Carthamus tinctorius, Carya illinoinensis, Citrus limon, Citrus sinensis, Coffea arabica (Coffea canephora, Coffea liberica), Cucumis sativus, Cynodon dactylon, Daucus carota, Elaeis guineensis, Fragaria vesca, Glycine max, Gossypium hirsutum, (Gossypium arboreum, Gossypium herbaceum, Gossypium vitifolium), Helianthus annuus, Hevea brasiliensis, Hordeum vulgare, Humulus lupulus, Ipomoea batatas, Juglans regia, Lens culinaris, Linum usitatissimum, Lycopersicon lycopersicum, Malus spp., Manihot esculenta, Medicago sativa, Musa spp., Nicotiana tabacum (N. rustica), Olea europaea, Oryza sativa, Phaseolus lunatus, Phaseolus vulgaris, Picea abies, Pinus spp., Pisum sativum, Prunus avium, Prunus persica, Pyrus communis, Ribes sylvestre, Ricinus communis, Saccharum officinarum, Secale cereale, Solanum tuberosum, Sorghum bicolor (S. vulgare), Theobroma cacao, Trifolium pratense, Triticum aestivum, Triticum durum, Vicia faba, Vitis vinifera и Zea mays. Кроме того, соединения формулы I могут применяться также в культурах, которые благодаря методам селекции и/или генной инженерии приобрели значительную устойчивость к действию соединений 1 или к другим гербицидам. Действующие вещества, соответственно гербицидные препараты могут применяться в методах как предвсходовой, так и послевсходовой обработки. Если действующие вещества обладают недостаточной совместимостью с некоторыми культурными растениями, то рекомендуется применять такую технологию обработки, при которой гербицидные препараты следует распылять с помощью опрыскивателей так, чтобы они по возможности не попадали на листья чувствительных культур, а были направлены на листья растущих среди них нежелательных растений или на открытые участки почвы (способ направленного опрыскивания, способ ленточного опрыскивания). Соединения формулы I, соответственно содержащие их гербицидные препараты могут применяться, например, в виде предназначенных для непосредственного опрыскивания водных растворов, порошков, суспензий, в том числе высококонцентрированных водных, масляных или каких-либо других суспензий, или дисперсий, эмульсий, масляных дисперсий, паст, препаратов для опыливания, препаратов для опудривания или гранулятов, которые используют для обработки самыми разными методами, такими, как опрыскивание, обработка в виде туманов, опыливание, опудривание или полив. Методика обработки и используемые формы зависят от целей применения, но во всех случаях должно быть обеспечено максимально тонкое и равномерное распределение действующих веществ по изобретению. В качестве инертных вспомогательных агентов для приготовления предназначенных для непосредственного опрыскивания растворов, эмульсий, паст или масляных дисперсий могут рассматриваться в основном следующие: фракции нефтяного топлива с температурой кипения от средней до высокой, такие, как керосин и дизельное топливо, далее каменноугольное масло, а также масла растительного или животного происхождения, алифатические, циклические и ароматические углеводороды, например, парафины, тетрагидронафталин, алкилированные нафталины либо их производные, алкилированные бензолы и их производные, спирты, такие, как метанол, этанол, пропанол, бутанол и циклогексанол, кетоны, такие, как циклогексанон, сильно полярные растворители, например, амины, такие, как N-метилпирролидон, или вода. Водные формы применения могут приготавливаться из эмульсионных концентратов, суспензий, паст, смачивающихся порошков или диспергируемых в воде гранулятов добавлением воды. Для приготовления эмульсий, паст или масляных дисперсий субстраты как таковые либо после их растворения в масле или растворителе можно с помощью смачивателей, адгезивов, диспергаторов или эмульгаторов гомогенизировать в воде. Возможно также из действующего вещества, смачивателей, адгезивов, диспергаторов или эмульгаторов и необязательно растворителей или масла получать концентраты, пригодные для разбавления водой. В качестве поверхностно-активных веществ могут использоваться соли щелочных и щелочноземельных металлов и аммониевые соли ароматических сульфокислот, например, лигнин-, фенол-, нафталин- и дибутилнафталинсульфокислоты, а также соли жирных кислот, алкил- и алкиларилсульфонаты, алкилсульфаты, сульфаты лаурилового эфира и жирных спиртов и соли сульфатированных гекса-, гепта- и октадеканолов, а также гликолевых эфиров жирных спиртов, продукты конденсации сульфированного нафталина и его производных с формальдегидом, продукты конденсации нафталина, соответственно нафталинсульфокислот с фенолом и формальдегидом, полиоксиэтиленоктилфеноловый эфир, этоксилированный изооктил-, октил- или нонилфенол, полигликолевые эфиры алкилфенила и трибутилфенила, алкилариловые полиэфиры спиртов, изотридециловый спирт, конденсаты этиленоксида и жирных спиртов, этоксилированное касторовое масло, полиоксиэтилен- или полиоксипропиленалкиловые эфиры, ацетат эфира лаурилового спирта и полигликоля, сложные эфиры сорбита, отработанный лигнинсульфитный щелок или метилцеллюлоза. Порошковые препараты, препараты для опыливания и опудривания могут приготавливаться путем смешения или совместного измельчения действующих веществ с каким-либо твердым наполнителем. Грануляты, например, грануляты в оболочке, импрегнированные грануляты и гомогенные грануляты могут быть получены за счет связывания действующих веществ с твердыми наполнителями. В качестве таковых могут служить минеральные земли, в частности кремниевые кислоты, силикагели, силикаты, тальк, каолин, известняк, известь, мел, болюс, лесс, глина, доломит, диатомовая земля, сульфат кальция и магния, оксид магния, измельченные синтетические материалы, удобрения, такие, как сульфат аммония, фосфат аммония, нитрат аммония, мочевины и растительные продукты, такие, как мука зерновых, мука из коры деревьев, древесная мука и мука из ореховой скорлупы, целлюлозные порошки или какие-либо другие твердые наполнители. Концентрация действующих веществ в композициях может варьироваться в широких пределах, в основном от 0,01 до 95 мас.%, предпочтительно от 0,5 до 90 мас.%. Действующие вещества применяют при этом со степенью чистоты от 90% до 100%, предпочтительно от 95% до 100% (согласно ЯМР-спектру). Соединения формул Ia, соответственно Ia" согласно изобретению могут использоваться, например, для приготовления следующих композиций: I. 20 мас.частей соединения N 1.08 растворяют в смеси, состоящей из 80 мас. частей алкилированного бензола, 10 мас.частей продукта присоединения 8-10 молей этиленоксида к 1 молю N-моноэтаноламида олеиновой кислоты, 5 мас. частей кальциевой соли додецилбензолсульфокислоты и 5 мас.частей продукта присоединения 40 молей этиленоксида к 1 молю касторового масла. После декантирования и тонкого равномерного распределения раствора в 100000 мас.частях воды получают водную дисперсию, содержащую 0,02 мас.% действующего вещества. II. 20 мас.частей соединения N 1.08 растворяют в смеси, состоящей из 40 мас.частей циклогексанона, 30 мас.частей изобутанола, 20 мас.частей продукта присоединения 7 молей этиленоксида к 1 молю изооктилфенола и 10 мас.частей продукта присоединения 40 молей этиленоксида к 1 молю касторового масла. После декантирования и тонкого равномерного распределения раствора в 100000 мас. частях воды получают водную дисперсию, содержащую 0,02 мас.% действующего вещества. III. 20 мас. частей действующего вещества N 1.08 растворяют в смеси, состоящей из 25 мас. частей циклогексанона, 65 мас.частей получаемой при перегонке нефти фракции нефтяного топлива с температурой кипения 210-280oC и 10 мас. частей продукта присоединения 40 молей этиленоксида к 1 молю касторового масла. После декантирования и тонкого равномерного распределения раствора в 100000 мас.частях воды получают водную дисперсию, содержащую 0,02 мас.% действующего вещества. IV. 20 мас.частей действующего вещества N 1.08 тщательно перемешивают с 3 мас. частями натриевой соли диизобутилнафталин-  -сульфокислоты, 17 мас. частями натриевой соли лигнинсульфокислоты из отработанного сульфитного щелока и 60 мас.частями порошкообразного геля кремниевой кислоты, после чего измельчают в молотковой мельнице. После тонкого и равномерного распределения смеси в 20000 мас.частях воды получают раствор для опрыскивания, содержащий 0,1 мас.% действующего вещества. V. 3 мас.части действующего вещества N 1.08 смешивают с 97 мас.частями тонкодисперсного каолина. Таким путем получают препарат для опыливания, содержащий 3 мас.% действующего вещества. VI. 20 мас.частей действующего вещества N 1.08 тщательно смешивают с 2 мас.частями кальциевой соли додецилбензолсульфокислоты, 8 мас.частями полигликолевого эфира жирного спирта, 2 мас.частями натриевой соли конденсата фенолмочевины и формальдегида и 68 мас. частями парафинового минерального масла. Таким путем получают стабильную масляную дисперсию. Для расширения спектра действия и достижения синергического эффекта производные сахаринкарбоновой кислоты можно смешивать с многочисленными представителями других групп действующих веществ, обладающих гербицидными и рострегулирующими свойствами, и проводить обработку совместно с ними. В качестве таких ингредиентов смесей для совместной обработки могут служить, например, диазины, производные 4H-3,1-бензоксазина, бензотиадиазиноны, 2,6-динитроанилины, N-фенилкарбаматы, тиолкарбаматы, галогенкарбоновые кислоты, триазины, амиды, мочевины, дифениловые эфиры, триазиноны, урацилы, производные бензофурана, производные циклогексан-1,3-диона, несущие в положении 2, например, карбокси- или карбиминогруппу, производные хинолинкарбоновой кислоты, имидазолиноны, сульфонамиды, сульфонилмочевины, арилокси- и гетероарилоксифеноксипропионовые кислоты, а также их соли, эфиры и амиды, и ряд других. Кроме того, может оказаться полезным и целесообразным соединения формулы I индивидуально либо в сочетании с другими гербицидами применять также в смесях совместно с целым рядом других средств защиты растений, например, со средствами борьбы против вредителей или фитопатогенных грибов, соответственно бактерий. Интерес представляет далее возможность смешения с растворами минеральных солей, применяемых для компенсации недостатка питательных веществ и микроэлементов. Можно также вводить добавки нефитотоксичных масел и масляных концентратов. Нормы расхода действующих веществ в зависимости от цели обработки, времени года, обрабатываемых растений и стадии роста составляют от 0,001 до 3,0, предпочтительно от 0,01 до 1,0 кг/га активной субстанции (а.с.). Примеры получения 1. 2-метил-6-ацетаминобензойная кислота К раствору из 24,8 г (0,62 моля) NaOH в 500 мл воды добавляют 90,6 г (0,6 моля) 6-метилантраниловой кислоты и затем по каплям добавляют 63,4 г (0,62 моля) ацетангидрида. После перемешивания в течение 1 ч подкисляют при охлаждении концентрированной HCl до pH 3, выпадающий осадок отфильтровывают, промывают водой и при 50oC сушат под вакуумом. Выход: 107 г (0,55 моля) = 92% от теории, tпл 189-190oC. 2. 2-метил-3-нитро-6-ацетаминобензойная кислота При -5oC загружают 271 мл 98%-ной азотной кислоты и затем порциями добавляют 106 г (0,55 моля) полученной в примере 1 2-метил-6-ацетаминобензойной кислоты. После перемешивания в течение 1 ч реакционную смесь при 10oC сливают в смесь из 540 г льда и 270 мл воды. Выпавший осадок отфильтровывают, промывают водой и сушат при 50oC под вакуумом. Выход: 75,6 г (0,317 моля) = 58% от теории, tпл 190-191oC. Из фильтрата после продолжительной выдержки выделяется нитрированный в положении 3 изомер. Выход: 21,3 г (0,089 моля) = 16% от теории, tпл 180-182oC. 3. 2-метил-3-нитро-6-аминобензойная кислота Предварительно загружают 450 мл 2Н NaOH и затем добавляют 75,6 г (0,317 моля) 2-метил-3-нитро-6-ацетаминобензойной кислоты. Далее реакционную смесь нагревают до 95oC и оставляют при этой температуре на 1 ч для перемешивания. После охлаждения до 10oC подкисляют добавками 425 мл 2Н HCl, отфильтровывают выпавший осадок, промывают водой и сушат при 50oC под вакуумом. Выход: 50,7 г (0,258 моля) = 82% от теории, tпл 183-184oC. 4. Метиловый эфир 2-метил-3-нитро-6-аминобензойной кислоты 49,7 г (0,253 моля) 2-метил-3-нитро-6-аминобензойной кислоты растворяют в 380 мл ацетона и добавляют 43 г (0,51 моля) гидрокарбоната натрия. Затем нагревают до кипения до завершения выделения CO2. К полученной таким путем суспензии натриевой соли 2-метил-3-нитро-6-аминобензойной кислоты по каплям добавляют при температуре кипения ацетона в течение 2 ч 35,3 г (0,28 моля) диметилсульфата, после чего продолжают еще в течение 3 ч нагревать с обратным холодильником и затем дают остыть. После сливания реакционной смеси в 1,8 л воды экстрагируют метиленхлоридом. После сушки органическую фазу концентрируют. Полученное твердое вещество имеет достаточную степень чистоты (согласно ЯМР) для использования в последующей реакции. Выход: 50 г (0,238 моля) = 94% от теории, tпл 92-94oC. 5. Хлорангидрид 2-метоксикарбонил-3-метил-4-нитробензолсульфоновой кислоты 58,5 г (0,278 моля) метилового эфира 2-метил-3-нитро-6-аминобензойной кислоты растворяют при нагревании в 280 мл ледяного уксуса и этот раствор при 15-20oC сливают в 85 мл концентрированной HCl. Затем при 5-10oC по каплям добавляют раствор из 19,3 г (0,28 моля) нитрита натрия в 60 мл воды и оставляют на 30 мин при 5oC для перемешивания. Далее этот раствор диазониевой соли добавляют по каплям в раствор из 374 г SO2 в 750 мл ледяного уксуса, содержащий 14 г CuCl2 (растворенных в 30 мл воды). После завершения выделения азота продолжают перемешивать еще в течение 15 мин, после чего сливают в 1,4 л ледяной воды. Хлорангидрид сульфокислоты отделяют экстракцией 1,2 л метиленхлорида. После сушки и концентрирования органической фазы получают 73 г (0,25 моля) (= 90% от теории) масла, представляющего собой согласно ЯМР (в CDCl3) чистый хлорангидрид 2-метоксикарбонил-3-метил-4-нитробензолсульфоновой кислоты. 6. 4-метил-5-нитросахарин После загрузки 104 мл 25%-ного раствора аммиака добавляют 100 мл воды и затем при 10oC по каплям добавляют раствор из 48,7 г (0,166 моля) хлорангидрида 2-метоксикарбонил-3-метил-4-нитробензолсульфоновой кислоты в 70 мл тетрагидрофурана. После 3-часового перемешивания при 25oC концентрируют с помощью ротационного испарителя для удаления воды и ТГФ. Образовавшийся остаток тщательно перемешивают с уксусным эфиром, отфильтровывают и промывают уксусным эфиром. После сушки под вакуумом получают 34 г (0,131 моля) = 79% от теории твердого вещества белого цвета с tпл 312oC (разложение). 7. 2,4-диметил-5-нитросахарин Эта субстанция может быть получена последующим метилированием полученного в примере 6 сахарина диметилсульфатом в присутствии NaOH. 8. 3-метил-4-нитро-2-(N"-метил)карбоксамидо-N-метилбензолсульфонамид 50 мл воды сливают в 50 мл 40%-ного раствора метиламина и при 10oC по каплям добавляют раствор из 24,3 г (83 ммоля) хлорангидрида 2-метоксикарбонил-3-метил-4-нитробензолсульфоновой кислоты в 35 мл ТГФ. После перемешивания в течение 1 ч при 25oC все летучие компоненты удаляют с помощью ротационного испарителя. Остаток экстрагируют уксусным эфиром, органическую фазу промывают водой, сушат и концентрируют. Образующийся остаток кристаллизуется после продолжительного отстаивания. Выход: 10,3 г (40 ммолей = 48% от теории), tпл 125-126oC, после перекристаллизации из уксусного эфира tпл 144-145oC. 9. 4-метил-5-аминосахарин 33,6 г (0,13 моля) 4-метил-5-нитросахарина растворяют при нагревании до 45oC в 1,2 л воды и добавляют 5 г Pd/C (10%-ный на активированном угле). Затем при интенсивном перемешивании в раствор подают газообразный водород (гидрирование без давления). В течение 4,5 ч поглощается 9 л H2. После охлаждения до 25oC отфильтровывают от катализатора, с помощью ротационного испарителя концентрируют до объема 200 мл и затем подкисляют до pH 1. Выпавший осадок отфильтровывают, промывают водой и при 50oC сушат под вакуумом. Таким путем получают 23,4 г (0,11 моля = 85% от теории) твердого вещества белого цвета с tпл 272-273oC. 10. 4-метил-5-иодсахарин Предварительно загружают смесь из 205 мл уксусного эфира, 160 мл воды и 40 мл концентрированной HCl и при перемешивании добавляют 23,4 г (0,11 моля) 4-метил-5-аминосахарина при 15-20oC. К полученной суспензии при 5-10oC по каплям добавляют 7,9 г (0,115 моля) нитрита натрия и оставляют на 30 мин при 5oC для перемешивания. Затем образовавшуюся в виде суспензии диазониевую соль порциями добавляют по каплям в нагретый до 50oC раствор из 19,1 г (0,115 моля) иодида калия в 170 мл воды и при этом образуется азот. После охлаждения до комнатной температуры выпавший в осадок продукт выделяют путем фильтрации, промывают водой и при 50oC сушат под вакуумом. Таким путем получают 32,5 г (0,1 моля = 91% от теории) твердого вещества с tпл 257-258oC. Анализ сжиганием показал содержание иода 38,5% (теоретический расчет 39,3%). Степень чистоты продукта достаточна для его использования в последующих реакциях. 11. 4-метилсахарин-5-карбоновая кислота 6,4 г (0,002 моля) 4-метил-5-иодсахарина растворяют в 70 мл тетраметилмочевины и 30 мл воды, смешивают с 0,7 г хлорида бис(трифенилфосфин)палладия и смесь нагревают в автоклаве объемом 300 мл до 100oC и перемешивают в течение 36 ч при давлении моноокиси углерода 100 бар. Для последующей переработки фильтруют и воду и тетраметилмочевину удаляют перегонкой под высоким вакуумом. Остаток растворяют в метил-трет-бутиловом эфире (МТБЭ), экстрагируют раствором NaHCO3 и после подкисления HCl повторно экстрагируют МТБЭ. После концентрирования получают 2,8 г 4-метилсахарин-5-карбоновой кислоты (58% от теории). 1H-ЯМР (ДМСО), 400,1 МГц): 2,85 (3H, s); 8,05 (1H, d); 8,2 (1H, d); 13C-ЯМР (ДМСО, 100,6 МГц): 167,4 (CO); 161,3 (CO); 141,6 (четверт. C); 139,7 (четверт. C); 138,7 (четверт. C); 135,6 (CH); 125,4 (четверт. C); 118,5 (CH); 15,4 (CH3). 12. 2,4-диметилсахарин-5-карбоновая кислота 7,3 г (0,02 моля) 3-метил-4-иод-2-(N"-метил)карбоксамидо-N- метилбензолсульфонамида вместе с 0,69 г хлорида бис(трифенилфосфин)палладия, 30 мл воды и 70 мл тетраметилмочевины загружают в автоклав объемом 300 мл, после чего смесь нагревают до 100oC и в течение 36 ч перемешивают при давлении моноокиси углерода 100 бар. После переработки, аналогично описанной в примере 12, получают 4,1 г указанного в заголовке соединения (0,014 моля = 72% от теории). 1H-ЯМР (ДМСО, 400,1 МГц): 2,9 (3H, s); 3,15 (3H, s); 8,2 (2H, 2d); 14,0 (1H, s) 13C-ЯМР (ДМСО, 100,6 МГц): 167,3 (CO); 158,6 (CO); 139,7 (четверт. C); 139,1 (четверт. C); 138,9 (четверт. C); 135,5 (CH); 124,6 (четверт. C); 119,0 (CH); 22,9 (CH3); 15,6 (CH3). 13. 4-амино-3-метил-2-(N"-метил)карбоксамидо-N-метилбензолсульфонамид Аналогично описанной в примере 9 методике гидрировали без давления полученный в примере 8 3-метил-4-нитро-2-(N"-метил)карбоксамидо- N-метилбензолсульфонамид. Таким путем получили с 93%-ным выходом производное анилина структуры -сульфокислоты, 17 мас. частями натриевой соли лигнинсульфокислоты из отработанного сульфитного щелока и 60 мас.частями порошкообразного геля кремниевой кислоты, после чего измельчают в молотковой мельнице. После тонкого и равномерного распределения смеси в 20000 мас.частях воды получают раствор для опрыскивания, содержащий 0,1 мас.% действующего вещества. V. 3 мас.части действующего вещества N 1.08 смешивают с 97 мас.частями тонкодисперсного каолина. Таким путем получают препарат для опыливания, содержащий 3 мас.% действующего вещества. VI. 20 мас.частей действующего вещества N 1.08 тщательно смешивают с 2 мас.частями кальциевой соли додецилбензолсульфокислоты, 8 мас.частями полигликолевого эфира жирного спирта, 2 мас.частями натриевой соли конденсата фенолмочевины и формальдегида и 68 мас. частями парафинового минерального масла. Таким путем получают стабильную масляную дисперсию. Для расширения спектра действия и достижения синергического эффекта производные сахаринкарбоновой кислоты можно смешивать с многочисленными представителями других групп действующих веществ, обладающих гербицидными и рострегулирующими свойствами, и проводить обработку совместно с ними. В качестве таких ингредиентов смесей для совместной обработки могут служить, например, диазины, производные 4H-3,1-бензоксазина, бензотиадиазиноны, 2,6-динитроанилины, N-фенилкарбаматы, тиолкарбаматы, галогенкарбоновые кислоты, триазины, амиды, мочевины, дифениловые эфиры, триазиноны, урацилы, производные бензофурана, производные циклогексан-1,3-диона, несущие в положении 2, например, карбокси- или карбиминогруппу, производные хинолинкарбоновой кислоты, имидазолиноны, сульфонамиды, сульфонилмочевины, арилокси- и гетероарилоксифеноксипропионовые кислоты, а также их соли, эфиры и амиды, и ряд других. Кроме того, может оказаться полезным и целесообразным соединения формулы I индивидуально либо в сочетании с другими гербицидами применять также в смесях совместно с целым рядом других средств защиты растений, например, со средствами борьбы против вредителей или фитопатогенных грибов, соответственно бактерий. Интерес представляет далее возможность смешения с растворами минеральных солей, применяемых для компенсации недостатка питательных веществ и микроэлементов. Можно также вводить добавки нефитотоксичных масел и масляных концентратов. Нормы расхода действующих веществ в зависимости от цели обработки, времени года, обрабатываемых растений и стадии роста составляют от 0,001 до 3,0, предпочтительно от 0,01 до 1,0 кг/га активной субстанции (а.с.). Примеры получения 1. 2-метил-6-ацетаминобензойная кислота К раствору из 24,8 г (0,62 моля) NaOH в 500 мл воды добавляют 90,6 г (0,6 моля) 6-метилантраниловой кислоты и затем по каплям добавляют 63,4 г (0,62 моля) ацетангидрида. После перемешивания в течение 1 ч подкисляют при охлаждении концентрированной HCl до pH 3, выпадающий осадок отфильтровывают, промывают водой и при 50oC сушат под вакуумом. Выход: 107 г (0,55 моля) = 92% от теории, tпл 189-190oC. 2. 2-метил-3-нитро-6-ацетаминобензойная кислота При -5oC загружают 271 мл 98%-ной азотной кислоты и затем порциями добавляют 106 г (0,55 моля) полученной в примере 1 2-метил-6-ацетаминобензойной кислоты. После перемешивания в течение 1 ч реакционную смесь при 10oC сливают в смесь из 540 г льда и 270 мл воды. Выпавший осадок отфильтровывают, промывают водой и сушат при 50oC под вакуумом. Выход: 75,6 г (0,317 моля) = 58% от теории, tпл 190-191oC. Из фильтрата после продолжительной выдержки выделяется нитрированный в положении 3 изомер. Выход: 21,3 г (0,089 моля) = 16% от теории, tпл 180-182oC. 3. 2-метил-3-нитро-6-аминобензойная кислота Предварительно загружают 450 мл 2Н NaOH и затем добавляют 75,6 г (0,317 моля) 2-метил-3-нитро-6-ацетаминобензойной кислоты. Далее реакционную смесь нагревают до 95oC и оставляют при этой температуре на 1 ч для перемешивания. После охлаждения до 10oC подкисляют добавками 425 мл 2Н HCl, отфильтровывают выпавший осадок, промывают водой и сушат при 50oC под вакуумом. Выход: 50,7 г (0,258 моля) = 82% от теории, tпл 183-184oC. 4. Метиловый эфир 2-метил-3-нитро-6-аминобензойной кислоты 49,7 г (0,253 моля) 2-метил-3-нитро-6-аминобензойной кислоты растворяют в 380 мл ацетона и добавляют 43 г (0,51 моля) гидрокарбоната натрия. Затем нагревают до кипения до завершения выделения CO2. К полученной таким путем суспензии натриевой соли 2-метил-3-нитро-6-аминобензойной кислоты по каплям добавляют при температуре кипения ацетона в течение 2 ч 35,3 г (0,28 моля) диметилсульфата, после чего продолжают еще в течение 3 ч нагревать с обратным холодильником и затем дают остыть. После сливания реакционной смеси в 1,8 л воды экстрагируют метиленхлоридом. После сушки органическую фазу концентрируют. Полученное твердое вещество имеет достаточную степень чистоты (согласно ЯМР) для использования в последующей реакции. Выход: 50 г (0,238 моля) = 94% от теории, tпл 92-94oC. 5. Хлорангидрид 2-метоксикарбонил-3-метил-4-нитробензолсульфоновой кислоты 58,5 г (0,278 моля) метилового эфира 2-метил-3-нитро-6-аминобензойной кислоты растворяют при нагревании в 280 мл ледяного уксуса и этот раствор при 15-20oC сливают в 85 мл концентрированной HCl. Затем при 5-10oC по каплям добавляют раствор из 19,3 г (0,28 моля) нитрита натрия в 60 мл воды и оставляют на 30 мин при 5oC для перемешивания. Далее этот раствор диазониевой соли добавляют по каплям в раствор из 374 г SO2 в 750 мл ледяного уксуса, содержащий 14 г CuCl2 (растворенных в 30 мл воды). После завершения выделения азота продолжают перемешивать еще в течение 15 мин, после чего сливают в 1,4 л ледяной воды. Хлорангидрид сульфокислоты отделяют экстракцией 1,2 л метиленхлорида. После сушки и концентрирования органической фазы получают 73 г (0,25 моля) (= 90% от теории) масла, представляющего собой согласно ЯМР (в CDCl3) чистый хлорангидрид 2-метоксикарбонил-3-метил-4-нитробензолсульфоновой кислоты. 6. 4-метил-5-нитросахарин После загрузки 104 мл 25%-ного раствора аммиака добавляют 100 мл воды и затем при 10oC по каплям добавляют раствор из 48,7 г (0,166 моля) хлорангидрида 2-метоксикарбонил-3-метил-4-нитробензолсульфоновой кислоты в 70 мл тетрагидрофурана. После 3-часового перемешивания при 25oC концентрируют с помощью ротационного испарителя для удаления воды и ТГФ. Образовавшийся остаток тщательно перемешивают с уксусным эфиром, отфильтровывают и промывают уксусным эфиром. После сушки под вакуумом получают 34 г (0,131 моля) = 79% от теории твердого вещества белого цвета с tпл 312oC (разложение). 7. 2,4-диметил-5-нитросахарин Эта субстанция может быть получена последующим метилированием полученного в примере 6 сахарина диметилсульфатом в присутствии NaOH. 8. 3-метил-4-нитро-2-(N"-метил)карбоксамидо-N-метилбензолсульфонамид 50 мл воды сливают в 50 мл 40%-ного раствора метиламина и при 10oC по каплям добавляют раствор из 24,3 г (83 ммоля) хлорангидрида 2-метоксикарбонил-3-метил-4-нитробензолсульфоновой кислоты в 35 мл ТГФ. После перемешивания в течение 1 ч при 25oC все летучие компоненты удаляют с помощью ротационного испарителя. Остаток экстрагируют уксусным эфиром, органическую фазу промывают водой, сушат и концентрируют. Образующийся остаток кристаллизуется после продолжительного отстаивания. Выход: 10,3 г (40 ммолей = 48% от теории), tпл 125-126oC, после перекристаллизации из уксусного эфира tпл 144-145oC. 9. 4-метил-5-аминосахарин 33,6 г (0,13 моля) 4-метил-5-нитросахарина растворяют при нагревании до 45oC в 1,2 л воды и добавляют 5 г Pd/C (10%-ный на активированном угле). Затем при интенсивном перемешивании в раствор подают газообразный водород (гидрирование без давления). В течение 4,5 ч поглощается 9 л H2. После охлаждения до 25oC отфильтровывают от катализатора, с помощью ротационного испарителя концентрируют до объема 200 мл и затем подкисляют до pH 1. Выпавший осадок отфильтровывают, промывают водой и при 50oC сушат под вакуумом. Таким путем получают 23,4 г (0,11 моля = 85% от теории) твердого вещества белого цвета с tпл 272-273oC. 10. 4-метил-5-иодсахарин Предварительно загружают смесь из 205 мл уксусного эфира, 160 мл воды и 40 мл концентрированной HCl и при перемешивании добавляют 23,4 г (0,11 моля) 4-метил-5-аминосахарина при 15-20oC. К полученной суспензии при 5-10oC по каплям добавляют 7,9 г (0,115 моля) нитрита натрия и оставляют на 30 мин при 5oC для перемешивания. Затем образовавшуюся в виде суспензии диазониевую соль порциями добавляют по каплям в нагретый до 50oC раствор из 19,1 г (0,115 моля) иодида калия в 170 мл воды и при этом образуется азот. После охлаждения до комнатной температуры выпавший в осадок продукт выделяют путем фильтрации, промывают водой и при 50oC сушат под вакуумом. Таким путем получают 32,5 г (0,1 моля = 91% от теории) твердого вещества с tпл 257-258oC. Анализ сжиганием показал содержание иода 38,5% (теоретический расчет 39,3%). Степень чистоты продукта достаточна для его использования в последующих реакциях. 11. 4-метилсахарин-5-карбоновая кислота 6,4 г (0,002 моля) 4-метил-5-иодсахарина растворяют в 70 мл тетраметилмочевины и 30 мл воды, смешивают с 0,7 г хлорида бис(трифенилфосфин)палладия и смесь нагревают в автоклаве объемом 300 мл до 100oC и перемешивают в течение 36 ч при давлении моноокиси углерода 100 бар. Для последующей переработки фильтруют и воду и тетраметилмочевину удаляют перегонкой под высоким вакуумом. Остаток растворяют в метил-трет-бутиловом эфире (МТБЭ), экстрагируют раствором NaHCO3 и после подкисления HCl повторно экстрагируют МТБЭ. После концентрирования получают 2,8 г 4-метилсахарин-5-карбоновой кислоты (58% от теории). 1H-ЯМР (ДМСО), 400,1 МГц): 2,85 (3H, s); 8,05 (1H, d); 8,2 (1H, d); 13C-ЯМР (ДМСО, 100,6 МГц): 167,4 (CO); 161,3 (CO); 141,6 (четверт. C); 139,7 (четверт. C); 138,7 (четверт. C); 135,6 (CH); 125,4 (четверт. C); 118,5 (CH); 15,4 (CH3). 12. 2,4-диметилсахарин-5-карбоновая кислота 7,3 г (0,02 моля) 3-метил-4-иод-2-(N"-метил)карбоксамидо-N- метилбензолсульфонамида вместе с 0,69 г хлорида бис(трифенилфосфин)палладия, 30 мл воды и 70 мл тетраметилмочевины загружают в автоклав объемом 300 мл, после чего смесь нагревают до 100oC и в течение 36 ч перемешивают при давлении моноокиси углерода 100 бар. После переработки, аналогично описанной в примере 12, получают 4,1 г указанного в заголовке соединения (0,014 моля = 72% от теории). 1H-ЯМР (ДМСО, 400,1 МГц): 2,9 (3H, s); 3,15 (3H, s); 8,2 (2H, 2d); 14,0 (1H, s) 13C-ЯМР (ДМСО, 100,6 МГц): 167,3 (CO); 158,6 (CO); 139,7 (четверт. C); 139,1 (четверт. C); 138,9 (четверт. C); 135,5 (CH); 124,6 (четверт. C); 119,0 (CH); 22,9 (CH3); 15,6 (CH3). 13. 4-амино-3-метил-2-(N"-метил)карбоксамидо-N-метилбензолсульфонамид Аналогично описанной в примере 9 методике гидрировали без давления полученный в примере 8 3-метил-4-нитро-2-(N"-метил)карбоксамидо- N-метилбензолсульфонамид. Таким путем получили с 93%-ным выходом производное анилина структуры  с tпл 217-218oC. 14. 3-метил-4-иод-2-(N"-метил)карбоксамидо-N-метилбензолсульфонамид По описанной в примере 10 методике диазотировали соединение из предыдущего примера и взаимодействием с иодидом калия трансформировали в производное иодбензола следующей структуры с tпл 217-218oC. 14. 3-метил-4-иод-2-(N"-метил)карбоксамидо-N-метилбензолсульфонамид По описанной в примере 10 методике диазотировали соединение из предыдущего примера и взаимодействием с иодидом калия трансформировали в производное иодбензола следующей структуры 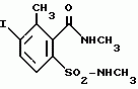 Выход: 95% от теории, tпл 60-62oC. 15. Хлорангидрид 2,4-диметилсахарин-5-карбоновой кислоты 3,8 г (14,9 ммолей) 2,4-диметилсахарин-5-карбоновой кислоты суспендируют в 100 мл толуола, нагревают до 80oC и по каплям добавляют 3,5 г (29,8 ммолей) тионилхлорида. После нагревания в течение 2 ч с обратным холодильником декантируют в горячем состоянии и реакционную смесь концентрируют с помощью ротационного испарителя. Полученный продукт (3 г, 74% от теории) имеет tплл 149-150oC. 16. Общая методика получения соединений формулы I 16.1 Ацилирование 5-гидрокси-1,3-диметилпиразола хлорангидридом сахаринкарбоновой кислоты К суспензии из 1,12 г (10 ммолей) 5-гидрокси-1,3-диметилпиразола в 70 мл метиленхлорида добавляют 1,01 г (11 ммолей) триэтиламина. Затем при 25oC по каплям добавляют раствор или суспензию из 10 ммолей хлорангидрида кислоты формулы IV в 30 мл метиленхлорида и далее нагревают в течение 5 ч до 45oC. После охлаждения до 25oC реакционную смесь смешивают с 60 мл воды, сливают в делительную воронку и органическую фазу отделяют. После экстрагирования водной фазы 50 мл метиленхлорида органические фазы объединяют и сушат над сульфатом натрия. После фильтрации и удаления метиленхлорида образуется масло, которое без последующей очистки используют в реакции перегруппировки. 16.2 Перегруппировка полученного в примере 16.1 пиразолового эфира Полученный в 16.1 O-ацильный эфир сахаринкарбоновой кислоты 5-гидрокси-1,3-диметилпиразола (приблизительно 10 ммолей) помещают в 80 мл ацетонитрила и смешивают сначала с 2,7 мл (2,2 г = 20 ммолей) триэтиламина, а затем с 0,2 г (2,3 ммоля) ацетонциангидрина и перемешивают в течение 16 ч при 25oC. Далее в реакционную смесь сливают 30 г 5%-ной HCl и экстрагируют метиленхлоридом. После этого органическую фазу экстрагируют 5%-ным раствором карбоната калия, органическую фазу отделяют, а щелочно-водную фазу добавлением по каплям концентрированной HCl подкисляют до pH 1, при этом продукт выпадает в виде вязкой массы. Для очистки этот продукт растворяют в метиленхлориде, промывают водой, сушат над сульфатом натрия и концентрируют. После растирания с диэтиловым эфир-петролейным эфиром остаток кристаллизуется. По аналогичной методике могут быть получены соединения, представленные в таблице 1. В табл. 2 и 3 показана селективная гербицидная активность при послевсходовой обработке теплиц. Примеры по применению Гербицидное действие производных сахарина формулы I было подтверждено в ходе проведения следующих опытов в теплице. В качестве вегетационных сосудов служили пластиковые цветочные горшки с супесью с содержанием приблизительно 3% гумуса в качестве субстрата. Семена опытных растений высевали раздельно по видам. Предвсходовую обработку суспендированными или эмульгированными в воде действующими веществами проводили непосредственно после высевания с помощью соответствующих сопел, обеспечивающих мелкокапельное распыление. Сосуды подвергали легкому дождеванию с тем, чтобы способствовать прорастанию и росту, после чего сосуды накрывали прозрачными пластиковыми крышками, пока растения не пошли в рост. Такие крышки обеспечивают равномерную всхожесть опытных растений, пока еще не испытывающих воздействия активных субстанций. Для послевсходовой обработки опытные растения в зависимости от экстерьера выращивали сначала до достижения ими высоты от 3 до 15 см и лишь после этого обрабатывали суспендированными или эмульгированными в воде действующими веществами. С этой целью опытные растения либо непосредственно высевали и выращивали в тех же самых сосудах, либо их выращивали сначала отдельно как зародышевые растения, а за несколько дней до обработки пересаживали в сосуды для экспериментов. Растения по видам выдерживали при температурах 10-25oC, соответственно 20-35oC. Опыты проводились в течение 2-4 недель. В течение этого периода времени за растениями вели тщательный уход, определяя при этом их реакцию на каждую из проводимых обработок. Оценку производили по шкале с градацией от 0 до 100. При этом показатель 100 означал, что растения не взошли, соответственно что имеет место полная гибель по крайней мере их надземных частей, а показатель 0 означал, что растения не повреждены или наблюдается их нормальный рост. Выход: 95% от теории, tпл 60-62oC. 15. Хлорангидрид 2,4-диметилсахарин-5-карбоновой кислоты 3,8 г (14,9 ммолей) 2,4-диметилсахарин-5-карбоновой кислоты суспендируют в 100 мл толуола, нагревают до 80oC и по каплям добавляют 3,5 г (29,8 ммолей) тионилхлорида. После нагревания в течение 2 ч с обратным холодильником декантируют в горячем состоянии и реакционную смесь концентрируют с помощью ротационного испарителя. Полученный продукт (3 г, 74% от теории) имеет tплл 149-150oC. 16. Общая методика получения соединений формулы I 16.1 Ацилирование 5-гидрокси-1,3-диметилпиразола хлорангидридом сахаринкарбоновой кислоты К суспензии из 1,12 г (10 ммолей) 5-гидрокси-1,3-диметилпиразола в 70 мл метиленхлорида добавляют 1,01 г (11 ммолей) триэтиламина. Затем при 25oC по каплям добавляют раствор или суспензию из 10 ммолей хлорангидрида кислоты формулы IV в 30 мл метиленхлорида и далее нагревают в течение 5 ч до 45oC. После охлаждения до 25oC реакционную смесь смешивают с 60 мл воды, сливают в делительную воронку и органическую фазу отделяют. После экстрагирования водной фазы 50 мл метиленхлорида органические фазы объединяют и сушат над сульфатом натрия. После фильтрации и удаления метиленхлорида образуется масло, которое без последующей очистки используют в реакции перегруппировки. 16.2 Перегруппировка полученного в примере 16.1 пиразолового эфира Полученный в 16.1 O-ацильный эфир сахаринкарбоновой кислоты 5-гидрокси-1,3-диметилпиразола (приблизительно 10 ммолей) помещают в 80 мл ацетонитрила и смешивают сначала с 2,7 мл (2,2 г = 20 ммолей) триэтиламина, а затем с 0,2 г (2,3 ммоля) ацетонциангидрина и перемешивают в течение 16 ч при 25oC. Далее в реакционную смесь сливают 30 г 5%-ной HCl и экстрагируют метиленхлоридом. После этого органическую фазу экстрагируют 5%-ным раствором карбоната калия, органическую фазу отделяют, а щелочно-водную фазу добавлением по каплям концентрированной HCl подкисляют до pH 1, при этом продукт выпадает в виде вязкой массы. Для очистки этот продукт растворяют в метиленхлориде, промывают водой, сушат над сульфатом натрия и концентрируют. После растирания с диэтиловым эфир-петролейным эфиром остаток кристаллизуется. По аналогичной методике могут быть получены соединения, представленные в таблице 1. В табл. 2 и 3 показана селективная гербицидная активность при послевсходовой обработке теплиц. Примеры по применению Гербицидное действие производных сахарина формулы I было подтверждено в ходе проведения следующих опытов в теплице. В качестве вегетационных сосудов служили пластиковые цветочные горшки с супесью с содержанием приблизительно 3% гумуса в качестве субстрата. Семена опытных растений высевали раздельно по видам. Предвсходовую обработку суспендированными или эмульгированными в воде действующими веществами проводили непосредственно после высевания с помощью соответствующих сопел, обеспечивающих мелкокапельное распыление. Сосуды подвергали легкому дождеванию с тем, чтобы способствовать прорастанию и росту, после чего сосуды накрывали прозрачными пластиковыми крышками, пока растения не пошли в рост. Такие крышки обеспечивают равномерную всхожесть опытных растений, пока еще не испытывающих воздействия активных субстанций. Для послевсходовой обработки опытные растения в зависимости от экстерьера выращивали сначала до достижения ими высоты от 3 до 15 см и лишь после этого обрабатывали суспендированными или эмульгированными в воде действующими веществами. С этой целью опытные растения либо непосредственно высевали и выращивали в тех же самых сосудах, либо их выращивали сначала отдельно как зародышевые растения, а за несколько дней до обработки пересаживали в сосуды для экспериментов. Растения по видам выдерживали при температурах 10-25oC, соответственно 20-35oC. Опыты проводились в течение 2-4 недель. В течение этого периода времени за растениями вели тщательный уход, определяя при этом их реакцию на каждую из проводимых обработок. Оценку производили по шкале с градацией от 0 до 100. При этом показатель 100 означал, что растения не взошли, соответственно что имеет место полная гибель по крайней мере их надземных частей, а показатель 0 означал, что растения не повреждены или наблюдается их нормальный рост.
ФОРМУЛА ИЗОБРЕТЕНИЯ1. 5-Гидроксипиразол-4-илкарбонилзамещенные производные сахарина формулы I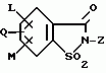 в которой заместители имеют следующее значение: L, M обозначают водород, C1-C4алкил, хлор; Z обозначает водород, C1-C4алкил, C3-C5-алкинил, C3-C8алкенил, фенил; Q обозначает радикал CO-J; J обозначает присоединенное в положение 4 бензольного кольца 5-гидроксипиразольное кольцо формулы II в которой заместители имеют следующее значение: L, M обозначают водород, C1-C4алкил, хлор; Z обозначает водород, C1-C4алкил, C3-C5-алкинил, C3-C8алкенил, фенил; Q обозначает радикал CO-J; J обозначает присоединенное в положение 4 бензольного кольца 5-гидроксипиразольное кольцо формулы II 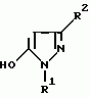 в которой R1 обозначает C1-C4алкил; R2 обозначает водород или метил, а также обычно применяемые в сельском хозяйстве соли соединений формулы I. 2. Производные сахарина формулы I по п. 1, в которой радикалы L, M обозначают водород, C1-C4алкил. 3. Производные сахарина формулы I по п. 1, в которой радикалы L, M обозначают водород, метил, хлор. 4. Гербицидное средство, содержащее производное сахарина формулы (I) по п.1 и обычные инертные добавки. в которой R1 обозначает C1-C4алкил; R2 обозначает водород или метил, а также обычно применяемые в сельском хозяйстве соли соединений формулы I. 2. Производные сахарина формулы I по п. 1, в которой радикалы L, M обозначают водород, C1-C4алкил. 3. Производные сахарина формулы I по п. 1, в которой радикалы L, M обозначают водород, метил, хлор. 4. Гербицидное средство, содержащее производное сахарина формулы (I) по п.1 и обычные инертные добавки.Популярные патенты: 2446659 Способ и устройство для органического возделывания зерновых культур ... способ посева зерновых культур через полосу при примерно равных по ширине размерах (20-25 см) засеваемой и незасеваемой полос /2/ и устройство для его осуществления (патент РФ 2204891). Почву в засеваемой полосе рыхлят по всей ширине на глубину посева и одновременно укладывают семена вразброс на подготовленное ложе. Верхний слой взрыхленной почвы сдвигают в незасеваемую полосу. Оставшуюся прикрывающую семена взрыхленную почву выравнивают и уплотняют.Укладка убираемого, наиболее сухого слоя почвы из засеваемой полосы на засеваемую полосу в виде гребня позволяет получать дополнительную влагу, которая скатывается с гребня в засеваемую полосу и благоприятно влияет на ... 2472336 Соломорезка и оснащенная такой соломорезкой уборочная машина ... распределять на поле, чем поток произвольного поперечного сечения или поток поперечного сечения, изменяющегося в зависимости от наклона обрабатываемого косогора.В предпочтительном примере выполнения на окружной поверхности корпуса предусмотрены впускное отверстие для подачи подлежащего измельчению материала, проходящее в осевом направлении ротора, и выпускное отверстие для выдачи измельченного материала.Корпус, по меньшей мере, на части своего периметра выполнен с большим радиусом в средней области, чем в концевых областях. Такое выполнение способствует тому, что измельченный материал, прижимаемый к корпусу центробежной силой, стремится к средней области. Предпочтительно радиус ... 2228024 Способ профилактики мастита у коров и устройство для его осуществления ... 4. Регулирование интенсивности потока излучения осуществлялось путем изменения расхода воздуха через сопло 2 и расстояния между соплом 2 и резонатором 4. При необходимости осуществления дезинфицирующей обработки или лечения через шланг (не показано) во входной патрубок 7 в кольцевую полость 6 подают дезинфицирующий или лечебный раствор, который в виде тонкой пленки выливается через щель 8 в зону активных ультразвуковых колебаний, где пленка разбивается на мелкие капли. Размер последних зависит от частоты генерируемых колебаний, их интенсивности, от толщины пленки жидкости и ее физико-химических свойств. Образованные в зоне интенсивных ультразвуковых колебаний частицы вещества ... 2114555 Способ электродиагностики вымени крупного рогатого скота и устройство для его осуществления ... за счет применения предлагаемого способа появляется возможность профилактировать травматизм доярок и свести его до минимума путем прогнозирования оборонительной реакции коров, так как травмирование чаще происходит внезапно, когда доярка не ожидает удара от ранее спокойного животного, без наличия видимых признаков заболевания. Животное травмирует доярку, проявляя оборонительную реакцию на прикосновение доильных стаканов к воспалительному очагу, еще не видимому клинически, но уже болезненному. Способ безболезненный, не вызывает оборонительной реакции животного, не требует выдаивания молока и его исследования, позволяет быстро и с высокой точностью обследовать все поголовье животных ... 2040900 Фунгицидное средство ... как циклогексан или парафины, спирты и гликоли, также их простые и сложные эфиры, такие как монометиловый эфир этиленгликоля; кетоны, как циклогексан; сильно полярный растворитель, как N-метил-2-пирролидон, диметилсульфоксид или диметилформамид, также, смотря по обстоятельствам, эпоксидированные растительные масла или соевое масло; или вода. В виде твердого материала носителя подразумевают, например, для распыляемого средства или диспергируемого порошка, кальцит, тальк, каолин, монтмориллонит или аттапульгит, тонкодисперсная кремневая кислота или продукт полимеризации, обладающий всасывающей способностью. Зерновым, поглощающим носителем для гранулята, служит пемза, кирпичная ... |
Еще из этого раздела: 2180475 Устройство для поштучной подачи предметов, в частности семян сельскохозяйственных культур 2407284 Акустический анализатор роевого состояния пчелосемей 2476277 Способ защиты почв от остатков пестицидов 2289908 Способ получения рассады стевии 2114107 Производные триазола, способ их получения и инсектоакарицидная композиция 2490869 Способ направленного изменения циркуляции воздушных масс и связанных с ней погодных условий 2161402 Способ акселерационного содержания и разведения кроликов 2196403 Почвообрабатывающий модуль 2260943 Способ подращивания личинок осетровых рыб 2427121 Почвообрабатывающий агрегат |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||