Антимикробные белкиПатент на изобретение №: 2158762 Автор: КРАГ Карстен Маттиас (DK), МИККЕЛЬСЕН Йорн Далгорд (DK), НИЛЬСЕН Клаус Кристиан (DK) Патентообладатель: НОВАРТИС АГ (CH) Дата публикации: 10 Ноября, 2000 Начало действия патента: 20 Октября, 1994 Адрес для переписки: 101000, Москва, Малый Златоустинский пер., д.10, кв.15, "ЕВРОМАРКПАТ", Веселицкой И.А. Изображения 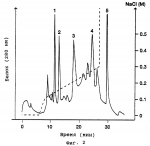  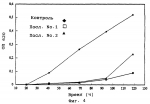 Изобретение относится к получению антимикробных белков, используемых для борьбы с грибами. Белки выделены из сахарной свеклы и имеют аминокислотную последовательность, представленную в любой из последовательностей SEQ NO ID:1, SEQ NO ID:2 и SEQ NO ID:3. Получена рекомбинантная ДНК, кодирующая вышеуказанные белки и имеющая последовательность, представленную в SEQ ID NO 7. Вышеуказанные белки обладают антигрибковой активностью против грибов вида С. beticola. 3 с. и 1 з.п. ф-лы, 9 ил. , , , , , , , , , , , , , , , ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУПредметом настоящего изобретения являются антимикробные белки, выделяемые из сахарной свеклы. Согласно настоящему изобретению предлагают антимикробный белок, содержащий пептид, имеющий следующую аминокислотную последовательность: AA1-AA2-AA3-Cys-AA5 -AA6-AA7-AA8-AA9-Cys-AA11- AA12-AA13-AA14-Cys-Cys-AA17-AA18- AA19-AA20-AA21-Cys-AA23-AA24 -AA25-AA26-AA27-AA28-Cys-AA30, где "AA" обозначает любую из общеизвестных 20 аминокислот. Предпочтительно, чтобы AA7 являлась тирозином; AA14 являлась тирозином; AA18 являлась лизином. Кроме того, наиболее предпочтительно, чтобы AA24 являлась валином; AA26 являлась аргинином; a AA27 являлась аланином. Под антимикробным белком подразумевают белок (один или в сочетании с другим материалом), который является токсичным или ингибирует рост в любых обстоятельствах любого микроорганизма, включая бактерии (наиболее часто грамположительные бактерии), вирусы и особенно грибы. К числу таких антимикробных белков относятся белки, которые проявляют антимикробную активность при контакте с микроорганизмом, а также белки, антимикробные свойства которых являются следствием их накопления или вдыхания. Изобретение включает также антимикробный белок, имеющий последовательность, описанную в любой из Посл. N 1-3. Далее изобретение включает чистый белок, который существенно сходен с любым из вышеуказанных белков. Под термином "существенно сходные" понимают чистые белки, имеющие аминокислотную последовательность, которая по меньшей мере на 85% сходна с последовательностью белков согласно изобретению. Предпочтительно, чтобы степень сходства составляла по меньшей мере 90%, еще более предпочтительно, чтобы степень сходства составляла по меньшей мере 95%. В контексте настоящего изобретения две аминокислотные последовательности с по меньшей мере 85%, 90% или 95%-ным сходством друг с другом имеют по меньшей мере 85%, 90% или 95% идентичных или консервативно замещенных аминокислотных остатков в одинаковом положении при оптимальном расположении, допускающем наличие до 2-х разрывов при условии, что в отношении каждого разрыва задействовано в целом не более чем 3 аминокислотных остатка. В случае белков, специфически описанных в Посл. N 1 или 2, количество разрывов может быть увеличено до 4-х при условии, что в отношении каждого разрыва задействовано в целом не более 5 аминокислотных остатков. Для целей настоящего изобретения могут быть произведены консервативные замещения между аминокислотами в пределах следующих групп: (I) Серин и Треонин; (II) Глутаминовая кислота и Аспарагиновая кислота; (III) Аргинин и Лизин; (IV) Аспарагин и Глютамин; (V) Изолейцин, Лейцин, Валин и Метионин; (VI) Фенилаланин, Тирозин и Триптофан; (VII) Аланин и Глицин. Далее изобретение включает чистые белки, которые по меньшей мере на 90% идентичны антимикробным белкам согласно изобретению, а также чистые белки, которые обладают по меньшей мере 90% их специфической активности. С точки зрения целей настоящего применения под специфической активностью понимают количественное измерение ингибирования роста или репликации, вызываемое определенным количеством белка по отношению к определенному количеству определенного микроорганизма. Далее изобретение включает указанные чистые белки в сочетании с по меньшей мере одним белком, выбранным из группы, состоящей из белков, описанных в Посл. N 4-6. Такие скомбинированные белки могут быть далее объединены с одним или более из известных "патогенеззависимых белков". Инфицирование растений грибными или вирусными патогенами может индуцировать в растительных тканях системный синтез около 10 семейств гомологичных патогенеззависимых белков (ПЗ-белков). Эти ПЗ-белки были классифицированы на 5 групп. ПЗ-2, ПЗ-3 и ПЗ-5-белки являются бета-1,3-глюканазой, хитиназами и томатинподобными белками соответственно. ПЗ-1 и ПЗ-4-группам белков не были приписаны специфические функции. ПЗ-4-белки сходны с C-концевыми доменами прогевеина и предположительно индуцируемых поранением ПИН белков картофеля, не имеющих, следовательно, N-концевого домена гевеина. Наиболее предпочтительно, чтобы белки согласно изобретению были объединены с одним или более белков, которые являются основными противоположными частями ПЗ-4-группы белков, подразумевая основную противоположную часть белков, сходную с C-концевыми доменами прогевеина и предположительно индуцируемых поранением ПИН белков картофеля. Наиболее предпочтительно, чтобы основная противоположная часть, указанных патогенеззависимых белков являлась хитинсвязывающим ПИН белком, в частности белком, продуцируемым зерном ячменя или листьями ячменя, подвергнутого стрессовому воздействию. Далее изобретение включает рекомбинантную ДНК, содержащую последовательность, кодирующую белок, имеющий аминокислотную последовательность вышеописанных антимикробных белков. В частности, ДНК может кодировать по меньшей мере один из белков, последовательности которых описаны в Посл. N 1-3, возможно в дополнение к по меньшей мере одному из белков, последовательности которых описаны в Посл. N 4-6. Кроме того, рекомбинантная ДНК может кодировать белок, обладающий свойствами гербицидоустойчивости, стимуляции растительного роста, антигрибными, антибактериальными, антивирусными и/или антинематодными свойствами. В том случае, когда ДНК должна быть введена в гетерологичный организм, она может быть модифицирована посредством удаления известных мотивов нестабильности мДНК (таких как АТ-богатые области) и сигналов полиаденилирования (если они присутствуют), кроме того, кодоны, которые предпочитаются организмом, в который должна быть введена рекомбинантная ДНК, могут быть использованы таким образом, чтобы экспрессия такой модифицированной ДНК в указанном организме приводила к образованию белка, существенно сходного с белком, который получается при экспрессии немодифицированной рекомбинантной ДНК в организме, в котором антимикробный белок согласно изобретению является эндогенным. Кроме того, изобретение включает рекомбинантную ДНК, которая "сходна" с ДНК, упоминавшейся выше. Под "сходной ДНК" понимают последовательность, которая комплементарна тест-последовательности, которая способна к гибридизации с предлагаемой рекомбинантной последовательностью. В том случае, когда тест-последовательность и предлагаемая последовательность являются двунитевыми, нуклеиновая кислота, из которой состоит тест-последовательность, предпочтительно имеет ТПл, отличающуюся не более чем на 20oC от значения ТПл предлагаемой последовательности. В том случае, когда тест-последовательность и предлагаемая последовательность смешаны вместе и одновременно денатурированы, значения ТПл последовательностей предпочтительно отличаются друг от друга не более чем на 10oC. Более предпочтительно проводить гибридизацию в строгих условиях, когда либо тест-ДНК, либо предлагаемая ДНК предпочтительно находятся на подложке. Тогда, либо денатурированная тест-последовательность, либо предлагаемая последовательность предпочтительно сначала связывается с подложкой, а гибридизацию проводят в течение определенного промежутка времени при температуре между 50 и 70oC в двукратном забуференном цитратом солевом растворе (ДСЦ), содержащем 0,1% ДДС, с последующим промыванием подложки при той же температуре, но буфером, имеющем пониженную концентрацию ДСЦ. В зависимости от степени требуемой точности, а отсюда и степени сходства последовательностей такие буферы с пониженной концентрацией являются обычно однократными ДСЦ, содержащими 0,1% ДДС, ДСЦ с половинной концентрацией, содержащими 0,1% ДДС, и ДСЦ с концентрацией, равной одной десятой от исходной, содержащими 0,1% ДДС. Последовательностями, имеющими наибольшую степень сходства, являются последовательности, на гибридизацию которых менее всего влияет промывание в буферах пониженной концентрации. Наиболее предпочтительно, чтобы тест-последовательность и предлагаемая последовательность являлись настолько сходными, что на гибридизацию между ними существенно не влияло промывание или инкубация в натрий-цитратном буфере с концентрацией, равной одной десятой от исходной, содержащем 0,1% ДДС. Далее изобретение включает последовательность ДНК, которая комплементарна последовательности, которая гибридизуется в строгих условиях с рекомбинантной ДНК согласно изобретению. Кроме того, настоящее изобретение включает: вектор, который содержит вышеописанную ДНК, которая может экспрессироваться в растениях и связана с действующим растительным промотором и терминатором; растения, трансформированные такой ДНК; потомство таких растений, которое содержит ДНК, стабильно встроенную и наследуемую согласно закону Менделя, и/или семена таких растений и такого потомства. Трансформированные растения получены известными способами, которые включают регенерацию растительных клеток или протопластов, трансформированных ДНК по изобретению согласно разнообразным известным способам (Ti и Ri плазмиды Agrobacterium, электропорация, микроинъекция, микрозарядная пушка и т.д.). Трансформированная клетка в соответствующих случаях может быть регенерирована в целые растения, у которых ядерный материал стабильно включен в геном. Таким образом могут быть получены как однодольные, так и двудольные растения. Примеры трансформированных растений согласно настоящему изобретению включают: фрукты, включая томаты, манго, персики, яблоки, груши, землянику, бананы и дыни; полевые культуры, такие как canola, подсолнечник, табак, сахарная свекла, зерновые культуры, такие как пшеница, ячмень и рис, кукуруза и хлопок, и овощи, такие как картофель, морковь, латук, капуста и лук. Предпочтительными растениями являются сахарная свекла и кукуруза. Далее изобретение включает белок, продуцируемый в результате экспрессии указанной ДНК, и антимикробный белок, продуцируемый при экспрессии рекомбинантной ДНК в трансформированных таким образом растениях. Далее изобретение включает антимикробный состав, содержащий один или более белков согласно изобретению; способ борьбы с грибами, который включает обработку их такими белками, и способ экстракции для получения антимикробных белков из органического материала, их содержащего, включая обработку материала - предпочтительно в форме микроорганизма - посредством мацерации и экстракции растворителем. Следует отметить, что антимикробный белок оказывает небольшое, если оно вообще имеет место, антимикробное действие на микроорганизм, который является источником органического материала, о котором упоминалось в предыдущем абзаце. Далее изобретение будет детализировано исходя из следующего описания и сопровождается чертежами и списками последовательностей. На Фиг. 1 представлен характерный профиль элюции внутриклеточной промывочной жидкости из колонки с КМ-Сефарозой; на фиг. 2 представлен характерный профиль элюции из колонки Mono S ЖЭХБ 0,3 М NaCl фракции, представленной на фиг. 1; на фиг. 3 представлен характерный профиль элюции из колонки ОФ-ЖХВР белков, детектируемых в виде пика 3 на фиг. 2; на фиг. 4 показана антигрибная активность 10 уг белка, детектируемого в виде пиков 3.1 и 3.2 на фиг. 3 (Посл. N 1 и 2 соответственно); на фиг. 5 показана хроматограмма гель-фильтрации на Сефадексе G-75 0,1 М фракции, представленной на фиг. 1; на фиг. 6 показан характерный профиль элюции из колонки Mono S ЖЭХБ пика (пула) V, представленного на фиг. 5; на фиг. 7 показана антигрибная активность 10 уг белка, детектируемого в виде пиков 1 и 2 (Посл. N 1) на фиг. 6; на фиг. 8А показана объединенная антигрибная активность 2 уг каждого из белков, представленных Посл. N 2 и 3; на фиг. 8Б показана объединенная антимикробная активность 2 уг каждого из белков, представленных Посл. N 2 и 5; на фиг. 9A и 9B показана морфология гиф C. beticola, выросших в отсутствие антимикробных белков по изобретению; на фиг. 9C и 9D показаны гифы в том случае, когда гриб растет в течение 48 часов в присутствии 2 уг белков, имеющих последовательности, описанные в Посл. N 2 и 3 соответственно. Опыт проводят в микротитрационных планшетах, как описано ниже; увеличение на фиг. 9A - 76X; на фиг. 9B-9D - 294X. Посл. N 1 представляет аминокислотную последовательность белка, детектируемого в виде пика 3.1 на фиг. 3; Посл.N 2 представляет аминокислотную последовательность белка, детектируемого в виде пика 3.2 на фиг. 3; и Посл. N 3 показывает аминокислотную последовательность белка, детектируемого в виде пиков 1 и 2 на фиг. 6; Посл. N 4-6 показывает аминокислотные последовательности трех известных антигрибных белков; Посл. N 7 показывает нуклеотидную последовательность кДНК, кодирующей белок, описанный в Посл. N 3; и Посл. N 8 показывает продукт трансляции транскрипта, кодируемого последовательностью кДНК, описанной в Посл. N 7; этот продукт включает N- и C-концевые удлиняющие сегменты белка, описанного в Посл. N 3. Выделение внутриклеточной промывочной жидкости ВПЖ выделяют из 500-700 грамм листьев сахарной свеклы путем их погружения в 20 мМ НАц (pH 4,5). Погруженные таким образом листья затем помещали в эксикатор и подвергали вакуумной фильтрации в течение 5 минут при 4 торр (максимум). После воздушной сушки поверхности листьев ВПЖ собирают посредством центрифугирования при 500 g в течение 15 минут в центрифужных пробирках емкостью 500 мл. Катионообменная хроматография Полученную таким образом ВПЖ фракционируют путем катионообменной хроматографии на колонке с КМ-Сефарозой емкостью 10 мл (Pharmacia LKB), предварительно уравновешенной стартовым буфером (20 мМ НАц (pH 4,5)). Фракционирование проводят при 4oC при скорости протока 25 мл/г. Собирают фракции объемом 3 мл. Белки, не связавшиеся с колонкой, удаляют путем тщательного промывания колонки стартовым буфером. Связанные белки элюируют путем нанесения на колонку дополнительного стартового буфера, содержащего последовательно увеличивающиеся концентрации соли: 0,1 М NaCl, 0,3 М NaCl и 0,5 М NaCl. Измеряют поглощение элюата при 280 нм, а фракции, предположительно содержащие белок, тестируют на их антигрибную активность против C. beticola способом биооценки в микротитрационных планшетах, как описано выше [1]. Характерный профиль элюции показан на фиг. 1. Элюаты, получающиеся после нанесения на колонку стартового буфера, содержащие 0,3 М NaCl и 0,1 М NaCl, очищают далее, как описано ниже. Очистка антигрибных белков в 0,3 М NaCl элюате, полученном после ЖЭХБ хроматографии на КМ-Сефарозе 0,3 М NaCl белковую фракцию обессоливают путем диализа в течение ночи (Мв: 3 кД) против 20 мМ НАц (pH 4,5) при 4oC. К диализированной таким образом белковой фракции добавляют бетаин в концентрации 5%. Четыре мл полученного раствора фракционируют затем посредством катионообменной жидкостной экспресс-хроматографии белков (ЖЭХБ) с помощью Mono S HR 5/5 колонки (Pharmacia LKB), уравновешенной в 20 мМ НАц (pH 4,5), содержащим 5% (в/об) бетаина (A-буфер). Связанные белки элюируют линейным градиентом соли от 0 до 0,3 М NaCl в 30 мл A-буфера с последующей стадийной элюцией 1,0 М NaCl в том же самом буфере. Скорость протока составляет 1 мл/мин. Фиг. 2 показывает, что 0,3 М NaCl фракция содержит ряд отдельных белков, количественно наиболее существенными из которых являются белки, детектируемые в виде пиков 1-5. При разделении посредством ДДС-ПААГ с использованием Phast системы (Pharmacia LKB) окрашенных серебром 10-15% градиентных Phast гелей или гелей с высокой плотностью (Pharmacia LKB) установлено, что пики 1-5 содержат 2-5 белковых полос. ЖХВР с обращенной фазой Белковый пик 3 (обозначенный на фиг. 2) из Mono S колонки очищают далее с помощью ЖХВР с обращенной фазой (ОФ-) на Vydac C4 колонке с кремнием (The Separations Group, CA, USA). Системой растворителей является система А: 0,1%-ный ТФА в воде и система Б: 0,1%-ный ТФА в ацетонитриле. Белки элюируют линейным градиентом от 5 до 45% Б-буфера, наносимым через 18 минут после нанесения образца с последующим нанесением 60%-ного Б-буфера через 2 минуты. Скорость протока 0,7 мл/мин. Белок выявляют путем регистрации поглощения элюата при 214 и 280 нм. Отдельные белковые пики собирают и лиофилизируют. Лиофилизированные таким образом белки затем промывают дважды водой, повторно лиофилизируют и затем растворяют в 10 мМ Трис-HCl (pH 8,0) перед анализом на чистоту и антигрибную активность. Фиг. 3 показывает, что пик 3 из фиг. 2 разделяется на четыре пика (обозначенные как 3.1-3.4 на фиг. 3) на ОФ колонке. ДДС-ПААГ пиков 3.1-3.4 показывает, что каждый из них состоит из четырех белков, имеющих молекулярный вес около 7 кД (пики 3.1, 3.2 и 3.3) и 2.5-3 кД (3.4). Очистка антигрибных белков из 0,1 М NaCl элюата из КМ-Сефарозы Пять мл 0,1 М NaCl элюата из фиг. 1 фракционируют гель-фильтрацией на колонке емкостью 370 мл с Сефадексом G-75 (Pharmacia LKB), уравновешенной 50 мМ МЭС (pH 6,0) при скорости протока 20 мл/ч. Собирают фракции объемом по 10 мл. Эти фракции последовательно делят на шесть больших фракций, I-VI, содержащих приблизительно по 50 мл каждая (фиг. 5). Катионный обмен (Моно S) Пул V (показанный на фиг. 5) из колонки с Сефадексом G-75 наносят на Mono S ЖЭХБ колонку, уравновешенную буфером А: 50 мМ МЭС (pH 6,0), содержащим 5% бетаина (в/об). После промывания А-буфером связавшиеся белки элюируют при скорости протока 1 мл/мин линейным градиентом от 0 до 0,5 М NaCl в 30 мл А-буфера (фиг. 6). При ДДС-гелевом электрофорезе в присутствии ДТТ белка, детектируемого в виде пиков 1 и 2, наблюдают две отдельные полосы. Первая полоса имеет молекулярный вес между 2,5 и 3 кД, а вторая полоса, которая представляет собой нередуцированный димер белка первой полосы, имеет молекулярный вес около 5 кД. ИДЕНТИФИКАЦИЯ АНТИГРИБНЫХ БЕЛКОВ Антигрибная активность Фиг. 4 и 7-9 показывают, что белки, детектируемые в виде пиков 3.1 и 3.2 (Посл. N 1 и 2 соответственно) на фиг. 3, и пики 1 и 2 (Посл. N 3) на фиг. 6 имеют значительную антигрибную активность, среди прочего, против C. beticola. Ингибирование грибного роста измеряют в 96-луночном микротитрационном планшете при 620 нм, как описано [1]. Фиг. 9 показывает, что C. beticola, обработанный таким белком, имеет ослабленные гифы, которые являются истонченными и более разветвленными (фиг. 9B, 9D) по сравнению с гифами гриба, растущего при отсутствии антимикробных белков (фиг. 9A, 9B). Белки, одни или в сочетании с ПИН N (который выделяют из зерна ячменя или листьев ячменя, подвергнутого стрессовому воздействию, как описано [2]), и/или белком, имеющим последовательность, соответствующую по меньшей мере одной из приведенных в Посл. N 4-6, инкубируют со спорами C. beticola. Опытная смесь (240 ул) содержит 100 ул картофельного агара с глюкозой (Difco), 40 ул белкового образца (или буферного контроля) в 100 мМ Трис и 20 мМ NaCl (pH 8,0), а также приблизительно 400 спор в 100 ул воды. Микротитрационные планшеты заклеивают лентой во избежание испарения и загрязнения, а затем инкубируют при комнатной температуре на встряхивателе, работающем при 200 об/мин. Ежедневно в течение 8 дней измеряют поглощение при 620 нм и строят графическую зависимость концентрации белка от времени. Аминокислотное секвенирование Очищенные антигрибные белки, соответствующие пикам 3.1 и 3.2 на фиг. 3 (Посл. N 1 и 2 соответственно), источником которых является 0,3 М NaCl элюат из колонки с КМ-Сефарозой (фиг. 1); и белок, соответствующий пикам 1 и 2 на фиг. 6 (Посл. N 3), источником которого является 0,1 М NaCl элюат из указанной колонки с КМ-Сефарозой, карбоксилируют и подвергают ОФ-ЖХВР на Vydac C4 колонке. Системой растворителей являются система А: 0,1%-ный ТФА в воде и система Б: 0,1%-ный ТФА в ацетонитриле. Белки элюируются в виде отдельных пиков с малоотличающимися значениями времени удержания. C-концевые последовательности белков получают посредством расщепления их эндо-R-протеиназой и последующей очистки путем ОФ-ЖХВР на Vydac C18 колонке. Получение трансформированных растений Гены, кодирующие белки согласно изобретению, вводят в растения. На основе геноспецефических праймеров из соответствующих мРНК посредством ПЦР синтезируют кодирующие области генов, кодирующих эти белки. После введения промоторной и терминаторной последовательностей гены, кодирующие указанные белки, вводят в вектор для трансформации растений. Вектор может включать ген, кодирующий ПИН белок, а также белок, получаемый из листа ячменя, подвергнутого стрессовому воздействию, или зерна ячменя, и/или ген, кодирующий белок, описанный в Посл. N 4, Посл. N 5 и/или Посл. N 6, и/или ген, кодирующий хитиназу и/или глюканазу. Предпочтительной хитиназой является хитиназа 4, описанная [1] . Этими векторами может быть трансформирована, например Agrobacterium tumefaciens. Затем такой трансформированной Agrobacterium обрабатывают растительные клетки, а трансформированные таким образом растительные клетки регенерируют в целые растения, у которых новый ядерный материал стабильно включен в геном. Следует иметь в виду, однако, что ДНК, кодирующая белок согласно настоящему изобретению (или сочетания таких белков), возможно также кодирующая другие белки, может быть введена в растительные клетки другими известными способами, включая применение микрозарядной пушки, электропорацию, электротрансформацию, микроинъецирование и т. д., и что регенерацию трансформированных растительных клеток осуществляют согласно способам, известным специалистам, включая обработку клеток цитокинами, если это необходимо или желательно для того, чтобы увеличить частоту регенерации. Кроме того, подходящие микроорганизмы (например микроорганизмы, для которых продуцирование белков по настоящему изобретению не является существенно токсичным) могут быть трансформированы вектором, содержащим ген (или гены), кодирующий белок, таким образом, что трансформированные микроорганизмы продуцируют этот белок. Микроорганизмы могут содержать, кроме того, гены, кодирующие другие белки, такие как ПИН белок и/или белок, последовательность которого описана в одной или более из Посл. N 4-6. Кроме того, такие дополнительные белки могут также содержать различные хитиназы и/или глюканазы. Наиболее предпочтительным таким дополнительным белком является хитиназа 4, как описано [1]. Такие микроорганизмы могут быть затем использованы для борьбы с растительными патогенами. Например трансформированные микроорганизмы могут быть высушены и распылены на инфицированные растения или растения при угрозе инфицирования. Список последовательностей приведен в конце описания. ЛИТЕРАТУРА 1. PCT Patent Application N. PCT/DK92/00108, Publication N. WO 92/17591. 2. Hejgaard et al., FEBS Letters, 307, 389-392 (1992).ФОРМУЛА ИЗОБРЕТЕНИЯ1. Белок, обладающий фунгицидной активностью и имеющий аминокислотную последовательность, выбранную из группы аминокислотных последовательностей SEQ NO ID : 1, SEQ NO ID : 2 и SEQ NO ID : 3. 2. Рекомбинантная ДНК, кодирующая белок, обладающий фунгицидной активностью по п.1. 3. Рекомбинантная ДНК по п.2, имеющая последовательность, представленную в SEQ NO ID 7. 4. Способ борьбы с грибами, при котором на них воздействуют белком по п. 1.Популярные патенты: 2468582 Инсектицидно-фунгицидный состав и способ борьбы с вредителями и болезнями крестоцветных культур ... к общему числу растений на каждой площадке. Биологическую эффективность инсектицидов рассчитывали по формуле ВНИИЗР:Э=100-(В/А)×100,где Э - эффективность, выраженная % снижения поврежденности растений относительно контроля;В - поврежденность растений в опыте;А - поврежденность растений в контроле, Биологическую эффективность фунгицидов рассчитывали по формуле ВНИИЗР:Э=(А-В)/А×100, где А - количество пораженных растений в контроле; В - количество пораженных растений в опыте.Анализ полученных данных позволяет сделать вывод о преимуществах заявляемого состава (вариант 4) в сравнении с прототипом (вариант 3) и эталоном (вариант 2). При этом биологическая эффективность ... 2060618 Пневматический высевающий аппарат ... центр вращения диска, нижнюю точку начала зоны забора семян, и вертикальной линией, проходящей через центр вращения диска, составляет 105о, а угол между вертикальной линией и линией, проходящей через центр вращения диска и нижнюю точку зоны сброса семян, составляет 135о. Крышка 18 отделена от высевающего диска 19 капроновой накладкой 21 толщиной 3 мм, снабженной вырезом 25 и устройством для отсечения вакуума 26. Вырез 25 предназначен для обеспечения доступа вакуума к высевающему диску 20 и имеет конфигурацию и размеры просвета камеры разряжения 19, при наложении накладки на крышку в рабочем положении контуры выреза и камеры совпадают. В накладке 21 имеется глухой паз 27 (фиг.4), ... 2460269 Малогабаритный картофелеуборочный комбайн ... выше, отсекаются от ботвы, встретившись с клубнеотбойным прутком 23, и также скатываются вниз. Выброс свободных клубней назад вместе с почвой и растительными примесями предотвращается пластиной 22, а наматывание ботвы и растительных остатков на валец 18 - прутками 21 (гребенкой). В необходимых случаях угол наклона верхней ветви ворохоподъемного элеватора 15 регулируется перестановкой болта по отверстиям сектора 17.На верхней ветви клубнеприемного элеватора 11 клубни, встретившись с отражательным щитком 12, смещаются в сторону, сходят с поверхности элеватора и по лотку 24 поступают в тару (корзину, мешок). При этом мелкие почвенные примеси остаются на поверхности элеватора ... 2259028 Устройство для безотвальной обработки почвы ... а под заточкой наплавленный слой сормайта, расставленных симметрично и с зазором, при этом в каждом зазоре между плоскими треугольниками лапы размещен кронштейн в виде треугольной призмы, приваренный к нижней части стойки и имеющий выфрезерованный с дном, параллельным линии заточки, паз с несколькими резьбовыми отверстиями, в который вставлено плоское долото с нижней заточкой, с отверстием на конце, противоположном лезвию, и консольно закреплено с помощью винта, при этом глубина паза ограничена приваренной перемычкой, установленной на высоте, равной высоте долота, причем устройство снабжено комплектом сменных треугольников составляющих лап на ширину захвата лап 125 мм, 200 мм ... 2404898 Устройство на воздушной подушке для разбрасывателей органоминеральных удобрений ... в виде платформ с вентиляторами и камерами для образования воздушной подушки. На боковых приставках установлен складной портал с пантографом для обеспечения параллельности бортовых приставок и их размещения параллельно разбрасывателю. В таком устройстве сцепление бортовых приставок с разбрасывателем может быть выполнено через ободы его колес и дышло. Изобретение позволяет повышать проходимость полуприцепных разбрасывателей органоминеральных удобрений и увеличивать время их использования при применении на почвах со слабой несущей способностью. 1 з.п. ф-лы, 11 ил. Изобретение относится к транспортным средствам на воздушной подушке (ВП), непосредственно к машинам с ... |
Еще из этого раздела: 2250602 Широкозахватный колесный дождеватель 2405306 Способ определения содержания крахмала по содержанию глюкозы с учетом индивидуального коэффициента пересчета в растительном материале 2164741 Устройство для заготовки древесины 2051971 Способ определения биологической активности -эндотоксинов различных патотипов bacileus thuringiensis 2446688 Композиция для получения растительного организма с улучшенным содержанием сахара и ее применение 2254705 Способ уплотнения и герметизации консервируемых кормов в рулонах 2146444 Способ выявления и отбора стрессоустойчивых животных 2162635 Устройство для аэрозольного распыления (варианты) 2492623 Портативный электроинструмент с управлением спусковым механизмом 2228022 Способ ведения виноградных кустов |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||