Способ осуществления микробной деконтаминации тромбоцитов кровиПатент на изобретение №: 2156138 Автор: Марджори С. РИД (US), Артур П. БОДЕ (US), Луис Дж. СУММАРИА (US) Патентообладатель: ДЗЕ ЮНИВЕРСИТИ ОФ НОРТ КАРОЛИНА ЭТ ЧЕПЕЛ ХИЛ (US), ИСТ КАРОЛИНА ЮНИВЕРСИТИ (US), АРМОР ФАРМАСЬЮТИКАЛ КОМПАНИ (US) Дата публикации: 20 Сентября, 2000 Начало действия патента: 9 Апреля, 1996 Адрес для переписки: 129010, Москва, ул. Большая Спасская 25, стр.3, ООО "Городисский и Партнеры", Лебедевой Н.Г. Изображения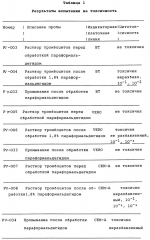 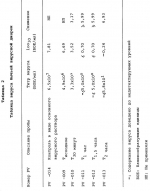 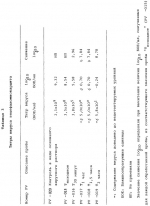 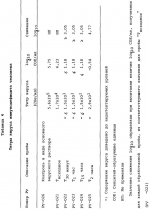 Изобретение относится к способам получения высушенных в фиксированном состоянии тромбоцитов, пригодных для введения пациентам. Способ инактивации микробиологических загрязнений в препарате тромбоцитов из человеческой крови включает получение тромбоцитов крови, приведение тромбоцитов в контакт с фиксаторами и высушивание тромбоцитов. Способ позволяет получить тромбоциты, которые остаются жизнеспособными после фиксирующей обработки. 7 з.п.ф-лы, 4 табл. , , , ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУНастоящее изобретение относится к способам получения высушенных в фиксированном состоянии тромбоцитов, пригодных для введения пациентам, в соответствии с которым микробная деконтаминация тромбоцитов достигается в ходе их приготовления. За последние тридцать лет в трансфузионной медицине прочно утвердилось использование концентратов тромбоцитов. Однако быстрая потеря тромбоцитами при хранении функциональной активности и риск бактериального загрязнения серьезно усложняют управление эффективным учетом концентратов тромбоцитов в банках крови. Во многих случаях ограниченный срок хранения концентратов тромбоцитов резко снижает возможности их применения. Клейн с соавт. (E. KIein et al., J. Pediatrics, 49, 517-522 (1956)) описывает способ приготовления и введения лиофилизированного тромбоцитарного материала детям с острым лейкозом и гипопластической анемией. При этом на месте вливания отмечались болезненность и веноспазм. В табл. 2 приведены данные, демонстрирующие ограниченную эффективность этих материалов. По прошествии более чем тридцати лет использования этот материал не позволил добиться успешных терапевтических результатов. Для того, чтобы сделать более управляемой для банков крови терапию трансфузии тромбоцитов, было уделено особое внимание разработке устройств для уменьшения или задержки в ходе хранения потери тромбоцитами их функциональной активности. Один из таких подходов лежит в области разработки бесплазменных сред для хранения (cм., например, S. Holme, Патент США N 4695460). Другой подход основан на использовании биохимических методов стабилизации тромбоцитов (cм. например, A. Bode et al. Патент США N 4994367). Известны также способ и устройство для дезинфекции биологических жидкостей и контейнер для них (cм. публикация PCT заявки WO 88/09655 A1, 15.12.88, стр. 26) Однако, несмотря на то, что эти методы увеличивают срок годности тромбоцитов, они не способны увеличивать его на значительный период времени. И наконец, получение тромбоцитарных мембранных микровезикул среди других, также из устаревших тромбоцитовб описано в патенте США N 5185160 (F. Chao). Тромбоциты, полученные при высушивании фиксированных препаратов крови, с целью использования в диагностических процедурах, раскрыты в патенте США N 4287087 (Brinkhous et al.). В то время, как такие высушенные в фиксированном состоянии тромбоцитные препараты, предназначенные для диагностических целей, могут храниться в течение длительного периода времени, они до настоящего времени не применялись для фармацевтического введения человеку. В соответствии с вышесказанным, имеется насущная потребность в новых способах приготовления препаратов тромбоцитов крови, которые обладали бы увеличенным сроком хранения и были пригодны для введения, при необходимости, человеку. В документе Рида с соавт. (M. Read et al. Публикация PCT заявки WO 93/23997 (опубликована 9 декабря 1993) описываются препараты высушенных в фиксированном состоянии тромбоцитов крови, а также способы их получения. В настоящем изобретении раскрывается способ инактивации микробиологического загрязнения препаратов тромбоцитов человеческой крови. Указанный способ включает, во-первых, получение тромбоцитов крови, в частности тромбоцитов человеческой крови, в отношении которых имеется подозрение на наличие контаминации микроорганизмами (т.е. бактериями, вирусами). После этого тромбоциты приводят в контакт с фиксатором в течение периода времени, достаточного для фиксирования тромбоцитов, и затем (предпочтительно) промывают и высушивают с получением тромбоцитов, высушенных в фиксированном состоянии. Стадию взаимодействия тромбоцитов с фиксатором осуществляют в течение времени, достаточного для того, чтобы убить некоторые или все загрязняющие материал микроорганизмы. Однако, длительность указанной стадии не должна быть слишком большой, чтобы не вызвать потерю способности тромбоцитов после высушивания и восстановления: (i) прилипать к тромбогенным поверхностям; (ii) не прилипать к нетромбогенным поверхностям; (iii) изменять форму (расширяться) при прилипании к тромбогенной поверхности; (iv) прилипать друг к другу с образованием гемостатической закупоривавшей массы в случае прилипания к тромбогенной поверхности; и (v) высвобождать свое гранулярное содержимое. Иными словами, тромбоциты должны оставаться жизнеспособными после фиксирующей обработки. Упомянутые выше, а также другие цели и аспекты настоящего изобретения будут подробно описаны в приведенной ниже спецификации. В процессе изготовления фармацевтических биопрепаратов из крови желательно включать стадии, направленные либо на удаление, либо на инактивацию (т. е. уничтожение микроорганизмов) микробной инфективности в течение ряда log циклов. Независимо от того, какой процесс инактивации имеет место: частичного уничтожения микроорганизмов (т.е. это могут быть бактерицидный или варицидный процессы) или полного уничтожения микроорганизмов (что имеет место, например, при стерилизации), он дает уверенность в том, что побочные вещества, включая контаминанты, которые могут вводиться с исходным материалом, не присутствуют в готовом продукте. Способ настоящего изобретения может быть осуществлен с применением фиксатора, выбранного из группы, состоящей из формальдегида, параформальдегида и глютаральдегида. Фиксацию такими агентами следует проводить осторожно, используя для этого модифицированную процедуру, приведенную в патенте США N 4287087 с тем, чтобы избежать потери жизнеспособности тромбоцитов. В общих чертах процедура состоит в том, что промытые тромбоциты фиксируют путем инкубирования их, в типичном случае при комнатной температуре в течение периода времени до 60 минут (и предпочтительно по меньшей мере, 30 или 45 минут в случае некоторых вирусов, которые инактивируются уже в течение 30 минут) в растворе, содержащем до 1,8% фиксатора (предпочтительно, от 1 до 2% фиксатора). Как будет более подробно описано ниже, следует также соблюдать осторожность для достижения достаточного фиксирования тромбоцитов или для того, чтобы избежать чрезмерного лизиса их в ходе высушивания. Альтернативная техника состоит в фиксации тромбоцитов при инкубировании их в растворе перманганата (например, перманганата натрия, перманганата калия). В общем, в рамках этой методики промытые тромбоциты могут быть получены при инкубировании их в течение от 5 до 20 минут в растворе KMnO4 или NaMnO4 концентрации от 0,001 до 1 г/дл, более предпочтительно, при инкубировании их в течение от 5 до 15 минут в растворе KMnO4 или NaMnO4 концентрации от 0,005 до 0,5 г/дл, и наиболее предпочтительно, при инкубировании их в течение от 8 до 12 минут в растворе KMnO4 или NaMnO4 концентрации от 0,005 до 0,05 г/дл. Препараты тромбоцитов крови, предназначенные для использования в изготовлении фармацевтических средств, должны быть практически свободны от примесей инородных материалов, в особенности, лизированных тромбоцитов крови, представляющих собой свободные тромбогенные агенты, которые могут вводиться пациенту. В этой связи, следует соблюдать особую тщательность для того, чтобы достичь достаточной степени фиксации тромбоцитов (но без нарушения их жизнеспособности, что уже было отмечено выше) перед сушкой, поскольку в противном случае на стадии высушивания может происходить чрезмерный лизис. Так, например, препараты тромбоцитов, пригодные для использования в изготовлении фармацевтических средств для человека, предпочтительно характеризуются при их восстановлении наличием 109 тромбоцитов в одном миллилитре раствора, менее 10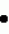 106 микрочастиц (фрагментарных остатков лизированных тромбоцитов) на миллилитр и предпочтительно демонстрируют активность лактатдегидрогеназы менее 150 Международных Единиц (МЕ) на литр, изменяемую в супернатанте после ресуспендирования и гранулирования (при этом 2200 МЕ на литр отражает полный лизис 109 клеток в 1 миллилитре). Высушивание тромбоцитов после фиксации может быть осуществлено любым подходящим способом, но предпочтительно его проводят лиофилизацией. Следует принять меры предосторожности и стабилизировать препараты тромбоцитов перед высушиванием, чтобы не допустить неприемлемо высокого уровня лизиса тромбоцитов. Стабилизация может быть проведена при суспендировании тромбоцитов в растворе, содержащем подходящую молекулу, замещающую воду (или "стабилизатор"), такую как альбумин или трегалозу, с последующим высушиванием раствора. В одном из вариантов осуществления изобретения используют от 0,1 до 20 мас.% альбумина, более предпочтительно используют от 1 до 10 мас.% и наиболее предпочтительно используют от 5 до 10 мас.% альбумина. Вводимый объекту альбумин должен принадлежать к тому же виду, что и объект, в организм которого его вводят (например, человеческий альбумин). В альтернативном варианте, препарат можно высушить с альбумином, выделенным из другого вида, это может быть альбумин, выделяемый из тромбоцитов при восстановлении, и альбумин того же вида, добавляемый вновь в восстановленный препарат для введения объекту, однако, следует соблюдать особую тщательность, чтобы удалить весь относящийся к другому виду специфический альбумин, поскольку он может обладать антигенными свойствами для объекта, которому вводят рассматриваемый препарат. Фармацевтические композиции по настоящему изобретению могут просто включать высушенные (предпочтительно лиофилизированные) тромбоциты, которые должны быть стерильными и свободными от пирогенов и находиться в стерильной асептической упаковке. Как указывалось выше, в композицию может быть включен альбумин. Фармацевтические композиции могут также включать препарат тромбоцитов по настоящему изобретению, восстановленный в фармацевтически приемлемом носителе. Для повторной гидратации тромбоцитов, которые будут при этом обладать перечисленными выше характеристиками и окажутся пригодными для внутривенных инъекций, может использоваться любой водный носитель (например, стерильный, не содержащий пирогенов физиологический раствор). В восстановленную композицию могут быть введены дополнительные агенты, такие как буферы, консерванты и другие терапевтически активные средства (cм., например, патент США N 4994367 - раскрытие его приведено в настоящем описании в качестве ссылки). Восстановленные фармацевтические композиции по настоящему изобретению в типичном случае вводят человеку путем внутривенной инъекции. К нуждающимся в таком лечении пациентам относятся пациенты с тромбоцитопенией (в том числе такие, у которых наблюдается вымывание тромбоцитов), пациенты с геморрагической дисфункцией тромбоцитов, и пациенты с сильным кровотечением, вызванным травмой. Количество вводимой в организм пациента композиции будет изменяться в зависимости от веса и состояния больного, однако, в типичном случае она варьируется по концентрации, составляя от 20 до 350 миллилитров по объему и от 1 106 микрочастиц (фрагментарных остатков лизированных тромбоцитов) на миллилитр и предпочтительно демонстрируют активность лактатдегидрогеназы менее 150 Международных Единиц (МЕ) на литр, изменяемую в супернатанте после ресуспендирования и гранулирования (при этом 2200 МЕ на литр отражает полный лизис 109 клеток в 1 миллилитре). Высушивание тромбоцитов после фиксации может быть осуществлено любым подходящим способом, но предпочтительно его проводят лиофилизацией. Следует принять меры предосторожности и стабилизировать препараты тромбоцитов перед высушиванием, чтобы не допустить неприемлемо высокого уровня лизиса тромбоцитов. Стабилизация может быть проведена при суспендировании тромбоцитов в растворе, содержащем подходящую молекулу, замещающую воду (или "стабилизатор"), такую как альбумин или трегалозу, с последующим высушиванием раствора. В одном из вариантов осуществления изобретения используют от 0,1 до 20 мас.% альбумина, более предпочтительно используют от 1 до 10 мас.% и наиболее предпочтительно используют от 5 до 10 мас.% альбумина. Вводимый объекту альбумин должен принадлежать к тому же виду, что и объект, в организм которого его вводят (например, человеческий альбумин). В альтернативном варианте, препарат можно высушить с альбумином, выделенным из другого вида, это может быть альбумин, выделяемый из тромбоцитов при восстановлении, и альбумин того же вида, добавляемый вновь в восстановленный препарат для введения объекту, однако, следует соблюдать особую тщательность, чтобы удалить весь относящийся к другому виду специфический альбумин, поскольку он может обладать антигенными свойствами для объекта, которому вводят рассматриваемый препарат. Фармацевтические композиции по настоящему изобретению могут просто включать высушенные (предпочтительно лиофилизированные) тромбоциты, которые должны быть стерильными и свободными от пирогенов и находиться в стерильной асептической упаковке. Как указывалось выше, в композицию может быть включен альбумин. Фармацевтические композиции могут также включать препарат тромбоцитов по настоящему изобретению, восстановленный в фармацевтически приемлемом носителе. Для повторной гидратации тромбоцитов, которые будут при этом обладать перечисленными выше характеристиками и окажутся пригодными для внутривенных инъекций, может использоваться любой водный носитель (например, стерильный, не содержащий пирогенов физиологический раствор). В восстановленную композицию могут быть введены дополнительные агенты, такие как буферы, консерванты и другие терапевтически активные средства (cм., например, патент США N 4994367 - раскрытие его приведено в настоящем описании в качестве ссылки). Восстановленные фармацевтические композиции по настоящему изобретению в типичном случае вводят человеку путем внутривенной инъекции. К нуждающимся в таком лечении пациентам относятся пациенты с тромбоцитопенией (в том числе такие, у которых наблюдается вымывание тромбоцитов), пациенты с геморрагической дисфункцией тромбоцитов, и пациенты с сильным кровотечением, вызванным травмой. Количество вводимой в организм пациента композиции будет изменяться в зависимости от веса и состояния больного, однако, в типичном случае она варьируется по концентрации, составляя от 20 до 350 миллилитров по объему и от 1 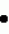 109 до 3 109 до 3 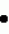 109 тромбоцитов на миллилитр (и более предпочтительно, от 2 109 тромбоцитов на миллилитр (и более предпочтительно, от 2 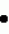 109 до 3 109 до 3  109 тромбоцитов на миллилитр). Фармацевтические композиции могут быть упакованы в стерильный, не содержащий пирогенов контейнер, который содержит указанные объемы и дозировки в виде разовой стандартной дозы. Настоящее изобретение описывается подробно в приведенных ниже примерах. При этом следует учитывать, что эти примеры приведены лишь с иллюстративной целью и ни в коей мере не могут быть истолкованы как ограничивающие каким-либо образом настоящее изобретение. Пример 1 Получение тромбоцитов крови, высушенных после фиксирования А. Получение лиофилизированных тромбоцитов человека (Протокол 1). Тромбоциты человека получают из крови, отобранной в среду с кислотно-цитратно-декстрозным антикоагулянтом [КЦД (ACD)] (0,085 М тринатрий-цитрат, 0,0702 М лимонная кислота, 0,111 М декстроза, pH 4,5) в соотношении одна часть антикоагулянта на 5,66 частей крови. Тромбоциты выделяли дифференциальным центрифугированием и трижды промывали кислотно-цитратно-солевым раствором (0,00544 М тринатрий-цитрат, 0,154 М NaCl, доводили до pH 6,5 с помощью 0,1 N HCl). После промывания тромбоциты фиксировали при инкубировании промытых тромбоцитов, отобранных из 100 мл крови, в 5,0 мл 1,8%-ного раствора параформальдегида (для приготовления которого к 9,0 мл 4%-ного раствора параформальдегида добавляли 1,0 мл КЦД плюс 10,0 мл 0,135 М NaH2PO4) в течение 45 минут при комнатной температуре (время фиксирования может быть продлено до 60 минут). В альтернативном варианте инкубируют промытые тромбоциты, выделенные из 100 мл крови, в 1,0%-ном растворе параформальдегида в течение 45 минут при комнатной температуре (время фиксирования может быть продлено до 60 минут). Для удаления параформальдегида, после инкубации с параформальдегидом, к каждой пробирке добавляют равный объем имидазолсодержащего солевого буфера (0,084 М имидазола; 0,146 М NaCl, доведенного до pH 6,8 с помощью 1,0 N HCl) и осаждают тромбоциты центрифугированием при 1500 109 тромбоцитов на миллилитр). Фармацевтические композиции могут быть упакованы в стерильный, не содержащий пирогенов контейнер, который содержит указанные объемы и дозировки в виде разовой стандартной дозы. Настоящее изобретение описывается подробно в приведенных ниже примерах. При этом следует учитывать, что эти примеры приведены лишь с иллюстративной целью и ни в коей мере не могут быть истолкованы как ограничивающие каким-либо образом настоящее изобретение. Пример 1 Получение тромбоцитов крови, высушенных после фиксирования А. Получение лиофилизированных тромбоцитов человека (Протокол 1). Тромбоциты человека получают из крови, отобранной в среду с кислотно-цитратно-декстрозным антикоагулянтом [КЦД (ACD)] (0,085 М тринатрий-цитрат, 0,0702 М лимонная кислота, 0,111 М декстроза, pH 4,5) в соотношении одна часть антикоагулянта на 5,66 частей крови. Тромбоциты выделяли дифференциальным центрифугированием и трижды промывали кислотно-цитратно-солевым раствором (0,00544 М тринатрий-цитрат, 0,154 М NaCl, доводили до pH 6,5 с помощью 0,1 N HCl). После промывания тромбоциты фиксировали при инкубировании промытых тромбоцитов, отобранных из 100 мл крови, в 5,0 мл 1,8%-ного раствора параформальдегида (для приготовления которого к 9,0 мл 4%-ного раствора параформальдегида добавляли 1,0 мл КЦД плюс 10,0 мл 0,135 М NaH2PO4) в течение 45 минут при комнатной температуре (время фиксирования может быть продлено до 60 минут). В альтернативном варианте инкубируют промытые тромбоциты, выделенные из 100 мл крови, в 1,0%-ном растворе параформальдегида в течение 45 минут при комнатной температуре (время фиксирования может быть продлено до 60 минут). Для удаления параформальдегида, после инкубации с параформальдегидом, к каждой пробирке добавляют равный объем имидазолсодержащего солевого буфера (0,084 М имидазола; 0,146 М NaCl, доведенного до pH 6,8 с помощью 1,0 N HCl) и осаждают тромбоциты центрифугированием при 1500 g в течение 8 минут при комнатной температуре. Декантируют супернатант и промывают тромбоциты при суспендировании осадка тромбоцитов в 5-10 мл имидазолсодержащего солевого буфера, pH 7,35. Промывание повторяют еще два раза для удаления всего параформальдегида. После третьего промывания тромбоциты повторно суспендируют в 5%-ном растворе сывороточного альбумина (5 г альбумина на 100 цитратно-солевого раствора: 0,0054 М цитрата натрия, 0,154 NaCl, pH 6,5). Производят подсчет числа тромбоцитов с использованием фазово-контрастного микроскопа и гемоцитометра (American Optical Bright-Line Hemocytometer). Концентрацию тромбоцитов доводят до 800000 на 1 мм3. Аликвоты (10 мл) тромбоцитов с откорректированной концентрацией в растворе сывороточного альбумина помещают в 20-мл стеклянные флаконы и замораживают при -70oC. Затем тромбоциты лиофилизируют в течение 12 часов или до появления ломкого белого порошка. Тромбоцитарный продукт может быть также обработан замораживанием в больших объемах от 100 до 500 мл с последующей лиофилизацией при -40oC в течение четырех часов, после чего в течение всего периода сушки температуру поднимают до -25oC. Лиофилизированный продукт хранят при температуре от -20 до -70oC до момента использования. Лиофилизированные тромбоциты регидратируют с помощью 0,084 М имидазольного буфера (без добавления соли), доведенного до pH 7,35 с помощью 1,0 М NaOH. После добавления имидазольного буфера раствору дают осесть, не трогая его в течение нескольких минут, затем его осторожно перемешивают при прокатывании или вращении пробирки с образованием однородной суспензии регидратированных одиночных тромбоцитов. Б. Получение лиофилизированных тромбоцитов человека (Протокол 2). Цельную кровь отбирают от здоровых добровольных доноров в коммерческие контейнеры для сбора крови (Fenwal 4R6402, Baxter Health Care), содержащие стандартную антикоагулирующую добавку (CPDA-1). Окончательный объем каждой стандартной упаковки отобранной цитратной цельной крови составляет 500 см3. Каждый пакет цельной крови центрифугируют с получением плазмы, обогащенной тромбоцитами [PRP (ТОП)] , которую отсасывают из пакета и промывают в ходе трех стадий центрифугирования/ресуспендирования в фосфатно-буферном солевом растворе (так же, как описано в пункте А). Промытые тромбоциты затем снова центрифугируют и осадок обрабатывают забуференным раствором, содержащим 1,8% параформальдегида (который был описан выше в пункте А) в течение периода времени от 45 минут до 1 часа при комнатной температуре. Выход тромбоцитов после удаления стабилизирующего реагента и проведения дальнейшей промывки тромбоцитов для удаления параформальдегида составляет 60 - 80% от количества их в тромбоцитарной суспензии до стабилизации. В том случае, когда в буфер для промывания после стабилизации не добавляют альбумин, выход тромбоцитов падает. Для достижения соответствующего выхода важна композиция окончательной тромбоцитарной ресуспензии, перед сушкой замораживанием. В целом, для получения в результате стадий лиофилизации/регидратации выходов тромбоцитов в диапазоне от 85 до 100% необходимо эффективное количество стабилизатора, такого как альбумин или трегалоза в солевом буфере. Альбумин следует включать в количестве от 0,1 до 50 г/дл, более предпочтительно - в количестве от 1 до 25 г/дл, и наиболее предпочтительно - в количестве от 5 до 10 г/дл. Трегалозу следует включать в количестве от 0,1 до 10,0 М, более предпочтительно - от 0,2 до 5 М, и наиболее предпочтительно - от 0,5 до 1,0 М. Для регидратации могут быть использованы растворы нескольких типов без заметных различий в параметрах выхода: фосфатно-буферный солевой раствор, pH 7,3, трис-буферный солевой раствор, pH 7,4, имидазольно-буферный солевой раствор или UNISOLTM физиологически сбалансированный солевой раствор. Пример 2 Бактериальная деконтаминация тромбоцитов крови Цель данного изобретения заключалась в том, чтобы продемонстрировать кинетику инактивации бактерий в процессе консервации тромбоцитов с помощью 1,8% параформальдегида. Из Американского Красного Креста были получены двенадцать пакетов с тромбоцитами. Каждый пакет был инъецирован культурой Bacillus cereus с достижением конечной концентрации в 50 колоний-образующий единиц (КОЕ)/мл во всех стандартных упаковках. Тромбоциты из шести пакетов обрабатывали с получением лиофилизированных тромбоцитов, используя для этого процедуру, описанную выше в примере 1, протокол 1, и возвращали их в пакет для хранения тромбоцитов. Шесть других образцов оставляли в исходных пакетах для хранения. Проводили ежедневное количественное обсеменение всех пакетов в течение семи дней бактериальными культурами (серийные разведения по 0,1 мл распределяли с одним повтором по чашкам с кровяным агаром, которые инкубировали при 37oC в течение 48 часов) до достижения сильной контаминации. В результате: Bacillus cereus вырос для всех шести хранившихся в стандартных условиях пакетах, но ни в одной из чашек с обработанными тромбоцитами. Во втором эксперименте шесть пакетов с тромбоцитами инокулировали культурой Staphylococcus epidermis до конечной концентрации 50 КОЕ/мл. Каждый тромбоцитный пакет разделяли на две равные пробы. Одну пробу из каждого тромбоцитного пакета обрабатывали с проведением стадий фиксирования и промывания, описанных в примере 1, протокол 1, и затем возвращали их в новый тромбоцитный пакет для хранения. Оставшиеся пробы хранили в обычных условиях. В результате в необработанных пробах рост S.epidermis отмечался к третьему дню хранения для всех пакетов. При этом в предварительных экспериментах было показано, что S.epidermis, инокулированный в тромбоцитные единицы в концентрации 50 КОЕ/мл, приводит к 100%-ному росту единиц к 7-ому дню (см. , например, M.Brecher et al. Transfusion 34, 750-755 (1994)). Тромбоциты, прошедшие обработку на стадиях фиксирования и промывания, описанных в примере 1, оставались стерильными в течение всего 7-дневного периода наблюдения. Пример 3 Вирусная деконтаминация тромбоцитов крови В этом эксперименте исследуют вирусную модель, обладающую большим набором вирусных характеристик, на возможность инактивации в пяти отдельных временных точках при инкубации с 1,8% параформальдегидом, по существу так же, как это было описано в примере 1. Для указанного испытания были отобраны следующие вирусы, несущие в себе широкие биохимические и структурные особенности, которые могут соответствовать таковым у потенциальных вирусов-контаминантов, имеющихся в исходном материале: 1) Вирус бычьей вирусной диареи (BVD, штамм KY-22) представляет собой покрытый оболочкой РНК-содержащий вирус размером 40-70 нм. Последние исследования вирусного генома и физических характеристик вируса гепатита с (HCV, известный ранее как гепатит не-A и не-B типа) показали, что он является членом семейства флавивирусов и наиболее близок к роду пестивирусов. Поскольку HCV не может размножаться in vitro, и отсутствуют иные животные модели, пригодные для инфекции HCV, кроме шимпанзе, в исследованиях по сертификации метода для HCV была использована модель BDV. 2) Вирус энцефаломиокардита (EMC, штамм EMC) представляет собой не покрытый оболочкой РНК-содержащий Пикорнавирус размером 28-30 нм, очень устойчивый ко многим стандартным процедурам, применяемым для инактивации вирусов. Указанный вирус относится к тому же семейству, что и вирус гепатита A, и может в этой связи служить для него хорошей моделью. 3) Вирус иммунодефицита человека (HIV (ВИЧ), штамм HTLV - ШВ), представляет собой покрытый оболочкой РНК-содержащий ретровирус размером 80-100 нм, который является потенциальным контаминантом человеческой крови. HIV определяют in vitro титрованием в тесте с CEM-A синцитием. После инфицирования ВИЧ у CEM-A клеток за 7-10 дней развиваются легко обнаруживаемые многоядерные клетки, или синцитии. Весь объем исследований, относящийся к работе с ВИЧ, был проведен с использованием аппаратуры Кволити Биотек BSL-3 (Quality Bio-tech"s BSL-3). I. Процедура А. Материалы В соответствии с описанной выше процедурой, готовили аликвоты стерильного исходного материала (тромбоциты в цитратно-солевом буфере). Исследуемый материал хранили при температуре 22-28oC. Аликвоты 4% параформальдегида, 0,135 М натрий-фосфатного буфера, ACD буфера и имидазол/солевого буфера хранили при комнатной температуре. Б. Исследование на токсичность В предварительных испытаниях, предназначенных для дальнейших исследований, материал был протестирован на токсичность с использованием BT-1 индикаторных клеток с целью определения титра BVD, VERO индикаторных клеток - с целью определения титра EMC и CEM-A индикаторных клеток с целью определения титра ВИЧ-1. Для каждого из перечисленных вирусов испытанию на токсичность подвергали следующие пробы: 1) тромбоцитарный раствор перед проведением параформальдегидной обработки; 2) тромбоцитарный раствор после обработки в 1,8%-ном параформальдегиде. В начале тестирования проводили "провокационную обработку" ("mock spiked") 1,8 мл "Тромбоцитарного раствора перед проведением параформальдегидной обработки" (PV-001) с применением 0,2 мл ресуспендирующего буфера для вируса. Затем добавляли 1,8 мл 4% параформальдегида. Получали следующие пробы: PV-004, PV-006 и PV-008. Вторую аликвоту готовили при проведении "провокационной обработки" ("mock spiked") 3,3 мл раствора тромбоцитов (PV-001) с применением 0,7 мл ресуспендирующего буфера для вируса. Получали следующие пробы, PV-003, PV-005, PV-007. Все образцы в двойном повторе тестировали на цитотоксичность относительно соответствующих индикаторных клеток при использовании их в полной активности, а также в 10-кратном и 100-кратном разведениях (в минимальной эссенциальной среде Игла, EMEM) в соответствии со стандартным протоколом титрования для каждого вируса (см. Раздел 4.60). Цитотоксичными считались те пробы, которые вызывали образование монослоев из индикаторных клеток, которые сливаются менее чем на 50%. Результаты предварительных испытаний токсичности указывали на значительный уровень токсичности проб, содержащих параформальдегид. Поэтому испытанию подвергли также дополнительные пробы, состоящие из тромбоцитов, которые прошли параформальдегидную обработку, после чего из них был удален параформальдегид с помощью центрифугирования и последующего промывания. Эти образцы тестировали непосредственно (без "провокационной обработки") на токсичность в соответствии с описанной процедурой. При этом получали пробы PV-032, PV-033, PV-034. В. Испытание на инактивацию Для каждого исследуемого вируса готовят следующие пробы: 1) Tисходное 2) T30 минут 3) T1 час 4) T1,5 часа 5) T2 часа Исходный материал (3,6 мл тромбоцитов в цитратно-солевом буфере), который имел температуру 25 g в течение 8 минут при комнатной температуре. Декантируют супернатант и промывают тромбоциты при суспендировании осадка тромбоцитов в 5-10 мл имидазолсодержащего солевого буфера, pH 7,35. Промывание повторяют еще два раза для удаления всего параформальдегида. После третьего промывания тромбоциты повторно суспендируют в 5%-ном растворе сывороточного альбумина (5 г альбумина на 100 цитратно-солевого раствора: 0,0054 М цитрата натрия, 0,154 NaCl, pH 6,5). Производят подсчет числа тромбоцитов с использованием фазово-контрастного микроскопа и гемоцитометра (American Optical Bright-Line Hemocytometer). Концентрацию тромбоцитов доводят до 800000 на 1 мм3. Аликвоты (10 мл) тромбоцитов с откорректированной концентрацией в растворе сывороточного альбумина помещают в 20-мл стеклянные флаконы и замораживают при -70oC. Затем тромбоциты лиофилизируют в течение 12 часов или до появления ломкого белого порошка. Тромбоцитарный продукт может быть также обработан замораживанием в больших объемах от 100 до 500 мл с последующей лиофилизацией при -40oC в течение четырех часов, после чего в течение всего периода сушки температуру поднимают до -25oC. Лиофилизированный продукт хранят при температуре от -20 до -70oC до момента использования. Лиофилизированные тромбоциты регидратируют с помощью 0,084 М имидазольного буфера (без добавления соли), доведенного до pH 7,35 с помощью 1,0 М NaOH. После добавления имидазольного буфера раствору дают осесть, не трогая его в течение нескольких минут, затем его осторожно перемешивают при прокатывании или вращении пробирки с образованием однородной суспензии регидратированных одиночных тромбоцитов. Б. Получение лиофилизированных тромбоцитов человека (Протокол 2). Цельную кровь отбирают от здоровых добровольных доноров в коммерческие контейнеры для сбора крови (Fenwal 4R6402, Baxter Health Care), содержащие стандартную антикоагулирующую добавку (CPDA-1). Окончательный объем каждой стандартной упаковки отобранной цитратной цельной крови составляет 500 см3. Каждый пакет цельной крови центрифугируют с получением плазмы, обогащенной тромбоцитами [PRP (ТОП)] , которую отсасывают из пакета и промывают в ходе трех стадий центрифугирования/ресуспендирования в фосфатно-буферном солевом растворе (так же, как описано в пункте А). Промытые тромбоциты затем снова центрифугируют и осадок обрабатывают забуференным раствором, содержащим 1,8% параформальдегида (который был описан выше в пункте А) в течение периода времени от 45 минут до 1 часа при комнатной температуре. Выход тромбоцитов после удаления стабилизирующего реагента и проведения дальнейшей промывки тромбоцитов для удаления параформальдегида составляет 60 - 80% от количества их в тромбоцитарной суспензии до стабилизации. В том случае, когда в буфер для промывания после стабилизации не добавляют альбумин, выход тромбоцитов падает. Для достижения соответствующего выхода важна композиция окончательной тромбоцитарной ресуспензии, перед сушкой замораживанием. В целом, для получения в результате стадий лиофилизации/регидратации выходов тромбоцитов в диапазоне от 85 до 100% необходимо эффективное количество стабилизатора, такого как альбумин или трегалоза в солевом буфере. Альбумин следует включать в количестве от 0,1 до 50 г/дл, более предпочтительно - в количестве от 1 до 25 г/дл, и наиболее предпочтительно - в количестве от 5 до 10 г/дл. Трегалозу следует включать в количестве от 0,1 до 10,0 М, более предпочтительно - от 0,2 до 5 М, и наиболее предпочтительно - от 0,5 до 1,0 М. Для регидратации могут быть использованы растворы нескольких типов без заметных различий в параметрах выхода: фосфатно-буферный солевой раствор, pH 7,3, трис-буферный солевой раствор, pH 7,4, имидазольно-буферный солевой раствор или UNISOLTM физиологически сбалансированный солевой раствор. Пример 2 Бактериальная деконтаминация тромбоцитов крови Цель данного изобретения заключалась в том, чтобы продемонстрировать кинетику инактивации бактерий в процессе консервации тромбоцитов с помощью 1,8% параформальдегида. Из Американского Красного Креста были получены двенадцать пакетов с тромбоцитами. Каждый пакет был инъецирован культурой Bacillus cereus с достижением конечной концентрации в 50 колоний-образующий единиц (КОЕ)/мл во всех стандартных упаковках. Тромбоциты из шести пакетов обрабатывали с получением лиофилизированных тромбоцитов, используя для этого процедуру, описанную выше в примере 1, протокол 1, и возвращали их в пакет для хранения тромбоцитов. Шесть других образцов оставляли в исходных пакетах для хранения. Проводили ежедневное количественное обсеменение всех пакетов в течение семи дней бактериальными культурами (серийные разведения по 0,1 мл распределяли с одним повтором по чашкам с кровяным агаром, которые инкубировали при 37oC в течение 48 часов) до достижения сильной контаминации. В результате: Bacillus cereus вырос для всех шести хранившихся в стандартных условиях пакетах, но ни в одной из чашек с обработанными тромбоцитами. Во втором эксперименте шесть пакетов с тромбоцитами инокулировали культурой Staphylococcus epidermis до конечной концентрации 50 КОЕ/мл. Каждый тромбоцитный пакет разделяли на две равные пробы. Одну пробу из каждого тромбоцитного пакета обрабатывали с проведением стадий фиксирования и промывания, описанных в примере 1, протокол 1, и затем возвращали их в новый тромбоцитный пакет для хранения. Оставшиеся пробы хранили в обычных условиях. В результате в необработанных пробах рост S.epidermis отмечался к третьему дню хранения для всех пакетов. При этом в предварительных экспериментах было показано, что S.epidermis, инокулированный в тромбоцитные единицы в концентрации 50 КОЕ/мл, приводит к 100%-ному росту единиц к 7-ому дню (см. , например, M.Brecher et al. Transfusion 34, 750-755 (1994)). Тромбоциты, прошедшие обработку на стадиях фиксирования и промывания, описанных в примере 1, оставались стерильными в течение всего 7-дневного периода наблюдения. Пример 3 Вирусная деконтаминация тромбоцитов крови В этом эксперименте исследуют вирусную модель, обладающую большим набором вирусных характеристик, на возможность инактивации в пяти отдельных временных точках при инкубации с 1,8% параформальдегидом, по существу так же, как это было описано в примере 1. Для указанного испытания были отобраны следующие вирусы, несущие в себе широкие биохимические и структурные особенности, которые могут соответствовать таковым у потенциальных вирусов-контаминантов, имеющихся в исходном материале: 1) Вирус бычьей вирусной диареи (BVD, штамм KY-22) представляет собой покрытый оболочкой РНК-содержащий вирус размером 40-70 нм. Последние исследования вирусного генома и физических характеристик вируса гепатита с (HCV, известный ранее как гепатит не-A и не-B типа) показали, что он является членом семейства флавивирусов и наиболее близок к роду пестивирусов. Поскольку HCV не может размножаться in vitro, и отсутствуют иные животные модели, пригодные для инфекции HCV, кроме шимпанзе, в исследованиях по сертификации метода для HCV была использована модель BDV. 2) Вирус энцефаломиокардита (EMC, штамм EMC) представляет собой не покрытый оболочкой РНК-содержащий Пикорнавирус размером 28-30 нм, очень устойчивый ко многим стандартным процедурам, применяемым для инактивации вирусов. Указанный вирус относится к тому же семейству, что и вирус гепатита A, и может в этой связи служить для него хорошей моделью. 3) Вирус иммунодефицита человека (HIV (ВИЧ), штамм HTLV - ШВ), представляет собой покрытый оболочкой РНК-содержащий ретровирус размером 80-100 нм, который является потенциальным контаминантом человеческой крови. HIV определяют in vitro титрованием в тесте с CEM-A синцитием. После инфицирования ВИЧ у CEM-A клеток за 7-10 дней развиваются легко обнаруживаемые многоядерные клетки, или синцитии. Весь объем исследований, относящийся к работе с ВИЧ, был проведен с использованием аппаратуры Кволити Биотек BSL-3 (Quality Bio-tech"s BSL-3). I. Процедура А. Материалы В соответствии с описанной выше процедурой, готовили аликвоты стерильного исходного материала (тромбоциты в цитратно-солевом буфере). Исследуемый материал хранили при температуре 22-28oC. Аликвоты 4% параформальдегида, 0,135 М натрий-фосфатного буфера, ACD буфера и имидазол/солевого буфера хранили при комнатной температуре. Б. Исследование на токсичность В предварительных испытаниях, предназначенных для дальнейших исследований, материал был протестирован на токсичность с использованием BT-1 индикаторных клеток с целью определения титра BVD, VERO индикаторных клеток - с целью определения титра EMC и CEM-A индикаторных клеток с целью определения титра ВИЧ-1. Для каждого из перечисленных вирусов испытанию на токсичность подвергали следующие пробы: 1) тромбоцитарный раствор перед проведением параформальдегидной обработки; 2) тромбоцитарный раствор после обработки в 1,8%-ном параформальдегиде. В начале тестирования проводили "провокационную обработку" ("mock spiked") 1,8 мл "Тромбоцитарного раствора перед проведением параформальдегидной обработки" (PV-001) с применением 0,2 мл ресуспендирующего буфера для вируса. Затем добавляли 1,8 мл 4% параформальдегида. Получали следующие пробы: PV-004, PV-006 и PV-008. Вторую аликвоту готовили при проведении "провокационной обработки" ("mock spiked") 3,3 мл раствора тромбоцитов (PV-001) с применением 0,7 мл ресуспендирующего буфера для вируса. Получали следующие пробы, PV-003, PV-005, PV-007. Все образцы в двойном повторе тестировали на цитотоксичность относительно соответствующих индикаторных клеток при использовании их в полной активности, а также в 10-кратном и 100-кратном разведениях (в минимальной эссенциальной среде Игла, EMEM) в соответствии со стандартным протоколом титрования для каждого вируса (см. Раздел 4.60). Цитотоксичными считались те пробы, которые вызывали образование монослоев из индикаторных клеток, которые сливаются менее чем на 50%. Результаты предварительных испытаний токсичности указывали на значительный уровень токсичности проб, содержащих параформальдегид. Поэтому испытанию подвергли также дополнительные пробы, состоящие из тромбоцитов, которые прошли параформальдегидную обработку, после чего из них был удален параформальдегид с помощью центрифугирования и последующего промывания. Эти образцы тестировали непосредственно (без "провокационной обработки") на токсичность в соответствии с описанной процедурой. При этом получали пробы PV-032, PV-033, PV-034. В. Испытание на инактивацию Для каждого исследуемого вируса готовят следующие пробы: 1) Tисходное 2) T30 минут 3) T1 час 4) T1,5 часа 5) T2 часа Исходный материал (3,6 мл тромбоцитов в цитратно-солевом буфере), который имел температуру 25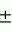 3oC, был обработан с применением 0,4 мл вируса с высоким титром. pH пробы доводили до значения 6,8-7,6 и разделяли полученную таким образом пробу на две равных аликвоты. Одну аликвоту, которая должна служить дублером, сразу же замораживали при -70oC или ниже. Оставшуюся аликвоту также без промедления подвергали тестированию с использованием соответствующего протокола титрования вируса, как описано ниже, в разделе Д. Она будет представлять собой пробу "Tисходное". 21,6 мл исходного материала (тромбоциты в цитратно-солевом буфере), находящегося при температуре 25 3oC, был обработан с применением 0,4 мл вируса с высоким титром. pH пробы доводили до значения 6,8-7,6 и разделяли полученную таким образом пробу на две равных аликвоты. Одну аликвоту, которая должна служить дублером, сразу же замораживали при -70oC или ниже. Оставшуюся аликвоту также без промедления подвергали тестированию с использованием соответствующего протокола титрования вируса, как описано ниже, в разделе Д. Она будет представлять собой пробу "Tисходное". 21,6 мл исходного материала (тромбоциты в цитратно-солевом буфере), находящегося при температуре 25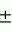 3oC, центрифугировали со скоростью 800 3oC, центрифугировали со скоростью 800  g в течение 8 минут при температуре 25 g в течение 8 минут при температуре 25 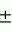 3oC для получения осевшей массы тромбоцитов. Готовили свежий 2,0%-ный раствор параформальдегида при смешивании 12,5 мл 4%-ного параформальдегида с 11,5 мл 0,135 М натрий-фосфатного буфера, готовили также 1,0 мл буфера ACD. После удаления цитрат/солевого супернатанта осевшую тромбоцитарную массу ресуспендировали в 21,6 мл свежеприготовленного 2,0%-ного раствора параформальдегида. Полученную тромбоцитарную суспензию обрабатывали 2,4 миллилитрами вируса с высоким титром для получения концентрации параформальдегида, равной 1,8%. Затем обработанный исходный материал, содержащий 1,8% параформальдегид, разделяли на три равных аликвоты по 4 мл и одну аликвоту в 10 мл и проводили инкубацию проб в водяной бане при температуре 25 3oC для получения осевшей массы тромбоцитов. Готовили свежий 2,0%-ный раствор параформальдегида при смешивании 12,5 мл 4%-ного параформальдегида с 11,5 мл 0,135 М натрий-фосфатного буфера, готовили также 1,0 мл буфера ACD. После удаления цитрат/солевого супернатанта осевшую тромбоцитарную массу ресуспендировали в 21,6 мл свежеприготовленного 2,0%-ного раствора параформальдегида. Полученную тромбоцитарную суспензию обрабатывали 2,4 миллилитрами вируса с высоким титром для получения концентрации параформальдегида, равной 1,8%. Затем обработанный исходный материал, содержащий 1,8% параформальдегид, разделяли на три равных аликвоты по 4 мл и одну аликвоту в 10 мл и проводили инкубацию проб в водяной бане при температуре 25 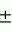 3oC. Температуру водяной бани (25 3oC. Температуру водяной бани (25 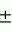 3oC) постоянно отслеживали для поддержания ее постоянства и записывали точные значения. Для получения образцов во временных точках T30 минут и T1 час и T1,5 часа (соответствуют указанному времени 3oC) постоянно отслеживали для поддержания ее постоянства и записывали точные значения. Для получения образцов во временных точках T30 минут и T1 час и T1,5 часа (соответствуют указанному времени 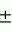 1 минута) отбирают по 4 мл пробы. К каждой 4-мл аликвоте добавляли по 4 мл имидазолсодержащего солевого буфера. Эти пробы три раза переворачивали и затем центрифугировали со скоростью 800 1 минута) отбирают по 4 мл пробы. К каждой 4-мл аликвоте добавляли по 4 мл имидазолсодержащего солевого буфера. Эти пробы три раза переворачивали и затем центрифугировали со скоростью 800 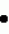 g в течение 8 минут при температуре 25 g в течение 8 минут при температуре 25 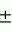 3oC. Затем сливали супернатант, и тромбоциты ресуспендировали в 4 мл имидазол/солевого буфера. Пробы три раза переворачивали и затем центрифугировали со скоростью 800 3oC. Затем сливали супернатант, и тромбоциты ресуспендировали в 4 мл имидазол/солевого буфера. Пробы три раза переворачивали и затем центрифугировали со скоростью 800 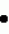 g в течение 8 минут при температуре 25 g в течение 8 минут при температуре 25  3oC. Стадию промывания повторяли еще два раза. После окончательного центрифугирования брали 4 мл имидазол/солевого буфера для ресуспендирования тромбоцитов. Затем пробы разделяли на две равных аликвоты. Одну аликвоту, которая должна служить в качестве дублера, сразу же замораживали при -70oC или ниже. Оставшуюся аликвоту также без промедления подвергали тестированию с использованием соответствующего протокола титрования вируса, как описано ниже, в разделе Д. Для вирусов BVD и EMC помещали по 0,5 мл неразбавленных и разбавленных проб в каждую из 3 ячеек на микротитрационной пластине, общим объемом в 1,5 мл. В случае ВИЧ помещали по 0,2 мл неразбавленных и разбавленных проб в каждую из 4 ячеек на микротитрационной пластине (общим объемом в 0,8 мл). Для получения пробы во временной точке T2 часа (соответствует указанному времени 3oC. Стадию промывания повторяли еще два раза. После окончательного центрифугирования брали 4 мл имидазол/солевого буфера для ресуспендирования тромбоцитов. Затем пробы разделяли на две равных аликвоты. Одну аликвоту, которая должна служить в качестве дублера, сразу же замораживали при -70oC или ниже. Оставшуюся аликвоту также без промедления подвергали тестированию с использованием соответствующего протокола титрования вируса, как описано ниже, в разделе Д. Для вирусов BVD и EMC помещали по 0,5 мл неразбавленных и разбавленных проб в каждую из 3 ячеек на микротитрационной пластине, общим объемом в 1,5 мл. В случае ВИЧ помещали по 0,2 мл неразбавленных и разбавленных проб в каждую из 4 ячеек на микротитрационной пластине (общим объемом в 0,8 мл). Для получения пробы во временной точке T2 часа (соответствует указанному времени  1 минута) отбирали по 10 мл пробы. Далее к каждой 10-мл аликвоте добавляют десять мл имидазолсодержащего солевого буфера. Эти пробы три раза переворачивали и затем центрифугировали со скоростью 800 1 минута) отбирали по 10 мл пробы. Далее к каждой 10-мл аликвоте добавляют десять мл имидазолсодержащего солевого буфера. Эти пробы три раза переворачивали и затем центрифугировали со скоростью 800  g в течение 8 минут при температуре 25 g в течение 8 минут при температуре 25 3o. Сливали супернатант и тромбоциты ресуспендировали в 10 мл имидазол/солевого буфера. Пробы три раза переворачивали и затем центрифугировали со скоростью 800 3o. Сливали супернатант и тромбоциты ресуспендировали в 10 мл имидазол/солевого буфера. Пробы три раза переворачивали и затем центрифугировали со скоростью 800  g в течение 8 минут при температуре 25 g в течение 8 минут при температуре 25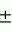 3oC. Стадию промывания повторяли еще два раза. После окончательного центрифугирования брали 10 мл имидазол/солевого буфера для ресуспендирования тромбоцитов. Затем пробы разделяли на две равные аликвоты. Одну аликвоту, которая должна служить в качестве дублера, сразу же замораживали при -70oC или ниже. Оставшуюся аликвоту, также без промедления, подвергали тестированию с использованием соответствующего протокола титрования вируса, как описано в разделе Д. Для вирусов BVD и EMC помещали по 0,5 мл неразбавленных образцов в каждую из 8 ячеек на микротитрационной пластине, общим объемом в 4 мл. В случае БИЧ помещали по 0,2 мл неразбавленных образцов в каждую из 20 ячеек на микротитрационной пластине (общим объемом в 4 мл). Все разбавленные пробы наносили на пластину в соответствии с процедурой, описанной выше применительно к первым четырем временным точкам. Г. Контроли (1) Основные вирусные контроли. Для каждого вируса роль положительного контроля исполняет основной вирусный раствор. (2) Отрицательные контроли. Используемая в процедуре титрования каждого вируса клеточная культуральная среда служит в проводимых испытаниях в качестве отрицательного контроля. Д. Титрование вируса. В начале титрований вирусов одну аликвоту каждой пробы и контроля (другая служит в качестве дублера) разбавляли клеточной культуральной средой до конечной точки (100, 3-кратное, 10-1, 10-2, 10-3, 10-4, 10-5, 10-6, 10-7 и 10-8, как потребуется). Каждое разведение тестируют в соответствии со стандартным протоколом титрования вируса на наличие инфекционных вирусных частиц, как описано ниже для каждого вируса. BVD: Каждое разведение BVD-содержащих проб оценивали на наличие инфекционных вирусных частиц с помощью BVD реакции розеткообразования, используя бычьи спиралевидные (BT) индикаторные клетки. EMC: Каждое разведение EMC-содержащих проб оценивали на наличие инфекционных вирусных частиц с помощью EMC реакции розеткообразования, используя индикаторные клетки VERO. ВИЧ: Каждое разведение ВИЧ-содержащих проб оценивали на наличие инфекционных вирусных частиц с помощью теста на образование CEM-A синцитий, используя CEM-A индикаторные клетки. II. Результаты и обсуждение А. Валидность Тест был валиден. Положительные контроли демонстрировали наличие инфекционного вируса, а в отрицательных контролях вирус не обнаруживался. Б. Испытания на токсичность Результаты исследований токсичности, проведенных на BT, CEM-A и VERO индикаторных клеточных линиях, которые применялись для титрования вирусов, представлены в табл. 1. Введение стадии промывания после параформальдегидной обработки значительно снижает токсичность, связанную с такого рода обработкой (PV-032, PV-033 и PV-034); исходя из этого, все связанные с вирусами исследования выполнены с включением указанной стадии промывания. В. Исследование процесса инактивации В табл. 2-4 приведены значения титров вирусов для каждой пробы и контроля, полученные при исследовании процесса инактивации. Титры вирусов выражены в виде бляшкообразующих единиц (БОЕ) на мл или синцитийобразующих единиц (СОЕ) на 1 мл. Титры выражаются значениями 3oC. Стадию промывания повторяли еще два раза. После окончательного центрифугирования брали 10 мл имидазол/солевого буфера для ресуспендирования тромбоцитов. Затем пробы разделяли на две равные аликвоты. Одну аликвоту, которая должна служить в качестве дублера, сразу же замораживали при -70oC или ниже. Оставшуюся аликвоту, также без промедления, подвергали тестированию с использованием соответствующего протокола титрования вируса, как описано в разделе Д. Для вирусов BVD и EMC помещали по 0,5 мл неразбавленных образцов в каждую из 8 ячеек на микротитрационной пластине, общим объемом в 4 мл. В случае БИЧ помещали по 0,2 мл неразбавленных образцов в каждую из 20 ячеек на микротитрационной пластине (общим объемом в 4 мл). Все разбавленные пробы наносили на пластину в соответствии с процедурой, описанной выше применительно к первым четырем временным точкам. Г. Контроли (1) Основные вирусные контроли. Для каждого вируса роль положительного контроля исполняет основной вирусный раствор. (2) Отрицательные контроли. Используемая в процедуре титрования каждого вируса клеточная культуральная среда служит в проводимых испытаниях в качестве отрицательного контроля. Д. Титрование вируса. В начале титрований вирусов одну аликвоту каждой пробы и контроля (другая служит в качестве дублера) разбавляли клеточной культуральной средой до конечной точки (100, 3-кратное, 10-1, 10-2, 10-3, 10-4, 10-5, 10-6, 10-7 и 10-8, как потребуется). Каждое разведение тестируют в соответствии со стандартным протоколом титрования вируса на наличие инфекционных вирусных частиц, как описано ниже для каждого вируса. BVD: Каждое разведение BVD-содержащих проб оценивали на наличие инфекционных вирусных частиц с помощью BVD реакции розеткообразования, используя бычьи спиралевидные (BT) индикаторные клетки. EMC: Каждое разведение EMC-содержащих проб оценивали на наличие инфекционных вирусных частиц с помощью EMC реакции розеткообразования, используя индикаторные клетки VERO. ВИЧ: Каждое разведение ВИЧ-содержащих проб оценивали на наличие инфекционных вирусных частиц с помощью теста на образование CEM-A синцитий, используя CEM-A индикаторные клетки. II. Результаты и обсуждение А. Валидность Тест был валиден. Положительные контроли демонстрировали наличие инфекционного вируса, а в отрицательных контролях вирус не обнаруживался. Б. Испытания на токсичность Результаты исследований токсичности, проведенных на BT, CEM-A и VERO индикаторных клеточных линиях, которые применялись для титрования вирусов, представлены в табл. 1. Введение стадии промывания после параформальдегидной обработки значительно снижает токсичность, связанную с такого рода обработкой (PV-032, PV-033 и PV-034); исходя из этого, все связанные с вирусами исследования выполнены с включением указанной стадии промывания. В. Исследование процесса инактивации В табл. 2-4 приведены значения титров вирусов для каждой пробы и контроля, полученные при исследовании процесса инактивации. Титры вирусов выражены в виде бляшкообразующих единиц (БОЕ) на мл или синцитийобразующих единиц (СОЕ) на 1 мл. Титры выражаются значениями 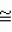 5,0 5,0 100 БОЕ (СОЕ)/мл, в том случае, когда вирусы не обнаруживаются или обнаруживаются в количестве менее чем 5 БОЕ (СОЕ) на 1 мл. Для ВИЧ-теста в CEM-A клетках используют 3-кратное разведение; титры выражаются значениями 100 БОЕ (СОЕ)/мл, в том случае, когда вирусы не обнаруживаются или обнаруживаются в количестве менее чем 5 БОЕ (СОЕ) на 1 мл. Для ВИЧ-теста в CEM-A клетках используют 3-кратное разведение; титры выражаются значениями  1,5 1,5 101 БОЕ (СОЕ)/мл и даже в том случае, когда вирусы не обнаруживаются или обнаруживаются в количестве менее, чем 5 БОЕ (СОЕ) на мл в пробах с 3-кратным разведением, неразбавленные пробы являются цитотоксичными. Величину снижения log10 определяют при вычитании значения log10 БОЕ (СОЕ)/мл для каждой обработанной пробы из соответствующего значения, полученного для пробы Tисходное. Процесс инактивации вирусов при параформальдегидной обработке снижает титр вирусов: для BVD, например, на 6,93 loq10 (содержание вируса доводится до недетектируемого уровня) для EMC - на 8,78 log10 (содержание вируса доводится до недектируемого уровня), для EMC - на 4,77 log10 (содержание вируса доводится до падектируемого уровня). Г. Статистический анализ Пробы, отобранные в точке "2 часа", обработали статистически с использованием метода распределения Пуассона (Poisson-based) для определения наличия изменений в титрах вирусов, которые могут возникнуть при помещении в дополнительные ячейки микротитрационной пластины дополнительных, нужных для тестирования ингредиентов. В таких случаях чувствительность теста может упасть ниже текущего уровня. В случае BVD и EMC, если в схеме разведения, использующей дополнительные ячейки, не обнаруживается вирус, титр составляет, как было показано, 0,58 БОЕ/мл. Для ВИЧ, если в схеме разведения, использующей дополнительные ячейки, не обнаруживается вирус, титр составляет, как было показано, 0,29 СОЕ/мл. Значение снижения log10 определяли при вычитании величин loq10 БОЕ/мл, полученных для каждой обработанной пробы, из соответствующего значения для пробы "Tисходное" (PV-009). Приведенные выше примеры следует рассматривать только как иллюстративные в отношении настоящего изобретения, которые ни в коей мере не следует трактовать как ограничивающие его. Объем изобретения определяется прилагаемой формулой изобретения с эквивалентами притязаний, которые могут быть включены в нее. 101 БОЕ (СОЕ)/мл и даже в том случае, когда вирусы не обнаруживаются или обнаруживаются в количестве менее, чем 5 БОЕ (СОЕ) на мл в пробах с 3-кратным разведением, неразбавленные пробы являются цитотоксичными. Величину снижения log10 определяют при вычитании значения log10 БОЕ (СОЕ)/мл для каждой обработанной пробы из соответствующего значения, полученного для пробы Tисходное. Процесс инактивации вирусов при параформальдегидной обработке снижает титр вирусов: для BVD, например, на 6,93 loq10 (содержание вируса доводится до недетектируемого уровня) для EMC - на 8,78 log10 (содержание вируса доводится до недектируемого уровня), для EMC - на 4,77 log10 (содержание вируса доводится до падектируемого уровня). Г. Статистический анализ Пробы, отобранные в точке "2 часа", обработали статистически с использованием метода распределения Пуассона (Poisson-based) для определения наличия изменений в титрах вирусов, которые могут возникнуть при помещении в дополнительные ячейки микротитрационной пластины дополнительных, нужных для тестирования ингредиентов. В таких случаях чувствительность теста может упасть ниже текущего уровня. В случае BVD и EMC, если в схеме разведения, использующей дополнительные ячейки, не обнаруживается вирус, титр составляет, как было показано, 0,58 БОЕ/мл. Для ВИЧ, если в схеме разведения, использующей дополнительные ячейки, не обнаруживается вирус, титр составляет, как было показано, 0,29 СОЕ/мл. Значение снижения log10 определяли при вычитании величин loq10 БОЕ/мл, полученных для каждой обработанной пробы, из соответствующего значения для пробы "Tисходное" (PV-009). Приведенные выше примеры следует рассматривать только как иллюстративные в отношении настоящего изобретения, которые ни в коей мере не следует трактовать как ограничивающие его. Объем изобретения определяется прилагаемой формулой изобретения с эквивалентами притязаний, которые могут быть включены в нее.
ФОРМУЛА ИЗОБРЕТЕНИЯ1. Способ инактивации микробиологических загрязнений в препарате тромбоцитов из человеческой крови, включающий получение тромбоцитов крови, в отношении которых имеется подозрение на наличие контаминации микроорганизмами, контактирование указанных человеческих тромбоцитов с фиксатором в течение периода времени, достаточного для фиксирования тромбоцитов, и затем высушивание указанных тромбоцитов с получением тромбоцитов крови, высушенных в фиксированном состоянии, причем указанное контактирование осуществляют в течение времени, достаточного для того, чтобы уничтожить указанные микроорганизмы, и недостаточного для того, чтобы вызвать потерю способности тромбоцитов при восстановлении прилипать к тромбогенным поверхностям, не прилипать к нетромбогенным поверхностям, расширяться при прилипании к тромбогенной поверхности, прилипать друг к другу с образованием гемостатической закупоривающей массы в случае прилипания к тромбогенной поверхности и высвобождать свое гранулярное содержимое. 2. Способ по п.1, отличающийся тем, что указанные микроорганизмы выбирают из группы, состоящей из бактерий и вирусов. 3. Способ по п.1, отличающийся тем, что указанное контактирование осуществляют при смешивании указанных тромбоцитов с раствором, содержащим указанный фиксатор. 4. Способ по п.1, отличающийся тем, что указанное высушивание осуществляют путем лиофилизации. 5. Способ по п.1, отличающийся тем, что указанный фиксатор выбирают из группы, состоящей из формальдегида, параформальдегида и глютаральдегида. 6. Способ по п.1, отличающийся тем, что указанный фиксатор представляет собой перманганат. 7. Способ по п.1, отличающийся тем, что дополнительно включает стадию стабилизации указанных тромбоцитов альбумином. 8. Способ по п.1, отличающийся тем, что дополнительно включает стадию стабилизации указанных тромбоцитов трегалозой.Популярные патенты: 2462864 Устройство составления экономичного кормового рациона и экономичного кормления животных и птиц ... образом. Неверное дозирование корма или неверно выбранный рацион могут привести к тому, что разница между наивысшей ценой реализованной продукции и очень высокой суммой стоимостей израсходованного корма Кмакс окажется совсем малой. Такое же положение дел может возникнуть при проблеме с ресурсами ингредиентов корма на предприятии, когда просто невозможно обеспечить установленный нормативный рацион корма. Это означает, что прибыль в данном (старом) варианте управления по критерию максимальной продуктивности поголовья Пс получена небольшая Заявляемое вместе со способом экономически оптимального (экономически наилучшего) управления устройство автоматически выбирает такой режим ... 2271092 Сортировка барабанного типа ... тем, что сортировка барабанного типа снабжена рамой, на которой размещены привод, горизонтальный вал со спиральным каркасом, на витках которого закреплен сортирующий рабочий орган, поверхность которого выполнена в виде гибкой эластичной ячеистой сетки, с образованием отдельных сортирующих секций путем провисания в плоскостях по геометрической оси барабана между соседними витками его спирального каркаса, при этом ячейки в секциях выполнены различными по размерам, увеличивающимися по направлению перемещения продукта от места подачи в барабан, а отводящие лотки расположены под ячеистой поверхностью перпендикулярно оси вращения барабана, причем крайняя по ходу перемещения продукта ... 2154940 Способ получения, содержания и хранения живого корма для биологических объектов птиц и рыб ... воду, в которую вводят антимикробные средства - соли щелочных и щелочноземельных металлов, растворимые соли никеля, меди или цинка, а также противосудорожные средства, преимущественно карбамазелин. Таким способом можно сохранить живой корм для рыб - мотыля озерного, мотыля лиманного (солоноводного), коретру, трубочника, гаммаруса, дафнию, циклопов (CHIRONOMUS CF. PLUMOSUS, CHIRONOMUS CF. THUMMI, BEOTEN-DIPES CF. TAVRICUS, HAOBORUS FLAVICANS, HAOBORUS CRISTALLINUS, TUBIFEX SP. GAMMARUS LACUSTRIS, GMELINOIDES FASCIATUS, DAPHNIA SP., CYCLOP SP.) [1]. Известен способ культивирования ветвистоусых рачков (дафнии и моины), биомасса которых является ценным живым или сухим кормом ... 2471341 Стойло, устройство в стойле и способ монтажа указанного устройства ... с полом (14) вдоль противоположной стороны подгрудной доски (13), причем, по меньшей мере, два крепежных средства, таких как винты (36) или болты, прикрепляют второй фланец (34) или отдельные выступы подгрудной доски (13) к полу (14).9. Устройство в стойле (10) для животного, имеющее открытую сторону (12), через которую животное входит в стойло (10), и противоположный конец для головы животного, причем устройство содержит подгрудную доску (13) для позиционирования животного продольно внутри стойла (10), отличающееся тем, что оно дополнительно содержит продолговатый профиль (25) для прикрепления одной стороны подгрудной доски (13) к полу (14) стойла (10), причем продолговатый ... 2275801 Способ выращивания рыбы в рисовых чеках (варианты) ... рыб, сброс воды с чека и отлов рыб, согласно изобретению по третьему варианту, посадку в чек ведут личинками растительноядных рыб, кефалей дальневосточного комплекса и теплолюбивых американских рыб-буффало, для зарыбления используют неподрощенных 4-х дневных и подрощенных однодневных личинок белого амура, подрощенных 14-18-ти дневных личинок карпа, при плотности посадки неподрощенных личинок белого амура (40-70)×10 3 штук/га, подрощенных личинок белого амура 13-103 штук/га и личинок карпа - (15,3-30,0)·103 штук/га, содержание личинок рыб в чеках ведут при температуре воды +23...+28°C с повышением температуры воды при устойчивом привесе сеголеток до +34°С, а ... |
Еще из этого раздела: 2293463 Способ разработки лесосек 2121252 Агротранспортная система 2496309 Зубчатое устройство для вычесывания домашних животных с механизмом выброса шерсти 2051575 Способ отделения дождевых червей от среды обитания и устройство для его осуществления 2167510 Способ и устройство для изготовления круглых тюков соломы или подобного материала с пленочным защитным покрытием 2197817 Поплавок для рыболовных удочек и снастей 2165134 Корнеподрезающий рабочий орган машины для добычи лакричного сырья 2182889 Дезинфицирующее средство 2495561 Машина лесозаготовительная 2438304 Улей |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||