Фумигант, фумигантная композиция и способ окуриванияПатент на изобретение №: 2141762 Автор: Генри Джонатан Бэнкс (AU), Френсиз Джеймс Майкл Демаршелье (AU), Йонглин Рен (CN) Патентообладатель: Коммонвелт Сайентифик энд Индастриал Рисерч Организейшн (AU) Дата публикации: 27 Ноября, 1999 Начало действия патента: 15 Января, 1993 Адрес для переписки: 129010, Москва, ул.Спасская, 25, стр.3, Союзпатент, Патентному поверенному Лебедевой Н.Г. Изображения    Изобретение относится к дезинфекции пищевых продуктов, почвы, лесоматериалов и помещений от насекомых, клещей, нематод и бактерий. Для борьбы с указанными вредителями используют фумигант, представляющий собой карбонилсульфид и композицию на его основе, содержащую газ-разбавитель. Дезинфекцию продуктов, почвы, помещений осуществляют окуриванием их карбонилсульфидом в течение от 1 ч до 35 дней в концентрации 38 - 460 мг ч/л в зависимости от вредителя и стадии его развития. Карбонилсульфид слабо абсорбируется зерном, обладает более низкой воспламеняемостью, чем известный фумигант -фосфин, не влияет на прорастание семян и его очевидная безопасность для окружающей среды делают карбонилсульфид особенно выгодным в качестве фумиганта при хранении зерна. Его можно также использовать для окуривания других хранящихся продуктов (включая скоропортящиеся продукты), почвы, пиломатериалов и помещений (например, зданий) и таких материалов, которые могут быть инфицированы насекомыми или клещами или могут действовать как источник такого заражения. 3 с. и 6 з.п. ф-лы, 1 ил., 20 табл. , , , , , , , , , , , , , , , , , , , , , ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУНастоящее изобретение относится к газообразным фумигантам. Более конкретно, оно относится к газообразному карбонилсульфиду (COS), который также называют оксисульфидом углерода, используемому в качестве фумиганта. Фумиганты широко используют для дезинфекции и защиты от заражения, когда обычно необходимо защитить мелкие материалы (такие, как зерно) и другие хранящиеся продукт /включая скоропортящиеся пищевые продукты и продукты длительного хранения/, пористые объемные материалы (например, почву или лесоматериалы) и помещения (обычно пустые здания). Идеальный фумигант должен быть токсичен для насекомых, клещей, нематод, бактерий, грибков и плесени. Он должен быть эффективен в малых концентрациях. Он должен слабо абсорбироваться материалами, находящимися в зоне окуривания. Он должен обладать низкой токсичностью для млекопитающих и не оставлять никакого остатка или инертного остатка. Кроме того, идеальный фумигант не должен создавать никаких затруднений с точки зрения безопасности при использовании и не должен оказывать вредного воздействия на окуриваемые товары или помещения. Ни один из фумигантов не удовлетворяют этим "идеальным" критериям. Два фумиганта, которые наиболее часто используют для окуривания зерна, других сыпучих материалов, фруктов и пиломатериалов, являются фосфином и метилбромидом. Фосфин является предпочтительным фумигантом для зернохранилищ и т. п. , так как он эффективен против вредителей зерна и оставляет мало остаточного вещества (которое представляет собой практически безвредный фосфат). Однако фосфин может спонтанно возгораться, если его концентрация превышает относительно низкую величину. Метилбромид более токсичен для вредителей зерна, нежели фосфин, если его используют для короткого промежутка окуривания, но фосфин более токсичен для вредителей зерна, когда осуществляют длительное окуривание. Метилбромид отличается меньшей воспламеняемостью, нежели фосфин, но последние исследования показали, что метилбромид разрушает озонный слой. Таким образом, возможность применения метилбромида в качестве фумиганта находится в процессе обсуждения после Монреальского соглашения. Остальные фумиганты, которые обычно использовали против вредителей зерновых, включают акрилонитрил, сероуглерод, четыреххлористый углерод, хлорпикрин, этилендибромид, этилендихлорид, этиленоксид, цианистый водород и фтористый сульфурил. Следует отметить, что галоид присутствует в большинстве этих "обычно" фумигантов, и ни один из них не обладает свойствами "идеального" фумиганта. В работе В.И. Вашкова "Дезинфекция, дезинсекция и дератизация", М., Медгиз, 1956 раскрываются газообразные и парообразные средства, применяемые для дезинсекции и дератизации. В течение многих лет происходят поиски новых фумигантов, и нет сомнения в том, что всегда будет необходимость в усовершенствованных фумигантах. Основной целью настоящего изобретения является создание нового фумиганта, обладающего таким свойствами, которые сделали бы его ценной альтернативой обычным фумигантам, в частности, для борьбы с насекомыми, клещами и плесенью. Этих целей можно достичь, используя в качестве фумиганта карбонилсульфид. Карбонилсульфид является хорошо известным соединением. В условиях STP (стандартные температура и давление) он является газом, температура кипения которого -50,2oC. Он бесцветен, воспламеняется (но не столь же легко, как фосфин) и растворим в воде. Его растворимость в воде составляет 1,4 г/л при 25oC по сравнению с растворимостями в воде 13,4 г/л и 2,2 г/л для метилбромида и дисульфида углерода соответственно (указано, что фосфин умеренно растворим в воде). Находясь в водном растворе, он медленно разлагается. Коммерческий карбонилсульфид обычно поставляют в сжиженной форме в цилиндрах при давлении около 160 пси (11,25 кг/см2). Однако он существует в природе, являясь основным серусодержащим соединением в атмосфере (где он равномерно распределен в тропосфере и нижних слоях тропосферы, где его концентрация достигает 1,3 мкг/м3), и составляет часть естественных серных потоков в почвах и болотах. Карбонилсульфид образуется также при анаэробном разложении навоза и компоста и присутствует в большинстве продуктов пиролиза и в продуктах переработки нефти. В результате его роли в серном цикле, его присутствия в продуктах пиролиза и его использования в качестве химического сырья карбонилсульфид был подробно исследован, и его свойства и возможности применения хорошо известны. Однако тщательное исследование технической литературы и оценочный поиск на основе Dialog - компьютера (проведенного в области CAB Abstracts 1972-1991, Biosis Previews 1969-1991, Life Sciences Collection 1978-1991, Agricola 1970-1991, Agris International 1974-1991, European Directory of Agrochemical Products and Oceanic Abstracts 1964-1991) не выявило использования или предполагаемого использования карбонилсульфида в качестве фумиганта, и не были обнаружены ссылки на токсичность карбонилсульфида для насекомых. Проведенный вручную поиск в Chemical Abstracts вплоть до 1900 года не обнаружил ссылок на карбонилсульфид в качестве фумиганта. Известно, что карбонилсульфид является газом, токсичным для млекопитающих. В статье Robert J. Ferm, озаглавленной "Химия карбонилсульфида", опубликованной в Chemical Review, т. 57, 1957, p. 621-637, приводятся три ссылки в поддержку утверждения на стр. 627, что "Холоднокровные животные обладают большей устойчивостью по отношению к карбонилсульфиду, нежели теплокровные животные. Мыши и кролики гибнут быстро, если дышат воздухом, в котором содержание карбонилсульфида превышает 0,3%. В современном Matheson Gas Products Catalogue в разделе "Carbonyl sulfide" (стр. 115-117) указано, что (стр. 115): "Карбонилсульфид действует в основном через нервную систему, причем смерть наступает в основном за счет паралича органов дыхания. У кроликов наблюдается некоторая болезненность после пребывания в течение получаса при концентрации 1300 ppm. Что касается мышей, то гибель наблюдается через 3/4 минуты при концентрации 8900 ppm, через 1,5 минуты при концентрации 2900 ppm и через 35 минут при концентрации 1200 ppm. 60-минутное пребывание при концентрации 900 ppm не вызывает ощутимых результатов". Однако известно, что газообразные соединения, которые приводят к летальному исходу у людей и мелких млекопитающих, а также у холоднокровных позвоночных, могут оказаться нетоксичными для насекомых, клещей, плесени и т.п. Одним из таких токсичных для млекопитающих газов является окись углерода. Таким образом, было бы некорректно заключить, что карбонилсульфид будет гибельным для насекомых, плесени, клещей и т.п., просто потому, что карбонилсульфид обладает известной токсичностью для млекопитающих. Вот почему авторы настоящего изобретения с удивлением обнаружили, что карбонилсульфид можно использовать в качестве фумиганта. Однако теперь авторы настоящего изобретения установили, что если карбонилсульфид используют в качестве фумиганта, его можно наносить в неразбавленном виде способом, который позволяет смешивать его с атмосферой внутри подлежащей обработке системы, или его можно вносить в смеси с инертным газом-разбавителем. Газ-разбавитель следует использовать в тех случаях, когда необходимо получить более разбавленный фумигант, или в качестве ингибитора для того, чтобы понизить воспламеняемость карбонилсульфида. Обычно газом-разбавителем является воздух, хотя можно использовать и другие подходящие газы-носители. Настоящее изобретение охватывает также способ окуривания сыпучих материалов, товаров, пиломатериалов, помещений и почвы, который включает обработку их газообразным карбонилсульфидом. Далее будут представлены дополнительные подробности, только лишь в качестве примеров при обсуждении характеристик карбонилсульфида в качестве фумиганта, включая те примеры, которые демонстрируют эти характеристики. Эффективность фумиганта обычно выражают как "произведение СТ", где произведение концентрации на время определяет эффективность, выраженную в мг ч/л. (Обычно для LC95 или LC99, которые представляют летальные концентрации-дозы- для 95 и 99% соответственно, для той популяции, против которой направлено действие фумиганта). Обычно задается температура, при которой используют фумигант, так как обычно чем выше температура при обработке фумигантом, тем более низкие дозы или концентрации необходимы для достижения нужной эффективности. В таблице 1 представлены произведения концентрации на время, выраженные в общепринятых единицах LD90, LD95 или LD99 (хотя, строго говоря, эти величины представляют собой L(CxT)90, L(CxT)95 и L(CxT)99), для одиннадцати ранее известных фумигантов, которые все еще используют для борьбы с вредителями зерновых. Данные таблицы 1, относящиеся к восьми видам вредителей зерновых, все взяты из более ранних публикаций. Было проведено множество экспериментов для демонстрации эффективности карбонилсульфида в качестве фумиганта. Ряд этих экспериментов подробно описывается в нижеследующих примерах. В каждом случае использования карбонилсульфида этот газ получают при взаимодействии тиоцианата калия с серной кислотой по способу A. Stock and E. Kuss, изложенному в Chemische Berichte and deutchen Gesellschaft, vol. 50, 1917, p. 159. Этот способ получения рекомендован R. S. Ferm в его указанной ранее статье в Chemical Review, v. 57, 1957. Получаемый таким образом карбонилсульфид промывают раствором ацетата свинца в воде для удаления сероводорода. Степень чистоты карбонилсульфида определяют, используя GOW - MAC /модель 40-001/ детектор плотности газа, и обычно он имеет степень чистоты от 80% до 90% (объем/объем), причем основной примесью является двуокись углерода. Сероводород или двуокись серы не были обнаружены. Концентрацию фумиганта в экспериментах определяют с помощью газового хроматографа Шимадзу GC6 с пламенно-ионизационным детектором. Условия в колонке: 20% OV 101 на Gas Chrom Q при температуре колонки 42o и температуре ввода 105oC. Для определения эффективности карбонилсульфида в качестве фумиганта были тестированы следующие виды: Tribolium castaneum (Herbst), (Coleoptera, tenebrionidae), штамм CTC4; T. confusum (Jacg du Val) (Coleoptera, Curculionidae), штамм CLS2; Phyzopertha dominica (F) (Coleoptera, Bostrichidae), штамм CRD2; Oryzaephilus Surinamensis (L) (Coleoptera, Silvanidae), штамм NOS4; Ephestia cautella (Walker) (Noctudae, Pyralidae), штамм CEC2; Bactrocera tyroni (Froggat), ранее Dacus tyroni (Diptera, Tephrididae), собран Wollongong 1989; Liposcelis bastrychophilus; Lepidoglyphus destructor (Schrank); Coptotermes acinaciformis (Froggat) (Isoptera Rhinotermidae); and Cryptotermes domesticus (Haviland, Isoptera, Kalotermitidae). Пример 1 Тест на эффективность карбонилсульфида для борьбы с насекомыми во внешней стадии в хранилище продуктов Для тестирования эффективности карбонилсульфида против внешней стадии этих насекомых в хранилищах продуктов используют стеклянные ампулы для сыворотки (флаконы) с объемом приблизительно 120 мл. У ампул имеется крышка, которая позволяет осуществлять инъекцию газа с помощью шприца (клапан Mininert). Флаконы оставляют открытыми при относительной влажности воздуха 55% при температуре проведения биоанализа (обычно 25 или 30oC). Для определения эффективности карбонилсульфида против живых насекомых от 25 до 35 насекомых помещают в каждый флакон, который после этого закрывают крышкой. Затем из каждого флакона отсасывают такое количество воздуха, которое равно объему газа, который необходимо ввести в каждый флакон, и затем вводят тоже самое количество газа. Флаконы выдерживают при постоянной температуре на протяжении биоанализа, что составляет обычно 6 или 24 ч. К концу этого промежутка времени насекомых из каждого флакона или ампулы переносят в соответствующие 60 мл стеклянные сосуды, содержащие по 20 г пшеницы. Насекомые остаются в сосудах с пшеницей в течение 14 дней прежде, чем проводят оценку их смертности. Все анализы повторяют 3 или 4 раза, и они сопровождаются контрольным опытом, в котором во флакон с насекомыми не вводят карбонилсульфид. При оценке смертности взрослых насекомых рассматривают как погибших, если они не реагируют ни на какие раздражения. Всегда проводят контрольную оценку смертности. Анализ эффективности карбонилсульфида против куколок насекомых проводят аналогично анализам для взрослых насекомых, за исключением того, что после обработки во флаконе куколок переносят в стеклянные сосуды, содержащие 10 г муки. Гибель куколок оценивают как неспособность куколки превратиться во взрослое насекомое. Биоанализы на куколках повторяют 3 или 4 раза в сопровождении контрольного анализа. Таким же образом, как для куколок, проводят соответствующие анализы по определению эффективности карбонилсульфида против личинок, за исключением того, что гибель личинок оценивают так же, как и для взрослых насекомых, как неспособность реагировать на какие-либо раздражения. Личинки, которые успешно окукливаются после обработки, считаются выжившими. Тесты на эффективность карбонилсульфида против яичек насекомых осуществляют для яичек на полосках фильтровальной бумаги. Эти полоски представляют собой 1 x 5 см2, вырезанные из фильтровальной бумаги S and S Rundfilter N 593, 90 мм диаметром, поставляемой Schleicher and Schuell. Яички большинства видов откладываются непосредственно на фильтровальную бумагу после того, как взрослых насекомых помещают на тонкий слой пшеницы, пивных дрожжей и фильтровальной бумаги. В случае Tribolium castaneum (Травяной), яички откладываются на сверхтонкого помола муку и отделяются через сито. Затем яички переносят с помощью волосяной щетки, погруженной в 30% раствор сахарозы, на полоски фильтровальной бумаги, покрытые двусторонней липкой бумагой - "Double Stick Tape", поставляемой как "Scotch brand" (торговая марка) 3M Consumer Products Group. Взрослых насекомых удаляют через 16 ч на среду. Некоторые яички обрабатывают карбонилсульфидом через 24 ч с момента яйцекладки, и их классифицируют как "яички в возрасте 0-1 день". Остальные яички выдерживают еще 4 дня и получают "яички в возрасте 4-5 дней" прежде, чем их обрабатывают карбонилсульфидом. Обычно от 20 до 30 яичек бывает расположено на каждой полоске фильтровальной бумаги. Полоски фильтровальной бумаги с расположенными на них яичками помещают в соответствующие стеклянные ампулы (флаконы) того же типа, который был использован для тестирования действия карбонилсульфида на взрослых насекомых, и были обработаны карбонилсульфидом в таких же дозах, как и для взрослых насекомых. После обработки карбонилсульфидом яички помещают в закрытые чашки Петри и хранят при 30oC в течение 7 дней. К концу периода хранения подсчитывают количество вылупившихся и невылупившихся яичек с помощью стереомикроскопа Nicon, снабженного холодным источником света. Те яички, которые остались невылупленными, считают погибшими. Все анализы с яичками проводились трижды при соответствующем контрольном эксперименте (без обработки карбонилсульфидом). Результаты биоанализа для внешних стадий приведены в таблице 2, где указаны вид, стадия развития насекомого (взрослая особь, куколка, личинка или яички), периода обработки карбонилсульфидом, температуры, при которой проводился биоанализ, значения LC95 (выраженного в мг ч/л. (Обычно для LC95 или LC99, которые представляют летальные концентрации-дозы- для 95 и 99% соответственно, для той популяции, против которой направлено действие фумиганта). Обычно задается температура, при которой используют фумигант, так как обычно чем выше температура при обработке фумигантом, тем более низкие дозы или концентрации необходимы для достижения нужной эффективности. В таблице 1 представлены произведения концентрации на время, выраженные в общепринятых единицах LD90, LD95 или LD99 (хотя, строго говоря, эти величины представляют собой L(CxT)90, L(CxT)95 и L(CxT)99), для одиннадцати ранее известных фумигантов, которые все еще используют для борьбы с вредителями зерновых. Данные таблицы 1, относящиеся к восьми видам вредителей зерновых, все взяты из более ранних публикаций. Было проведено множество экспериментов для демонстрации эффективности карбонилсульфида в качестве фумиганта. Ряд этих экспериментов подробно описывается в нижеследующих примерах. В каждом случае использования карбонилсульфида этот газ получают при взаимодействии тиоцианата калия с серной кислотой по способу A. Stock and E. Kuss, изложенному в Chemische Berichte and deutchen Gesellschaft, vol. 50, 1917, p. 159. Этот способ получения рекомендован R. S. Ferm в его указанной ранее статье в Chemical Review, v. 57, 1957. Получаемый таким образом карбонилсульфид промывают раствором ацетата свинца в воде для удаления сероводорода. Степень чистоты карбонилсульфида определяют, используя GOW - MAC /модель 40-001/ детектор плотности газа, и обычно он имеет степень чистоты от 80% до 90% (объем/объем), причем основной примесью является двуокись углерода. Сероводород или двуокись серы не были обнаружены. Концентрацию фумиганта в экспериментах определяют с помощью газового хроматографа Шимадзу GC6 с пламенно-ионизационным детектором. Условия в колонке: 20% OV 101 на Gas Chrom Q при температуре колонки 42o и температуре ввода 105oC. Для определения эффективности карбонилсульфида в качестве фумиганта были тестированы следующие виды: Tribolium castaneum (Herbst), (Coleoptera, tenebrionidae), штамм CTC4; T. confusum (Jacg du Val) (Coleoptera, Curculionidae), штамм CLS2; Phyzopertha dominica (F) (Coleoptera, Bostrichidae), штамм CRD2; Oryzaephilus Surinamensis (L) (Coleoptera, Silvanidae), штамм NOS4; Ephestia cautella (Walker) (Noctudae, Pyralidae), штамм CEC2; Bactrocera tyroni (Froggat), ранее Dacus tyroni (Diptera, Tephrididae), собран Wollongong 1989; Liposcelis bastrychophilus; Lepidoglyphus destructor (Schrank); Coptotermes acinaciformis (Froggat) (Isoptera Rhinotermidae); and Cryptotermes domesticus (Haviland, Isoptera, Kalotermitidae). Пример 1 Тест на эффективность карбонилсульфида для борьбы с насекомыми во внешней стадии в хранилище продуктов Для тестирования эффективности карбонилсульфида против внешней стадии этих насекомых в хранилищах продуктов используют стеклянные ампулы для сыворотки (флаконы) с объемом приблизительно 120 мл. У ампул имеется крышка, которая позволяет осуществлять инъекцию газа с помощью шприца (клапан Mininert). Флаконы оставляют открытыми при относительной влажности воздуха 55% при температуре проведения биоанализа (обычно 25 или 30oC). Для определения эффективности карбонилсульфида против живых насекомых от 25 до 35 насекомых помещают в каждый флакон, который после этого закрывают крышкой. Затем из каждого флакона отсасывают такое количество воздуха, которое равно объему газа, который необходимо ввести в каждый флакон, и затем вводят тоже самое количество газа. Флаконы выдерживают при постоянной температуре на протяжении биоанализа, что составляет обычно 6 или 24 ч. К концу этого промежутка времени насекомых из каждого флакона или ампулы переносят в соответствующие 60 мл стеклянные сосуды, содержащие по 20 г пшеницы. Насекомые остаются в сосудах с пшеницей в течение 14 дней прежде, чем проводят оценку их смертности. Все анализы повторяют 3 или 4 раза, и они сопровождаются контрольным опытом, в котором во флакон с насекомыми не вводят карбонилсульфид. При оценке смертности взрослых насекомых рассматривают как погибших, если они не реагируют ни на какие раздражения. Всегда проводят контрольную оценку смертности. Анализ эффективности карбонилсульфида против куколок насекомых проводят аналогично анализам для взрослых насекомых, за исключением того, что после обработки во флаконе куколок переносят в стеклянные сосуды, содержащие 10 г муки. Гибель куколок оценивают как неспособность куколки превратиться во взрослое насекомое. Биоанализы на куколках повторяют 3 или 4 раза в сопровождении контрольного анализа. Таким же образом, как для куколок, проводят соответствующие анализы по определению эффективности карбонилсульфида против личинок, за исключением того, что гибель личинок оценивают так же, как и для взрослых насекомых, как неспособность реагировать на какие-либо раздражения. Личинки, которые успешно окукливаются после обработки, считаются выжившими. Тесты на эффективность карбонилсульфида против яичек насекомых осуществляют для яичек на полосках фильтровальной бумаги. Эти полоски представляют собой 1 x 5 см2, вырезанные из фильтровальной бумаги S and S Rundfilter N 593, 90 мм диаметром, поставляемой Schleicher and Schuell. Яички большинства видов откладываются непосредственно на фильтровальную бумагу после того, как взрослых насекомых помещают на тонкий слой пшеницы, пивных дрожжей и фильтровальной бумаги. В случае Tribolium castaneum (Травяной), яички откладываются на сверхтонкого помола муку и отделяются через сито. Затем яички переносят с помощью волосяной щетки, погруженной в 30% раствор сахарозы, на полоски фильтровальной бумаги, покрытые двусторонней липкой бумагой - "Double Stick Tape", поставляемой как "Scotch brand" (торговая марка) 3M Consumer Products Group. Взрослых насекомых удаляют через 16 ч на среду. Некоторые яички обрабатывают карбонилсульфидом через 24 ч с момента яйцекладки, и их классифицируют как "яички в возрасте 0-1 день". Остальные яички выдерживают еще 4 дня и получают "яички в возрасте 4-5 дней" прежде, чем их обрабатывают карбонилсульфидом. Обычно от 20 до 30 яичек бывает расположено на каждой полоске фильтровальной бумаги. Полоски фильтровальной бумаги с расположенными на них яичками помещают в соответствующие стеклянные ампулы (флаконы) того же типа, который был использован для тестирования действия карбонилсульфида на взрослых насекомых, и были обработаны карбонилсульфидом в таких же дозах, как и для взрослых насекомых. После обработки карбонилсульфидом яички помещают в закрытые чашки Петри и хранят при 30oC в течение 7 дней. К концу периода хранения подсчитывают количество вылупившихся и невылупившихся яичек с помощью стереомикроскопа Nicon, снабженного холодным источником света. Те яички, которые остались невылупленными, считают погибшими. Все анализы с яичками проводились трижды при соответствующем контрольном эксперименте (без обработки карбонилсульфидом). Результаты биоанализа для внешних стадий приведены в таблице 2, где указаны вид, стадия развития насекомого (взрослая особь, куколка, личинка или яички), периода обработки карбонилсульфидом, температуры, при которой проводился биоанализ, значения LC95 (выраженного в мг ч/л) и минимальной эффективной тестовой дозы. Минимальная эффективная тестовая доза представляет собой минимальную тестовую дозу, которая убивает всех насекомых, представленных в анализах, включая по крайней мере 100 насекомых. Энтомологам будет очевидно, что сравнение результатов таблицы 2 с известными ранее данными, приведенными в таблице 1, демонстрирует сопоставимость эффективности карбонилсульфида против внешних стадий насекомых с эффективностью, достигаемой другими, известными фумигантами. Представленные в таблице 2 данные ясно показывают эффективность карбонилсульфида против всех внешних стадий насекомых, перечисленных в таблице 2. Пример 2 Эффективность карбонилсульфида против внешних стадий насекомых в хранилищах продуктов. В ряде экспериментов взрослым особям вредителей зерновых Rhyzopertha dominica позволяют откладывать яички в течение 4-5 недель на 1000 г пшеницы, в условиях 30oC при содержании влаги 12%. В каждом эксперименте взрослых особей удаляют с пшеницы, которую затем делят на три части, две для дозированной обработки карбонилсульфидом, а одну для использования в качестве контроля. Каждую порцию пшеницы помещают в стеклянный сосуд объемом 1,1 л и этот сосуд закрывают завинчивающейся крышкой, снабженной перегородкой. Через эту перегородку вводят дозы карбонилсульфида в интервале от 8 мг/л до 45 мг/л. После заданного времени анализа (например, после 24 ч) завинчивающуюся крышку заменяют фильтровальной бумагой для доступа воздуха. Затем пшеницу хранят либо при 25oC, либо при 30oC. Развившихся взрослых насекомых подсчитывают с еженедельными интервалами на протяжении от 4 до 5 недель. Дублирование каждого эксперимента осуществляют, повторяя всю процедуру. Результаты этой серии экспериментов представлены в таблице 3. Следует отметить, что экспонирование в течение 24 ч при дозе 8 мг/л карбонилсульфида дает, в среднем, 93,4% гибели всех взрослых стадий R. dominica. Наиболее устойчивой стадией является стадия пре-куколки (то есть те насекомые, которые появляются в промежуток 7-14 дней после обработки). Вторую серию экспериментов проводят таким же образом, но экспонируют пшеницу карбонилсульфиду на протяжении 6 ч, 24 ч и 48 ч, полученные результаты представлены в таблице 4. Следует отметить, что при одной и той же дозе карбонилсульфида увеличение времени экспонирования повышает смертность внешних стадий насекомых, что свидетельствует о том, что токсический эффект карбонилсульфида на насекомых во всем объеме зерна не исчезает быстро за счет абсорбции карбонилсульфида. Третью серию экспериментов проводят для исследования эффективности карбонилсульфида при борьбе с внешними стадиями вредителей зерна Sitophilus oryzae. Используют ту же процедуру при дозах карбонилсульфида в интервале от 15 мг/л до 91 мг/л, при экспонировании единичной дозы в интервале от 6 ч до 72 ч. Полученные результаты представлены в таблицах 5, 6 и 7. Четвертую серию экспериментов проводят, используя процедуру этого примера для определения относительной эффективности карбонилсульфида, сероуглерода и этилформата против внутренних незрелых стадий S. oryzae и R. dominica в целом зерне. Результаты этих серий экспериментов представлены в таблице 8. Совершенно очевидно превосходство карбонилсульфида в качестве агента для борьбы с внутренними стадиями этих вредителей зерна. Пример 3 Эффективность карбонилсульфида в борьбе с клещами и psocids в хранилищах продуктов Был проведен ряд анализов для демонстрации эффективности карбонилсульфида против взрослых пшеничных клещей и psocids (вид Liposcelis bostrychophilus). Использовали методику анализа взрослых внешних стадий насекомых, обитающих в хранилищах продуктов, описанную в примере 1, за исключением того, что 3 г пшеницы (содержание влаги 18%) и приблизительно 100 мг пивных дрожжей помещали в стеклянные сосуды перед тем, как туда помещали приблизительно 200 psocids. После экспонирования psocids карбонилсульфиду в течение либо 6, либо 24 ч герметизирующие крышки с сосудов удаляют и спустя 1 ч пребывания на воздухе сосуды закрывают пластиком. Анализ ведут при 25oC, 75% относительной влажности. Количество подвижных клещей считают к концу экспонирования карбонилсульфиду и смертность оценивают после периода выдерживания в 5 дней. Результаты этих экспериментов с взрослыми psocids и клещами (Lepidoglyphus destructor) представлены в таблице 9 и 10, причем часть информации, полученная из этих данных, включена в таблицу 2. В отдельном эксперименте, 200 psocids в стеклянном контейнере экспонируют дозу 5 мг/л карбонилсульфида в течение одного часа. К концу этого часа все 200 psocids оказались погибшими. Пример 4 Эффективность карбонилсульфида в борьбе с плодовой мушкой Биоанализ влияния карбонилсульфида на внешние незрелые стадии плодовых мушек Квинсленда (Queensland), Bactrocera tyroni (Diptera: Tephritidae) проводят так же, как и анализ незрелых внешних стадий насекомых в примере 1, за исключением того, что (a) при использовании яичек полоски фильтровальной бумаги бывают влажными при обработке яичек дозой карбонилсульфида, и (b) в каждый сосуд добавляют 1 каплю воды для личинок перед добавлением насекомых. Анализы с яичками, питающимися личинками и куколками B. tyroni, проводят при 30oC. Полученные результаты представлены в таблицах 11, 12 и 13 для, соответственно, куколок, поздней стадии личинок и яичек B. tyroni. Пример 5 Использование карбонилсульфида для борьбы с термитами Взрослых термитов и нимф видов Coptotermes acinaciformis (froggat) (Isoptera, Rhinotermitidae) и Cryptotermes domesticus (Haviland, Isoptera, Kalotermitidae) экспонируют карбонилсульфиду таким же образом, как и взрослых насекомых в примере 1, за исключением того, что в каждый сосуд помещают влажную фильтровальную бумагу (Ватман N 1, диаметром 4,25 см) перед помещением туда насекомых. Результаты, полученные в этой серии экспериментов с взрослыми и нимфами Coptotermes acinaciformis, представлены в таблицах 14 и 15. Пример 6 Влияние карбонилсульфида на прорастание семян Для исследования того, влияет ли карбонилсульфид на прорастание семян, зерна Австралийской стандартной белой пшеницы и солодового ячменя доводят до 12% и 16% содержания влаги, как указано в способе JSO с воздушным термостатом. Образцы зерен подвергают воздействию карбонилсульфида в течение 24 ч при концентрации карбонилсульфида 0,5% (объем/объем), 1,0% (объем/объем) и 5,0% (объем/объем). При этих концентрациях соответствующие номинальные произведения концентрации на время составили 300 мг ч/л) и минимальной эффективной тестовой дозы. Минимальная эффективная тестовая доза представляет собой минимальную тестовую дозу, которая убивает всех насекомых, представленных в анализах, включая по крайней мере 100 насекомых. Энтомологам будет очевидно, что сравнение результатов таблицы 2 с известными ранее данными, приведенными в таблице 1, демонстрирует сопоставимость эффективности карбонилсульфида против внешних стадий насекомых с эффективностью, достигаемой другими, известными фумигантами. Представленные в таблице 2 данные ясно показывают эффективность карбонилсульфида против всех внешних стадий насекомых, перечисленных в таблице 2. Пример 2 Эффективность карбонилсульфида против внешних стадий насекомых в хранилищах продуктов. В ряде экспериментов взрослым особям вредителей зерновых Rhyzopertha dominica позволяют откладывать яички в течение 4-5 недель на 1000 г пшеницы, в условиях 30oC при содержании влаги 12%. В каждом эксперименте взрослых особей удаляют с пшеницы, которую затем делят на три части, две для дозированной обработки карбонилсульфидом, а одну для использования в качестве контроля. Каждую порцию пшеницы помещают в стеклянный сосуд объемом 1,1 л и этот сосуд закрывают завинчивающейся крышкой, снабженной перегородкой. Через эту перегородку вводят дозы карбонилсульфида в интервале от 8 мг/л до 45 мг/л. После заданного времени анализа (например, после 24 ч) завинчивающуюся крышку заменяют фильтровальной бумагой для доступа воздуха. Затем пшеницу хранят либо при 25oC, либо при 30oC. Развившихся взрослых насекомых подсчитывают с еженедельными интервалами на протяжении от 4 до 5 недель. Дублирование каждого эксперимента осуществляют, повторяя всю процедуру. Результаты этой серии экспериментов представлены в таблице 3. Следует отметить, что экспонирование в течение 24 ч при дозе 8 мг/л карбонилсульфида дает, в среднем, 93,4% гибели всех взрослых стадий R. dominica. Наиболее устойчивой стадией является стадия пре-куколки (то есть те насекомые, которые появляются в промежуток 7-14 дней после обработки). Вторую серию экспериментов проводят таким же образом, но экспонируют пшеницу карбонилсульфиду на протяжении 6 ч, 24 ч и 48 ч, полученные результаты представлены в таблице 4. Следует отметить, что при одной и той же дозе карбонилсульфида увеличение времени экспонирования повышает смертность внешних стадий насекомых, что свидетельствует о том, что токсический эффект карбонилсульфида на насекомых во всем объеме зерна не исчезает быстро за счет абсорбции карбонилсульфида. Третью серию экспериментов проводят для исследования эффективности карбонилсульфида при борьбе с внешними стадиями вредителей зерна Sitophilus oryzae. Используют ту же процедуру при дозах карбонилсульфида в интервале от 15 мг/л до 91 мг/л, при экспонировании единичной дозы в интервале от 6 ч до 72 ч. Полученные результаты представлены в таблицах 5, 6 и 7. Четвертую серию экспериментов проводят, используя процедуру этого примера для определения относительной эффективности карбонилсульфида, сероуглерода и этилформата против внутренних незрелых стадий S. oryzae и R. dominica в целом зерне. Результаты этих серий экспериментов представлены в таблице 8. Совершенно очевидно превосходство карбонилсульфида в качестве агента для борьбы с внутренними стадиями этих вредителей зерна. Пример 3 Эффективность карбонилсульфида в борьбе с клещами и psocids в хранилищах продуктов Был проведен ряд анализов для демонстрации эффективности карбонилсульфида против взрослых пшеничных клещей и psocids (вид Liposcelis bostrychophilus). Использовали методику анализа взрослых внешних стадий насекомых, обитающих в хранилищах продуктов, описанную в примере 1, за исключением того, что 3 г пшеницы (содержание влаги 18%) и приблизительно 100 мг пивных дрожжей помещали в стеклянные сосуды перед тем, как туда помещали приблизительно 200 psocids. После экспонирования psocids карбонилсульфиду в течение либо 6, либо 24 ч герметизирующие крышки с сосудов удаляют и спустя 1 ч пребывания на воздухе сосуды закрывают пластиком. Анализ ведут при 25oC, 75% относительной влажности. Количество подвижных клещей считают к концу экспонирования карбонилсульфиду и смертность оценивают после периода выдерживания в 5 дней. Результаты этих экспериментов с взрослыми psocids и клещами (Lepidoglyphus destructor) представлены в таблице 9 и 10, причем часть информации, полученная из этих данных, включена в таблицу 2. В отдельном эксперименте, 200 psocids в стеклянном контейнере экспонируют дозу 5 мг/л карбонилсульфида в течение одного часа. К концу этого часа все 200 psocids оказались погибшими. Пример 4 Эффективность карбонилсульфида в борьбе с плодовой мушкой Биоанализ влияния карбонилсульфида на внешние незрелые стадии плодовых мушек Квинсленда (Queensland), Bactrocera tyroni (Diptera: Tephritidae) проводят так же, как и анализ незрелых внешних стадий насекомых в примере 1, за исключением того, что (a) при использовании яичек полоски фильтровальной бумаги бывают влажными при обработке яичек дозой карбонилсульфида, и (b) в каждый сосуд добавляют 1 каплю воды для личинок перед добавлением насекомых. Анализы с яичками, питающимися личинками и куколками B. tyroni, проводят при 30oC. Полученные результаты представлены в таблицах 11, 12 и 13 для, соответственно, куколок, поздней стадии личинок и яичек B. tyroni. Пример 5 Использование карбонилсульфида для борьбы с термитами Взрослых термитов и нимф видов Coptotermes acinaciformis (froggat) (Isoptera, Rhinotermitidae) и Cryptotermes domesticus (Haviland, Isoptera, Kalotermitidae) экспонируют карбонилсульфиду таким же образом, как и взрослых насекомых в примере 1, за исключением того, что в каждый сосуд помещают влажную фильтровальную бумагу (Ватман N 1, диаметром 4,25 см) перед помещением туда насекомых. Результаты, полученные в этой серии экспериментов с взрослыми и нимфами Coptotermes acinaciformis, представлены в таблицах 14 и 15. Пример 6 Влияние карбонилсульфида на прорастание семян Для исследования того, влияет ли карбонилсульфид на прорастание семян, зерна Австралийской стандартной белой пшеницы и солодового ячменя доводят до 12% и 16% содержания влаги, как указано в способе JSO с воздушным термостатом. Образцы зерен подвергают воздействию карбонилсульфида в течение 24 ч при концентрации карбонилсульфида 0,5% (объем/объем), 1,0% (объем/объем) и 5,0% (объем/объем). При этих концентрациях соответствующие номинальные произведения концентрации на время составили 300 мг ч/л, 600 мг ч/л, 600 мг ч/л и 3000 мг ч/л и 3000 мг ч/л. Во всех этих экспериментах не было обнаружено никакого влияния ни на прорастание, ни на рост. В таблице 16 представлены результаты, полученные для пшеницы при 16% влажности. Пример 7 Сорбирование зерном карбонилсульфида Исследования сорбции проводили с зернами Австралийской стандартной белой пшеницы и риса Calrose, используя стеклянные ампулы для сыворотки емкостью 120 мл, каждая из которых была снабжена крышкой с клапаном "Mininert" для ввода газа. Содержание влаги в образцах зерна определяли электронометром (Marconi). Затем образцы зерна помещали в ампулы до уровней соответственно 25%, 50% и 95%. Ампулы хранили при 25 ч/л. Во всех этих экспериментах не было обнаружено никакого влияния ни на прорастание, ни на рост. В таблице 16 представлены результаты, полученные для пшеницы при 16% влажности. Пример 7 Сорбирование зерном карбонилсульфида Исследования сорбции проводили с зернами Австралийской стандартной белой пшеницы и риса Calrose, используя стеклянные ампулы для сыворотки емкостью 120 мл, каждая из которых была снабжена крышкой с клапаном "Mininert" для ввода газа. Содержание влаги в образцах зерна определяли электронометром (Marconi). Затем образцы зерна помещали в ампулы до уровней соответственно 25%, 50% и 95%. Ампулы хранили при 25 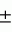 1oC. Из ампул откачивали объем воздуха, соответствующий объему дозы фумиганта для каждой ампулы, затем соответствующий объем карбонилсульфида вводили в каждую ампулу. Концентрацию карбонилсульфида определяли в зависимости от промежутка времени и проводили анализ для оценки уменьшения количества карбонилсульфида. В таблице 17 приводится пример необработанных данных, полученных в ходе этих экспериментов. Следует отметить, что для отношения (степени) заполнения 0% (то есть без пшеницы в ампуле), выделено спустя 0,25 часа после введения дозы 98,4% от расчетной введенной дозы. Это очень высокий уровень выделения. Уменьшение концентрации фумиганта в ампулах, не содержащих зерна, при повторных экспериментах спустя 93,9 ч всегда находилось в интервале от 1,2% до 1,5%, что указывает на высокую степень герметичности ампул. Результаты, полученные в экспериментах, соответствуют быстрому начальному поглощению части фумиганта зерном, с последующим уменьшением концентрации фумиганта пропорциональным количеству зерна в ампуле. Аналогичные эксперименты были проведены с такими фумигантами, как метилбромид и фосфин, для получения сравнительных данных. Полученные результаты представлены на чертеже. Чистый карбонилсульфид поглощается гораздо менее интенсивно, нежели метилбромид, и несколько менее интенсивно, нежели фосфин. Этот результат свидетельствует о том, что карбонилсульфид можно использовать для длительного дымления. Пример 8 Эффективность карбонилсульфида в качестве ингибитора плесени В тесте на эффективность карбонилсульфида в качестве ингибитора плесени ряд образцов пшеницы, содержащей 31% влаги (вес/вес) помещают в закрытые контейнеры (стеклянные сосуды). В некоторых контейнерах содержится только образец пшеницы и воздух. В других контейнерах содержится образец пшеницы и воздух, содержащий от 2,5% до 10% (объемных) карбонилсульфида. Все герметизированные контейнеры выдерживают при 35oC в течение 7 дней. После двух дней хранения часть пшеницы в герметизированных контейнерах, в которых фумигант отсутствует, заметно обесцвечивается. Спустя 7 дней вся пшеница в контейнерах без фумиганта обесцвечивается за счет роста на зернах плесени. Однако в тех контейнерах, в которых содержится карбонилсульфид в концентрациях от 4,5% до 10% (объемных), не происходит обесцвечивания. Пример 9 Исследование того, как период экспонирования влияет на концентрацию карбонилсульфида Образцы смешанной культуры Sitophilus oryzae были экспонированы различным концентрациям карбонилсульфида на протяжении промежутков времени от 6 до 168 ч, используя способ примера 2. Результаты этой серии экспериментов представлены в таблице 18. Видно, что карбонилсульфид является эффективным средством для борьбы с насекомыми в широком интервале концентраций и для широкого круга времен экспонирования. Пример 10 Исследование применения карбонилсульфида для окуривания почвы Три образца почвы - обозначенные A, B и C - были взяты из сада с овощами. Образец A был взят из компостной кучи в саду. Влажность образцов A, B и C составляла соответственно 29,4%, 25,8% и 27,1%. Три стеклянные ампулы (сосуда), каждый емкостью 120 мл, примерно наполовину заполнили почвой из каждого из образцов A, B и C. Затем каждую ампулу снабдили клапаном "Mininert". Карбонилсульфид вводили в две из трех ампул, содержащих почву каждого из образцов. Третью ампулу оставляли необработанной для контроля. Кроме того, 1 кг почвы образца В поместили в стеклянный сосуд емкостью 1,8 л, с крышкой с перегородкой, через которую вводили карбонилсульфид. Все сосуды (то есть ампулы по 120 мл емкостью и сосуд емкостью 1,8 л) хранили при 27oC в течение 20 ч. За это время хранения определяли концентрацию карбонилсульфида в каждом из сосудов. Из этих измерений концентрации карбонилсульфида во время хранения получили следующие результаты: (a) через две минуты после введения карбонилсульфида концентрация карбонилсульфида составила в среднем 62% от рассчитанной исходной концентрации, что указывает на быстрое поглощение карбонилсульфида влажной почвой, (b) спустя пять часов после инъекции карбонилсульфида в сосудах содержалось (в среднем) 18% рассчитанной исходной концентрации, и (c) спустя 20 ч средняя концентрация карбонилсульфида составила 5,9% от исходной расчетной концентрации. К концу периода хранения крышки удаляли и сосуды оставили открытыми на воздухе. Эффективность карбонилсульфида оценивали, сравнивая количество нематод в контрольных сосудах с теми, в которых была окуренная фумигантом почва. Полученные результаты представлены в таблице 19. Из таблицы 19 следует, что карбонилсульфид эффективно удаляет из почвы нематод. Пример 11 Оценка карбонилсульфида как фумиганта по сравнению с фосфином и метилбромидом Во вступлении к этому описанию было указано, что "идеальных" фумигантов не существует. Выбор фумиганта осуществляют, оценивая его преимущества и недостатки. Авторы настоящего изобретения провели сравнение обычно используемых фумигантов-метилбромида и фосфина с карбонилсульфидом с точки зрения токсичности для млекопитающих, токсичности по отношению к насекомым (при кратковременном или длительном экспонировании), безопасности для окружающей среды и воспламеняемости. Для каждого из параметров оценка 1 соответствует лучшим значениям, а 3 - худшим. Оценка полученных результатов приведена в таблице A. Величина токсичности для млекопитающих была основана на значениях TLV, а воспламеняемость оценивали, сравнивая пределы воспламеняемости на воздухе. Метилбромид оценивается как худший с точки зрения безопасности для окружающей среды, так как он влияет на озонный слой, а карбонилсульфид в этой категории расценивается как более предпочтительный, чем фосфин, так как для фосфина нет данных о его вреде для окружающей среды и нет данных о механизмах реакций фосфина в окружающей среде. Очевидно, что карбонилсульфид является реальной альтернативой метилбромиду и фосфину в качестве фумиганта. Его можно использовать для кратковременного окуривания (что невозможно с фосфином) и для длительного окуривания - вплоть до 35 дней или более (что невозможно с метилбромидом). Кроме того, энтомологам должно быть ясно, что регистрация карбонилсульфида в качестве "нового" фумиганта должна быть недорогой, учитывая интенсивные исследования, уже проведенные для карбонилсульфида. 1oC. Из ампул откачивали объем воздуха, соответствующий объему дозы фумиганта для каждой ампулы, затем соответствующий объем карбонилсульфида вводили в каждую ампулу. Концентрацию карбонилсульфида определяли в зависимости от промежутка времени и проводили анализ для оценки уменьшения количества карбонилсульфида. В таблице 17 приводится пример необработанных данных, полученных в ходе этих экспериментов. Следует отметить, что для отношения (степени) заполнения 0% (то есть без пшеницы в ампуле), выделено спустя 0,25 часа после введения дозы 98,4% от расчетной введенной дозы. Это очень высокий уровень выделения. Уменьшение концентрации фумиганта в ампулах, не содержащих зерна, при повторных экспериментах спустя 93,9 ч всегда находилось в интервале от 1,2% до 1,5%, что указывает на высокую степень герметичности ампул. Результаты, полученные в экспериментах, соответствуют быстрому начальному поглощению части фумиганта зерном, с последующим уменьшением концентрации фумиганта пропорциональным количеству зерна в ампуле. Аналогичные эксперименты были проведены с такими фумигантами, как метилбромид и фосфин, для получения сравнительных данных. Полученные результаты представлены на чертеже. Чистый карбонилсульфид поглощается гораздо менее интенсивно, нежели метилбромид, и несколько менее интенсивно, нежели фосфин. Этот результат свидетельствует о том, что карбонилсульфид можно использовать для длительного дымления. Пример 8 Эффективность карбонилсульфида в качестве ингибитора плесени В тесте на эффективность карбонилсульфида в качестве ингибитора плесени ряд образцов пшеницы, содержащей 31% влаги (вес/вес) помещают в закрытые контейнеры (стеклянные сосуды). В некоторых контейнерах содержится только образец пшеницы и воздух. В других контейнерах содержится образец пшеницы и воздух, содержащий от 2,5% до 10% (объемных) карбонилсульфида. Все герметизированные контейнеры выдерживают при 35oC в течение 7 дней. После двух дней хранения часть пшеницы в герметизированных контейнерах, в которых фумигант отсутствует, заметно обесцвечивается. Спустя 7 дней вся пшеница в контейнерах без фумиганта обесцвечивается за счет роста на зернах плесени. Однако в тех контейнерах, в которых содержится карбонилсульфид в концентрациях от 4,5% до 10% (объемных), не происходит обесцвечивания. Пример 9 Исследование того, как период экспонирования влияет на концентрацию карбонилсульфида Образцы смешанной культуры Sitophilus oryzae были экспонированы различным концентрациям карбонилсульфида на протяжении промежутков времени от 6 до 168 ч, используя способ примера 2. Результаты этой серии экспериментов представлены в таблице 18. Видно, что карбонилсульфид является эффективным средством для борьбы с насекомыми в широком интервале концентраций и для широкого круга времен экспонирования. Пример 10 Исследование применения карбонилсульфида для окуривания почвы Три образца почвы - обозначенные A, B и C - были взяты из сада с овощами. Образец A был взят из компостной кучи в саду. Влажность образцов A, B и C составляла соответственно 29,4%, 25,8% и 27,1%. Три стеклянные ампулы (сосуда), каждый емкостью 120 мл, примерно наполовину заполнили почвой из каждого из образцов A, B и C. Затем каждую ампулу снабдили клапаном "Mininert". Карбонилсульфид вводили в две из трех ампул, содержащих почву каждого из образцов. Третью ампулу оставляли необработанной для контроля. Кроме того, 1 кг почвы образца В поместили в стеклянный сосуд емкостью 1,8 л, с крышкой с перегородкой, через которую вводили карбонилсульфид. Все сосуды (то есть ампулы по 120 мл емкостью и сосуд емкостью 1,8 л) хранили при 27oC в течение 20 ч. За это время хранения определяли концентрацию карбонилсульфида в каждом из сосудов. Из этих измерений концентрации карбонилсульфида во время хранения получили следующие результаты: (a) через две минуты после введения карбонилсульфида концентрация карбонилсульфида составила в среднем 62% от рассчитанной исходной концентрации, что указывает на быстрое поглощение карбонилсульфида влажной почвой, (b) спустя пять часов после инъекции карбонилсульфида в сосудах содержалось (в среднем) 18% рассчитанной исходной концентрации, и (c) спустя 20 ч средняя концентрация карбонилсульфида составила 5,9% от исходной расчетной концентрации. К концу периода хранения крышки удаляли и сосуды оставили открытыми на воздухе. Эффективность карбонилсульфида оценивали, сравнивая количество нематод в контрольных сосудах с теми, в которых была окуренная фумигантом почва. Полученные результаты представлены в таблице 19. Из таблицы 19 следует, что карбонилсульфид эффективно удаляет из почвы нематод. Пример 11 Оценка карбонилсульфида как фумиганта по сравнению с фосфином и метилбромидом Во вступлении к этому описанию было указано, что "идеальных" фумигантов не существует. Выбор фумиганта осуществляют, оценивая его преимущества и недостатки. Авторы настоящего изобретения провели сравнение обычно используемых фумигантов-метилбромида и фосфина с карбонилсульфидом с точки зрения токсичности для млекопитающих, токсичности по отношению к насекомым (при кратковременном или длительном экспонировании), безопасности для окружающей среды и воспламеняемости. Для каждого из параметров оценка 1 соответствует лучшим значениям, а 3 - худшим. Оценка полученных результатов приведена в таблице A. Величина токсичности для млекопитающих была основана на значениях TLV, а воспламеняемость оценивали, сравнивая пределы воспламеняемости на воздухе. Метилбромид оценивается как худший с точки зрения безопасности для окружающей среды, так как он влияет на озонный слой, а карбонилсульфид в этой категории расценивается как более предпочтительный, чем фосфин, так как для фосфина нет данных о его вреде для окружающей среды и нет данных о механизмах реакций фосфина в окружающей среде. Очевидно, что карбонилсульфид является реальной альтернативой метилбромиду и фосфину в качестве фумиганта. Его можно использовать для кратковременного окуривания (что невозможно с фосфином) и для длительного окуривания - вплоть до 35 дней или более (что невозможно с метилбромидом). Кроме того, энтомологам должно быть ясно, что регистрация карбонилсульфида в качестве "нового" фумиганта должна быть недорогой, учитывая интенсивные исследования, уже проведенные для карбонилсульфида.
ФОРМУЛА ИЗОБРЕТЕНИЯ1. Применение карбонилсульфида в качестве фумиганта для контроля насекомых, нематод, плесени или клещей. 2. Фумигантная композиция, содержащая активный ингредиент и газ-разбавитель, отличающаяся тем, что в качестве активного ингредиента она содержит карбонилсульфид. 3. Фумигантная композиция по п.2, отличающаяся тем, что газ-разбавитель выбирают из группы, состоящей из воздуха, двуокиси углерода и ингибитора воспламенения. 4. Способ окуривания, предусматривающий обработку фумигантов продуктов хранения, пиломатериалов, почвы или помещений, предрасположенных к заражению насекомыми, нематодами, плесенью или клещами, причем указанные продукты хранения включают различные виды зерна и другие продукты длительного хранения, а также фрукты и другие скоропортящиеся продукты, отличающийся тем, что в качестве фумиганта используют карбонилсульфид в эффективном количестве. 5. Способ по п.4, отличающийся тем, что обработку карбонилсульфидом зерна или других продуктов длительного хранения проводят в промежуток времени в интервале от 1 ч до 35 дней в количестве, достаточном для контроля выбранных вредителей продуктов. 6. Способ по п.5, отличающийся тем, что для достижения смертности вредителей 95% (а) если вредитель продуктов является взрослой особью Rhyroppertha dominica, то количество карбонилсульфида при 25oC составляет, по крайней мере, 38 мг час/л, (b) если вредитель продуктов является взрослой особью Tribolium castaneum, то количество карбонилсульфида при 25oC составляет, по крайней мере, 82 мг ч/л, (c) если вредитель продуктов является взрослой особью Sitophilus oryzae, то количество карбонилсульфида при 25oC составляет, по крайней мере, 99 мг ч/л, (d) если вредитель продуктов является взрослой особью Oryzaephilus surinamensis, то количество карбонилсульфида при 25oC составляет, по крайней мере, 198 мг ч/л, (e) если вредитель зерна является взрослой особью Tribolium confusum, то количество карбонилсульфида при 25oC составляет, по крайней мере, 111 мг ч/л. (f) если вредитель продуктов является взрослой особью Lepidoglyphus destructor, то количество карбонилсульфида составляет, по крайней мере, 240 мг ч/л, (g) если вредитель является куколкой T.castaneum, то количество карбонилсульфида при 30oC составляет, по крайней мере, 290 мг ч/л, (h) если вредитель является куколкой B.tyroni, то количество карбонилсульфида при 27oC составляет, по крайней мере, 440 мг ч/л, (i) если вредитель является личинкой T.castaneum, то количество карбонилсульфида при 25oC составляет, по крайней мере, 270 мг ч/л, (j) если вредитель является E. cautella, то количество карбонилсульфида составляет, по крайней мере, 410 мг ч/л, (k) если вредитель является личинкой O.surinamensis, то количество карбонилсульфида составляет, по крайней мере, 210 мг ч/л, (l) если вредитель представляет собой яички R.dominica, то количество карбонилсульфида составляет, по крайней мере, 102 мг ч/л, (m) если вредитель представляет собой яички T.castaneum, то количество карбонилсульфида составляет, по крайней мере, 430 мг ч/л, (n) если вредитель представляет собой яички O.surinamensis, то количество карбонилсульфида составляет, по крайней мере, 495 мг ч/л, (o) если вредитель представляет собой яички B.tyroni, то количество карбонилсульфида составляет, по крайней мере, 460 мг ч/л. 7. Способ по п.4, отличающийся тем, что обработку карбонилсульфидом продуктов, представляющих собой фрукты или другие скоропортящиеся продукты, проводят в течение, по крайней мере, 6 ч в количестве, достаточном для контроля за всеми незрелыми стадиями плодовой мушки. 8. Способ по п.4, отличающийся тем, что обработку карбонилсульфидом пиломатериалов, изделий из древесины или деревянных зданий проводят в количестве, достаточном для контроля термитов или других вредителей пиломатериалов. 9. Способ по п.4, отличающийся тем, что обработку почвы карбонилсульфидом проводят в количестве, достаточном для контроля нематод.Популярные патенты: 2263431 Устройство для предпосевной обработки семян ... образом в камеру 10 заливают рассол природного минерала бишофита плотностью 1,2-1,4 т/м3. При закрытых вентилях 5, 14 и открытом вентиле источника сжатого воздуха 11 в камере 8 создают избыточное давление. При открытых вентилях 13 и 14 через трубопровод 12 жидкий агент транспортируют в камеру 8. Нагревателями 9 температуру рассола бишофита поднимают до +80...+120°С. Дальше при открытом вентиле 7 по нагнетательному трубопроводу 6 рассол бишофита перемещается в емкость смесительной камеры 1. При вращающемся роторе 17 его криволинейными лопастями 18 (см. фиг.1 и 2) порции семян приподнимаются над уровнем рассола и вновь в него сбрасываются.Многократные окунания семян ... 2381650 Синергические фунгицидные комбинации биологически активных веществ и их применение для борьбы с нежелательными фитопатогенными грибами ... ... 2241322 Навесное устройство трактора ... полого корпуса и упором, а другая - между упором и нижней крышкой полого корпуса.2. Навесное устройство по п.1, отличающееся тем, что диаметр упора равен внутреннему диаметру полого корпуса. MM4A - Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 29.04.2005 Извещение опубликовано: 20.02.2007 БИ: ... 2471341 Стойло, устройство в стойле и способ монтажа указанного устройства ... выступов, должны быть удалены для того, чтобы отцепить подгрудную доску от профиля.Устройство монтируют в соответствии с различными этапами, определенными в способе, заявленном в независимом пункте 15, включающем следующие этапы: - прикрепление одной стороны мата к полу стойла профилем, прикрепляемым к полу по меньшей мере двумя крепежными средствами, такими как винты или болты;- введение фланца подгрудной доски, или множества отдельных выступов, в паз в профиле, или паз, образованный профилем; и- закрепление подгрудной доски в полу стойла так, чтобы не дать возможность фланцу, или множеству отдельных выступов, вставленных в паз, выскользнуть из зацепления с продолговатым ... 2395497 Способ стимулирования роста подсолнечника регулятором роста ... концентрации 0,001%. В качестве аналога по строению использовали соединение 3. Ростстимулирующую активность определяли по увеличению длины стебля и корня семян, обработанных раствором исследуемого вещества, в сравнении с контролем.Повторность опыта трехкратная. В каждой повторности использовали по 50 штук семян.Результаты измерений подвергали статистической обработке с использованием t-критерия Стьюдента при Р=0,95. Полученные данные представлены в таблице. Испытания, проведенные на семенах подсолнечника сорта ВНИИМК-8883, позволили установить, что заявляемые соединения 1-2 в диапазоне концентраций 10-2-10-5 мас.% проявляют свойства стимуляторов роста.Соединение 1 ... |
Еще из этого раздела: 2154931 Корнеуборочная машина 2060659 Установка для переработки органического субстрата в биогумус 2027757 Способ получения растений - регенерантов in vitro 2091006 Способ создания и формирования хвойнодубоволиственных лесов на северной половине ареала дуба 2293463 Способ разработки лесосек 2075926 Устройство для группового учета молока на доильных установках 2114528 Устройство для клеточного содержания мелких животных 2459398 Способ рекультивации почв, загрязненных минерализованными водами 2473366 Вещество, обладающее антимикробным действием 2297128 Способ мелиорации солонцовых почв в условиях орошения |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||