Рекомбинантная плазмидная днкрtv241, способ конструирования рекомбинантной плазмидной днкрtv241, способ конструирования плазмиды, содержащей ген cry iii a в составе транспозона tn917cat, штамм бактерий bacillus thuringiensis subsp. thuringiensis, активныйПатент на изобретение №: 2125091 Автор: Добрица А.П. Патентообладатель: Государственное федеральное предприятие Государственный научный центр прикладной микробиологии Дата публикации: 20 Января, 1999 Адрес для переписки: 142279 Московская обл. Серпуховский р-н, пос.Оболенск, ГНЦПМ Изображения Изобретение относится к биотехнологии, в частности к генетической инженерии. Рекомбинантная плазмидная ДНК рТV/241, обеспечивающая экспрессию гена дельта-эндотоксина cryIII A Bacillus thuringiensis subsp. tenebrionis, содержит полную последовательность векторной плазмиды рТV24, полную последовательность Bam HI-Bgl II - фрагментa ДНК Bacillus thuringiensis subsp. tenebrionis размером 2,9 т.п.н., интактный ген дельта-эндотоксина Bacillus thuringiensis subsp. tenebrionis cry IIIA, встроенный в последовательность транспозона Тп917 cat. Способ конструирования рекомбинантной плазмидной ДНК pTV241 заключается в том, что смесь ДНК плазмиды pUC19 и Bacillus thuringiensis subsp. tenebrionis расщеляют эндонуклеазой HindIII. Обрабатывают смесью клетки Escherichia coli JM103, отбирают бесцветные колонии на среде Мак-Конки с ампициллином. Отобранные колонии проверяют на наличие последовательностей ДНК, гомологичных соответствующим последовательностям cryIIIА гена. Из клеток одной из колоний, содержащих указанные последовательности, выделяют ДНК-плазмиду с геном cryIIIA, обозначенную рВТТ51. Плазмиду рВТТ51 расщепляют эндонуклеазами Bam HI и Bgl II. Полученные фрагменты смешивают с фрагментами ДНК плазмиды pTV24 и соединяют. Трансформируют фрагменты посредством электропорации клеток Bacillus thuringiensis subsp. kurstaki. Трансформанты высевают на агаризованную среду, содержащую хлорамфеникол (Cm). Выделяют из Cm - устойчивых клеток плазмидные ДНК. Отбирают целевую рекомбинантную плазмидную ДНК pTV241. Способ конструирования плазмиды, содержащей ген cryIIIA в составе транспозона Tn917 cat, размером около 50 т.п.н., заключается в том, что рекомбинантную плазмидную ДНК pTV241 передают в клетки штамма Bacillus thuringiensis subsp. morrisoni ДС. Отбирают трансформированные клоны, устойчивые к Cm. Затем их скрещивают со штаммом Bacillus cereus, устойчивым к рифампицину (Rf). Из клеточных клонов, устойчивых к Cm и Rf, выделяют целевую конъюгативную плазмиду. На основе данной плазмиды получают штамм Bacillus thuringiensis subsp. thuringiensis IPM-37, активный против колорадского жука. Предлагаемoе изобретение позволяет получить более эффективный штамм, не только активный против колорадского жука, но и против других жесткокрылых вредных насекомых. 4 c.п. ф-лы, 1 ил. Изобретение относится к области биотехнологии и, в частности, к генетической инженерии, и представляет собой рекомбинантную плазмидную ДНК, содержащую ген дельта-эндотоксина Bacillus thuringiensis (cryIIIA), активного против колорадского жука, в составе транспозона, способ конструирования данной рекомбинантной плазмидной ДНК, способ конструирования конъюгативной плазмиды с этим транспозоном и энтомопатогенный штамм Bacillus thuringiensis, содержащий рекомбинантную плазмиду с сrуIIIА-геном и продуцирующий Coleoptera-специфический кристаллический дельта-эндотоксин и бета-экзотоксин. Известен штамм бактерий Bacillus thuringiensis - продуцент дельта-эндотоксина против колорадского жука (SU патент 1814520 МПК А 01 N 63/00). Однако данный штамм обладает недостаточно высокой инсектицидной активностью. Известен штамм Bacillus thuringiensis, синтезирующий белки, токсичные против насекомых отряда Соlеорtега, известны последовательности этих токсинов и кодирующих их генов (патент ЕР 0498537 A2 С 12 N 15/32,1992). Однако приведенные в этом источнике сведения носят общий характер и не содержат подробной информации о возможных способах конструирования новых штаммов и их характеристиках. Кроме того, данные гены кодируют токсины, отличные от токсина сгуIIIА-типа, продуцируемого заявляемым штаммом Bacillus thuringiensis. Задача изобретения - создание штамма Bacillus thuringiensis - продуцента биоинсектицида комбинированного действия для борьбы с колорадским жуком и другими жесткокрылыми насекомыми. Создана рекомбинантная плазмидная ДНК pTV241, обеспечивающая экспрессию гена дельта-эндотоксина cryIIIA Bacillus thuringiensis subsp. tenebrionis размером 16,3 т.п.н., содержащая следующие конструктивные элементы: полную последовательность векторной плазмиды pTV24 размером 12,4 т.п.н; - полную последовательность Bam HI-Bgl II-фрагмент ДНК B.thuringiensis subsp.tenebrionis размером 2,9 т.п.н; - интактный ген дельта-эндотоксина B.thuringiensis subsp. tenebrionis cryIIIA, встроенный в последовательность транспозона Тп917 cat; - ген устойчивости к тетрациклину (tet); - ген устойчивости к хлорамфениколу (cat) в составe транспозона Тп917 cat; - генетические элементы плазмиды pE194, обеспечивающие репликацию плазмиды pTV24 и входящие в состав данной плазмиды; - гены и структурные элементы, необходимые для миграции транспозона Тп917 cat; - сайты расщепления эндонуклеазой EcoRI с координатами 0; 6,9 и 7,4 т.п. н; - сайты расщепления эндонуклеазой Pst I с координатами 8,4 и 13,7 т.п.н; - сайт расщепления эндонуклеазой Bam HI с координатой 9,1 т.п.н. Способ конструирования рекомбинантной плазмидной ДНК pTV241, заключается в том, что смесь ДНК плазмиды pUC19 и B.thuringiensis subsp. tenebrionis расщепляют эндонуклеазой HindIII, обрабатывают ДНК-лигазой, трансформируют обработанный смесью клетки Escherichia coli JM103, отбирают бесцветные колонии на среде Мак-Конки с ампицилином, отобранные колонии проверяют на наличие последовательностей ДНК, гомологичных соответствующим последовательностям cryIIIA гена, из клеток одной из колоний, содержащих указанные последовательности, выделяют ДНК-плазмиду с геном cryIIIA B.thuringiensis subsp. tenebrionis, обозначенную pBTT51, далее плазмиду pBTT51 расщепляют эндонуклеазами Bam HI и Bgl II, полученные фрагменты смешивают с фрагментами ДНК плазмиды pTV24, подвергнутой гидролизу эндонуклеазой Bam HI, фрагменты соединяют с помощью ДНК-лигазы и трансформируют ими посредством электропорации клетки бесплазмидного штамма B.thuringiensis subsp. kurstaki высевают трансформанты на агаризованную среду, содержащую хлорамфеникол (Cm) выделяют из Cm-устойчивых клеток плазмидные ДНК, проводят их рестрикционный анализ и отбирают целевую рекомбинантную ДНК pTV241, в структуре которой Bam HI-Bgl II-фрагмент плазмиды pBTT51 размером 2,9 т.п.н. встроен в Bam HI-сайт плазмиды pTV241 из cryIIIA ген находится в прямой ориентации по отношению к гену, определяющему устойчивость к эритромицину. Способ конструирования конъюгативной плазмиды, содержащей ген cryIIIA в составе транспозона Тп917 cat, размером около 50 т.п.н., заключается в том, что рекомбинантную ДНК pTV241 передают с помощью электропорации в клетки штамма B. thuringiensis subsp. morrisoni DC, отбирают трансформированные клоны по устойчивости к хлорамфениколу (Cm), отобранные клоны скрещивают с бесплазмидным штаммом Bacillus cereus, устойчивым к рифампицилину (Rf), и из клеточных клонов, устойчивых к хлорамфениколу и рифампицину (Cm Rf), выделяют целевую конъюгативную плазмиду, в состав которой транспазон Тп917 cat с геном cryIIIA включился в результате его транслокации из pTV241. Предложен штамм бактерий Bacillus thuringiensis subsp. thuringiensis IPM-37, содержащий конъюгативную плазмиду, полученную, как описано выше, активный против колорадского жука. Регистрационный номер в Центральной коллекции микроорганизмов Российского акционерного общества "Биопрепарат" ЦКМ В - 65И. Штамм получен в результате конъюгационного переноса плазмиды с cryIIIA-геном из B.cereus в клетки стрептомицин-устойчивого акристаллического варианта штамма B.thuringiensis subsp. thuringiensis 98. Полученный штамм характеризуется следующими признаками: Культурально-морфологические признаки. Вегетативные клетки штамма палочковидной формы длиной 2,6 - 5,5 мкм, шириной 1,7-1,9 мкм, в логарифмической фазе роста подвижные, грамположительные, расположены одиночно, попарно или в цепочках из нескольких клеток, в стационарной фазе роста спорулируют и образуют параспоральные кристаллические белковые включения квадратной формы. На МПА колонии серовато-белого цвета, округлые со слегка волнистыми краями, непрозрачные. Физиолого-биохимические признаки. Усваивает глюкозу, маннозу, сахарозу, целлобиозу, салицин, гидролизует крахмал, эскулин, пептонизирует молоко, образует лецитиназу и уреазу, восстанавливает нитраты. По Н-антигену относится к I-серотипу. Оптимальная температура роста 28-30oC. Генетические особенности штамма. Несет плазмиду с транспозоном Тп917 cat-cryIIIA. Молекулярная масса плазмиды - около 50 т.п.н. Проявляет устойчивость к хлорамфениколу (5-10 мкг/мл) и эритромицину (1 мкг/мл), детерминируемые геном cat и erm в составе транспозона. Условия хранения штамма. Штамм может храниться в лиофильно-высушенном состоянии или в столбиках 0,7% агаризованной среды под вазелиновым маслом после споруляции клеток. Штамм непатогенен для теплокровных животных. Преимущества такого штамма, перед другими штаммами В. thuringiensis, используемыми для биологического контроля колорадского жука: - более высокая инсектицидная активность - уменьшение риска формирования популяций насекомых устойчивых к биоинсектициду. На чертеже показана карта плазмиды pTV241. Изобретение иллюстрируется следующими примерами. Пример 1. Из клеток штамма B.thuringiensis subsp. tenebrionis, синтезирующего энтомоцидный белок против личинок колорадского жука, выделяют ДНК. Бактерии выращивают в 1 л среды LB до поздней логарифмической фазы роста при 30oC, клетки собирают центрифугированием, суспендируют в 50 мл TES-буфера (0,01 М трис-HCl, pH 8,0, 0,001 М ЭДТА, 0,1 М NaCl) и добавляют 5 мл раствора лизоцима (20 мг/мл). Суспензию клеток инкубируют при 37oC в течение 30 мин, затем добавляют 3 мл 20%-ного раствора додецилсульфата натрия. Лизат экстрагируют дважды равным объемом смеси хлороформа и изоамилового спирта (24: 1). Препарат ДНК обрабатывают РНК-азой (конечная концентрация 50 мкг/мл) в течение 1 ч при 37oC и осаждают этанолом. Чистоту и концентрацию препарата ДНК определяют спектрофотометрически. Затем смешивают 0,1 мкг ДНК плазмиды pUC19, выделенной из клеток Escherichia coli и очищенной в градиенте плотности CsCl в присутствии бромистого этидия и 2 мкг ДНК B.thuringiensis subsp. tenebrionis и гидролизуют эндонуклеазой HindIII (10 ед.) в 50 мкл буфера Б (10 мМ трис-HCl, pH 7,5, 50 мМ NaCl, 10 мМ MgCl2, 1 мМ дитиотрейтол). ДНК осаждают добавлением двух объемов этанола, растворяют в буфере ТЕ (10 мМ трис-HCl, pH 7,4, 1мМ ЭДТА, pH 8,0) добавляют буфер для лигирования (конечная концентрация - 66 мМ трис-HCl, pH 7,5, 5 мМ MgCl2, 5мМ дитиотрейтол, 1 мМ АТФ) и ДНК - лигазу фага Т4 (1 ед/мкг ДНК). Концентрация ДНК составляет около 50 мкг/мл. Реакцию проводят при 8-10oC в течение ночи. Для получения компетентных клеток культуру E.coli DH-альфа выращивают в среде LB при 37oC до середины логарифмической фазы роста. Клетки осаждают центрифугированием (эту и дальнейшие операции проводят при 2-4oC). Осадок ресуспендируют в 1/2 первоначального объема 10 мМ раствора CaCl2, выдерживают 20 мин и после центрифугирования ресуспендируют в 1/50 первоначального объема 50 мМ CaCl2. Через 12-24 ч хранения при 2-4oC 0,2 мл суспензии клеток смешивают с 10 мкл раствора, лигированной ДНК (10-50 мкг/мл) и инкубируют 30-60 мин на льду. Трансформационную смесь переносят на 2 мин в водяную баню (42oC), добавляют к суспензии 1 мл LB, инкубируют 1 ч при 37oC и высевают на aгаризованную среду Мак-Конки с ампициллином (100 мкг/мл). Чашки инкубируют при 37oC в течение ночи и отбирают бесцветные колонии. Из клеток этих клонов выделяют плазмидные ДНК и, используя эти ДНК в качестве матриц, проводят полимеразную цепную реакцию (ПЦР). Праймерами в ПЦР служат олигодезоксинуклеотиды, имеющие следующую структуру: 5 - GGNNCCAACCAGGATATT - 3 и 5 -CAGACCGCAAGATTTGAT - 3 ! Первый соответствует фрагменту cryIIIA-гена B.thuringiensis subsp. tenebrionis c 1034 по 1051 нуклеотид и второй комплементарен последовательности этого детерминанта с 1215 по 1232 нуклеотид. Последовательности ДНК, исследуемые на наличие гена Coleoptera-специфического инсектицидного белка, амплифицируют in vitro с помощью ПЦР в 50 мкл реакционной смеси, содержащей около 10 мг ДНК, праймеры (концентрация каждого праймера - 0,3 мкМ), 60 мМ трис-HCl, 16 мM (NH3)2SO4, 1,5 мМ MgCl2, 1 мМ дитиотрейтол, 0,01 % тритона Х-100, 0,01% Твин-20, бычий сывороточный альбумин (0,1 мг/мл), смесь дезоксинуклеозидфосфатов (дАТФ, дЦТФ, и дТТФ - по 0,2 мМ) и 2 ед. Tth - полимеразы; pH смеси - 8,8 при 25oC. Реакцию амплификации проводят под вазелиновым маслом в течение 30 циклов: 94oC - 1 мин, 45oC - 2 мин и 67oC - 2 мин. Продукты ПЦР разделяют с помощью электрофореза в геле 2,5-ной агарозы и отбирают клоны, содержащие плазмиды, являющиеся матрицей для синтеза фрагментов ДНК размером около 0,2 т.п.н., при использовании в ПЦР указанных праймеров. Плазмиду, в структуре которой ген дельта - эндотоксина входит в состав HindIII - фрагмента размером около 3 т.п.н. и находится в прямой ориентации по отношению к lac-промотору, обозначают как рВТТ51. ДНК плазмиды рВТТ51 трансформируют клетки E.coli GM272, выделяют из клеток трансформантов плазмидную ДНК и гидролизуют рестрикционными эндонуклеазами Bgl II и Bam HI при 37oC в буфере А (10 мМ трис-HCI, pH 7,5, 10 мМ MgCl2, 1 мМ дитиотрейтол) и буфере Б соответственно. ДНК плазмиды pTV24 расщепляют рестриктазой Bam HI при 37oC в буфере Б. По окончании реакции гидролиза инкубационные смеси прогревают при 65oC и вносят 5 М раствор NaCl до конечной концентрации 0.1 М. ДНК осаждают добавлением двух объемов этанола и растворяют в буфере ТЕ. Гидролизаты ДНК pBTT51 и pTV24 смешивают в соотношении 5:1 и фрагменты ДНК объединяют с помощью ДНК - лигазы, как описано выше. Полноту гидролиза и лигирования ДНК контролируют с помощью электрофореза в геле 0,7%-ной агарозы. Для трансформации с помощью электропорации культуру бесплазмидного штамма В. thuringiensis subsp. kurstaki выращивают в среде BHIG (сердечно-мозговая вытяжка - 3,7%, глицерин - 0,5%) с перемешиванием на качалке при 28-30oC в течение ночи, разбавляют в 20 раз и продолжают инкубацию еще 1 ч. Клетки осаждают, промывают средой ЕВ (0,625 М сахароза, 1 мМ MgCl2), снова центрифугируют и суспендируют в ЕВ (клетки из 5 мл культуры суспендируют в 0,75 мл буфера). Суспензию помещают в ледяную баню (2-4oC), добавляют 2 мкл раствора лигированной ДНК с концентрацией 50-100 мкг/мл и смесь инкубируют на льду 5 мин. Затем вносят в электродную ячейку с расстоянием между электродами 2,5 мм и проводят одиночный разряд 1500 c продолжительностью 1 мс. Ячейку переносят на лед, инкубируют 5 мин и суспензию клеток из ячейки добавляют к 1,5 мл BHIG. Культуры инкубируют на качалке при 28-30oC 1 ч и высевают на чашки со средой LB, содержащей хлорамфеникол (5 мкг/мл). Чашки инкубируют в течение суток при 28-30oC, выросшие колонии отбирают, из полученных клонов выделяют плазмидные ДНК и проводят рестрикционный анализ выделенных плазмид. Отбирают плазмиды, которые переходят в линейную форму при расщеплении Bam HI и имеют размер 16,3 т.п.н. Рекомбинантную плазмиду, содержащую cryIIIA-ген в прямой ориентации по отношению к erm-гену, обозначают как pTV241. Карта плазмиды pTV241 представлена на чертеже. Пример 2. Для конструирования конъюгативной плазмиды с cryIIIA-геном плазмиду pTV241 передают с помощью электропорации в клетки штамма B.thuringiensis subsp. morrisoni DC или другого штамма, несущего конъюгативную плазмиду, и трансформированные клоны отбирают по устойчивости к хлорамфениколу, как описано выше. Трансформанты скрещивают с бесплазмидным штаммом В. cereus, устойчивым к рифампицину (Rf), и в случае использования в качестве донора трансформанта в B. thuringiensis subsp. morrisoni DC, из клеток CMRf- клонов трансконъюгантов выделяют 50 т.п.н. плазмиду, в структуру которой включился транспозон с cryIIIA-геном в результате его транслокации из генома pTV241. Пример 3. Для получения штамма B.thuringiensis - продуцента двух токсинов различного механизма действия, бета-экзотоксина и дельта-эндотоксина, активных против колорадского жука и других насекомых отр. Coleoptera, штамм B.cereus, несущий конъюгативную плазмиду из B. thuringiensis subsp. morrisoni DC с cryIIIA-геном, скрещивают сo стрептомицинустойчивым мутантом штамма B.thuringiensis subsp. thuringiensis 98 (ExoCry). Отбор трансконъюгантов проводят на агаризованной среде LB, содержащей стрептомицин (50 мкг/мл) и хлорамфеникол (5 мкг/мл). В клетках трансконъюгантов детектируют продукцию кристаллов дельта-эндотоксина с помощью фазовоконтрастной микроскопии и бета-экзотоксина с помощью тонкослойной хроматографии культуральной жидкости. Синтез энтомоцидного белка cryIIIA-типа подтверждают с помощью метода двойной радиальной иммунодиффузии, используя сыворотку кролика к кристаллическому инсектицидному белку, продуцируемому B.thuringiensis subsp. tenebrionis. Один из клонов трансконъюгантов - продуцентов дельта-эндотоксина cryIIIA-типа и бета-экзотоксина обозначают как В. thuringiensis subsp. thuringiensis IPM-37. Пример 4. Оценку инсектицидной активности штамма В. thuringiensis subsp. thuringiensis IPM-37 проводят на личинках колорадского жука (Leptinotarsa decemlineata) первого или второго возраста, отродившихся из одной природной популяции. Бактериальную культуру разводят в 5 раз 0,9% NaCl и готовят серию из пяти разведений культуры с шагом 5. В качестве положительного контроля используют серии разведений спорокристаллических смесей B.thuringiensis subsp. tenebrionis и thuringiensis subsp. thuringiensis. В приготовленные суспензии опускают листья картофеля примерно одного размера, вынимают, дают им высохнуть при 20oC и помещают в чашки Петри. В качестве отрицательного контроля используют раствор 0,9% NaCl. На каждое разведение используют по 10 личинок жука и по 2-5 листьев картофеля. Учет гибели личинок проводят через 3 суток инкубирования в термостате при температуре 21oC и фотопериоде 18 ч. Биологическую активность штаммов, выраженную в ЛК50, вычисляют по формуле Кербера в процентах концентрации культуральной жидкости (КЖ) в суспензии: lg ЛК50= lgСм - 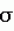 ( (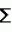 L - 0,5), где См - максимальная из испытанных концентраций; L - 0,5), где См - максимальная из испытанных концентраций;  - логарифм отношения каждой предыдущей концентрации к последующей (логарифм кратности разведения); - логарифм отношения каждой предыдущей концентрации к последующей (логарифм кратности разведения);  L - сумма значений L (доли погибших личинок от числа испытуемых), найденных для всех концентраций с учетом поправки на гибель в контроле по методу Аббота: L=(pо-pк):(l-pк), где pо - доля погибших личинок при испытании культуры; pк - доля погибших личинок в контрольном опыте. Штамм В. thuringiensis subsp. thuringiensis IPM-37 по своей инсектицидной активности (ЛК50 равна 0,21% КЖ) превосходит штаммы В. thuringiensis subsp. tenebrionis (ЛК50= 0,86% КЖ) и В. thuringiensis subsp. thuringiensis 98 (ЛК50= 0,82% КЖ). (Абсолютные значения инсектицидной активности могут отличаться в зависимости от популяции колорадского жука, взятой для анализа). Предлагаемое изобретение позволяет получить штамм В. thuringiensis - продуцент биоинсектицида комбинированного действия против колорадского жука и других насекомых отр. Coleoptera. Конъюгативная плазмида, в которую был включен транспозон с геном Coleoptera-специфического инсектицидного белка, может быть также легко передана в клетки других штаммов В.thuringiensis с целью конструирования продуцентов, синтезирующих токсины в комбинациях, отличных от представленных в данном изобретении. Положительный эффект предлагаемого изобретения достигается за счет свойств сконструированной новым способом плазмиды pTV241 по наличию в ее структуре транспозона с детерминантом инсектицидного белка cryIIIA-типа, способного транслоцироваться в бациллах, и генетических элементов сконструированной новым способом конъюгативной плазмиды с cryIIIA-геном, определяющих ее способность к передаче и автономной репликации в клетках B.thuringiensis. Синтез в клетках предлагаемого штамма B.thuringiensis subsp. thuringiensis IPM-37 двух токсинов с различными механизмами действия определяет более чем в 3 раза высокую активность этого штамма по сравнению с другими штаммами B. thuringiensis, используемыми для борьбы с колорадским жуком. Это свойство позволяет также снизить риск формирования популяций насекомых, устойчивых к биоинсектициду. L - сумма значений L (доли погибших личинок от числа испытуемых), найденных для всех концентраций с учетом поправки на гибель в контроле по методу Аббота: L=(pо-pк):(l-pк), где pо - доля погибших личинок при испытании культуры; pк - доля погибших личинок в контрольном опыте. Штамм В. thuringiensis subsp. thuringiensis IPM-37 по своей инсектицидной активности (ЛК50 равна 0,21% КЖ) превосходит штаммы В. thuringiensis subsp. tenebrionis (ЛК50= 0,86% КЖ) и В. thuringiensis subsp. thuringiensis 98 (ЛК50= 0,82% КЖ). (Абсолютные значения инсектицидной активности могут отличаться в зависимости от популяции колорадского жука, взятой для анализа). Предлагаемое изобретение позволяет получить штамм В. thuringiensis - продуцент биоинсектицида комбинированного действия против колорадского жука и других насекомых отр. Coleoptera. Конъюгативная плазмида, в которую был включен транспозон с геном Coleoptera-специфического инсектицидного белка, может быть также легко передана в клетки других штаммов В.thuringiensis с целью конструирования продуцентов, синтезирующих токсины в комбинациях, отличных от представленных в данном изобретении. Положительный эффект предлагаемого изобретения достигается за счет свойств сконструированной новым способом плазмиды pTV241 по наличию в ее структуре транспозона с детерминантом инсектицидного белка cryIIIA-типа, способного транслоцироваться в бациллах, и генетических элементов сконструированной новым способом конъюгативной плазмиды с cryIIIA-геном, определяющих ее способность к передаче и автономной репликации в клетках B.thuringiensis. Синтез в клетках предлагаемого штамма B.thuringiensis subsp. thuringiensis IPM-37 двух токсинов с различными механизмами действия определяет более чем в 3 раза высокую активность этого штамма по сравнению с другими штаммами B. thuringiensis, используемыми для борьбы с колорадским жуком. Это свойство позволяет также снизить риск формирования популяций насекомых, устойчивых к биоинсектициду.
Формула изобретения1. Рекомбинантная плазмидная ДНК pTV241, обеспечивающая экспрессию гена дельта-эндотоксина cryIIIA Bacillus thuringiensis subsp. tenebrionis размером 16,3 т.п.н., содержащая следующие конструктивные элементы: полную последовательность векторной плазмиды pTV24 размером 12,4 т.п.н.; полную последовательность BamHI - Bgl II - фрагмента ДНК Bacillus thuringiensis subsp. tenebrionis размером 2,9 т.п.н.; интактный ген дельта-эндотоксина Bacillus thuringiensis subsp. tenebrionis cryIIIA, встроенный в последовательность транспозона Тп917 cat; ген устойчивости к тетрациклину (tet); ген устойчивости к хлорамфениколу (cat) в составе транспозола Тп917 cat; генетические элементы плазмиды pE194, обеспечивающие репликацию плазмиды pTV24 и входящие в состав данной плазмиды; гены и структурные элементы, необходимые для миграции транспозона Тп 917 cat; сайты расщепления эндонуклеазой EcoRI с координатами 0; 6, 9 и 7,4 т.п.н.; сайты расщепления эндонуклеазой Pts I с координатами 8,4 и 13,7 т.п.н.; сайт расщепления эндонуклеазой Bam HI с координатой 9,1 т.п.н. 2. Способ конструирования рекомбинантной плазмидной ДНК pTV241, заключающийся в том, что смесь ДНК плазмиды pUC19 и Bacillus thuringiensis subsp. tenebrionis расщепляют эндонуклеазой HindIII, обрабатывают смесью клетки Eschrichia coli JM103, отбирают бесцветные колонии на среде Мак-Конки с ампициллином, отобранные колонии проверяют на наличие последовательностей ДНК, гомологичных соответствующим последовательностям cryIIIA гена, из клеток одной из колоний, содержащих указанные последовательности, выделяют ДНК-плазмиду с геном cryIIIA Bacillus thuringiensis subsp. tenebrionis, обозначенную pBTT51, далее плазмиду pBTT51 расщепляют эндонуклеазами BamHI и Bgl II, полученные фрагменты смешивают с фрагментами ДНК плазмиды pVT24, подвергнутой гидролизу эндонуклеазой BamHI, фрагменты соединяют с помощью ДНК-лигазы и трансформируют ими посредством электропорации клетки Bacillus thuringiensis subsp. kurstaki, высевают трансформанты на агаризованную среду, содержащую хлорамфеникол (Cm), выделяют из Cm-устойчивых клеток плазмидные ДНК, проводят их рестрикционный анализ и отбирают целевую рекомбинантную плазмидную ДНК pTV24, в структуре которой BamH I - Bgl II - фрагмент плазмиды pTV241 размером 2,9 т.п.н. встроен в BamH I -сайт плазмиды pTV24 и cryIIIA ген находится в прямой ориентации по отношению к гену, определяющему устойчивость к эритромицину. 3. Способ конструирования плазмиды, содержащей ген cryIIIA в составе транспозона Тп917cat, размером около 50 т.п.н., заключающийся в том, что рекомбинантную плазмидную ДНКpTY241 передают с помощью электропорации в клетки штамма Bacillus thuringiensis subsp.morrisoni DC, отбирают трансформированные клоны по устойчивости к хлорамфениколу (Cm), отобранные клоны скрещивают с бесплазмидным штаммом Bacillus cereus, устойчивым к рифампицину (Rf), и из клеточных клонов, устойчивых к хлорамфениколу и рифмапицину (Cmr Rfr), выделяют целевую коньюгативную плазмиду, в состав которой транспозон Тп917 cat с геном cryIIIA включился в результате его транслокации из pTV241. 4. Штамм бактерий Bacillus thuringiensis subsp. thuringiensis IPM-37, содержащий коньюгативную плазмиду, полученную, как описано в п.3 формулы, активный против колорадского жука.MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 24.11.2003 Извещение опубликовано: 10.11.2004 БИ: 31/2004 Популярные патенты: 2444881 Конвейер для проращивания зерна ... при помощи цепной передачи 15 (фиг.1) соединена с мотором-редуктором 14. Ведущая звездочка 21 (фиг.2) при помощи шпонки 22 зафиксирована на валу 23. Цилиндрическая шестерня 24 при помощи шпонки 25 зафиксирована на валу 23. На валу 23 установлены колеса 26 (фиг 2, 3), которые предназначены для привода транспортера 8 (фиг.1, 2, 3). Колеса 26 неподвижно соединены с валом 23 (фиг.2). Подшипники 27 надеты на вал 23 и вставлены в неподвижный корпус 28. Цилиндрическая шестерня 29 зубьями входит в зацепление с шестерней 24. Цилиндрическая шестерня 29 при помощи шпонки 30 неподвижно установлена на вал 31. Ведомая звездочка 32 при помощи шпонки 33 неподвижно установлена на вал 31. Вал ... 2270554 Сепарирующее устройство зерноуборочного комбайна (варианты) ... настоящего изобретения будут подробнее описаны ниже со ссылками на прилагаемые чертежи, на которых:фиг.1 изображает на виде сбоку переднюю часть зерноуборочного комбайна с сепарирующим устройством, фиг.2 изображает в увеличенном масштабе вид в разрезе по линии II-II на фиг.1,фиг.3 изображает сепарирующий короб на виде в перспективе,фиг.4 изображает сепарирующий короб на виде в перспективе под другим углом зрения,фиг.5 изображает часть сепарирующего короба в увеличенном масштабе,фиг.6 изображает вид в разрезе по линии VI-VI на фиг.5,фиг.7 изображает этап установки деталей при изготовлении сепарирующего короба по изобретению,фиг.8 изображает на виде в перспективе сепарирующий короб в ... 2102853 Питательное устройство для растений ... снабжено воронкой, связанной с корпусом устройства и имеющей сток под твердую фазу в нижнюю часть корпуса. 21. Устройство по п.20, отличающееся тем, что в виде воронки выполнена верхняя стенка корпуса и в корпусе под воронкой установлена проточная камера, сообщающаяся с воронкой, снабженная вверху переливным отверстием и предназначенная для накопления воды, используемой в качестве внутреннего источника молекул водяного ... 2051971 Способ определения биологической активности -эндотоксинов различных патотипов bacileus thuringiensis ... перед растворением кристаллы последовательно промывают водой, раствором поваренной соли и ацетоноводной смесью в соотношении 2 : 3, после удаления нерастворимых компонентов из раствора эндотоксины осаждают уксусной кислотой при рН 4,0 - 6,5, полученный осадок растворяют в буфере при рН 8,5 - 9,0, а на агаризованную среду вносят растворы с концентрацией белка 65 - 250 ... 2127511 Композиция пленочного полимерного материала для покрытия теплиц и оптический активатор для полимерного материала (варианты) ... ... |
Еще из этого раздела: 2154938 Способ охлаждения молока на животноводческих фермах и устройство для его осуществления 2391812 Способ выращивания растений в условиях защищенного грунта, устройство для выращивания растений в условиях защищенного грунта и сборно-разборный многоярусный стеллаж для выращивания растений в условиях защищенного грунта 2181640 Способ биологической рекультивации нарушенных земель 2106081 Животноводческая ферма с применением помещений круглой формы и способ содержания в ней, например, крупного рогатого скота 2066320 Производные тиазола, способ их получения и способ борьбы с грибками 2182889 Дезинфицирующее средство 2279799 Балансир рыболовный 2154629 Производные оксима, способ их получения, фунгицидное средство и способ борьбы с грибковыми заболеваниями 2016512 Средство для борьбы против стресса у рыб и способ борьбы со стрессом у рыб 2241327 Многоопорная дождевальная машина |
Изобретения в сельском хозяйстве
Обработка почвы в сельском и лесном хозяйствах
Посадка, посев, удобрение
Уборка урожая, жатва
Обработка и хранение продуктов полеводства и садоводства
Садоводство, разведение овощей, цветов, риса, фруктов, винограда, лесное хозяйство
Новые виды растений или способы их выращивания
Производство молочных продуктов
Животноводство, разведение и содержание птицы, рыбы, насекомых, рыбоводство, рыболовство
Поимка, отлов или отпугивание животных
Консервирование туш животных, или растений или их частей
Биоцидная, репеллентная, аттрактантная или регулирующая рост растений активность химических соединений или препаратов
Хлебопекарные печи, машины и прочее оборудование для хлебопечения
Машины или оборудование для приготовления или обработки теста
Обработка муки или теста для выпечки, способы выпечки, мучные изделия
|
|
||